引用本文: 張香閨, 宋艷萍, 黃珍, 葉婭, 閆明. Brolucizumab治療難治性息肉樣脈絡膜血管病變1例. 中華眼底病雜志, 2024, 40(8): 633-635. doi: 10.3760/cma.j.cn511434-20231026-00432 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
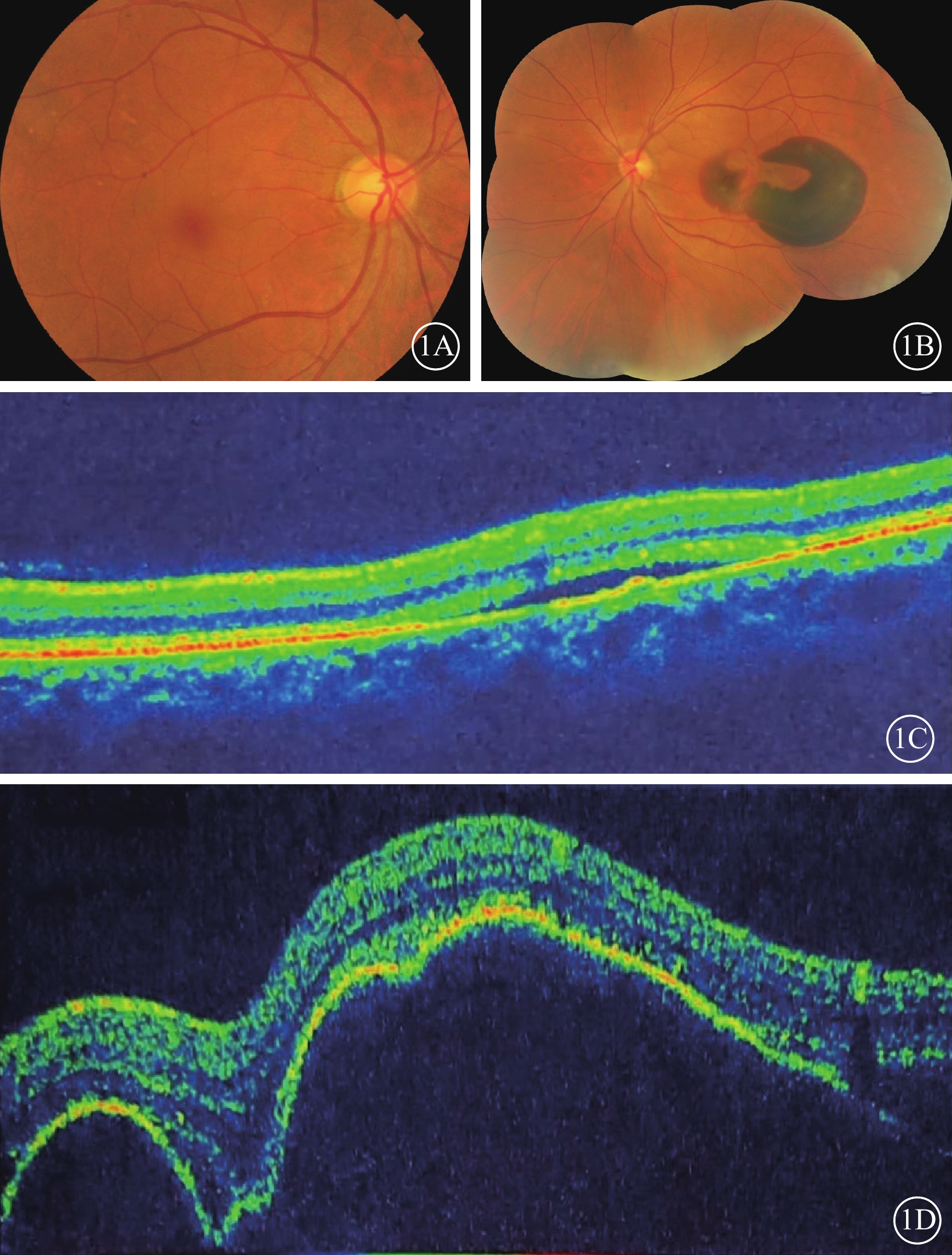
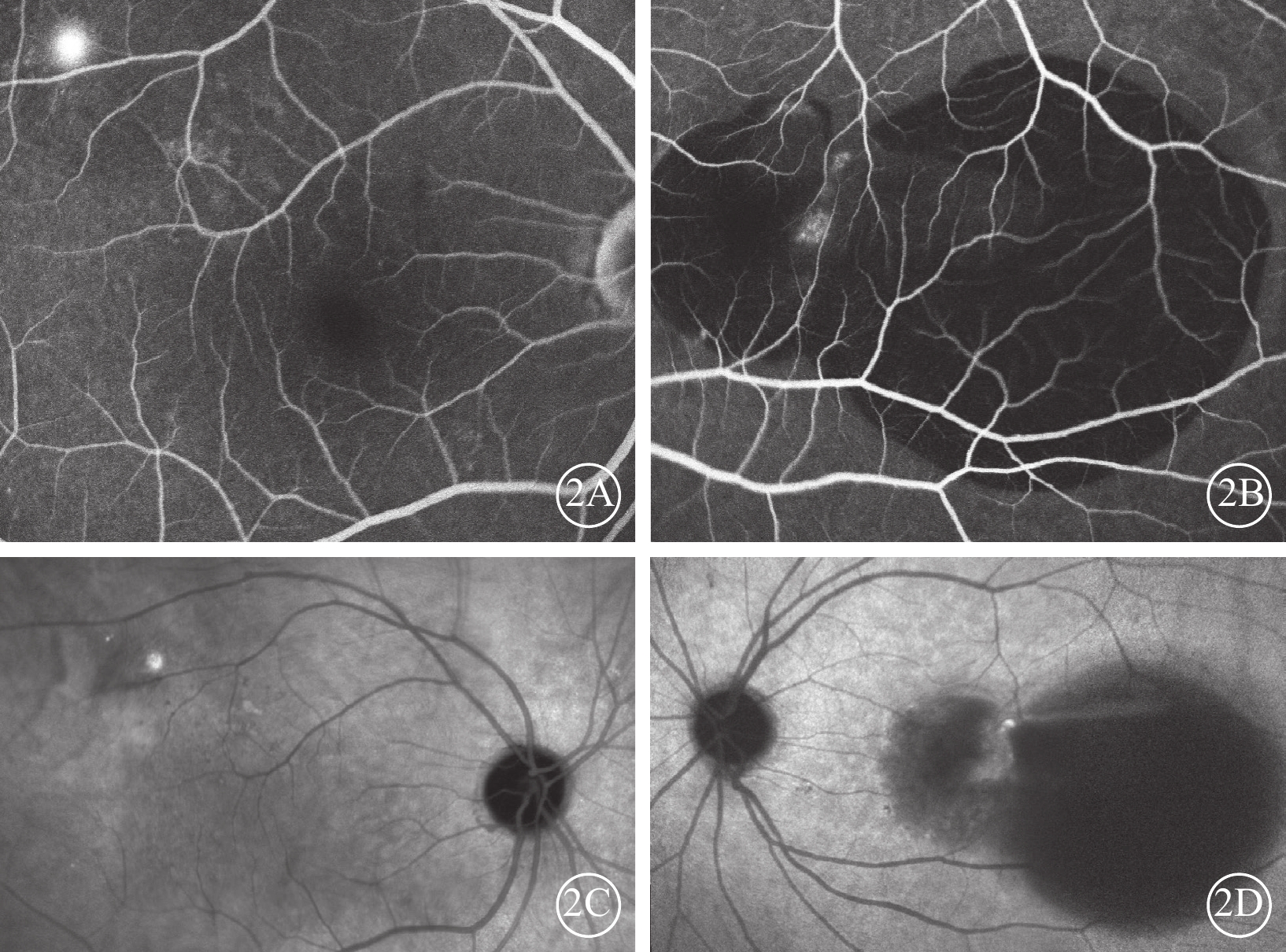
患者女,56歲。因突發左眼視力下降,伴眼前黑影遮擋感2 d于2014年12月30日到中部戰區總醫院眼科就診。左眼慢性中心性漿液性脈絡膜視網膜病變病史3年,膽囊炎行膽囊切除手術20年,右腎結石行經皮腎結石取出手術2年,甲狀腺乳頭狀癌行全甲狀腺切除手術1年。眼科檢查:右眼、左眼最佳矯正視力分別為1.0、數指/眼前20 cm。右眼、左眼眼壓分別為14、15 mm Hg(1 mm Hg=0.133 kPa)。左眼相對性傳入性瞳孔障礙(+)。右眼眼前節檢查未見明顯異常。眼底檢查,右眼后極部視網膜散在玻璃膜疣,左眼黃斑中心凹大片狀視網膜下出血(圖1A,1B)。光相干斷層掃描(OCT)檢查,右眼視網膜神經上皮層下液性弱反射暗區,視網膜色素上皮(RPE)條帶稍隆起。左眼黃斑中心凹RPE條帶呈多個色素上皮脫離(PED)樣高隆起,其下血性弱反射暗區,神經上皮層下液性弱反射暗區(圖1C,1D)。熒光素眼底血管造影檢查,右眼黃斑顳上方近血管弓處焦點狀熒光素滲漏。左眼黃斑中心凹大片出血遮蔽熒光,其間夾雜小片狀透見熒光(圖2A,2B)。吲哚青綠血管造影檢查,右眼黃斑區顳上方可見焦點樣強熒光,左眼出血遮蔽熒光,其間焦點樣強熒光(圖2C,2D)。診斷:(1)左眼息肉樣脈絡膜血管病變(PCV);(2)左眼黃斑下出血;(3)右眼中心性漿液性脈絡膜視網膜病變。給予患者左眼玻璃體腔注射抗血管內皮生長因子(VEGF)藥物、雷珠單抗,口服卵磷脂絡合碘片治療。治療1月后復查,患者左眼視力0.08。
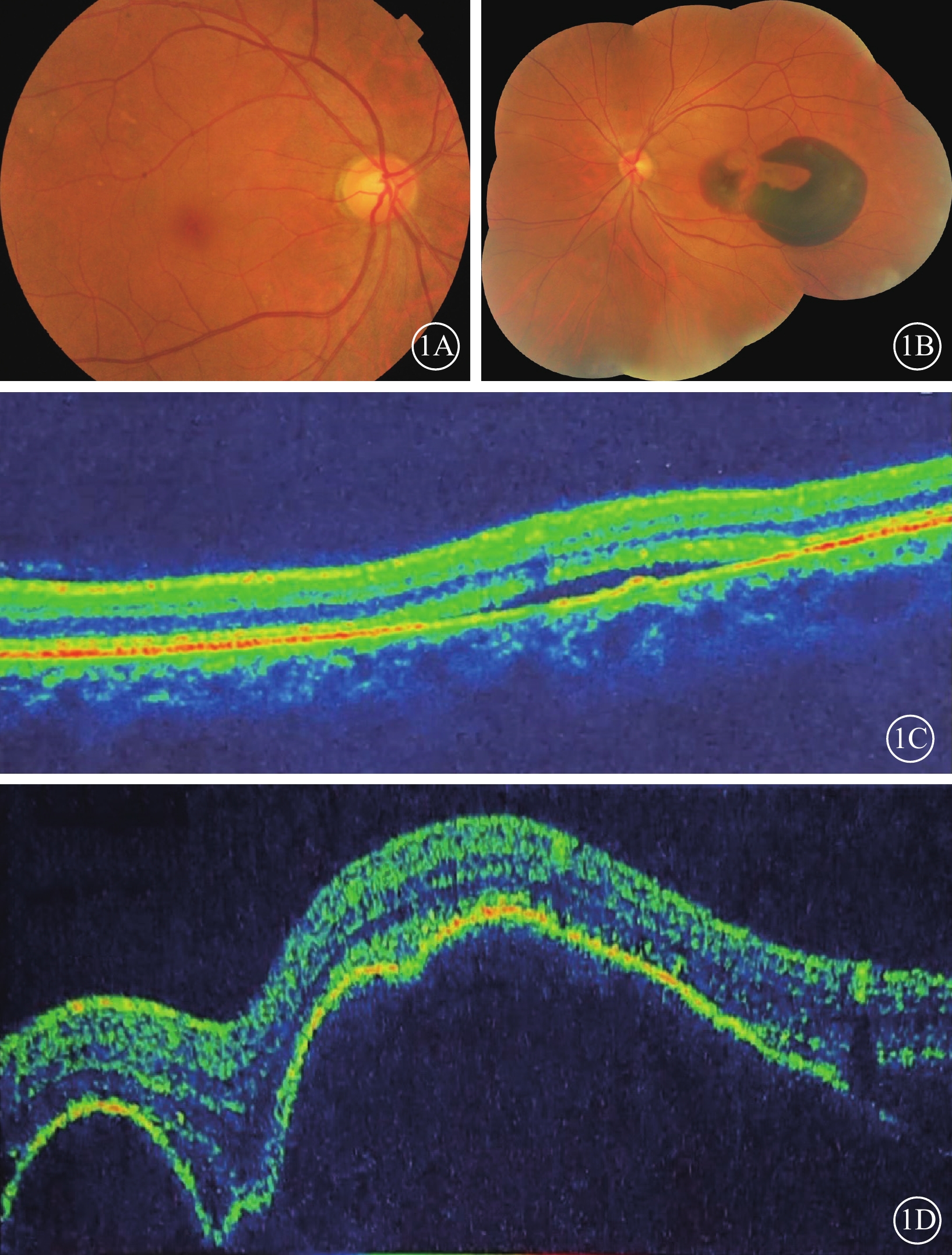 圖1
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼眼部檢查像
圖1
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼眼部檢查像
1A、1B分別示右眼、左眼廣角彩色眼底像,右眼視網膜后極部散在玻璃膜疣;左眼黃斑中心凹大片狀視網膜下出血。1C、1D分別示右眼、左眼光相干斷層掃描像,右眼視網膜神經上皮層下液性弱反射暗區,視網膜色素上皮條帶稍隆起;左眼黃斑中心凹視網膜色素上皮條帶呈多個色素上皮脫離樣高隆起,其下血性弱反射暗區,神經上皮層下液性弱反射暗區
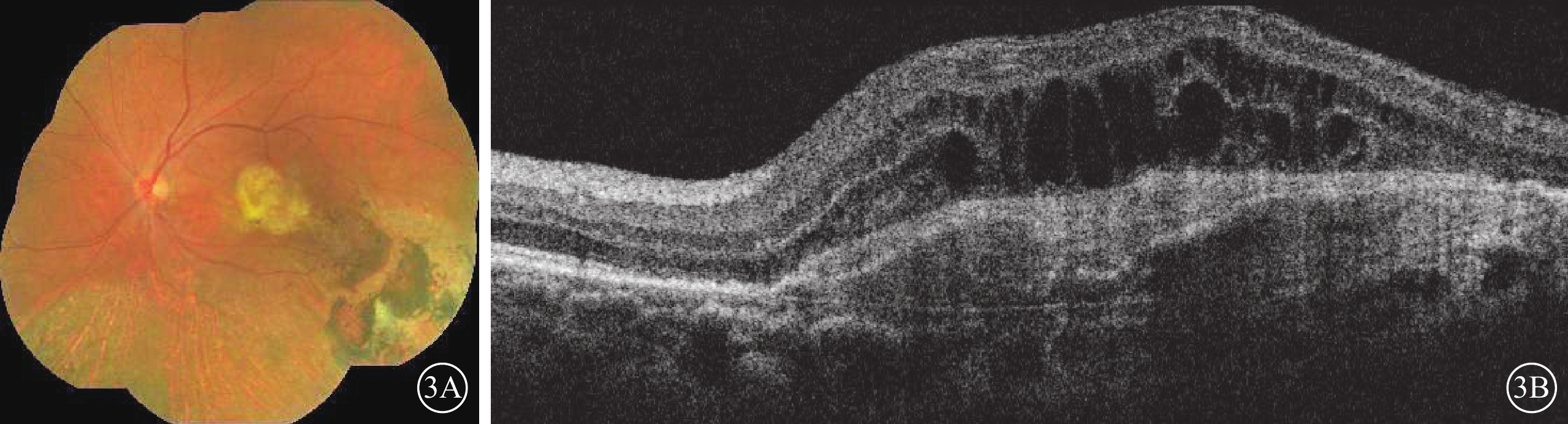
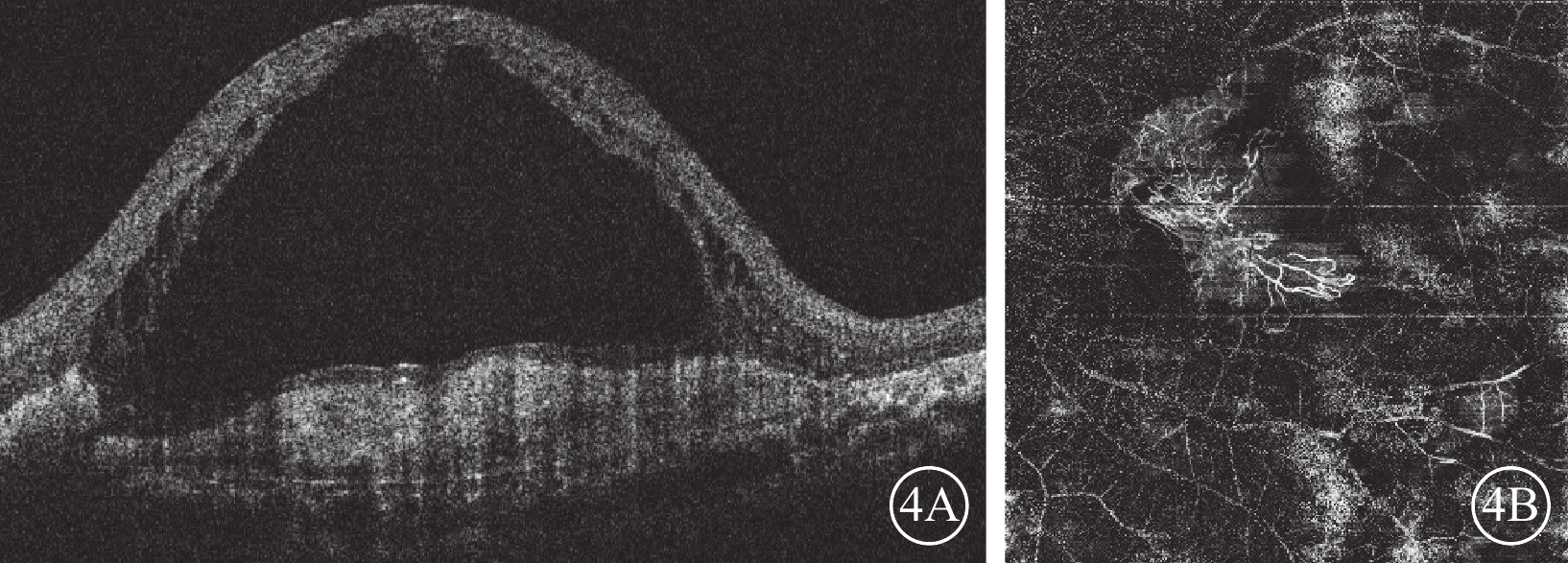
2014年12月30日至2023年3月24日,患者左眼共行抗VEGF治療64次(期間藥物由雷珠單抗更替為康柏西普或阿柏西普)。2015年2月11日患者因左眼玻璃體積血行玻璃體切割手術。2016年12月23日,患者于我院復查,左眼視力0.02。眼底檢查,左眼黃斑區黃色機化瘢痕形成,顳下方視網膜廣泛色素沉著樣改變(圖3A)。OCT檢查,黃斑中心凹視網膜厚度(CMT)降低,視網膜內液(IRF)及視網膜下液(SRF)減少,血性PED內積血吸收,PED高度降低,黃斑部機化瘢痕形成(圖3B)。2017年2月6日患者因左眼并發性白內障,行左眼白內障超聲乳化及人工晶狀體植入手術。2017年10月26日患者因左眼眼內炎,給予玻璃體腔注射頭孢他啶2 mg、萬古霉素1 mg治療。2022年12月23日復查,OCT檢查,左眼SRF明顯增多,IRF廣泛存在,CMT增高為1 242 μm,PED高度降低,黃斑部機化瘢痕形成(圖4A)。OCT血管成像(OCTA)檢查,左眼黃斑中心凹新生血管邊界清楚,呈“水母狀”外觀,分支密集,終末端血管吻合成拱廊(圖4B)。給予患者左眼玻璃體腔注射Brolucizumab 6 mg/0.0.5 ml。2023年1月25日復查,OCT檢查,左眼CMT347 μm,SRF完全吸收,IRF明顯改善,黃斑區結構恢復明顯,黃斑前膜及黃斑區機化瘢痕形成(圖5)。2023年2月27日復查,OCT檢查,左眼視網膜積液復發,視網膜層間形成多個弱反射液性囊腔,強反射點增多,CMT增加為576 μm。(圖6)。再次給予患者左眼玻璃體腔注射Brolucizumab,劑量同前。2023年3月24日復查,OCT檢查,左眼視網膜積液明顯吸收,視網膜層間強反射點減少,CMT降低為310 μm(圖7A)。OCTA檢查,黃斑中心凹新生血管粗大分散,新生血管中央區纏繞呈扭結樣外觀,周圍區分散呈“枯樹枝樣”改變(圖7B)。
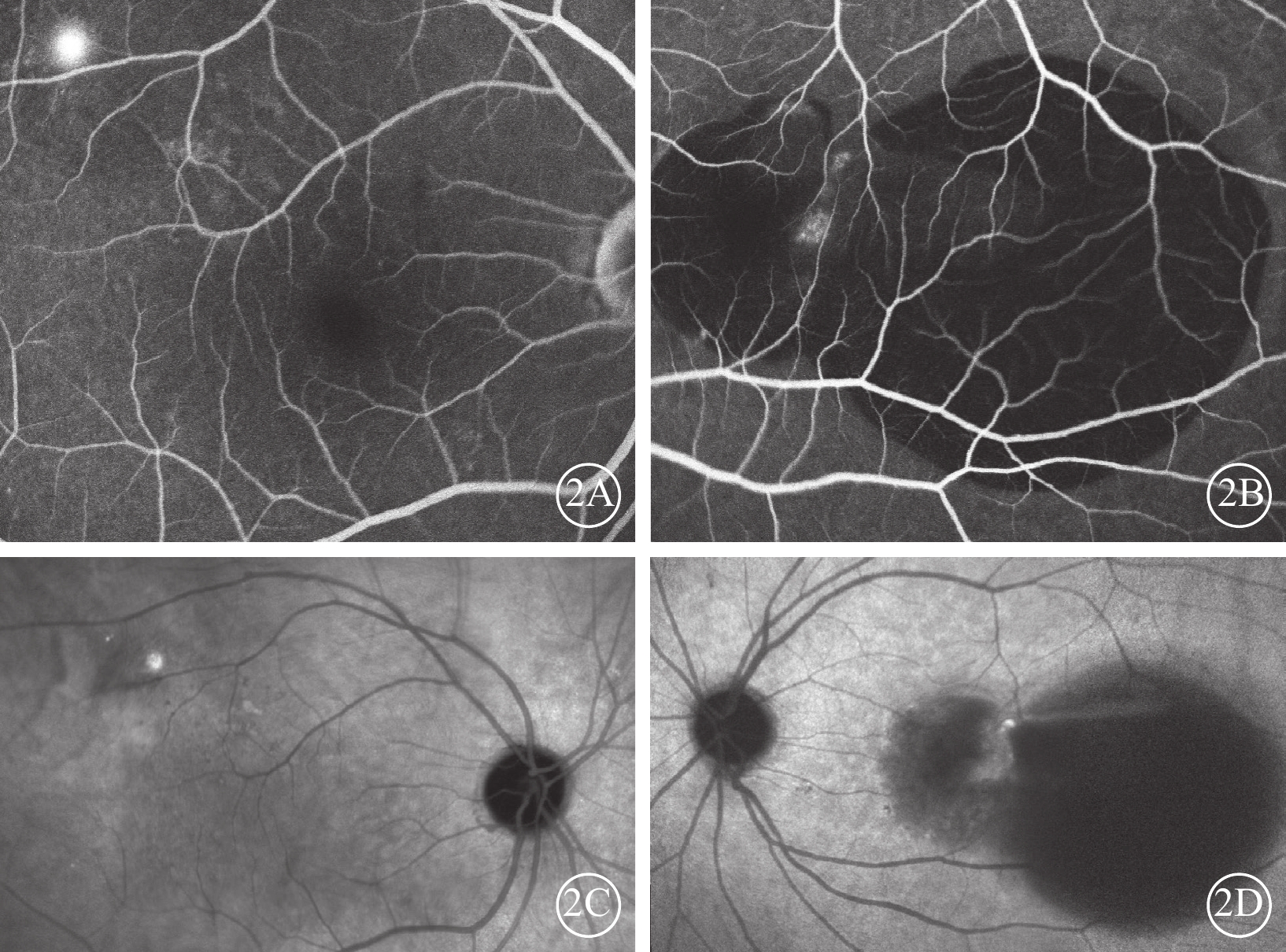 圖2
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼熒光造影像
圖2
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼熒光造影像
2A、2B分別示右眼、左眼熒光素眼底血管造影像,右眼黃斑顳上方近血管弓處焦點狀熒光素滲漏;左眼黃斑中心凹大片出血遮蔽熒光,其間夾雜小片狀透見熒光。2C、2D分別示右眼、左眼吲哚青綠血管造影像,右眼黃斑區顳上方可見焦點樣強熒光;左眼出血遮蔽熒光,其間可見焦點樣強熒光
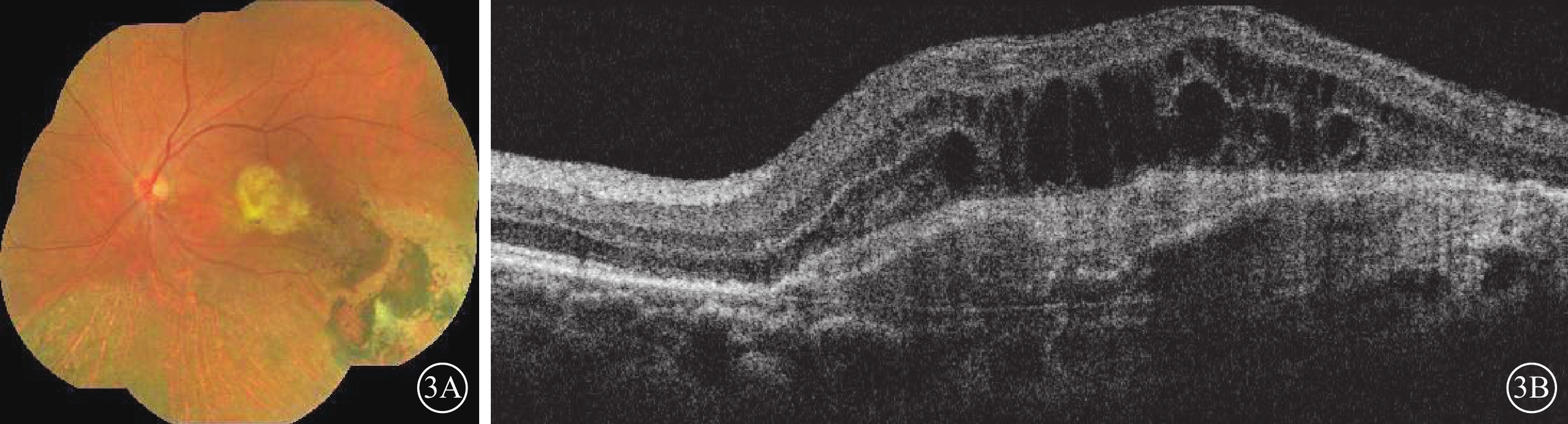 圖3
Brolucizumab治療難治性息肉樣脈絡膜血管病變2016年12月23日復查左眼眼部檢查像
圖3
Brolucizumab治療難治性息肉樣脈絡膜血管病變2016年12月23日復查左眼眼部檢查像
3A示廣角彩色眼底像,黃斑區形成黃色機化瘢痕,顳下方視網膜廣泛色素沉著。3B示光相干斷層掃描像,黃斑中心凹視網膜厚度降低,視網膜內液及視網膜下液減少,血性色素上皮脫離內積血吸收,形成纖維血管性色素上皮脫離,色素上皮脫離高度降低,黃斑部形成機化瘢痕
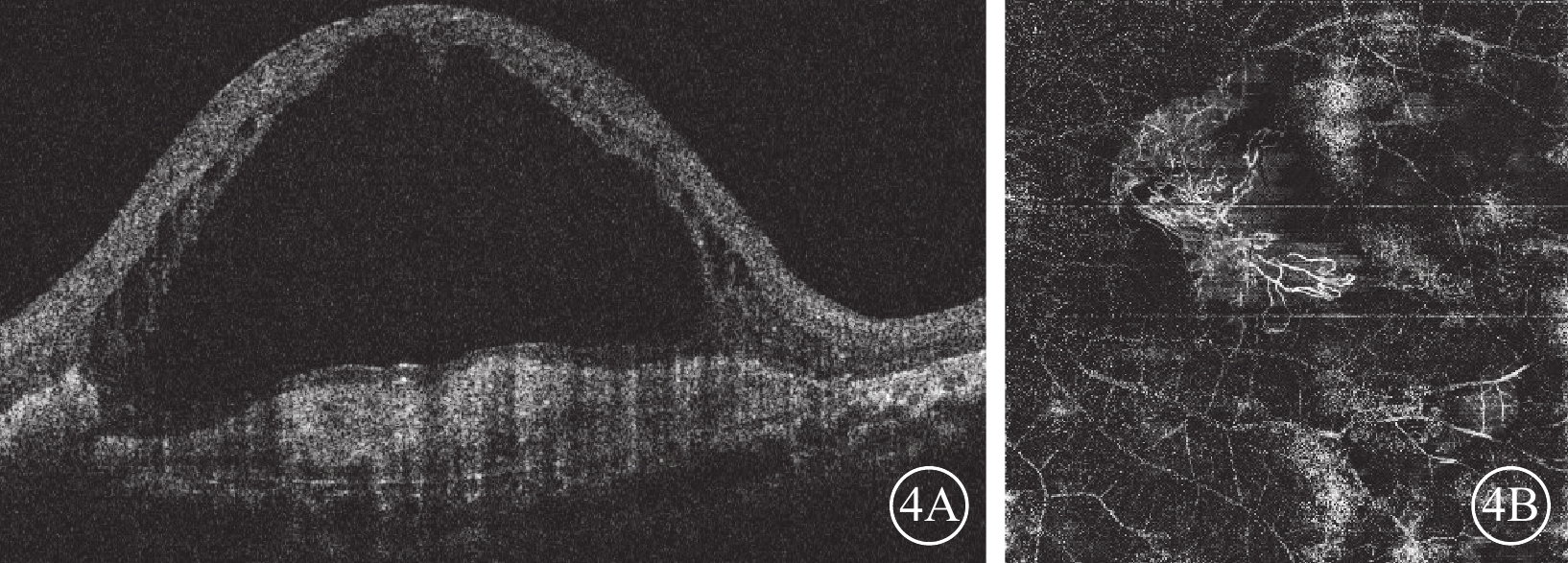 圖4
Brolucizumab治療難治性息肉樣脈絡膜血管病變2022年12月23日復查左眼眼部檢查像
圖4
Brolucizumab治療難治性息肉樣脈絡膜血管病變2022年12月23日復查左眼眼部檢查像
4A示光相干斷層掃描像,左眼視網膜下液明顯增多,視網膜內液廣泛存在,黃斑中心凹視網膜厚度增高為1 242 μm,視網膜色素上皮脫離高度降低,黃斑部機化瘢痕形成。4B示光相干斷層掃描血管成像,黃斑中心凹新生血管邊界清楚,呈“水母狀”外觀,分支密集,終末端血管吻合成拱廊
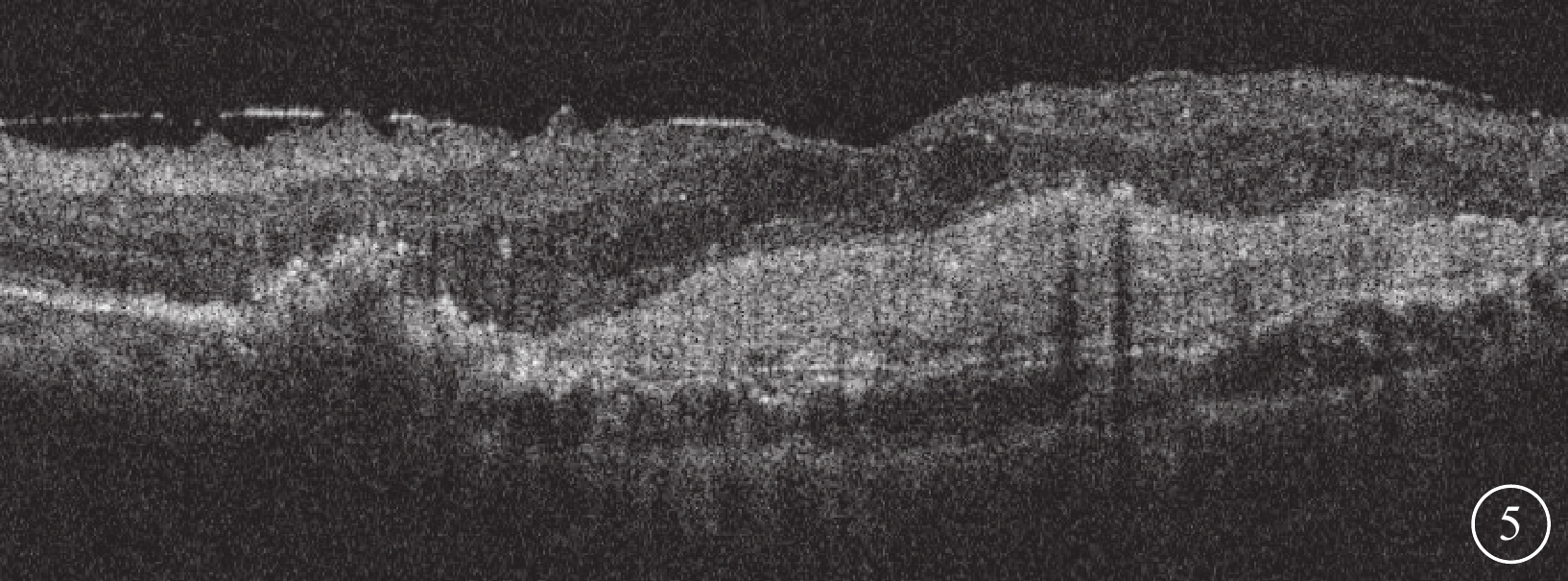 圖5
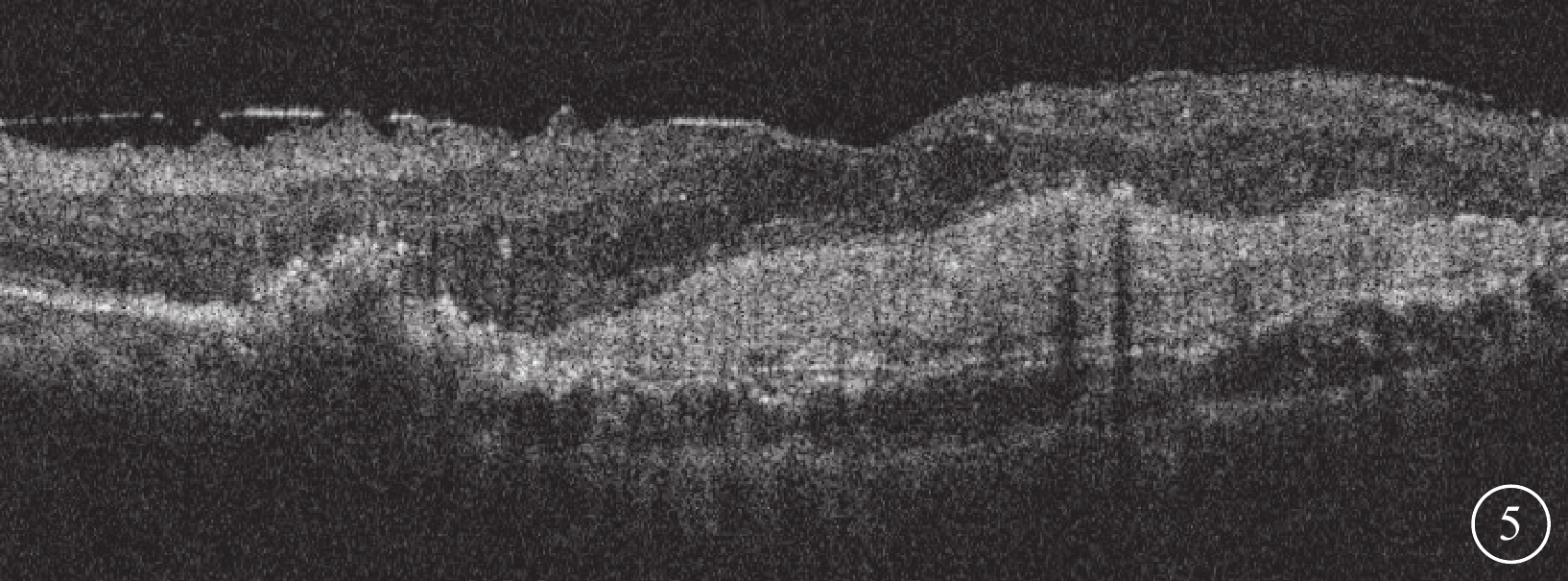
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年1月25日復查左眼光相干斷層掃描像
圖5
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年1月25日復查左眼光相干斷層掃描像
左眼視網膜下液完全吸收,視網膜內液明顯改善,黃斑中心凹結構恢復明顯,可見黃斑前膜形成及黃斑區機化瘢痕,黃斑中心凹視網膜厚度降低為347 μm
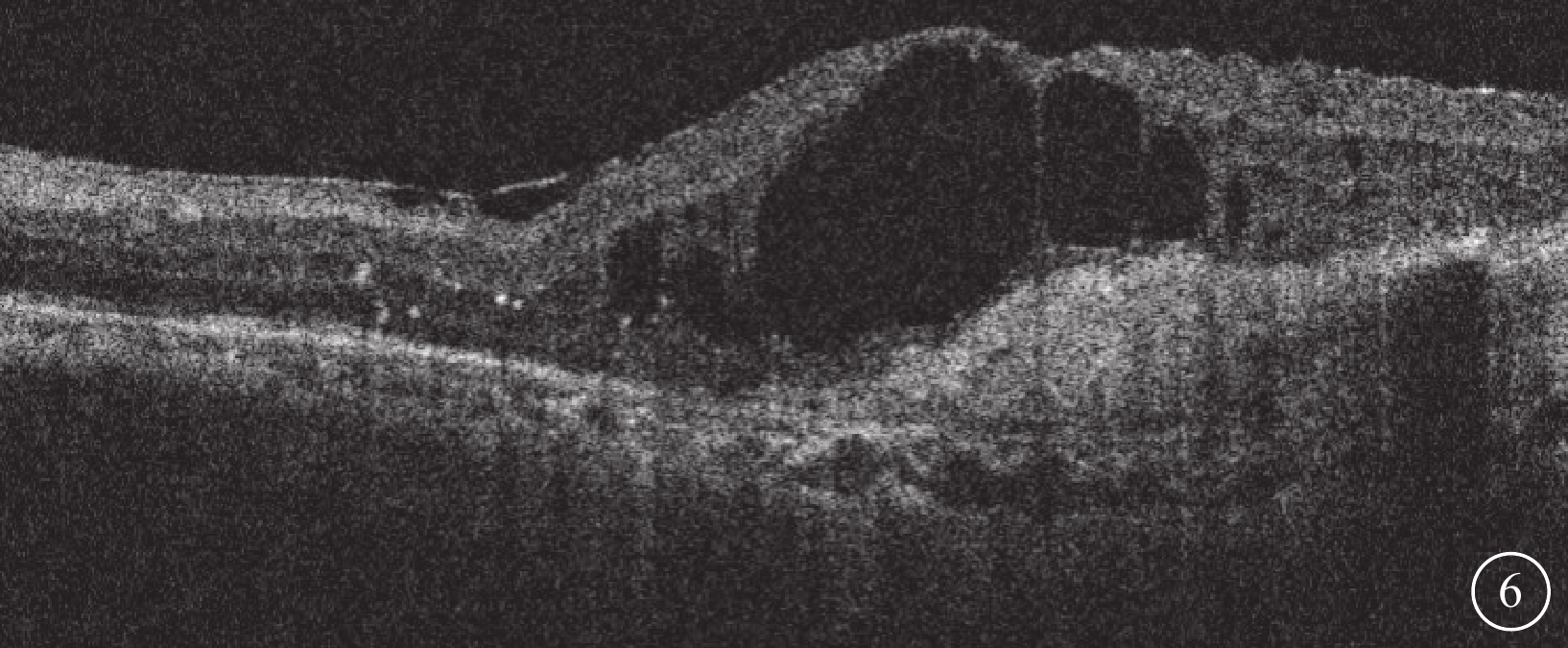 圖6
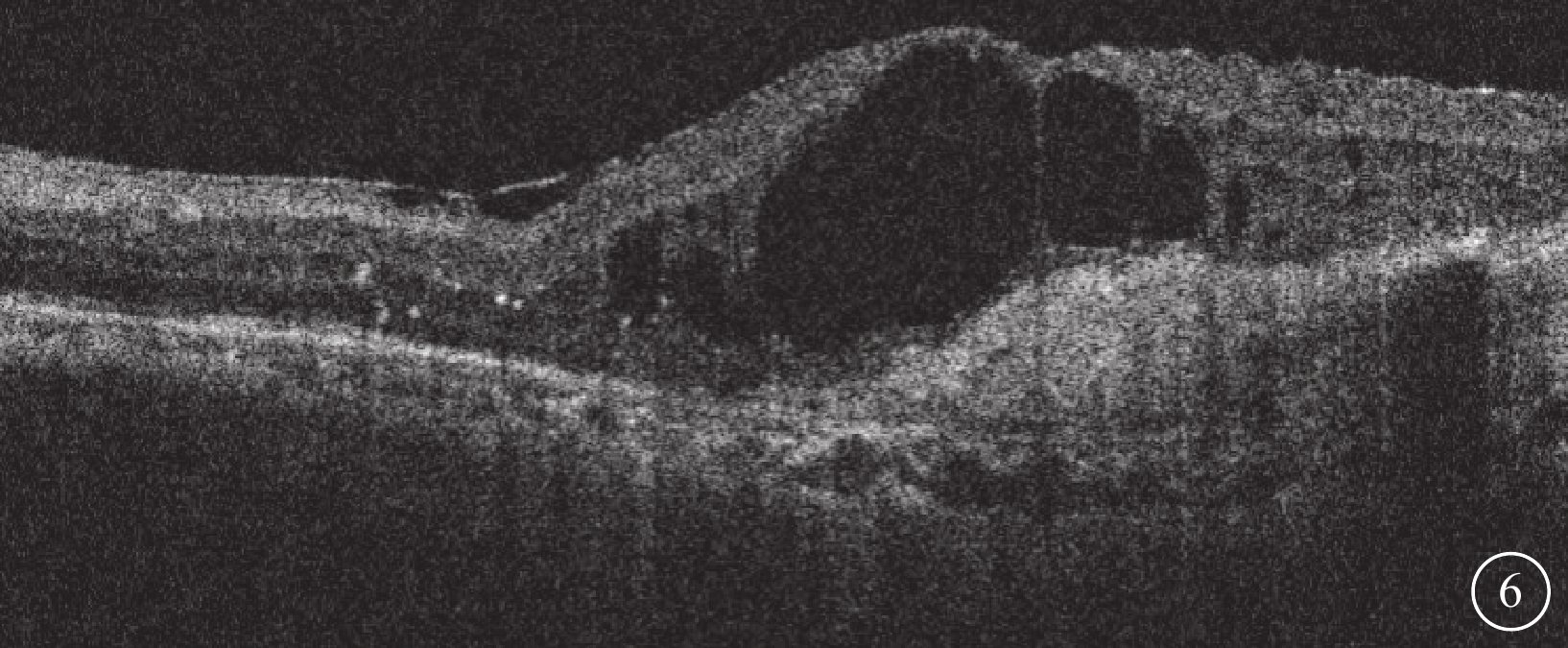
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年2月27日復查左眼光相干斷層掃描像
圖6
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年2月27日復查左眼光相干斷層掃描像
左眼視網膜積液復發,視網膜層間形成多個弱反射液性囊腔,強反射點增多,黃斑中心凹視網膜厚度增加為576 μm
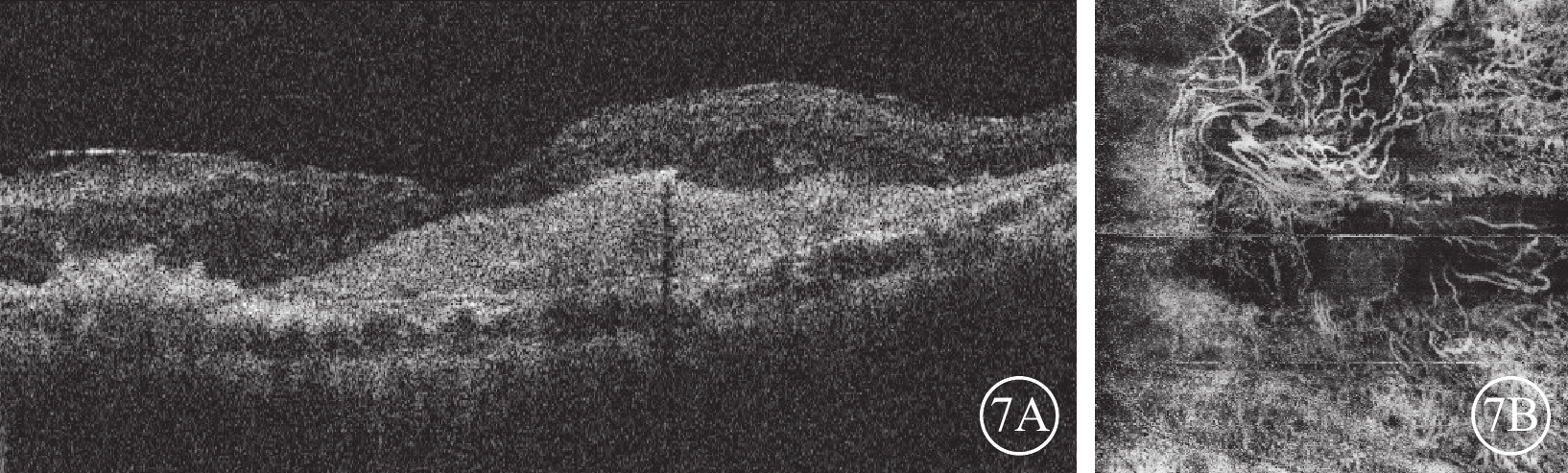 圖7
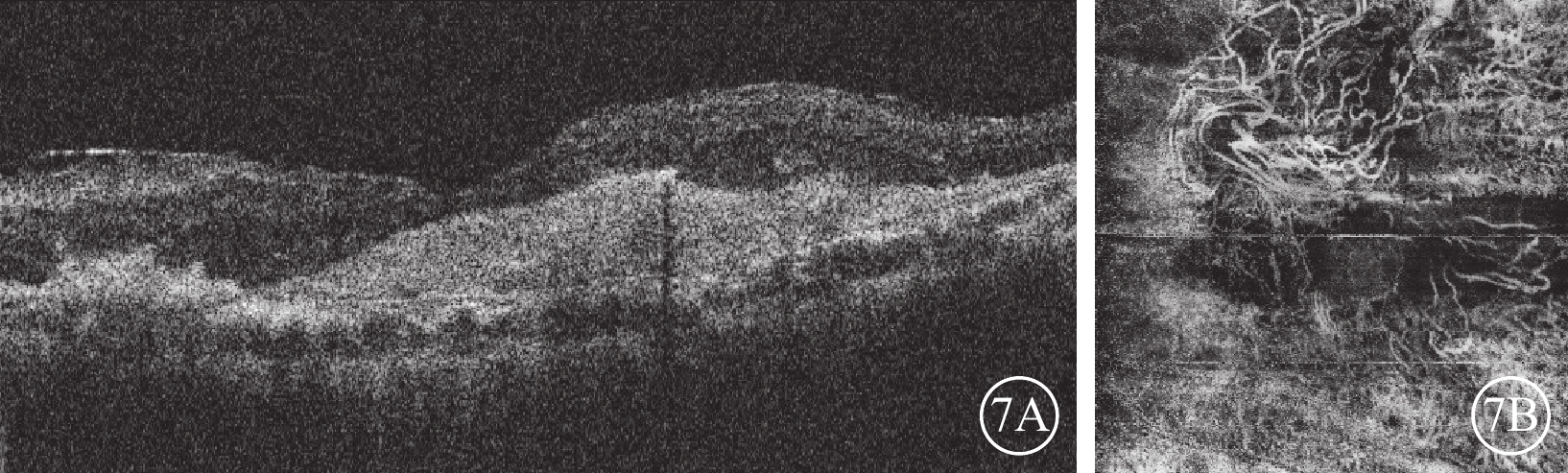
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年3月24日復查左眼眼部檢查像
圖7
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年3月24日復查左眼眼部檢查像
7A示光相干斷層掃描像,視網膜積液明顯吸收,視網膜層間強反射點減少,黃斑中心凹視網膜厚度降低為310 μm。7B示光相干斷層掃描血管成像,黃斑中心凹新生血管粗大分散,新生血管中央區呈扭結樣外觀,周圍區分散呈“枯樹枝樣”改變
討論 PCV是新生血管性年齡相關性黃斑變性(nAMD)的一種特殊亞型,屬于1型黃斑新生血管(MNV),亞洲人群中,nAMD中的50%以上為PCV[1-2]。PCV的主要病理特征為RPE與Bruch膜之間的息肉樣病灶和分支血管網,常導致復發的視網膜下出血及積液。PCV的一線治療方式為抗VEGF藥物治療[3],可改善PCV患者視功能及解剖學形態,但臨床中存在部分患者反復抗VEGF藥物治療應答不佳。本例患者左眼為PCV合并黃斑區視網膜下出血,在為期8年的治療中共注射抗VEGF藥物64次。2014年至2016年患者對抗VEGF藥物治療應答良好,視網膜積液減少,視網膜下出血吸收。2016年至2022年隨訪觀察中,無論抗VEGF藥物從雷珠單抗更換為康柏西普或阿柏西普,并每月注射,患者均表現為難以吸收的視網膜積液及纖維血管性PED。考慮其原因可能與反復注射疾病的耐藥性、新生血管的隱匿性、藥物的滲透性、新生血管的成熟形態等相關。因此,尋找更優的PCV治療方案仍是目前研究的重點。
Brolucizumab是一種人源化單克隆單鏈抗體片段,為目前已知的相對分子質量最小(26 ×103)的抗VEGF藥物,具有組織穿透性強、藥物摩爾濃度高、注射間隔時間長等優勢[4]。相比于阿柏西普,Brolucizumab的療效呈非劣效性,可延長治療間隔,并且對視網膜積液的改善更為顯著[5-7]。Matsumoto等[8]研究發現,78.9%未接受治療的PCV患者,在接受3次Brolucizumab治療后息肉樣病變完全消退。關于初治型nAMD患者Brolucizumab治療前后OCTA上MNV的面積變化,研究結果存在爭議。Rübsam 等[9]研究發現,nAMD患者經Brolucizumab治療后MNV的面積降低。Toto等[10]研究發現,nAMD患者經Brolucizumab治療后MNV面積無明顯改善。目前對難治性nAMD患者治療后MNV面積變化暫未見報道。本例患者經Brolucizumab治療后3個月,OCTA檢查MNV形態逐漸粗大分散,考慮這與新生血管的結構逐漸成熟相關。對于難治性nAMD患者使用Brolucizumab治療的結果也有相應報道[11-13]。研究報道,對既往多次注射抗VEGF藥物治療(3~107次)的難治性nAMD患者進行至少1次的Brolucizumab治療,治療后患者視力無顯著改善,但CMT和視網膜積液顯著改善[12]。本例患者經Brolucizumab治療前后視力均為0.02,但Brolucizumab治療后SRF及IRF明顯吸收,治療后1個月,CMT從1 242 μm下降至347 μm,這與既往研究結果相似。而視力無改善的原因考慮與長期病灶存在導致光感受器細胞被破壞有關。
Brolucizumab作為新型的小分子抗VEGF藥物,在國外研究中發現其對初治型和難治性nAMD表現出良好的療效。本例患者中,Brolucizumab對持續不消退IRF有良好的解剖學效果,能明顯地消除視網膜積液,并穩定患者的視力。這是我國首次報道Brolucizumab對難治性PCV的觀察,在Brolucizumab治療的隨訪期間患者尚未出現結膜出血、眼內炎、葡萄膜炎等安全性事件,在未來尚需更多的多中心大樣本的前瞻性研究來探討Brolucizumab對我國難治性PCV患者的安全性及有效性。
患者女,56歲。因突發左眼視力下降,伴眼前黑影遮擋感2 d于2014年12月30日到中部戰區總醫院眼科就診。左眼慢性中心性漿液性脈絡膜視網膜病變病史3年,膽囊炎行膽囊切除手術20年,右腎結石行經皮腎結石取出手術2年,甲狀腺乳頭狀癌行全甲狀腺切除手術1年。眼科檢查:右眼、左眼最佳矯正視力分別為1.0、數指/眼前20 cm。右眼、左眼眼壓分別為14、15 mm Hg(1 mm Hg=0.133 kPa)。左眼相對性傳入性瞳孔障礙(+)。右眼眼前節檢查未見明顯異常。眼底檢查,右眼后極部視網膜散在玻璃膜疣,左眼黃斑中心凹大片狀視網膜下出血(圖1A,1B)。光相干斷層掃描(OCT)檢查,右眼視網膜神經上皮層下液性弱反射暗區,視網膜色素上皮(RPE)條帶稍隆起。左眼黃斑中心凹RPE條帶呈多個色素上皮脫離(PED)樣高隆起,其下血性弱反射暗區,神經上皮層下液性弱反射暗區(圖1C,1D)。熒光素眼底血管造影檢查,右眼黃斑顳上方近血管弓處焦點狀熒光素滲漏。左眼黃斑中心凹大片出血遮蔽熒光,其間夾雜小片狀透見熒光(圖2A,2B)。吲哚青綠血管造影檢查,右眼黃斑區顳上方可見焦點樣強熒光,左眼出血遮蔽熒光,其間焦點樣強熒光(圖2C,2D)。診斷:(1)左眼息肉樣脈絡膜血管病變(PCV);(2)左眼黃斑下出血;(3)右眼中心性漿液性脈絡膜視網膜病變。給予患者左眼玻璃體腔注射抗血管內皮生長因子(VEGF)藥物、雷珠單抗,口服卵磷脂絡合碘片治療。治療1月后復查,患者左眼視力0.08。
 圖1
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼眼部檢查像
圖1
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼眼部檢查像
1A、1B分別示右眼、左眼廣角彩色眼底像,右眼視網膜后極部散在玻璃膜疣;左眼黃斑中心凹大片狀視網膜下出血。1C、1D分別示右眼、左眼光相干斷層掃描像,右眼視網膜神經上皮層下液性弱反射暗區,視網膜色素上皮條帶稍隆起;左眼黃斑中心凹視網膜色素上皮條帶呈多個色素上皮脫離樣高隆起,其下血性弱反射暗區,神經上皮層下液性弱反射暗區
2014年12月30日至2023年3月24日,患者左眼共行抗VEGF治療64次(期間藥物由雷珠單抗更替為康柏西普或阿柏西普)。2015年2月11日患者因左眼玻璃體積血行玻璃體切割手術。2016年12月23日,患者于我院復查,左眼視力0.02。眼底檢查,左眼黃斑區黃色機化瘢痕形成,顳下方視網膜廣泛色素沉著樣改變(圖3A)。OCT檢查,黃斑中心凹視網膜厚度(CMT)降低,視網膜內液(IRF)及視網膜下液(SRF)減少,血性PED內積血吸收,PED高度降低,黃斑部機化瘢痕形成(圖3B)。2017年2月6日患者因左眼并發性白內障,行左眼白內障超聲乳化及人工晶狀體植入手術。2017年10月26日患者因左眼眼內炎,給予玻璃體腔注射頭孢他啶2 mg、萬古霉素1 mg治療。2022年12月23日復查,OCT檢查,左眼SRF明顯增多,IRF廣泛存在,CMT增高為1 242 μm,PED高度降低,黃斑部機化瘢痕形成(圖4A)。OCT血管成像(OCTA)檢查,左眼黃斑中心凹新生血管邊界清楚,呈“水母狀”外觀,分支密集,終末端血管吻合成拱廊(圖4B)。給予患者左眼玻璃體腔注射Brolucizumab 6 mg/0.0.5 ml。2023年1月25日復查,OCT檢查,左眼CMT347 μm,SRF完全吸收,IRF明顯改善,黃斑區結構恢復明顯,黃斑前膜及黃斑區機化瘢痕形成(圖5)。2023年2月27日復查,OCT檢查,左眼視網膜積液復發,視網膜層間形成多個弱反射液性囊腔,強反射點增多,CMT增加為576 μm。(圖6)。再次給予患者左眼玻璃體腔注射Brolucizumab,劑量同前。2023年3月24日復查,OCT檢查,左眼視網膜積液明顯吸收,視網膜層間強反射點減少,CMT降低為310 μm(圖7A)。OCTA檢查,黃斑中心凹新生血管粗大分散,新生血管中央區纏繞呈扭結樣外觀,周圍區分散呈“枯樹枝樣”改變(圖7B)。
 圖2
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼熒光造影像
圖2
Brolucizumab治療難治性息肉樣脈絡膜血管病變初診雙眼熒光造影像
2A、2B分別示右眼、左眼熒光素眼底血管造影像,右眼黃斑顳上方近血管弓處焦點狀熒光素滲漏;左眼黃斑中心凹大片出血遮蔽熒光,其間夾雜小片狀透見熒光。2C、2D分別示右眼、左眼吲哚青綠血管造影像,右眼黃斑區顳上方可見焦點樣強熒光;左眼出血遮蔽熒光,其間可見焦點樣強熒光
 圖3
Brolucizumab治療難治性息肉樣脈絡膜血管病變2016年12月23日復查左眼眼部檢查像
圖3
Brolucizumab治療難治性息肉樣脈絡膜血管病變2016年12月23日復查左眼眼部檢查像
3A示廣角彩色眼底像,黃斑區形成黃色機化瘢痕,顳下方視網膜廣泛色素沉著。3B示光相干斷層掃描像,黃斑中心凹視網膜厚度降低,視網膜內液及視網膜下液減少,血性色素上皮脫離內積血吸收,形成纖維血管性色素上皮脫離,色素上皮脫離高度降低,黃斑部形成機化瘢痕
 圖4
Brolucizumab治療難治性息肉樣脈絡膜血管病變2022年12月23日復查左眼眼部檢查像
圖4
Brolucizumab治療難治性息肉樣脈絡膜血管病變2022年12月23日復查左眼眼部檢查像
4A示光相干斷層掃描像,左眼視網膜下液明顯增多,視網膜內液廣泛存在,黃斑中心凹視網膜厚度增高為1 242 μm,視網膜色素上皮脫離高度降低,黃斑部機化瘢痕形成。4B示光相干斷層掃描血管成像,黃斑中心凹新生血管邊界清楚,呈“水母狀”外觀,分支密集,終末端血管吻合成拱廊
 圖5
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年1月25日復查左眼光相干斷層掃描像
圖5
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年1月25日復查左眼光相干斷層掃描像
左眼視網膜下液完全吸收,視網膜內液明顯改善,黃斑中心凹結構恢復明顯,可見黃斑前膜形成及黃斑區機化瘢痕,黃斑中心凹視網膜厚度降低為347 μm
 圖6
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年2月27日復查左眼光相干斷層掃描像
圖6
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年2月27日復查左眼光相干斷層掃描像
左眼視網膜積液復發,視網膜層間形成多個弱反射液性囊腔,強反射點增多,黃斑中心凹視網膜厚度增加為576 μm
 圖7
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年3月24日復查左眼眼部檢查像
圖7
Brolucizumab治療難治性息肉樣脈絡膜血管病變2023年3月24日復查左眼眼部檢查像
7A示光相干斷層掃描像,視網膜積液明顯吸收,視網膜層間強反射點減少,黃斑中心凹視網膜厚度降低為310 μm。7B示光相干斷層掃描血管成像,黃斑中心凹新生血管粗大分散,新生血管中央區呈扭結樣外觀,周圍區分散呈“枯樹枝樣”改變
討論 PCV是新生血管性年齡相關性黃斑變性(nAMD)的一種特殊亞型,屬于1型黃斑新生血管(MNV),亞洲人群中,nAMD中的50%以上為PCV[1-2]。PCV的主要病理特征為RPE與Bruch膜之間的息肉樣病灶和分支血管網,常導致復發的視網膜下出血及積液。PCV的一線治療方式為抗VEGF藥物治療[3],可改善PCV患者視功能及解剖學形態,但臨床中存在部分患者反復抗VEGF藥物治療應答不佳。本例患者左眼為PCV合并黃斑區視網膜下出血,在為期8年的治療中共注射抗VEGF藥物64次。2014年至2016年患者對抗VEGF藥物治療應答良好,視網膜積液減少,視網膜下出血吸收。2016年至2022年隨訪觀察中,無論抗VEGF藥物從雷珠單抗更換為康柏西普或阿柏西普,并每月注射,患者均表現為難以吸收的視網膜積液及纖維血管性PED。考慮其原因可能與反復注射疾病的耐藥性、新生血管的隱匿性、藥物的滲透性、新生血管的成熟形態等相關。因此,尋找更優的PCV治療方案仍是目前研究的重點。
Brolucizumab是一種人源化單克隆單鏈抗體片段,為目前已知的相對分子質量最小(26 ×103)的抗VEGF藥物,具有組織穿透性強、藥物摩爾濃度高、注射間隔時間長等優勢[4]。相比于阿柏西普,Brolucizumab的療效呈非劣效性,可延長治療間隔,并且對視網膜積液的改善更為顯著[5-7]。Matsumoto等[8]研究發現,78.9%未接受治療的PCV患者,在接受3次Brolucizumab治療后息肉樣病變完全消退。關于初治型nAMD患者Brolucizumab治療前后OCTA上MNV的面積變化,研究結果存在爭議。Rübsam 等[9]研究發現,nAMD患者經Brolucizumab治療后MNV的面積降低。Toto等[10]研究發現,nAMD患者經Brolucizumab治療后MNV面積無明顯改善。目前對難治性nAMD患者治療后MNV面積變化暫未見報道。本例患者經Brolucizumab治療后3個月,OCTA檢查MNV形態逐漸粗大分散,考慮這與新生血管的結構逐漸成熟相關。對于難治性nAMD患者使用Brolucizumab治療的結果也有相應報道[11-13]。研究報道,對既往多次注射抗VEGF藥物治療(3~107次)的難治性nAMD患者進行至少1次的Brolucizumab治療,治療后患者視力無顯著改善,但CMT和視網膜積液顯著改善[12]。本例患者經Brolucizumab治療前后視力均為0.02,但Brolucizumab治療后SRF及IRF明顯吸收,治療后1個月,CMT從1 242 μm下降至347 μm,這與既往研究結果相似。而視力無改善的原因考慮與長期病灶存在導致光感受器細胞被破壞有關。
Brolucizumab作為新型的小分子抗VEGF藥物,在國外研究中發現其對初治型和難治性nAMD表現出良好的療效。本例患者中,Brolucizumab對持續不消退IRF有良好的解剖學效果,能明顯地消除視網膜積液,并穩定患者的視力。這是我國首次報道Brolucizumab對難治性PCV的觀察,在Brolucizumab治療的隨訪期間患者尚未出現結膜出血、眼內炎、葡萄膜炎等安全性事件,在未來尚需更多的多中心大樣本的前瞻性研究來探討Brolucizumab對我國難治性PCV患者的安全性及有效性。