引用本文: 馬映雪, 何廣輝, 高翔, 付燕, 武斌. 人臍帶間充質干細胞外泌體靶向miR-126調節高糖誘導的人視網膜血管內皮細胞中血管內皮生長因子-A的表達. 中華眼底病雜志, 2024, 40(5): 372-378. doi: 10.3760/cma.j.cn511434-20240108-00007 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
既往研究發現,人臍帶間充質干細胞(hUCMSC)外泌體(Exo)在一定劑量和時間范圍內能顯著降低高糖刺激下人視網膜血管內皮細胞(hREC)中VEGF-A蛋白和mRNA的表達,其中100 μg/ml Exo與hREC共培養24 h時降VEGF-A效應最顯著[1]。此外,miR-126與血管生成調控密切相關,如通過激活缺氧誘導因子1α(HIF-1α)而優化間充質干細胞(MSC)Exo對骨折愈合的治療作用[2];通過抑制VEGF-A分泌、調控血管生成因子及直接下調VEGF-A,對高糖誘導視網膜病變、缺血性視網膜新生血管和脈絡膜新生血管形成發揮抑制作用[3-5]。本課題組前期工作進一步表明,MSC Exo通過調節miR-126對高遷移率族蛋白B1的靶向作用,有效緩解高糖引起的視網膜炎癥[6],提示miR-126通路在糖尿病視網膜病變(DR)炎癥治療中的潛力。盡管如此,DR病理進程中VEGF-A過度表達驅動的血管新生異常同樣關鍵。鑒于VEGF-A抑制劑在DR治療中的廣泛應用,深入探究MSC Exo通過miR-126對VEGF-A的調控機制,對于全面評估其在DR綜合治療中的價值至關重要。為此,本研究在高糖低氧條件下建立了hREC模型,旨在觀察hUCMSC Exo通過miR-126對VEGF-A的影響,并初步探討其潛在機制,旨在闡明MSC Exo如何同時通過miR-126抑制炎癥并干預DR的血管異常。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
hUCMSC及hREC細胞株(天津賽爾生物技術有限公司);HIF-1α抗體(ab51608)、哺乳動物雷帕霉素靶蛋白(mTOR)抗體(ab2732)、β-肌動蛋白(actin,ab8226)、辣根過氧化物酶(HRP)標記的羊抗兔免疫球蛋白G(IgG)二抗(ab6721)(英國Abcam公司);miRCURY LNA? microRNA inhibitor for miR-126(丹麥Exiqon公司);Lipofectamine RNAiMAX、Trizol Reagent(美國Invitrogen公司);mTOR抑制劑AZD2014(美國Selleckchem公司);HIF-1α抑制劑YC-1(美國MedChemExpress公司);Ttranswell共培養板(美國Corning公司);EPF柱(上海宇玫博生物科技有限公司);DYCZ-24DN型垂直電泳裝置(北京市六一儀器廠);LabWorksTM凝膠成像與分析系統(美國UVP公司);M-MLV逆轉錄酶、RNA酶抑制劑、dNTP(10 mmol/L)、SYBR Premix Ex Taq試劑盒(日本Takara公司);iQ5實時熒光定量聚合酶鏈反應(qPCR)儀(美國Applied Biosystems公司)。
1.2 細胞培養、分組及hUCMSC Exo制備
hREC常規培養于含10%胎牛血清的EGM-2-MV內皮細胞培養基中,待細胞約有80%貼壁生長且狀態良好時,換為含2%胎牛血清的培養基同步化12 h,而后換用30 mmol/L葡萄糖EGM-2-MV內皮細胞培養基,并將細胞置于含1% O2的低氧細胞培養箱中培養。
hUCMSC Exo制備:去除雜質的hUCMSC培養離心上清液中加入Exo濃縮溶液,靜置2 h,4℃,10 000×g離心60 min,棄上清;重懸后,4℃,12 000×g離心120 min。將收獲的Exo顆粒粗品轉入EPF柱上室中,4℃,3 000×g離心10 min。離心后收集EPF柱管底的液體,即為純化后的Exo顆粒。
將hREC分為Exo組、磷酸鹽緩沖液(PBS)組、PBS+anti-miR126組、Exo+anti-miR126組、PBS+anti-mTOR組、PBS+anti-HIF-1α組。PBS組、Exo組:Transwell共培養板下層為高糖低氧誘導的hREC;上層分別加入PBS、濃度為100 μg/ml的hCMSC Exo。PBS+anti-miR126組、Exo+anti-miR126組:miR-126 LNA Power inhibitor探針轉染高糖低氧誘導的hREC。參照Exiqon miRCURYTM LNA Power Inhibitor轉染試劑盒操作說明,Lipofectamine RNAiMAX為陰性對照,控制終濃度為50 nmol/L。轉染6 h后更換新鮮培養基并分別與PBS、濃度為100 μg/ml hUCMSC Exo共培養。PBS+anti-mTOR組、PBS+anti-HIF-1α組:濃度為500 nmol/L ADZ2014、25 μmol/LYC-1分別預處理hREC 12 h后,再行高糖低氧誘導后與PBS共培養。
1.3 免疫熒光法檢測共培養24 h后PBS組、Exo組hREC中mTOR、HIF-1α的蛋白表達
細胞固定于4%多聚甲醛中20 min,PBS漂洗3次,10 min/次;0.5% Triton X-100中孵育10 min,加入2%牛血清白蛋白封閉處理,室溫環境下靜置1 h。加入mTOR、HIF-1α一抗(1:200),4 ℃過夜孵育,PBS漂洗3次;加入羊抗兔IgG抗體(1:200),室溫2 h,PBS漂洗。4',6-二脒基-2-苯基吲哚染色,熒光顯微鏡下觀察拍照,Image Pro Plus 軟件半定量分析計算平均熒光強度。
1.4 蛋白免疫印跡法(Western blot)檢測共培養24 h后PBS組、Exo組hREC中mTOR、HIF-1α蛋白相對表達量以及PBS組、PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A蛋白相對表達量
收集各組細胞,PBS洗滌,加入RIPA冰上裂解15 min。4 ℃,以離心半徑10 cm、12 000 r/min離心10 min,收集上清,二喹啉甲酸蛋白定量。沸水浴蛋白變性,聚丙烯酰胺凝膠電泳中上樣電泳,轉至聚偏二氟乙烯膜,5%脫脂奶粉室溫封閉1 h,加入HIF-1α(1:1 000);mTOR(1:1 000)、β-actin(1:800)、VEGF-A(1:800)一抗,4 ℃過夜孵育,洗膜緩沖液(TBST)洗膜,加入HRP標記的山羊抗兔IgG(1:2 000),室溫孵育2 h,TBST洗膜,置于Western LightningTM Chemiluminescence Reagent顯色劑后曝光并拍照,凝膠成像系統掃描分析蛋白條帶。目的蛋白相對表達水平=目的蛋白條帶灰度值/內參照β-actin蛋白條帶灰度值。
1.5 qPCR檢測Exo組共培養0、8、16、24 h后hREC中miR-126 mRNA相對表達量以及PBS組、Exo組、PBS+anti-miR126組、Exo+anti-miR126組、PBS+anti-mTOR組、PBS+anti-HIF-1α組共培養24 h后hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量
收集各組細胞,Trizol法提取總RNA,檢測RNA濃度和純度,逆轉錄合成cDNA。反應體系包括cDNA 2 μl,正向引物及反向引物各2 μl,2倍SYBR? Green PCR Master Mix 10 μl,雙蒸水20 μl。應用Express 3.0軟件設計引物序列(表1)。反應條件:94 ℃ 5 min,94 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,共40個循環。以β-actin為內參基因,采用2-△△CT法計算目的基因mRNA相對表達水平。
1.6 統計學方法
采用SPSS22.0軟件行統計學分析。計量數據以均數±標準差(x±s)表示。兩組間比較采用t檢驗;多組間比較采用單因素方差分析。檢驗水準α=0.05。P<0.05為差異有統計學意義。
2 結果
2.1 hREC中miR-126水平隨hUCMSC Exo干預時間延長而逐步增高
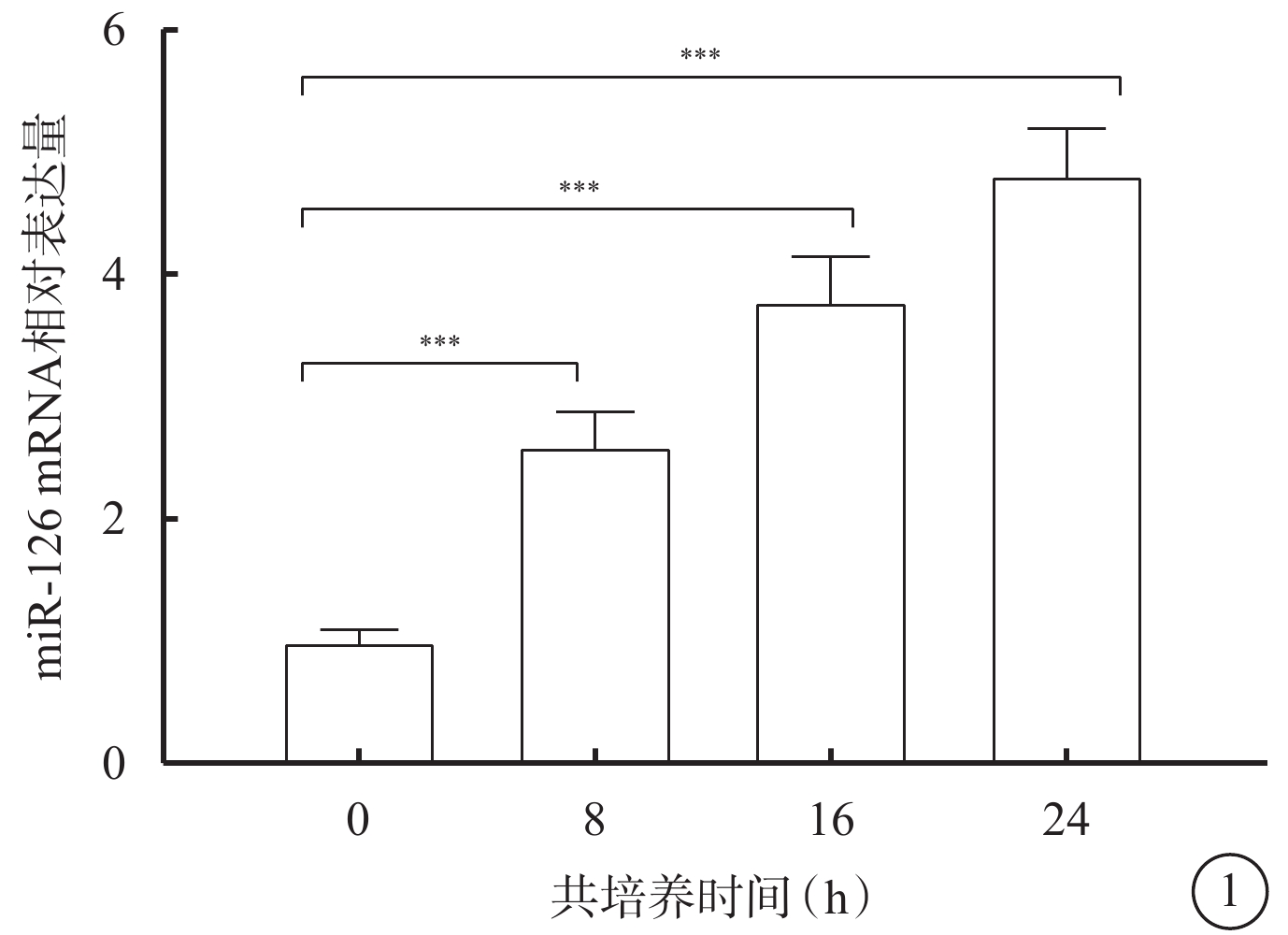
qPCR檢測結果顯示,共培養0、8、16、24 h,Exo組hREC中miR-126 mRNA相對表達量逐漸增高,差異有統計學意義(F=95.900,P<0.05)(圖1)。不同時間點miR-126 mRNA相對表達量比較,差異均有統計學意義(P<0.05)。
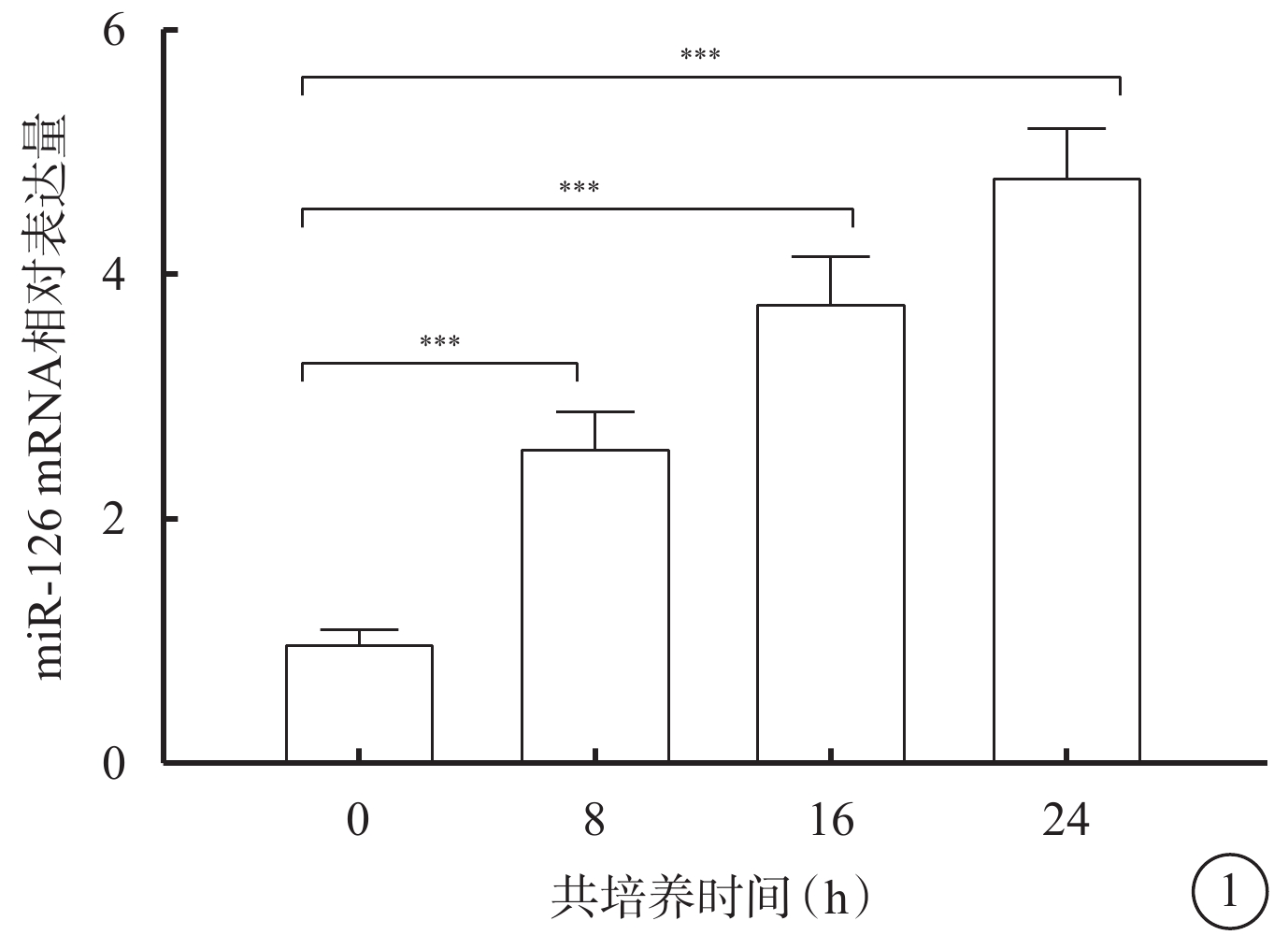 圖1
Exo組共培養后不同時間hREC中miR-126 mRNA相對表達量比較(n=3) Exo:外泌體;hREC:人視網膜血管內皮細胞;*P<0.05,**P<0.01,***P<0.001
圖1
Exo組共培養后不同時間hREC中miR-126 mRNA相對表達量比較(n=3) Exo:外泌體;hREC:人視網膜血管內皮細胞;*P<0.05,**P<0.01,***P<0.001
2.2 hUCMSC Exo下調高糖低氧誘導的hREC表達的mTOR、HIF-1α蛋白表達水平
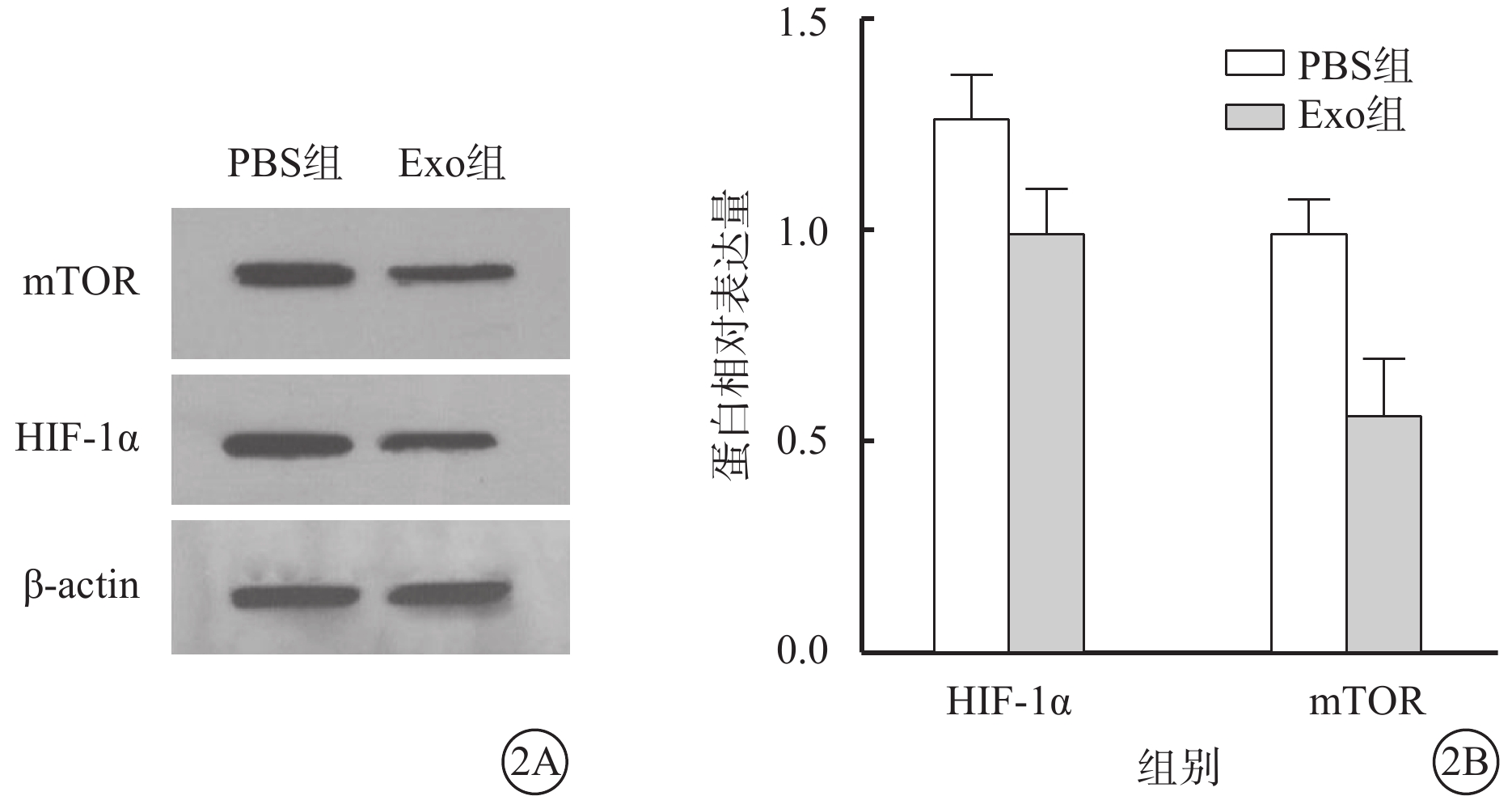
Western blot檢測結果顯示,PBS組、Exo組hREC中mTOR、HIF-1α蛋白相對表達量分別為1.271±0.170、1.000±0.170和1.000±0.127、0.057±0.220。與PBS組比較,Exo組hREC中mTOR、HIF-1α蛋白相對表達量均下調,差異有統計學意義(t=3.466、6.804,P<0.05、0.01)(圖2)。
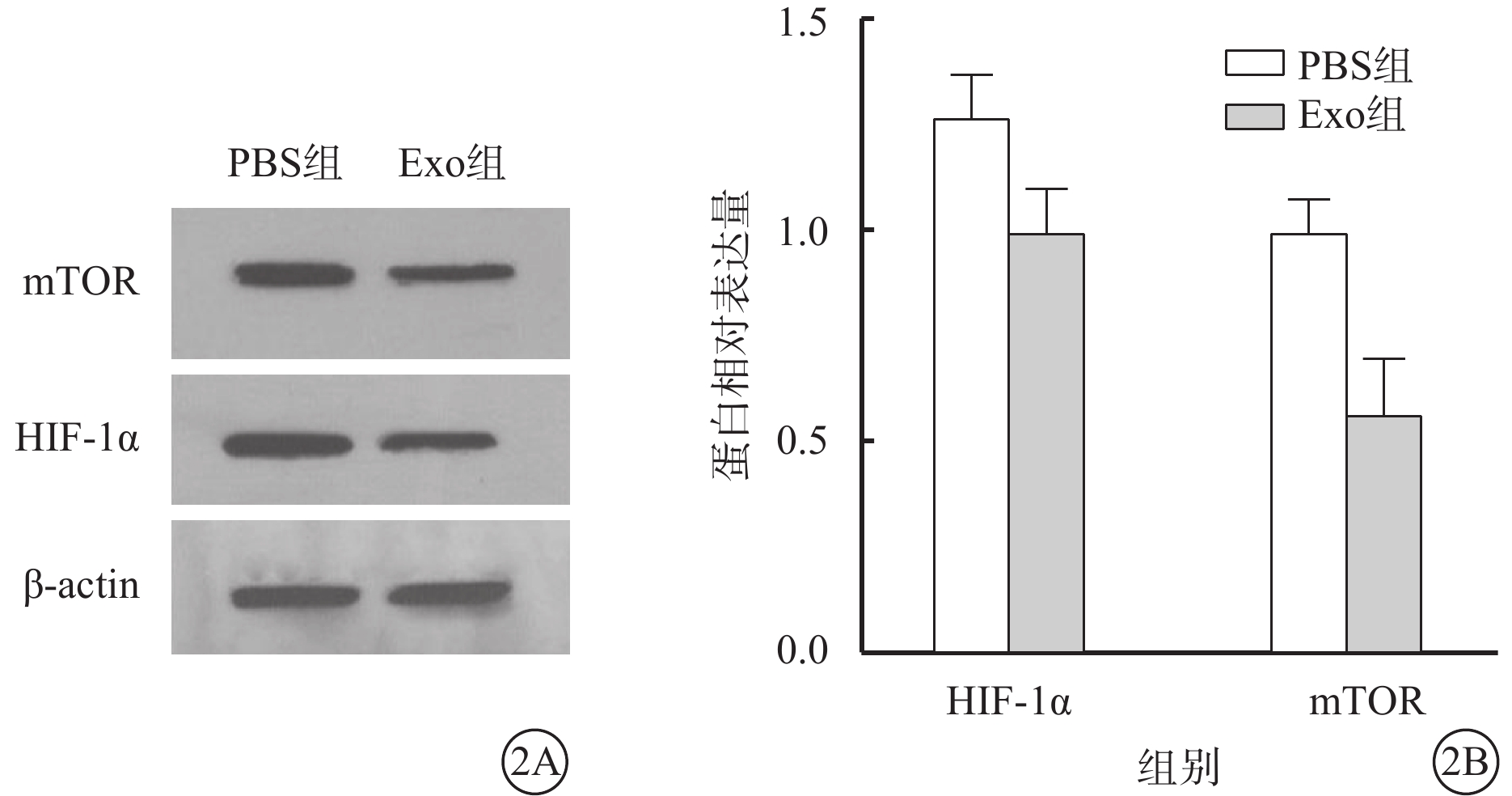 圖2
PBS組、Exo組hREC中mTOR、HIF-1α 蛋白表達水平(n=3) 2A示電泳圖;2B示PBS組、Exo組hREC中mTOR、HIF-1α 蛋白相對表達量比較,*P<0.05,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;actin:肌動蛋白
圖2
PBS組、Exo組hREC中mTOR、HIF-1α 蛋白表達水平(n=3) 2A示電泳圖;2B示PBS組、Exo組hREC中mTOR、HIF-1α 蛋白相對表達量比較,*P<0.05,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;actin:肌動蛋白
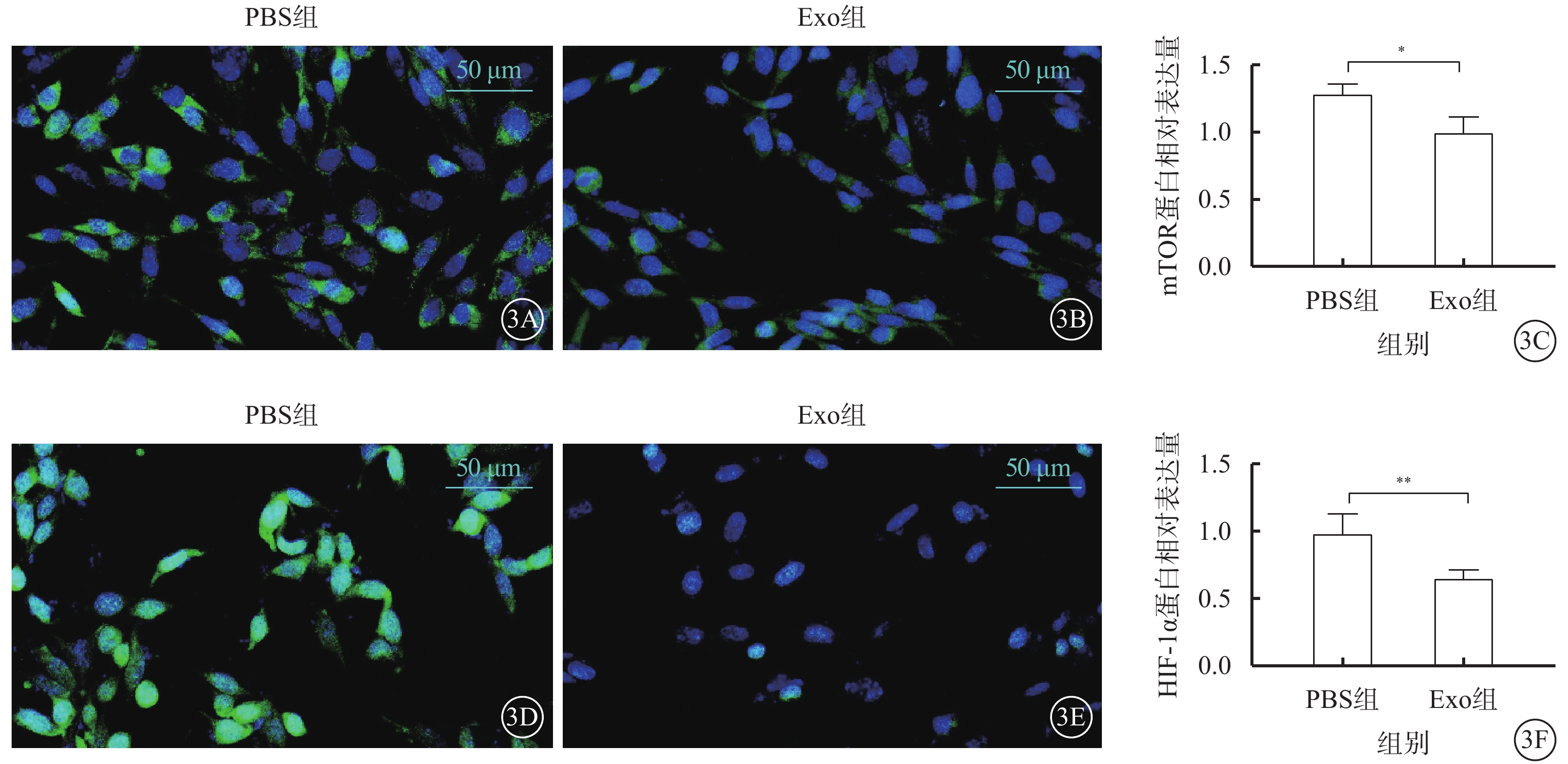
免疫熒光檢測結果顯示,與PBS組比較,Exo組hREC中mTOR、HIF-1α蛋白表達下調,差異有統計學意義(t=3.649、5.172,P<0.05、0.01)(圖3)。
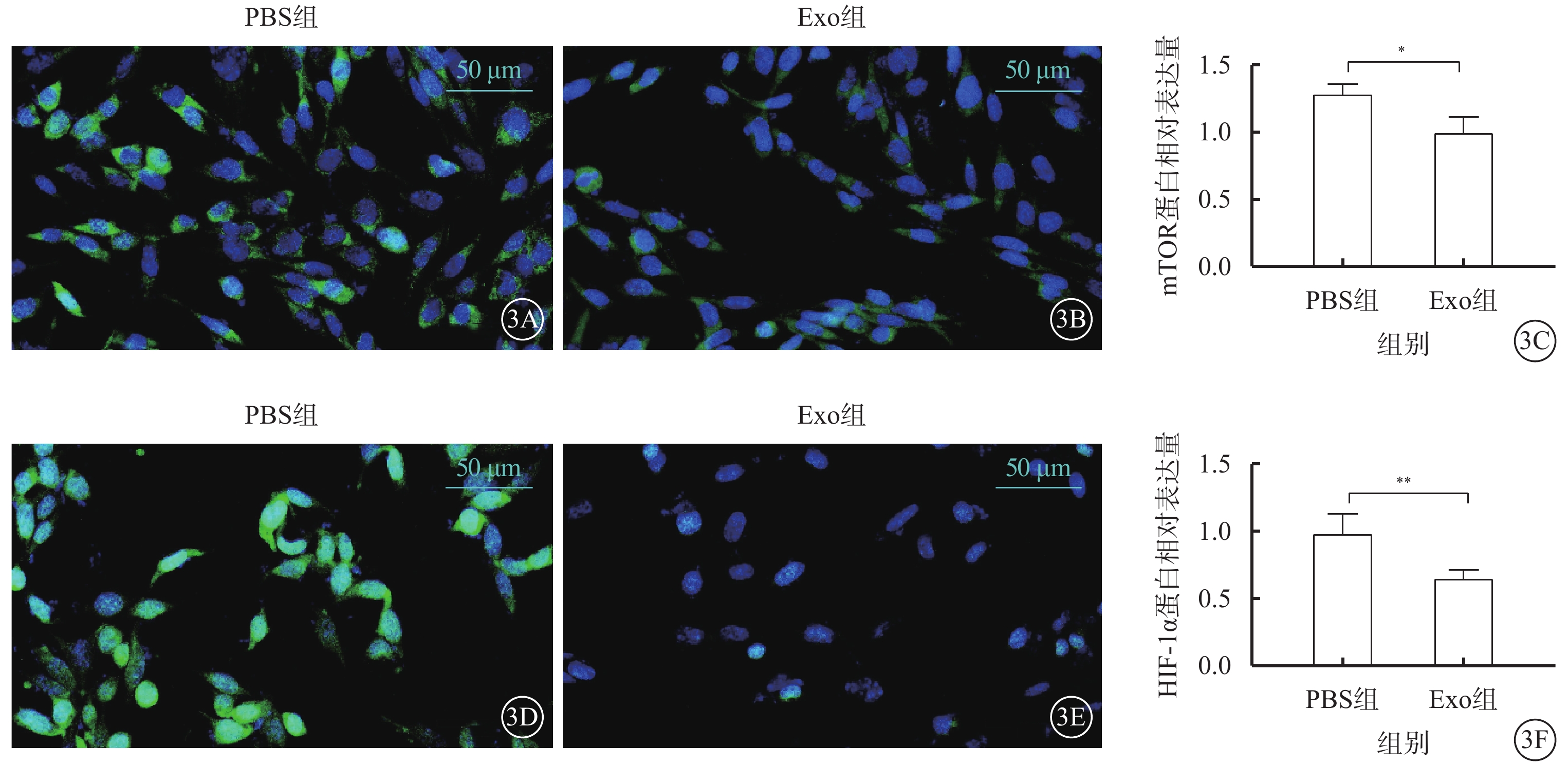 圖3
Exo對hREC中mTOR、HIF-1α的影響(n=3) 3A、3B分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),mTOR呈綠色熒光;3C示兩組mTOR表達比較,*P<0.05;3D、3E分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),HIF-1α呈綠色熒光;3F示兩組HIF-1α表達比較,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α
圖3
Exo對hREC中mTOR、HIF-1α的影響(n=3) 3A、3B分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),mTOR呈綠色熒光;3C示兩組mTOR表達比較,*P<0.05;3D、3E分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),HIF-1α呈綠色熒光;3F示兩組HIF-1α表達比較,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α
2.3 hUCMSC Exo下調高糖低氧誘導的hREC表達的mTOR、HIF-1α mRNA表達水平
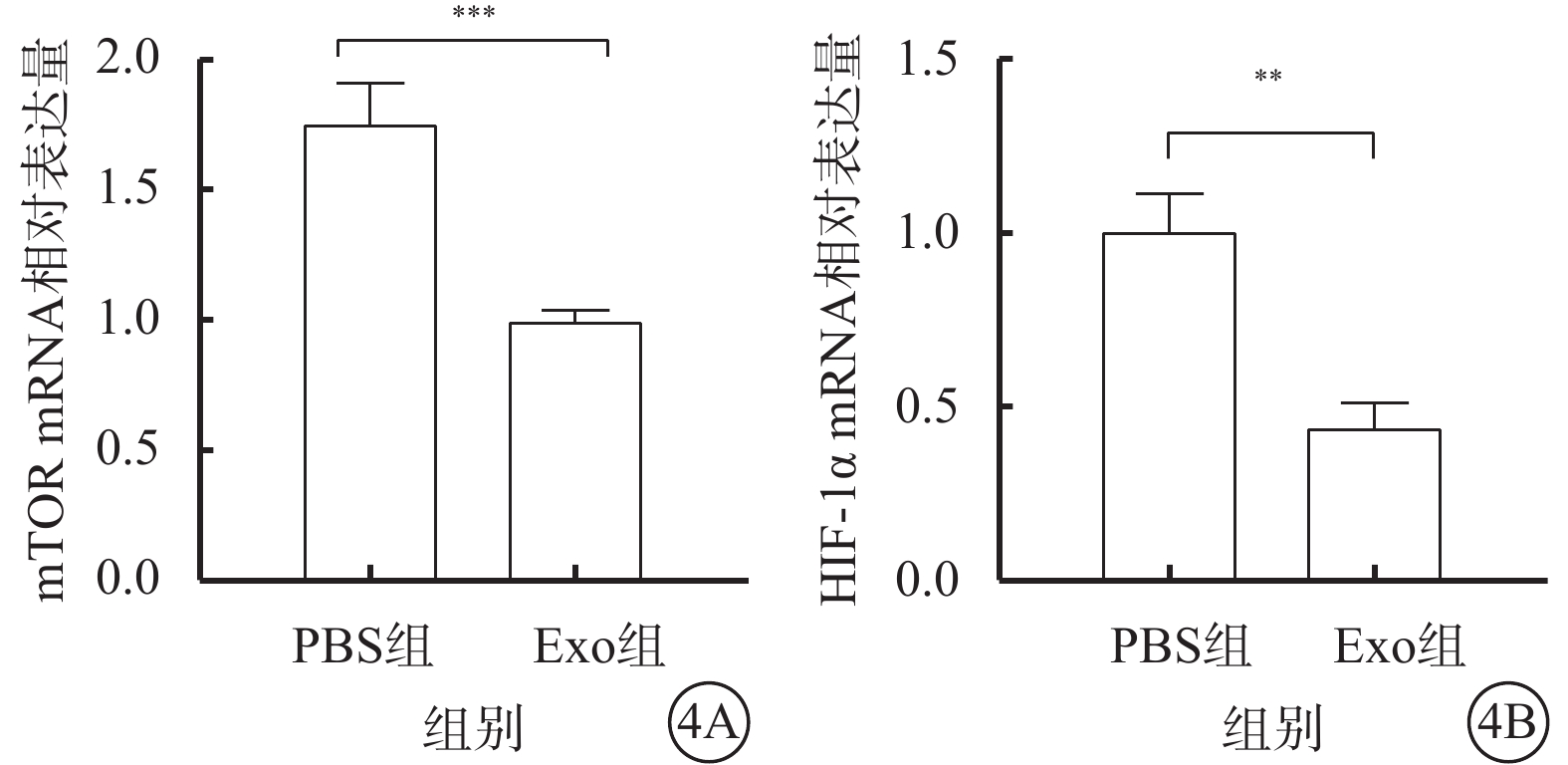
與PBS組比較,Exo組細胞中mTOR、HIF-1α mRNA相對表達量下降,差異有統計學意義(t=8.642、7.897,P<0.001、0.01)(圖4)。
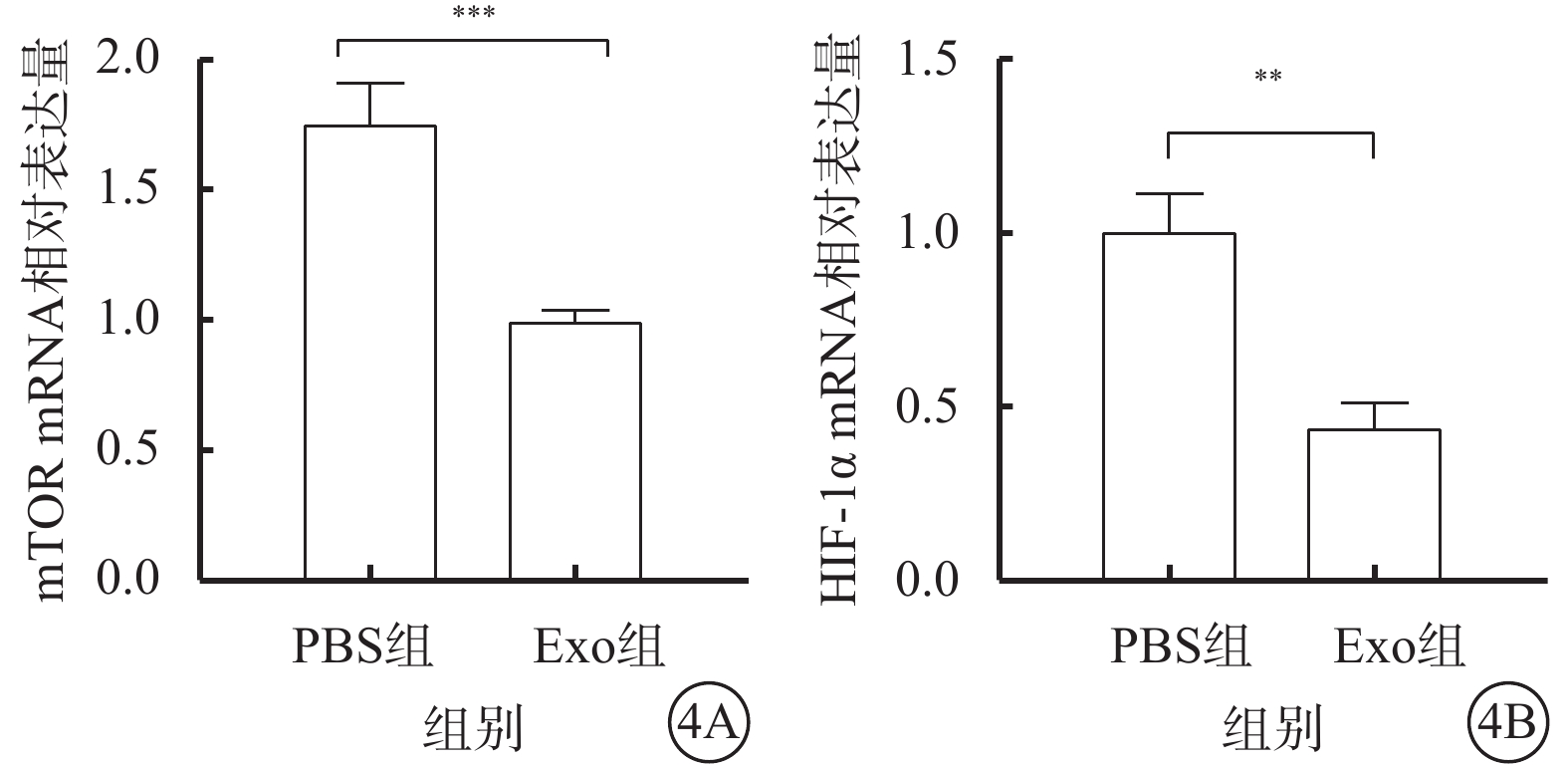 圖4
PBS組、Exo組hREC中mTOR、HIF-1α mRNA相對表達量比較(n=3) PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;**P<0.01,***P<0.001
圖4
PBS組、Exo組hREC中mTOR、HIF-1α mRNA相對表達量比較(n=3) PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;**P<0.01,***P<0.001
2.4 mTOR、HIF-1α抑制劑下調VEGF-A表達
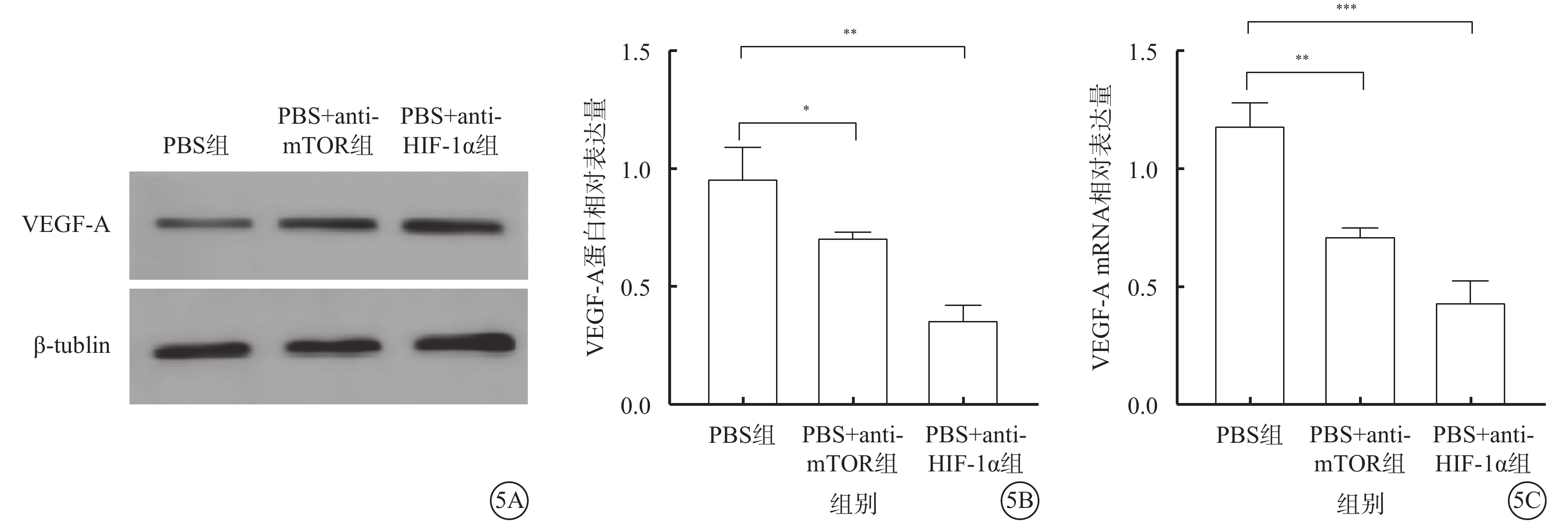
與PBS組比較,PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A蛋白(t=3.337、7.380,P<0.05、0.01)、mRNA(t=8.515、10.400,P<0.01、0.001)相對表達量下降,差異均有統計學意義(圖5)。
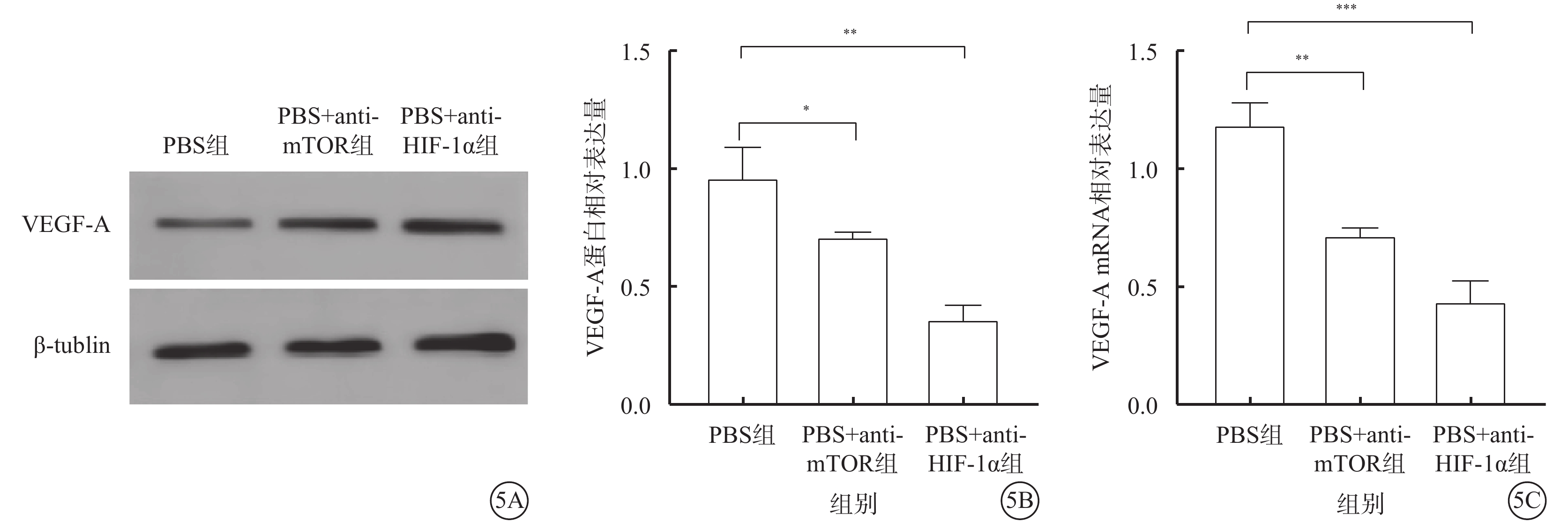 圖5
PBS組、PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A表達水平(n=3) 5A示電泳圖;5B、5C分別示3組VEGF-A蛋白、mRNA相對表達量比較,*P<0.05,**P<0.01,***P<0.00 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;tublin:微管蛋白
圖5
PBS組、PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A表達水平(n=3) 5A示電泳圖;5B、5C分別示3組VEGF-A蛋白、mRNA相對表達量比較,*P<0.05,**P<0.01,***P<0.00 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;tublin:微管蛋白
2.5 miR-126下調Exo干預的高糖低氧誘導的hREC中mTOR、HIF-α、VEGF-A mRNA表達
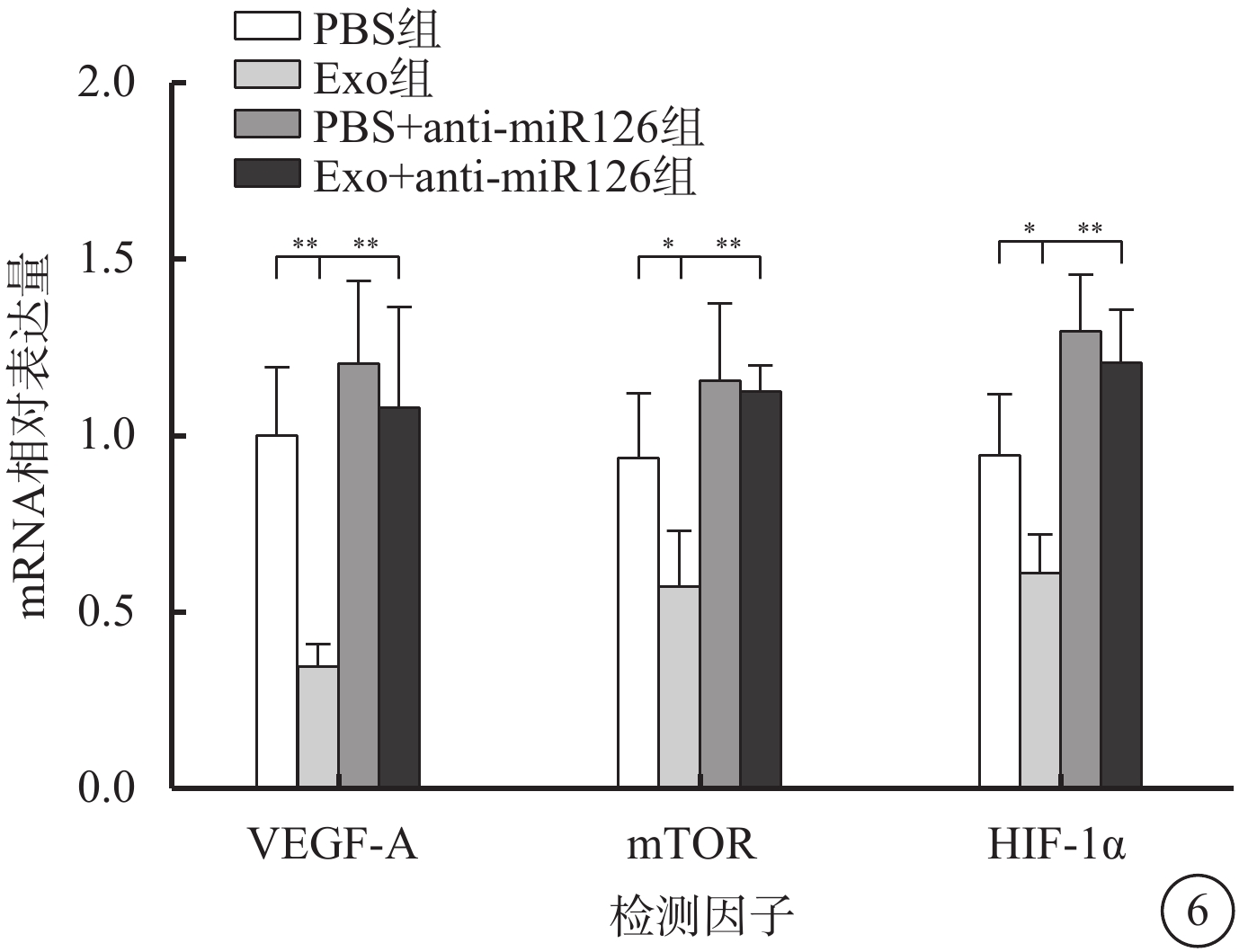
與PBS組比較,Exo組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量明顯降低,差異均有統計學意義(t=6.099、2.886、3.159,P<0.01、0.05、0.05)。PBS+anti-miR126組hREC中VEGF-A、mTOR mRNA相對表達量有所升高,但差異無統計學意義(t=1.253、1.428,P>0.05);HIF-1α mRNA相對表達量明顯升高,差異有統計學意義(t=2.837,P<0.05)。Exo+anti-miR126組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量明顯升高,差異均有統計學意義(t=4.664、6.136、6.247,P<0.01、0.01、0.01)(圖6)。
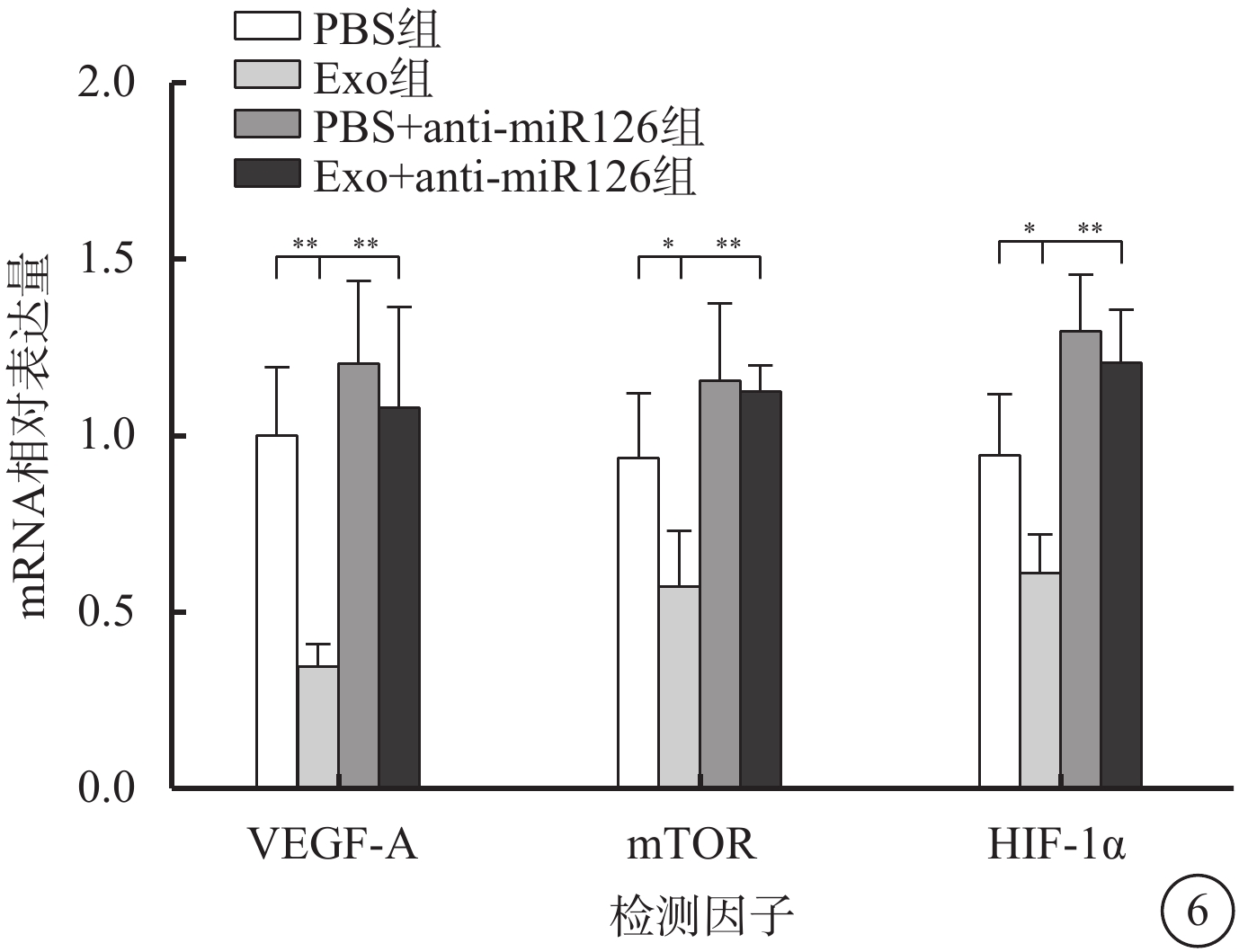 圖6
PBS組、Exo組、PBS+anti-miR126組、Exo+anti-miR126組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量比較(n=3)PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;*P<0.05,**P<0.01
圖6
PBS組、Exo組、PBS+anti-miR126組、Exo+anti-miR126組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量比較(n=3)PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;*P<0.05,**P<0.01
3 討論
本研究結果顯示,高糖低氧誘導的hREC經hUCMSC Exo干預后,其細胞中miR-126水平在24 h內隨干預時間逐漸上調,24 h后細胞中mTOR、HIF-1α蛋白、mRNA水平均下調;給予mTOR、HIF-1α抑制劑預處理后VEGF-A水平增幅有所下降,再應用hUCMSC Exo進行干預,其VEGF-A水平明顯上調。這提示miR126和mTOR/HIF-1α通路在hUCMSC Exo抑制高糖誘導hREC中VEGF-A升高發揮了重要作用。
病理情況下,如缺氧導致VEGF大量表達上調致血管生成,以提供足夠的氧氣供組織使用,并吸引白細胞進入血管壁,從而引發炎癥[7]。VEGF受體(VEGFR)-2主要在血管內皮細胞上表達,激活內皮細胞增殖和遷移,促進血管生成并增加血管通透性,這是血管生成的基本變化[8]。 文獻報道,增生型DR纖維血管增生的患者玻璃體中VEGF水平升高,提示其參與眼新生血管疾病[9-10]。當細胞缺氧時,穩定的HIF-1α易位至細胞核并與HIF-1β結合產生HIF-1轉錄因子,活化的HIF-1可以誘發大量VEGF的產生[11-13]。有研究表明,抑制HIF-1α或HIF-2α可減輕氧誘導視網膜病變小鼠模型中新生血管的產生,而缺氧能夠導致mTOR誘導血管生成和細胞增殖并增強 HIF-1α的活性[14]。Zhao等[15]發現,miR-126成為缺氧和再灌注的新調節因子,缺氧條件下,VEGF-A在內皮細胞中受到miR-126的調節。對于新生血管性視網膜疾病,血管生成的調節因子除VEGF-A等調節蛋白外,上游因子miRNA的調控被認為是最重要的調節因素[16-17]。研究表明,視網膜色素上皮細胞中miR-126的上調抵消了高血糖誘導的VEGF-A分泌增加[3]。miR-126在VEGF-A的3'-非翻譯區存在1個結合位點,能夠調節血管完整性和血管生成過程[18]。miR-126能夠通過抑制HIF-1α激活以抑制CXC趨化因子配體12/ CXC趨化因子受體4通路在血管損傷和缺氧中的作用[19]。此外,磷脂酰肌醇3激酶(PI3K)是被miR-126靶向的絲氨酸-蘇氨酸蛋白激酶(Akt)通路激活劑,缺氧使miR-126失調而增加PI3K激活,致使Akt激活和VEGF表達上調[20]。將miR-126轉染至癌細胞中能夠下調VEGF-A的表達[21]。miR-126通過調節內皮細胞對VEGF的反應發揮作用,從而調節血管完整性和血管生成[22]。我們前期研究已證實hUCMSC Exo能夠下調高糖誘導的hREC中VEGF-A水平[1]。本研究結果顯示,miR-126在hUCMSC Exo干預的高糖低氧誘導的hREC中顯著升高,且具有時間依賴效應。這提示hUCMSC Exo能夠上調hREC中miR-126的水平,進而發揮下調VEGF-A的作用。
本研究結果還提示,miR-126能夠通過mTOR間接調節HIF-1α水平。mTOR在調節HIF-1α介導的VEGF中的作用已被證實,且能夠在翻譯水平上調節HIF-1α的合成[23-25]。Wei等[26]發現,阻斷mTOR靶點能夠抑制DR中HIF-1α通路調節的VEGF,這與本研究部分結果一致。本研究結果顯示,hUCMSC Exo在干預高糖低氧誘導的hREC 24 h后,其細胞表達的miR-126上調,mTOR、HIF-1α水平下調,VEGF-A水平明顯下調,抑制高糖誘導的hREC中mTOR、HIF-1α能夠減輕VEGF-A的上調;應用miR-126抑制劑處理高糖誘導的hREC后,其VEGF-A、mTOR、HIF-1α mRNA相對表達量明顯升高,提示miR-126能夠下調mTOR表達,抑制mTOR,從而下調HIF-α和VEGF-A表達,即hUCMSC Exo通過上調高糖低氧誘導hREC中miR-126抑制mTOR/HIF-1α通路,從而抑制新生血管生成。
本研究旨在以miR-126為切入點解讀mTOR/HIF-1α通路參與hUCMSC Exo對高糖誘導的hREC中VEGF-A水平的影響,為新生血管性疾病的治療提供新的思路。目前本研究僅為初步驗證,一些深入問題還需進一步探索,如miR-126與HIF-1α之間的交互作用,且當前模型無法模擬體內環境,仍需體內實驗動物模型相關數據支持,如氧誘導視網膜新生血管模型、糖尿病模型等。今后工作中,進一步挖掘hUCMSC Exo調節miR-126通過mTOR/HIF-1α參與新生血管調控的生物學信息,為hUCMSC Exo參與治療視網膜新生血管性疾病提供理論支持。
既往研究發現,人臍帶間充質干細胞(hUCMSC)外泌體(Exo)在一定劑量和時間范圍內能顯著降低高糖刺激下人視網膜血管內皮細胞(hREC)中VEGF-A蛋白和mRNA的表達,其中100 μg/ml Exo與hREC共培養24 h時降VEGF-A效應最顯著[1]。此外,miR-126與血管生成調控密切相關,如通過激活缺氧誘導因子1α(HIF-1α)而優化間充質干細胞(MSC)Exo對骨折愈合的治療作用[2];通過抑制VEGF-A分泌、調控血管生成因子及直接下調VEGF-A,對高糖誘導視網膜病變、缺血性視網膜新生血管和脈絡膜新生血管形成發揮抑制作用[3-5]。本課題組前期工作進一步表明,MSC Exo通過調節miR-126對高遷移率族蛋白B1的靶向作用,有效緩解高糖引起的視網膜炎癥[6],提示miR-126通路在糖尿病視網膜病變(DR)炎癥治療中的潛力。盡管如此,DR病理進程中VEGF-A過度表達驅動的血管新生異常同樣關鍵。鑒于VEGF-A抑制劑在DR治療中的廣泛應用,深入探究MSC Exo通過miR-126對VEGF-A的調控機制,對于全面評估其在DR綜合治療中的價值至關重要。為此,本研究在高糖低氧條件下建立了hREC模型,旨在觀察hUCMSC Exo通過miR-126對VEGF-A的影響,并初步探討其潛在機制,旨在闡明MSC Exo如何同時通過miR-126抑制炎癥并干預DR的血管異常。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
hUCMSC及hREC細胞株(天津賽爾生物技術有限公司);HIF-1α抗體(ab51608)、哺乳動物雷帕霉素靶蛋白(mTOR)抗體(ab2732)、β-肌動蛋白(actin,ab8226)、辣根過氧化物酶(HRP)標記的羊抗兔免疫球蛋白G(IgG)二抗(ab6721)(英國Abcam公司);miRCURY LNA? microRNA inhibitor for miR-126(丹麥Exiqon公司);Lipofectamine RNAiMAX、Trizol Reagent(美國Invitrogen公司);mTOR抑制劑AZD2014(美國Selleckchem公司);HIF-1α抑制劑YC-1(美國MedChemExpress公司);Ttranswell共培養板(美國Corning公司);EPF柱(上海宇玫博生物科技有限公司);DYCZ-24DN型垂直電泳裝置(北京市六一儀器廠);LabWorksTM凝膠成像與分析系統(美國UVP公司);M-MLV逆轉錄酶、RNA酶抑制劑、dNTP(10 mmol/L)、SYBR Premix Ex Taq試劑盒(日本Takara公司);iQ5實時熒光定量聚合酶鏈反應(qPCR)儀(美國Applied Biosystems公司)。
1.2 細胞培養、分組及hUCMSC Exo制備
hREC常規培養于含10%胎牛血清的EGM-2-MV內皮細胞培養基中,待細胞約有80%貼壁生長且狀態良好時,換為含2%胎牛血清的培養基同步化12 h,而后換用30 mmol/L葡萄糖EGM-2-MV內皮細胞培養基,并將細胞置于含1% O2的低氧細胞培養箱中培養。
hUCMSC Exo制備:去除雜質的hUCMSC培養離心上清液中加入Exo濃縮溶液,靜置2 h,4℃,10 000×g離心60 min,棄上清;重懸后,4℃,12 000×g離心120 min。將收獲的Exo顆粒粗品轉入EPF柱上室中,4℃,3 000×g離心10 min。離心后收集EPF柱管底的液體,即為純化后的Exo顆粒。
將hREC分為Exo組、磷酸鹽緩沖液(PBS)組、PBS+anti-miR126組、Exo+anti-miR126組、PBS+anti-mTOR組、PBS+anti-HIF-1α組。PBS組、Exo組:Transwell共培養板下層為高糖低氧誘導的hREC;上層分別加入PBS、濃度為100 μg/ml的hCMSC Exo。PBS+anti-miR126組、Exo+anti-miR126組:miR-126 LNA Power inhibitor探針轉染高糖低氧誘導的hREC。參照Exiqon miRCURYTM LNA Power Inhibitor轉染試劑盒操作說明,Lipofectamine RNAiMAX為陰性對照,控制終濃度為50 nmol/L。轉染6 h后更換新鮮培養基并分別與PBS、濃度為100 μg/ml hUCMSC Exo共培養。PBS+anti-mTOR組、PBS+anti-HIF-1α組:濃度為500 nmol/L ADZ2014、25 μmol/LYC-1分別預處理hREC 12 h后,再行高糖低氧誘導后與PBS共培養。
1.3 免疫熒光法檢測共培養24 h后PBS組、Exo組hREC中mTOR、HIF-1α的蛋白表達
細胞固定于4%多聚甲醛中20 min,PBS漂洗3次,10 min/次;0.5% Triton X-100中孵育10 min,加入2%牛血清白蛋白封閉處理,室溫環境下靜置1 h。加入mTOR、HIF-1α一抗(1:200),4 ℃過夜孵育,PBS漂洗3次;加入羊抗兔IgG抗體(1:200),室溫2 h,PBS漂洗。4',6-二脒基-2-苯基吲哚染色,熒光顯微鏡下觀察拍照,Image Pro Plus 軟件半定量分析計算平均熒光強度。
1.4 蛋白免疫印跡法(Western blot)檢測共培養24 h后PBS組、Exo組hREC中mTOR、HIF-1α蛋白相對表達量以及PBS組、PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A蛋白相對表達量
收集各組細胞,PBS洗滌,加入RIPA冰上裂解15 min。4 ℃,以離心半徑10 cm、12 000 r/min離心10 min,收集上清,二喹啉甲酸蛋白定量。沸水浴蛋白變性,聚丙烯酰胺凝膠電泳中上樣電泳,轉至聚偏二氟乙烯膜,5%脫脂奶粉室溫封閉1 h,加入HIF-1α(1:1 000);mTOR(1:1 000)、β-actin(1:800)、VEGF-A(1:800)一抗,4 ℃過夜孵育,洗膜緩沖液(TBST)洗膜,加入HRP標記的山羊抗兔IgG(1:2 000),室溫孵育2 h,TBST洗膜,置于Western LightningTM Chemiluminescence Reagent顯色劑后曝光并拍照,凝膠成像系統掃描分析蛋白條帶。目的蛋白相對表達水平=目的蛋白條帶灰度值/內參照β-actin蛋白條帶灰度值。
1.5 qPCR檢測Exo組共培養0、8、16、24 h后hREC中miR-126 mRNA相對表達量以及PBS組、Exo組、PBS+anti-miR126組、Exo+anti-miR126組、PBS+anti-mTOR組、PBS+anti-HIF-1α組共培養24 h后hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量
收集各組細胞,Trizol法提取總RNA,檢測RNA濃度和純度,逆轉錄合成cDNA。反應體系包括cDNA 2 μl,正向引物及反向引物各2 μl,2倍SYBR? Green PCR Master Mix 10 μl,雙蒸水20 μl。應用Express 3.0軟件設計引物序列(表1)。反應條件:94 ℃ 5 min,94 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,共40個循環。以β-actin為內參基因,采用2-△△CT法計算目的基因mRNA相對表達水平。
1.6 統計學方法
采用SPSS22.0軟件行統計學分析。計量數據以均數±標準差(x±s)表示。兩組間比較采用t檢驗;多組間比較采用單因素方差分析。檢驗水準α=0.05。P<0.05為差異有統計學意義。
2 結果
2.1 hREC中miR-126水平隨hUCMSC Exo干預時間延長而逐步增高
qPCR檢測結果顯示,共培養0、8、16、24 h,Exo組hREC中miR-126 mRNA相對表達量逐漸增高,差異有統計學意義(F=95.900,P<0.05)(圖1)。不同時間點miR-126 mRNA相對表達量比較,差異均有統計學意義(P<0.05)。
 圖1
Exo組共培養后不同時間hREC中miR-126 mRNA相對表達量比較(n=3) Exo:外泌體;hREC:人視網膜血管內皮細胞;*P<0.05,**P<0.01,***P<0.001
圖1
Exo組共培養后不同時間hREC中miR-126 mRNA相對表達量比較(n=3) Exo:外泌體;hREC:人視網膜血管內皮細胞;*P<0.05,**P<0.01,***P<0.001
2.2 hUCMSC Exo下調高糖低氧誘導的hREC表達的mTOR、HIF-1α蛋白表達水平
Western blot檢測結果顯示,PBS組、Exo組hREC中mTOR、HIF-1α蛋白相對表達量分別為1.271±0.170、1.000±0.170和1.000±0.127、0.057±0.220。與PBS組比較,Exo組hREC中mTOR、HIF-1α蛋白相對表達量均下調,差異有統計學意義(t=3.466、6.804,P<0.05、0.01)(圖2)。
 圖2
PBS組、Exo組hREC中mTOR、HIF-1α 蛋白表達水平(n=3) 2A示電泳圖;2B示PBS組、Exo組hREC中mTOR、HIF-1α 蛋白相對表達量比較,*P<0.05,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;actin:肌動蛋白
圖2
PBS組、Exo組hREC中mTOR、HIF-1α 蛋白表達水平(n=3) 2A示電泳圖;2B示PBS組、Exo組hREC中mTOR、HIF-1α 蛋白相對表達量比較,*P<0.05,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;actin:肌動蛋白
免疫熒光檢測結果顯示,與PBS組比較,Exo組hREC中mTOR、HIF-1α蛋白表達下調,差異有統計學意義(t=3.649、5.172,P<0.05、0.01)(圖3)。
 圖3
Exo對hREC中mTOR、HIF-1α的影響(n=3) 3A、3B分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),mTOR呈綠色熒光;3C示兩組mTOR表達比較,*P<0.05;3D、3E分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),HIF-1α呈綠色熒光;3F示兩組HIF-1α表達比較,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α
圖3
Exo對hREC中mTOR、HIF-1α的影響(n=3) 3A、3B分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),mTOR呈綠色熒光;3C示兩組mTOR表達比較,*P<0.05;3D、3E分別示PBS組、Exo組熒光顯微鏡像(標尺:50 μm),HIF-1α呈綠色熒光;3F示兩組HIF-1α表達比較,**P<0.01 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α
2.3 hUCMSC Exo下調高糖低氧誘導的hREC表達的mTOR、HIF-1α mRNA表達水平
與PBS組比較,Exo組細胞中mTOR、HIF-1α mRNA相對表達量下降,差異有統計學意義(t=8.642、7.897,P<0.001、0.01)(圖4)。
 圖4
PBS組、Exo組hREC中mTOR、HIF-1α mRNA相對表達量比較(n=3) PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;**P<0.01,***P<0.001
圖4
PBS組、Exo組hREC中mTOR、HIF-1α mRNA相對表達量比較(n=3) PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;**P<0.01,***P<0.001
2.4 mTOR、HIF-1α抑制劑下調VEGF-A表達
與PBS組比較,PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A蛋白(t=3.337、7.380,P<0.05、0.01)、mRNA(t=8.515、10.400,P<0.01、0.001)相對表達量下降,差異均有統計學意義(圖5)。
 圖5
PBS組、PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A表達水平(n=3) 5A示電泳圖;5B、5C分別示3組VEGF-A蛋白、mRNA相對表達量比較,*P<0.05,**P<0.01,***P<0.00 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;tublin:微管蛋白
圖5
PBS組、PBS+anti-mTOR組、PBS+anti-HIF-1α組hREC中VEGF-A表達水平(n=3) 5A示電泳圖;5B、5C分別示3組VEGF-A蛋白、mRNA相對表達量比較,*P<0.05,**P<0.01,***P<0.00 PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;tublin:微管蛋白
2.5 miR-126下調Exo干預的高糖低氧誘導的hREC中mTOR、HIF-α、VEGF-A mRNA表達
與PBS組比較,Exo組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量明顯降低,差異均有統計學意義(t=6.099、2.886、3.159,P<0.01、0.05、0.05)。PBS+anti-miR126組hREC中VEGF-A、mTOR mRNA相對表達量有所升高,但差異無統計學意義(t=1.253、1.428,P>0.05);HIF-1α mRNA相對表達量明顯升高,差異有統計學意義(t=2.837,P<0.05)。Exo+anti-miR126組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量明顯升高,差異均有統計學意義(t=4.664、6.136、6.247,P<0.01、0.01、0.01)(圖6)。
 圖6
PBS組、Exo組、PBS+anti-miR126組、Exo+anti-miR126組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量比較(n=3)PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;*P<0.05,**P<0.01
圖6
PBS組、Exo組、PBS+anti-miR126組、Exo+anti-miR126組hREC中VEGF-A、mTOR、HIF-1α mRNA相對表達量比較(n=3)PBS:磷酸鹽緩沖液;Exo:外泌體;mTOR:哺乳動物雷帕霉素靶蛋白;HIF-1α:缺氧誘導因子1α;VEGF-A:血管內皮生長因子A;*P<0.05,**P<0.01
3 討論
本研究結果顯示,高糖低氧誘導的hREC經hUCMSC Exo干預后,其細胞中miR-126水平在24 h內隨干預時間逐漸上調,24 h后細胞中mTOR、HIF-1α蛋白、mRNA水平均下調;給予mTOR、HIF-1α抑制劑預處理后VEGF-A水平增幅有所下降,再應用hUCMSC Exo進行干預,其VEGF-A水平明顯上調。這提示miR126和mTOR/HIF-1α通路在hUCMSC Exo抑制高糖誘導hREC中VEGF-A升高發揮了重要作用。
病理情況下,如缺氧導致VEGF大量表達上調致血管生成,以提供足夠的氧氣供組織使用,并吸引白細胞進入血管壁,從而引發炎癥[7]。VEGF受體(VEGFR)-2主要在血管內皮細胞上表達,激活內皮細胞增殖和遷移,促進血管生成并增加血管通透性,這是血管生成的基本變化[8]。 文獻報道,增生型DR纖維血管增生的患者玻璃體中VEGF水平升高,提示其參與眼新生血管疾病[9-10]。當細胞缺氧時,穩定的HIF-1α易位至細胞核并與HIF-1β結合產生HIF-1轉錄因子,活化的HIF-1可以誘發大量VEGF的產生[11-13]。有研究表明,抑制HIF-1α或HIF-2α可減輕氧誘導視網膜病變小鼠模型中新生血管的產生,而缺氧能夠導致mTOR誘導血管生成和細胞增殖并增強 HIF-1α的活性[14]。Zhao等[15]發現,miR-126成為缺氧和再灌注的新調節因子,缺氧條件下,VEGF-A在內皮細胞中受到miR-126的調節。對于新生血管性視網膜疾病,血管生成的調節因子除VEGF-A等調節蛋白外,上游因子miRNA的調控被認為是最重要的調節因素[16-17]。研究表明,視網膜色素上皮細胞中miR-126的上調抵消了高血糖誘導的VEGF-A分泌增加[3]。miR-126在VEGF-A的3'-非翻譯區存在1個結合位點,能夠調節血管完整性和血管生成過程[18]。miR-126能夠通過抑制HIF-1α激活以抑制CXC趨化因子配體12/ CXC趨化因子受體4通路在血管損傷和缺氧中的作用[19]。此外,磷脂酰肌醇3激酶(PI3K)是被miR-126靶向的絲氨酸-蘇氨酸蛋白激酶(Akt)通路激活劑,缺氧使miR-126失調而增加PI3K激活,致使Akt激活和VEGF表達上調[20]。將miR-126轉染至癌細胞中能夠下調VEGF-A的表達[21]。miR-126通過調節內皮細胞對VEGF的反應發揮作用,從而調節血管完整性和血管生成[22]。我們前期研究已證實hUCMSC Exo能夠下調高糖誘導的hREC中VEGF-A水平[1]。本研究結果顯示,miR-126在hUCMSC Exo干預的高糖低氧誘導的hREC中顯著升高,且具有時間依賴效應。這提示hUCMSC Exo能夠上調hREC中miR-126的水平,進而發揮下調VEGF-A的作用。
本研究結果還提示,miR-126能夠通過mTOR間接調節HIF-1α水平。mTOR在調節HIF-1α介導的VEGF中的作用已被證實,且能夠在翻譯水平上調節HIF-1α的合成[23-25]。Wei等[26]發現,阻斷mTOR靶點能夠抑制DR中HIF-1α通路調節的VEGF,這與本研究部分結果一致。本研究結果顯示,hUCMSC Exo在干預高糖低氧誘導的hREC 24 h后,其細胞表達的miR-126上調,mTOR、HIF-1α水平下調,VEGF-A水平明顯下調,抑制高糖誘導的hREC中mTOR、HIF-1α能夠減輕VEGF-A的上調;應用miR-126抑制劑處理高糖誘導的hREC后,其VEGF-A、mTOR、HIF-1α mRNA相對表達量明顯升高,提示miR-126能夠下調mTOR表達,抑制mTOR,從而下調HIF-α和VEGF-A表達,即hUCMSC Exo通過上調高糖低氧誘導hREC中miR-126抑制mTOR/HIF-1α通路,從而抑制新生血管生成。
本研究旨在以miR-126為切入點解讀mTOR/HIF-1α通路參與hUCMSC Exo對高糖誘導的hREC中VEGF-A水平的影響,為新生血管性疾病的治療提供新的思路。目前本研究僅為初步驗證,一些深入問題還需進一步探索,如miR-126與HIF-1α之間的交互作用,且當前模型無法模擬體內環境,仍需體內實驗動物模型相關數據支持,如氧誘導視網膜新生血管模型、糖尿病模型等。今后工作中,進一步挖掘hUCMSC Exo調節miR-126通過mTOR/HIF-1α參與新生血管調控的生物學信息,為hUCMSC Exo參與治療視網膜新生血管性疾病提供理論支持。