膿毒癥患者中性粒細胞(PMN)的趨化遷移能力減弱,導致細菌清除率下降,加速了膿毒癥病程的發展。對膿毒癥患者PMN的趨化性進行量化,有助于表征膿毒癥患者的免疫健康狀況。微流控芯片具有試劑消耗低、近生理環境、遷移過程可視化等優點,被廣泛用于細胞趨化性分析。目前,采用微流控芯片進行PMN趨化性的研究,主要受限于細胞分離操作繁瑣和微流控芯片通量低。本文首先設計了一款慣性細胞分選芯片,利用白細胞(主要包括粒細胞、淋巴細胞和單核細胞)和紅細胞在螺旋微通道中運動時,會受到不同大小慣性力和迪恩阻力的作用,而移動至螺旋微通道的不同位置聚焦這一基本原理,實現兩大類細胞無標記分離。隨后,本文設計了多通道細胞遷移芯片,構建了微流控PMN慣性無標記分選及趨化性分析平臺,慣性細胞分選芯片分離出白細胞群后注入多通道細胞遷移芯片,可在15 min內完成PMN對趨化肽(fMLP)的趨化性測試。其余細胞,如單核細胞運動緩慢、淋巴細胞需要預先激活與增殖培養,而不會發生明顯趨化遷移現象。本研究招募的膿毒癥患者(n = 6)和健康志愿者(n = 3)測試結果表明,膿毒癥患者PMN的趨化性指數(CI)和遷移速度(v)明顯弱于健康志愿者。綜上,本文構建的微流控PMN慣性無標記分選及趨化性分析平臺可以作為細胞無標記分選及遷移研究的新工具。
引用本文: 高朝茹, 楊逍, 劉利娟, 王月, 朱靈, 周金華, 劉勇, 楊柯. 微流控膿毒癥患者中性粒細胞慣性無標記分選及趨化性研究. 生物醫學工程學雜志, 2023, 40(6): 1217-1226. doi: 10.7507/1001-5515.202304002 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引 言
膿毒癥患者進入重癥監護室的最初6 h內,若診斷和治療被延誤,病死率明顯增加。如果早期能對病情準確識別并合理地實施治療策略,可明顯改善膿毒癥預后。中性粒細胞(polymorphonuclear neutrophil,PMN)在抵抗疾病和保護宿主方面發揮著至關重要的作用[1]。研究發現,嚴重膿毒癥患者的PMN向感染部位移行的能力受到了抑制,從而不能及時地控制感染[2-3]。即時監測膿毒癥期間PMN趨化遷移功能變化,對于開展膿毒癥的預警與輔助診斷,評估患者免疫健康狀態和預后具有重要的科學意義。
微流控芯片最早起源于20世紀90年代,經過短短幾十年的發展,已經取得了令人矚目的成績,其中細胞趨化性分析是最重要的研究領域之一。這主要是因為微流控芯片具有分析快速、成本低、重現性好、集成化并可以在接近生理環境下運行等特點[4-8]。Ellett等[9]設計了迷宮式微流控芯片,全血直接注入微流控芯片后,觀察到膿毒癥患者PMN在狹窄微通道中的特異性自發遷移行為。Ren等[10]研制了一種填充了三維凝膠基質的三維微流控芯片,研究了T細胞在生理性皮膚炎癥物質和抗炎治療藥物作用下的跨內皮遷移反應。本項目組將微流控芯片與智能手機集成,研究了慢性阻塞性疾病患者PMN的遷移行為[11]。最近,還有一些研究人員報道了多通道細胞遷移芯片,以提高實驗分析效率。例如,Berthier等[12]開發了由50個獨立梯度單元組成的微流控芯片,研究了嚴重復發性細菌感染患者PMN的趨化性。Wu等[13]開發了一種具有八個獨立單元的微流控芯片,用于PMN和癌細胞的遷移行為研究。多通道細胞遷移芯片需要實時顯微鏡來記錄和跟蹤細胞遷移路徑[14]。由于顯微鏡的視野有限,多通道細胞遷移芯片僅能顯示一個獨立遷移通道[15-16]。擴大顯微鏡數量或旋轉/移動物鏡可以提高檢測通量,但將增加成本和運行多個設備的時間。此外,多通道細胞遷移芯片通常不具備分離細胞的能力或未配備分離細胞的輔件,從而限制了臨床診斷應用。采用多通道細胞遷移芯片測試趨化性時,需要采用密度梯度離心法分離PMN,費力且耗時,并可能導致細胞活化和損傷[1]。商用試劑盒促進了基于微流控芯片的細胞遷移研究,但仍需要離心,且成本高。在微流控芯片上利用微通道結構、細胞大小差異、抗原抗體反應,直接快速地分離血液里的PMN,特別適用于病體模型下PMN的功能表型即時分析[17-21]。然而,這些芯片的制造和預處理過程十分復雜。近年來,慣性微流控芯片已被開發用于從少量外周血中分離細胞[22-24]。例如,Hou等[25]開發了一種慣性微流控PMN分選和功能表型分析方法,用于糖尿病患者PMN的快速無標記純化和滾動行為分析。Jundi等[22]采用慣性微流控技術,從50 μL外周血中分離出PMN并用于下游吞噬功能、活性氧生成功能等的評估。Jiang等[26]開發了集成化微流控手持式無標記腫瘤細胞分選儀,用于從臨床胸腔積液中高通量分離惡性腫瘤細胞。綜上,微流控膿毒癥患者PMN慣性無標記分選及趨化性分析的研究尚處于起步階段。
本文首先設計了慣性細胞分選芯片(簡稱:慣性芯片),依托慣性力和迪恩阻力,分離白細胞群(直徑約7~20 μm)和紅細胞群(直徑約5~7 μm)。其中,本文主要關注的PMN(直徑約為10~15 μm)[27-28]。隨后,設計了多通道細胞遷移芯片(簡稱:多通道芯片),構建了微流控PMN慣性無標記分選及趨化性分析平臺。一般而言,白細胞群中的單核細胞遷移所需時間大概要1~5 h[29],而淋巴細胞一般需要經過增殖培養才能進行趨化遷移檢測[30]。而本文設計的慣性芯片和多通道芯片,預期能在30 min內完成細胞分選和PMN的趨化性分析,而無需任何其他操作。本文進一步招募健康志愿者和膿毒癥患者參與設計芯片的有效性測試,記錄并分析了健康志愿者和膿毒癥患者之間PMN趨化性的差異,以期驗證微流控PMN慣性無標記分選及趨化性分析平臺的可行性。本文創新性地將慣性芯片和多通道芯片相整合,旨在為基于微流控技術的細胞趨化性研究提供芯片設計思想和方法參考。
1 實驗部分
1.1 儀器和試劑
本研究所用儀器列舉如下:
倒置熒光顯微鏡(DMI8,Leica Inc.,德國);CO2恒溫細胞培養箱(D180,瑞沃德,中國);高速相機(AEM136M-16G,千眼狼,中國);恒壓泵(OB1 MK3,Elveflow,法國);流式細胞儀(Guava easyCyte,Merck,德國)。
本研究所用試劑列舉如下:
人纖維連接蛋白(fibronectin)(貨號:F2006,SIGMA-Aldrich,美國);趨化肽N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucyl-phenyl-alanine,fMLP)(貨號:F3506,SIGMA-Aldrich,美國);磷酸緩沖鹽溶液(phosphate buffered saline,PBS)(貨號:02-024-1ACS,Biological Industries,以色列);羅斯威爾·帕克紀念研究所-1640(Roswell Park memorial institute 1640,RPMI-1640)培養基(貨號:SH30809.01,Cytiva,美國);牛血清白蛋白(bovine albumin,BSA)(貨號:A1933,SIGMA-Aldrich,美國);CD66b-FITC抗體(貨號:305104,BioLegend,美國); 紅細胞裂解液(貨號:07800,STEMCELL,加拿大);5 μm聚苯乙烯微球(貨號:UniFlu PS-0205G,瑞格科技,中國);10 μm聚苯乙烯微球(貨號:UniFlu PS-0210O,瑞格科技,中國)。
1.2 慣性芯片工作原理
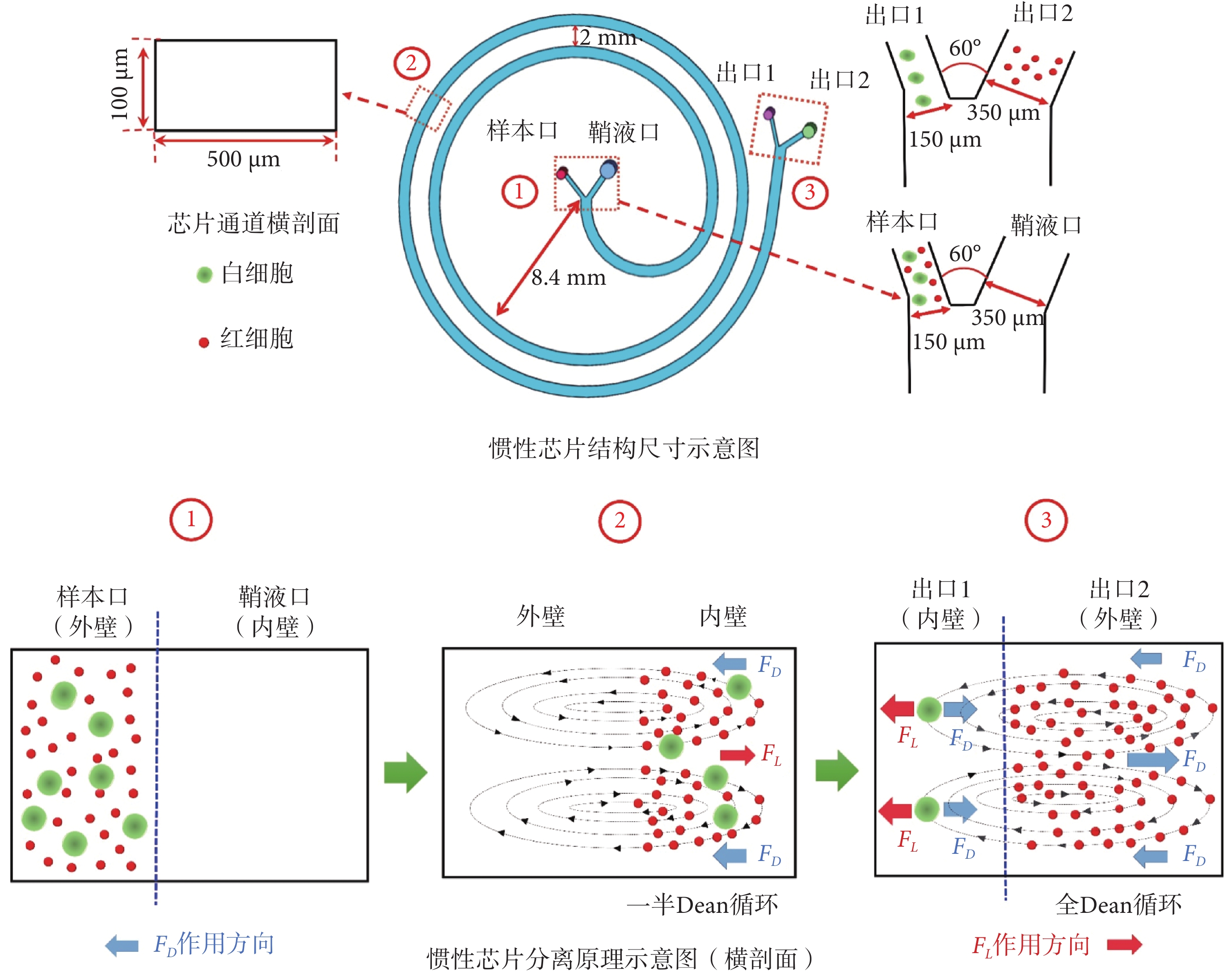
微流體通常與主要的粘性阻力相關,即雷諾數(Reynolds number,Re)(以符號Re表示)較低,這些阻力導致層流剖面沿流線夾帶懸浮顆粒和細胞在微通道中的不同位置聚焦[31-33]。慣性芯片分離原理如圖1所示,由于徑向離心加速度,在曲線通道內會形成上下兩個對稱的反向迪恩渦流(Dean vortices,Dean)(以符號Dean表示)[34],如式(1)所示:
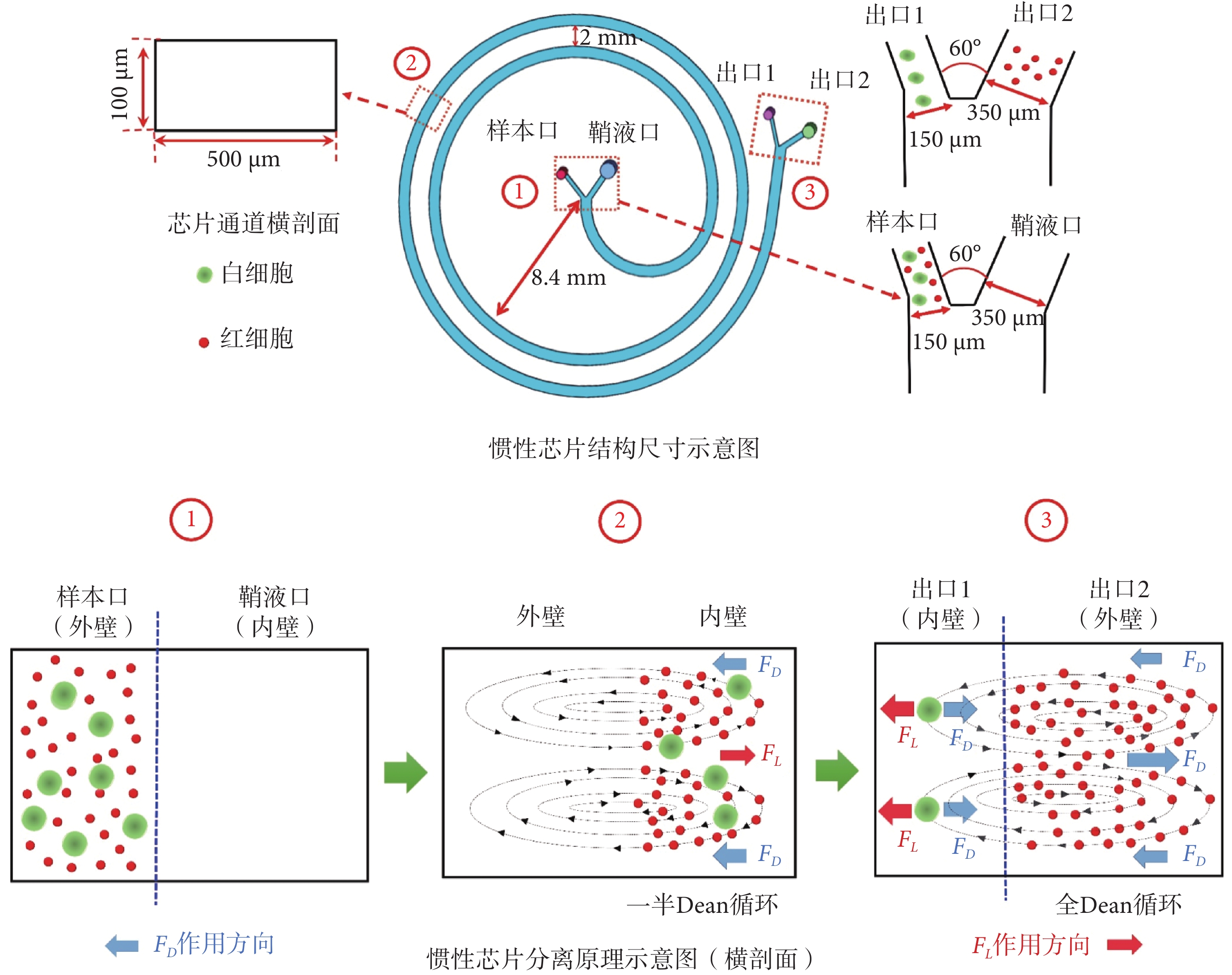 圖1
慣性芯片結構及分離原理示意圖
Figure1.
Schematic diagram of inertial chip structure and separation principle
圖1
慣性芯片結構及分離原理示意圖
Figure1.
Schematic diagram of inertial chip structure and separation principle
 |
其中,ρ是流體密度,U是通道中的平均速度,Dh水力直徑,μ是流體的動態粘度,R是通道的曲率半徑。Dean對懸浮在溶液中的粒子會產生迪恩阻力(FD),FD沿Dean流動的方向拖拽顆粒在通道內壁和外壁來回移動。外壁顆粒遷移到內壁完成一半Dean循環,繼續運動返回外壁完成全Dean循環[35-36],如式(2)所示:
 |
其中,Dean流速(以符號UDean表示)(UDean = 1.8 × 10?4 Dean1.63),ap粒子直徑,π表示圓周率。除FD外,顆粒和細胞在內壁附近還會受到慣性升力(FL)的影響,如式(3)所示:
 |
其中,fL是無量綱升力系數,它是雷諾數和歸一化橫截面位置(x/h)的函數[37], 是最大流速。較大顆粒(ap/通道高度h≥0.07)受FL作用強于FD會持續聚焦在內壁,不完成全Dean循環,較小顆粒則在FD牽引下完成全Dean循環。
是最大流速。較大顆粒(ap/通道高度h≥0.07)受FL作用強于FD會持續聚焦在內壁,不完成全Dean循環,較小顆粒則在FD牽引下完成全Dean循環。
1.3 慣性芯片設計與仿真
慣性芯片結構尺寸如圖1所示,芯片通道的橫剖面寬為500 μm,高為100 μm,總長10 cm,曲率半徑8.4 mm,設置螺旋圈數為2圈,螺距為2 mm。樣本口和鞘液口、出口1和出口2之間角度設置為60 o,通過實驗測試,確定樣本口和出口1通道寬度150 μm,鞘液口和出口2通道寬度350 μm。圖1中,①、②、③分別為相應紅色虛線框的放大示意圖,用以詳細描述芯片尺寸及功能。
使用有限元分析軟件COMSOL Multiphysics 5.5(COMSOL Inc.,瑞典)模擬分析了不同流量條件下,慣性芯片對于5 μm和10 μm模擬微球的分選性能。應用粒子跟蹤函數來追尋螺旋微通道中的微球軌跡分布情況。設置仿真參數:流體材料為水,流體溫度設置為20.35 ℃,流體密度ρ來自材料,動力黏度μ來自材料。樣本入口和鞘液入口設置不同流速,出口壓力為0 Pa。
1.4 多通道芯片設計與前處理
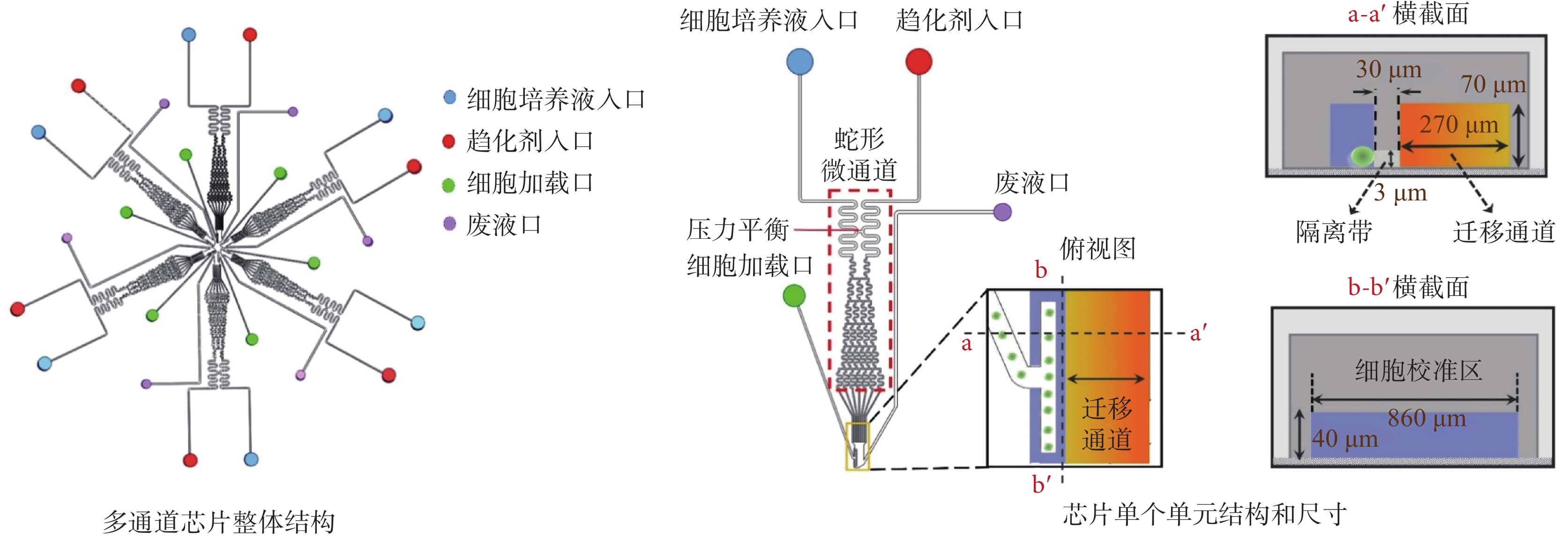
多通道芯片設計和制備,參考本課題組之前的工作——文獻[38]。如圖2所示,每個單元結構設計有細胞培養液入口、趨化劑入口、細胞加載口、廢液口、蛇形微通道、遷移通道、隔離帶,以及細胞校準區。其中蛇形微通道高70 μm、寬80 μm;遷移通道高70 μm、寬270 μm;隔離帶高3 μm、寬30 μm;細胞校準區長860 μm、寬40 μm。細胞從細胞加載口注入后,將整齊排列在細胞校準區的隔離帶邊緣。趨化劑入口和細胞培養液入口連接有蛇形微通道,并設置有壓力平衡連接通道,用于平衡趨化劑入口和細胞培養液入口的壓力差。蛇形微通道末端在遷移通道中匯聚,并通過層流和擴散機制在遷移通道中形成穩定的化學濃度梯度場。圖2中分別展示了遷移通道的俯視圖和不同角度的橫截面圖。多通道芯片使用前需要分別使用2.5 μg/mL的fibronectin溶液和細胞培養基(濃度為0.4%的BSA,經RPMI-1640稀釋)包被微通道,時長為1 h。
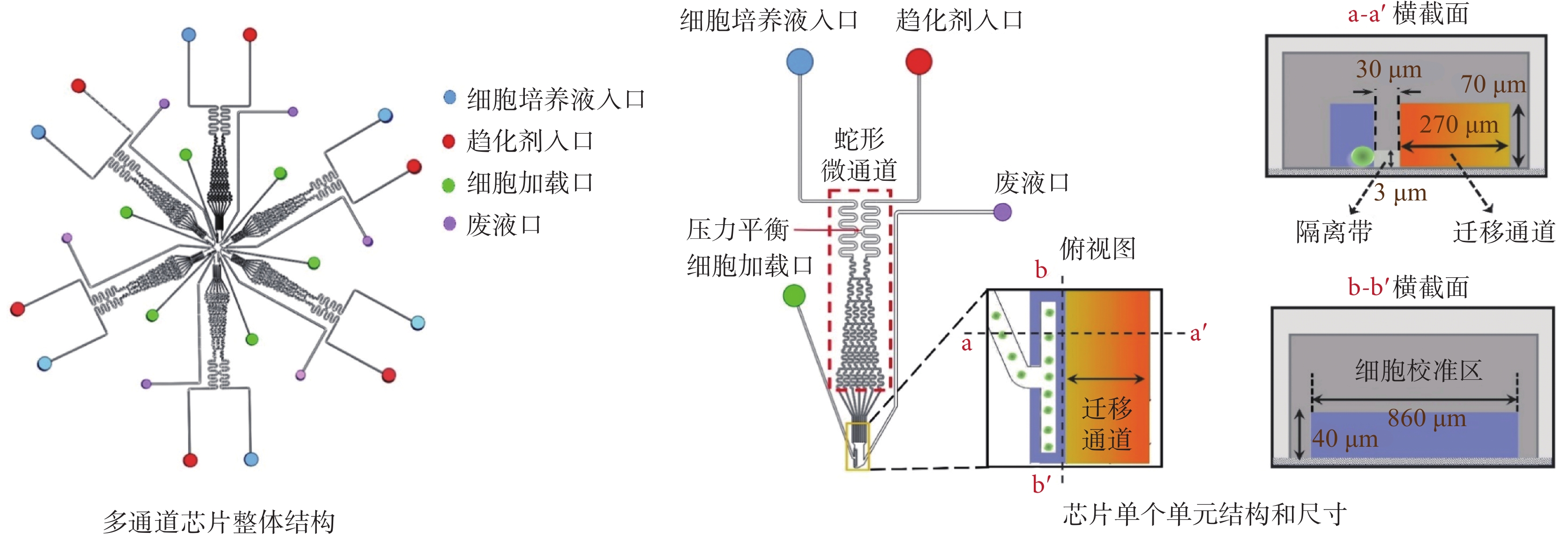 圖2
多通道芯片結構示意圖
Figure2.
Schematic diagram of multi-channel chip structure
圖2
多通道芯片結構示意圖
Figure2.
Schematic diagram of multi-channel chip structure
1.5 微流控PMN慣性無標記分選及趨化性分析平臺構建與實驗測試
1.5.1 平臺構建
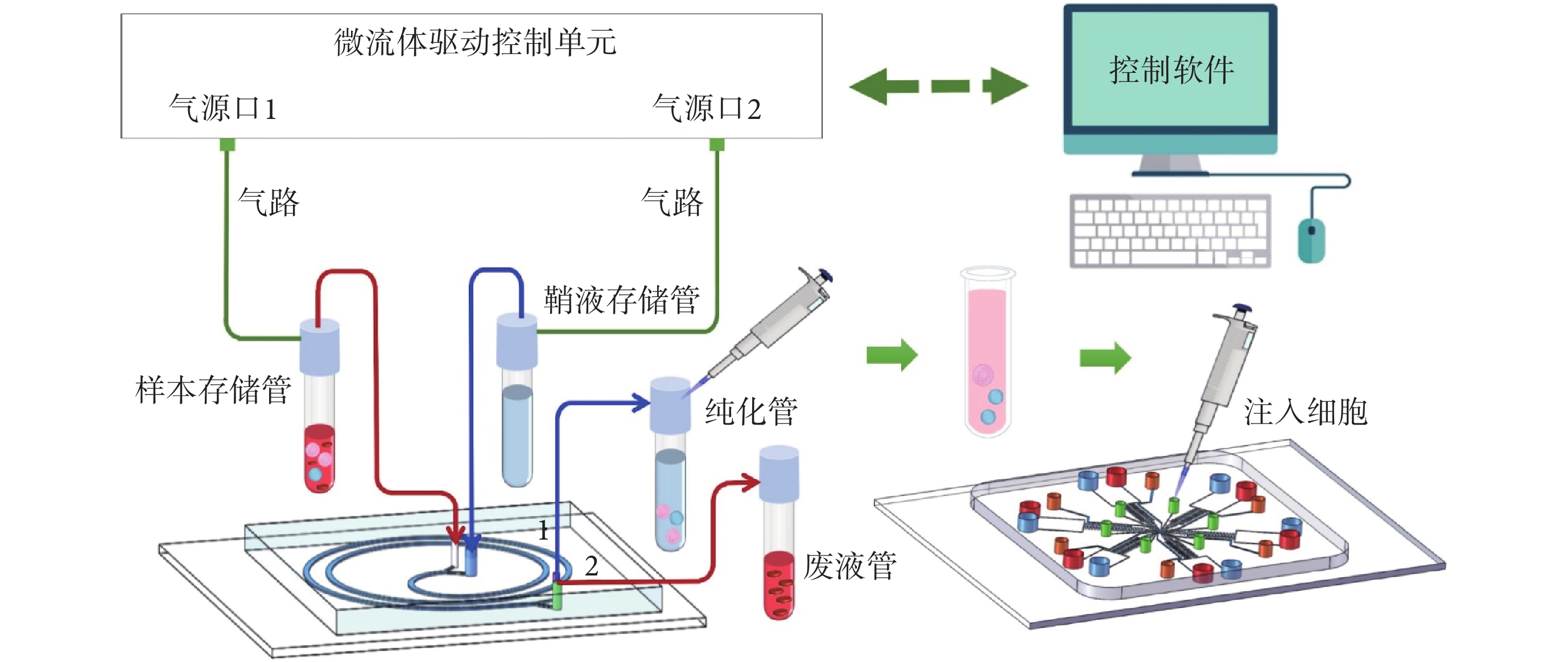
如圖3所示,細胞分選及趨化性分析平臺主要由以下部分組成:慣性芯片、多通道芯片、微流體驅動控制單元(包括氣源口1、氣源口2,用于調節流速)、樣本存儲管(15 mL,用于裝載樣本液形成樣本流)、鞘液存儲管(15 mL,用于裝載純水形成鞘流)、純化管(15 mL,用于收集目標液體)、廢液管(15 mL,用于收集廢液)、氣路、連接管路(紅、藍線)和控制軟件。
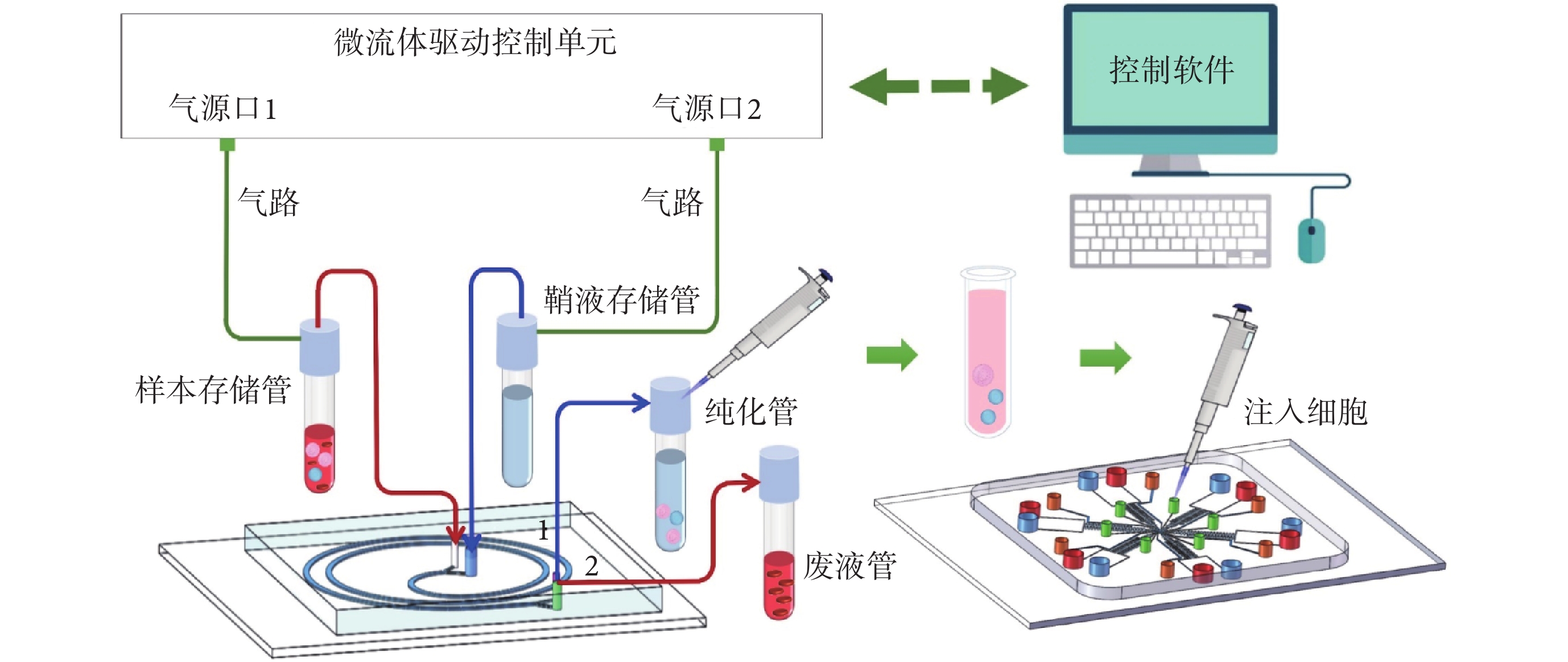 圖3
微流控PMN慣性無標記分選及趨化性分析平臺示意圖
Figure3.
Schematic diagram of the microfluidic PMN inertial label-free sorting and chemotaxis analysis platform
圖3
微流控PMN慣性無標記分選及趨化性分析平臺示意圖
Figure3.
Schematic diagram of the microfluidic PMN inertial label-free sorting and chemotaxis analysis platform
1.5.2 熒光微球分選實驗
本文以紅色5 μm和綠色10 μm的熒光微球群分別模擬紅細胞群和PMN群,分別取30 μL和20 μL加入到裝有12 mL去離子水的樣本存儲管中稀釋為3×106個/mL和1.5 × 105個/mL。然后,如圖3所示,將氣源口1、樣本存儲管和樣本口相互連接,向慣性芯片中泵入樣本液,氣源口2、鞘液存儲管和鞘液口相互連接向慣性芯片中泵入鞘液。調節流速,利用高速相機觀察兩種熒光微球在出口1和出口2的聚焦情況。純化管收集慣性芯片出口1中的微球溶液。廢液管收集慣性芯片出口2中的微球溶液。最后,以流式細胞儀檢測樣本存儲管、純化管和廢液管中兩種微球的比例。
1.5.3 PMN分選與趨化性實驗
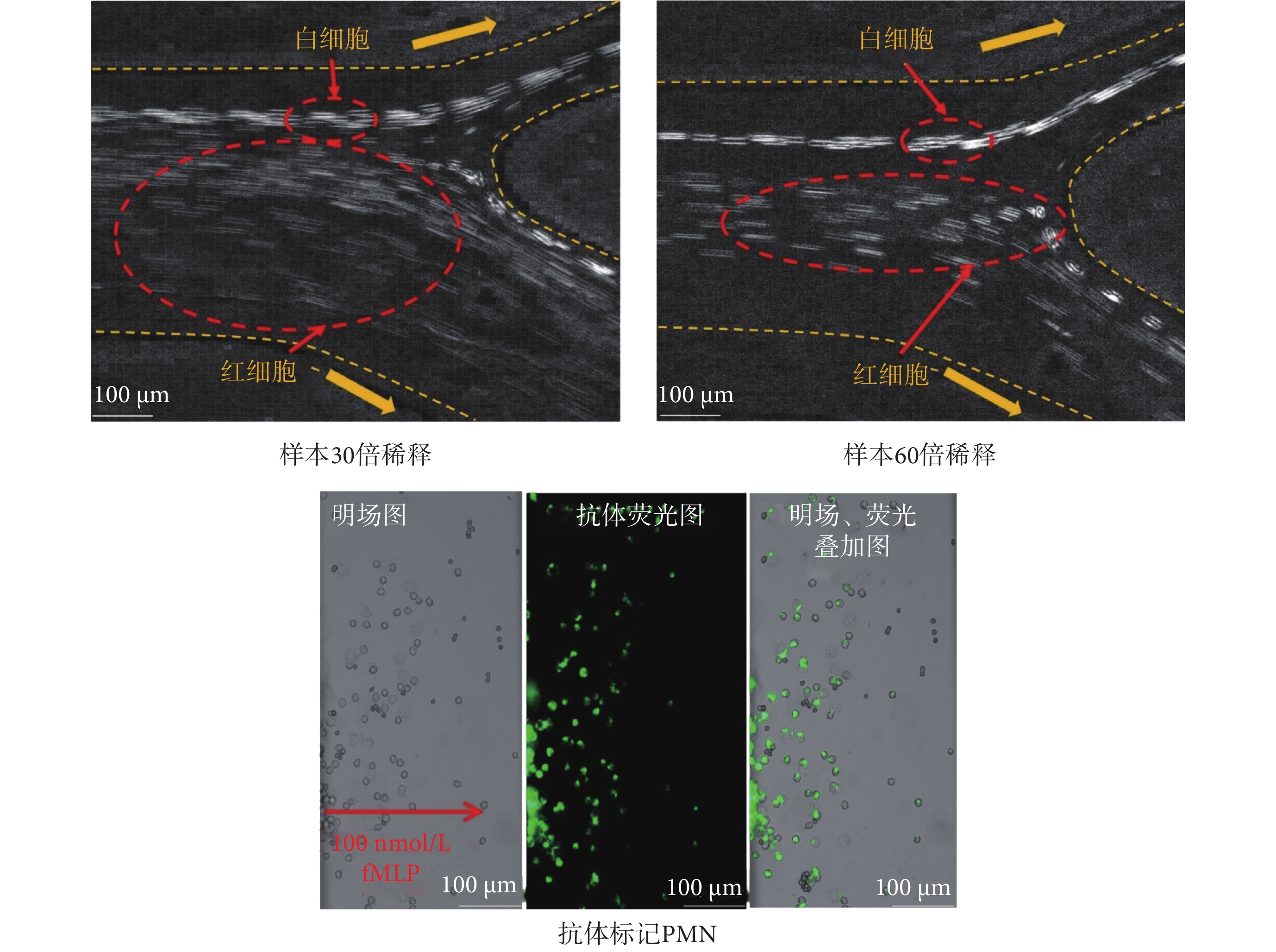
將50 μL CD66b-FITC抗體加入到1 mL人體血液樣本中,室溫孵育30 min;然后將9 mL紅細胞裂解液與上述1 mL人體血液樣本混合,冰上裂解10 min。取裂解后溶液400 μL裝入樣本存儲管,加入含有濃度為5%的BSA的PBS溶液,定容至12 mL,制備成30倍稀釋的樣本液。取裂解后溶液200 μL裝入樣本存儲管,加入含有5%BSA的PBS溶液,定容至12 mL,制備成60倍稀釋的樣本液。按照1.5.1和1.5.2小節的描述,連接各個試劑管和管路,調節流速,高速相機采集慣性芯片出口1和出口2的細胞分離圖像。隨后,為了確定PMN的分離率,用流式細胞儀分別從樣本存儲管和純化管中采集1 × 104個PMN,根據采取1 × 104個PMN所需的樣本體積來推測樣本存儲管和純化管中含有的PMN總個數,進而計算PMN的分離率。分離率為純化管中PMN數除以樣本存儲管中PMN數。為了確定PMN的遷移能力,首先將純化管中的細胞溶液離心后去上清液,再用1 mL細胞培養基重懸。接著取20 μL重懸液注入多通道芯片的細胞加載口。然后,分別向趨化劑入口和細胞培養液入口注入50 μL濃度為100 nmol/L的fMLP和細胞培養基。PMN遷移運動15 min后,熒光顯微鏡采集遷移通道中的細胞分布圖像。由于單核細胞遷移運動需1~5 h[29],淋巴細胞需增殖培養才有活性[30],因而理論上僅觀察到PMN的趨化運動。
1.5.4 膿毒癥患者PMN分選與趨化性實驗
本研究經中國科學院合肥物質科學研究院倫理委員會批準(編號:YXLL-2023-06),所有參與者均簽署書面知情同意書。依據膿毒癥新指南(Sepsis 3.0)標準,選擇“血細胞培養呈陽性+序貫器官衰竭評分≥2分”的6名入住重癥監護室患者,患者平均年齡62歲;另招募3名體檢結果正常的志愿者作為對照組;排除孕婦、輸血患者和白細胞減少且低于2 × 109 個/mL的患者。本研究首先將9 mL紅細胞裂解液與1 mL靜脈血混合,裂解10 min。取裂解溶液200 μL裝入樣本存儲管,加入含有濃度為5%的BSA的PBS溶液,定容至12 mL,制備成60倍稀釋的樣本液。按1.5.3小節所述,進行細胞分選和趨化性實驗。本文共設計了3個實驗序列:健康志愿者1與膿毒癥患者1和2;健康志愿者2與膿毒癥患者3和4;健康志愿者3與膿毒癥患者5和6。以6幀/min速率采集90張PMN遷移圖像。使用公共圖像處理軟件Image J(National Institute of Mental Health,美國)獲取單個PMN的遷移運動軌跡。每個單元的遷移通道中需要追蹤30個細胞。通過計算趨化性指數(chemotaxis index,CI)和遷移速度(以符號v表示)來評估PMN的遷移運動能力。CI,是指細胞朝向濃度梯度運動的位移除以遷移的總路程,體現細胞能否準確快速到達病灶處的能力;遷移速度,為總遷移距離與實驗時間的比值。此外,還將15 min細胞遷移時間分割成10份,計算了膿毒癥患者和健康志愿者群的PMN隨時間變換的速度vi(i = 1, 2, …, 10),以觀測細胞遷移運動過程中的細胞遷移運動變化情況[38]。實驗均重復3次,結果表示為平均值±標準偏差。
2 結果與討論
2.1 慣性芯片分選仿真結果
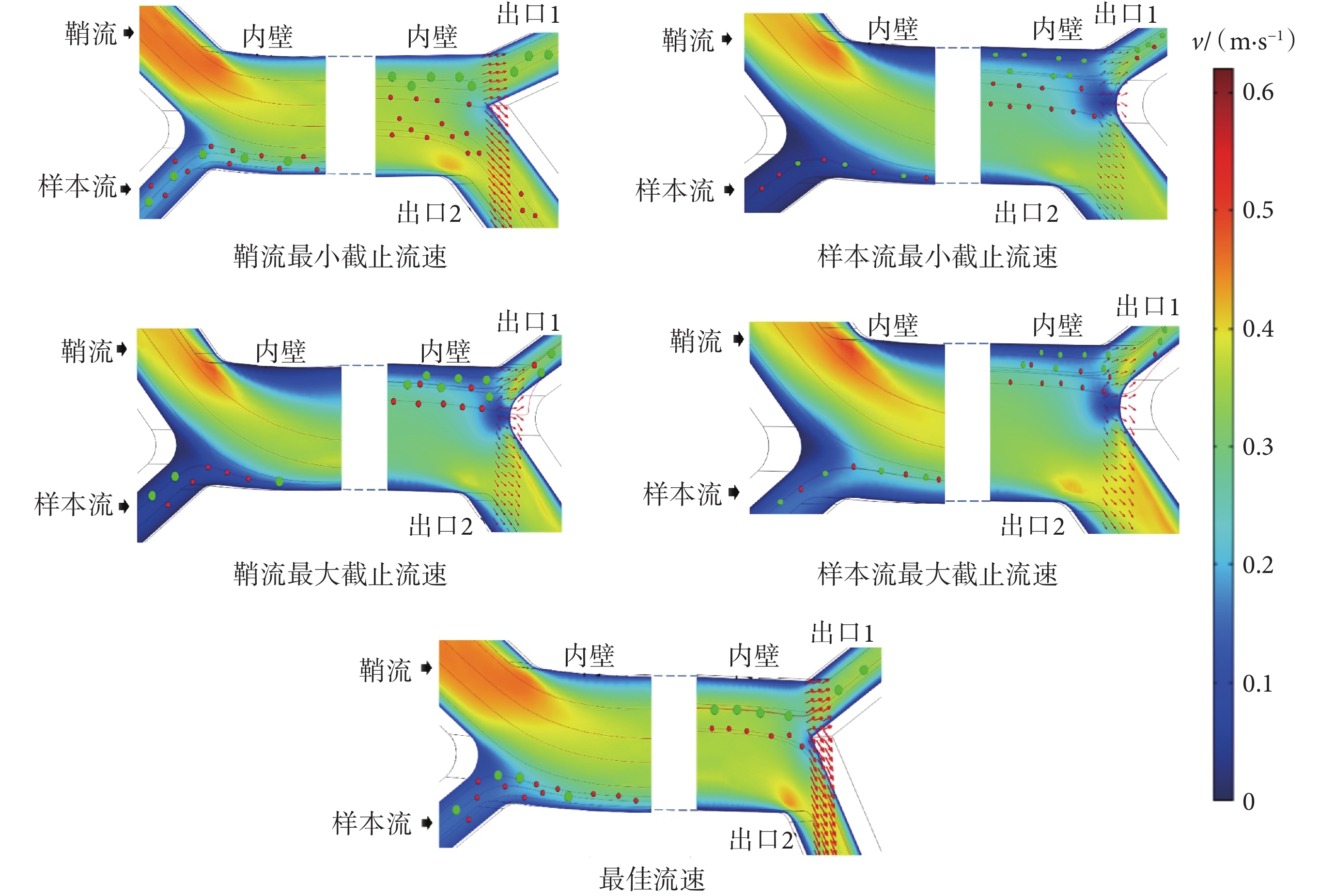
本文設計的慣性芯片依靠FL和FD共同作用,使微球或細胞聚焦在芯片不同位置,需滿足微球或細胞分離的流速條件,為此利用三維仿真軟件對參數范圍進行初步摸索。如圖4所示,展現了10 μm和5 μm模擬微球成功分離的最佳流速,以及分離現象產生變化的樣本流及鞘流的臨界值。當鞘流設置為0.84 mL/min、樣本流為0.09 mL/min時,10 μm和5 μm模擬微球完全分離。說明此條件下,FL和FD相互均衡,使模擬微球在芯片不同位置聚焦。以此流速為基準值,再分別固定樣本流改變鞘流、固定鞘流改變樣本流來觀察10 μm和5 μm模擬微球的分離情況。如圖4鞘流截止流速和最佳流速對比所示,當樣本流固定為0.1 m/s時,鞘流最小可調整到0.4 m/s,最大設置到0.6 m/s,10 μm和5 μm模擬微球的分離情況發生改變;另如圖4樣本流截止流速和最佳流速所示,當鞘流固定為0.5 m/s時,樣本流最小可調整到0.05 m/s,最大設置到0.2 m/s,10 μm和5 μm模擬微球會不完全分離。
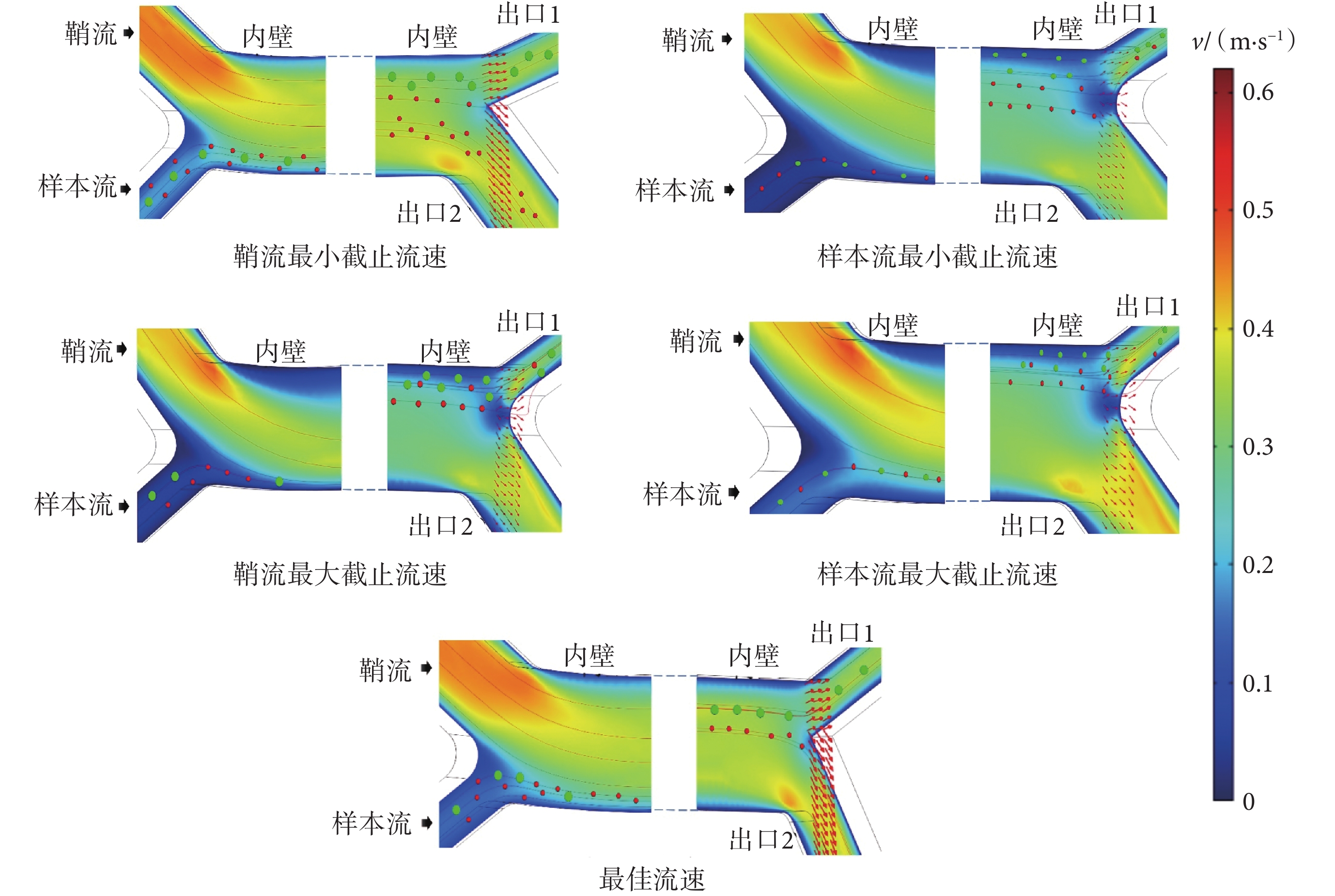 圖4
有限元分析軟件仿真結果
Figure4.
Finite element analysis software simulation results
圖4
有限元分析軟件仿真結果
Figure4.
Finite element analysis software simulation results
2.2 熒光微球分選結果
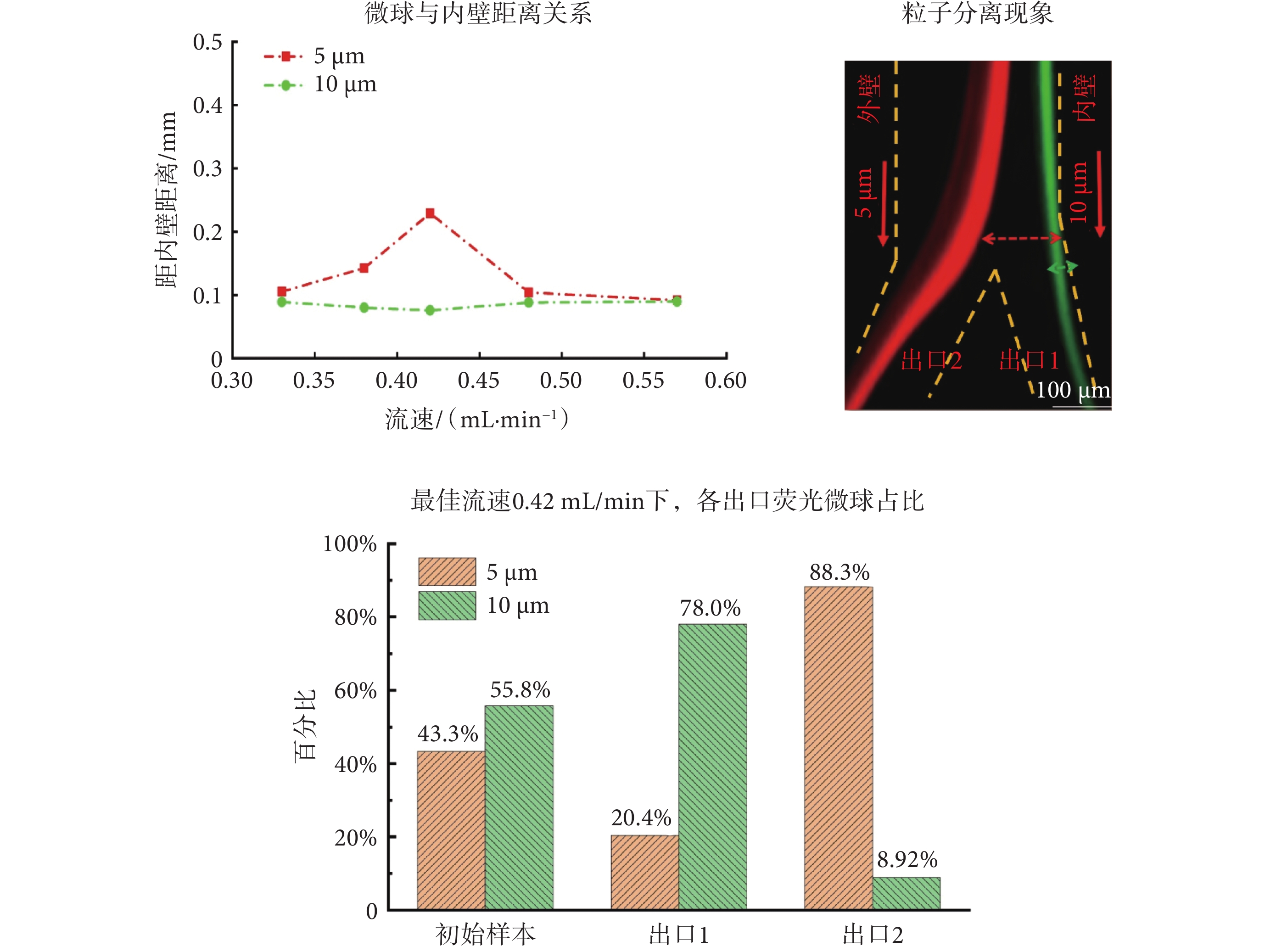
如圖5所示,本文首先基于微流控細胞慣性無標記分選及趨化性分析平臺,研究了不同樣本流速和鞘液流速條件下,10 μm和5 μm微球聚焦流中心位置與螺旋通道內壁的距離,來確定最佳樣本流速和鞘液流速。當樣本流速設置為0.42 mL/min,鞘液流速設置為5.7 mL/min時,慣性芯片中10 μm綠色微球聚焦流和5 μm紅色微球聚焦流間的距離最大,則此流速為最佳流速。同時流式細胞儀檢測結果表明,初始樣本中10 μm和5 μm微球各占55.8%和43.3%。在最佳流速下出口1純化管中收集到的10 μm微球占比為78.0%,出口2廢液管中5 μm微球占比為88.3%。說明慣性芯片收集目標微球,濾除背景干擾微球的能力較好。綜上,慣性芯片實現了不同粒徑大小熒光微球在螺旋通道不同位置的聚焦和分離。
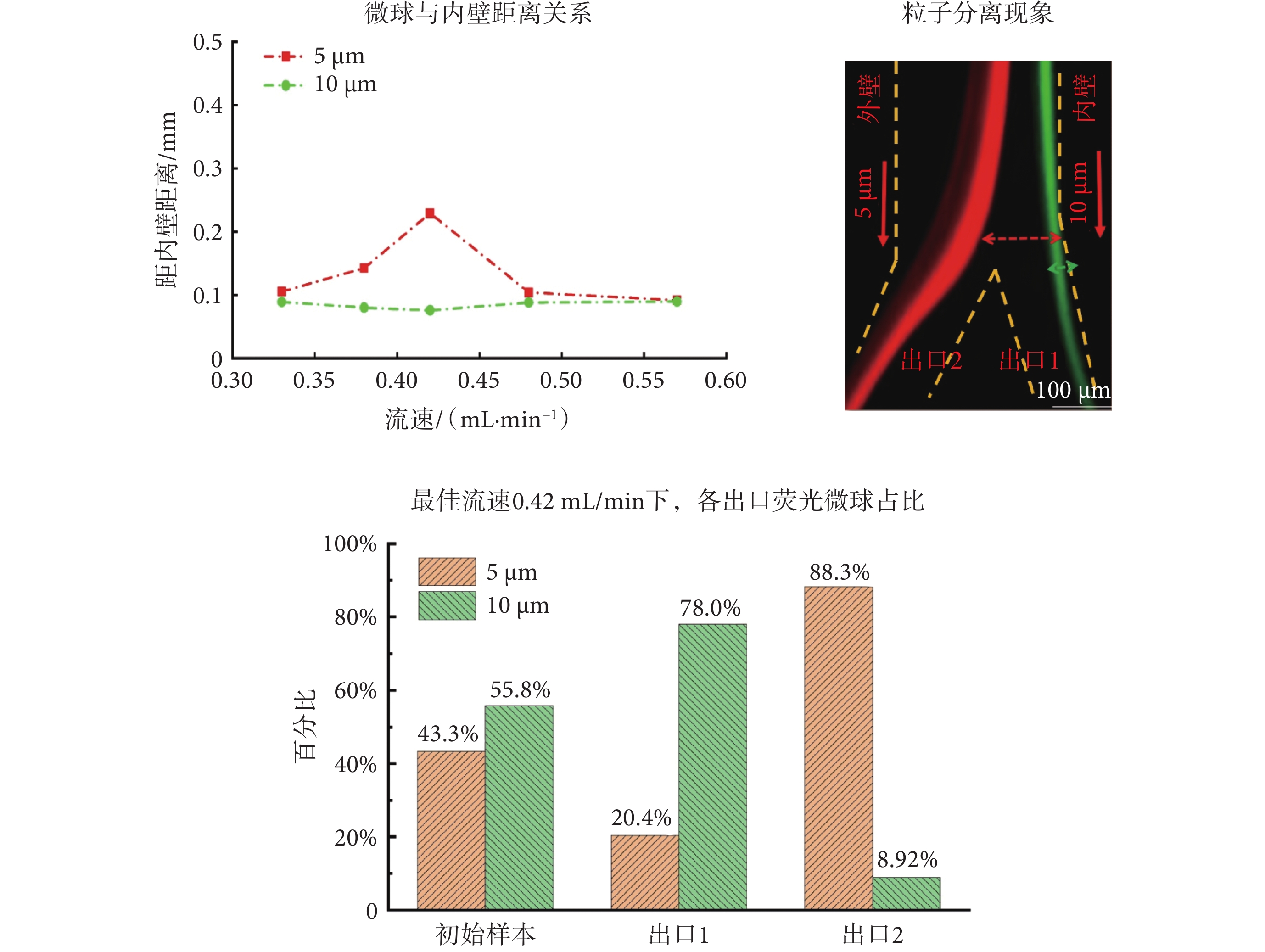 圖5
微球分離現象和分離結果
Figure5.
Microsphere separation phenomena and separation results
圖5
微球分離現象和分離結果
Figure5.
Microsphere separation phenomena and separation results
2.3 PMN分選和趨化性測試結果
采用微流控細胞慣性無標記分選及趨化性分析平臺,調節樣本流為0.42 mL/min,鞘液為5.7 mL/min進行細胞分選。如圖6所示,30倍稀釋的樣本液,紅細胞群與白細胞群存在交集,而60倍稀釋的樣本液被注入慣性芯片時,白細胞群和紅細胞群可以實現穩定分離聚焦。分選的白細胞群注入多通道芯片完成15 min的趨化運動后,采集遷移通道中的明場和熒光圖像。結果表明,CD66b-FITC抗體標記的PMN可以穿過細胞校準區的隔離帶并在遷移通道中進行遷移運動。遷移通道中CD66b-FITC抗體標記的PMN呈現出明顯的綠色熒光[39]。流式細胞儀計數結果表明,PMN的分離效率約在60%。PMN分離效率與其他慣性芯片相當,然而,其他研究需裂解全血后,再對紅細胞群進行洗滌濾除后通入芯片進行細胞分離[25],相較于本文加入紅細胞裂解液后直接利用慣性芯片進行分離更為繁瑣,故本文分選流程更為便捷高效。
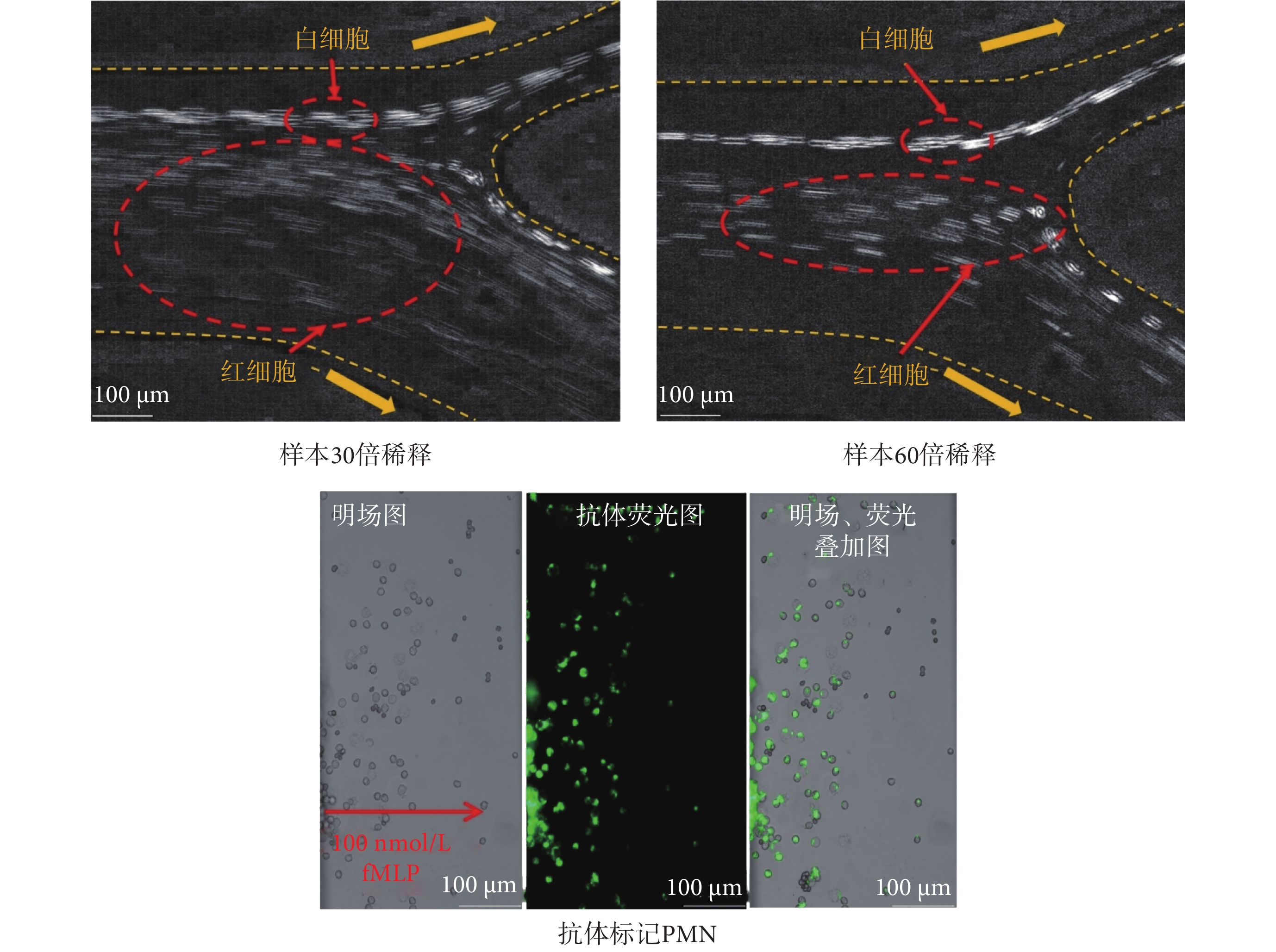 圖6
PMN分選與趨化遷移結果
Figure6.
PMN sorting and chemotactic migration results
圖6
PMN分選與趨化遷移結果
Figure6.
PMN sorting and chemotactic migration results
2.4 膿毒癥患者PMN分選和趨化性分析
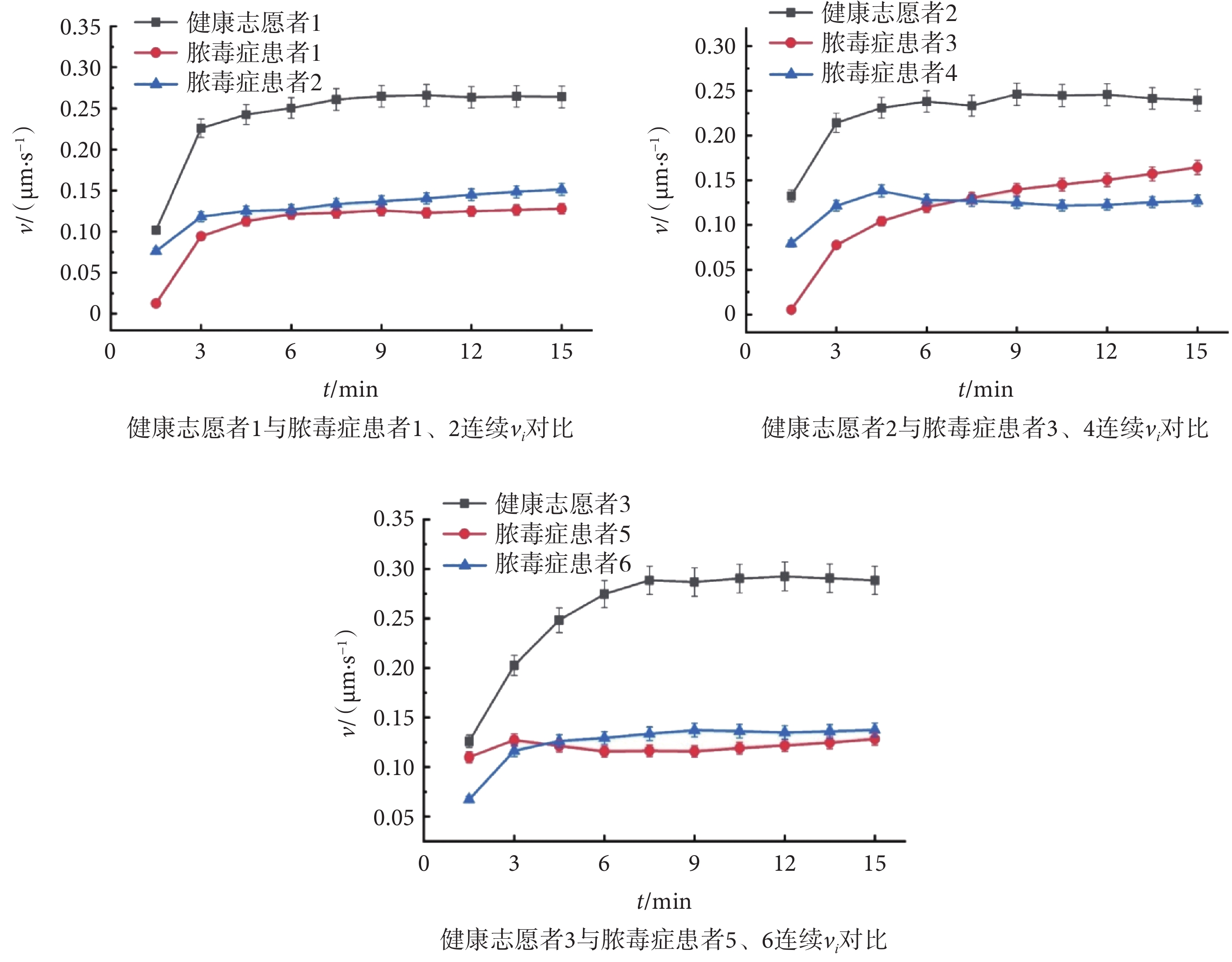
目前,已知膿毒癥患者PMN趨化遷移功能受損導致感染擴散與患者不良預后密切相關,主要是由于PMN釋放各種酶、炎癥介質等,導致組織損傷并最終發展為器官功能障礙和衰竭。因此,分析PMN的趨化遷移功能變化,對于膿毒癥的預警與輔助診斷以及監測患者免疫狀態和預后具有重要意義。微流控細胞慣性無標記分選及趨化性分析平臺實驗結果如圖7所示,健康志愿者1與膿毒癥患者1和2的CI值分別為0.72、0.46、0.57,健康志愿者2與膿毒癥患者3和4的CI值分別為0.73、0.51、0.42,健康志愿者3與膿毒癥患者5和6的CI值分別為0.71、0.60、0.52,膿毒癥患者組CI值平均低于健康志愿者組。因此,本文推斷膿毒癥患者的PMN趨化性受損,表現為偏向梯度方向運動。在此基礎上,如圖7所示,本文進一步比較了膿毒癥患者組和健康志愿者組的v值。健康志愿者1與膿毒癥患者1、2的v值分別為0.28 μm/s、0.14 μm/s、0.13 μm/s,健康志愿者2與膿毒癥患者3、4的v值分別為0.25 μm/s、0.18 μm/s、0.14 μm/s,健康志愿者3與膿毒癥患者5、6的v值分別為0.30 μm/s、0.16 μm/s、0.15 μm/s。實驗結果表明,膿毒癥患者組v值平均低于健康志愿者組。同時本文計算了15 min內隨時間變化的vi值。觀察到健康志愿者PMN的v值在各個時間段內均優于膿毒癥患者。過往研究已經表明,PMN主要通過其膜表面的趨化因子受體CXCR2識別感染部位的高濃度趨化物質,并觀察到膿毒癥患者及動物模型離體PMN的CXCR2存在表達下調或敏感性降低,因而對多種趨化因子如fMLP、白三烯B4(Leukotriene B4,LTB4)或白細胞介素-8(Interleukin-8,IL-8)的反應性降低[40]。同時,無論健康志愿者還是膿毒癥患者的PMN,其v值均會先上升到一定閾值之后,就隨時間推移而逐漸趨于平緩。這可能是當PMN進入低濃度趨化因子梯度環境時,細胞膜表面的趨化因子受體蛋白逐漸被吸引激活,細胞趨化反應逐漸上升,而當趨化因子濃度不斷升高,逐漸減少的受體蛋白難以吸收過量趨化因子導致細胞的遷移反應不斷降低[41-43]。由此可見,基于微流控細胞慣性無標記分選及趨化性分析平臺監測到膿毒癥患者PMN的趨化性受損,主要表現為CI和v值降低,此與前人研究結論保持一致。
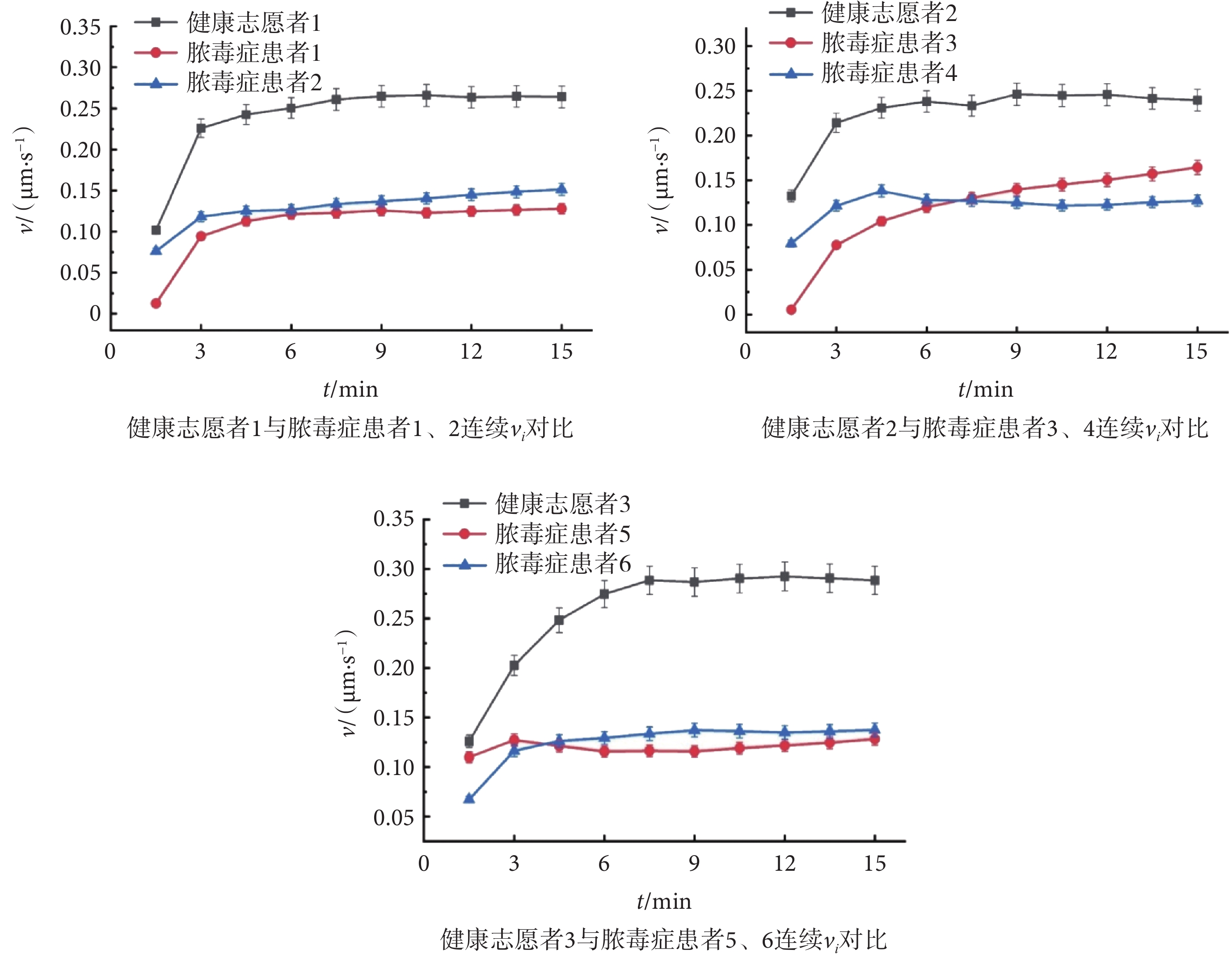 圖7
膿毒癥患者和健康志愿者PMN趨化行為對比分析
Figure7.
Comparative analysis of PMN chemotactic behavior in septic patients and healthy volunteers
圖7
膿毒癥患者和健康志愿者PMN趨化行為對比分析
Figure7.
Comparative analysis of PMN chemotactic behavior in septic patients and healthy volunteers
3 結論
本文創新性地將慣性芯片和多通道芯片相整合,首先利用慣性聚焦原理無標記分選白細胞群,隨后直接檢測PMN響應競爭梯度時的趨化遷移行為,以高效率方式實現了膿毒癥患者和健康志愿者對照PMN趨化遷移參數的差異化分析。目前研究旨在為基于微流控技術的細胞趨化性研究提供芯片設計思想和方法參考。通過改變慣性芯片和多通道芯片的尺寸,微流控細胞慣性無標記分選及趨化性分析平臺同樣適用于腫瘤細胞分選與趨化性分析。后期將繼續優化微流控細胞慣性無標記分選及趨化性分析平臺,為膿毒癥的預警與輔助診斷、監測膿毒癥患者免疫狀態和預后,提供新方法和新工具。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:高朝茹和楊柯設計實驗和撰寫論文,楊逍和劉利娟進行數據收集和數據分析,周金華和王月進行文中圖片潤色和芯片制備,劉勇和朱靈指導實驗和修改論文。
倫理聲明:本研究通過了中國科學院合肥物質科學研究院醫學倫理委員會的審批(批文編號:YXLL-2023-06)。
0 引 言
膿毒癥患者進入重癥監護室的最初6 h內,若診斷和治療被延誤,病死率明顯增加。如果早期能對病情準確識別并合理地實施治療策略,可明顯改善膿毒癥預后。中性粒細胞(polymorphonuclear neutrophil,PMN)在抵抗疾病和保護宿主方面發揮著至關重要的作用[1]。研究發現,嚴重膿毒癥患者的PMN向感染部位移行的能力受到了抑制,從而不能及時地控制感染[2-3]。即時監測膿毒癥期間PMN趨化遷移功能變化,對于開展膿毒癥的預警與輔助診斷,評估患者免疫健康狀態和預后具有重要的科學意義。
微流控芯片最早起源于20世紀90年代,經過短短幾十年的發展,已經取得了令人矚目的成績,其中細胞趨化性分析是最重要的研究領域之一。這主要是因為微流控芯片具有分析快速、成本低、重現性好、集成化并可以在接近生理環境下運行等特點[4-8]。Ellett等[9]設計了迷宮式微流控芯片,全血直接注入微流控芯片后,觀察到膿毒癥患者PMN在狹窄微通道中的特異性自發遷移行為。Ren等[10]研制了一種填充了三維凝膠基質的三維微流控芯片,研究了T細胞在生理性皮膚炎癥物質和抗炎治療藥物作用下的跨內皮遷移反應。本項目組將微流控芯片與智能手機集成,研究了慢性阻塞性疾病患者PMN的遷移行為[11]。最近,還有一些研究人員報道了多通道細胞遷移芯片,以提高實驗分析效率。例如,Berthier等[12]開發了由50個獨立梯度單元組成的微流控芯片,研究了嚴重復發性細菌感染患者PMN的趨化性。Wu等[13]開發了一種具有八個獨立單元的微流控芯片,用于PMN和癌細胞的遷移行為研究。多通道細胞遷移芯片需要實時顯微鏡來記錄和跟蹤細胞遷移路徑[14]。由于顯微鏡的視野有限,多通道細胞遷移芯片僅能顯示一個獨立遷移通道[15-16]。擴大顯微鏡數量或旋轉/移動物鏡可以提高檢測通量,但將增加成本和運行多個設備的時間。此外,多通道細胞遷移芯片通常不具備分離細胞的能力或未配備分離細胞的輔件,從而限制了臨床診斷應用。采用多通道細胞遷移芯片測試趨化性時,需要采用密度梯度離心法分離PMN,費力且耗時,并可能導致細胞活化和損傷[1]。商用試劑盒促進了基于微流控芯片的細胞遷移研究,但仍需要離心,且成本高。在微流控芯片上利用微通道結構、細胞大小差異、抗原抗體反應,直接快速地分離血液里的PMN,特別適用于病體模型下PMN的功能表型即時分析[17-21]。然而,這些芯片的制造和預處理過程十分復雜。近年來,慣性微流控芯片已被開發用于從少量外周血中分離細胞[22-24]。例如,Hou等[25]開發了一種慣性微流控PMN分選和功能表型分析方法,用于糖尿病患者PMN的快速無標記純化和滾動行為分析。Jundi等[22]采用慣性微流控技術,從50 μL外周血中分離出PMN并用于下游吞噬功能、活性氧生成功能等的評估。Jiang等[26]開發了集成化微流控手持式無標記腫瘤細胞分選儀,用于從臨床胸腔積液中高通量分離惡性腫瘤細胞。綜上,微流控膿毒癥患者PMN慣性無標記分選及趨化性分析的研究尚處于起步階段。
本文首先設計了慣性細胞分選芯片(簡稱:慣性芯片),依托慣性力和迪恩阻力,分離白細胞群(直徑約7~20 μm)和紅細胞群(直徑約5~7 μm)。其中,本文主要關注的PMN(直徑約為10~15 μm)[27-28]。隨后,設計了多通道細胞遷移芯片(簡稱:多通道芯片),構建了微流控PMN慣性無標記分選及趨化性分析平臺。一般而言,白細胞群中的單核細胞遷移所需時間大概要1~5 h[29],而淋巴細胞一般需要經過增殖培養才能進行趨化遷移檢測[30]。而本文設計的慣性芯片和多通道芯片,預期能在30 min內完成細胞分選和PMN的趨化性分析,而無需任何其他操作。本文進一步招募健康志愿者和膿毒癥患者參與設計芯片的有效性測試,記錄并分析了健康志愿者和膿毒癥患者之間PMN趨化性的差異,以期驗證微流控PMN慣性無標記分選及趨化性分析平臺的可行性。本文創新性地將慣性芯片和多通道芯片相整合,旨在為基于微流控技術的細胞趨化性研究提供芯片設計思想和方法參考。
1 實驗部分
1.1 儀器和試劑
本研究所用儀器列舉如下:
倒置熒光顯微鏡(DMI8,Leica Inc.,德國);CO2恒溫細胞培養箱(D180,瑞沃德,中國);高速相機(AEM136M-16G,千眼狼,中國);恒壓泵(OB1 MK3,Elveflow,法國);流式細胞儀(Guava easyCyte,Merck,德國)。
本研究所用試劑列舉如下:
人纖維連接蛋白(fibronectin)(貨號:F2006,SIGMA-Aldrich,美國);趨化肽N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucyl-phenyl-alanine,fMLP)(貨號:F3506,SIGMA-Aldrich,美國);磷酸緩沖鹽溶液(phosphate buffered saline,PBS)(貨號:02-024-1ACS,Biological Industries,以色列);羅斯威爾·帕克紀念研究所-1640(Roswell Park memorial institute 1640,RPMI-1640)培養基(貨號:SH30809.01,Cytiva,美國);牛血清白蛋白(bovine albumin,BSA)(貨號:A1933,SIGMA-Aldrich,美國);CD66b-FITC抗體(貨號:305104,BioLegend,美國); 紅細胞裂解液(貨號:07800,STEMCELL,加拿大);5 μm聚苯乙烯微球(貨號:UniFlu PS-0205G,瑞格科技,中國);10 μm聚苯乙烯微球(貨號:UniFlu PS-0210O,瑞格科技,中國)。
1.2 慣性芯片工作原理
微流體通常與主要的粘性阻力相關,即雷諾數(Reynolds number,Re)(以符號Re表示)較低,這些阻力導致層流剖面沿流線夾帶懸浮顆粒和細胞在微通道中的不同位置聚焦[31-33]。慣性芯片分離原理如圖1所示,由于徑向離心加速度,在曲線通道內會形成上下兩個對稱的反向迪恩渦流(Dean vortices,Dean)(以符號Dean表示)[34],如式(1)所示:
 圖1
慣性芯片結構及分離原理示意圖
Figure1.
Schematic diagram of inertial chip structure and separation principle
圖1
慣性芯片結構及分離原理示意圖
Figure1.
Schematic diagram of inertial chip structure and separation principle
 |
其中,ρ是流體密度,U是通道中的平均速度,Dh水力直徑,μ是流體的動態粘度,R是通道的曲率半徑。Dean對懸浮在溶液中的粒子會產生迪恩阻力(FD),FD沿Dean流動的方向拖拽顆粒在通道內壁和外壁來回移動。外壁顆粒遷移到內壁完成一半Dean循環,繼續運動返回外壁完成全Dean循環[35-36],如式(2)所示:
 |
其中,Dean流速(以符號UDean表示)(UDean = 1.8 × 10?4 Dean1.63),ap粒子直徑,π表示圓周率。除FD外,顆粒和細胞在內壁附近還會受到慣性升力(FL)的影響,如式(3)所示:
 |
其中,fL是無量綱升力系數,它是雷諾數和歸一化橫截面位置(x/h)的函數[37], 是最大流速。較大顆粒(ap/通道高度h≥0.07)受FL作用強于FD會持續聚焦在內壁,不完成全Dean循環,較小顆粒則在FD牽引下完成全Dean循環。
是最大流速。較大顆粒(ap/通道高度h≥0.07)受FL作用強于FD會持續聚焦在內壁,不完成全Dean循環,較小顆粒則在FD牽引下完成全Dean循環。
1.3 慣性芯片設計與仿真
慣性芯片結構尺寸如圖1所示,芯片通道的橫剖面寬為500 μm,高為100 μm,總長10 cm,曲率半徑8.4 mm,設置螺旋圈數為2圈,螺距為2 mm。樣本口和鞘液口、出口1和出口2之間角度設置為60 o,通過實驗測試,確定樣本口和出口1通道寬度150 μm,鞘液口和出口2通道寬度350 μm。圖1中,①、②、③分別為相應紅色虛線框的放大示意圖,用以詳細描述芯片尺寸及功能。
使用有限元分析軟件COMSOL Multiphysics 5.5(COMSOL Inc.,瑞典)模擬分析了不同流量條件下,慣性芯片對于5 μm和10 μm模擬微球的分選性能。應用粒子跟蹤函數來追尋螺旋微通道中的微球軌跡分布情況。設置仿真參數:流體材料為水,流體溫度設置為20.35 ℃,流體密度ρ來自材料,動力黏度μ來自材料。樣本入口和鞘液入口設置不同流速,出口壓力為0 Pa。
1.4 多通道芯片設計與前處理
多通道芯片設計和制備,參考本課題組之前的工作——文獻[38]。如圖2所示,每個單元結構設計有細胞培養液入口、趨化劑入口、細胞加載口、廢液口、蛇形微通道、遷移通道、隔離帶,以及細胞校準區。其中蛇形微通道高70 μm、寬80 μm;遷移通道高70 μm、寬270 μm;隔離帶高3 μm、寬30 μm;細胞校準區長860 μm、寬40 μm。細胞從細胞加載口注入后,將整齊排列在細胞校準區的隔離帶邊緣。趨化劑入口和細胞培養液入口連接有蛇形微通道,并設置有壓力平衡連接通道,用于平衡趨化劑入口和細胞培養液入口的壓力差。蛇形微通道末端在遷移通道中匯聚,并通過層流和擴散機制在遷移通道中形成穩定的化學濃度梯度場。圖2中分別展示了遷移通道的俯視圖和不同角度的橫截面圖。多通道芯片使用前需要分別使用2.5 μg/mL的fibronectin溶液和細胞培養基(濃度為0.4%的BSA,經RPMI-1640稀釋)包被微通道,時長為1 h。
 圖2
多通道芯片結構示意圖
Figure2.
Schematic diagram of multi-channel chip structure
圖2
多通道芯片結構示意圖
Figure2.
Schematic diagram of multi-channel chip structure
1.5 微流控PMN慣性無標記分選及趨化性分析平臺構建與實驗測試
1.5.1 平臺構建
如圖3所示,細胞分選及趨化性分析平臺主要由以下部分組成:慣性芯片、多通道芯片、微流體驅動控制單元(包括氣源口1、氣源口2,用于調節流速)、樣本存儲管(15 mL,用于裝載樣本液形成樣本流)、鞘液存儲管(15 mL,用于裝載純水形成鞘流)、純化管(15 mL,用于收集目標液體)、廢液管(15 mL,用于收集廢液)、氣路、連接管路(紅、藍線)和控制軟件。
 圖3
微流控PMN慣性無標記分選及趨化性分析平臺示意圖
Figure3.
Schematic diagram of the microfluidic PMN inertial label-free sorting and chemotaxis analysis platform
圖3
微流控PMN慣性無標記分選及趨化性分析平臺示意圖
Figure3.
Schematic diagram of the microfluidic PMN inertial label-free sorting and chemotaxis analysis platform
1.5.2 熒光微球分選實驗
本文以紅色5 μm和綠色10 μm的熒光微球群分別模擬紅細胞群和PMN群,分別取30 μL和20 μL加入到裝有12 mL去離子水的樣本存儲管中稀釋為3×106個/mL和1.5 × 105個/mL。然后,如圖3所示,將氣源口1、樣本存儲管和樣本口相互連接,向慣性芯片中泵入樣本液,氣源口2、鞘液存儲管和鞘液口相互連接向慣性芯片中泵入鞘液。調節流速,利用高速相機觀察兩種熒光微球在出口1和出口2的聚焦情況。純化管收集慣性芯片出口1中的微球溶液。廢液管收集慣性芯片出口2中的微球溶液。最后,以流式細胞儀檢測樣本存儲管、純化管和廢液管中兩種微球的比例。
1.5.3 PMN分選與趨化性實驗
將50 μL CD66b-FITC抗體加入到1 mL人體血液樣本中,室溫孵育30 min;然后將9 mL紅細胞裂解液與上述1 mL人體血液樣本混合,冰上裂解10 min。取裂解后溶液400 μL裝入樣本存儲管,加入含有濃度為5%的BSA的PBS溶液,定容至12 mL,制備成30倍稀釋的樣本液。取裂解后溶液200 μL裝入樣本存儲管,加入含有5%BSA的PBS溶液,定容至12 mL,制備成60倍稀釋的樣本液。按照1.5.1和1.5.2小節的描述,連接各個試劑管和管路,調節流速,高速相機采集慣性芯片出口1和出口2的細胞分離圖像。隨后,為了確定PMN的分離率,用流式細胞儀分別從樣本存儲管和純化管中采集1 × 104個PMN,根據采取1 × 104個PMN所需的樣本體積來推測樣本存儲管和純化管中含有的PMN總個數,進而計算PMN的分離率。分離率為純化管中PMN數除以樣本存儲管中PMN數。為了確定PMN的遷移能力,首先將純化管中的細胞溶液離心后去上清液,再用1 mL細胞培養基重懸。接著取20 μL重懸液注入多通道芯片的細胞加載口。然后,分別向趨化劑入口和細胞培養液入口注入50 μL濃度為100 nmol/L的fMLP和細胞培養基。PMN遷移運動15 min后,熒光顯微鏡采集遷移通道中的細胞分布圖像。由于單核細胞遷移運動需1~5 h[29],淋巴細胞需增殖培養才有活性[30],因而理論上僅觀察到PMN的趨化運動。
1.5.4 膿毒癥患者PMN分選與趨化性實驗
本研究經中國科學院合肥物質科學研究院倫理委員會批準(編號:YXLL-2023-06),所有參與者均簽署書面知情同意書。依據膿毒癥新指南(Sepsis 3.0)標準,選擇“血細胞培養呈陽性+序貫器官衰竭評分≥2分”的6名入住重癥監護室患者,患者平均年齡62歲;另招募3名體檢結果正常的志愿者作為對照組;排除孕婦、輸血患者和白細胞減少且低于2 × 109 個/mL的患者。本研究首先將9 mL紅細胞裂解液與1 mL靜脈血混合,裂解10 min。取裂解溶液200 μL裝入樣本存儲管,加入含有濃度為5%的BSA的PBS溶液,定容至12 mL,制備成60倍稀釋的樣本液。按1.5.3小節所述,進行細胞分選和趨化性實驗。本文共設計了3個實驗序列:健康志愿者1與膿毒癥患者1和2;健康志愿者2與膿毒癥患者3和4;健康志愿者3與膿毒癥患者5和6。以6幀/min速率采集90張PMN遷移圖像。使用公共圖像處理軟件Image J(National Institute of Mental Health,美國)獲取單個PMN的遷移運動軌跡。每個單元的遷移通道中需要追蹤30個細胞。通過計算趨化性指數(chemotaxis index,CI)和遷移速度(以符號v表示)來評估PMN的遷移運動能力。CI,是指細胞朝向濃度梯度運動的位移除以遷移的總路程,體現細胞能否準確快速到達病灶處的能力;遷移速度,為總遷移距離與實驗時間的比值。此外,還將15 min細胞遷移時間分割成10份,計算了膿毒癥患者和健康志愿者群的PMN隨時間變換的速度vi(i = 1, 2, …, 10),以觀測細胞遷移運動過程中的細胞遷移運動變化情況[38]。實驗均重復3次,結果表示為平均值±標準偏差。
2 結果與討論
2.1 慣性芯片分選仿真結果
本文設計的慣性芯片依靠FL和FD共同作用,使微球或細胞聚焦在芯片不同位置,需滿足微球或細胞分離的流速條件,為此利用三維仿真軟件對參數范圍進行初步摸索。如圖4所示,展現了10 μm和5 μm模擬微球成功分離的最佳流速,以及分離現象產生變化的樣本流及鞘流的臨界值。當鞘流設置為0.84 mL/min、樣本流為0.09 mL/min時,10 μm和5 μm模擬微球完全分離。說明此條件下,FL和FD相互均衡,使模擬微球在芯片不同位置聚焦。以此流速為基準值,再分別固定樣本流改變鞘流、固定鞘流改變樣本流來觀察10 μm和5 μm模擬微球的分離情況。如圖4鞘流截止流速和最佳流速對比所示,當樣本流固定為0.1 m/s時,鞘流最小可調整到0.4 m/s,最大設置到0.6 m/s,10 μm和5 μm模擬微球的分離情況發生改變;另如圖4樣本流截止流速和最佳流速所示,當鞘流固定為0.5 m/s時,樣本流最小可調整到0.05 m/s,最大設置到0.2 m/s,10 μm和5 μm模擬微球會不完全分離。
 圖4
有限元分析軟件仿真結果
Figure4.
Finite element analysis software simulation results
圖4
有限元分析軟件仿真結果
Figure4.
Finite element analysis software simulation results
2.2 熒光微球分選結果
如圖5所示,本文首先基于微流控細胞慣性無標記分選及趨化性分析平臺,研究了不同樣本流速和鞘液流速條件下,10 μm和5 μm微球聚焦流中心位置與螺旋通道內壁的距離,來確定最佳樣本流速和鞘液流速。當樣本流速設置為0.42 mL/min,鞘液流速設置為5.7 mL/min時,慣性芯片中10 μm綠色微球聚焦流和5 μm紅色微球聚焦流間的距離最大,則此流速為最佳流速。同時流式細胞儀檢測結果表明,初始樣本中10 μm和5 μm微球各占55.8%和43.3%。在最佳流速下出口1純化管中收集到的10 μm微球占比為78.0%,出口2廢液管中5 μm微球占比為88.3%。說明慣性芯片收集目標微球,濾除背景干擾微球的能力較好。綜上,慣性芯片實現了不同粒徑大小熒光微球在螺旋通道不同位置的聚焦和分離。
 圖5
微球分離現象和分離結果
Figure5.
Microsphere separation phenomena and separation results
圖5
微球分離現象和分離結果
Figure5.
Microsphere separation phenomena and separation results
2.3 PMN分選和趨化性測試結果
采用微流控細胞慣性無標記分選及趨化性分析平臺,調節樣本流為0.42 mL/min,鞘液為5.7 mL/min進行細胞分選。如圖6所示,30倍稀釋的樣本液,紅細胞群與白細胞群存在交集,而60倍稀釋的樣本液被注入慣性芯片時,白細胞群和紅細胞群可以實現穩定分離聚焦。分選的白細胞群注入多通道芯片完成15 min的趨化運動后,采集遷移通道中的明場和熒光圖像。結果表明,CD66b-FITC抗體標記的PMN可以穿過細胞校準區的隔離帶并在遷移通道中進行遷移運動。遷移通道中CD66b-FITC抗體標記的PMN呈現出明顯的綠色熒光[39]。流式細胞儀計數結果表明,PMN的分離效率約在60%。PMN分離效率與其他慣性芯片相當,然而,其他研究需裂解全血后,再對紅細胞群進行洗滌濾除后通入芯片進行細胞分離[25],相較于本文加入紅細胞裂解液后直接利用慣性芯片進行分離更為繁瑣,故本文分選流程更為便捷高效。
 圖6
PMN分選與趨化遷移結果
Figure6.
PMN sorting and chemotactic migration results
圖6
PMN分選與趨化遷移結果
Figure6.
PMN sorting and chemotactic migration results
2.4 膿毒癥患者PMN分選和趨化性分析
目前,已知膿毒癥患者PMN趨化遷移功能受損導致感染擴散與患者不良預后密切相關,主要是由于PMN釋放各種酶、炎癥介質等,導致組織損傷并最終發展為器官功能障礙和衰竭。因此,分析PMN的趨化遷移功能變化,對于膿毒癥的預警與輔助診斷以及監測患者免疫狀態和預后具有重要意義。微流控細胞慣性無標記分選及趨化性分析平臺實驗結果如圖7所示,健康志愿者1與膿毒癥患者1和2的CI值分別為0.72、0.46、0.57,健康志愿者2與膿毒癥患者3和4的CI值分別為0.73、0.51、0.42,健康志愿者3與膿毒癥患者5和6的CI值分別為0.71、0.60、0.52,膿毒癥患者組CI值平均低于健康志愿者組。因此,本文推斷膿毒癥患者的PMN趨化性受損,表現為偏向梯度方向運動。在此基礎上,如圖7所示,本文進一步比較了膿毒癥患者組和健康志愿者組的v值。健康志愿者1與膿毒癥患者1、2的v值分別為0.28 μm/s、0.14 μm/s、0.13 μm/s,健康志愿者2與膿毒癥患者3、4的v值分別為0.25 μm/s、0.18 μm/s、0.14 μm/s,健康志愿者3與膿毒癥患者5、6的v值分別為0.30 μm/s、0.16 μm/s、0.15 μm/s。實驗結果表明,膿毒癥患者組v值平均低于健康志愿者組。同時本文計算了15 min內隨時間變化的vi值。觀察到健康志愿者PMN的v值在各個時間段內均優于膿毒癥患者。過往研究已經表明,PMN主要通過其膜表面的趨化因子受體CXCR2識別感染部位的高濃度趨化物質,并觀察到膿毒癥患者及動物模型離體PMN的CXCR2存在表達下調或敏感性降低,因而對多種趨化因子如fMLP、白三烯B4(Leukotriene B4,LTB4)或白細胞介素-8(Interleukin-8,IL-8)的反應性降低[40]。同時,無論健康志愿者還是膿毒癥患者的PMN,其v值均會先上升到一定閾值之后,就隨時間推移而逐漸趨于平緩。這可能是當PMN進入低濃度趨化因子梯度環境時,細胞膜表面的趨化因子受體蛋白逐漸被吸引激活,細胞趨化反應逐漸上升,而當趨化因子濃度不斷升高,逐漸減少的受體蛋白難以吸收過量趨化因子導致細胞的遷移反應不斷降低[41-43]。由此可見,基于微流控細胞慣性無標記分選及趨化性分析平臺監測到膿毒癥患者PMN的趨化性受損,主要表現為CI和v值降低,此與前人研究結論保持一致。
 圖7
膿毒癥患者和健康志愿者PMN趨化行為對比分析
Figure7.
Comparative analysis of PMN chemotactic behavior in septic patients and healthy volunteers
圖7
膿毒癥患者和健康志愿者PMN趨化行為對比分析
Figure7.
Comparative analysis of PMN chemotactic behavior in septic patients and healthy volunteers
3 結論
本文創新性地將慣性芯片和多通道芯片相整合,首先利用慣性聚焦原理無標記分選白細胞群,隨后直接檢測PMN響應競爭梯度時的趨化遷移行為,以高效率方式實現了膿毒癥患者和健康志愿者對照PMN趨化遷移參數的差異化分析。目前研究旨在為基于微流控技術的細胞趨化性研究提供芯片設計思想和方法參考。通過改變慣性芯片和多通道芯片的尺寸,微流控細胞慣性無標記分選及趨化性分析平臺同樣適用于腫瘤細胞分選與趨化性分析。后期將繼續優化微流控細胞慣性無標記分選及趨化性分析平臺,為膿毒癥的預警與輔助診斷、監測膿毒癥患者免疫狀態和預后,提供新方法和新工具。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:高朝茹和楊柯設計實驗和撰寫論文,楊逍和劉利娟進行數據收集和數據分析,周金華和王月進行文中圖片潤色和芯片制備,劉勇和朱靈指導實驗和修改論文。
倫理聲明:本研究通過了中國科學院合肥物質科學研究院醫學倫理委員會的審批(批文編號:YXLL-2023-06)。