水凝膠是一種可降解親水聚合物,但親水性過大導致體積變大、彈性模量降低以及結構松散,影響其使用;尤其是在生物醫學工程領域,水凝膠的過分溶脹會壓迫神經,且降解速率過快,導致釋放的離子與組織生長不匹配等問題。因此,抗溶脹的水凝膠是近年來的研究熱點,本文綜述了抗溶脹水凝膠的近期研究進展,從水凝膠的溶脹機制和制備方法出發,詳細闡述其在生物醫學工程領域的應用發展,以期為抗溶脹水凝膠領域的研究者提供一些參考與借鑒。
引用本文: 宋昌隆, 付翔, 唐璐, 董志紅. 抗溶脹水凝膠在生物醫學領域的研究進展. 生物醫學工程學雜志, 2024, 41(4): 848-853. doi: 10.7507/1001-5515.202312008 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
水凝膠是一種親水性聚合物,在眾多學科領域中應用廣泛,以生物醫學工程領域為例,其在如軟體機器人、人造器官、再生醫學等方向都具有較大的應用潛力[1-2]。2020年中國醫用水凝膠市場規模達到了5.5億元,預計2026年將達到7.14億元,年增長率約為4.6%[3]。
水凝膠,作為一種三維的網絡交聯結構高分子聚合物,具有高彈性、穩定性、高吸水性、保水性和可溶脹等特性[4],其吸水性可以達到自身重量數百倍。但過分的溶脹會導致分子鏈結構破壞,機械性能下降,降解率提高,使用受限。因此,有研究者提出抗溶脹水凝膠概念[5],通過調控分子孔隙結構和交聯度來控制水凝膠的溶脹比,以期提升水凝膠的性能。基于此,本文綜述了近年來抗溶脹水凝膠的制備及在生物醫學工程領域的發展應用,以期為抗溶脹水凝膠的研究者們提供借鑒和參考。
1 水凝膠溶脹機制
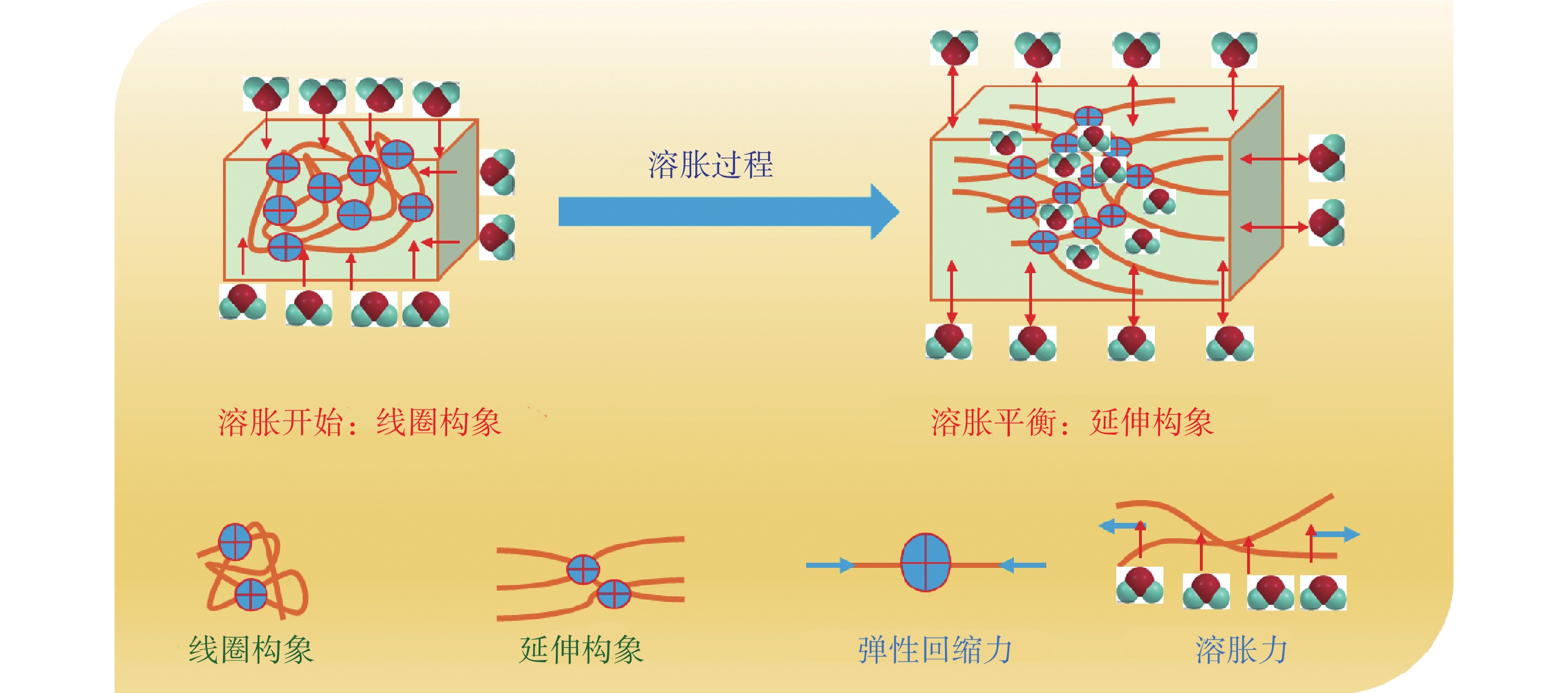
影響水凝膠溶脹的三個主要因素是:① 聚合物與水分子之間的相互作用,即聚合物分子鏈的親水性越強,聚合物與水分子的相互作用就越強。② 內外滲透壓,即如果水凝膠分子鏈中包含離子基團,則水凝膠內部和外部溶液的離子濃度差將產生滲透壓使其溶脹,離子濃度差越大,滲透壓就越大。③ 靜電作用,水凝膠表面的靜電相互作用會引起水分子向水凝膠表面移動,也能促使水凝膠發生溶脹[6]。三者的相互作用,導致水凝膠的溶脹和回縮相互制約,相互依賴。如圖1所示,隨著分子鏈網絡的溶脹逐漸從線圈構象變為延伸構象,彈性回縮力不斷增加,溶脹力不斷減少,最后趨于溶脹平衡。
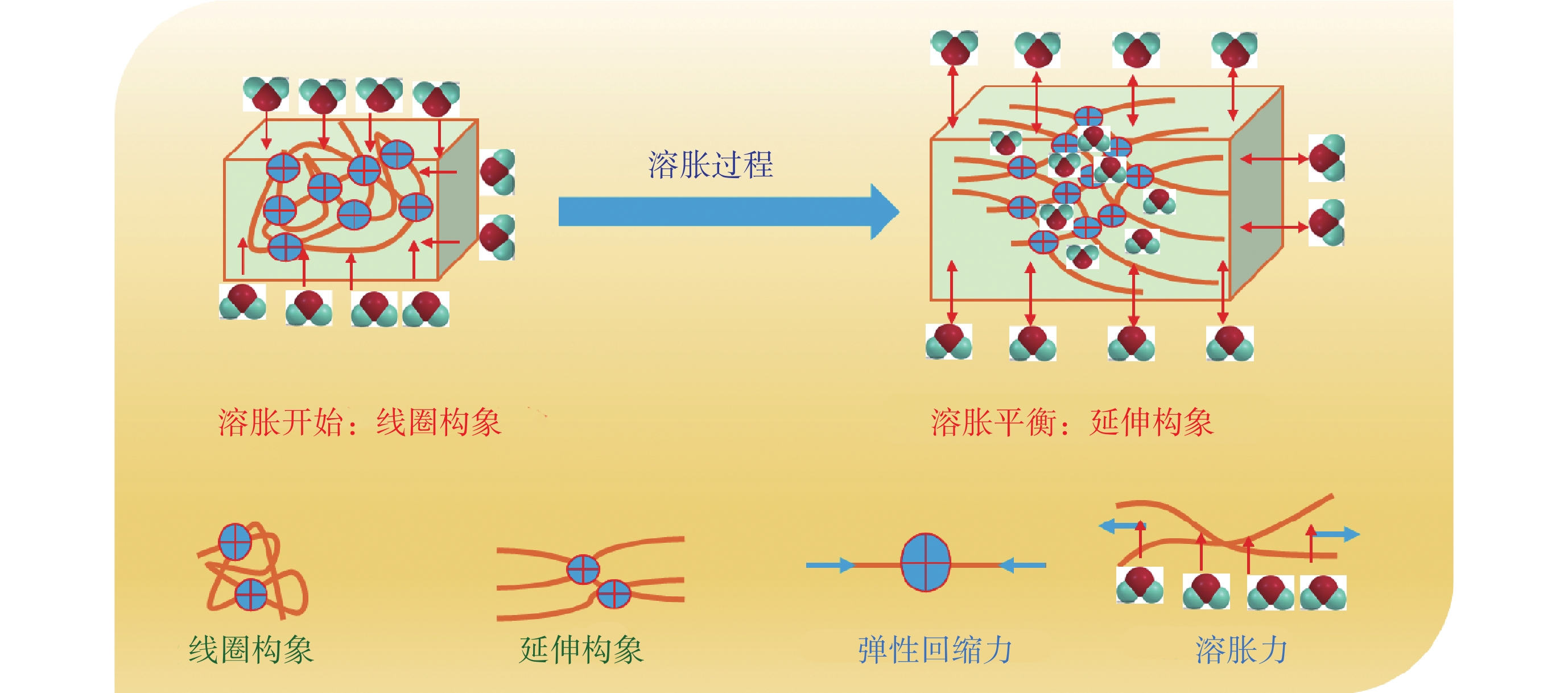 圖1
水凝膠的溶脹示意圖
Figure1.
Schematic diagram of hydrogel swelling
圖1
水凝膠的溶脹示意圖
Figure1.
Schematic diagram of hydrogel swelling
2 抗溶脹水凝膠的制備方法
基于水凝膠溶脹機制,抗溶脹水凝膠的制備主要是交聯成型,如化學交聯法、物理交聯法和物理/化學交聯法[7-8];研究者們通過不同材料的特性和交聯度,以獲得不同結構的抗溶脹水凝膠。如:化學交聯法,可以實現兩親性共分子鏈結構的抗溶脹水凝膠[9];物理交聯法,可以獲得單分子鏈高密度孔隙結構的抗溶脹水凝膠[10];物理/化學交聯法,可以獲得雙交聯(dual-cross-linked,DC)結構的抗溶脹水凝膠等[8]。按照三種不同的交聯方式,抗溶脹水凝膠特點如表1所示。
2.1 基于物理交聯法的抗溶脹水凝膠
物理交聯法,是通過材料分子間的非共價鍵相互作用,如氫鍵、靜電、疏水締合、π-π鍵和范德華力等,形成交錯的三維網絡結構[11-12]。例如,Wang等[13]通過在聚丙烯酸/鐵離子(polyacrylic acid/ferric ionic,PAA/Fe3+)中加入2-羥丙基三甲基氯化銨殼聚糖(2-hydroxypropyltrimethyl ammonium chloride chitosan,HACC),以物理交聯法制備了水凝膠。由于該水凝膠體系中存在靜電、離子配位和氫鍵共3種非共價鍵力相互作用,賦予了水凝膠優異的抗溶脹性能。Dai等[14]報道了二氨基三嗪-二氨基三嗪(diaminotriazine-diaminotriazine,DAT-DAT)氫鍵增強水凝膠,水凝膠內形成了穩定的DAT-DAT氫鍵域,表現出高拉伸和高壓縮強度,且在水溶液中不溶脹。Qi等[15]利用之前得到的聚丙烯酸共聚甲基丙烯酸月桂酯 (polyacrylic acid and lauryl methacrylate,PAA-co-LMA)與高濃度陽離子十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)以物理交聯法制備了超分子水凝膠。由于網絡中CTAB和PAA-co-LMA共聚物鏈的疏水締合作用,該水凝膠表現出優異的抗溶脹能力。
2.2 基于化學交聯法的抗溶脹水凝膠
化學交聯法,是通過添加交聯劑以化學反應形成共價鍵交聯結構。例如,Pi等[16]通過加入熱引發劑過硫酸銨(ammonium persulfate,APS)激活過渡金屬碳/氮化物(MXene)和鋯離子(Zr4+)誘導交聯,成功制備了聚丙烯酸(polyacrylic acid,PAA)與明膠(gelatine,Gel)的復合水凝膠。該水凝膠交聯反應時間短,交聯密度高,抗溶脹性能好。但是,大部分化學交聯法中使用的化學交聯劑難以根除,其殘留物將影響水凝膠使用,因此不添加交聯劑即可完成交聯的方法備受關注,如:希夫堿反應,通過胺對羰基的親核加成,經脫水可以形成亞胺鍵(-C=N-),從而獲得致密的交聯網絡。希夫堿反應形成的水凝膠其優勢在于可快速形成交聯結構,如Pang等[17]通過甲殼素納米晶須(chitin nano-whiskers,CtNWs)與羧甲基殼聚糖(carboxymethyl chitosan,CMCS)和右旋糖酐二甲醛(dextran dialdehyde,DDA)的希夫堿交聯,構建出一種機械性能增強的組織黏合劑水凝膠。該研究通過調節水凝膠中CtNWs的濃度,即能使水凝膠表現出靈活的抗溶脹性能。除此之外,還有其他各種加成反應的化學交聯也可以達到抗溶脹效果。
2.3 基于物理/化學交聯法的抗溶脹水凝膠
物理/化學交聯法,是通過分子鏈上的共價鍵和非共價鍵共同交聯的結果。雖然該交聯方式對實驗環境及控制要求相對較高,但是能使所制備的水凝膠避免上述單一交聯方式產生的缺點,使其具有非常顯著的抗溶脹性能。如Fan等[18]提出的DC水凝膠,即是將聚乙烯醇(polyvinyl alcohol,PVA)和聚丙烯酰胺(polyacrylamide,PAAm)化學交聯,然后將水凝膠浸入聚合物-單寧酸(polymer?tannic acid,TA)溶液中進行物理交聯,最終轉化為DC水凝膠。這種交聯機制有效抑制了水凝膠溶脹,表現出高機械強度和強韌性。Lu等[19]通過白光加熱APS將牛血清白蛋白(bovine serum albumin,BSA)和三(2, 2’-聯吡啶)二氯化釕[Ru(Ⅱ)]化學交聯成型,然后再將水凝膠水浴加熱(60~90 ℃)誘導BSA變性形成物理交聯,使水凝膠在去離子水中表現出優異的抗溶脹特性。
3 抗溶脹水凝膠在生物醫學中的應用
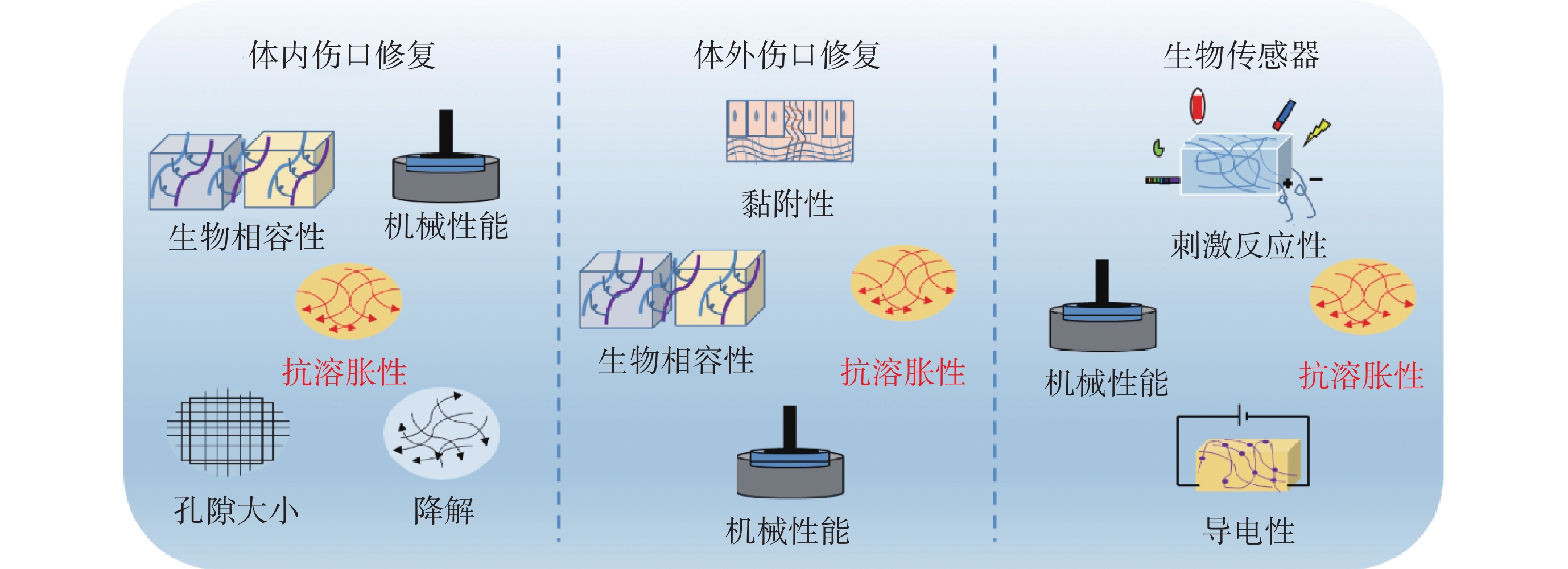
水凝膠廣泛應用于傷口愈合、組織黏合和組織再生等生物醫學領域[20],如體內外傷口敷料、生物傳感器和可注射的促軟體組織再生等。人體的復雜性對水凝膠結構特性要求極高,這就要求材料的設計及功能性要相匹配,其中涉及的幾個基礎設計理念如圖2所示。
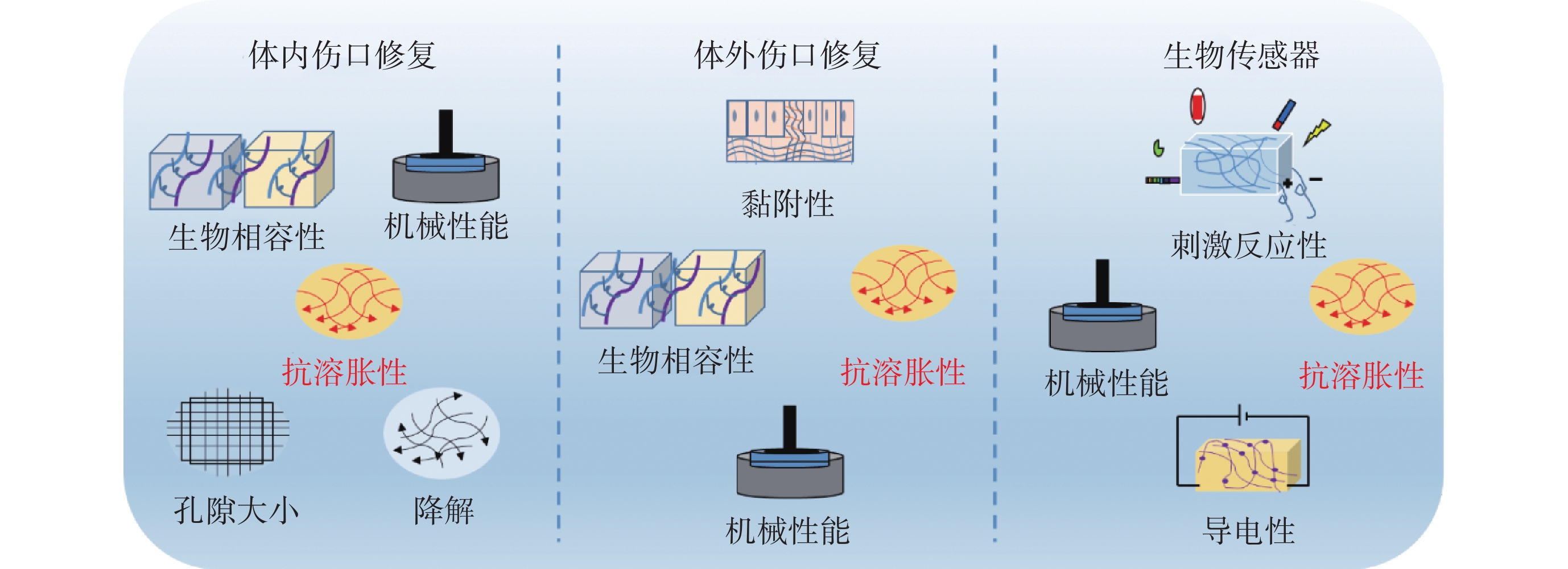 圖2
生物醫學領域對水凝膠抗溶脹性能的需求
Figure2.
Demand for hydrogel anti-swelling properties in the biomedical field
圖2
生物醫學領域對水凝膠抗溶脹性能的需求
Figure2.
Demand for hydrogel anti-swelling properties in the biomedical field
3.1 體內傷口修復的應用
3.1.1 口腔組織修復
口腔中的微生物菌群約有500多種,牙科手術中傷口處理不當將會引起菌群的破壞及病理環境的改變[21]。若以口腔敷料處理傷口,唾液的流動和潮濕環境對傷口的愈合是巨大的挑戰,傳統的治療方式是采用棉球、紗布配合縫線止血;而水凝膠有類似于天然細胞外基質的生物特征,是口腔內傷口敷料的首選。Wu等[22]報道了一種用于拔牙槽窩傷口的新型水凝膠敷料,采用化學交聯法將PAA和去質子化京尼平交聯的殼聚糖(genipin chitosan,G-CS)交聯,然后搭載抗生素,成功合成了水凝膠敷料。該敷料具有良好的抗溶脹性能和抗炎效果,能快速修復受損的組織。理想的口腔敷料在口腔中不僅需要具有穩定的黏附性和優越的韌性,還應該具有止血、殺菌、消炎和促進細胞增殖等功能。Zhu等[23]通過物理/化學交聯法,將甲基丙烯酸化明膠(gelatin methacrylate,GelMA)與納米黏土(nanoclay)化學交聯后,將水凝膠浸入TA溶液中進行物理交聯,成功制備了具備低溶脹、止血、殺菌、消炎和促細胞增殖多功能一體的水凝膠,可用于治療口腔全層黏膜缺損,效果顯著。
3.1.2 血管移植
目前,大多數水凝膠制備的血管移植物具有多孔的雙重網絡結構和穩定的力學性能,直徑在2~6 mm,但抗溶脹性欠佳,面向臨床應用還不成熟[24]。Hou等[25]通過化學交聯法制備了兩親性抗疲勞有機水凝膠,無論是在油還是在水介質中,該有機水凝膠的直徑和溶脹比保持平衡不變,且滿足血管的生物特征,具有與血管匹配的抗疲勞和機械性能。Wang等[26]用化學交聯法構建了雙網絡(dual network,DN)水凝膠,通過光引發自由基聚合普朗尼克F127二丙烯酸酯(di-acrylated Pluronic F127,F127DA)和甲基丙烯酸化透明質酸(methacrylated hyaluronic acid,HAMA),再引入GelMA和甲基丙烯酰化肝素(heparin methacryloyl,HepMA)賦予了該水凝膠優異的力學性能和生物學特征;該水凝膠表現出優異的抗溶脹性能,從其爆破壓力、半滲透性和順應性測試結果顯示具有與血管相匹配的參數,證明了該空心水凝膠管可作為人工心血管替代品的潛在材料。
3.1.3 內部軟組織修復
內部軟組織缺損通常是由手術切除、軟組織感染等引起的[27]。在體內微環境中,能促進組織愈合并具有抗溶脹特性的水凝膠,是理想的細胞外基質修復材料。Liang等[28]開發了一種新型生物相容性多孔聚乙烯醇水凝膠(janus porous polyvinyl alcohol,JPVA),通過物理交聯法制備,實現了內部軟組織受損后的有效修復,JPVA具有獨特的抗溶脹性能(最大溶脹比:6.4%),顯示出高效修復內部軟組織特性。Chen等[29]利用化學交聯法合成了耐酸水凝膠(acid-tolerant hydrogel,ATGel)生物黏合劑,該黏合劑具有無縫封閉和緩解炎癥的作用,還展現出抑制纖維化和促進血管生成效果,通過28 d的大鼠胃穿孔修復模型實驗證實,該水凝膠黏合劑表現出較好的抗溶脹性能。
3.1.4 骨組織修復
水凝膠作為骨缺損修復的材料,可為新骨組織生長提供橋梁,并為細胞和生長因子提供平臺;但是常規水凝膠固有的溶脹特性必然會壓迫軟組織,對其他組織或者器官造成繼發性損傷[30],因此開發抗溶脹水凝膠是必要的。Zhang等[31]將聚γ-谷氨酸(poly (γ-glutamic acid),γ-PGA)水凝膠浸泡在氯化鑭(LaCl3)水溶液中,以物理/化學交聯法制備了一種抗溶脹和高強度的La3+-γ-谷氨酸水凝膠,通過調節LaCl3溶液濃度及浸泡時間,可有效調節La3+-γ-谷氨酸水凝膠的溶脹率及力學性能,體外成骨細胞實驗表明La3+-γ-PGA水凝膠具備良好的生長環境,可用于促進軟骨修復和再生。You等[30]通過化學交聯法構建了一種磷酸氫根離子(HPO42-)交聯的生物聚合物水凝膠。該水凝膠表現出可控的溶脹比,體內外實驗表明該水凝膠顯著促進成骨細胞分化,加速新骨生成,是作為骨修復的優選材料。Wu等[32]通過物理/化學交聯法制備出一種抗溶脹水凝膠,首先通過化學交聯將明膠/聚乙二醇二丙烯酸酯/2-(二甲基氨基)甲基丙烯酸乙酯(gelatin/polyethylene glycol diacrylate/2-(dimethylamino)ethyl methacrylate,GPEGD)交聯成型,然后在GPEGD上物理交聯骨形態發生蛋白2(bone morphogenetic protein-2,BMP-2)負載多巴胺/肝素納米顆粒(BMP-2 loaded polydopamine/heparin nanoparticles, BPDAH),成功制備復合水凝膠,該水凝膠機械性能可與頜骨相匹配。由于有共價和非共價鍵作用,該水凝膠具有優異的抗溶脹性能,還具有生物降解性和聚多巴胺持續釋放性能。體內外實驗結果表明,該水凝膠能顯著促進細胞分化及礦化沉積,可作為下頜骨修復材料以促進組織再生。
3.2 體外傷口修復的應用
體外創傷和手術傷口的高發率推動體外傷口敷料的快速發展,傳統的縫合線和縫合釘會對組織造成二次傷害。親水性粘合劑水凝膠具有高含水量和適宜的機械性能,可以提供潮濕的微環境且具備促進細胞增殖等功能,可作為體外傷口敷料[33],但其易過分的溶脹導致體積增大、內聚力減弱和黏附性下降,也有引起傷口再次破裂和出血的風險[34]。因此,開發具備快速黏附和抗溶脹性為一體的水凝膠是外科手術中有利輔助。Bian等[35]利用化學交聯法開發了一種熱敏收縮納米膠束復合小分子黏附基團凝膠劑,成功制備了抗溶脹性能的可注射水凝膠(rapid-adhesion and anti-swelling properties,RAAS),該水凝膠在紫外照射下2 s內實現濕黏附,并在整個降解過程中表現出優異的抗溶脹性能;小鼠實驗表明,該水凝膠具有快速止血和密封傷口的作用,且傷口修復效果良好。糖尿病潰瘍導致皮膚潰爛的傷口修復是一大難題,Wei等[36]通過化學交聯法開發了一種具有大孔結構和抗溶脹性能的新型海綿狀大孔水凝膠(sponge-like macro-porous,SM),孔徑約為200~300 μm,并且在SM中引入甲基丙烯酰胺多巴胺和丙烯酸,獲得了具有生物學特征的復合水凝膠。該復合水凝膠在為期14 d的動物實驗中表現出卓越的抗溶脹性能,對糖尿病引發的皮膚潰爛傷口有很好的修復效果。
3.3 生物傳感器的應用
隨著導電水凝膠的快速發展,現已逐步應用于健康監測、人體運動檢測、人機界面及軟機器人等方向[37],然而大多數水凝膠傳感器在液體中會溶脹,這使得將其作為植入式傳感器使用受到影響。
為解決植入式水凝膠傳感器溶脹的問題,Xia等[38]采用化學交聯法制備了互穿聚合物網絡(interpenetrating polymer network,IPN)水凝膠,由于IPN中特殊的芳基乙酰化物主鏈,該水凝膠具有電子傳導、抗菌、抗溶脹性和組織黏附性能;當植入大鼠心臟區域時,該水凝膠電極顯示心外膜心電圖的原位記錄,同時信號穩定,四周無信號衰減,該水凝膠的開發為植入式傳感器開辟了新領域。Gao等[39]通過物理交聯法制備了水凝膠傳感器,由于PVA和支鏈淀粉(amylopectin,Amy)之間致密的氫鍵網絡和氯化鈉(NaCl)誘導的鹽析效應,使該水凝膠在各種液體介質中表現出顯著的抗溶脹性能(如在海水中的溶脹率=3.55%),結果表明該種含Amy質量百分比為4%的水凝膠具有穩定的導電性能和抗溶脹性能,可用于植入式傳感器實時檢測。Di等[40]通過物理/化學交聯法制備了DN水凝膠。由于該水凝膠浸入三價鐵離子(Fe3+)生成了過渡態雙交聯配位水凝膠,且引入了疏水單體和氫鍵作用,賦予了該水凝膠優異的抗溶脹性能,而動態離子(Fe3+、Na+、Cl-)使得水凝膠表現出快速響應(47.4 ms)和高靈敏度,可用于體內健康監測、運動識別和信息加密傳輸等領域。
4 總結與展望
隨著抗溶脹水凝膠的研究發展,其在生物醫學領域發展的空間越來越大,包括組織工程和再生醫學、組織移植物和植入式人工器官、醫用密封劑和生物粘合劑、生物傳感器和生物電子等方向。然而,面對個性化的設計要求,復雜的生理環境,包括pH、溫度、濕度、傷口等變化的不確定性,開發綜合優異的抗溶脹水凝膠仍然是一個巨大的挑戰。未來,尚需在以下方面尋求突破和改善:首先,需要進一步優化材料特性,包括控制其在微環境中受溫度、濕度和pH等因素影響的穩定性;其次,為符合臨床轉化的需求,需確保抗溶脹水凝膠的生物相容性和安全性;最后,還需對抗溶脹水凝膠的溶脹可控性、降解性和黏附性等相互之間的參數進行優化,以滿足個性化醫學的需求,實現精準化治療。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:宋昌隆為本文框架構思、文章撰寫人;付翔、唐璐負責相關文獻資料收集整理;董志紅負責論文選題以及指導、修改和審校。
0 引言
水凝膠是一種親水性聚合物,在眾多學科領域中應用廣泛,以生物醫學工程領域為例,其在如軟體機器人、人造器官、再生醫學等方向都具有較大的應用潛力[1-2]。2020年中國醫用水凝膠市場規模達到了5.5億元,預計2026年將達到7.14億元,年增長率約為4.6%[3]。
水凝膠,作為一種三維的網絡交聯結構高分子聚合物,具有高彈性、穩定性、高吸水性、保水性和可溶脹等特性[4],其吸水性可以達到自身重量數百倍。但過分的溶脹會導致分子鏈結構破壞,機械性能下降,降解率提高,使用受限。因此,有研究者提出抗溶脹水凝膠概念[5],通過調控分子孔隙結構和交聯度來控制水凝膠的溶脹比,以期提升水凝膠的性能。基于此,本文綜述了近年來抗溶脹水凝膠的制備及在生物醫學工程領域的發展應用,以期為抗溶脹水凝膠的研究者們提供借鑒和參考。
1 水凝膠溶脹機制
影響水凝膠溶脹的三個主要因素是:① 聚合物與水分子之間的相互作用,即聚合物分子鏈的親水性越強,聚合物與水分子的相互作用就越強。② 內外滲透壓,即如果水凝膠分子鏈中包含離子基團,則水凝膠內部和外部溶液的離子濃度差將產生滲透壓使其溶脹,離子濃度差越大,滲透壓就越大。③ 靜電作用,水凝膠表面的靜電相互作用會引起水分子向水凝膠表面移動,也能促使水凝膠發生溶脹[6]。三者的相互作用,導致水凝膠的溶脹和回縮相互制約,相互依賴。如圖1所示,隨著分子鏈網絡的溶脹逐漸從線圈構象變為延伸構象,彈性回縮力不斷增加,溶脹力不斷減少,最后趨于溶脹平衡。
 圖1
水凝膠的溶脹示意圖
Figure1.
Schematic diagram of hydrogel swelling
圖1
水凝膠的溶脹示意圖
Figure1.
Schematic diagram of hydrogel swelling
2 抗溶脹水凝膠的制備方法
基于水凝膠溶脹機制,抗溶脹水凝膠的制備主要是交聯成型,如化學交聯法、物理交聯法和物理/化學交聯法[7-8];研究者們通過不同材料的特性和交聯度,以獲得不同結構的抗溶脹水凝膠。如:化學交聯法,可以實現兩親性共分子鏈結構的抗溶脹水凝膠[9];物理交聯法,可以獲得單分子鏈高密度孔隙結構的抗溶脹水凝膠[10];物理/化學交聯法,可以獲得雙交聯(dual-cross-linked,DC)結構的抗溶脹水凝膠等[8]。按照三種不同的交聯方式,抗溶脹水凝膠特點如表1所示。
2.1 基于物理交聯法的抗溶脹水凝膠
物理交聯法,是通過材料分子間的非共價鍵相互作用,如氫鍵、靜電、疏水締合、π-π鍵和范德華力等,形成交錯的三維網絡結構[11-12]。例如,Wang等[13]通過在聚丙烯酸/鐵離子(polyacrylic acid/ferric ionic,PAA/Fe3+)中加入2-羥丙基三甲基氯化銨殼聚糖(2-hydroxypropyltrimethyl ammonium chloride chitosan,HACC),以物理交聯法制備了水凝膠。由于該水凝膠體系中存在靜電、離子配位和氫鍵共3種非共價鍵力相互作用,賦予了水凝膠優異的抗溶脹性能。Dai等[14]報道了二氨基三嗪-二氨基三嗪(diaminotriazine-diaminotriazine,DAT-DAT)氫鍵增強水凝膠,水凝膠內形成了穩定的DAT-DAT氫鍵域,表現出高拉伸和高壓縮強度,且在水溶液中不溶脹。Qi等[15]利用之前得到的聚丙烯酸共聚甲基丙烯酸月桂酯 (polyacrylic acid and lauryl methacrylate,PAA-co-LMA)與高濃度陽離子十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)以物理交聯法制備了超分子水凝膠。由于網絡中CTAB和PAA-co-LMA共聚物鏈的疏水締合作用,該水凝膠表現出優異的抗溶脹能力。
2.2 基于化學交聯法的抗溶脹水凝膠
化學交聯法,是通過添加交聯劑以化學反應形成共價鍵交聯結構。例如,Pi等[16]通過加入熱引發劑過硫酸銨(ammonium persulfate,APS)激活過渡金屬碳/氮化物(MXene)和鋯離子(Zr4+)誘導交聯,成功制備了聚丙烯酸(polyacrylic acid,PAA)與明膠(gelatine,Gel)的復合水凝膠。該水凝膠交聯反應時間短,交聯密度高,抗溶脹性能好。但是,大部分化學交聯法中使用的化學交聯劑難以根除,其殘留物將影響水凝膠使用,因此不添加交聯劑即可完成交聯的方法備受關注,如:希夫堿反應,通過胺對羰基的親核加成,經脫水可以形成亞胺鍵(-C=N-),從而獲得致密的交聯網絡。希夫堿反應形成的水凝膠其優勢在于可快速形成交聯結構,如Pang等[17]通過甲殼素納米晶須(chitin nano-whiskers,CtNWs)與羧甲基殼聚糖(carboxymethyl chitosan,CMCS)和右旋糖酐二甲醛(dextran dialdehyde,DDA)的希夫堿交聯,構建出一種機械性能增強的組織黏合劑水凝膠。該研究通過調節水凝膠中CtNWs的濃度,即能使水凝膠表現出靈活的抗溶脹性能。除此之外,還有其他各種加成反應的化學交聯也可以達到抗溶脹效果。
2.3 基于物理/化學交聯法的抗溶脹水凝膠
物理/化學交聯法,是通過分子鏈上的共價鍵和非共價鍵共同交聯的結果。雖然該交聯方式對實驗環境及控制要求相對較高,但是能使所制備的水凝膠避免上述單一交聯方式產生的缺點,使其具有非常顯著的抗溶脹性能。如Fan等[18]提出的DC水凝膠,即是將聚乙烯醇(polyvinyl alcohol,PVA)和聚丙烯酰胺(polyacrylamide,PAAm)化學交聯,然后將水凝膠浸入聚合物-單寧酸(polymer?tannic acid,TA)溶液中進行物理交聯,最終轉化為DC水凝膠。這種交聯機制有效抑制了水凝膠溶脹,表現出高機械強度和強韌性。Lu等[19]通過白光加熱APS將牛血清白蛋白(bovine serum albumin,BSA)和三(2, 2’-聯吡啶)二氯化釕[Ru(Ⅱ)]化學交聯成型,然后再將水凝膠水浴加熱(60~90 ℃)誘導BSA變性形成物理交聯,使水凝膠在去離子水中表現出優異的抗溶脹特性。
3 抗溶脹水凝膠在生物醫學中的應用
水凝膠廣泛應用于傷口愈合、組織黏合和組織再生等生物醫學領域[20],如體內外傷口敷料、生物傳感器和可注射的促軟體組織再生等。人體的復雜性對水凝膠結構特性要求極高,這就要求材料的設計及功能性要相匹配,其中涉及的幾個基礎設計理念如圖2所示。
 圖2
生物醫學領域對水凝膠抗溶脹性能的需求
Figure2.
Demand for hydrogel anti-swelling properties in the biomedical field
圖2
生物醫學領域對水凝膠抗溶脹性能的需求
Figure2.
Demand for hydrogel anti-swelling properties in the biomedical field
3.1 體內傷口修復的應用
3.1.1 口腔組織修復
口腔中的微生物菌群約有500多種,牙科手術中傷口處理不當將會引起菌群的破壞及病理環境的改變[21]。若以口腔敷料處理傷口,唾液的流動和潮濕環境對傷口的愈合是巨大的挑戰,傳統的治療方式是采用棉球、紗布配合縫線止血;而水凝膠有類似于天然細胞外基質的生物特征,是口腔內傷口敷料的首選。Wu等[22]報道了一種用于拔牙槽窩傷口的新型水凝膠敷料,采用化學交聯法將PAA和去質子化京尼平交聯的殼聚糖(genipin chitosan,G-CS)交聯,然后搭載抗生素,成功合成了水凝膠敷料。該敷料具有良好的抗溶脹性能和抗炎效果,能快速修復受損的組織。理想的口腔敷料在口腔中不僅需要具有穩定的黏附性和優越的韌性,還應該具有止血、殺菌、消炎和促進細胞增殖等功能。Zhu等[23]通過物理/化學交聯法,將甲基丙烯酸化明膠(gelatin methacrylate,GelMA)與納米黏土(nanoclay)化學交聯后,將水凝膠浸入TA溶液中進行物理交聯,成功制備了具備低溶脹、止血、殺菌、消炎和促細胞增殖多功能一體的水凝膠,可用于治療口腔全層黏膜缺損,效果顯著。
3.1.2 血管移植
目前,大多數水凝膠制備的血管移植物具有多孔的雙重網絡結構和穩定的力學性能,直徑在2~6 mm,但抗溶脹性欠佳,面向臨床應用還不成熟[24]。Hou等[25]通過化學交聯法制備了兩親性抗疲勞有機水凝膠,無論是在油還是在水介質中,該有機水凝膠的直徑和溶脹比保持平衡不變,且滿足血管的生物特征,具有與血管匹配的抗疲勞和機械性能。Wang等[26]用化學交聯法構建了雙網絡(dual network,DN)水凝膠,通過光引發自由基聚合普朗尼克F127二丙烯酸酯(di-acrylated Pluronic F127,F127DA)和甲基丙烯酸化透明質酸(methacrylated hyaluronic acid,HAMA),再引入GelMA和甲基丙烯酰化肝素(heparin methacryloyl,HepMA)賦予了該水凝膠優異的力學性能和生物學特征;該水凝膠表現出優異的抗溶脹性能,從其爆破壓力、半滲透性和順應性測試結果顯示具有與血管相匹配的參數,證明了該空心水凝膠管可作為人工心血管替代品的潛在材料。
3.1.3 內部軟組織修復
內部軟組織缺損通常是由手術切除、軟組織感染等引起的[27]。在體內微環境中,能促進組織愈合并具有抗溶脹特性的水凝膠,是理想的細胞外基質修復材料。Liang等[28]開發了一種新型生物相容性多孔聚乙烯醇水凝膠(janus porous polyvinyl alcohol,JPVA),通過物理交聯法制備,實現了內部軟組織受損后的有效修復,JPVA具有獨特的抗溶脹性能(最大溶脹比:6.4%),顯示出高效修復內部軟組織特性。Chen等[29]利用化學交聯法合成了耐酸水凝膠(acid-tolerant hydrogel,ATGel)生物黏合劑,該黏合劑具有無縫封閉和緩解炎癥的作用,還展現出抑制纖維化和促進血管生成效果,通過28 d的大鼠胃穿孔修復模型實驗證實,該水凝膠黏合劑表現出較好的抗溶脹性能。
3.1.4 骨組織修復
水凝膠作為骨缺損修復的材料,可為新骨組織生長提供橋梁,并為細胞和生長因子提供平臺;但是常規水凝膠固有的溶脹特性必然會壓迫軟組織,對其他組織或者器官造成繼發性損傷[30],因此開發抗溶脹水凝膠是必要的。Zhang等[31]將聚γ-谷氨酸(poly (γ-glutamic acid),γ-PGA)水凝膠浸泡在氯化鑭(LaCl3)水溶液中,以物理/化學交聯法制備了一種抗溶脹和高強度的La3+-γ-谷氨酸水凝膠,通過調節LaCl3溶液濃度及浸泡時間,可有效調節La3+-γ-谷氨酸水凝膠的溶脹率及力學性能,體外成骨細胞實驗表明La3+-γ-PGA水凝膠具備良好的生長環境,可用于促進軟骨修復和再生。You等[30]通過化學交聯法構建了一種磷酸氫根離子(HPO42-)交聯的生物聚合物水凝膠。該水凝膠表現出可控的溶脹比,體內外實驗表明該水凝膠顯著促進成骨細胞分化,加速新骨生成,是作為骨修復的優選材料。Wu等[32]通過物理/化學交聯法制備出一種抗溶脹水凝膠,首先通過化學交聯將明膠/聚乙二醇二丙烯酸酯/2-(二甲基氨基)甲基丙烯酸乙酯(gelatin/polyethylene glycol diacrylate/2-(dimethylamino)ethyl methacrylate,GPEGD)交聯成型,然后在GPEGD上物理交聯骨形態發生蛋白2(bone morphogenetic protein-2,BMP-2)負載多巴胺/肝素納米顆粒(BMP-2 loaded polydopamine/heparin nanoparticles, BPDAH),成功制備復合水凝膠,該水凝膠機械性能可與頜骨相匹配。由于有共價和非共價鍵作用,該水凝膠具有優異的抗溶脹性能,還具有生物降解性和聚多巴胺持續釋放性能。體內外實驗結果表明,該水凝膠能顯著促進細胞分化及礦化沉積,可作為下頜骨修復材料以促進組織再生。
3.2 體外傷口修復的應用
體外創傷和手術傷口的高發率推動體外傷口敷料的快速發展,傳統的縫合線和縫合釘會對組織造成二次傷害。親水性粘合劑水凝膠具有高含水量和適宜的機械性能,可以提供潮濕的微環境且具備促進細胞增殖等功能,可作為體外傷口敷料[33],但其易過分的溶脹導致體積增大、內聚力減弱和黏附性下降,也有引起傷口再次破裂和出血的風險[34]。因此,開發具備快速黏附和抗溶脹性為一體的水凝膠是外科手術中有利輔助。Bian等[35]利用化學交聯法開發了一種熱敏收縮納米膠束復合小分子黏附基團凝膠劑,成功制備了抗溶脹性能的可注射水凝膠(rapid-adhesion and anti-swelling properties,RAAS),該水凝膠在紫外照射下2 s內實現濕黏附,并在整個降解過程中表現出優異的抗溶脹性能;小鼠實驗表明,該水凝膠具有快速止血和密封傷口的作用,且傷口修復效果良好。糖尿病潰瘍導致皮膚潰爛的傷口修復是一大難題,Wei等[36]通過化學交聯法開發了一種具有大孔結構和抗溶脹性能的新型海綿狀大孔水凝膠(sponge-like macro-porous,SM),孔徑約為200~300 μm,并且在SM中引入甲基丙烯酰胺多巴胺和丙烯酸,獲得了具有生物學特征的復合水凝膠。該復合水凝膠在為期14 d的動物實驗中表現出卓越的抗溶脹性能,對糖尿病引發的皮膚潰爛傷口有很好的修復效果。
3.3 生物傳感器的應用
隨著導電水凝膠的快速發展,現已逐步應用于健康監測、人體運動檢測、人機界面及軟機器人等方向[37],然而大多數水凝膠傳感器在液體中會溶脹,這使得將其作為植入式傳感器使用受到影響。
為解決植入式水凝膠傳感器溶脹的問題,Xia等[38]采用化學交聯法制備了互穿聚合物網絡(interpenetrating polymer network,IPN)水凝膠,由于IPN中特殊的芳基乙酰化物主鏈,該水凝膠具有電子傳導、抗菌、抗溶脹性和組織黏附性能;當植入大鼠心臟區域時,該水凝膠電極顯示心外膜心電圖的原位記錄,同時信號穩定,四周無信號衰減,該水凝膠的開發為植入式傳感器開辟了新領域。Gao等[39]通過物理交聯法制備了水凝膠傳感器,由于PVA和支鏈淀粉(amylopectin,Amy)之間致密的氫鍵網絡和氯化鈉(NaCl)誘導的鹽析效應,使該水凝膠在各種液體介質中表現出顯著的抗溶脹性能(如在海水中的溶脹率=3.55%),結果表明該種含Amy質量百分比為4%的水凝膠具有穩定的導電性能和抗溶脹性能,可用于植入式傳感器實時檢測。Di等[40]通過物理/化學交聯法制備了DN水凝膠。由于該水凝膠浸入三價鐵離子(Fe3+)生成了過渡態雙交聯配位水凝膠,且引入了疏水單體和氫鍵作用,賦予了該水凝膠優異的抗溶脹性能,而動態離子(Fe3+、Na+、Cl-)使得水凝膠表現出快速響應(47.4 ms)和高靈敏度,可用于體內健康監測、運動識別和信息加密傳輸等領域。
4 總結與展望
隨著抗溶脹水凝膠的研究發展,其在生物醫學領域發展的空間越來越大,包括組織工程和再生醫學、組織移植物和植入式人工器官、醫用密封劑和生物粘合劑、生物傳感器和生物電子等方向。然而,面對個性化的設計要求,復雜的生理環境,包括pH、溫度、濕度、傷口等變化的不確定性,開發綜合優異的抗溶脹水凝膠仍然是一個巨大的挑戰。未來,尚需在以下方面尋求突破和改善:首先,需要進一步優化材料特性,包括控制其在微環境中受溫度、濕度和pH等因素影響的穩定性;其次,為符合臨床轉化的需求,需確保抗溶脹水凝膠的生物相容性和安全性;最后,還需對抗溶脹水凝膠的溶脹可控性、降解性和黏附性等相互之間的參數進行優化,以滿足個性化醫學的需求,實現精準化治療。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:宋昌隆為本文框架構思、文章撰寫人;付翔、唐璐負責相關文獻資料收集整理;董志紅負責論文選題以及指導、修改和審校。