版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
正畸源性牙根吸收(orthodontically induced root resorption,OIRR)是正畸牙移動(orthodontic tooth movement,OTM)產生的常見并發癥,發生率高達80%[1]。OIRR分為輕度(根尖吸收長度<2 mm)、中度(根尖吸收長度>2 mm但小于原根長的1/3)和重度牙根吸收(根尖吸收長度>4 mm或大于原根長的1/3)[2]。重度牙根吸收發生概率高達14.5%,會引起牙髓炎、根尖周炎甚至牙齒松動脫落[3],給患者帶來額外的治療費用和痛苦。因此,如何減少或修復OIRR對正畸治療效果和延長患者牙齒保留時間至關重要。當前,OIRR的防治方法主要包括藥物治療和物理治療。藥物治療是全身或局部應用藥物如青藤堿和淫羊藿苷等[4-5],但其安全性不確切;物理治療包括機械振動[6]、激光[7]、超聲[8]和光生物調節治療[9]等,但其臨床有效性存在爭議[10]。因此,現有方法很難有效預防或修復OIRR,亟需尋找新的防治方法。
干細胞是一類具有自我更新和多系分化的原始細胞,已被廣泛應用于組織修復與再生領域。干細胞不僅可分化為成骨細胞再生牙骨質,還可減少炎癥因子環氧合酶2(cyclooxygenase-2,COX-2)的表達,抑制破骨活動以減少牙根吸收[11]。當前,用于防治OIRR的干細胞類型包括BMSCs[11]、內臟脂肪來源干細胞(adipose-derived stem cells,ADSCs)[12]和人尿源性干細胞(human urine-derived stem cells,hUSCs)[13]。然而,獲取BMSCs創傷較大,且來源并不豐富;獲取內臟ADSCs過程較為繁瑣,接受度不高;hUSCs含量較少,培養難度較高。迄今為止,尚未檢索到皮下脂肪來源ADSCs修復OIRR的文獻報道。人皮下脂肪來源ADSCs(human subcutaneous ADSCs,hADSCs)臨床來源于丟棄的抽吸脂肪,含量豐富、容易獲取,且具有低免疫原性。因此,本研究擬建立大鼠上頜第1磨牙OTM模型,并在牙周局部注射hADSCs,探究hADSCs對OIRR的影響及可能機制,為臨床應用hADSCs抑制OIRR提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
hADSCs由遵義醫科大學附屬醫院燒傷整形外科提供,來源于臨床抽脂塑形的求美者,患者均知情同意并通過倫理批準。8周齡雄性SD大鼠40只,體質量260~300 g,由遵義醫科大學動物中心提供。DMEM培養基、FBS(GIBCO公司,美國);成脂誘導分化培養基、成骨誘導培養基及成軟骨誘導培養基 [賽業(廣州)生物科技有限公司];37%磷酸酸蝕劑(3M公司,美國);美佳印彈性體印模材料(0型/3;(山東滬鴿口腔材料股份有限公司);正畸結扎絲(0.2 mm/0.25 mm;Heraeus Kulzer公司,德國);鎳鈦拉簧(0.010 in×6 mm;上海埃蒙迪材料科技有限公司)。全自動染色機(LEICA公司,德國);流式細胞儀(BD公司,美國);倒置相差顯微鏡(Olympus公司,日本);掃描電鏡(Hitachi公司,日本);正畸測力計(長沙天天齒科器材有限公司);體式顯微鏡(Leica公司,德國)。
1.2 hADSCs 的分離、培養及鑒定
參照文獻 [14] 方法分離培養hADSCs。將臨床獲取的脂肪組織加入PBS中,洗滌離心去除PBS后加入等體積0.1% Ⅰ型膠原蛋白酶,37 ℃震蕩消化1 h;150目網篩過濾后以800×g離心5 min;棄上清,加入含10%FBS、1%雙抗的DMEM培養液,重懸細胞,以5×105個/mL濃度接種至培養皿,置于37 ℃、5%CO2培養箱中培養。72 h后首次換液,之后每3天換液1次,待細胞生長融合至70%~80%,0.25%胰蛋白酶-EDTA消化傳代、凍存。培養期間于倒置相差顯微鏡下觀察細胞形態變化并行表型鑒定和誘導分化。① 表型鑒定:取第3代細胞,采用流式細胞儀檢測CD90、CD105、CD73、CD44、CD29及CD45表達。②誘導分化鑒定:取第3代細胞,分別采用成脂誘導分化培養基培養3周,行油紅O染色觀察成脂效果;成骨誘導培養基培養3周,行茜素紅染色觀察成骨效果;成軟骨誘導培養基誘導培養4周,行阿利新藍染色觀察成軟骨效果。
1.3 動物分組及模型制備
將適應性飼養1周后健康無異常的40只SD大鼠按照隨機數字表法分為實驗組和對照組,每組20只,對每只大鼠做好標記和記錄初始體質量。參照文獻[15]方法建立大鼠右側上頜第1磨牙近中牙OTM模型。待大鼠麻醉(4%異氟烷誘導麻醉,固定四肢后經鼻吸入2%異氟烷維持麻醉)生效后,將大鼠以仰臥式體位固定于自制固定板上。用提前制作的大鼠上頜個別托盤通過二次印模法制取大鼠上頜印模,超硬石膏灌制模型用于測量牙移動距離。然后在大鼠上頜2顆中切牙頸部用牙科打磨機磨出2條深約0.2 mm的固位溝,37%磷酸酸蝕劑酸蝕上頜切牙,棉球擦拭,隔濕吹干,小棉棒涂布黏接劑,光固化,3M固體樹脂于上頜切牙堆塑倒梯形樹脂結構(頸部寬、切緣窄),堆樹脂時注意勿使樹脂進入固位溝,倒梯形樹脂結構用于加強固位溝的固位作用。使用0.20 mm正畸結扎絲從右上頜第1磨牙和第2磨牙相鄰間隙穿過后結扎于第1磨牙近中,接著在右側上頜第1磨牙和雙側切牙之間安置正畸鎳鈦拉簧,正畸測力計測得力值為50 g并用0.25 mm正畸結扎絲結扎于固位溝中,將大鼠舌體牽出口外等待麻醉蘇醒后放回飼養籠,至此大鼠OTM模型建立完成。
于建模前1周復蘇hADSCs并進行傳代培養,取第3~4代細胞采用0.25%胰酶-0.04%EDTA消化后,用PBS重懸為濃度1×107個/mL的細胞懸液。建模后1、4、8、12 d,于右側上頜第1磨牙頰腭側黏膜轉折處,實驗組單次注射25 μL細胞懸液,對照組單次注射25 μL PBS。每天詳細檢查大鼠的加力裝置是否脫落,若有脫落立即重新安裝,直至處死大鼠。為降低大鼠因啃食較硬飼料時破壞正畸加力裝置導致脫落的風險,在整個建模期間對大鼠進行軟食喂養。
1.4 觀測指標
1.4.1 OTM距離測量
兩組于加力7、14 d時分別取10只大鼠,同上法麻醉后,去除其口內加力裝置,并按照建模時方法制取大鼠上頜骨加力后的上頜印模,然后灌制超硬石膏模型用于測量OTM距離。具體方法:將大鼠建模前和建模后所獲得的上頜石膏模型置于體式顯微鏡下,保持平面與觀測臺平行,通過Leica Application Suite V4測量軟件(精度設置為0.000 1 mm)測量右上頜第1磨牙與第2磨牙腭溝之間的距離。每個樣本由同一研究人員重復測量3次,取均值。
1.4.2 掃描電鏡觀察牙根形態及測量牙根吸收面積比
大鼠上頜取模完成后經腹腔注射過量水合氯醛處死,解剖分離上頜標本并收集其包含第1磨牙的上頜骨標本。取5只大鼠上頜骨標本剔除多余軟組織,修整組織塊,4%多聚甲醛固定,PBS清洗,5.25%次氯酸鈉溶液浸泡,去除牙根表面牙槽骨;剝離上頜第1磨牙,磨除其近中根、近中頰根和近中腭根,留下遠中頰根和遠中腭根;去除表面殘留的牙周膜,PBS清洗,40 ℃烘箱干燥。在牙根表面噴金鍍膜后掃描電鏡觀察,以未加力的左側上頜第1磨牙為參照,在45倍下以相同角度采集兩組右側上頜第1磨牙遠中根近中面圖像并觀察牙根表面形態。利用Image J軟件計算右上頜第1磨牙遠中根近中面吸收面積比,以根分叉為牙根上界水平,牙根吸收面積比=牙根吸收面積/牙根總面積。
1.4.3 HE染色觀察牙根吸收及牙周組織改建
取剩余5只大鼠上頜骨標本,4%多聚甲醛固定,PBS清洗,10%EDTA脫鈣后常規脫水浸蠟包埋,5 μm厚切片,脫蠟后行HE染色。以未加力的左側上頜第1磨牙為參照,觀察分析兩組大鼠右側上頜第1磨牙遠中頰根近中面(壓力側和張力側)牙根吸收情況和牙周組織改建,并通過測定遠中頰根的牙根吸收指數定量評估牙根吸收的嚴重程度。100倍顯微鏡下采集圖片,采用Image J軟件的面積測量工具分別在右上頜第1磨牙遠中頰根的牙根邊界及吸收邊界描點,測量并計算牙根吸收面積和牙根總面積,按以下公式計算牙根吸收指數:遠中頰根吸收面積/遠中頰根總面積。每個樣本選取3張切片,取3張切片計算的牙根吸收指數均值作為最終結果。
1.4.4 抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色計數破牙骨質細胞和破骨細胞
取未加力的左側上頜第1磨牙以及兩組大鼠右側上頜第1磨牙組織切片,于65 ℃恒溫箱中烘烤60 min,脫蠟水化,純水孵育,行TRAP染色觀察。200倍顯微鏡下在每張組織切片上選擇壓力側牙根和牙槽骨的4個視野采集圖像。由同一研究人員計數每個視野內的TRAP陽性細胞,位于吸收陷窩內或接近牙根表面的為破牙骨質細胞,位于牙根吸收側牙槽骨表面的為破骨細胞。取4個視野細胞數的均值作為此張切片最終計數;每個樣本選取3張切片進行計數,取3張切片均值作為該樣本的最終計數。
1.5 統計學方法
采用SPSS26.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據均數±標準差表示,組間和組內比較均采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 hADSCs 的分離、培養及鑒定
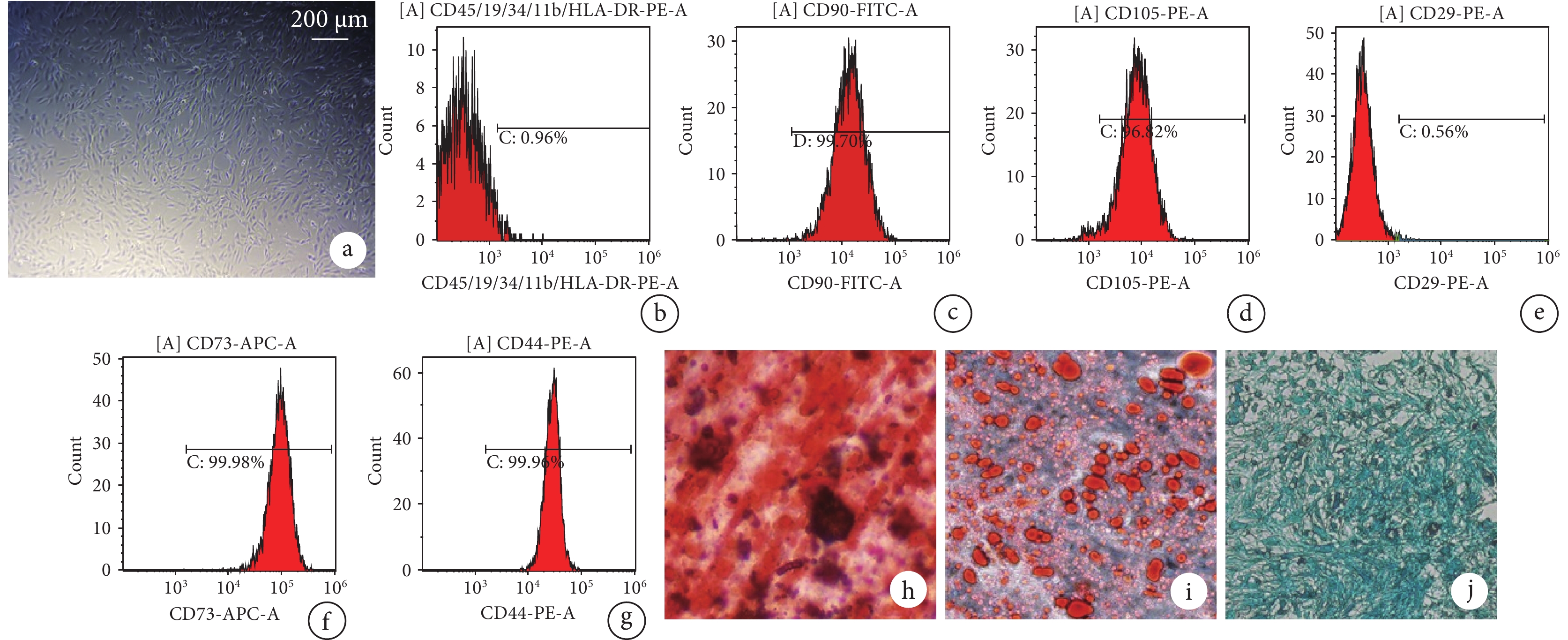
細胞復蘇24 h后可見少量細胞貼壁,呈短梭形;3 d后倒置相差顯微鏡下見細胞數量增多,大多數呈梭形和多角形且以集落或散在方式存在;6~7 d后鏡下見細胞融合至80%~90%左右,細胞形態為長梭形,成纖維細胞樣生長,呈“旋渦狀”,符合MSCs形態鑒定。
流式細胞儀檢測顯示細胞CD90、CD105、CD73、CD44表達呈陽性,CD29、CD45表達呈陰性。成骨誘導培養3周,茜素紅染色可見紅色鈣鹽結節;成脂誘導培養3周,油紅O染色示紅色串珠樣圓形脂滴;成軟骨誘導培養4周,阿利新藍染色見淡藍色酸性黏多糖。提示分離培養的細胞為hADSCs。見圖1。
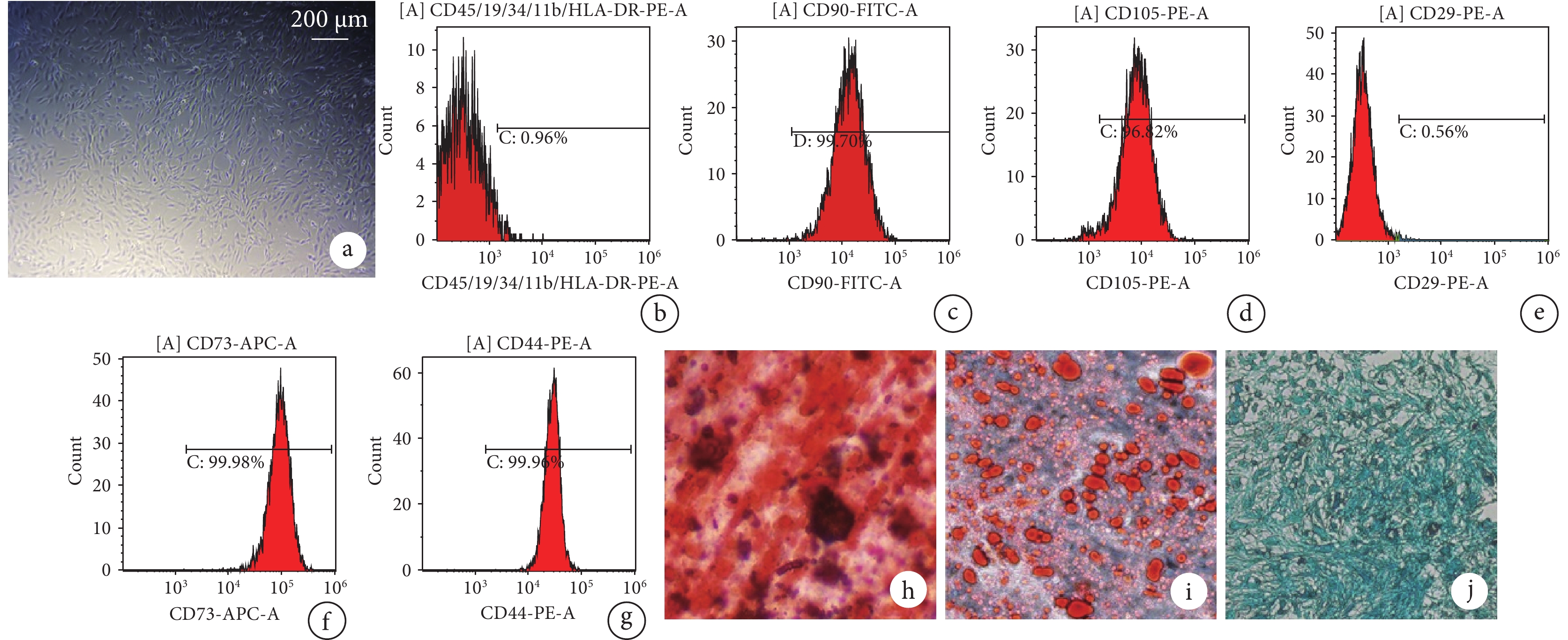 圖1
hADSCs 的分離、培養及鑒定
圖1
hADSCs 的分離、培養及鑒定
a. 細胞復蘇培養3 d(倒置相差顯微鏡×40);b~g. 流式細胞檢測(分別為CD90、CD105、CD73、CD44、CD29、CD45);h. 成骨誘導培養3周茜素紅染色(倒置相差顯微鏡×200);i. 成脂誘導培養3周油紅O染色(倒置相差顯微鏡×200);j. 成軟骨誘導培養4周阿利新藍染色(正置相差顯微鏡×200)
Figure1. Isolation, culture, and identification of hADSCsa. Cell resuscitation and culture for 3 days (Inverted phase contrast microscope×40); b-g. Flow cytometry detection (CD90, CD105, CD73, CD44, CD29, CD45, respectively); h. Alizarin red staining at 3 weeks after osteogenic induction(Inverted phase contrast microscope×200); i. Oil red O staining at 3 weeks after adipogenic induction (Inverted phase contrast microscope×200); j. Alcian blue staining at 4 weeks after chondrogenic induction (Inverted phase contrast microscope×200)
2.2 OTM距離測量
加力7、14 d兩組間OTM距離比較差無統計學意義(P>0.05);但兩組加力14 d時OTM距離均較7 d時顯著增加,差異有統計學意義(P<0.05),說明OTM距離隨加力時間延長而增大,造模成功。見表1。
 ±s)
Table1.
Comparison of each index between the experimental group and the control group after 7 and 14 days of force application (n=10,
±s)
Table1.
Comparison of each index between the experimental group and the control group after 7 and 14 days of force application (n=10,  ±s)
±s)
2.3 掃描電鏡觀察
掃描電鏡觀察示,大鼠左側上頜第1磨牙(未加力側)遠中根近中表面牙骨質完整,未見明顯陷窩。加力7 d,實驗組和對照組第1磨牙遠中根近中面出現不同程度吸收,兩組均可見小范圍、獨立散在的吸收陷窩,主要位于根頸1/3,實驗組吸收陷窩數較對照組少,陷窩范圍較對照組小;加力14 d,實驗組和對照組牙根吸收(表現為范圍較廣的片狀吸收區域)程度均較7 d時加重,實驗組吸收區域范圍較對照組小,吸收部位主要集中在牙根的頸1/3和中1/3,而對照組則擴展至根尖1/3。見圖2。
 圖2
上頜第1磨牙遠中根近中面掃描電鏡觀察(×45)
圖2
上頜第1磨牙遠中根近中面掃描電鏡觀察(×45)
a. 左側未加力側;b. 對照組(左)和實驗組(右)加力7 d(箭頭示吸收陷窩);c. 對照組(左)和實驗組(右)加力14 d(箭頭示吸收陷窩)
Figure2. Scanning electron microscope observation of the mesial surface of the distal root of the maxillary first molar (×45)a. The left side without force application; b. The control group (left) and the experimental group (right) applied force for 7 days (arrow showed the absorption lacuna); c. The control group (left) and the experimental group (right) applied force for 14 days (arrow showed the absorption lacuna)
加力7 d實驗組牙根吸收面積比較對照組小,但差異無統計學意義(P>0.05);加力14 d實驗組牙根吸收面積比顯著小于對照組,差異有統計學意義(P<0.05)。加力14 d兩組牙根吸收面積比均較7 d時顯著增加,差異有統計學意義(P<0.05)。見表1。
2.4 HE染色觀察
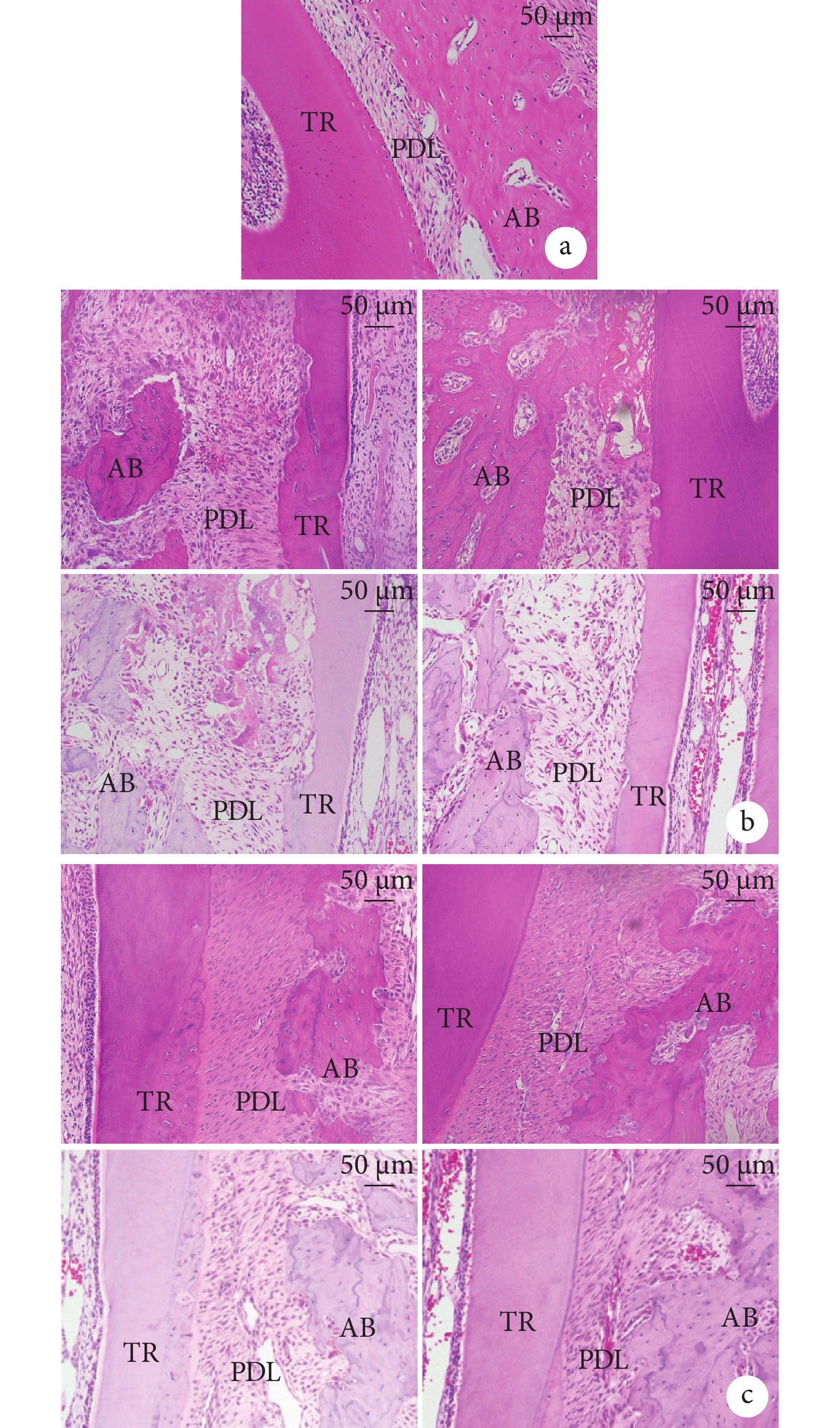
HE染色示,大鼠左側上頜第1磨牙(未加力側)牙根表面光滑,未見吸收陷窩,牙槽骨表面骨吸收陷窩少見,未見明顯破骨細胞,牙周膜纖維排列規則,無透明樣變區域。加力7 d,實驗組和對照組壓力側牙根均出現吸收陷窩,實驗組陷窩呈單個存在、吸收深度基本局限于牙骨質層,對照組呈吸收至牙本質淺層的小片狀吸收陷窩,實驗組牙根吸收范圍和深度較對照組小。加力14 d,兩組牙根吸收陷窩面積和深度較7 d時增加,融合成片狀,實驗組牙根吸收剛到達牙本質表層,牙周纖維排列變規則、牙周膜中的透明樣變區域基本消失;對照組牙根吸收超過牙本質表層,壓力側纖維排列仍比較紊亂,還可見透明樣變區域,牙槽骨吸收較實驗組明顯。見圖3a、b。
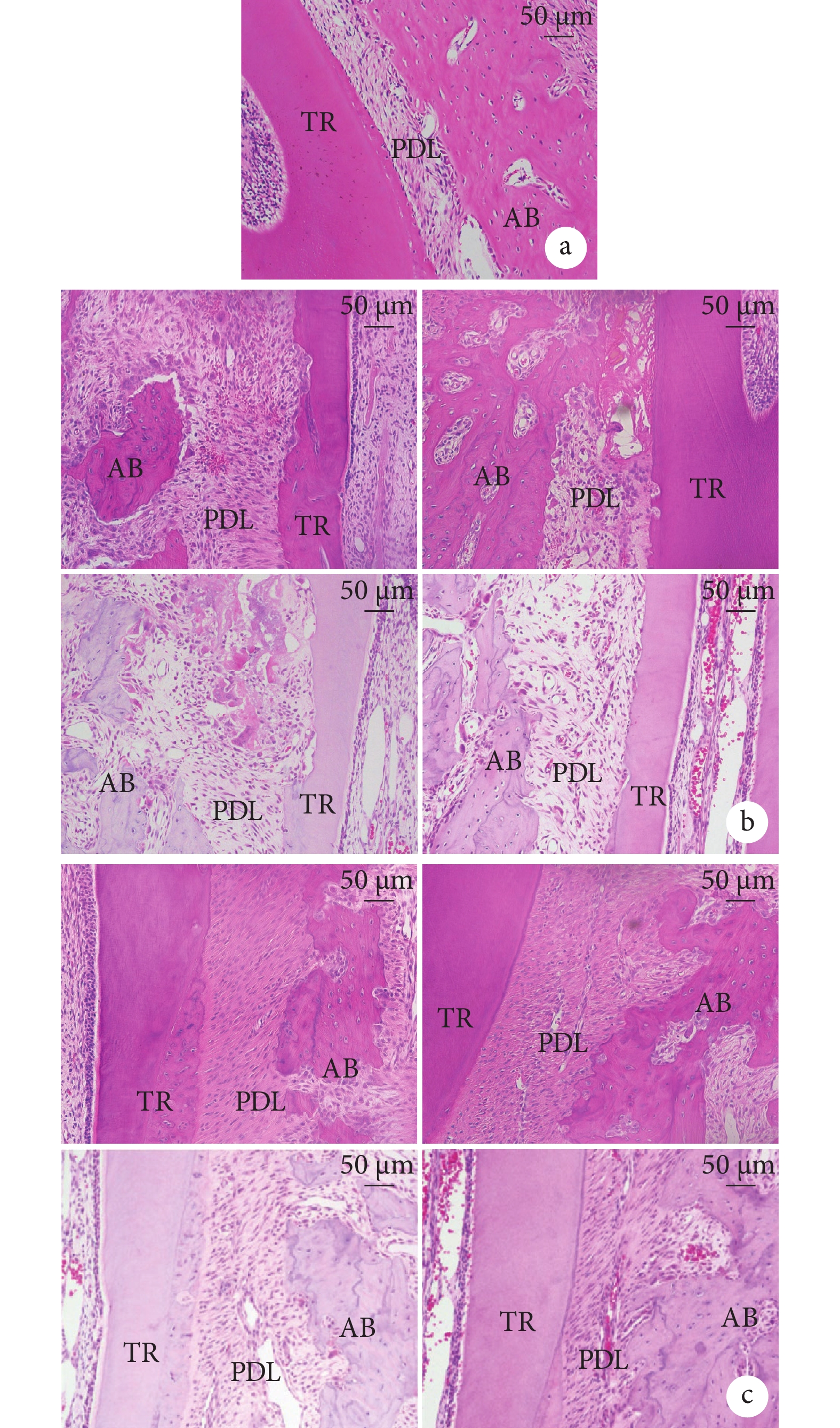 圖3
HE染色觀察(×200)
圖3
HE染色觀察(×200)
AB:牙槽骨 PDL:牙周膜 TR:牙根 a. 左側上頜第1磨牙牙周組織;b. 對照組(左)和實驗組(右)加力7 d(上)和14 d(下)壓力側牙根和牙周組織;c. 對照組(左)和實驗組(右)加力7 d(上)和14 d(下)張力側牙根和牙周組織
Figure3. HE staining observation (×200)AB: Alveolar bone PDL: Periodontal ligament TR: Tooth root a. Periodontal tissue of the left maxillary first molar; b. Root and periodontal tissue of the pressure side of the control group (left) and the experimental group (right) after 7 days (upper) and 14 days (lower) of force application; c. Root and periodontal tissue of the tension side of the control group (left) and the experimental group (right) for 7 days (upper) and 14 days (lower) of force application
加力7 d實驗組和對照組張力側牙周膜均被拉伸變寬,纖維排列變疏松和輕度不規則,牙槽骨未見新生骨組織。加力14 d,實驗組牙周膜較7 d時拉伸不明顯、寬度減小,纖維排列變緊密和規則;對照組牙周纖維排列較實驗組不規則,纖維細胞疏松排列;兩組牙槽骨表面未見明顯新骨形成。見圖3c。
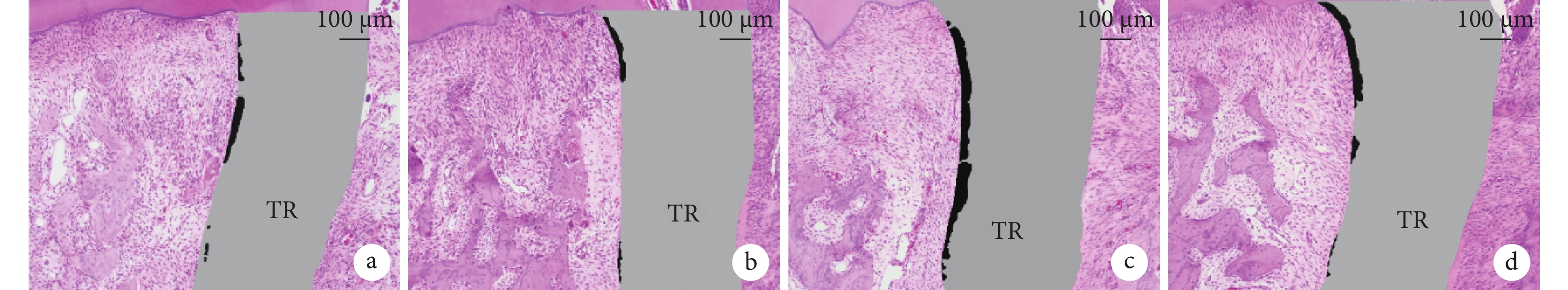
加力7 d實驗組牙根吸收指數較對照組小,但差異無統計學意義(P>0.05);加力14 d實驗組牙根吸收指數顯著小于對照組,差異有統計學意義(P<0.05)。加力14 d兩組牙根吸收指數均較7 d時顯著增加,差異有統計學意義(P<0.05)。見圖4,表1。
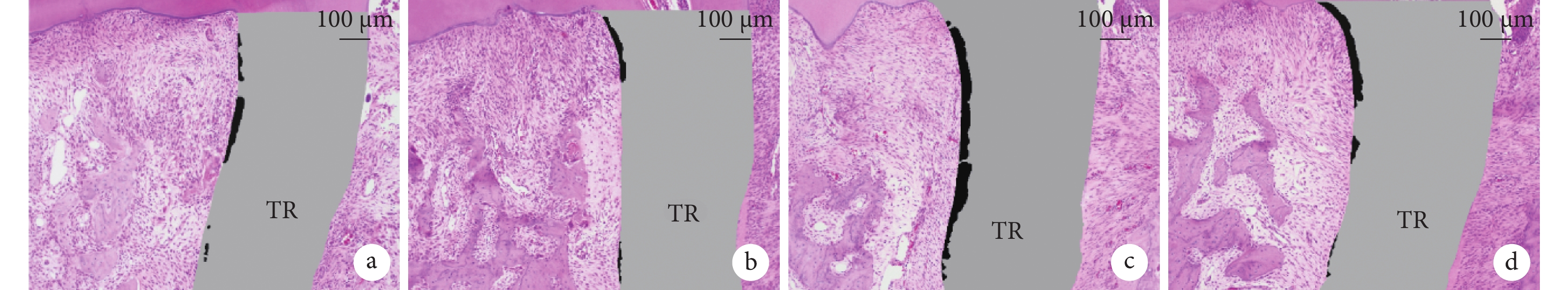 圖4
兩組壓力側牙根吸收指數計算示意圖(HE×100)
圖4
兩組壓力側牙根吸收指數計算示意圖(HE×100)
TR:牙根 黑色示牙根吸收區域,灰色示牙根未吸收區域 a. 對照組加力7 d;b. 實驗組加力7 d;c. 對照組加力14 d;d. 實驗組加力14 d
Figure4. Schematic diagram of calculation of root resorption index on the pressure side of the two groups (HE×100)TR: Tooth root Black area indicated the root resorption area, and gray area indicated the root non-resorption area a. The control group applied force for 7 days; b. The experimental group applied force for 7 days; c. The control group applied force for 14 days; d. The experimental group applied force for 14 days
2.5 TRAP染色觀察
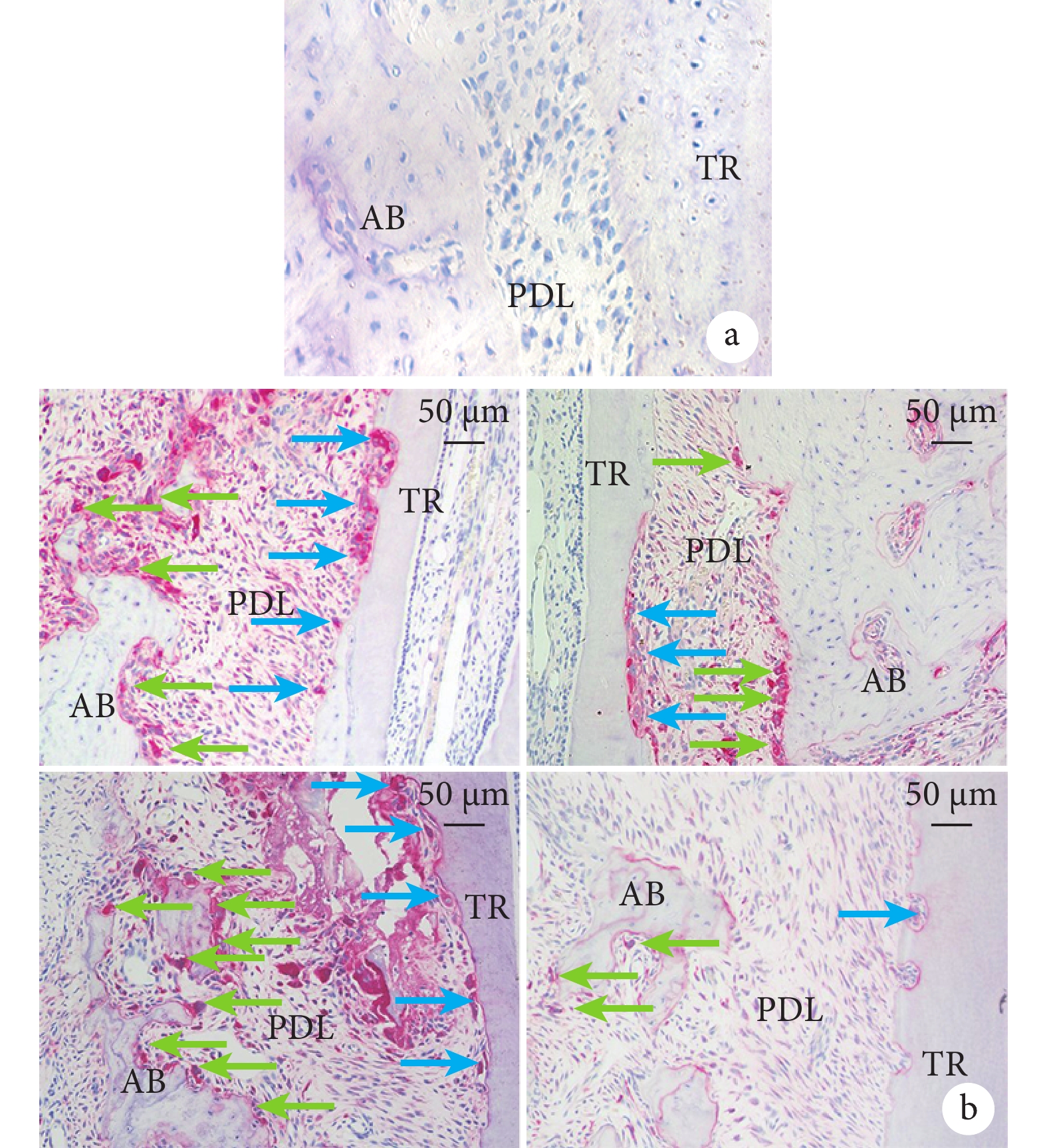
TRAP染色示,大鼠左側上頜第1磨牙(未加力側)遠中根近中面牙根表面未見破牙骨質細胞,牙槽骨表面未見破骨細胞。實驗組和對照組大鼠右側上頜第1磨牙遠中根近中面(壓力側)牙根和牙槽骨表面均出現TRAP陽性細胞。見圖5。
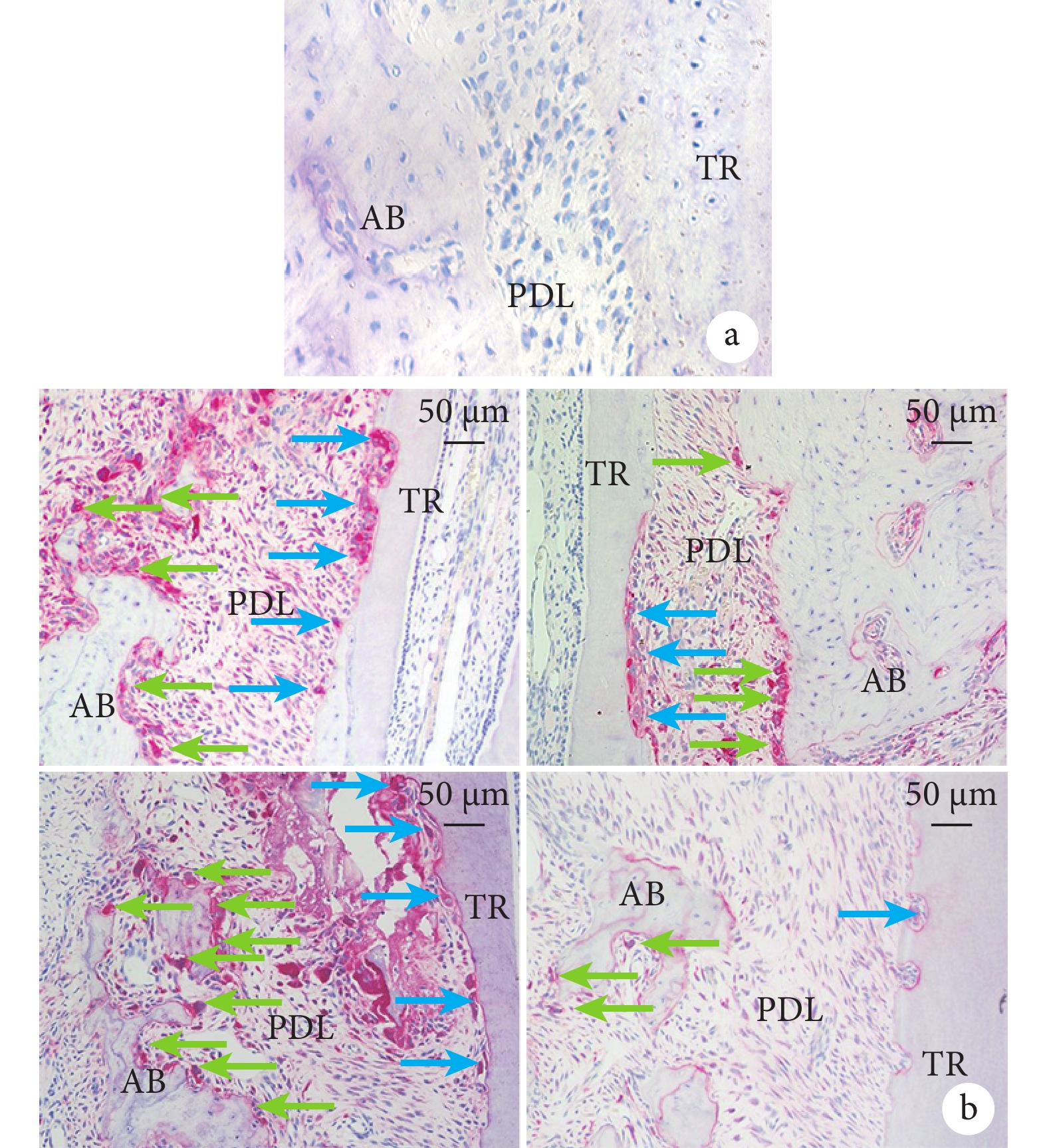 圖5
上頜第1磨牙牙根近中側TRAP染色觀察
圖5
上頜第1磨牙牙根近中側TRAP染色觀察
AB:牙槽骨 PDL:牙周膜 TR:牙根 a. 左側未加力側(×400);b. 對照組(左)和實驗組(右)加力7 d(上)和14 d(下)(×200) 藍箭頭示破牙骨質細胞,綠箭頭示破骨細胞
Figure5. TRAP staining observation of the mesial side of the root of the maxillary first molarAB: Alveolar bone PDL: Periodontal ligament TR: Tooth root a. Left unforced side (×400); b. The control group (left) and the experimental group (right) applied force for 7 days (upper) and 14 days (lower) (×200) Blue arrow showed the cementoclasts, green arrow showed the osteoclasts
加力7 d,實驗組和對照組牙根表面及吸收陷窩內均出現較多破牙骨質細胞和破骨細胞,實驗組破牙骨質細胞數量顯著少于對照組,差異有統計學意義(P<0.05);破骨細胞數量少于對照組,但差異無統計學意義(P>0.05)。加力14 d,實驗組破牙骨質細胞和破骨細胞數量均顯著少于對照組,差異有統計學意義(P<0.05)。組內比較示,加力14 d實驗組破牙骨質細胞數量較7 d時顯著減少,差異有統計學意義(P<0.05);破骨細胞較7 d時減少,但差異無統計學意義(P>0.05)。對照組破牙骨質細胞和破骨細胞數量均較7 d時減少,但差異無統計學意義(P>0.05)。見表1。
3 討論
近年有研究報道干細胞局部移植對OIRR有抑制或修復作用[16]。Amuk等[11]建立大鼠OTM模型,于加力期間在其牙周局部注射同種異體BMSCs,有效減少了大鼠牙根吸收陷窩數目和吸收面積比,增加了牙骨質的形成,減少了OIRR發生。隨后,該團隊繼續在大鼠上頜擴弓模型中注射同種異體內臟脂肪來源ADSCs,結果顯示大鼠磨牙牙根的吸收陷窩數目和體積同樣減少,牙骨質形成增加[12]。國內周建萍[13]在建立大鼠正畸牙根吸收模型后再注射hUSCs,發現注射細胞的大鼠牙根吸收體積較未注射細胞的大鼠顯著減小,認為hUSCs可促進移動性牙根吸收的修復。然而,迄今未檢索到皮下脂肪來源ADSCs局部移植對OIRR吸收的研究。皮下脂肪來源ADSCs含量更豐富且取材簡便,具有較強和較穩定的成骨分化潛能,是牙周改建最理想的種子細胞,更適用于OIRR的研究[17]。因此本研究選用hADSCs進行實驗,這是首次應用hADSCs局部移植抑制或修復OIRR的研究。
牙根吸收面積比主要是從頰舌向分析牙根整個近中面牙根吸收面積的大小,牙根吸收指數則是從近遠中向觀察牙根吸收面積大小,其測定由牙根的吸收長度和深度構成。牙根吸收面積比和牙根吸收指數可反映牙根吸收的嚴重程度[18]。本研究建立大鼠右側上頜第1磨牙近中OTM模型,通過掃描電鏡和HE染色觀察示加力14 d時,實驗組牙根吸收面積比及牙根吸收指數較對照組有統計學差異。而加力7 d時,實驗組大鼠牙根吸收面積比和牙根吸收指數雖然均較對照組小,但差異無統計學意義,這意味著早期hADSCs對OIRR的抑制作用并不明顯。目前在干細胞與OIRR的研究[11-13]中,觀察周期多為加力14 d或更多,加力7 d屬于牙根吸收早期階段,移植的hADSCs可能需要一定時間遷移或激活牙根吸收修復相關細胞,這可能是7 d時hADSCs抑制牙根吸收不明顯的原因。通常認為OIRR由破牙細胞和破骨細胞共同引起的[19]。破骨細胞激活可轉化為破牙細胞,破牙細胞包括破牙骨質細胞和破牙本細胞,但以破牙骨質細胞吸收牙根為主。因此破骨細胞和破牙骨質細胞的含量可用來評估牙根吸收嚴重程度[20]。本研究通過TRAP染色定量評估這兩種細胞在牙周組織中的數量,結果顯示加力14 d后實驗組兩種細胞數量較對照組顯著減少,與牙根吸收減少情況一致。加力7 d時,破牙骨質細胞數量較對照組顯著降低,但是牙根吸收卻無顯著減輕,這一結果可能與實驗組破骨細胞數量與對照組差異無統計學意義相關,因為破骨細胞數量也會影響牙根吸收的嚴重程度。同時,移植的hADSCs可能需要一定時間遷移到牙根吸收處,發揮自身作用及引發內源性細胞產生修復效應,因此在加力早期未顯示明顯治療作用。此外,本研究設計的加力7 d周期可能過短,下一步需要更長周期以獲得較為可靠的研究結果。
OTM的速率主要取決于破骨細胞的數量、活性及骨吸收過程[21]。本研究中,加力7、14 d的OTM距離顯示,與對照組相比,實驗組輕度減少了OTM距離,盡管這種差異不顯著,但不能排除hADSCs有減緩OTM的趨勢,因為移植的hADSCs減少了大鼠磨牙壓力側破骨細胞數量。該結果與Amuk等[11]的研究結論一致,他們發現移植到大鼠牙周組織的BMSCs在減少OIRR的同時,增加了牙周組織中骨吸收抑制因子骨保護素的表達,減少了破骨細胞生成,因此猜測移植的BMSCs可能會減慢牙移動[11]。然而,Amuk等的另一項研究[12]發現,移植到大鼠牙周組織的同種異體內臟脂肪來源ADSCs在減少牙根吸收的同時增加了磨牙在擴弓期間向頰側移動的距離,與本研究向大鼠移植異種異體hADSCs并未加速牙移動的結果不盡相同,可能與ADSCs來源、模型構建方式及OTM距離測量方式不同有關。因本研究主要是探討hADSCs對OIRR的影響,并未檢測骨吸收相關因子的表達,有必要進一步探究hADSCs對OTM速率的影響及機制。
綜上述,hADSCs 局部移植可能通過減少大鼠OTM過程中破牙骨質細胞和破骨細胞的數量來減小牙根吸收面積和深度,從而抑制OIRR。本研究存在一些局限:首先,hADSCs移植前并未對其進行熒光標記,未追蹤其轉歸情況;其次,本研究仍停留在形態學層面,未從分子生物學角度進一步闡明hADSCs的作用機制;最后,hADSCs通過具體哪些細胞因子發揮作用并不清楚。越來越多研究顯示干細胞局部移植后通過旁分泌細胞因子、外囊泡或外泌體等發揮治療作用[22],近年也有文獻報道USCs的外泌體局部移植可促進移動性牙根吸收修復,上調BMP-2、骨涎蛋白,誘導牙周細胞的增殖分化[23]。因此,我們猜測hADSCs局部移植后可能通過旁分泌各種細胞因子刺激宿主局部的修復細胞,啟動修復,從而發揮抑制OIRR的作用,具體作用機制還需要進一步探究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案(獲取hADSCs)經遵義醫科大學附屬口腔醫院倫理委員會批準(YJSKTLS-2020-2023-004H),患者均知情同意。所有動物實驗符合《實驗動物管理條例》和《實驗動物許可管理辦法》的規定,且獲遵義醫科大學實驗動物福利倫理委員會批準(ZMU21-2304-004);實驗動物使用許可證號:SYXK(黔)2021-0004
作者貢獻聲明 張疆弢:研究設計;張丹、楊春先:研究實施;胥鵬、唐娜娜、肖順娥:數據收集整理及統計分析;張丹:文章撰寫、經費支持;張疆弢:行政支持
正畸源性牙根吸收(orthodontically induced root resorption,OIRR)是正畸牙移動(orthodontic tooth movement,OTM)產生的常見并發癥,發生率高達80%[1]。OIRR分為輕度(根尖吸收長度<2 mm)、中度(根尖吸收長度>2 mm但小于原根長的1/3)和重度牙根吸收(根尖吸收長度>4 mm或大于原根長的1/3)[2]。重度牙根吸收發生概率高達14.5%,會引起牙髓炎、根尖周炎甚至牙齒松動脫落[3],給患者帶來額外的治療費用和痛苦。因此,如何減少或修復OIRR對正畸治療效果和延長患者牙齒保留時間至關重要。當前,OIRR的防治方法主要包括藥物治療和物理治療。藥物治療是全身或局部應用藥物如青藤堿和淫羊藿苷等[4-5],但其安全性不確切;物理治療包括機械振動[6]、激光[7]、超聲[8]和光生物調節治療[9]等,但其臨床有效性存在爭議[10]。因此,現有方法很難有效預防或修復OIRR,亟需尋找新的防治方法。
干細胞是一類具有自我更新和多系分化的原始細胞,已被廣泛應用于組織修復與再生領域。干細胞不僅可分化為成骨細胞再生牙骨質,還可減少炎癥因子環氧合酶2(cyclooxygenase-2,COX-2)的表達,抑制破骨活動以減少牙根吸收[11]。當前,用于防治OIRR的干細胞類型包括BMSCs[11]、內臟脂肪來源干細胞(adipose-derived stem cells,ADSCs)[12]和人尿源性干細胞(human urine-derived stem cells,hUSCs)[13]。然而,獲取BMSCs創傷較大,且來源并不豐富;獲取內臟ADSCs過程較為繁瑣,接受度不高;hUSCs含量較少,培養難度較高。迄今為止,尚未檢索到皮下脂肪來源ADSCs修復OIRR的文獻報道。人皮下脂肪來源ADSCs(human subcutaneous ADSCs,hADSCs)臨床來源于丟棄的抽吸脂肪,含量豐富、容易獲取,且具有低免疫原性。因此,本研究擬建立大鼠上頜第1磨牙OTM模型,并在牙周局部注射hADSCs,探究hADSCs對OIRR的影響及可能機制,為臨床應用hADSCs抑制OIRR提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
hADSCs由遵義醫科大學附屬醫院燒傷整形外科提供,來源于臨床抽脂塑形的求美者,患者均知情同意并通過倫理批準。8周齡雄性SD大鼠40只,體質量260~300 g,由遵義醫科大學動物中心提供。DMEM培養基、FBS(GIBCO公司,美國);成脂誘導分化培養基、成骨誘導培養基及成軟骨誘導培養基 [賽業(廣州)生物科技有限公司];37%磷酸酸蝕劑(3M公司,美國);美佳印彈性體印模材料(0型/3;(山東滬鴿口腔材料股份有限公司);正畸結扎絲(0.2 mm/0.25 mm;Heraeus Kulzer公司,德國);鎳鈦拉簧(0.010 in×6 mm;上海埃蒙迪材料科技有限公司)。全自動染色機(LEICA公司,德國);流式細胞儀(BD公司,美國);倒置相差顯微鏡(Olympus公司,日本);掃描電鏡(Hitachi公司,日本);正畸測力計(長沙天天齒科器材有限公司);體式顯微鏡(Leica公司,德國)。
1.2 hADSCs 的分離、培養及鑒定
參照文獻 [14] 方法分離培養hADSCs。將臨床獲取的脂肪組織加入PBS中,洗滌離心去除PBS后加入等體積0.1% Ⅰ型膠原蛋白酶,37 ℃震蕩消化1 h;150目網篩過濾后以800×g離心5 min;棄上清,加入含10%FBS、1%雙抗的DMEM培養液,重懸細胞,以5×105個/mL濃度接種至培養皿,置于37 ℃、5%CO2培養箱中培養。72 h后首次換液,之后每3天換液1次,待細胞生長融合至70%~80%,0.25%胰蛋白酶-EDTA消化傳代、凍存。培養期間于倒置相差顯微鏡下觀察細胞形態變化并行表型鑒定和誘導分化。① 表型鑒定:取第3代細胞,采用流式細胞儀檢測CD90、CD105、CD73、CD44、CD29及CD45表達。②誘導分化鑒定:取第3代細胞,分別采用成脂誘導分化培養基培養3周,行油紅O染色觀察成脂效果;成骨誘導培養基培養3周,行茜素紅染色觀察成骨效果;成軟骨誘導培養基誘導培養4周,行阿利新藍染色觀察成軟骨效果。
1.3 動物分組及模型制備
將適應性飼養1周后健康無異常的40只SD大鼠按照隨機數字表法分為實驗組和對照組,每組20只,對每只大鼠做好標記和記錄初始體質量。參照文獻[15]方法建立大鼠右側上頜第1磨牙近中牙OTM模型。待大鼠麻醉(4%異氟烷誘導麻醉,固定四肢后經鼻吸入2%異氟烷維持麻醉)生效后,將大鼠以仰臥式體位固定于自制固定板上。用提前制作的大鼠上頜個別托盤通過二次印模法制取大鼠上頜印模,超硬石膏灌制模型用于測量牙移動距離。然后在大鼠上頜2顆中切牙頸部用牙科打磨機磨出2條深約0.2 mm的固位溝,37%磷酸酸蝕劑酸蝕上頜切牙,棉球擦拭,隔濕吹干,小棉棒涂布黏接劑,光固化,3M固體樹脂于上頜切牙堆塑倒梯形樹脂結構(頸部寬、切緣窄),堆樹脂時注意勿使樹脂進入固位溝,倒梯形樹脂結構用于加強固位溝的固位作用。使用0.20 mm正畸結扎絲從右上頜第1磨牙和第2磨牙相鄰間隙穿過后結扎于第1磨牙近中,接著在右側上頜第1磨牙和雙側切牙之間安置正畸鎳鈦拉簧,正畸測力計測得力值為50 g并用0.25 mm正畸結扎絲結扎于固位溝中,將大鼠舌體牽出口外等待麻醉蘇醒后放回飼養籠,至此大鼠OTM模型建立完成。
于建模前1周復蘇hADSCs并進行傳代培養,取第3~4代細胞采用0.25%胰酶-0.04%EDTA消化后,用PBS重懸為濃度1×107個/mL的細胞懸液。建模后1、4、8、12 d,于右側上頜第1磨牙頰腭側黏膜轉折處,實驗組單次注射25 μL細胞懸液,對照組單次注射25 μL PBS。每天詳細檢查大鼠的加力裝置是否脫落,若有脫落立即重新安裝,直至處死大鼠。為降低大鼠因啃食較硬飼料時破壞正畸加力裝置導致脫落的風險,在整個建模期間對大鼠進行軟食喂養。
1.4 觀測指標
1.4.1 OTM距離測量
兩組于加力7、14 d時分別取10只大鼠,同上法麻醉后,去除其口內加力裝置,并按照建模時方法制取大鼠上頜骨加力后的上頜印模,然后灌制超硬石膏模型用于測量OTM距離。具體方法:將大鼠建模前和建模后所獲得的上頜石膏模型置于體式顯微鏡下,保持平面與觀測臺平行,通過Leica Application Suite V4測量軟件(精度設置為0.000 1 mm)測量右上頜第1磨牙與第2磨牙腭溝之間的距離。每個樣本由同一研究人員重復測量3次,取均值。
1.4.2 掃描電鏡觀察牙根形態及測量牙根吸收面積比
大鼠上頜取模完成后經腹腔注射過量水合氯醛處死,解剖分離上頜標本并收集其包含第1磨牙的上頜骨標本。取5只大鼠上頜骨標本剔除多余軟組織,修整組織塊,4%多聚甲醛固定,PBS清洗,5.25%次氯酸鈉溶液浸泡,去除牙根表面牙槽骨;剝離上頜第1磨牙,磨除其近中根、近中頰根和近中腭根,留下遠中頰根和遠中腭根;去除表面殘留的牙周膜,PBS清洗,40 ℃烘箱干燥。在牙根表面噴金鍍膜后掃描電鏡觀察,以未加力的左側上頜第1磨牙為參照,在45倍下以相同角度采集兩組右側上頜第1磨牙遠中根近中面圖像并觀察牙根表面形態。利用Image J軟件計算右上頜第1磨牙遠中根近中面吸收面積比,以根分叉為牙根上界水平,牙根吸收面積比=牙根吸收面積/牙根總面積。
1.4.3 HE染色觀察牙根吸收及牙周組織改建
取剩余5只大鼠上頜骨標本,4%多聚甲醛固定,PBS清洗,10%EDTA脫鈣后常規脫水浸蠟包埋,5 μm厚切片,脫蠟后行HE染色。以未加力的左側上頜第1磨牙為參照,觀察分析兩組大鼠右側上頜第1磨牙遠中頰根近中面(壓力側和張力側)牙根吸收情況和牙周組織改建,并通過測定遠中頰根的牙根吸收指數定量評估牙根吸收的嚴重程度。100倍顯微鏡下采集圖片,采用Image J軟件的面積測量工具分別在右上頜第1磨牙遠中頰根的牙根邊界及吸收邊界描點,測量并計算牙根吸收面積和牙根總面積,按以下公式計算牙根吸收指數:遠中頰根吸收面積/遠中頰根總面積。每個樣本選取3張切片,取3張切片計算的牙根吸收指數均值作為最終結果。
1.4.4 抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色計數破牙骨質細胞和破骨細胞
取未加力的左側上頜第1磨牙以及兩組大鼠右側上頜第1磨牙組織切片,于65 ℃恒溫箱中烘烤60 min,脫蠟水化,純水孵育,行TRAP染色觀察。200倍顯微鏡下在每張組織切片上選擇壓力側牙根和牙槽骨的4個視野采集圖像。由同一研究人員計數每個視野內的TRAP陽性細胞,位于吸收陷窩內或接近牙根表面的為破牙骨質細胞,位于牙根吸收側牙槽骨表面的為破骨細胞。取4個視野細胞數的均值作為此張切片最終計數;每個樣本選取3張切片進行計數,取3張切片均值作為該樣本的最終計數。
1.5 統計學方法
采用SPSS26.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據均數±標準差表示,組間和組內比較均采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 hADSCs 的分離、培養及鑒定
細胞復蘇24 h后可見少量細胞貼壁,呈短梭形;3 d后倒置相差顯微鏡下見細胞數量增多,大多數呈梭形和多角形且以集落或散在方式存在;6~7 d后鏡下見細胞融合至80%~90%左右,細胞形態為長梭形,成纖維細胞樣生長,呈“旋渦狀”,符合MSCs形態鑒定。
流式細胞儀檢測顯示細胞CD90、CD105、CD73、CD44表達呈陽性,CD29、CD45表達呈陰性。成骨誘導培養3周,茜素紅染色可見紅色鈣鹽結節;成脂誘導培養3周,油紅O染色示紅色串珠樣圓形脂滴;成軟骨誘導培養4周,阿利新藍染色見淡藍色酸性黏多糖。提示分離培養的細胞為hADSCs。見圖1。
 圖1
hADSCs 的分離、培養及鑒定
圖1
hADSCs 的分離、培養及鑒定
a. 細胞復蘇培養3 d(倒置相差顯微鏡×40);b~g. 流式細胞檢測(分別為CD90、CD105、CD73、CD44、CD29、CD45);h. 成骨誘導培養3周茜素紅染色(倒置相差顯微鏡×200);i. 成脂誘導培養3周油紅O染色(倒置相差顯微鏡×200);j. 成軟骨誘導培養4周阿利新藍染色(正置相差顯微鏡×200)
Figure1. Isolation, culture, and identification of hADSCsa. Cell resuscitation and culture for 3 days (Inverted phase contrast microscope×40); b-g. Flow cytometry detection (CD90, CD105, CD73, CD44, CD29, CD45, respectively); h. Alizarin red staining at 3 weeks after osteogenic induction(Inverted phase contrast microscope×200); i. Oil red O staining at 3 weeks after adipogenic induction (Inverted phase contrast microscope×200); j. Alcian blue staining at 4 weeks after chondrogenic induction (Inverted phase contrast microscope×200)
2.2 OTM距離測量
加力7、14 d兩組間OTM距離比較差無統計學意義(P>0.05);但兩組加力14 d時OTM距離均較7 d時顯著增加,差異有統計學意義(P<0.05),說明OTM距離隨加力時間延長而增大,造模成功。見表1。
 ±s)
Table1.
Comparison of each index between the experimental group and the control group after 7 and 14 days of force application (n=10,
±s)
Table1.
Comparison of each index between the experimental group and the control group after 7 and 14 days of force application (n=10,  ±s)
±s)
2.3 掃描電鏡觀察
掃描電鏡觀察示,大鼠左側上頜第1磨牙(未加力側)遠中根近中表面牙骨質完整,未見明顯陷窩。加力7 d,實驗組和對照組第1磨牙遠中根近中面出現不同程度吸收,兩組均可見小范圍、獨立散在的吸收陷窩,主要位于根頸1/3,實驗組吸收陷窩數較對照組少,陷窩范圍較對照組小;加力14 d,實驗組和對照組牙根吸收(表現為范圍較廣的片狀吸收區域)程度均較7 d時加重,實驗組吸收區域范圍較對照組小,吸收部位主要集中在牙根的頸1/3和中1/3,而對照組則擴展至根尖1/3。見圖2。
 圖2
上頜第1磨牙遠中根近中面掃描電鏡觀察(×45)
圖2
上頜第1磨牙遠中根近中面掃描電鏡觀察(×45)
a. 左側未加力側;b. 對照組(左)和實驗組(右)加力7 d(箭頭示吸收陷窩);c. 對照組(左)和實驗組(右)加力14 d(箭頭示吸收陷窩)
Figure2. Scanning electron microscope observation of the mesial surface of the distal root of the maxillary first molar (×45)a. The left side without force application; b. The control group (left) and the experimental group (right) applied force for 7 days (arrow showed the absorption lacuna); c. The control group (left) and the experimental group (right) applied force for 14 days (arrow showed the absorption lacuna)
加力7 d實驗組牙根吸收面積比較對照組小,但差異無統計學意義(P>0.05);加力14 d實驗組牙根吸收面積比顯著小于對照組,差異有統計學意義(P<0.05)。加力14 d兩組牙根吸收面積比均較7 d時顯著增加,差異有統計學意義(P<0.05)。見表1。
2.4 HE染色觀察
HE染色示,大鼠左側上頜第1磨牙(未加力側)牙根表面光滑,未見吸收陷窩,牙槽骨表面骨吸收陷窩少見,未見明顯破骨細胞,牙周膜纖維排列規則,無透明樣變區域。加力7 d,實驗組和對照組壓力側牙根均出現吸收陷窩,實驗組陷窩呈單個存在、吸收深度基本局限于牙骨質層,對照組呈吸收至牙本質淺層的小片狀吸收陷窩,實驗組牙根吸收范圍和深度較對照組小。加力14 d,兩組牙根吸收陷窩面積和深度較7 d時增加,融合成片狀,實驗組牙根吸收剛到達牙本質表層,牙周纖維排列變規則、牙周膜中的透明樣變區域基本消失;對照組牙根吸收超過牙本質表層,壓力側纖維排列仍比較紊亂,還可見透明樣變區域,牙槽骨吸收較實驗組明顯。見圖3a、b。
 圖3
HE染色觀察(×200)
圖3
HE染色觀察(×200)
AB:牙槽骨 PDL:牙周膜 TR:牙根 a. 左側上頜第1磨牙牙周組織;b. 對照組(左)和實驗組(右)加力7 d(上)和14 d(下)壓力側牙根和牙周組織;c. 對照組(左)和實驗組(右)加力7 d(上)和14 d(下)張力側牙根和牙周組織
Figure3. HE staining observation (×200)AB: Alveolar bone PDL: Periodontal ligament TR: Tooth root a. Periodontal tissue of the left maxillary first molar; b. Root and periodontal tissue of the pressure side of the control group (left) and the experimental group (right) after 7 days (upper) and 14 days (lower) of force application; c. Root and periodontal tissue of the tension side of the control group (left) and the experimental group (right) for 7 days (upper) and 14 days (lower) of force application
加力7 d實驗組和對照組張力側牙周膜均被拉伸變寬,纖維排列變疏松和輕度不規則,牙槽骨未見新生骨組織。加力14 d,實驗組牙周膜較7 d時拉伸不明顯、寬度減小,纖維排列變緊密和規則;對照組牙周纖維排列較實驗組不規則,纖維細胞疏松排列;兩組牙槽骨表面未見明顯新骨形成。見圖3c。
加力7 d實驗組牙根吸收指數較對照組小,但差異無統計學意義(P>0.05);加力14 d實驗組牙根吸收指數顯著小于對照組,差異有統計學意義(P<0.05)。加力14 d兩組牙根吸收指數均較7 d時顯著增加,差異有統計學意義(P<0.05)。見圖4,表1。
 圖4
兩組壓力側牙根吸收指數計算示意圖(HE×100)
圖4
兩組壓力側牙根吸收指數計算示意圖(HE×100)
TR:牙根 黑色示牙根吸收區域,灰色示牙根未吸收區域 a. 對照組加力7 d;b. 實驗組加力7 d;c. 對照組加力14 d;d. 實驗組加力14 d
Figure4. Schematic diagram of calculation of root resorption index on the pressure side of the two groups (HE×100)TR: Tooth root Black area indicated the root resorption area, and gray area indicated the root non-resorption area a. The control group applied force for 7 days; b. The experimental group applied force for 7 days; c. The control group applied force for 14 days; d. The experimental group applied force for 14 days
2.5 TRAP染色觀察
TRAP染色示,大鼠左側上頜第1磨牙(未加力側)遠中根近中面牙根表面未見破牙骨質細胞,牙槽骨表面未見破骨細胞。實驗組和對照組大鼠右側上頜第1磨牙遠中根近中面(壓力側)牙根和牙槽骨表面均出現TRAP陽性細胞。見圖5。
 圖5
上頜第1磨牙牙根近中側TRAP染色觀察
圖5
上頜第1磨牙牙根近中側TRAP染色觀察
AB:牙槽骨 PDL:牙周膜 TR:牙根 a. 左側未加力側(×400);b. 對照組(左)和實驗組(右)加力7 d(上)和14 d(下)(×200) 藍箭頭示破牙骨質細胞,綠箭頭示破骨細胞
Figure5. TRAP staining observation of the mesial side of the root of the maxillary first molarAB: Alveolar bone PDL: Periodontal ligament TR: Tooth root a. Left unforced side (×400); b. The control group (left) and the experimental group (right) applied force for 7 days (upper) and 14 days (lower) (×200) Blue arrow showed the cementoclasts, green arrow showed the osteoclasts
加力7 d,實驗組和對照組牙根表面及吸收陷窩內均出現較多破牙骨質細胞和破骨細胞,實驗組破牙骨質細胞數量顯著少于對照組,差異有統計學意義(P<0.05);破骨細胞數量少于對照組,但差異無統計學意義(P>0.05)。加力14 d,實驗組破牙骨質細胞和破骨細胞數量均顯著少于對照組,差異有統計學意義(P<0.05)。組內比較示,加力14 d實驗組破牙骨質細胞數量較7 d時顯著減少,差異有統計學意義(P<0.05);破骨細胞較7 d時減少,但差異無統計學意義(P>0.05)。對照組破牙骨質細胞和破骨細胞數量均較7 d時減少,但差異無統計學意義(P>0.05)。見表1。
3 討論
近年有研究報道干細胞局部移植對OIRR有抑制或修復作用[16]。Amuk等[11]建立大鼠OTM模型,于加力期間在其牙周局部注射同種異體BMSCs,有效減少了大鼠牙根吸收陷窩數目和吸收面積比,增加了牙骨質的形成,減少了OIRR發生。隨后,該團隊繼續在大鼠上頜擴弓模型中注射同種異體內臟脂肪來源ADSCs,結果顯示大鼠磨牙牙根的吸收陷窩數目和體積同樣減少,牙骨質形成增加[12]。國內周建萍[13]在建立大鼠正畸牙根吸收模型后再注射hUSCs,發現注射細胞的大鼠牙根吸收體積較未注射細胞的大鼠顯著減小,認為hUSCs可促進移動性牙根吸收的修復。然而,迄今未檢索到皮下脂肪來源ADSCs局部移植對OIRR吸收的研究。皮下脂肪來源ADSCs含量更豐富且取材簡便,具有較強和較穩定的成骨分化潛能,是牙周改建最理想的種子細胞,更適用于OIRR的研究[17]。因此本研究選用hADSCs進行實驗,這是首次應用hADSCs局部移植抑制或修復OIRR的研究。
牙根吸收面積比主要是從頰舌向分析牙根整個近中面牙根吸收面積的大小,牙根吸收指數則是從近遠中向觀察牙根吸收面積大小,其測定由牙根的吸收長度和深度構成。牙根吸收面積比和牙根吸收指數可反映牙根吸收的嚴重程度[18]。本研究建立大鼠右側上頜第1磨牙近中OTM模型,通過掃描電鏡和HE染色觀察示加力14 d時,實驗組牙根吸收面積比及牙根吸收指數較對照組有統計學差異。而加力7 d時,實驗組大鼠牙根吸收面積比和牙根吸收指數雖然均較對照組小,但差異無統計學意義,這意味著早期hADSCs對OIRR的抑制作用并不明顯。目前在干細胞與OIRR的研究[11-13]中,觀察周期多為加力14 d或更多,加力7 d屬于牙根吸收早期階段,移植的hADSCs可能需要一定時間遷移或激活牙根吸收修復相關細胞,這可能是7 d時hADSCs抑制牙根吸收不明顯的原因。通常認為OIRR由破牙細胞和破骨細胞共同引起的[19]。破骨細胞激活可轉化為破牙細胞,破牙細胞包括破牙骨質細胞和破牙本細胞,但以破牙骨質細胞吸收牙根為主。因此破骨細胞和破牙骨質細胞的含量可用來評估牙根吸收嚴重程度[20]。本研究通過TRAP染色定量評估這兩種細胞在牙周組織中的數量,結果顯示加力14 d后實驗組兩種細胞數量較對照組顯著減少,與牙根吸收減少情況一致。加力7 d時,破牙骨質細胞數量較對照組顯著降低,但是牙根吸收卻無顯著減輕,這一結果可能與實驗組破骨細胞數量與對照組差異無統計學意義相關,因為破骨細胞數量也會影響牙根吸收的嚴重程度。同時,移植的hADSCs可能需要一定時間遷移到牙根吸收處,發揮自身作用及引發內源性細胞產生修復效應,因此在加力早期未顯示明顯治療作用。此外,本研究設計的加力7 d周期可能過短,下一步需要更長周期以獲得較為可靠的研究結果。
OTM的速率主要取決于破骨細胞的數量、活性及骨吸收過程[21]。本研究中,加力7、14 d的OTM距離顯示,與對照組相比,實驗組輕度減少了OTM距離,盡管這種差異不顯著,但不能排除hADSCs有減緩OTM的趨勢,因為移植的hADSCs減少了大鼠磨牙壓力側破骨細胞數量。該結果與Amuk等[11]的研究結論一致,他們發現移植到大鼠牙周組織的BMSCs在減少OIRR的同時,增加了牙周組織中骨吸收抑制因子骨保護素的表達,減少了破骨細胞生成,因此猜測移植的BMSCs可能會減慢牙移動[11]。然而,Amuk等的另一項研究[12]發現,移植到大鼠牙周組織的同種異體內臟脂肪來源ADSCs在減少牙根吸收的同時增加了磨牙在擴弓期間向頰側移動的距離,與本研究向大鼠移植異種異體hADSCs并未加速牙移動的結果不盡相同,可能與ADSCs來源、模型構建方式及OTM距離測量方式不同有關。因本研究主要是探討hADSCs對OIRR的影響,并未檢測骨吸收相關因子的表達,有必要進一步探究hADSCs對OTM速率的影響及機制。
綜上述,hADSCs 局部移植可能通過減少大鼠OTM過程中破牙骨質細胞和破骨細胞的數量來減小牙根吸收面積和深度,從而抑制OIRR。本研究存在一些局限:首先,hADSCs移植前并未對其進行熒光標記,未追蹤其轉歸情況;其次,本研究仍停留在形態學層面,未從分子生物學角度進一步闡明hADSCs的作用機制;最后,hADSCs通過具體哪些細胞因子發揮作用并不清楚。越來越多研究顯示干細胞局部移植后通過旁分泌細胞因子、外囊泡或外泌體等發揮治療作用[22],近年也有文獻報道USCs的外泌體局部移植可促進移動性牙根吸收修復,上調BMP-2、骨涎蛋白,誘導牙周細胞的增殖分化[23]。因此,我們猜測hADSCs局部移植后可能通過旁分泌各種細胞因子刺激宿主局部的修復細胞,啟動修復,從而發揮抑制OIRR的作用,具體作用機制還需要進一步探究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案(獲取hADSCs)經遵義醫科大學附屬口腔醫院倫理委員會批準(YJSKTLS-2020-2023-004H),患者均知情同意。所有動物實驗符合《實驗動物管理條例》和《實驗動物許可管理辦法》的規定,且獲遵義醫科大學實驗動物福利倫理委員會批準(ZMU21-2304-004);實驗動物使用許可證號:SYXK(黔)2021-0004
作者貢獻聲明 張疆弢:研究設計;張丹、楊春先:研究實施;胥鵬、唐娜娜、肖順娥:數據收集整理及統計分析;張丹:文章撰寫、經費支持;張疆弢:行政支持