引用本文: 劉源欣, 付來華, 劉昊天, 張耕溥, 肖婉祎, 高梓唯, 張洪亮, 楊吉龍. 惡性周圍神經鞘瘤中細胞周期蛋白依賴性激酶1的表達及其臨床意義. 中國修復重建外科雜志, 2024, 38(10): 1220-1228. doi: 10.7507/1002-1892.202406090 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
惡性周圍神經鞘瘤(malignant peripheral nerve sheath tumor,MPNST)是一種罕見且具有高度侵襲性的軟組織肉瘤,起源于周圍神經或其鞘膜,多見于20~50歲人群,占所有軟組織肉瘤的5%~10%。該腫瘤的發病與Ⅰ型神經纖維瘤病(neurofibromatosis type 1,NF1)密切相關,約50% MPNST患者發生于NF1患者中。MPNST具有高度惡性特性,易復發和轉移,預后較差。盡管手術切除是主要治療手段,但由于腫瘤的侵襲性和復雜的生物學行為,臨床治療效果有限。
MPNST的相關基因組學分析研究表明,NF1雙等位基因的功能性缺失和RAS基因異常激活、CDKN2A基因組位點的雜合性缺失是MPNST細胞發生中上游突變的關鍵環節[1]。細胞周期蛋白依賴性激酶1(cell-cycle dependent kinase 1,CDK1)作為一種參與調控細胞增殖和遷移、炎癥反應、免疫應激的關鍵因子,已逐漸被國內外學者關注[2]。CDK1作為細胞周期的核心調控因子,其異常表達與多種癌癥的發生、發展密切相關,如在乳腺癌、肺癌和胃癌中CDK1為高表達狀態,且與腫瘤細胞增殖加快、侵襲性增強和患者預后較差相關[3-4]。
為了研究CDK1在MPNST中的分子生物學特性以及其臨床意義,本研究對來自天津市腫瘤醫院的MPNST樣本和正常組織樣本進行了轉錄組測序,并結合外部數據集進行生物信息學分析,進一步利用免疫組織化學染色分析CDK1蛋白在MPNST組織中的表達情況,為臨床治療策略提供新的方向。
1 資料與方法
1.1 研究對象
選取2011年9月—2020年3月于天津市腫瘤醫院接受手術切除治療,并經組織學、病理學證實的56例MPNST患者腫瘤樣本及17例正常組織樣本(同一MPNST患者距離腫瘤邊緣5 cm以上的非腫瘤組織)作為研究對象。其中男32例,女24例;年齡12~82歲,平均51歲。病變位于四肢22例,頭頸部1例,軀干14例,內臟7例,其他部位10例。患者入院時39例為原發病灶,17例為復發病灶。其中NF1型患者12例(21.4%)。腫瘤為單發42例,多發14例;腫瘤最大徑2.0~18.0 cm,平均7.1 cm,其中<5 cm 21例,5~10 cm 26例,>10 cm 9例。術后復發12例(21.4%),遠處轉移(遠隔部位皮膚、軟組織、器官的轉移和/或非區域淋巴結轉移)13例(23.2%);接受化療23例,放療13例。將切除后的腫瘤和正常組織置入–196℃超低溫液氮罐凍存。
1.2 轉錄組測序及生物信息學分析
1.2.1 轉錄組測序
取56例MPNST患者的冷凍組織和17例正常組織樣本,采用Trizol試劑(Invitrogen公司,美國)提取RNA,按照MGlEasy mRNA文庫試劑盒(深圳華大智造科技股份有限公司)方法構建mRNA文庫,在DNBSEO-G400測序儀(深圳華大智造科技股份有限公司)上對PE150循環的mRNA文庫進行測序。使用子讀取對齊器將讀段與人類參考基因組 (GRCh38) 進行比對,在計算機R studio軟件中利用edgeR R包對RNA讀取計數進行歸一化,將每個RNA的表達轉化為每千個堿基的轉錄每百萬映射讀取的轉錄本,并將56例患者轉錄組測序得到的基因集和基因表達矩陣命名為“Tianjin”數據集[5]。
1.2.2 基因表達綜合數據庫(Gene Expression Omnibus database,GEO)、癌癥基因組圖譜(the cancer genome atlas,TCGA)數據庫檢索
檢索GEO,共得到4個包含較大MPNST樣本量的轉錄組測序數據集,分別為GSE141438 RNA測序 [7例MPNST,7例正常,3例神經纖維瘤(neurofibromatosis,NF)]、GSE145064 RNA測序 [25例MPNST,21例叢狀神經纖維瘤(plexiform neurofibromas,PNF)]、GSE140987 MicroRNA(10例散發,9例PNF,9例MPNST)、GSE66743芯片(30例MPNST,8例NF)。TCGA數據庫中,根據組織來源不同,檢索得到包含脂肪肉瘤、平滑肌肉瘤、未分化多形性肉瘤、黏液纖維肉瘤、MPNST和滑膜肉瘤等肉瘤亞型共計263例肉瘤樣本及2例正常組織樣本相關信息。
1.2.3 基因集變異分析(gene set variation analysis,GSVA)及基因富集分析(gene set enrichment analysis,GSEA)
使用GSVA包(v1.34.0)和R中的pheatmap包(v1.0.12)對Tianjin和GSE141438數據集進行GSVA和GSEA分析,篩選轉錄水平表達升高的通路。并對篩選得到的通路取交集,得到差異表達基因。
1.2.4 蛋白間互作網絡(Protein-Protein interaction networks,PPI)構建及Cytoscape軟件可視化
使用STRING 11.5數據庫(https://string-db.org/)預測通路分析得到的差異基因編碼PPI。設置“minimum required interaction score”為0.4。利用Cytoscape v3.7.0軟件(NDEX公司,美國)將上述結果可視化。
1.3 差異表達分析
根據TCGA數據庫中的肉瘤及正常組織樣本轉錄組測序數據,分析CDK1 mRNA在肉瘤與正常組織中的表達差異。選擇包含生存信息的Tianjin數據集和GSE141438數據集,分析CDK1 mRNA在MPNST與正常組織中的表達水平差異。進一步分析GSE66743、GSE145064數據集中CDK1 mRNA在MPNST與NF組織和PNF組織表達水平差異。利用TCGA、Tianjin、GSE66743和GSE145064這4個數據集對比其他CDK家族成員(CDK2~8)在MPNST與正常組織、NF組織、PNF組織中的mRNA表達水平。
1.4 免疫組織化學染色觀察
取56例MPNST患者組織樣本,經甲醛固定、石蠟包埋后構建組織微矩陣(經病理科專業醫師再次確認并核對病理結果后,標記典型腫瘤區域進行組織芯片制作)。按常規方法行CDK1免疫組織化學染色,從每個組織中隨機挑選10個視野,根據免疫組織化學染色結果評分標準[6],對每個視野中的CDK1陽性細胞進行計數。實驗采用雙盲法,由至少2名病理學專家進行評定。并計算CDK1蛋白表達率,公式:CDK1陽性細胞數/腫瘤細胞總數×100%。
1.5 生存分析及生存風險評估
根據CDK1 mRNA在病變組織中表達的中位值將患者分為低表達組和高表達組;根據56例MPNST患者組織微矩陣免疫組織化學染色結果將患者分為CDK1蛋白陽性(CDK1-positive)組與CDK1蛋白陰性(CDK1-negative)組;通過Kaplan-Meier生存分析及Log-rank檢驗比較組間患者生存差異,并繪制患者Kaplan-Meier生存曲線。
1.6 統計學方法
采用R studio、R 4.2.2軟件及SPSS25.0、GraphPad Prism 8軟件進行統計分析和繪圖,利用Cytoscape v3.7.0軟件進行PPI結果可視化。計量資料經正態性檢驗,符合正態分布的數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;不符合正態分布的數據以M(Q1,Q3)表示,組間比較采用Wilcoxon秩和檢驗。檢驗水準取雙側α=0.05。
2 結果
2.1 CDK1 為篩選得到的樞紐基因
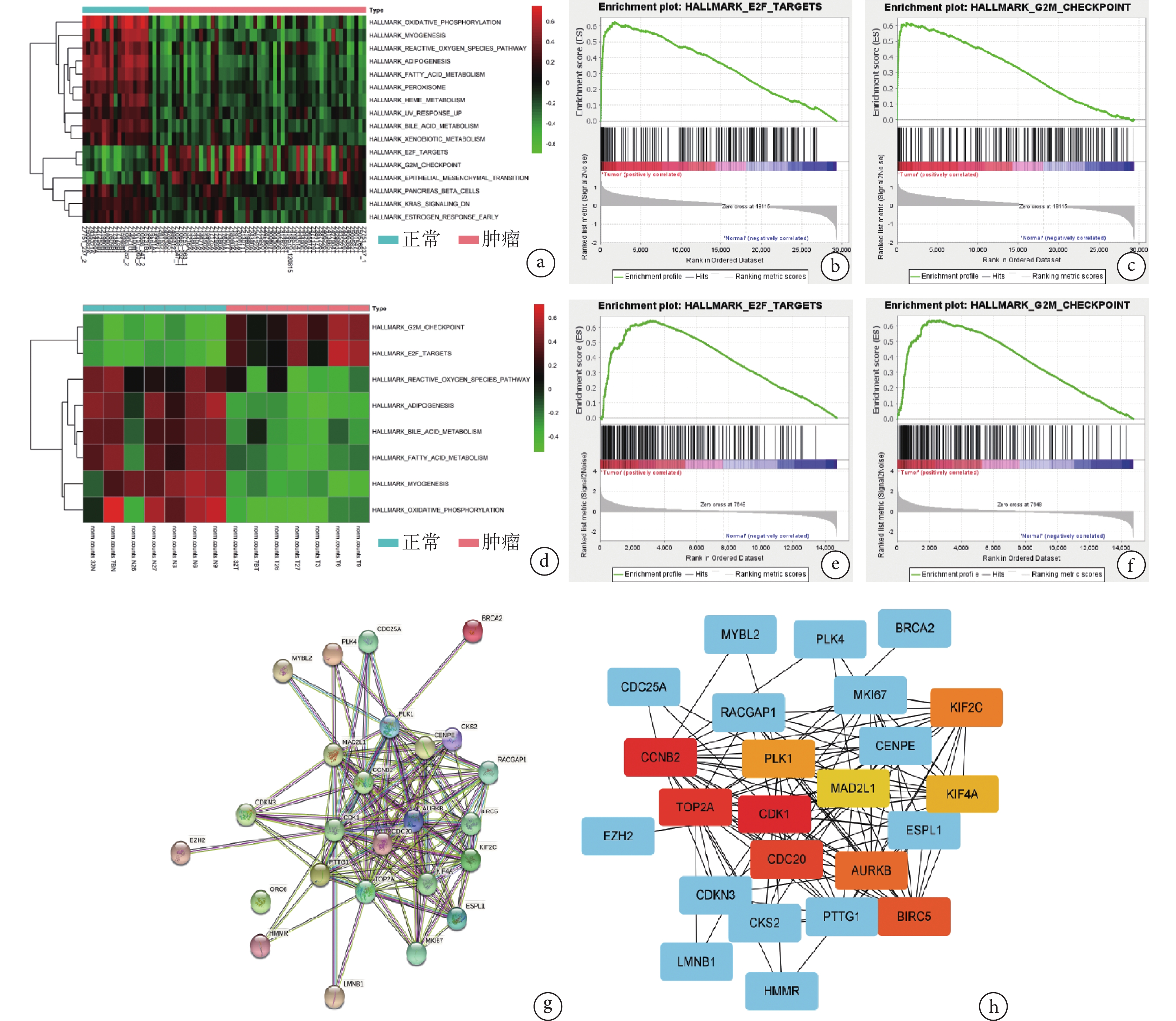
對Tianjin數據集轉錄組測序結果通路分析,GSVA分析發現相較于正常組織,MPNST中表達升高的基因在E2F、G2M、EMT 3條通路顯著富集。GSEA分析同樣發現,與正常組織相比,MPNST表達升高的基因在E2F、G2M、EMT 3條通路顯著富集。見圖1a~c。通過分析GSE141438數據集,GSVA、GSEA均發現轉錄水平表達升高的基因在E2F和G2M 2條通路顯著富集。見圖1d~f。
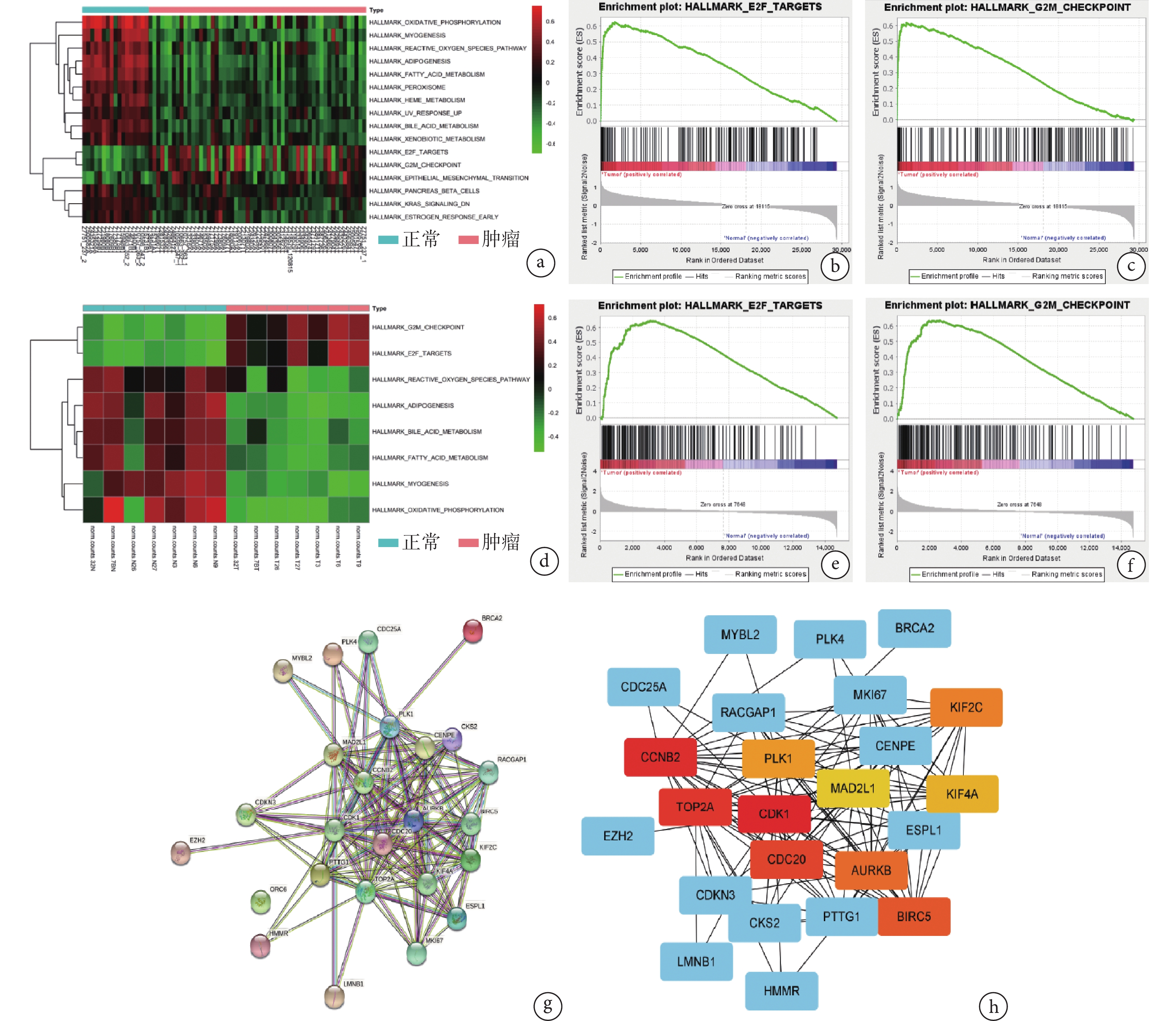 圖1
CDK1 mRNA表達水平檢測
圖1
CDK1 mRNA表達水平檢測
a. 聚類熱圖示Tianjin數據集中表達升高的基因在E2F、G2M通路顯著富集;b、c. GSEA分析示Tianjin數據集中表達升高的基因在E2F、G2M通路顯著富集;d. 聚類熱圖示GSE141438數據集中表達升高的基因在E2F、G2M通路顯著富集;e、f. GSEA分析示GSE141438數據集中表達升高的基因在E2F、G2M通路顯著富集;g. PPI分析示CDK1蛋白是節點數最高的節點蛋白;h. Cytoscape軟件可視化查找得到CDK1為樞紐基因
Figure1. Detection of CDK1 mRNA expressiona. The cluster heatmap illustrated that genes with elevated expression in the Tianjin dataset significantly enriched in the E2F and G2M pathways; b, c. GSEA analysis indicated that genes with elevated expression in the Tianjin dataset significantly enriched in the E2F and G2M pathways; d. The cluster heatmap illustrated that genes with elevated expression in the GSE141438 dataset significantly enriched in the E2F and G2M pathways; e, f. GSEA analysis indicated that genes with elevated expression in the GSE141438 dataset significantly enriched in the E2F and G2M pathways; g. PPI analysis revealed that CDK1 protein was the node protein with the highest number of connections; h. Cytoscape software visualizes and identifies CDK1 as a hub gene
對Tianjin數據集及GSE141438數據集中整體表達均升高的2條通路(E2F、G2M)取交集,共得到25個差異表達基因。PPI分析表明,CDK1蛋白的節點數為20(圖1g);并利用Cytoscape軟件進行可視化,發現CDK1基因的關聯強度高于其他差異表達基因,CDK1為樞紐基因(圖1h)。
2.2 CDK1 mRNA表達水平在肉瘤、MPNST中顯著升高
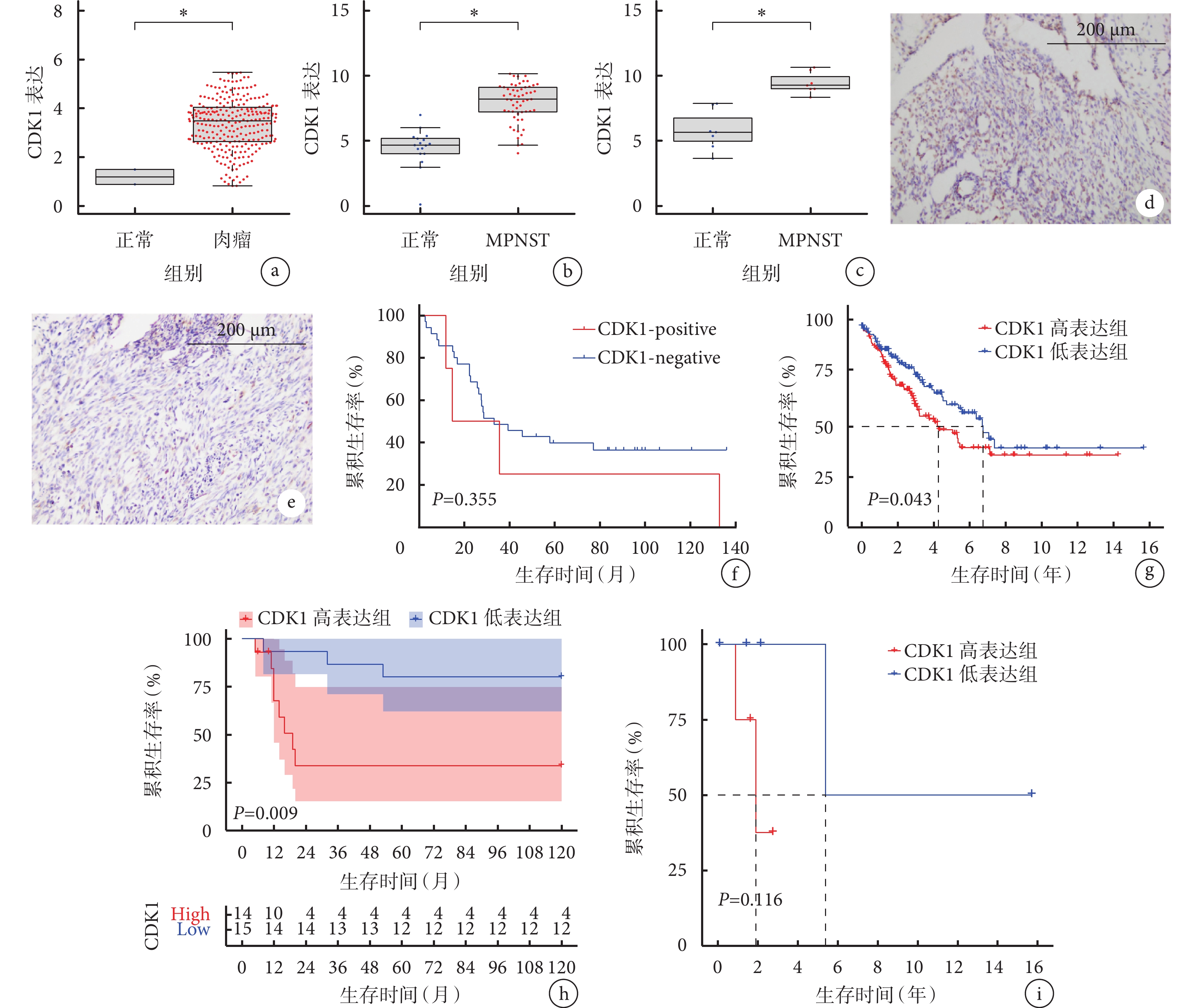
TCGA包含的263例肉瘤樣本中CDK1 mRNA表達水平較2例正常組織樣本顯著上升(P<0.05);Tianjin、GSE141438數據集中MPNST相較于正常組織,CDK1 mRNA表達顯著上升(P<0.05)。見圖2a~c。
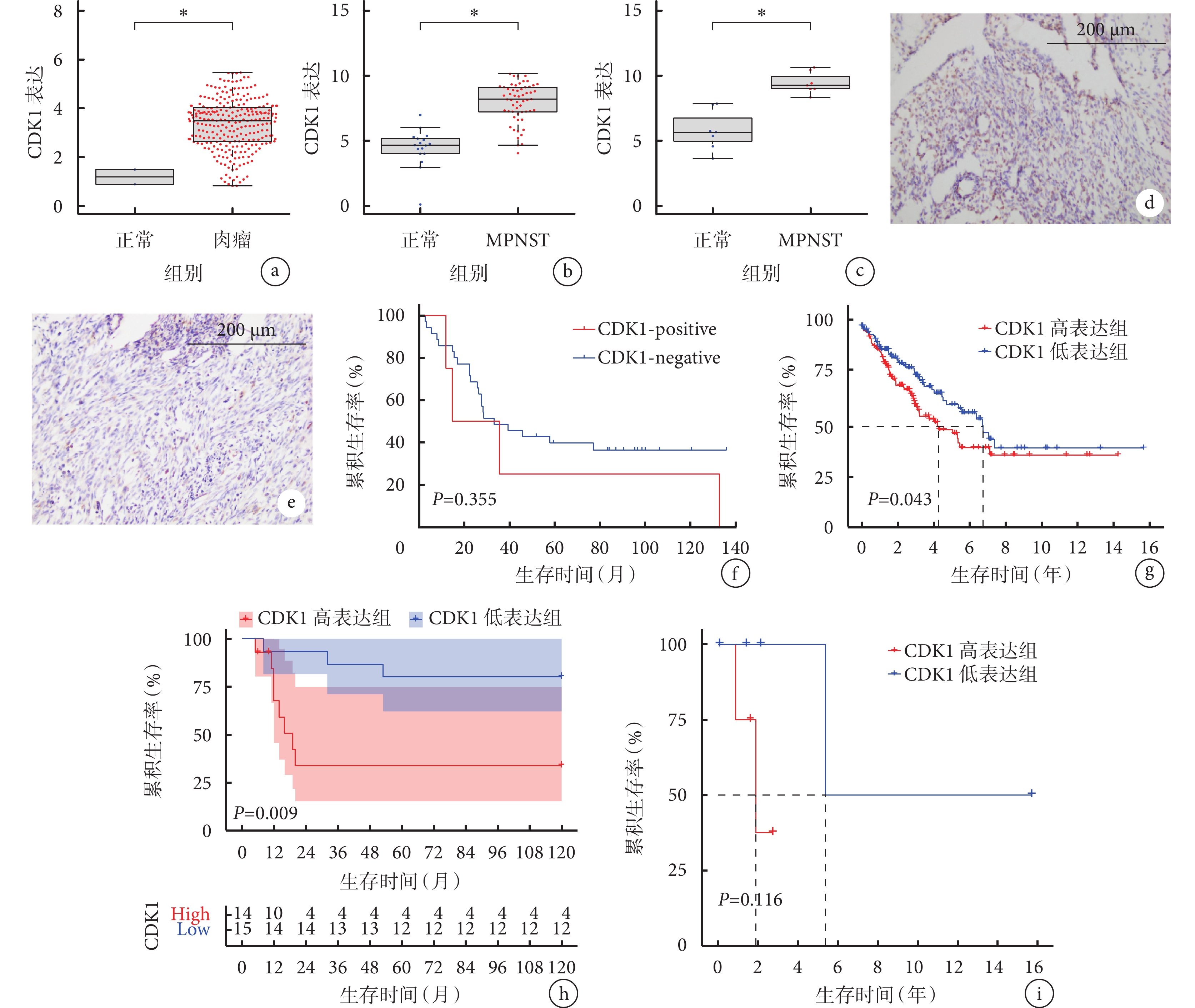 圖2
CDK1 在肉瘤、MPNST組織中的表達情況及其表達高低與預后的關系
圖2
CDK1 在肉瘤、MPNST組織中的表達情況及其表達高低與預后的關系
a. TCGA數據庫中CDK1 mRNA表達 *
a. CDK1 mRNA expression in the TCGA database *
2.3 肉瘤、MPNST中CDK1 蛋白、mRNA表達水平與患者預后關系
免疫組織化學染色示,CDK1蛋白在MPNST組織中的表達率為40.31%。結合患者臨床隨訪信息,根據CDK1蛋白在腫瘤組織中陽性表達水平將患者分為CDK1-positive組(n=4)和CDK1-negative組(n=36)。生存分析結果表明CDK1-positive組與CDK1-negative組中位總生存期分別為25.19個月和33.30個月,差異無統計學意義(P>0.05)。CDK1-positive組整體生存趨勢較CDK1-negative組差。見圖2d~f。
在CDK1 mRNA表達水平層面,Kaplan-Meier生存分析示,TCGA數據庫和GSE66743數據集中的肉瘤、MPNST患者CDK1高表達組生存時間與低表達組比較差異均有統計學意義(P<0.05)。在TCGA的263例肉瘤數據中,共有259例肉瘤患者有生存數據,CDK1 mRNA高表達組(n=130)和低表達組(n=129)中位總生存期分別為4.75年和6.75年,差異有統計學意義(P<0.05)。GSE66743數據集中29例MPNST患者CDK1 mRNA高表達組(n=16)與低表達組(n=13)中位總生存期分別為19 個月和NA,差異有統計學意義(P<0.05)。263例肉瘤患者樣本中包含9例MPNST樣本(CDK1高表達組n=5,低表達組n=4),Kaplan-Meier生存分析示差異無統計學意義(P>0.05),可能與樣本量較小有關,但生存曲線整體趨勢仍顯示CDK1高表達組患者預后較差。見圖2g~i。
2.4 CDK1和其他CDK家族在MPNST中表達特點
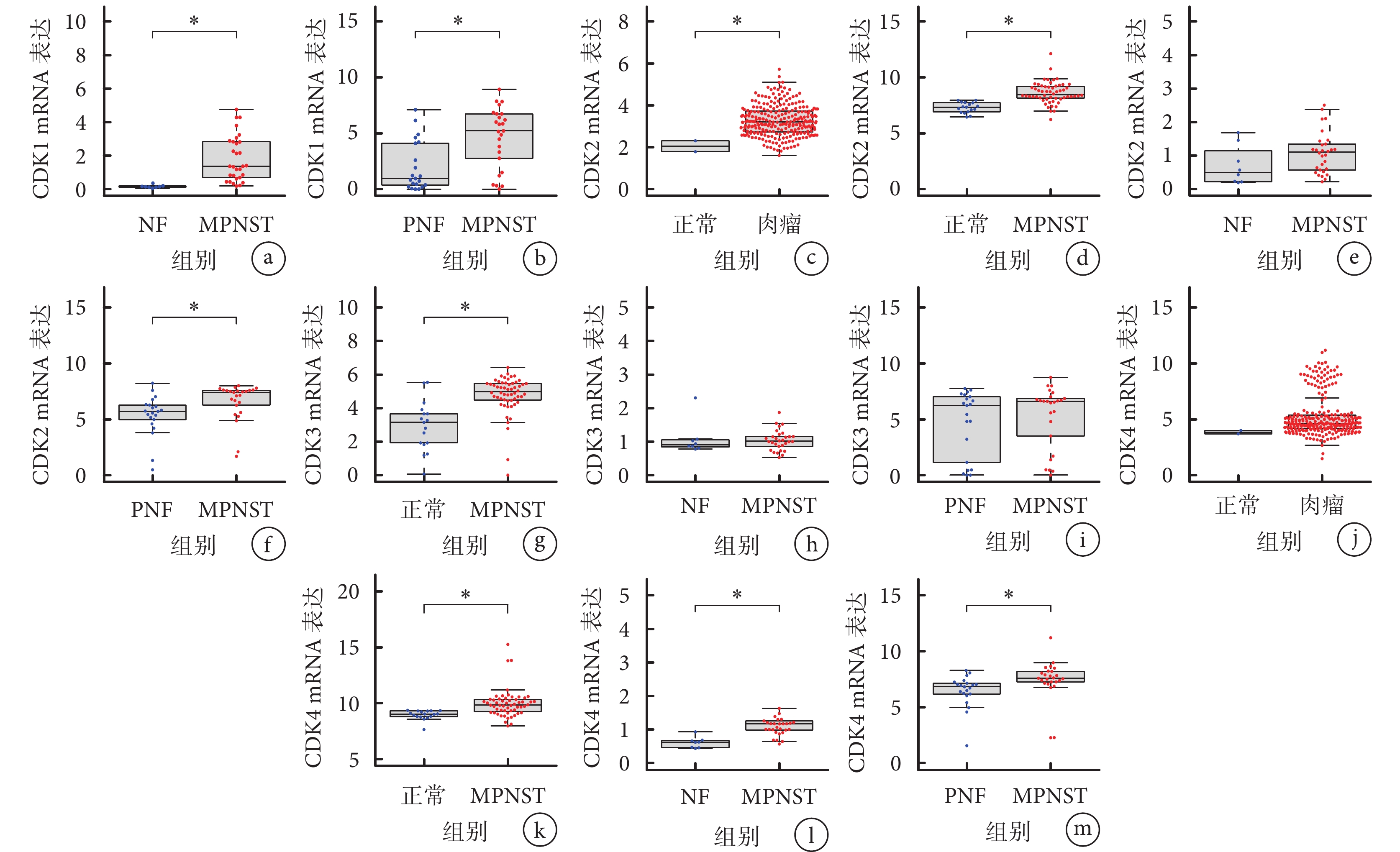
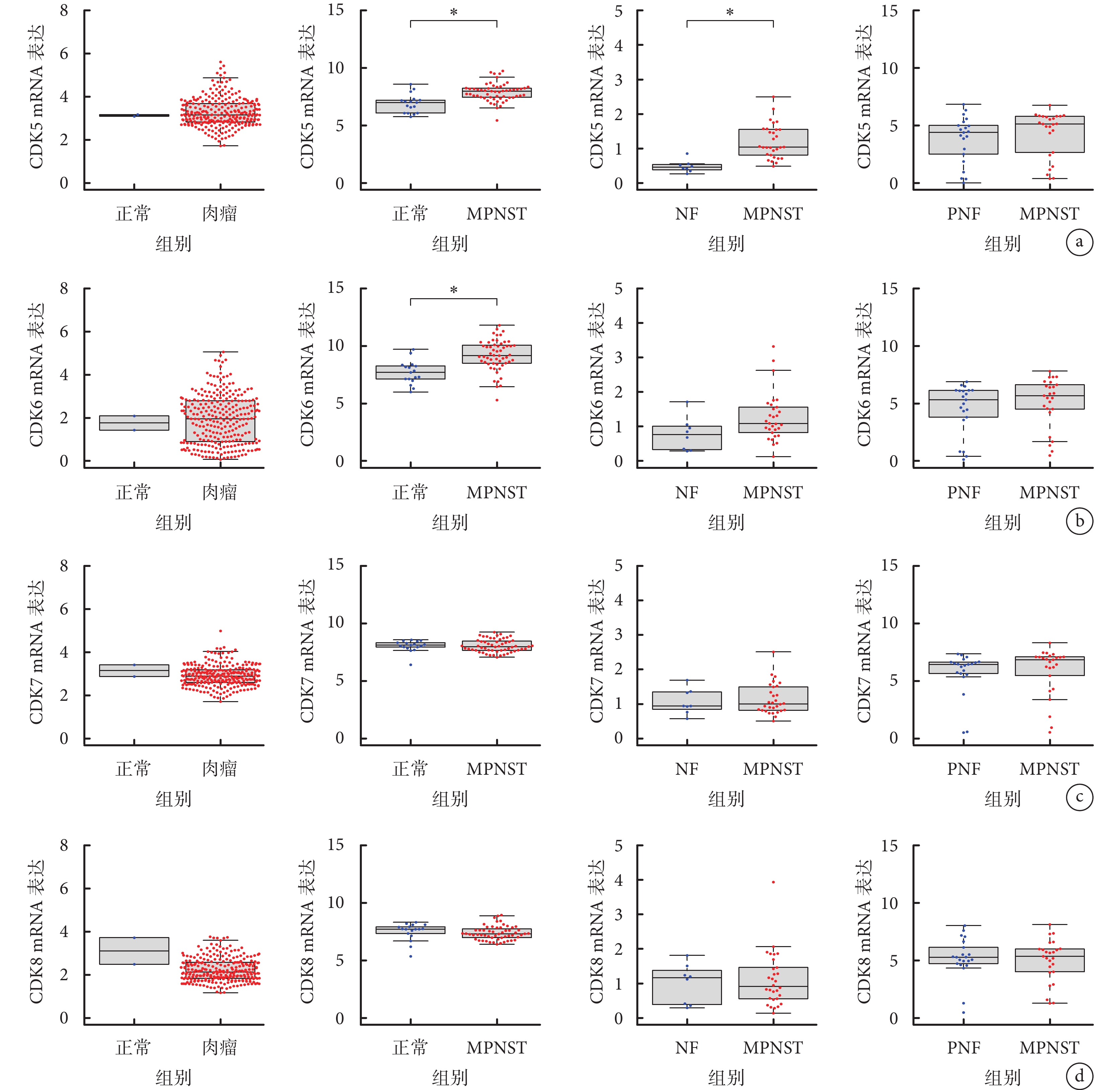
與NF和PNF組織相比,CDK1 mRNA的表達在MPNST患者中顯著上調 [GSE66743、GSE145064數據集(P<0.05)]。GSE66743數據集中CDK2 mRNA在MPNST和NF組織中表達差異無統計學意義(P>0.05);GSE66743、GSE145064數據集中CDK3 mRNA在MPNST與NF及PNF組織中表達差異無統計學意義(P>0.05);TCGA數據庫中CDK4 mRNA在肉瘤組織與正常組織中表達差異無統計學意義(P>0.05);GSE145064數據集中CDK5 mRNA在MPNST與PNF組織中表達差異無統計學意義(P>0.05),TCGA數據庫中CDK5 mRNA在肉瘤與正常組織中表達差異無統計學意義(P>0.05);GSE145064數據集、GSE66743數據集和TCGA數據庫中CDK6 mRNA在MPNST與NF、PNF組織中表達差異無統計學意義(P>0.05),在肉瘤與正常組織中表達差異無統計學意義(P>0.05);Tianjin、TCGA、GSE66743、GSE145064數據集中CDK7 mRNA在MPNST與正常、NF、PNF組織中表達差異均無統計學意義(P>0.05),在肉瘤與正常組織中表達差異無統計學意義(P>0.05);Tianjin、TCGA、GSE66743、GSE145064數據集中CDK8 mRNA在MPNST與正常、NF、PNF組織中表達差異均無統計學意義(P>0.05),在肉瘤組織中表達低于正常組織,但差異無統計學意義(P>0.05)。因此,在轉錄組水平上,CDK家族成員中只有CDK1在MPNST中表達與正常組織、NF組織和PNF組織差異均有統計學意義(P<0.05)。見圖3、4。
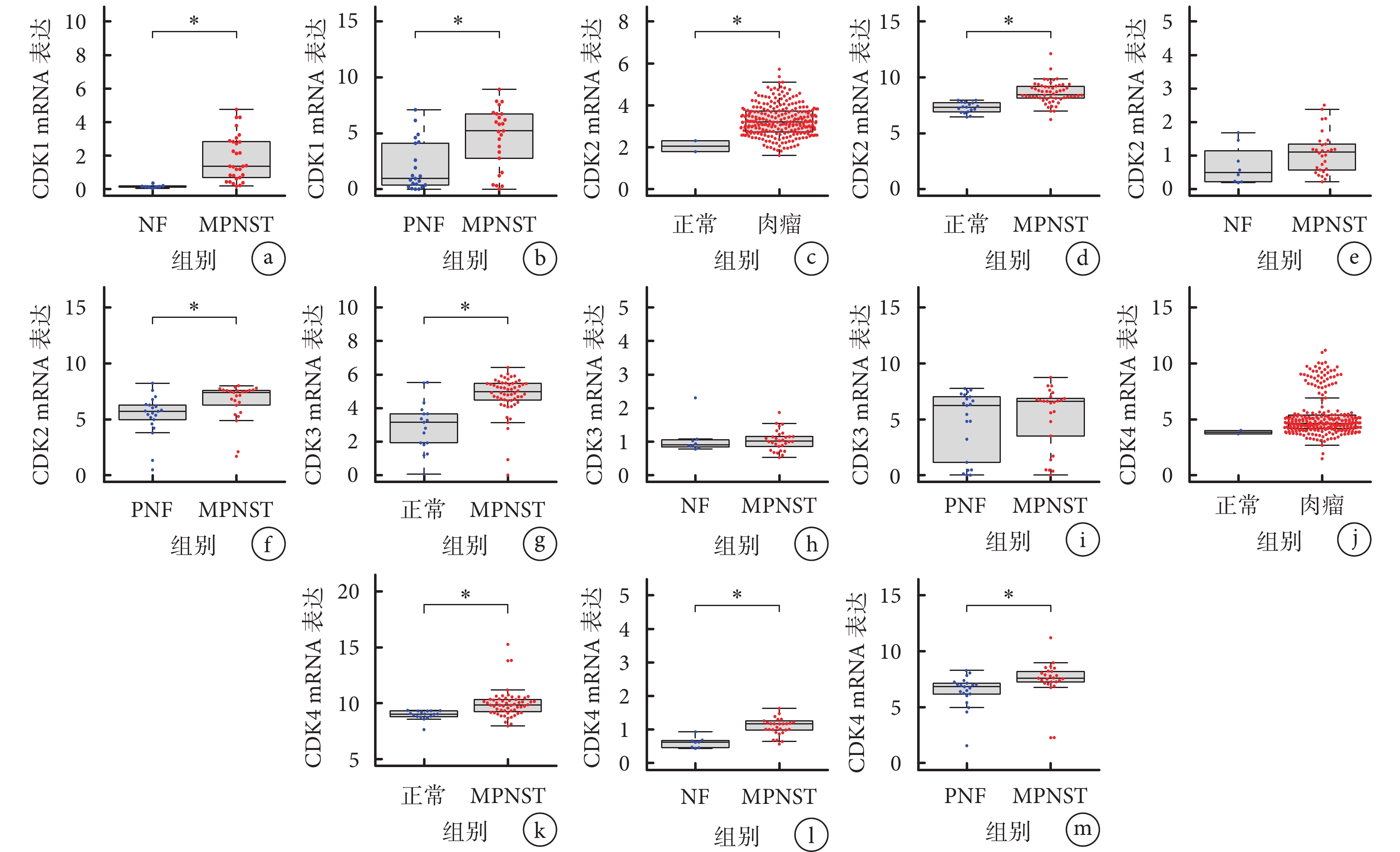 圖3
CDK1~4 mRNA在各組織中的表達情況 *P<0.05
圖3
CDK1~4 mRNA在各組織中的表達情況 *P<0.05
a. GSE66743數據集中CDK1 mRNA表達;b. GSE145064數據集中CDK1 mRNA表達;c~f. TCGA、Tianjin、GSE66743和GSE145064數據集中CDK2 mRNA表達;g~i. Tianjin、GSE66743和GSE145064數據集中CDK3 mRNA表達;j~m. TCGA、Tianjin、GSE66743和GSE145064數據集中CDK4 mRNA表達
Figure3. Expression of CDK1-4 mRNA in various tissues *P<0.05a. Expression of CDK1 mRNA in the GSE66743 dataset; b. Expression of CDK1 mRNA in the GSE145064 dataset; c-f. Expression of CDK2 mRNA in the TCGA, Tianjin, GSE66743, and GSE145064 datasets; g-i. Expression of CDK3 mRNA in the Tianjin, GSE66743, and GSE145064 datasets; j-m. Expression of CDK4 mRNA in the TCGA, Tianjin, GSE66743, and GSE145064 datasets
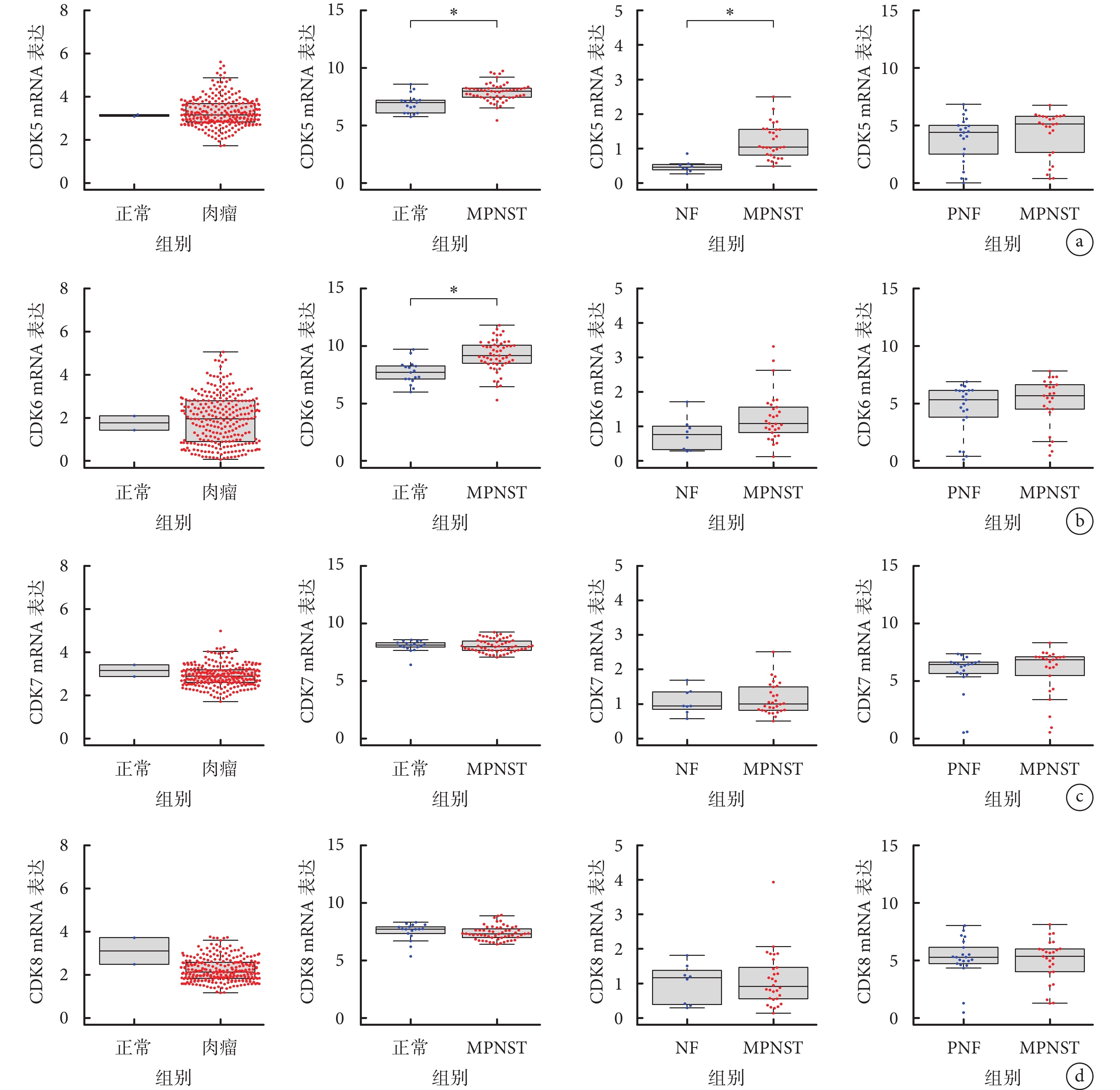 圖4
CDK5~8 mRNA在各組織中的表達情況 *P<0.05
圖4
CDK5~8 mRNA在各組織中的表達情況 *P<0.05
從左至右依次為TCGA、Tianjin、GSE66743和GSE145064數據集中 a. CDK5 mRNA;b. CDK6 mRNA;c. CDK7 mRNA;d. CDK8 mRNA
Figure4. Expression of CDK5-8 mRNA in various tissues *P<0.05From left to right for TCGA, Tianjin, GSE66743, and GSE145064 datasets, respectively a. CDK5 mRNA; b. CDK6 mRNA; c. CDK7 mRNA; d. CDK8 mRNA
3 討論
CDK1蛋白是細胞周期調控的關鍵酶,本研究進一步表明其在MPNST中扮演著重要角色。既往研究表明,CDK1在諸多瘤種中的高表達與腫瘤的快速增殖、侵襲性增高和較差的預后密切相關[2,7-10]。基于轉錄組測序和生物信息學分析,我們發現CDK1在MPNST腫瘤樣本中的轉錄水平顯著高于正常組織,這一發現得到了公共數據集的支持。CDK1的異常高表達通常伴隨著腫瘤細胞增殖加速和惡性行為的增強。本研究進一步行生存分析顯示,存在CDK1轉錄上調的MPNST患者其生存時間顯著低于低表達組,MPNST組織中CDK1蛋白表達陽性患者生存趨勢較表達陰性患者差。提示CDK1可能是影響MPNST患者預后的重要因素。這些研究結果不僅揭示了CDK1在MPNST中的關鍵作用,還表明其表達水平可以作為評估MPNST患者預后的潛在生物標志物。
CDK1在多個瘤種中被證實是參與腫瘤發生、發展的關鍵因子。研究表明[9,11],CDK1高表達與胰腺導管細胞癌患者較差的預后相關,靶向CDK1能夠通過誘導G2/M期阻滯、誘導腫瘤細胞凋亡、抑制腫瘤干細胞等方式治療胰腺導管細胞癌。本研究結果顯示CDK1 mRNA在MPNST中的轉錄上調與較差的預后相關,且相較于其他CDK家族成員,CDK1在MPNST中表現出獨特的表達模式。我們分析CDK1可能是MPNST發生、發展過程中的關鍵分子,CDK1作為MPNST潛在的治療靶點具有良好研究前景。
CDK1是如何影響MPNST發生、發展的具體機制目前仍未明確。Xu等[12]的研究表明,CDK1表達水平與胰腺導管細胞癌預后相關,敲低CDK1表達會導致胰腺癌細胞腫瘤干性降低并使腫瘤干細胞亞群減少,具體機制是通過調節CDK1的翻譯后修飾,即減少組蛋白去乙酰化酶介導的CDK1去乙酰化,從而減少STAT3的磷酸化來實現的。此外,富含絲氨酸/精氨酸剪接因子9(SRSF9)、癌高甲基化因子1(HIC1)、丙酮酸激酶同工酶M2型(PKM2)、長鏈酰基輔酶A合酶 4 (ASCL-4)、去泛素化酶YOD1等因子也在膠質瘤、膠質母細胞瘤、結直腸癌和三陰性乳腺癌中分別通過不同途徑來調控CDK1表達,進而影響細胞周期進程來影響腫瘤細胞增殖能力、耐藥性等[13-17]。基于上述研究結果, CDK1上下游相關分子也可能通過直接與CDK1啟動子區域結合、表觀遺傳修飾、減少鐵死亡等途徑調控MPNST細胞惡性增殖。CDK1的這些多重作用機制揭示了其在MPNST發生和進展中的核心地位,表明其異常活性可能是導致MPNST細胞逃避正常細胞周期控制和加速腫瘤發展的關鍵因素。
本研究結果表明,CDK家族中僅有CDK1在MPNST中的轉錄相較于正常組織、NF組織和PNF組織均上調,然而本次組織微陣列中免疫組織化學染色陽性表達CDK1蛋白的患者較少,與CDK1 mRNA在MPNST組織中的高表達存在明顯差異。我們分析這種差異是由于CDK1蛋白上、下游存在潛在調節機制亦或是免疫組織化學染色操作等原因造成的。在今后的研究中,我們將重點就CDK1 mRNA的表觀遺傳修飾以及CDK1蛋白的翻譯后修飾進行研究,探尋CDK1 mRNA和蛋白上、下游的具體調節機制。同時,細胞周期的調控復雜多樣,無法忽視其他CDK家族成員分子以及細胞周期調節因子和CDK1蛋白之間的相互作用關系。不僅CDK1蛋白受到WEE1樣蛋白激酶、細胞分裂周期因子(CDC25)等分子對其的磷酸化/去磷酸化調控,研究表明,CDK7也能發揮CDK激酶(CAK)活性磷酸化包含CDK1在內的幾種CDK成員[18-19]。因此,其他CDK分子以及參與細胞周期調控因子與CDK1之間的相互作用同樣不能被忽略,這也是需要進一步探索研究的關鍵之一。
鑒于CDK1在MPNST中的關鍵作用,針對CDK1的抑制成為一種具有潛力的治療策略。初步研究顯示,CDK1抑制劑能夠有效阻止MPNST細胞的增殖,并誘導腫瘤細胞凋亡[20]。這些發現為開發新的MPNST治療方法提供了重要依據。未來研究需要進一步優化CDK1抑制劑的設計,提升其選擇性和效力,同時評估其在臨床應用中的安全性和有效性。此外,結合現有的化療和放療手段,CDK1抑制劑有望增強治療效果,提高患者生存率。值得注意的是,CDK1不僅在MPNST中表現出關鍵作用,在多種惡性腫瘤中也顯示出相似的機制和潛力。因此,針對CDK1的治療策略不僅可能為MPNST患者帶來新的希望,也有望為其他癌癥的治療提供新思路。通過深入研究CDK1在MPNST中的具體作用機制和其作為治療靶點的潛力,我們期待未來能夠開發出更加精準和有效的治療方案,顯著改善MPNST患者預后,并拓展這一策略在其他腫瘤中的應用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
倫理聲明 研究方案經天津市腫瘤醫院(核)醫學倫理委員會批準(bc2023111);患者均簽署知情同意書
作者貢獻聲明 劉源欣:免疫組織化學染色、作圖、文章撰寫 ;付來華:數據統計分析、臨床資料收集整理;劉昊天:研究設計、數據統計分析、作圖;張耕溥、肖婉祎:臨床資料收集整理;高梓唯、張洪亮:數據統計分析;楊吉龍:研究指導、論文審閱、實驗設計、經費支持
惡性周圍神經鞘瘤(malignant peripheral nerve sheath tumor,MPNST)是一種罕見且具有高度侵襲性的軟組織肉瘤,起源于周圍神經或其鞘膜,多見于20~50歲人群,占所有軟組織肉瘤的5%~10%。該腫瘤的發病與Ⅰ型神經纖維瘤病(neurofibromatosis type 1,NF1)密切相關,約50% MPNST患者發生于NF1患者中。MPNST具有高度惡性特性,易復發和轉移,預后較差。盡管手術切除是主要治療手段,但由于腫瘤的侵襲性和復雜的生物學行為,臨床治療效果有限。
MPNST的相關基因組學分析研究表明,NF1雙等位基因的功能性缺失和RAS基因異常激活、CDKN2A基因組位點的雜合性缺失是MPNST細胞發生中上游突變的關鍵環節[1]。細胞周期蛋白依賴性激酶1(cell-cycle dependent kinase 1,CDK1)作為一種參與調控細胞增殖和遷移、炎癥反應、免疫應激的關鍵因子,已逐漸被國內外學者關注[2]。CDK1作為細胞周期的核心調控因子,其異常表達與多種癌癥的發生、發展密切相關,如在乳腺癌、肺癌和胃癌中CDK1為高表達狀態,且與腫瘤細胞增殖加快、侵襲性增強和患者預后較差相關[3-4]。
為了研究CDK1在MPNST中的分子生物學特性以及其臨床意義,本研究對來自天津市腫瘤醫院的MPNST樣本和正常組織樣本進行了轉錄組測序,并結合外部數據集進行生物信息學分析,進一步利用免疫組織化學染色分析CDK1蛋白在MPNST組織中的表達情況,為臨床治療策略提供新的方向。
1 資料與方法
1.1 研究對象
選取2011年9月—2020年3月于天津市腫瘤醫院接受手術切除治療,并經組織學、病理學證實的56例MPNST患者腫瘤樣本及17例正常組織樣本(同一MPNST患者距離腫瘤邊緣5 cm以上的非腫瘤組織)作為研究對象。其中男32例,女24例;年齡12~82歲,平均51歲。病變位于四肢22例,頭頸部1例,軀干14例,內臟7例,其他部位10例。患者入院時39例為原發病灶,17例為復發病灶。其中NF1型患者12例(21.4%)。腫瘤為單發42例,多發14例;腫瘤最大徑2.0~18.0 cm,平均7.1 cm,其中<5 cm 21例,5~10 cm 26例,>10 cm 9例。術后復發12例(21.4%),遠處轉移(遠隔部位皮膚、軟組織、器官的轉移和/或非區域淋巴結轉移)13例(23.2%);接受化療23例,放療13例。將切除后的腫瘤和正常組織置入–196℃超低溫液氮罐凍存。
1.2 轉錄組測序及生物信息學分析
1.2.1 轉錄組測序
取56例MPNST患者的冷凍組織和17例正常組織樣本,采用Trizol試劑(Invitrogen公司,美國)提取RNA,按照MGlEasy mRNA文庫試劑盒(深圳華大智造科技股份有限公司)方法構建mRNA文庫,在DNBSEO-G400測序儀(深圳華大智造科技股份有限公司)上對PE150循環的mRNA文庫進行測序。使用子讀取對齊器將讀段與人類參考基因組 (GRCh38) 進行比對,在計算機R studio軟件中利用edgeR R包對RNA讀取計數進行歸一化,將每個RNA的表達轉化為每千個堿基的轉錄每百萬映射讀取的轉錄本,并將56例患者轉錄組測序得到的基因集和基因表達矩陣命名為“Tianjin”數據集[5]。
1.2.2 基因表達綜合數據庫(Gene Expression Omnibus database,GEO)、癌癥基因組圖譜(the cancer genome atlas,TCGA)數據庫檢索
檢索GEO,共得到4個包含較大MPNST樣本量的轉錄組測序數據集,分別為GSE141438 RNA測序 [7例MPNST,7例正常,3例神經纖維瘤(neurofibromatosis,NF)]、GSE145064 RNA測序 [25例MPNST,21例叢狀神經纖維瘤(plexiform neurofibromas,PNF)]、GSE140987 MicroRNA(10例散發,9例PNF,9例MPNST)、GSE66743芯片(30例MPNST,8例NF)。TCGA數據庫中,根據組織來源不同,檢索得到包含脂肪肉瘤、平滑肌肉瘤、未分化多形性肉瘤、黏液纖維肉瘤、MPNST和滑膜肉瘤等肉瘤亞型共計263例肉瘤樣本及2例正常組織樣本相關信息。
1.2.3 基因集變異分析(gene set variation analysis,GSVA)及基因富集分析(gene set enrichment analysis,GSEA)
使用GSVA包(v1.34.0)和R中的pheatmap包(v1.0.12)對Tianjin和GSE141438數據集進行GSVA和GSEA分析,篩選轉錄水平表達升高的通路。并對篩選得到的通路取交集,得到差異表達基因。
1.2.4 蛋白間互作網絡(Protein-Protein interaction networks,PPI)構建及Cytoscape軟件可視化
使用STRING 11.5數據庫(https://string-db.org/)預測通路分析得到的差異基因編碼PPI。設置“minimum required interaction score”為0.4。利用Cytoscape v3.7.0軟件(NDEX公司,美國)將上述結果可視化。
1.3 差異表達分析
根據TCGA數據庫中的肉瘤及正常組織樣本轉錄組測序數據,分析CDK1 mRNA在肉瘤與正常組織中的表達差異。選擇包含生存信息的Tianjin數據集和GSE141438數據集,分析CDK1 mRNA在MPNST與正常組織中的表達水平差異。進一步分析GSE66743、GSE145064數據集中CDK1 mRNA在MPNST與NF組織和PNF組織表達水平差異。利用TCGA、Tianjin、GSE66743和GSE145064這4個數據集對比其他CDK家族成員(CDK2~8)在MPNST與正常組織、NF組織、PNF組織中的mRNA表達水平。
1.4 免疫組織化學染色觀察
取56例MPNST患者組織樣本,經甲醛固定、石蠟包埋后構建組織微矩陣(經病理科專業醫師再次確認并核對病理結果后,標記典型腫瘤區域進行組織芯片制作)。按常規方法行CDK1免疫組織化學染色,從每個組織中隨機挑選10個視野,根據免疫組織化學染色結果評分標準[6],對每個視野中的CDK1陽性細胞進行計數。實驗采用雙盲法,由至少2名病理學專家進行評定。并計算CDK1蛋白表達率,公式:CDK1陽性細胞數/腫瘤細胞總數×100%。
1.5 生存分析及生存風險評估
根據CDK1 mRNA在病變組織中表達的中位值將患者分為低表達組和高表達組;根據56例MPNST患者組織微矩陣免疫組織化學染色結果將患者分為CDK1蛋白陽性(CDK1-positive)組與CDK1蛋白陰性(CDK1-negative)組;通過Kaplan-Meier生存分析及Log-rank檢驗比較組間患者生存差異,并繪制患者Kaplan-Meier生存曲線。
1.6 統計學方法
采用R studio、R 4.2.2軟件及SPSS25.0、GraphPad Prism 8軟件進行統計分析和繪圖,利用Cytoscape v3.7.0軟件進行PPI結果可視化。計量資料經正態性檢驗,符合正態分布的數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;不符合正態分布的數據以M(Q1,Q3)表示,組間比較采用Wilcoxon秩和檢驗。檢驗水準取雙側α=0.05。
2 結果
2.1 CDK1 為篩選得到的樞紐基因
對Tianjin數據集轉錄組測序結果通路分析,GSVA分析發現相較于正常組織,MPNST中表達升高的基因在E2F、G2M、EMT 3條通路顯著富集。GSEA分析同樣發現,與正常組織相比,MPNST表達升高的基因在E2F、G2M、EMT 3條通路顯著富集。見圖1a~c。通過分析GSE141438數據集,GSVA、GSEA均發現轉錄水平表達升高的基因在E2F和G2M 2條通路顯著富集。見圖1d~f。
 圖1
CDK1 mRNA表達水平檢測
圖1
CDK1 mRNA表達水平檢測
a. 聚類熱圖示Tianjin數據集中表達升高的基因在E2F、G2M通路顯著富集;b、c. GSEA分析示Tianjin數據集中表達升高的基因在E2F、G2M通路顯著富集;d. 聚類熱圖示GSE141438數據集中表達升高的基因在E2F、G2M通路顯著富集;e、f. GSEA分析示GSE141438數據集中表達升高的基因在E2F、G2M通路顯著富集;g. PPI分析示CDK1蛋白是節點數最高的節點蛋白;h. Cytoscape軟件可視化查找得到CDK1為樞紐基因
Figure1. Detection of CDK1 mRNA expressiona. The cluster heatmap illustrated that genes with elevated expression in the Tianjin dataset significantly enriched in the E2F and G2M pathways; b, c. GSEA analysis indicated that genes with elevated expression in the Tianjin dataset significantly enriched in the E2F and G2M pathways; d. The cluster heatmap illustrated that genes with elevated expression in the GSE141438 dataset significantly enriched in the E2F and G2M pathways; e, f. GSEA analysis indicated that genes with elevated expression in the GSE141438 dataset significantly enriched in the E2F and G2M pathways; g. PPI analysis revealed that CDK1 protein was the node protein with the highest number of connections; h. Cytoscape software visualizes and identifies CDK1 as a hub gene
對Tianjin數據集及GSE141438數據集中整體表達均升高的2條通路(E2F、G2M)取交集,共得到25個差異表達基因。PPI分析表明,CDK1蛋白的節點數為20(圖1g);并利用Cytoscape軟件進行可視化,發現CDK1基因的關聯強度高于其他差異表達基因,CDK1為樞紐基因(圖1h)。
2.2 CDK1 mRNA表達水平在肉瘤、MPNST中顯著升高
TCGA包含的263例肉瘤樣本中CDK1 mRNA表達水平較2例正常組織樣本顯著上升(P<0.05);Tianjin、GSE141438數據集中MPNST相較于正常組織,CDK1 mRNA表達顯著上升(P<0.05)。見圖2a~c。
 圖2
CDK1 在肉瘤、MPNST組織中的表達情況及其表達高低與預后的關系
圖2
CDK1 在肉瘤、MPNST組織中的表達情況及其表達高低與預后的關系
a. TCGA數據庫中CDK1 mRNA表達 *
a. CDK1 mRNA expression in the TCGA database *
2.3 肉瘤、MPNST中CDK1 蛋白、mRNA表達水平與患者預后關系
免疫組織化學染色示,CDK1蛋白在MPNST組織中的表達率為40.31%。結合患者臨床隨訪信息,根據CDK1蛋白在腫瘤組織中陽性表達水平將患者分為CDK1-positive組(n=4)和CDK1-negative組(n=36)。生存分析結果表明CDK1-positive組與CDK1-negative組中位總生存期分別為25.19個月和33.30個月,差異無統計學意義(P>0.05)。CDK1-positive組整體生存趨勢較CDK1-negative組差。見圖2d~f。
在CDK1 mRNA表達水平層面,Kaplan-Meier生存分析示,TCGA數據庫和GSE66743數據集中的肉瘤、MPNST患者CDK1高表達組生存時間與低表達組比較差異均有統計學意義(P<0.05)。在TCGA的263例肉瘤數據中,共有259例肉瘤患者有生存數據,CDK1 mRNA高表達組(n=130)和低表達組(n=129)中位總生存期分別為4.75年和6.75年,差異有統計學意義(P<0.05)。GSE66743數據集中29例MPNST患者CDK1 mRNA高表達組(n=16)與低表達組(n=13)中位總生存期分別為19 個月和NA,差異有統計學意義(P<0.05)。263例肉瘤患者樣本中包含9例MPNST樣本(CDK1高表達組n=5,低表達組n=4),Kaplan-Meier生存分析示差異無統計學意義(P>0.05),可能與樣本量較小有關,但生存曲線整體趨勢仍顯示CDK1高表達組患者預后較差。見圖2g~i。
2.4 CDK1和其他CDK家族在MPNST中表達特點
與NF和PNF組織相比,CDK1 mRNA的表達在MPNST患者中顯著上調 [GSE66743、GSE145064數據集(P<0.05)]。GSE66743數據集中CDK2 mRNA在MPNST和NF組織中表達差異無統計學意義(P>0.05);GSE66743、GSE145064數據集中CDK3 mRNA在MPNST與NF及PNF組織中表達差異無統計學意義(P>0.05);TCGA數據庫中CDK4 mRNA在肉瘤組織與正常組織中表達差異無統計學意義(P>0.05);GSE145064數據集中CDK5 mRNA在MPNST與PNF組織中表達差異無統計學意義(P>0.05),TCGA數據庫中CDK5 mRNA在肉瘤與正常組織中表達差異無統計學意義(P>0.05);GSE145064數據集、GSE66743數據集和TCGA數據庫中CDK6 mRNA在MPNST與NF、PNF組織中表達差異無統計學意義(P>0.05),在肉瘤與正常組織中表達差異無統計學意義(P>0.05);Tianjin、TCGA、GSE66743、GSE145064數據集中CDK7 mRNA在MPNST與正常、NF、PNF組織中表達差異均無統計學意義(P>0.05),在肉瘤與正常組織中表達差異無統計學意義(P>0.05);Tianjin、TCGA、GSE66743、GSE145064數據集中CDK8 mRNA在MPNST與正常、NF、PNF組織中表達差異均無統計學意義(P>0.05),在肉瘤組織中表達低于正常組織,但差異無統計學意義(P>0.05)。因此,在轉錄組水平上,CDK家族成員中只有CDK1在MPNST中表達與正常組織、NF組織和PNF組織差異均有統計學意義(P<0.05)。見圖3、4。
 圖3
CDK1~4 mRNA在各組織中的表達情況 *P<0.05
圖3
CDK1~4 mRNA在各組織中的表達情況 *P<0.05
a. GSE66743數據集中CDK1 mRNA表達;b. GSE145064數據集中CDK1 mRNA表達;c~f. TCGA、Tianjin、GSE66743和GSE145064數據集中CDK2 mRNA表達;g~i. Tianjin、GSE66743和GSE145064數據集中CDK3 mRNA表達;j~m. TCGA、Tianjin、GSE66743和GSE145064數據集中CDK4 mRNA表達
Figure3. Expression of CDK1-4 mRNA in various tissues *P<0.05a. Expression of CDK1 mRNA in the GSE66743 dataset; b. Expression of CDK1 mRNA in the GSE145064 dataset; c-f. Expression of CDK2 mRNA in the TCGA, Tianjin, GSE66743, and GSE145064 datasets; g-i. Expression of CDK3 mRNA in the Tianjin, GSE66743, and GSE145064 datasets; j-m. Expression of CDK4 mRNA in the TCGA, Tianjin, GSE66743, and GSE145064 datasets
 圖4
CDK5~8 mRNA在各組織中的表達情況 *P<0.05
圖4
CDK5~8 mRNA在各組織中的表達情況 *P<0.05
從左至右依次為TCGA、Tianjin、GSE66743和GSE145064數據集中 a. CDK5 mRNA;b. CDK6 mRNA;c. CDK7 mRNA;d. CDK8 mRNA
Figure4. Expression of CDK5-8 mRNA in various tissues *P<0.05From left to right for TCGA, Tianjin, GSE66743, and GSE145064 datasets, respectively a. CDK5 mRNA; b. CDK6 mRNA; c. CDK7 mRNA; d. CDK8 mRNA
3 討論
CDK1蛋白是細胞周期調控的關鍵酶,本研究進一步表明其在MPNST中扮演著重要角色。既往研究表明,CDK1在諸多瘤種中的高表達與腫瘤的快速增殖、侵襲性增高和較差的預后密切相關[2,7-10]。基于轉錄組測序和生物信息學分析,我們發現CDK1在MPNST腫瘤樣本中的轉錄水平顯著高于正常組織,這一發現得到了公共數據集的支持。CDK1的異常高表達通常伴隨著腫瘤細胞增殖加速和惡性行為的增強。本研究進一步行生存分析顯示,存在CDK1轉錄上調的MPNST患者其生存時間顯著低于低表達組,MPNST組織中CDK1蛋白表達陽性患者生存趨勢較表達陰性患者差。提示CDK1可能是影響MPNST患者預后的重要因素。這些研究結果不僅揭示了CDK1在MPNST中的關鍵作用,還表明其表達水平可以作為評估MPNST患者預后的潛在生物標志物。
CDK1在多個瘤種中被證實是參與腫瘤發生、發展的關鍵因子。研究表明[9,11],CDK1高表達與胰腺導管細胞癌患者較差的預后相關,靶向CDK1能夠通過誘導G2/M期阻滯、誘導腫瘤細胞凋亡、抑制腫瘤干細胞等方式治療胰腺導管細胞癌。本研究結果顯示CDK1 mRNA在MPNST中的轉錄上調與較差的預后相關,且相較于其他CDK家族成員,CDK1在MPNST中表現出獨特的表達模式。我們分析CDK1可能是MPNST發生、發展過程中的關鍵分子,CDK1作為MPNST潛在的治療靶點具有良好研究前景。
CDK1是如何影響MPNST發生、發展的具體機制目前仍未明確。Xu等[12]的研究表明,CDK1表達水平與胰腺導管細胞癌預后相關,敲低CDK1表達會導致胰腺癌細胞腫瘤干性降低并使腫瘤干細胞亞群減少,具體機制是通過調節CDK1的翻譯后修飾,即減少組蛋白去乙酰化酶介導的CDK1去乙酰化,從而減少STAT3的磷酸化來實現的。此外,富含絲氨酸/精氨酸剪接因子9(SRSF9)、癌高甲基化因子1(HIC1)、丙酮酸激酶同工酶M2型(PKM2)、長鏈酰基輔酶A合酶 4 (ASCL-4)、去泛素化酶YOD1等因子也在膠質瘤、膠質母細胞瘤、結直腸癌和三陰性乳腺癌中分別通過不同途徑來調控CDK1表達,進而影響細胞周期進程來影響腫瘤細胞增殖能力、耐藥性等[13-17]。基于上述研究結果, CDK1上下游相關分子也可能通過直接與CDK1啟動子區域結合、表觀遺傳修飾、減少鐵死亡等途徑調控MPNST細胞惡性增殖。CDK1的這些多重作用機制揭示了其在MPNST發生和進展中的核心地位,表明其異常活性可能是導致MPNST細胞逃避正常細胞周期控制和加速腫瘤發展的關鍵因素。
本研究結果表明,CDK家族中僅有CDK1在MPNST中的轉錄相較于正常組織、NF組織和PNF組織均上調,然而本次組織微陣列中免疫組織化學染色陽性表達CDK1蛋白的患者較少,與CDK1 mRNA在MPNST組織中的高表達存在明顯差異。我們分析這種差異是由于CDK1蛋白上、下游存在潛在調節機制亦或是免疫組織化學染色操作等原因造成的。在今后的研究中,我們將重點就CDK1 mRNA的表觀遺傳修飾以及CDK1蛋白的翻譯后修飾進行研究,探尋CDK1 mRNA和蛋白上、下游的具體調節機制。同時,細胞周期的調控復雜多樣,無法忽視其他CDK家族成員分子以及細胞周期調節因子和CDK1蛋白之間的相互作用關系。不僅CDK1蛋白受到WEE1樣蛋白激酶、細胞分裂周期因子(CDC25)等分子對其的磷酸化/去磷酸化調控,研究表明,CDK7也能發揮CDK激酶(CAK)活性磷酸化包含CDK1在內的幾種CDK成員[18-19]。因此,其他CDK分子以及參與細胞周期調控因子與CDK1之間的相互作用同樣不能被忽略,這也是需要進一步探索研究的關鍵之一。
鑒于CDK1在MPNST中的關鍵作用,針對CDK1的抑制成為一種具有潛力的治療策略。初步研究顯示,CDK1抑制劑能夠有效阻止MPNST細胞的增殖,并誘導腫瘤細胞凋亡[20]。這些發現為開發新的MPNST治療方法提供了重要依據。未來研究需要進一步優化CDK1抑制劑的設計,提升其選擇性和效力,同時評估其在臨床應用中的安全性和有效性。此外,結合現有的化療和放療手段,CDK1抑制劑有望增強治療效果,提高患者生存率。值得注意的是,CDK1不僅在MPNST中表現出關鍵作用,在多種惡性腫瘤中也顯示出相似的機制和潛力。因此,針對CDK1的治療策略不僅可能為MPNST患者帶來新的希望,也有望為其他癌癥的治療提供新思路。通過深入研究CDK1在MPNST中的具體作用機制和其作為治療靶點的潛力,我們期待未來能夠開發出更加精準和有效的治療方案,顯著改善MPNST患者預后,并拓展這一策略在其他腫瘤中的應用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
倫理聲明 研究方案經天津市腫瘤醫院(核)醫學倫理委員會批準(bc2023111);患者均簽署知情同意書
作者貢獻聲明 劉源欣:免疫組織化學染色、作圖、文章撰寫 ;付來華:數據統計分析、臨床資料收集整理;劉昊天:研究設計、數據統計分析、作圖;張耕溥、肖婉祎:臨床資料收集整理;高梓唯、張洪亮:數據統計分析;楊吉龍:研究指導、論文審閱、實驗設計、經費支持