引用本文: 徐翔宇, 袁磊, 孫飛, 沈志明, 單一波, 盧毅, 朱劍煒, 陳文軒, 史宏燦. 納米顆粒應用于非小細胞肺癌治療的研究熱點:文獻計量學方法分析. 中國胸心血管外科臨床雜志, 2024, 31(8): 1139-1147. doi: 10.7507/1007-4848.202212017 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
最新的統計數據[1]顯示,肺癌是世界范圍內發病率和死亡率均居第1位的惡性腫瘤。如今,肺癌的治療手段逐漸多樣化,但是絕大多數肺癌患者仍然預后不佳。非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌組織學分型中的一種,該類患者占所有肺癌患者的80%[2]。手術、放化療的單獨或結合應用在NSCLC的治療中各有優勢,但是各種治療手段的局限性以及對機體的副作用也不容小覷[3]。近年來,新出現的免疫治療和靶向治療對NSCLC患者的預后有一定的改善,但是其僅能為一些特定群體提供有效的藥物治療,隨之而來的免疫反應等相關問題也亟待解決[4]。隨著科學技術的不斷進步,納米技術在醫學領域的研究應用使NSCLC患者有機會獲得更有效的治療,其中納米顆粒(nanoparticles,NPs)不但作為納米材料的一種特殊表現形式在納米醫學的應用中占據主導地位,而且也是當前NSCLC治療的研究熱點,對改善NSCLC患者的健康狀況有很大潛力[5]。NPs具有良好的生物相容性和較高的表面積比,依靠其特殊結構可以有效封裝化療藥物并將其準確輸送至肺癌細胞中,避免損傷正常組織器官[6]。NPs不僅可以彌補普通化療藥物體內遞送所產生的非特異性毒性,而且可以有效控制藥物在體內釋放的速度,減少用藥頻率的同時提升藥物在體內的利用率[7]。隨著時代和科技的發展,納米技術在NSCLC治療中的應用越來越受到國內外研究者的關注。本研究擬采用文獻計量學的方法,對該領域的研究熱點進行可視化分析,并預測未來發展方向,為國內從事NPs治療NSLCL研究的學者提供理論指導與幫助。
1 資料與方法
1.1 文獻檢索
檢索Web of Science核心合集中NPs應用于NSCLC的相關文獻,檢索時間為建庫至2022年11月。檢索式為:TS=(nanoparticle*) AND (TS=(non-small cell lung cancer) OR TS=(NSCLC) OR TS=(non-small cell lung carcinoma)) AND (TS=(therapy) OR TS=(treatment*) OR TS=(therapeutic))。
1.2 文獻納入與排除標準
研究對象:NPs在NSCLC治療中的應用;文獻類型:論著和綜述;語種:英語。排除重復發表的文獻、會議記錄、專題報道、信件、評論等。
1.3 數據處理與分析
本研究基于文獻計量學的方法,分別對發文量、發文國家、作者及其機構的合作關系、關鍵詞、文獻共被引頻次、突現詞等進行分析。年發文量代表該研究方向在每年的研究熱度;作者和機構的合作關系和發文量可以看出此研究方向的重點研究人員與機構[8];關鍵詞分析可以看出該研究方向中的重點研究對象[9];突現詞分析可以看到未來該研究方向的發展[10]。
1.4 主要研究工具
本研究采用文獻可視化軟件CiteSpace 6.1.R2(Java 17.0.1)和VOSviewer 1.6.18,以及文獻計量在線分析平臺(https://bibliometric.com/)開展研究。CiteSpace軟件[11]是美國德雷塞爾大學信息科學與技術學院陳超美教授及其團隊開發的一種通過算法將大量數據整合處理分析的文獻計量可視化軟件,其可以用來探尋某一學科的研究前沿、當前熱點以及對學科未來進行科學預估。VOSviewer軟件[12]是荷蘭萊頓大學科學技術研究中心開發的計量分析軟件,目前主要應用領域是文獻計量學。
2 結果
2.1 文獻檢索結果
初次檢索得到文獻782篇。通過2位研究者(徐翔宇和袁磊)的多次獨立篩查并交叉核對后去除與本文主題無關的文獻10篇,去除會議摘要14篇,社論9篇,會議記錄4篇,數據論文2篇,重復文獻1篇,最終得到文獻742篇,以純文本格式和制表符分隔文件形式導出。
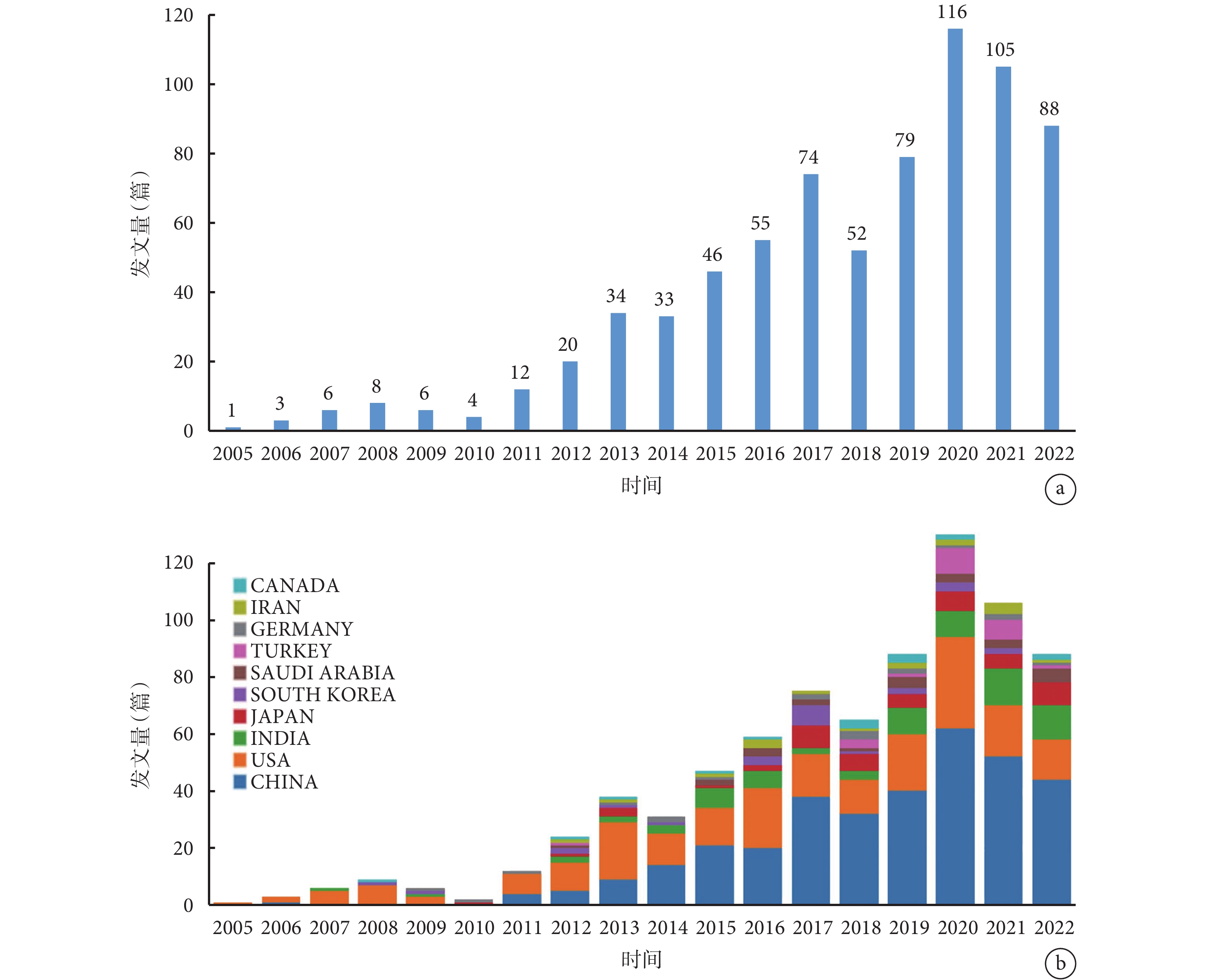
從整體上來看,文獻發表數量呈上升趨勢,2018—2022年的發文量達440篇,占總發文量的59.3%。2020年達到高峰,累計發文量116篇,2021年的發文量(105篇)相比2020年有略微下降,我們推斷該領域的相關研究正處在瓶頸期;見圖1a。盡管如此,NPs在NSCLC治療中的應用仍是當下的研究熱點,未來合理使用NPs可能會顯著提升NSCLC治療手段的多樣性和有效性。
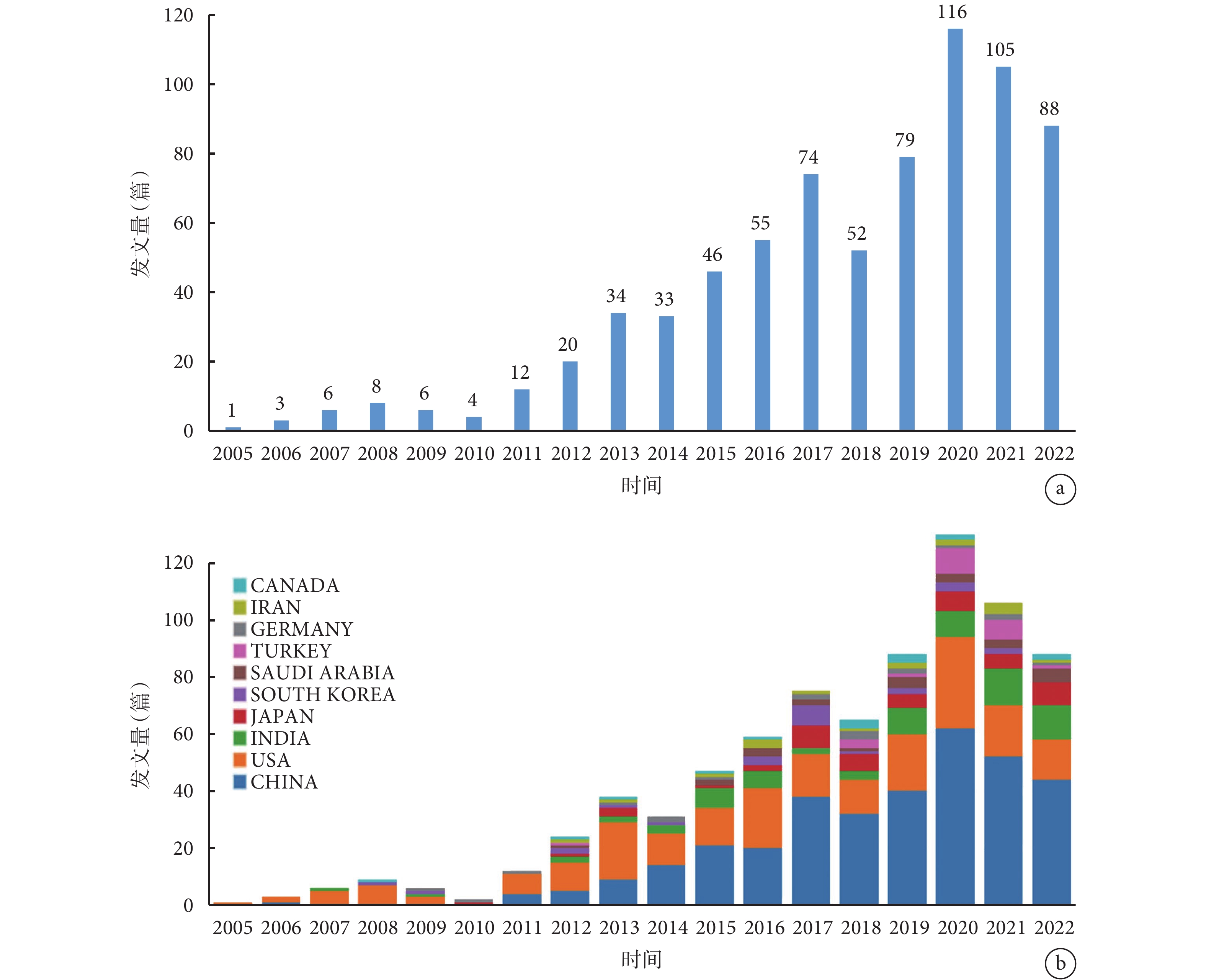 圖1
發文量統計分析
圖1
發文量統計分析
a:年發文總量;b:年發文量排名前10的國家發文量
美國是最早投入到該研究領域的國家,對本研究領域的發展起到了開創性的作用。我們還發現,從2017年初開始我國年發文量已經超過美國,至今仍持續處于領先地位;見圖1b。
2.2 來源期刊分布
742篇文獻來自283個期刊,發文量排名前10的期刊信息見表1。
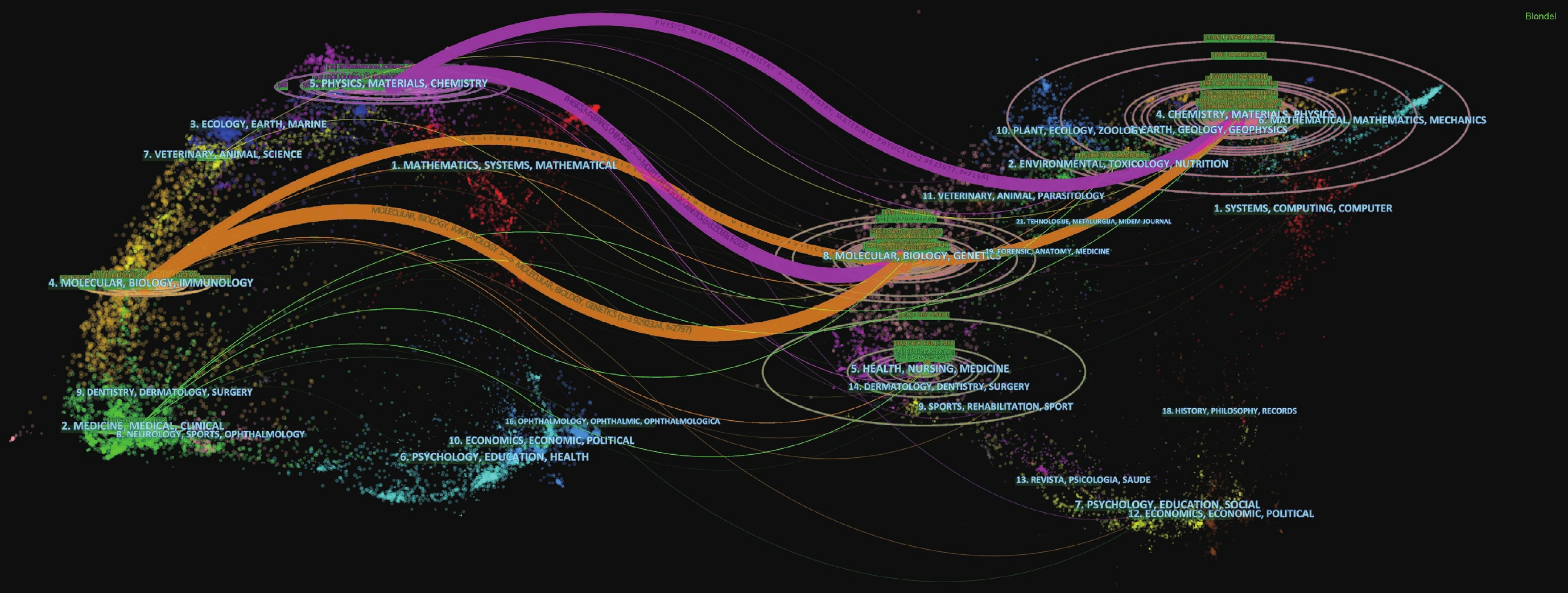
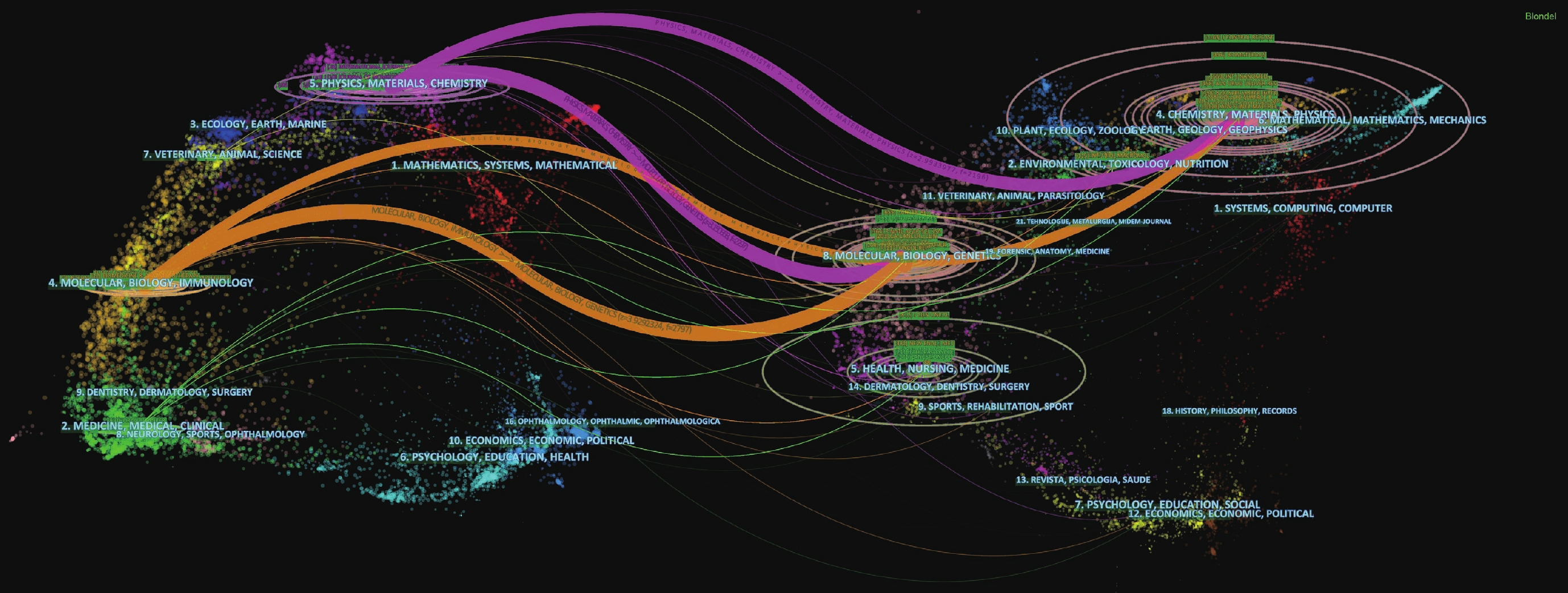
Dual-map overlay可以被運用于學科和期刊的分析,并將兩者聯系起來。經過分析可知,與NPs治療NSCLC研究相關的施引文獻主要發表在物理學、材料學、化學、分子學、生物學和免疫學期刊上,而被引文獻主要發表在化學、物理學、材料學、分子學、生物學和遺傳學期刊上;見圖2。因此,對于NPs和NSCLC治療的研究離不開醫學基礎學科和生物化學工程類學科的有機結合。
2.3 核心作者可視化分析
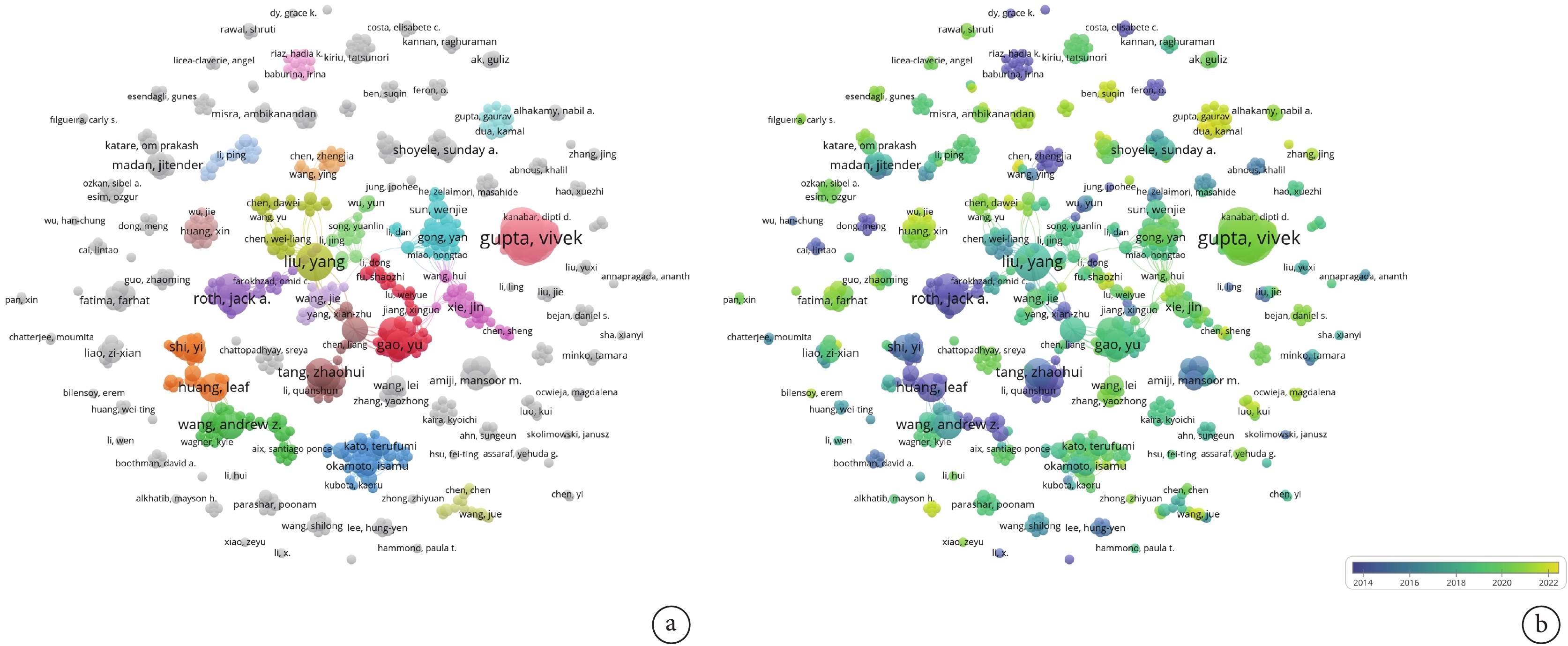
將文獻以制表符分隔文件的形式導入VOSviewer進行作者分析,設置單個作者的最少出現次數為2,得到可供分析的作者653位。該研究領域發文量前10的作者中,有7位來自美國,3位來自中國。其中美國學者Gupta Vivek發文15篇,是NPs治療NSCLC研究領域發文量最高的作者,占總文獻數的2.02%;見表2。聚類視圖分析可知,位于中心的聚類是由Liu Yang(黃色)、Gao Yu(紅色)、Tang Zhaohui(褐色)、Gong Yan(藍色)、Xie Jin(粉色)及其所在團隊構成,以上5大研究團隊不僅內部聯系緊密,而且相互之間也存在較為密切的合作關系。團隊主要研究人員均來自中國,展現出了國內該領域良好的合作氛圍,但是鮮與國外的主要研究團隊(Gupta Vivek和Roth Jack A研究團隊)建立合作關系。不僅如此,以上5大國內研究團隊的主要成果產出多集中在2014—2018年,近幾年廣泛開展本領域研究且密切合作的是國外研究者Gupta Gaurav和Dua Kamal;見圖3。因此,國內的研究者們仍需繼續加強與國外研究團隊之間的相互交流,以建立全方位、多層次合作關系。
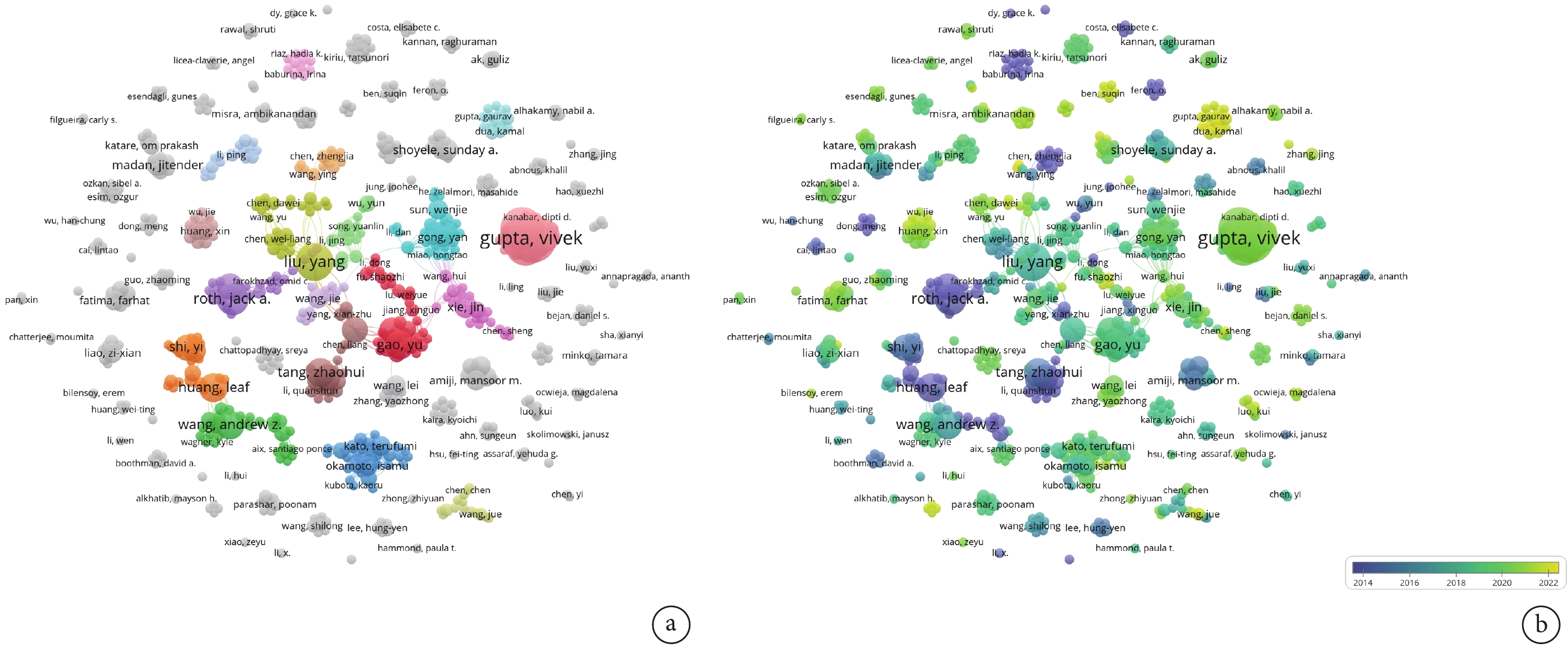 圖3
作者合作網絡分析
圖3
作者合作網絡分析
a:作者合作網絡示意圖,圓圈、字號的大小與發文量成正比,相互連線的密集度代表合作的緊密程度;b:作者時序分析示意圖,不同顏色代表作者發表文獻的不同年份
2.4 國家/機構合作可視化分析
我國發文量344篇,位列第1,占本研究領域總發文量的46.36%,約為排名第2的美國發文量(183篇)的2倍,印度發文量65篇,位列第3。整體上來看,NPs與NSCLC治療的研究主要分布在亞洲、北美洲和大洋洲。各個節點之間的連線眾多且較為復雜,表明各國在NPs與NSCLC治療的研究上均有合作,但中國、美國和印度之間的合作關系最為密切;見圖4a。
在相關研究機構中,中國科學院的發文量最多(29篇),其次是復旦大學、北卡羅萊納大學和上海交通大學,分別是25篇、21篇和19篇。我國進行該領域研究的機構較多,并且機構間的合作也較為緊密,但與國外研究機構合作較少;見圖4b。因此,應加強我國與其他國家研究機構的交流與合作,構建全球合作網絡,促進研究質量的提升,進而改善全球NSCLC患者的生活質量和預后。
2.5 關鍵詞分析
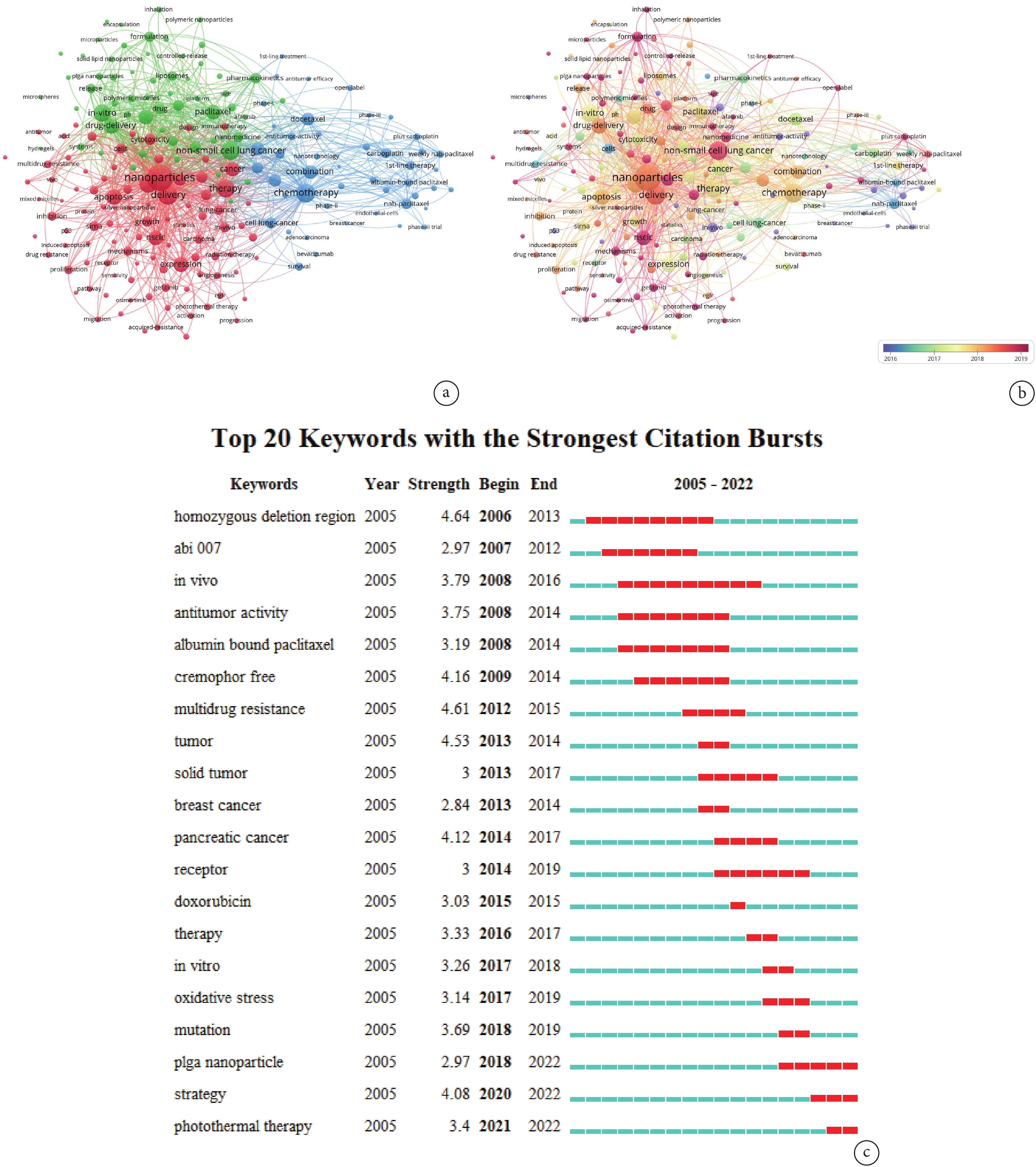
目前NPs與NSCLC治療方面的關鍵詞聚類主要分為3大部分。在所有聚類中占比最高的是NPs(紅色),包括NPs的體內相容性、藥物遞送以及促細胞凋亡機制等相關內容。第二大聚類(藍色)主要是化療藥物的選取,最常用的有多西他賽、卡鉑等。該聚類主要圍繞NPs的負載物進行整合歸類,這些負載物常以化療藥為主。第三大聚類(綠色)主要圍繞NPs的材料和結構,不同材料和結構的NPs存在不同的物理化學特性,其中包括聚合物NPs[17]、固體脂質NPs[18]和金屬NPs[19]等。不僅如此,NPs的藥物封裝和體內輸入方式也是該聚類的一大部分;見圖5a。與此同時,分析關鍵詞時序圖可以發現,關于NSCLC中的納米藥物、免疫療法、聚合物NPs等研究具有較大的前瞻性且較為新穎;見圖5b。NPs從2019年開始成為本領域的研究熱點并進入研究者們的視野,近幾年研究者將其與藥物遞送和NSCLC放化療結合開展研究;見表3。
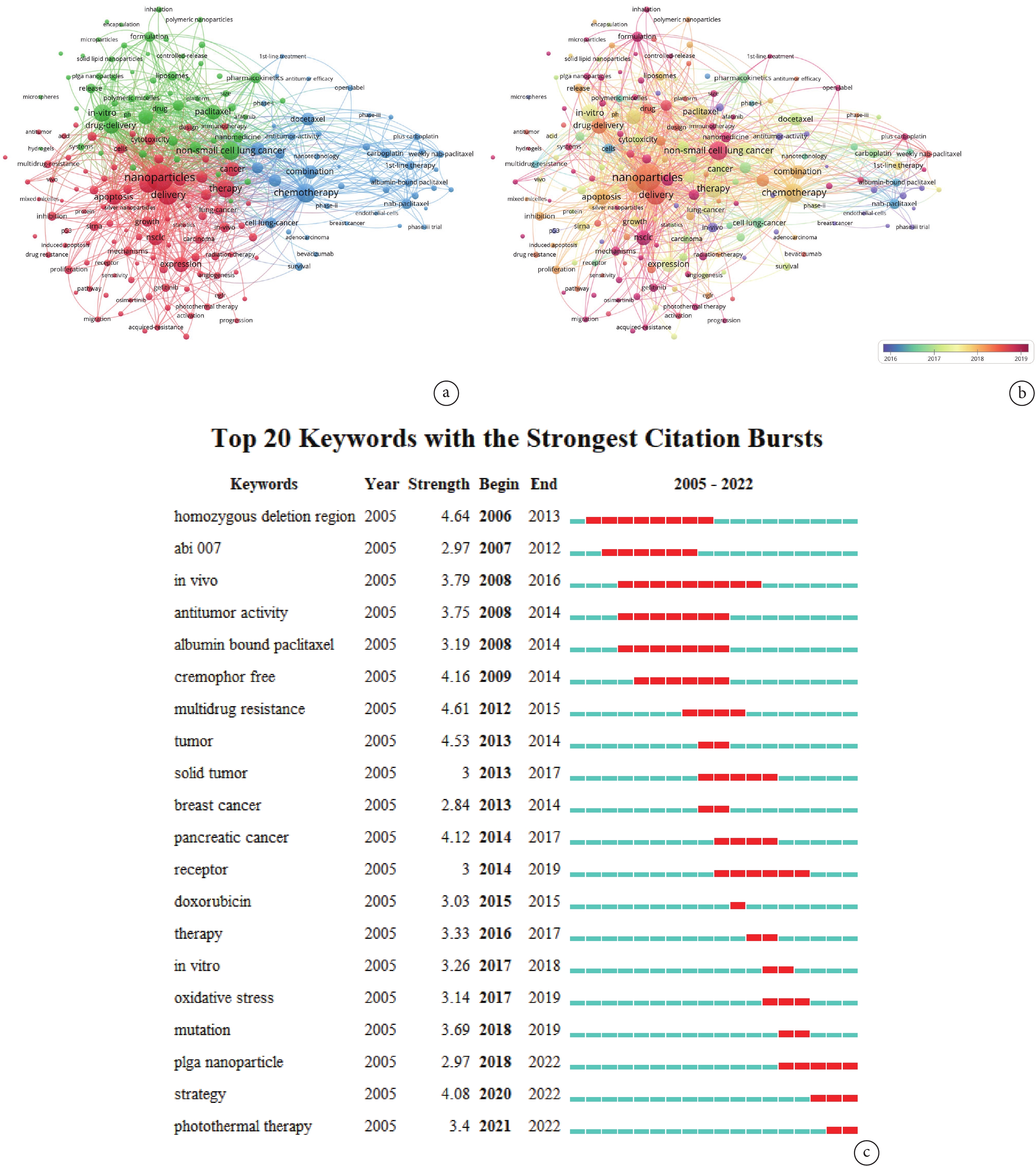 圖5
關鍵詞分析
圖5
關鍵詞分析
a:關鍵詞聚類示意圖,不同顏色代表關鍵詞的不同聚類,圓圈之間的連線代表關鍵詞之間的關聯程度;b:關鍵詞時序分析示意圖,圓圈的不同顏色代表關鍵詞出現的不同年份;c:關鍵詞突現示意圖,圖中所示為突現強度前20的關鍵詞,按照突現起始年份由遠及近(從上至下)依次排列,圖片右側每一藍色短帶代表1年,紅色短帶代表突現持續時間
關鍵詞突現展示了NPs在NSCLC治療中的研究熱點轉變趨勢。該領域中最早的研究成果是abi007(一種基于白蛋白的紫杉NPs),目前研究者們正在嘗試將其作為復發性NSCLC患者的治療藥物開展臨床試驗并對其有效性進行評估[20]。隨后研究逐漸過渡到化療藥物的多重耐藥性以及NPs作用受體的研究。近幾年聚乳酸羥基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)NPs和NSCLC光照療法(photothermal therapy,PTT)的研究廣泛開展,并成為該領域的研究熱點;見圖5c。
3 討論
文獻計量學是一門對已發表文獻進行統計和定量分析的學科,該學科可以合理分析并得出特定領域的熱點研究問題和發展趨勢,為研究者們提供全局性和指導性的幫助[21]。通過合作網絡分析、時序分析、聚類分析等多種分析手段對所研究領域進行全方位把控,可以展示特定領域以往研究的不足并快速挖掘未來的研究趨勢。
目前,肺癌發病率和死亡率均居第1位。2022年的全球癌癥統計數據[1]顯示,在中國無論是男性還是女性最常患的癌癥均是肺癌。所有肺癌組織學分型中,NSCLC占比約80%[22]。不僅如此,在NSCLC的各亞型中,肺腺癌的患病率在西方國家接近47%,而我國的肺腺癌患者約占所有NSCLC病例的55%~60%,形勢不容樂觀[23]。目前,手術切除仍是早期NSCLC的最優治療方式,但隨著近幾年靶向治療、免疫治療以及新興納米技術在腫瘤治療領域的應用,NSCLC的治療手段也在不斷更新與發展。對于目前NPs結合NSCLC治療的研究現狀進行梳理分析,可以較明確指出該領域未來的發展方向和研究熱點。
本研究發現,NPs與NSCLC治療領域的文獻發表數量不斷增加,自2011年開始呈現較為明顯的上升趨勢。雖然本研究統計的742篇文獻中有很大一部分來自中國,但是美國卻是該領域最早開展研究的國家。近年對于NSCLC的治療均體現出治療手段的多樣化,這與日益精進的藥物研發水平和多種新興療法的出現密不可分。同時這也是肺癌治療發展的必然趨勢,全球肺癌患者數量不斷上升,臨床和基礎科研工作者們迫切需要找到一種有效的治療手段,以破除肺癌患者晚治難治的困境。作者和機構分析可知,我國有較多研究團隊開展過該領域的研究,但是目前仍繼續堅持研究并獲得較多研究成果的主要是美國學者Gupta Vivek及其團隊。分析關鍵詞不難發現,各國研究機構和研究人員的重點關注內容以“化療藥物遞送”“PLGA NPs”和“PTT”為主。其中,用于NSCLC治療的化療藥物的輸送在關鍵詞聚類中占據最大部分。此外,研究人員對NPs體內應用中的細胞毒性也進行了較深入研究。2018年以來,“PLGA NPs”和“PTT”先后成為納米顆粒在NSCLC治療中的研究熱點,對其深入研究有望推動該領域未來的發展,有效改善NSCLC患者的預后。
PTT作為2021年突現的關鍵詞并延續至今,成為目前NPs治療NSCLC的一大研究熱點。簡而言之,PTT是一種通過光照射而導致局部熱損傷的癌癥治療手段,在高功率的激光器和高達數百瓦的激光照射下可對腫瘤細胞產生有效的殺傷作用[24]。但是該療法仍然存在較大的局限性:(1)一些健康細胞/組織中存在的內源性發色團(有顏色的光吸收分子)會妨礙激光對腫瘤細胞/組織的選擇性和靶向性;(2)高功率激光設備的使用較為復雜,操作的安全性也需重視[25]。對于高能激光器的使用,只有將其精準照向腫瘤細胞才能對其產生有效的殺傷作用并避免健康細胞/組織受損,操作難度顯而易見[26]。高效光熱造影劑的開發與應用顯得非常重要,高水平的光吸收率、光轉換率、靶向性以及良好的生物相容性缺一不可[27]。因此,研究者們將關注點匯聚于新一代基于NPs的光熱造影劑,其可較大程度提升高能激光照射的靶向性。不僅如此,使用納米光熱造影劑可以有效增大激光吸收率,在使用低功率設備進行照射的同時也可以產生很好的腫瘤消融作用,以此增加激光器使用的安全性和簡便性。金NPs是直徑1~100 nm的小金顆粒,其依靠較低的毒性和良好的生物相容性從眾多NPs中脫穎而出[28]。在PTT中,金NPs更是展現出了超高的光子吸收率,在功率相對較低的激光器的照射下,入射光子被金NPs廣泛大量吸收并轉化為熱能,以此保證了腫瘤的高效消融[29]。Camacho等[30]已經在體外實驗中證明光激發的金殼分離NPs在誘導A549肺腺癌細胞活性抑制中可產生有效作用,而同樣情況下PTT則對肺腺癌細胞周圍的健康細胞影響較小。值得關注的是,近幾年也有學者提出不同觀點,盡管PTT的研究潛力較好,但是相比普通PTT而言,光動力療法和無光熱造影劑的PTT開發更為成熟,臨床應用更為熟練。不僅如此,PTT的臨床研究和臨床前研究所關注的重點不一致,前者的普遍關注點在于高能激光設備功率的提升,而后者更注重靶向光熱造影劑的開發,基礎研究的臨床轉化存在較大困難[31]。
PLGA是一種無毒、可生物降解和生物相容性較好的聚合物。PLGA經過生物改造后形成的PLGA NPs具有良好的靶向作用,在體內可以到達特定的癌細胞,從而增加藥物遞送的精確性[32]。Feng等[33]使用基于PLGA的智能納米遞送系統輸送多西他賽,期間結合PTT、化療和免疫療法,可以產生較好的A549細胞殺傷作用。因此,PTT和基于PLGA NPs的遞送系統不僅是目前NSCLC治療的一大研究熱點,而且將來有望成為治療NSCLC的重要手段。
本研究存在一定的局限性:數據的廣泛性和完整性仍然不足,數據來源僅局限于英文數據庫Web of Science,并未涉及到相關研究的中文文獻,仍然需要NSCLC的國內外專業數據庫加以交叉驗證。
綜上所述,納米技術作為一種新興醫療科學技術在與NSCLC相關的研究方面獨樹一幟,使NSCLC治療手段逐漸從單純的手術治療、放化療過渡到免疫靶向、NPs藥物遞送平臺結合治療。目前,研究者們積極將納米技術與NSCLC治療融合,嘗試開發出新型NPs遞送平臺和光熱造影劑,以增強化療藥物的靶向性和PTT的精準性,PTT中光熱造影劑的改進和NPs遞送平臺的設計將有可能成為未來NSCLC治療的研究熱點和發展方向。
利益沖突:無。
作者貢獻:徐翔宇、盧毅、朱劍煒負責論文初稿撰寫和修改;孫飛、單一波、陳文軒負責論文整體布局設計;徐翔宇、袁磊、沈志明負責數據收集、整理、統計與分析;史宏燦負責論文審查與文獻校對。
最新的統計數據[1]顯示,肺癌是世界范圍內發病率和死亡率均居第1位的惡性腫瘤。如今,肺癌的治療手段逐漸多樣化,但是絕大多數肺癌患者仍然預后不佳。非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌組織學分型中的一種,該類患者占所有肺癌患者的80%[2]。手術、放化療的單獨或結合應用在NSCLC的治療中各有優勢,但是各種治療手段的局限性以及對機體的副作用也不容小覷[3]。近年來,新出現的免疫治療和靶向治療對NSCLC患者的預后有一定的改善,但是其僅能為一些特定群體提供有效的藥物治療,隨之而來的免疫反應等相關問題也亟待解決[4]。隨著科學技術的不斷進步,納米技術在醫學領域的研究應用使NSCLC患者有機會獲得更有效的治療,其中納米顆粒(nanoparticles,NPs)不但作為納米材料的一種特殊表現形式在納米醫學的應用中占據主導地位,而且也是當前NSCLC治療的研究熱點,對改善NSCLC患者的健康狀況有很大潛力[5]。NPs具有良好的生物相容性和較高的表面積比,依靠其特殊結構可以有效封裝化療藥物并將其準確輸送至肺癌細胞中,避免損傷正常組織器官[6]。NPs不僅可以彌補普通化療藥物體內遞送所產生的非特異性毒性,而且可以有效控制藥物在體內釋放的速度,減少用藥頻率的同時提升藥物在體內的利用率[7]。隨著時代和科技的發展,納米技術在NSCLC治療中的應用越來越受到國內外研究者的關注。本研究擬采用文獻計量學的方法,對該領域的研究熱點進行可視化分析,并預測未來發展方向,為國內從事NPs治療NSLCL研究的學者提供理論指導與幫助。
1 資料與方法
1.1 文獻檢索
檢索Web of Science核心合集中NPs應用于NSCLC的相關文獻,檢索時間為建庫至2022年11月。檢索式為:TS=(nanoparticle*) AND (TS=(non-small cell lung cancer) OR TS=(NSCLC) OR TS=(non-small cell lung carcinoma)) AND (TS=(therapy) OR TS=(treatment*) OR TS=(therapeutic))。
1.2 文獻納入與排除標準
研究對象:NPs在NSCLC治療中的應用;文獻類型:論著和綜述;語種:英語。排除重復發表的文獻、會議記錄、專題報道、信件、評論等。
1.3 數據處理與分析
本研究基于文獻計量學的方法,分別對發文量、發文國家、作者及其機構的合作關系、關鍵詞、文獻共被引頻次、突現詞等進行分析。年發文量代表該研究方向在每年的研究熱度;作者和機構的合作關系和發文量可以看出此研究方向的重點研究人員與機構[8];關鍵詞分析可以看出該研究方向中的重點研究對象[9];突現詞分析可以看到未來該研究方向的發展[10]。
1.4 主要研究工具
本研究采用文獻可視化軟件CiteSpace 6.1.R2(Java 17.0.1)和VOSviewer 1.6.18,以及文獻計量在線分析平臺(https://bibliometric.com/)開展研究。CiteSpace軟件[11]是美國德雷塞爾大學信息科學與技術學院陳超美教授及其團隊開發的一種通過算法將大量數據整合處理分析的文獻計量可視化軟件,其可以用來探尋某一學科的研究前沿、當前熱點以及對學科未來進行科學預估。VOSviewer軟件[12]是荷蘭萊頓大學科學技術研究中心開發的計量分析軟件,目前主要應用領域是文獻計量學。
2 結果
2.1 文獻檢索結果
初次檢索得到文獻782篇。通過2位研究者(徐翔宇和袁磊)的多次獨立篩查并交叉核對后去除與本文主題無關的文獻10篇,去除會議摘要14篇,社論9篇,會議記錄4篇,數據論文2篇,重復文獻1篇,最終得到文獻742篇,以純文本格式和制表符分隔文件形式導出。
從整體上來看,文獻發表數量呈上升趨勢,2018—2022年的發文量達440篇,占總發文量的59.3%。2020年達到高峰,累計發文量116篇,2021年的發文量(105篇)相比2020年有略微下降,我們推斷該領域的相關研究正處在瓶頸期;見圖1a。盡管如此,NPs在NSCLC治療中的應用仍是當下的研究熱點,未來合理使用NPs可能會顯著提升NSCLC治療手段的多樣性和有效性。
 圖1
發文量統計分析
圖1
發文量統計分析
a:年發文總量;b:年發文量排名前10的國家發文量
美國是最早投入到該研究領域的國家,對本研究領域的發展起到了開創性的作用。我們還發現,從2017年初開始我國年發文量已經超過美國,至今仍持續處于領先地位;見圖1b。
2.2 來源期刊分布
742篇文獻來自283個期刊,發文量排名前10的期刊信息見表1。
Dual-map overlay可以被運用于學科和期刊的分析,并將兩者聯系起來。經過分析可知,與NPs治療NSCLC研究相關的施引文獻主要發表在物理學、材料學、化學、分子學、生物學和免疫學期刊上,而被引文獻主要發表在化學、物理學、材料學、分子學、生物學和遺傳學期刊上;見圖2。因此,對于NPs和NSCLC治療的研究離不開醫學基礎學科和生物化學工程類學科的有機結合。
2.3 核心作者可視化分析
將文獻以制表符分隔文件的形式導入VOSviewer進行作者分析,設置單個作者的最少出現次數為2,得到可供分析的作者653位。該研究領域發文量前10的作者中,有7位來自美國,3位來自中國。其中美國學者Gupta Vivek發文15篇,是NPs治療NSCLC研究領域發文量最高的作者,占總文獻數的2.02%;見表2。聚類視圖分析可知,位于中心的聚類是由Liu Yang(黃色)、Gao Yu(紅色)、Tang Zhaohui(褐色)、Gong Yan(藍色)、Xie Jin(粉色)及其所在團隊構成,以上5大研究團隊不僅內部聯系緊密,而且相互之間也存在較為密切的合作關系。團隊主要研究人員均來自中國,展現出了國內該領域良好的合作氛圍,但是鮮與國外的主要研究團隊(Gupta Vivek和Roth Jack A研究團隊)建立合作關系。不僅如此,以上5大國內研究團隊的主要成果產出多集中在2014—2018年,近幾年廣泛開展本領域研究且密切合作的是國外研究者Gupta Gaurav和Dua Kamal;見圖3。因此,國內的研究者們仍需繼續加強與國外研究團隊之間的相互交流,以建立全方位、多層次合作關系。
 圖3
作者合作網絡分析
圖3
作者合作網絡分析
a:作者合作網絡示意圖,圓圈、字號的大小與發文量成正比,相互連線的密集度代表合作的緊密程度;b:作者時序分析示意圖,不同顏色代表作者發表文獻的不同年份
2.4 國家/機構合作可視化分析
我國發文量344篇,位列第1,占本研究領域總發文量的46.36%,約為排名第2的美國發文量(183篇)的2倍,印度發文量65篇,位列第3。整體上來看,NPs與NSCLC治療的研究主要分布在亞洲、北美洲和大洋洲。各個節點之間的連線眾多且較為復雜,表明各國在NPs與NSCLC治療的研究上均有合作,但中國、美國和印度之間的合作關系最為密切;見圖4a。
在相關研究機構中,中國科學院的發文量最多(29篇),其次是復旦大學、北卡羅萊納大學和上海交通大學,分別是25篇、21篇和19篇。我國進行該領域研究的機構較多,并且機構間的合作也較為緊密,但與國外研究機構合作較少;見圖4b。因此,應加強我國與其他國家研究機構的交流與合作,構建全球合作網絡,促進研究質量的提升,進而改善全球NSCLC患者的生活質量和預后。
2.5 關鍵詞分析
目前NPs與NSCLC治療方面的關鍵詞聚類主要分為3大部分。在所有聚類中占比最高的是NPs(紅色),包括NPs的體內相容性、藥物遞送以及促細胞凋亡機制等相關內容。第二大聚類(藍色)主要是化療藥物的選取,最常用的有多西他賽、卡鉑等。該聚類主要圍繞NPs的負載物進行整合歸類,這些負載物常以化療藥為主。第三大聚類(綠色)主要圍繞NPs的材料和結構,不同材料和結構的NPs存在不同的物理化學特性,其中包括聚合物NPs[17]、固體脂質NPs[18]和金屬NPs[19]等。不僅如此,NPs的藥物封裝和體內輸入方式也是該聚類的一大部分;見圖5a。與此同時,分析關鍵詞時序圖可以發現,關于NSCLC中的納米藥物、免疫療法、聚合物NPs等研究具有較大的前瞻性且較為新穎;見圖5b。NPs從2019年開始成為本領域的研究熱點并進入研究者們的視野,近幾年研究者將其與藥物遞送和NSCLC放化療結合開展研究;見表3。
 圖5
關鍵詞分析
圖5
關鍵詞分析
a:關鍵詞聚類示意圖,不同顏色代表關鍵詞的不同聚類,圓圈之間的連線代表關鍵詞之間的關聯程度;b:關鍵詞時序分析示意圖,圓圈的不同顏色代表關鍵詞出現的不同年份;c:關鍵詞突現示意圖,圖中所示為突現強度前20的關鍵詞,按照突現起始年份由遠及近(從上至下)依次排列,圖片右側每一藍色短帶代表1年,紅色短帶代表突現持續時間
關鍵詞突現展示了NPs在NSCLC治療中的研究熱點轉變趨勢。該領域中最早的研究成果是abi007(一種基于白蛋白的紫杉NPs),目前研究者們正在嘗試將其作為復發性NSCLC患者的治療藥物開展臨床試驗并對其有效性進行評估[20]。隨后研究逐漸過渡到化療藥物的多重耐藥性以及NPs作用受體的研究。近幾年聚乳酸羥基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)NPs和NSCLC光照療法(photothermal therapy,PTT)的研究廣泛開展,并成為該領域的研究熱點;見圖5c。
3 討論
文獻計量學是一門對已發表文獻進行統計和定量分析的學科,該學科可以合理分析并得出特定領域的熱點研究問題和發展趨勢,為研究者們提供全局性和指導性的幫助[21]。通過合作網絡分析、時序分析、聚類分析等多種分析手段對所研究領域進行全方位把控,可以展示特定領域以往研究的不足并快速挖掘未來的研究趨勢。
目前,肺癌發病率和死亡率均居第1位。2022年的全球癌癥統計數據[1]顯示,在中國無論是男性還是女性最常患的癌癥均是肺癌。所有肺癌組織學分型中,NSCLC占比約80%[22]。不僅如此,在NSCLC的各亞型中,肺腺癌的患病率在西方國家接近47%,而我國的肺腺癌患者約占所有NSCLC病例的55%~60%,形勢不容樂觀[23]。目前,手術切除仍是早期NSCLC的最優治療方式,但隨著近幾年靶向治療、免疫治療以及新興納米技術在腫瘤治療領域的應用,NSCLC的治療手段也在不斷更新與發展。對于目前NPs結合NSCLC治療的研究現狀進行梳理分析,可以較明確指出該領域未來的發展方向和研究熱點。
本研究發現,NPs與NSCLC治療領域的文獻發表數量不斷增加,自2011年開始呈現較為明顯的上升趨勢。雖然本研究統計的742篇文獻中有很大一部分來自中國,但是美國卻是該領域最早開展研究的國家。近年對于NSCLC的治療均體現出治療手段的多樣化,這與日益精進的藥物研發水平和多種新興療法的出現密不可分。同時這也是肺癌治療發展的必然趨勢,全球肺癌患者數量不斷上升,臨床和基礎科研工作者們迫切需要找到一種有效的治療手段,以破除肺癌患者晚治難治的困境。作者和機構分析可知,我國有較多研究團隊開展過該領域的研究,但是目前仍繼續堅持研究并獲得較多研究成果的主要是美國學者Gupta Vivek及其團隊。分析關鍵詞不難發現,各國研究機構和研究人員的重點關注內容以“化療藥物遞送”“PLGA NPs”和“PTT”為主。其中,用于NSCLC治療的化療藥物的輸送在關鍵詞聚類中占據最大部分。此外,研究人員對NPs體內應用中的細胞毒性也進行了較深入研究。2018年以來,“PLGA NPs”和“PTT”先后成為納米顆粒在NSCLC治療中的研究熱點,對其深入研究有望推動該領域未來的發展,有效改善NSCLC患者的預后。
PTT作為2021年突現的關鍵詞并延續至今,成為目前NPs治療NSCLC的一大研究熱點。簡而言之,PTT是一種通過光照射而導致局部熱損傷的癌癥治療手段,在高功率的激光器和高達數百瓦的激光照射下可對腫瘤細胞產生有效的殺傷作用[24]。但是該療法仍然存在較大的局限性:(1)一些健康細胞/組織中存在的內源性發色團(有顏色的光吸收分子)會妨礙激光對腫瘤細胞/組織的選擇性和靶向性;(2)高功率激光設備的使用較為復雜,操作的安全性也需重視[25]。對于高能激光器的使用,只有將其精準照向腫瘤細胞才能對其產生有效的殺傷作用并避免健康細胞/組織受損,操作難度顯而易見[26]。高效光熱造影劑的開發與應用顯得非常重要,高水平的光吸收率、光轉換率、靶向性以及良好的生物相容性缺一不可[27]。因此,研究者們將關注點匯聚于新一代基于NPs的光熱造影劑,其可較大程度提升高能激光照射的靶向性。不僅如此,使用納米光熱造影劑可以有效增大激光吸收率,在使用低功率設備進行照射的同時也可以產生很好的腫瘤消融作用,以此增加激光器使用的安全性和簡便性。金NPs是直徑1~100 nm的小金顆粒,其依靠較低的毒性和良好的生物相容性從眾多NPs中脫穎而出[28]。在PTT中,金NPs更是展現出了超高的光子吸收率,在功率相對較低的激光器的照射下,入射光子被金NPs廣泛大量吸收并轉化為熱能,以此保證了腫瘤的高效消融[29]。Camacho等[30]已經在體外實驗中證明光激發的金殼分離NPs在誘導A549肺腺癌細胞活性抑制中可產生有效作用,而同樣情況下PTT則對肺腺癌細胞周圍的健康細胞影響較小。值得關注的是,近幾年也有學者提出不同觀點,盡管PTT的研究潛力較好,但是相比普通PTT而言,光動力療法和無光熱造影劑的PTT開發更為成熟,臨床應用更為熟練。不僅如此,PTT的臨床研究和臨床前研究所關注的重點不一致,前者的普遍關注點在于高能激光設備功率的提升,而后者更注重靶向光熱造影劑的開發,基礎研究的臨床轉化存在較大困難[31]。
PLGA是一種無毒、可生物降解和生物相容性較好的聚合物。PLGA經過生物改造后形成的PLGA NPs具有良好的靶向作用,在體內可以到達特定的癌細胞,從而增加藥物遞送的精確性[32]。Feng等[33]使用基于PLGA的智能納米遞送系統輸送多西他賽,期間結合PTT、化療和免疫療法,可以產生較好的A549細胞殺傷作用。因此,PTT和基于PLGA NPs的遞送系統不僅是目前NSCLC治療的一大研究熱點,而且將來有望成為治療NSCLC的重要手段。
本研究存在一定的局限性:數據的廣泛性和完整性仍然不足,數據來源僅局限于英文數據庫Web of Science,并未涉及到相關研究的中文文獻,仍然需要NSCLC的國內外專業數據庫加以交叉驗證。
綜上所述,納米技術作為一種新興醫療科學技術在與NSCLC相關的研究方面獨樹一幟,使NSCLC治療手段逐漸從單純的手術治療、放化療過渡到免疫靶向、NPs藥物遞送平臺結合治療。目前,研究者們積極將納米技術與NSCLC治療融合,嘗試開發出新型NPs遞送平臺和光熱造影劑,以增強化療藥物的靶向性和PTT的精準性,PTT中光熱造影劑的改進和NPs遞送平臺的設計將有可能成為未來NSCLC治療的研究熱點和發展方向。
利益沖突:無。
作者貢獻:徐翔宇、盧毅、朱劍煒負責論文初稿撰寫和修改;孫飛、單一波、陳文軒負責論文整體布局設計;徐翔宇、袁磊、沈志明負責數據收集、整理、統計與分析;史宏燦負責論文審查與文獻校對。