體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技術是治療嚴重心肺衰竭患者重要的生命支持方式。建立穩定的ECMO動物模型有助于深入探究ECMO對機體的影響,為臨床上ECMO管理策略的優化和并發癥防治提供幫助。近年來,大鼠因其價格低廉、重復性好等優點被廣泛用于ECMO實驗模型的建立。因此本文就ECMO大鼠模型的相關文獻進行綜述,旨在對ECMO大鼠模型的環路設備、圍實驗期管理策略等進行全面總結,為后續建立更為穩定、成熟的ECMO大鼠模型提供理論基礎。
引用本文: 王添隆, 閆偉東, 吉冰洋. 大鼠體外膜肺氧合實驗動物模型研究新進展. 中國胸心血管外科臨床雜志, 2024, 31(6): 915-921. doi: 10.7507/1007-4848.202305012 復制
體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)由術中體外循環(cardiopulmonary bypass,CPB)技術發展而來,可以長時間全部或部分替代心肺功能,是嚴重心肺衰竭患者重要的生命支持治療方式[1-2]。通過建立穩定的ECMO動物模型,可深入研究ECMO對機體的影響,對臨床上優化ECMO管理策略、減少ECMO相關并發癥、改善患者預后等具有重要意義。
目前,國內外學者已經將羊、豬、兔等動物作為ECMO動物模型建立的實驗對象[3-5]。近年來,因大鼠解剖結構與人類幾乎相同、體積小、成本低、建模過程相對簡單、重復性高等優點而被廣泛用于ECMO實驗模型的建立[6]。但目前ECMO大鼠模型的環路設備、圍實驗期管理策略等仍需進一步完善。既往有研究[7]對ECMO大鼠模型環路設備進行了歸納總結,但缺少文章系統總結ECMO大鼠模型整體圍手術期管理策略。因此本文將對ECMO大鼠模型的相關文獻進行綜述,重點補充近期大鼠ECMO模型的相關研究,并對ECMO大鼠模型的環路設備、圍實驗期管理策略、研究現狀等進行全面總結,從而為后續建立更為穩定、成熟的ECMO大鼠模型提供可靠的理論依據。
1 體外膜肺氧合大鼠模型基礎特征
1.1 實驗大鼠的選擇
ECMO大鼠模型多采用Sprague-Dawley大鼠,有明確大鼠周齡報道的研究較少,大鼠體重一般控制在300~550 g,符合成年鼠的標準;見表1。成年大鼠抗創傷能力較強,血管條件相對成熟,易于模型的穩定建立。研究納入的實驗鼠大多為雄鼠,原因在于雌鼠存在激素的周期性變化[8],會對實驗結果產生影響,但未來實驗有必要納入雌鼠進行研究以探究ECMO模型在不同性別大鼠的差異。
1.2 圍實驗期監測
圍實驗期體溫監測方式多為直腸測溫,該測溫方式簡單易行,為大多數實驗所采用;見表1。在動脈血壓及心率監測方面,22/24G股動脈穿刺監測仍為首選;見表1。部分ECMO大鼠模型由于回流端選擇了股動脈,而將監測動脈更換為尾動脈或頸總動脈[14, 17-18, 23],不選擇另一側股動脈監測的原因可能在于回流端股動脈的泵入血流會在兩側股動脈交匯處影響血壓的測定。少數研究[15, 17-18, 23]選擇術中經頸動脈至左心室放置容積-壓力導管以實時監測心功能。血氣分析一般是在實驗前根據實驗目的確定好監測指標,并合理制定采血量與采血時間以減少血液丟失。
1.3 麻醉及呼吸管理
合理的麻醉方式及適當的麻醉深度是模型建立的基礎。目前ECMO大鼠模型大多采用七氟烷/異氟烷吸入麻醉;見表1。吸入麻醉為非有創性麻醉方式,可以通過調節濃度和氣流量快速達到所需的麻醉深度,且吸入麻醉可以通過機械通氣所需的人工氣道實現,無需進行腹腔注射或經靜脈注射等額外的給藥操作。
大鼠人工氣道的建立大多選擇經口插入14/16G氣管導管,機械通氣均采用容量控制通氣模式。根據大鼠常規生理特征,呼吸頻率設為60~80次/min,潮氣量控制在6~10 mL/kg,也有研究[18, 23]依據大鼠體重根據公式推算出具體的呼吸頻率和潮氣量參數;見表1。各研究間吸入氧濃度差異較大,這與各實驗團隊的實驗條件、實驗目的和管理策略不同有關。有研究[16]證實ECMO下高氧管理會造成超氧化物生成增多以誘發肺損傷和全身炎癥反應,因此應盡可能避免純氧或高濃度氧通氣管理。
2 體外膜肺氧合大鼠模型建立與管理策略
2.1 體外膜肺氧合回路組成
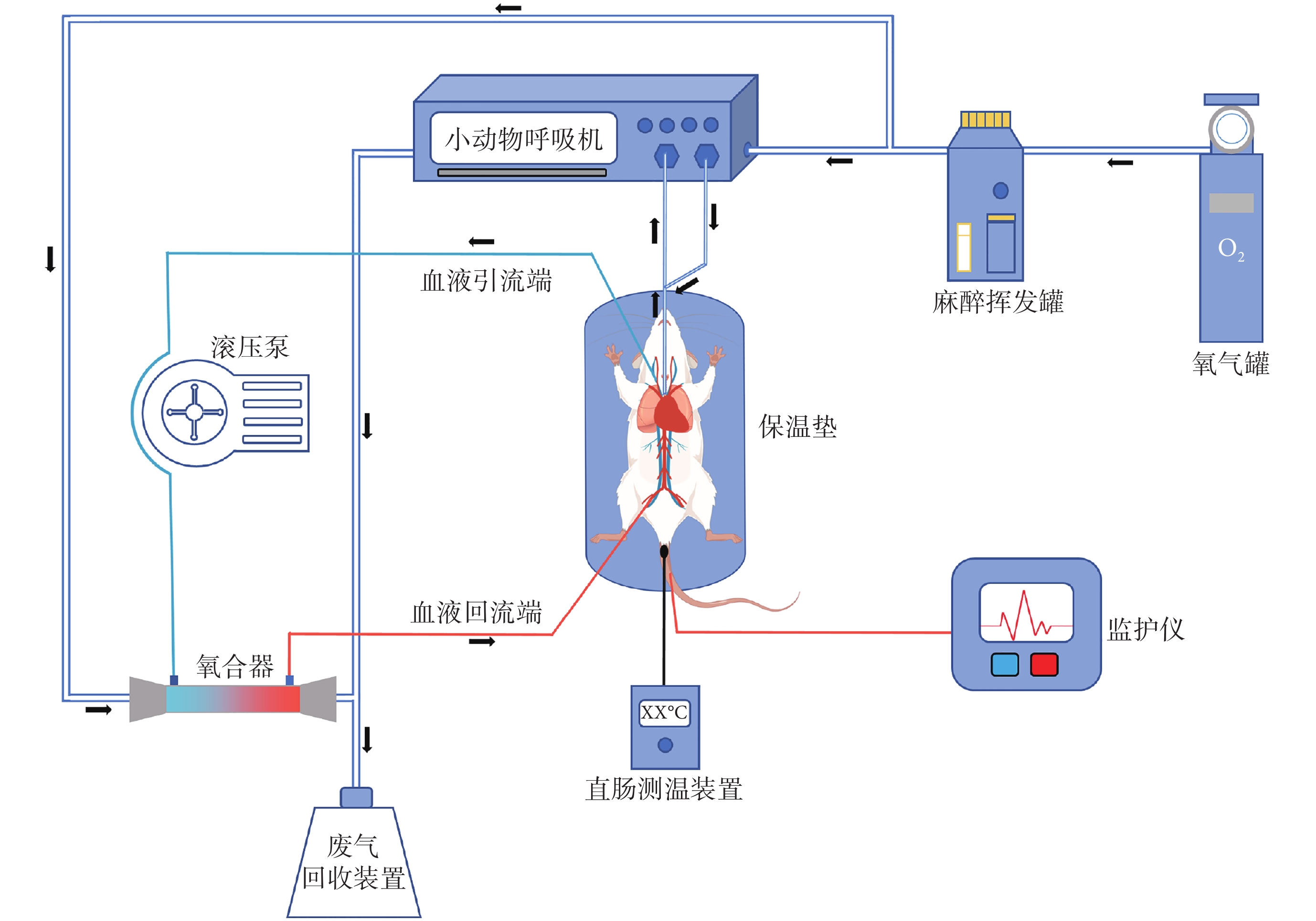
大鼠ECMO模型簡圖見圖1。ECMO回路主要包括血管內留置導管(引流端與回流端)、血泵、氧合器及連接管路。不同于CPB實現的是心臟手術中短期完全替代心肺功能,ECMO是在重癥監護室通過外周插管為嚴重心臟或呼吸衰竭患者提供長期心肺輔助,因此大鼠ECMO環路不配備回流室及熱交換器,整體回路體積小,以實現長時間中、低流量的心肺輔助。血泵的選擇上,離心泵雖與滾壓泵相比對血液成分破壞較輕,但離心泵在小流量下控制較為困難[31],不適用于大鼠ECMO回路。目前大鼠ECMO回路均應用小型滾壓泵,可匹配較小的連接管路,且能實現小流量下的精準調控。氧合器的選擇上,目前的研究大多應用公司自制的微型氧合器,在滿足氣體交換的需求下盡可能達到較小的預充量。部分研究[15, 25]在引流端到血泵之間連接充滿液體的注射器作為儲液器,以支持回路運轉并在轉流時排除回路中產生的氣泡;也有研究[10-13, 17-18]直接在回路中連接與大氣相連靜脈儲液器,雖然增加了整體回路預充量,但便于靜脈引流。整體回路的連接管路多選擇聚氯乙烯或硅膠材質,具有良好的彈性和柔韌性,且血液破壞較少。
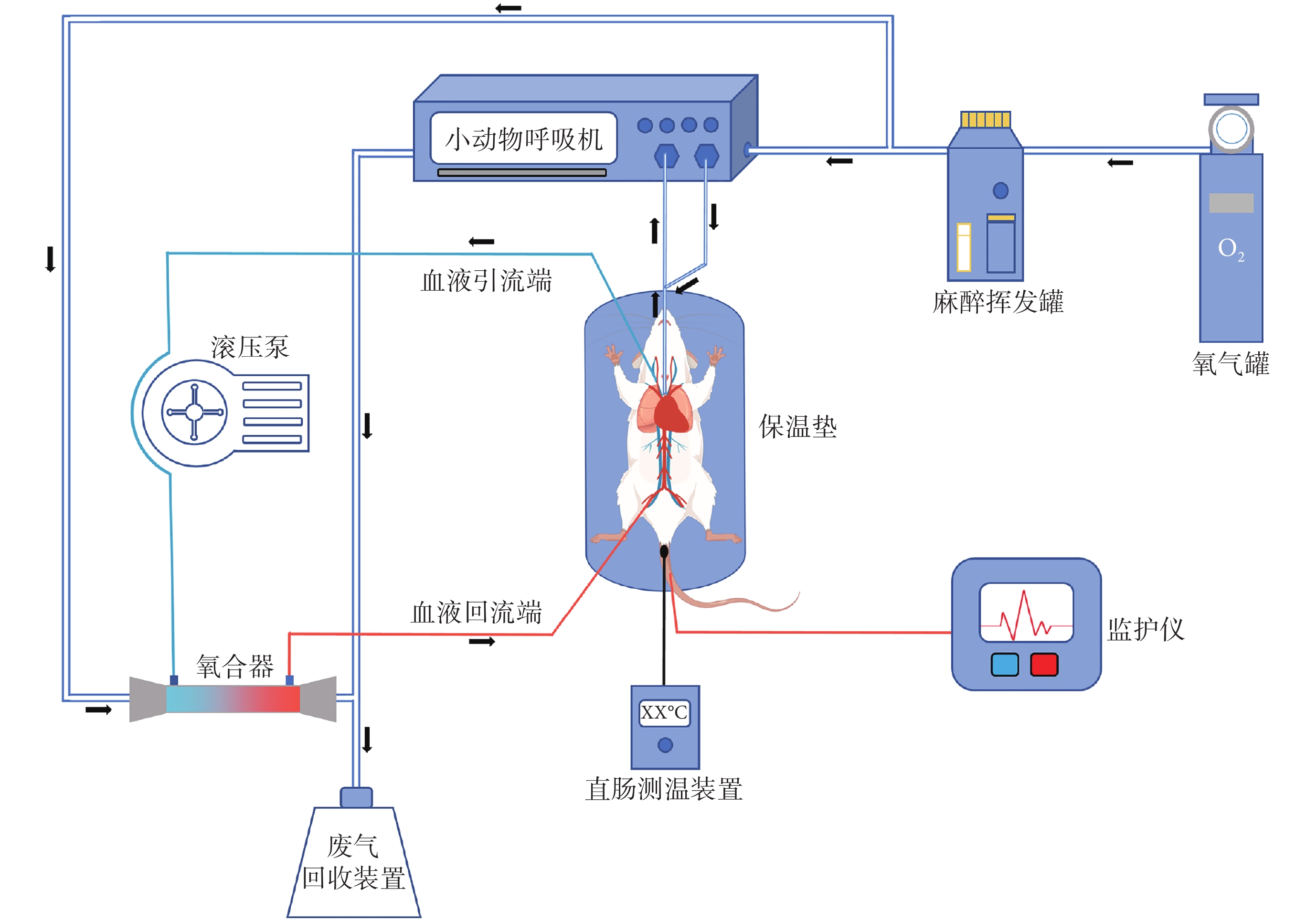 圖1
ECMO大鼠模型簡圖(以VA-ECMO模型為例)
圖1
ECMO大鼠模型簡圖(以VA-ECMO模型為例)
VA-ECMO:靜脈-動脈ECMO;ECMO:體外膜肺氧合
2.2 外科插管的選擇
ECMO模型具體置管血管的選擇依據所建立的ECMO類型的不同而改變。在臨床上,ECMO的3種主要類型是靜脈-動脈ECMO(veno-arterial extracorporeal membrane oxygenation,VA-ECMO)、靜脈-靜脈ECMO(veno-venous extracorporeal membrane oxygenation,VV-ECMO)以及專門應用于心肺復蘇患者的體外心肺復蘇(extracorporeal cardiopulmonary resuscitation,ECPR)[32]。對于VA-ECMO和ECPR這類靜脈引流、動脈回流模型,目前相關研究基本都選擇右側頸靜脈(頸內或頸外靜脈)進行靜脈引流,該通路便于置管到右心位置,可達到最佳引流量。僅一項研究[20],在VA-ECMO模型基礎上變化為動脈引流(左頸總動脈),靜脈回流(右側頸外靜脈),因該研究為評估一款小型3D打印氧合器對ECMO回路中血液凝血功能的影響,血壓高的動脈更易維持流量,故做此調整。靜脈留置導管多為自制多側孔靜脈引流管,便于置管后右心房的側邊引流。回流動脈的選擇依據研究者的操作習慣、測壓動脈的選擇等有所差異,但均為外周大動脈血管,包括股動脈、雙側頸動脈和尾動脈。對于VV-ECMO這類靜脈引流、靜脈回流模型,早期研究大多選擇右頸靜脈(頸內或頸外靜脈)和右股靜脈進行置管操作。近期Li等[28]利用自制的多腔靜脈套管實現了右頸靜脈單靜脈置管模式,節省了前期血管分離和置管的手術時間,且貼合臨床應用的單管雙腔頸靜脈置管VV-ECMO技術。部分研究[17-18, 23-24, 28-29]在轉機前額外分離股靜脈或側尾靜脈等非ECMO回路靜脈并置管,以便于術中由游離靜脈注射給藥。
2.3 體外膜肺氧合管理相關策略
預充液的選擇上,常規以晶體液和膠體液為主,可根據抗凝需要添加適量肝素。由于ECMO大鼠模型整體回路的不斷優化,總預充量可減少到6~8 mL;見表2。大鼠血容量約為64 mL/kg[33],低預充量可盡可能避免血液稀釋,從而達到安全穩定的無血預充。大多數研究選擇一次性靜脈注入300~500 IU/kg劑量的肝素實現全身肝素化,也有少數研究選擇持續泵入肝素以達到抗凝的目的。臨床上ECMO轉機前激活全血凝固時間(activated coagulation time,ACT)的參考值為180~200 s[34],目前較少研究報道大鼠ECMO模型啟動轉機ACT值,建議參照臨床參考值,轉機時可定時檢測凝血功能指標并及時調整抗凝策略。正常大鼠心排血量為160~180 mL/(kg·min)[15],大部分研究將轉機最大流量設定在大鼠心排血量的50%左右以模擬臨床上ECMO部分替代心肺功能以實現心肺輔助;見表2。目前大多研究將ECMO轉機時間設置在<3 h,原因可能是現有的大鼠適配氧合器及連接管路的適用性較臨床上的ECMO應用設備仍有差距,長時間轉機導致大鼠全身炎癥反應及血栓并發癥的風險較高。有研究[19]顯示,在ECMO轉機30 min后成年大鼠血液中炎性因子顯著上升。為避免長時間轉機對大鼠機體造成嚴重影響,建議結合實驗目的進行預實驗,摸索較為適宜的ECMO轉機時間。為減少大鼠ECMO轉機時炎癥激活和血栓形成、延長轉機時間以及更好地模擬臨床上ECMO提供長時間心肺輔助的情形,未來有必要利用更先進的材料制作微型氧合器及配套管路。
3 體外膜肺氧合大鼠模型研究現狀
現有研究大多圍繞各類疾病模型探究ECMO對機體的影響及其病理生理機制,如評估VA-ECMO在心肌梗死大鼠模型中的保護作用[15]、研究VV-ECMO對急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)和急性肺損傷大鼠的保護作用及機制[14, 24, 30]、證實ECPR相較傳統心肺復蘇對于心跳驟停(cardiac arrest,CA)大鼠有更好的救治效果[9]等。此外也有研究在ECMO模型基礎上應用其他干預措施探究其在各類疾病模型中的應用療效,如在VA-ECMO基礎上應用地塞米松可更有效地改善心肌梗死大鼠的心肌預后[22];注射YTHDF1敲除的巨噬細胞治療對于VA-ECMO膿毒血癥大鼠的腦損傷有保護作用[21];光療聯合VV-ECMO可增加CO中毒大鼠的CO清除率并改善預后[26];在CA大鼠ECPR過程中應用fingolimod可有效改善心功能、降低心肌損傷和炎癥反應[11]等。
由于ECMO在轉機過程中血液會與非生物表面接觸,導致炎癥反應激活以及血栓形成[35]。目前有研究對此進行了探索,如Edinger等[17]研究了alpha1-antitrypsin在VA-ECMO大鼠模型中抗炎反應的作用以及兩種不同小型動物氧合器(Micro-1型與SAMO型)在大鼠VA-ECMO模型中誘導炎癥反應的差異。Umei等[20]設計了3D打印的微型氧合器,縮小了ECMO回路體積并將預充量降低至2.5 mL,減少了血液稀釋對凝血功能的影響,為后期研究ECMO相關凝血疾病提供了可靠模型。
此外,還有少數研究在ECMO的圍術期管理方面進行了探索,如Edinger等[23]研究了在進行VA-ECMO治療時不同的肺通氣吸入氧濃度對心功能的影響,結果顯示ECMO期間肺缺氧會導致嚴重心功能障礙;Fujii等[16]研究了VA-ECMO期間不同動脈血氧分壓(partial pressure of oxygen in arterial blood,PaO2)對血清炎癥因子水平的影響,結果發現當PaO2>300 mm Hg時會加劇炎癥反應和肺損傷;Zhang等[29]證實了在VV-ECMO治療ARDS大鼠時應用吸入性麻醉藥七氟烷較靜脈注射丙泊酚可有效減少炎癥因子的產生并減輕肺損傷。
4 展望
目前,ECMO大鼠模型的建立已經逐步完善,但在設備及建模細節上仍需改進。未來需建立能盡可能模擬臨床實際、持續時間長、創傷小、大鼠術后可長期存活、操作簡單、重復性好的ECMO大鼠模型。利用該模型我們可以深入探究ECMO對機體的影響,探討ECMO結合其他治療手段的可行性及有效性,探索新型藥物等干預措施以減少ECMO并發癥等。未來更為完善的ECMO大鼠模型將為臨床上ECMO管理策略的優化、相關并發癥的防治等提供更有效的幫助。
利益沖突:無。
作者貢獻:王添隆檢索文獻,撰寫文章;閆偉東修改文章;吉冰洋制定綜述主題。
體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)由術中體外循環(cardiopulmonary bypass,CPB)技術發展而來,可以長時間全部或部分替代心肺功能,是嚴重心肺衰竭患者重要的生命支持治療方式[1-2]。通過建立穩定的ECMO動物模型,可深入研究ECMO對機體的影響,對臨床上優化ECMO管理策略、減少ECMO相關并發癥、改善患者預后等具有重要意義。
目前,國內外學者已經將羊、豬、兔等動物作為ECMO動物模型建立的實驗對象[3-5]。近年來,因大鼠解剖結構與人類幾乎相同、體積小、成本低、建模過程相對簡單、重復性高等優點而被廣泛用于ECMO實驗模型的建立[6]。但目前ECMO大鼠模型的環路設備、圍實驗期管理策略等仍需進一步完善。既往有研究[7]對ECMO大鼠模型環路設備進行了歸納總結,但缺少文章系統總結ECMO大鼠模型整體圍手術期管理策略。因此本文將對ECMO大鼠模型的相關文獻進行綜述,重點補充近期大鼠ECMO模型的相關研究,并對ECMO大鼠模型的環路設備、圍實驗期管理策略、研究現狀等進行全面總結,從而為后續建立更為穩定、成熟的ECMO大鼠模型提供可靠的理論依據。
1 體外膜肺氧合大鼠模型基礎特征
1.1 實驗大鼠的選擇
ECMO大鼠模型多采用Sprague-Dawley大鼠,有明確大鼠周齡報道的研究較少,大鼠體重一般控制在300~550 g,符合成年鼠的標準;見表1。成年大鼠抗創傷能力較強,血管條件相對成熟,易于模型的穩定建立。研究納入的實驗鼠大多為雄鼠,原因在于雌鼠存在激素的周期性變化[8],會對實驗結果產生影響,但未來實驗有必要納入雌鼠進行研究以探究ECMO模型在不同性別大鼠的差異。
1.2 圍實驗期監測
圍實驗期體溫監測方式多為直腸測溫,該測溫方式簡單易行,為大多數實驗所采用;見表1。在動脈血壓及心率監測方面,22/24G股動脈穿刺監測仍為首選;見表1。部分ECMO大鼠模型由于回流端選擇了股動脈,而將監測動脈更換為尾動脈或頸總動脈[14, 17-18, 23],不選擇另一側股動脈監測的原因可能在于回流端股動脈的泵入血流會在兩側股動脈交匯處影響血壓的測定。少數研究[15, 17-18, 23]選擇術中經頸動脈至左心室放置容積-壓力導管以實時監測心功能。血氣分析一般是在實驗前根據實驗目的確定好監測指標,并合理制定采血量與采血時間以減少血液丟失。
1.3 麻醉及呼吸管理
合理的麻醉方式及適當的麻醉深度是模型建立的基礎。目前ECMO大鼠模型大多采用七氟烷/異氟烷吸入麻醉;見表1。吸入麻醉為非有創性麻醉方式,可以通過調節濃度和氣流量快速達到所需的麻醉深度,且吸入麻醉可以通過機械通氣所需的人工氣道實現,無需進行腹腔注射或經靜脈注射等額外的給藥操作。
大鼠人工氣道的建立大多選擇經口插入14/16G氣管導管,機械通氣均采用容量控制通氣模式。根據大鼠常規生理特征,呼吸頻率設為60~80次/min,潮氣量控制在6~10 mL/kg,也有研究[18, 23]依據大鼠體重根據公式推算出具體的呼吸頻率和潮氣量參數;見表1。各研究間吸入氧濃度差異較大,這與各實驗團隊的實驗條件、實驗目的和管理策略不同有關。有研究[16]證實ECMO下高氧管理會造成超氧化物生成增多以誘發肺損傷和全身炎癥反應,因此應盡可能避免純氧或高濃度氧通氣管理。
2 體外膜肺氧合大鼠模型建立與管理策略
2.1 體外膜肺氧合回路組成
大鼠ECMO模型簡圖見圖1。ECMO回路主要包括血管內留置導管(引流端與回流端)、血泵、氧合器及連接管路。不同于CPB實現的是心臟手術中短期完全替代心肺功能,ECMO是在重癥監護室通過外周插管為嚴重心臟或呼吸衰竭患者提供長期心肺輔助,因此大鼠ECMO環路不配備回流室及熱交換器,整體回路體積小,以實現長時間中、低流量的心肺輔助。血泵的選擇上,離心泵雖與滾壓泵相比對血液成分破壞較輕,但離心泵在小流量下控制較為困難[31],不適用于大鼠ECMO回路。目前大鼠ECMO回路均應用小型滾壓泵,可匹配較小的連接管路,且能實現小流量下的精準調控。氧合器的選擇上,目前的研究大多應用公司自制的微型氧合器,在滿足氣體交換的需求下盡可能達到較小的預充量。部分研究[15, 25]在引流端到血泵之間連接充滿液體的注射器作為儲液器,以支持回路運轉并在轉流時排除回路中產生的氣泡;也有研究[10-13, 17-18]直接在回路中連接與大氣相連靜脈儲液器,雖然增加了整體回路預充量,但便于靜脈引流。整體回路的連接管路多選擇聚氯乙烯或硅膠材質,具有良好的彈性和柔韌性,且血液破壞較少。
 圖1
ECMO大鼠模型簡圖(以VA-ECMO模型為例)
圖1
ECMO大鼠模型簡圖(以VA-ECMO模型為例)
VA-ECMO:靜脈-動脈ECMO;ECMO:體外膜肺氧合
2.2 外科插管的選擇
ECMO模型具體置管血管的選擇依據所建立的ECMO類型的不同而改變。在臨床上,ECMO的3種主要類型是靜脈-動脈ECMO(veno-arterial extracorporeal membrane oxygenation,VA-ECMO)、靜脈-靜脈ECMO(veno-venous extracorporeal membrane oxygenation,VV-ECMO)以及專門應用于心肺復蘇患者的體外心肺復蘇(extracorporeal cardiopulmonary resuscitation,ECPR)[32]。對于VA-ECMO和ECPR這類靜脈引流、動脈回流模型,目前相關研究基本都選擇右側頸靜脈(頸內或頸外靜脈)進行靜脈引流,該通路便于置管到右心位置,可達到最佳引流量。僅一項研究[20],在VA-ECMO模型基礎上變化為動脈引流(左頸總動脈),靜脈回流(右側頸外靜脈),因該研究為評估一款小型3D打印氧合器對ECMO回路中血液凝血功能的影響,血壓高的動脈更易維持流量,故做此調整。靜脈留置導管多為自制多側孔靜脈引流管,便于置管后右心房的側邊引流。回流動脈的選擇依據研究者的操作習慣、測壓動脈的選擇等有所差異,但均為外周大動脈血管,包括股動脈、雙側頸動脈和尾動脈。對于VV-ECMO這類靜脈引流、靜脈回流模型,早期研究大多選擇右頸靜脈(頸內或頸外靜脈)和右股靜脈進行置管操作。近期Li等[28]利用自制的多腔靜脈套管實現了右頸靜脈單靜脈置管模式,節省了前期血管分離和置管的手術時間,且貼合臨床應用的單管雙腔頸靜脈置管VV-ECMO技術。部分研究[17-18, 23-24, 28-29]在轉機前額外分離股靜脈或側尾靜脈等非ECMO回路靜脈并置管,以便于術中由游離靜脈注射給藥。
2.3 體外膜肺氧合管理相關策略
預充液的選擇上,常規以晶體液和膠體液為主,可根據抗凝需要添加適量肝素。由于ECMO大鼠模型整體回路的不斷優化,總預充量可減少到6~8 mL;見表2。大鼠血容量約為64 mL/kg[33],低預充量可盡可能避免血液稀釋,從而達到安全穩定的無血預充。大多數研究選擇一次性靜脈注入300~500 IU/kg劑量的肝素實現全身肝素化,也有少數研究選擇持續泵入肝素以達到抗凝的目的。臨床上ECMO轉機前激活全血凝固時間(activated coagulation time,ACT)的參考值為180~200 s[34],目前較少研究報道大鼠ECMO模型啟動轉機ACT值,建議參照臨床參考值,轉機時可定時檢測凝血功能指標并及時調整抗凝策略。正常大鼠心排血量為160~180 mL/(kg·min)[15],大部分研究將轉機最大流量設定在大鼠心排血量的50%左右以模擬臨床上ECMO部分替代心肺功能以實現心肺輔助;見表2。目前大多研究將ECMO轉機時間設置在<3 h,原因可能是現有的大鼠適配氧合器及連接管路的適用性較臨床上的ECMO應用設備仍有差距,長時間轉機導致大鼠全身炎癥反應及血栓并發癥的風險較高。有研究[19]顯示,在ECMO轉機30 min后成年大鼠血液中炎性因子顯著上升。為避免長時間轉機對大鼠機體造成嚴重影響,建議結合實驗目的進行預實驗,摸索較為適宜的ECMO轉機時間。為減少大鼠ECMO轉機時炎癥激活和血栓形成、延長轉機時間以及更好地模擬臨床上ECMO提供長時間心肺輔助的情形,未來有必要利用更先進的材料制作微型氧合器及配套管路。
3 體外膜肺氧合大鼠模型研究現狀
現有研究大多圍繞各類疾病模型探究ECMO對機體的影響及其病理生理機制,如評估VA-ECMO在心肌梗死大鼠模型中的保護作用[15]、研究VV-ECMO對急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)和急性肺損傷大鼠的保護作用及機制[14, 24, 30]、證實ECPR相較傳統心肺復蘇對于心跳驟停(cardiac arrest,CA)大鼠有更好的救治效果[9]等。此外也有研究在ECMO模型基礎上應用其他干預措施探究其在各類疾病模型中的應用療效,如在VA-ECMO基礎上應用地塞米松可更有效地改善心肌梗死大鼠的心肌預后[22];注射YTHDF1敲除的巨噬細胞治療對于VA-ECMO膿毒血癥大鼠的腦損傷有保護作用[21];光療聯合VV-ECMO可增加CO中毒大鼠的CO清除率并改善預后[26];在CA大鼠ECPR過程中應用fingolimod可有效改善心功能、降低心肌損傷和炎癥反應[11]等。
由于ECMO在轉機過程中血液會與非生物表面接觸,導致炎癥反應激活以及血栓形成[35]。目前有研究對此進行了探索,如Edinger等[17]研究了alpha1-antitrypsin在VA-ECMO大鼠模型中抗炎反應的作用以及兩種不同小型動物氧合器(Micro-1型與SAMO型)在大鼠VA-ECMO模型中誘導炎癥反應的差異。Umei等[20]設計了3D打印的微型氧合器,縮小了ECMO回路體積并將預充量降低至2.5 mL,減少了血液稀釋對凝血功能的影響,為后期研究ECMO相關凝血疾病提供了可靠模型。
此外,還有少數研究在ECMO的圍術期管理方面進行了探索,如Edinger等[23]研究了在進行VA-ECMO治療時不同的肺通氣吸入氧濃度對心功能的影響,結果顯示ECMO期間肺缺氧會導致嚴重心功能障礙;Fujii等[16]研究了VA-ECMO期間不同動脈血氧分壓(partial pressure of oxygen in arterial blood,PaO2)對血清炎癥因子水平的影響,結果發現當PaO2>300 mm Hg時會加劇炎癥反應和肺損傷;Zhang等[29]證實了在VV-ECMO治療ARDS大鼠時應用吸入性麻醉藥七氟烷較靜脈注射丙泊酚可有效減少炎癥因子的產生并減輕肺損傷。
4 展望
目前,ECMO大鼠模型的建立已經逐步完善,但在設備及建模細節上仍需改進。未來需建立能盡可能模擬臨床實際、持續時間長、創傷小、大鼠術后可長期存活、操作簡單、重復性好的ECMO大鼠模型。利用該模型我們可以深入探究ECMO對機體的影響,探討ECMO結合其他治療手段的可行性及有效性,探索新型藥物等干預措施以減少ECMO并發癥等。未來更為完善的ECMO大鼠模型將為臨床上ECMO管理策略的優化、相關并發癥的防治等提供更有效的幫助。
利益沖突:無。
作者貢獻:王添隆檢索文獻,撰寫文章;閆偉東修改文章;吉冰洋制定綜述主題。