患者,女,70歲,因“心臟術后心慌4月”入院就診。8個月前因活動后心慌7年,加重2個月就診于當地醫院,并行二尖瓣置換+主動脈瓣置換+三尖瓣成形術+心臟射頻消融改良迷宮術+左心耳切除術。術后4個月出現二尖瓣損壞,于我院行心尖入路經導管二尖瓣置換。就此例患者治療進行病例報道討論。
瓣膜置換術后人工生物瓣膜會隨著時間推移發生衰敗,瓣膜衰敗后患者通常需要再次行開胸瓣膜置換術,然而傳統正中二次開胸手術創傷大、風險高,部分患者常不能耐受而放棄治療。近年隨著介入技術迅速發展,經導管二尖瓣瓣中瓣技術(transcatheter mitral valve-in-valve,TMVIV)治療生物瓣衰敗安全、可靠,是治療此類患者的良好選擇。
臨床資料 患者,女,70歲,因“心臟術后心慌4月”入院。現病史:患者8個月前因活動后心慌7年,加重2個月就診于當地醫院,2022年5月16日于外院行二尖瓣置換+主動脈瓣置換+三尖瓣成形術+心臟射頻消融改良迷宮術+左心耳切除術。術后4個月出現心慌等不適,就診于我院門診。門診以“心臟瓣膜病”收住入院。
入院診斷:心臟瓣膜病,主動脈瓣生物瓣置換術后、二尖瓣生物瓣置換術后、生物瓣膜置換術后功能衰竭、二尖瓣關閉不全;NYHA 心功能III級;冠狀動脈粥樣硬化;肺氣腫;腔隙性腦梗死。
術前經胸超聲心動圖示:(1)主動脈瓣環處不寬,升主動脈近端增寬,主動脈瓣位人工瓣,反射清晰,開放可。肺動脈主干不寬。 (2)左房擴大,左室不擴大,右房不擴大,右室不擴大。(3)二尖瓣位人工瓣葉反射清晰,后葉稍增厚,活動稍受限,開放可。三尖瓣根部可見成形環強回聲。(4)室間隔不增厚,左室后壁不增厚,二者呈逆向運動,未見節段性室壁運動異常。(5)多普勒血流頻譜。主動脈瓣位人工瓣口收縮期血流頻譜測值。PFV. 2.1 m/s,RC. 18 mm Hg。二尖瓣位人工瓣口左房側收縮期可見偏心性中-重度反流血流信號及湍流頻譜。三尖瓣口右房側收縮期可見輕度反流血流信號及湍流頻譜。左房前后徑37 mm,左室前后徑43 mm,左室射血分數(EF值)71%,二尖瓣口E峰流速104 cm/s,二尖瓣瓣口A峰流速206 cm/s,室間隔二尖瓣環e’流速6 cm/s、a’流速5 cm/s、s’流速7 cm/s。
超聲診斷:(1)二尖瓣置換術后:二尖瓣位人工瓣中-重度關閉不全;(2)主動脈瓣位人工瓣功能正常;(3)三尖瓣成形術后改變;(4)升主動脈近端增寬
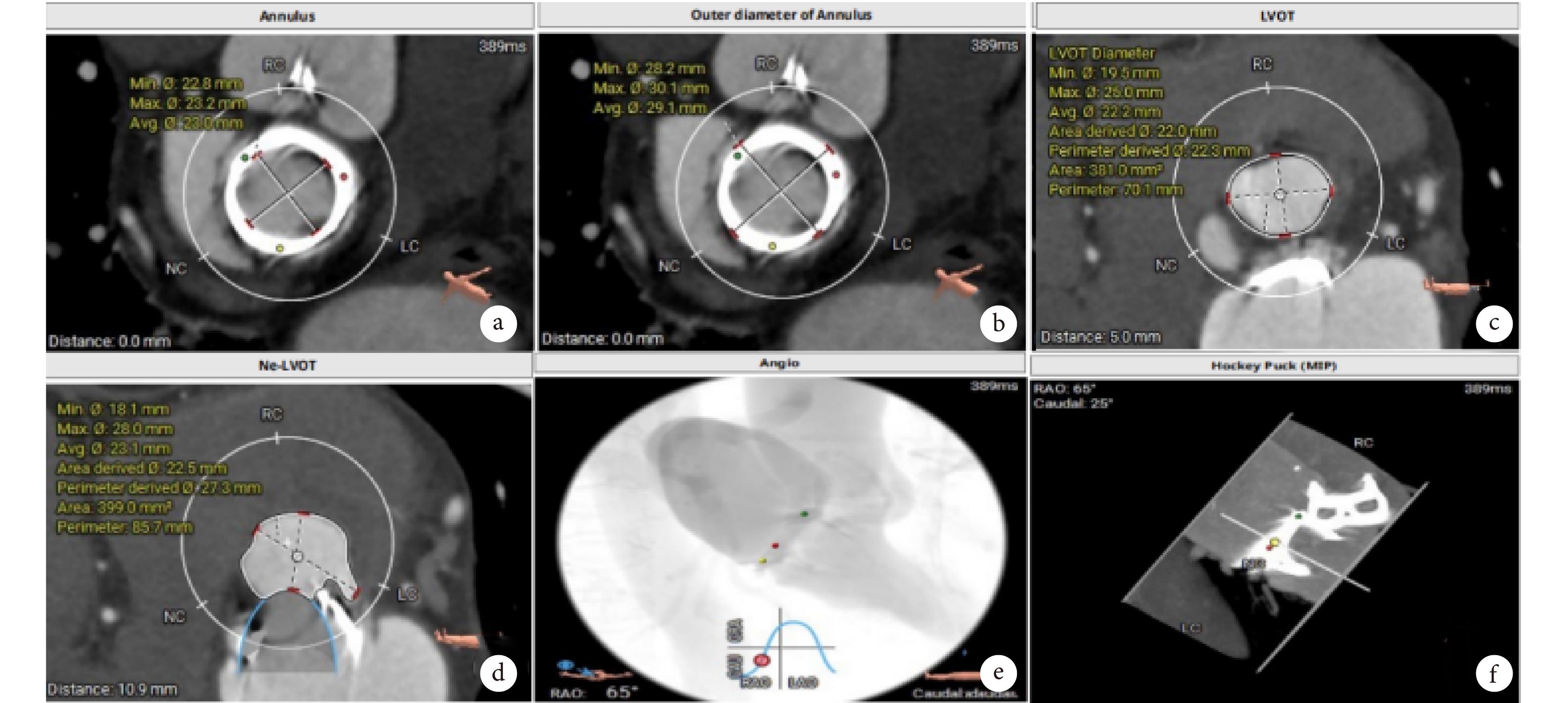
術前胸腹主動脈CTA評估見圖1。
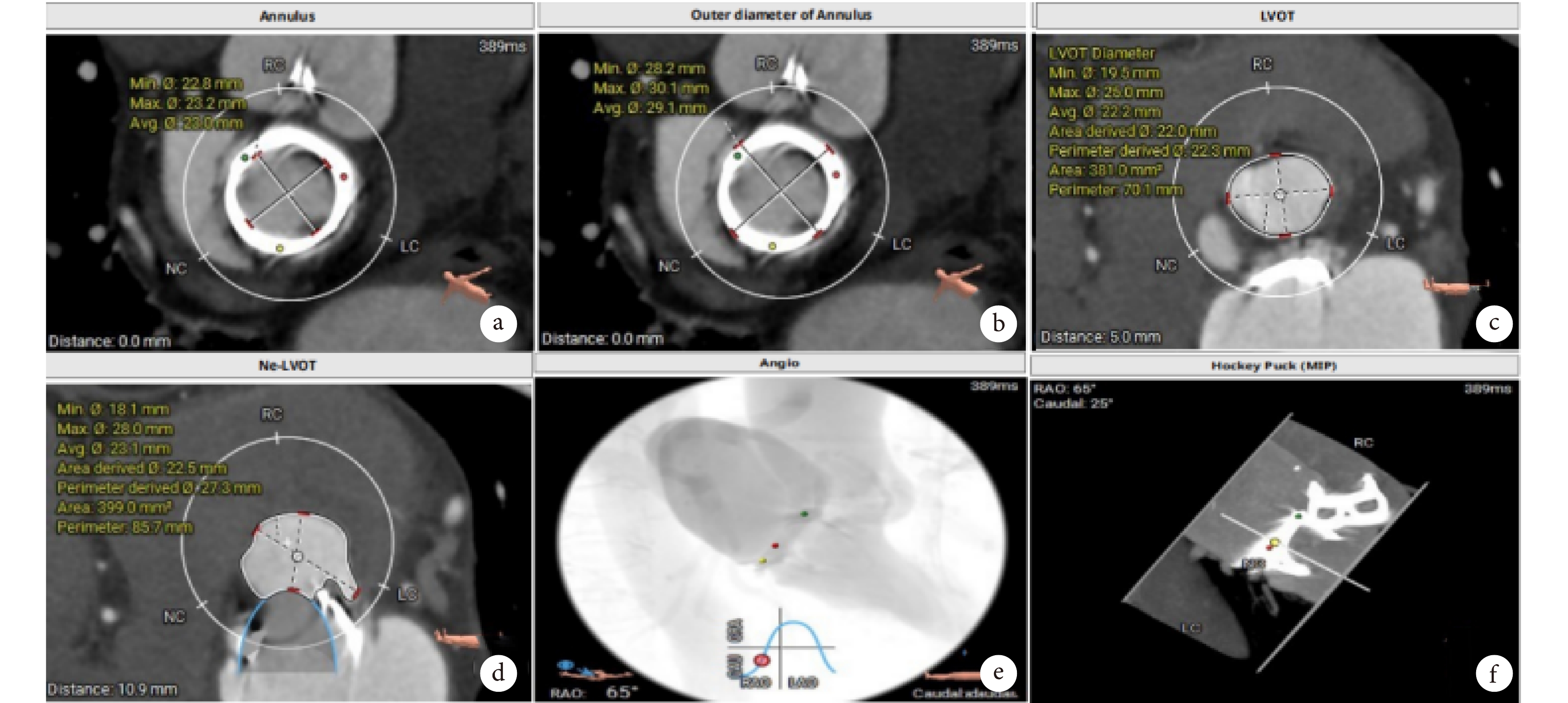 圖1
胸腹主動脈CTA評估
圖1
胸腹主動脈CTA評估
a、b:原生物瓣金屬環平均內徑23.0 mm,外徑29.1 mm ;1C、1D左室流出道(left ventricular outflow tract,LVOT):381.0 mm2,Neo-LVOT:399.0 mm2模擬置入二尖瓣位生物瓣后對左心室流出道進行評估;e、f:患者術中最佳投射角度:RAO 65°/CAU 25°
本醫療團隊考慮到該患者年齡大,基礎狀況較差,短期內經歷創傷較大的開胸手術,開胸術后組織粘連,再次開胸手術時間長、難度大,經充分超聲心動圖與螺旋CT評估后與患者及家屬充分交流溝通病情及治療方案后決定為該患者行TMVIV。
1.2 手術方法
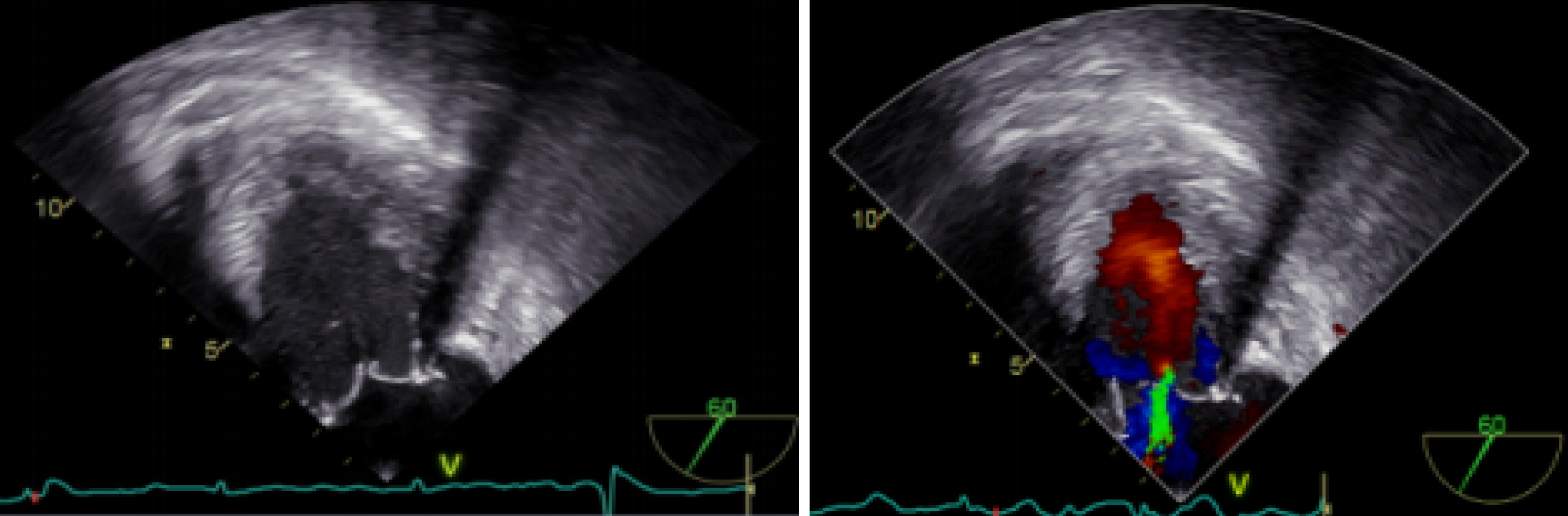
患者取仰臥位,常規全身麻醉氣管插管。置入經食道超聲心動圖(transesophageal echocardiography,TEE),術前評估二尖瓣反流情況;見圖2。
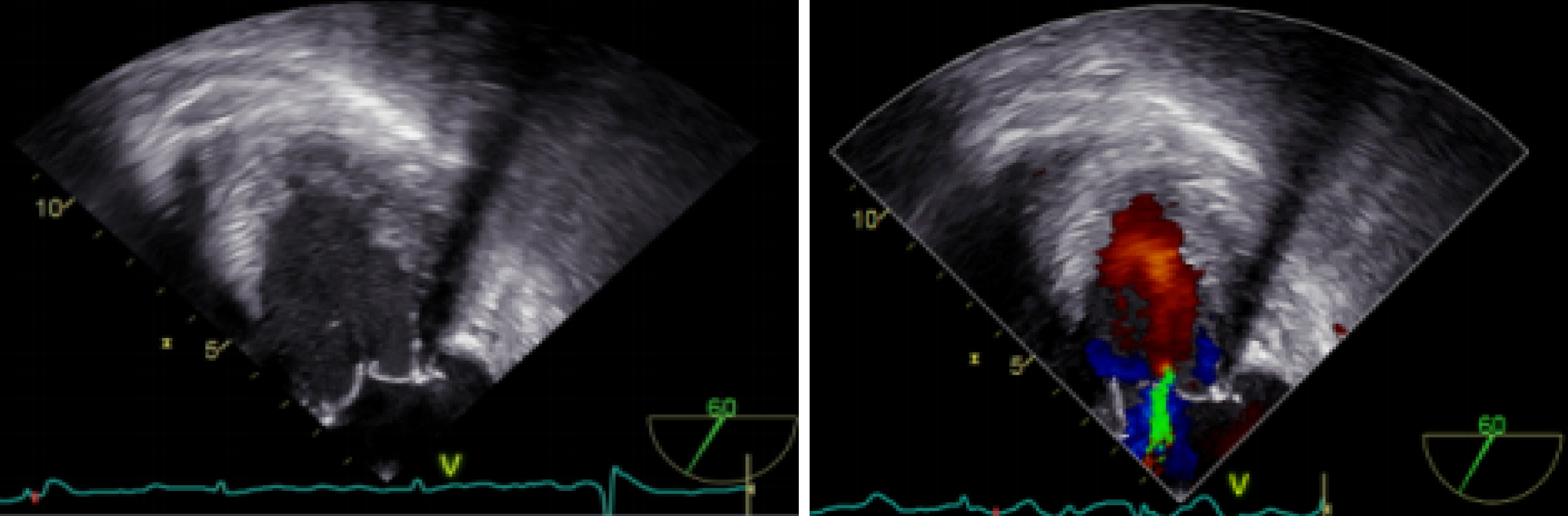 圖2
術前 TEE 評估二尖瓣反流情況VIV 植入前 TEE 評估二尖瓣反流,TEE 可見二尖瓣位人工瓣反射清晰,后葉稍增厚;多普勒血流頻譜:二尖瓣口左房側收縮期可見中度偏心性反流血流信號及湍流頻譜
圖2
術前 TEE 評估二尖瓣反流情況VIV 植入前 TEE 評估二尖瓣反流,TEE 可見二尖瓣位人工瓣反射清晰,后葉稍增厚;多普勒血流頻譜:二尖瓣口左房側收縮期可見中度偏心性反流血流信號及湍流頻譜
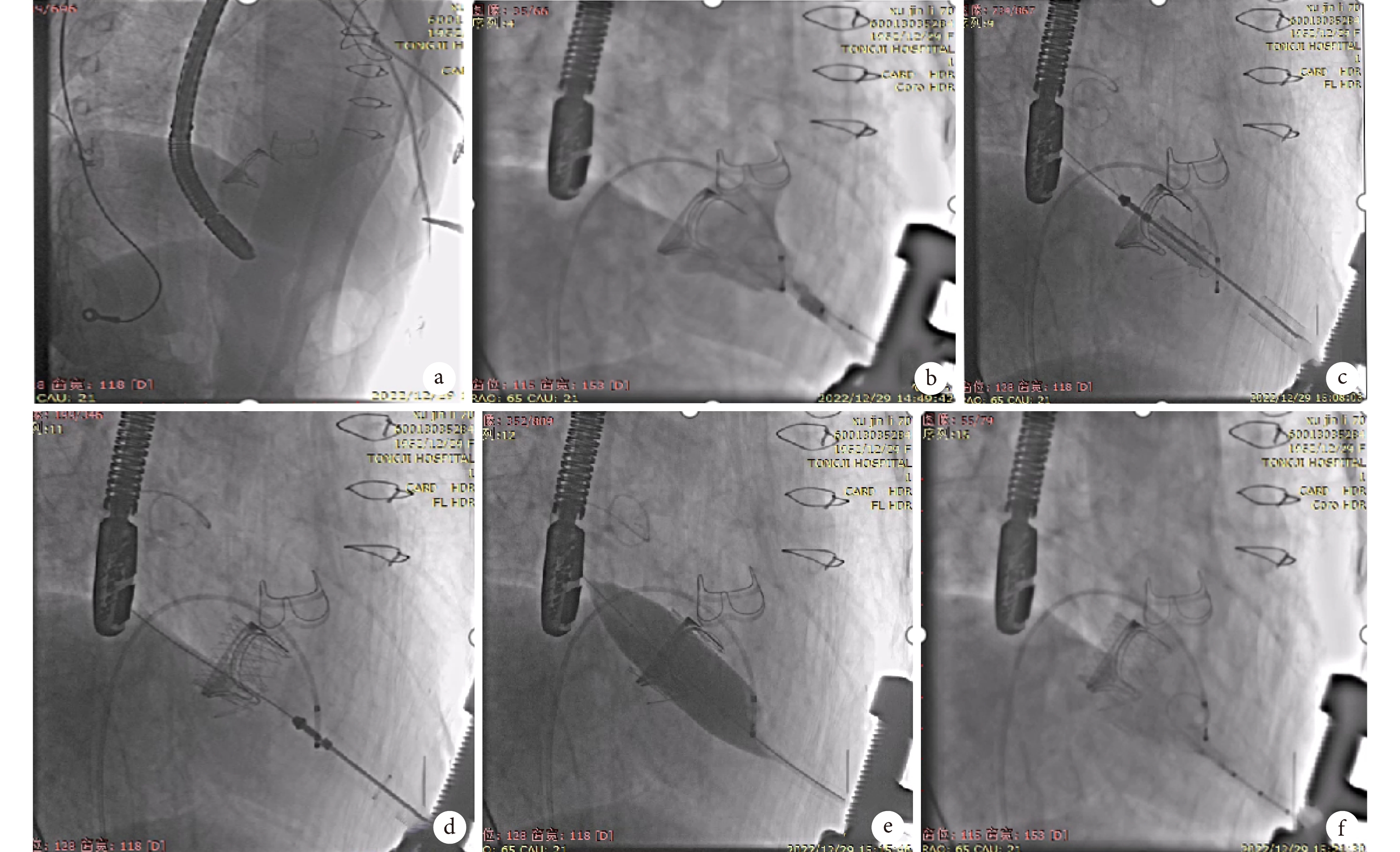
以股鞘(6FDemax , 北京迪瑪克醫藥科技有限公司,CN)于患者右側股靜脈穿刺置管。于6F股鞘置入電生理電極導管(6F BIPOLAR TriguyTM,惠泰醫療,CN),雙極端置入右心室,另一端連接臨時起搏器(livetec,medtronic,USA)后調整其參數:模式為VVI,起搏頻率為120 ppm,起搏閾值為5.0 V,感知靈敏度為2.0 mV,觀察心電監護儀可見起搏信號,心率為120 bpm,確認臨時起搏器功能正常,斷開起搏器置一旁備用。于射線及經胸超聲引導下定位心尖部位,以左胸第5肋間心尖處切開皮膚作一約3 cm切口,逐層切開皮下脂肪、肌肉、心包。縫線(3-0 VICRYLTM Plus,Johnson & Johnson Medtech,USA)懸吊心包以充分暴露術野,以2根縫線(3-0 Prolene,Johnson & Johnson Medtech,USA)帶毛氈片預置心尖荷包。經6F股鞘推注6000U肝素鈉溶液以預防血栓形成及栓塞,于心尖荷包內穿刺置入軟導絲(0.035″-150cm Blackeel?,APT Medical,CN),導絲引導下植入造影導管(5F-0.035″-100 cm PIG-CSC-20,COOK Medical,USA),于左心室造影提示二尖瓣大量反流。射線引導下造影導管進入左心房,測得左心房壓力為26/10 (17)mm Hg。調整C臂機于RAO65° CAUD21°瓣膜釋放位。用彎血管鉗將硬導絲(0.035″-260 cm Amplatz,Boston Scientific Corporation,USA)頭端進行預塑形以減少對心肌損傷,交換硬導絲,于硬導絲、射線引導下植入支架瓣膜(J-Valve,杰成醫療科技有限公司,CN)輸送系統,輸送系統跨瓣后打開1號鍵,釋放定位器并使其入原生物瓣“竇”,旋回1號鍵,將外鞘頂住瓣架下緣,防止瓣膜釋放時向心室側回彈,脫出二尖瓣生物瓣瓣環;旋3號鍵,待瓣膜大部分緩慢自膨后稍松開1號鍵,使J-Valve瓣膜的瓣架整體充分打開;釋放瓣膜支架。射線下提示瓣膜支架位置滿意,撤出支架輸送系統。設置臨時起搏器起搏頻率180次/分,監護儀示血壓55/36 mm Hg,用球囊(24D MicroPort,上海微創醫療器械(集團)有限公司,CN)于射線引導下擴張瓣膜支架(圖3)。停止起搏,藥物輔助恢復循環穩定,血壓117/82 mm Hg。置入測壓導管測得術后左心房壓力為23/10(15)mm Hg。TEE評估二尖瓣反流消失,無明顯瓣周漏。留置30號胸腔引流管1根,止血縫合切口(圖4)。
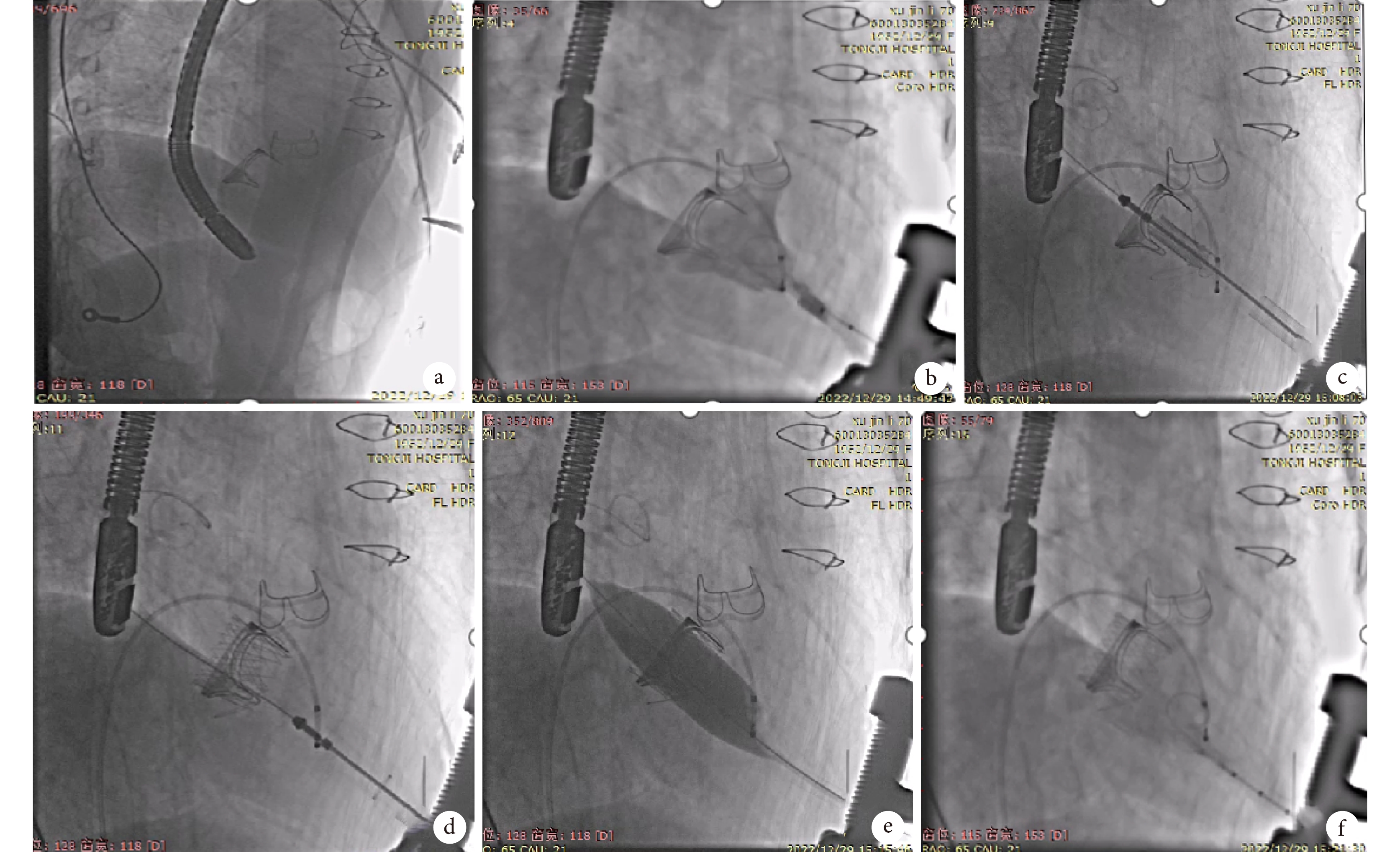 圖3
術中造影
圖3
術中造影
a:射線下定位心尖;b:造影導管左心室造影見二尖瓣大量反流;c:跨瓣后打開1號鍵釋放定位系統;d:VIV準確釋放后,撤出輸送系統;e:起搏狀態下球囊擴張瓣膜支架;f:球囊擴張后造影提示二尖瓣反流消失
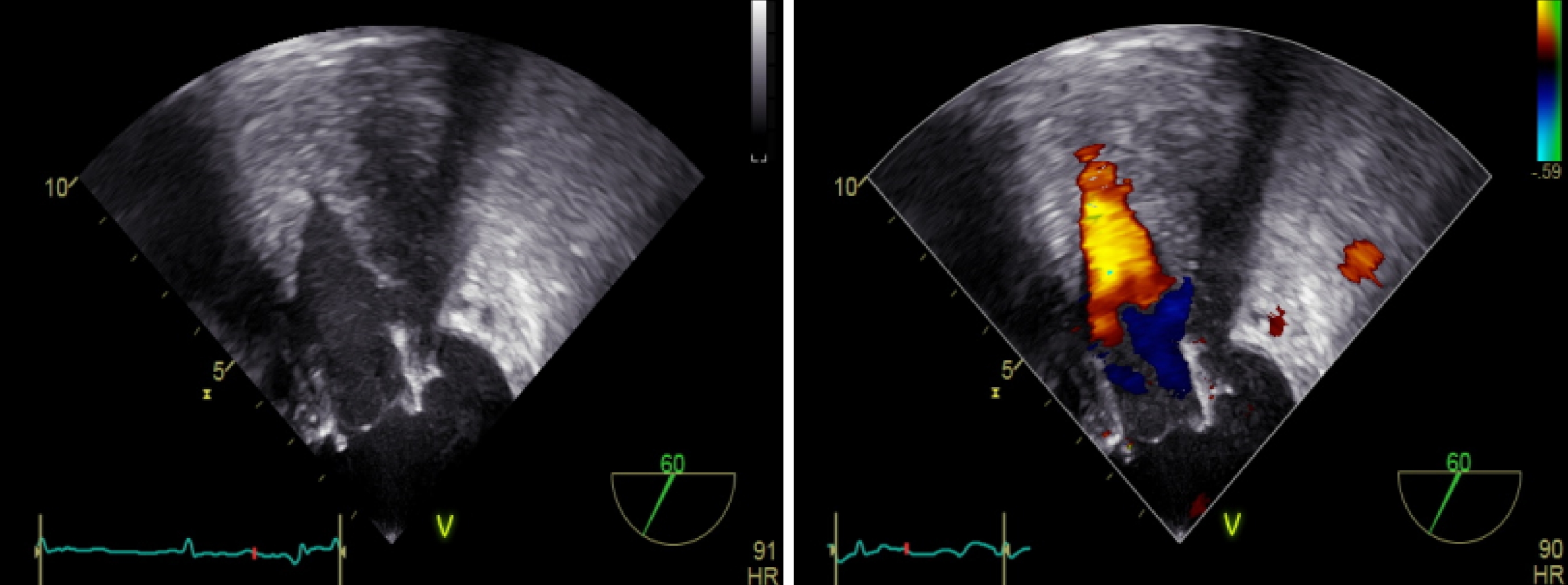
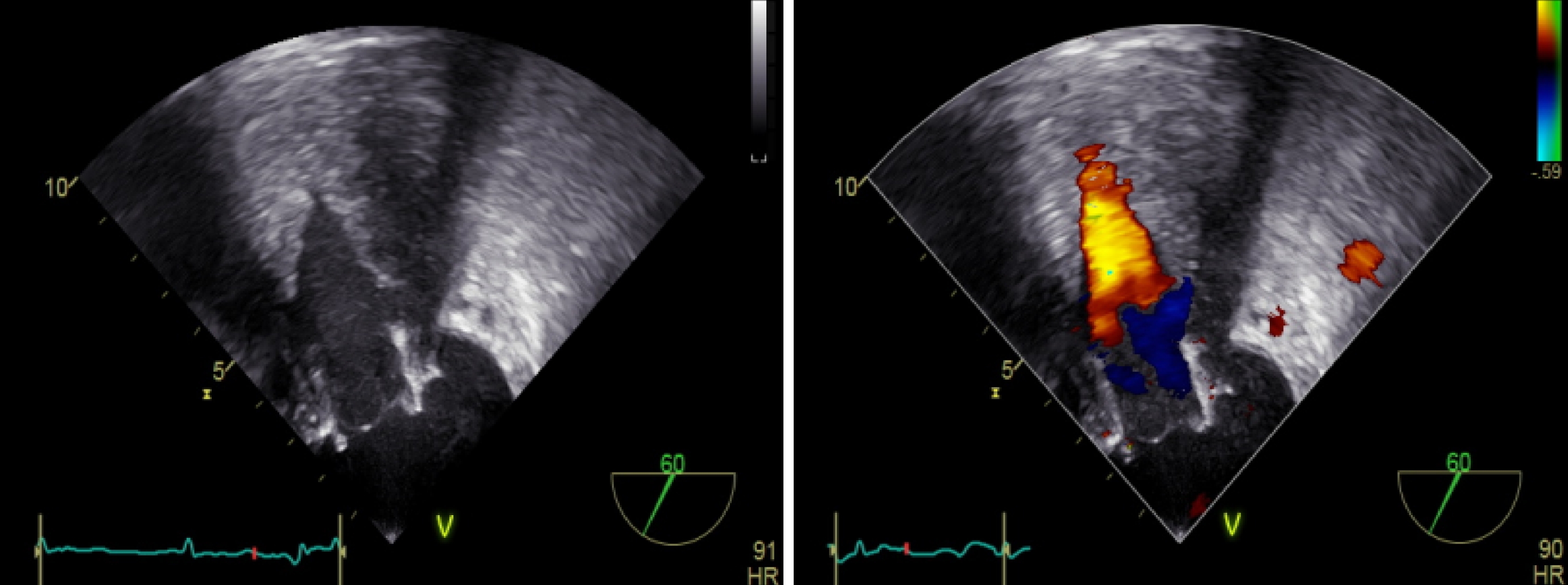 圖4
瓣中瓣植入后 TEE 評估二尖瓣反流
圖4
瓣中瓣植入后 TEE 評估二尖瓣反流
TEE 可見二尖瓣位人工瓣反射清晰,開放可,多普勒血流頻譜下二尖瓣口未見反流血流信號,左室流出道未見梗阻,未見明顯心包積液
手術時長4 h 10 min,未使用體外循環,術中無輸血。術后麻醉狀態、氣管插管狀態下返回重癥監護室。泵入丙泊酚/長鏈脂肪乳注射液、硝酸甘油注射液、鹽酸多巴胺注射液、重酒石酸去甲腎上腺素注射液調整血壓心率,查動脈血氣行靜脈補鉀、補鈣糾正穩定內環境。患者于術后16 h拔除氣管插管,24 h轉出重癥監護室。
術后第1 d于患者床旁行超聲心動圖示:(1)右室流出道不增寬,升主動脈近端增寬(38 mm),主動脈瓣位人工瓣反射清晰,開放可;(2)左房不擴大,左室不擴大,右房不擴大,右室不擴大;(3)二尖瓣位人工瓣反射清晰,開放可;(4)室間隔不增厚,左室后壁不增厚,二者呈逆向運動,未見明顯節段性室壁運動異常;(5)多普勒血流頻譜:血流信號顯示不清6.左心收縮功能測定:EF:60%
術后第6 d超聲心動圖示:(1)主動脈瓣環處不寬,升主動脈近端增寬,主動脈瓣位人工瓣反射清晰,開放可,肺動脈主干不寬;(2)左房不擴大,左室不擴大,右房不擴大,右室不擴大;(3)二尖瓣前葉活動呈雙峰,前后葉呈逆向運動,瓣膜回聲正常,開放可;(4)室間隔不增厚,左室后壁不增厚,二者呈逆向運動,未見明顯節段性室壁運動異;(5)多普勒血流頻譜:主動脈瓣位人工瓣口收縮期血流頻譜測值:PFV:2.2 m/s,PG 19 mm Hg。主動脈瓣位人工瓣口舒張期可見輕度反流血流信號及湍流頻譜,三尖瓣口右房側收縮期可見輕度反流血流信號及湍流頻譜;(6)左心收縮功能測定:EF:59%
討論 二尖瓣疾病是常見的心臟瓣膜疾病,當二尖瓣疾病導致心臟結構和功能改變引發臨床癥狀時,需要對其進行外科修復或置換。因生物瓣具有組織親和力強,無需長期服用抗凝藥物等優點,成為了高齡瓣膜疾病患者的優先選擇。生物瓣理論壽命約為10~15年,在二尖瓣生物瓣膜置換術后的前10年內,多達35%的患者需要再次手術[1]。本例患者術后4個月即出現瓣膜損壞,遠低于生物瓣平均壽命時間,這或許與術中操作失誤、使用不當等原因有關。對于這類高齡、身體基礎條件差的患者再次開胸換瓣手術難度及風險高,圍術期并發癥發生率、死亡率更高,輸血(38%二次開胸換瓣 vs. 7.6% TMVIV)、急性腎功能損傷(36.7%二次開胸換瓣 vs. 13.9% TMVIV)、肺部感染(10.1% 二次開胸換瓣vs. 2.8% TMVIV)、死亡率(7.6%二次開胸換瓣 vs. 2.8% TMVIV)[2],部分患者因此放棄再次開胸手術治療。自2009年有報道的首例經導管內二尖瓣瓣中瓣技術[3],研究[4]發現經導管二尖瓣置換術(transcatheter mitral valve replacement,TMVR)不僅可用于天然二尖瓣病變也可用于退化的成形后二尖瓣或人工二尖瓣,并且在二尖瓣嚴重鈣化、成形后二尖瓣、人工生物二尖瓣條件下,針對主動脈瓣位置設計的導管瓣膜可以以較高的安全性、成功率進行植入。Kamioka等[5]的研究表明,二尖瓣人工瓣衰敗后行二次開胸二尖瓣置換術和TMVIV術,術后臨床效果與超聲心動圖效果無明顯差異。因此對此類高齡、高危患者實施TMVIV術會是一個更好的選擇。TMVIV入路方式包含經股靜脈、房間隔入路和經心尖入路。Whisenant等[6]認為經股靜脈、房間隔入路比經心尖入路更安全,1年全因死亡率更低(15.8%股靜脈、房間隔入路 vs. 21.7%心尖入路)。然而經心尖入路為TMVIV術更好的保證瓣膜的同軸性,提供了更合適的手術入路。對手術入路的選擇應該術前對患者進行全方位評估,充分考慮患者靜脈情況、出血風險、瓣膜角度等,以選擇最佳的手術路線。然而,TMVIVI術也存在其自身的局限性。TMVIV手術禁忌證包含:感染性心內膜炎、嚴重瓣周漏(perivalvular leakage,PVL)、生物瓣膜撕裂等, 且原人工瓣膜必須滿足特定的解剖和血流動力學標準,并且操作員需要豐富的操作經驗[7]。術后PVL以及LVOTO發生率高于常規換瓣手術。除此之外還面臨瓣膜移位、血栓形成及栓塞、心律失常、術后低心排血量綜合征等風險。部分患者出現嚴重的心力衰竭導致死亡,提示圍術期心功能管理對患者恢復至關重要[8]。術前多層螺旋CT三維重建和超聲心動圖慎重評估不可或缺,有助于評估左室流出道梗阻風險并有助于瓣膜尺寸選擇,避免瓣膜移位[9]。
隨著介入技術的發展,越來越多的患者可以通過介入技術獲得更好的治療效果,但許多技術問題,諸如瓣膜大小和通路選擇、介入瓣膜的使用壽命、術后抗凝策略仍然沒有統一答案,術后遠期治療效果及不良事件需進一步研究明確[10-11]。謹慎的患者選擇和術前規劃對于最大化收益和避免并發癥是必要的,并且有必要進一步開發研究TMVR設備,以便為更多患者提供更合適的經導管治療。
利益沖突:無。
貢獻說明:馮異負責數據收集、文章撰寫;朱章強、馬先桃負責數據收集、文章校對;李師亮、Akilu Wajeehullahi負責方案實施;程才負責方案設計、方案實施、研究管理。
瓣膜置換術后人工生物瓣膜會隨著時間推移發生衰敗,瓣膜衰敗后患者通常需要再次行開胸瓣膜置換術,然而傳統正中二次開胸手術創傷大、風險高,部分患者常不能耐受而放棄治療。近年隨著介入技術迅速發展,經導管二尖瓣瓣中瓣技術(transcatheter mitral valve-in-valve,TMVIV)治療生物瓣衰敗安全、可靠,是治療此類患者的良好選擇。
臨床資料 患者,女,70歲,因“心臟術后心慌4月”入院。現病史:患者8個月前因活動后心慌7年,加重2個月就診于當地醫院,2022年5月16日于外院行二尖瓣置換+主動脈瓣置換+三尖瓣成形術+心臟射頻消融改良迷宮術+左心耳切除術。術后4個月出現心慌等不適,就診于我院門診。門診以“心臟瓣膜病”收住入院。
入院診斷:心臟瓣膜病,主動脈瓣生物瓣置換術后、二尖瓣生物瓣置換術后、生物瓣膜置換術后功能衰竭、二尖瓣關閉不全;NYHA 心功能III級;冠狀動脈粥樣硬化;肺氣腫;腔隙性腦梗死。
術前經胸超聲心動圖示:(1)主動脈瓣環處不寬,升主動脈近端增寬,主動脈瓣位人工瓣,反射清晰,開放可。肺動脈主干不寬。 (2)左房擴大,左室不擴大,右房不擴大,右室不擴大。(3)二尖瓣位人工瓣葉反射清晰,后葉稍增厚,活動稍受限,開放可。三尖瓣根部可見成形環強回聲。(4)室間隔不增厚,左室后壁不增厚,二者呈逆向運動,未見節段性室壁運動異常。(5)多普勒血流頻譜。主動脈瓣位人工瓣口收縮期血流頻譜測值。PFV. 2.1 m/s,RC. 18 mm Hg。二尖瓣位人工瓣口左房側收縮期可見偏心性中-重度反流血流信號及湍流頻譜。三尖瓣口右房側收縮期可見輕度反流血流信號及湍流頻譜。左房前后徑37 mm,左室前后徑43 mm,左室射血分數(EF值)71%,二尖瓣口E峰流速104 cm/s,二尖瓣瓣口A峰流速206 cm/s,室間隔二尖瓣環e’流速6 cm/s、a’流速5 cm/s、s’流速7 cm/s。
超聲診斷:(1)二尖瓣置換術后:二尖瓣位人工瓣中-重度關閉不全;(2)主動脈瓣位人工瓣功能正常;(3)三尖瓣成形術后改變;(4)升主動脈近端增寬
術前胸腹主動脈CTA評估見圖1。
 圖1
胸腹主動脈CTA評估
圖1
胸腹主動脈CTA評估
a、b:原生物瓣金屬環平均內徑23.0 mm,外徑29.1 mm ;1C、1D左室流出道(left ventricular outflow tract,LVOT):381.0 mm2,Neo-LVOT:399.0 mm2模擬置入二尖瓣位生物瓣后對左心室流出道進行評估;e、f:患者術中最佳投射角度:RAO 65°/CAU 25°
本醫療團隊考慮到該患者年齡大,基礎狀況較差,短期內經歷創傷較大的開胸手術,開胸術后組織粘連,再次開胸手術時間長、難度大,經充分超聲心動圖與螺旋CT評估后與患者及家屬充分交流溝通病情及治療方案后決定為該患者行TMVIV。
1.2 手術方法
患者取仰臥位,常規全身麻醉氣管插管。置入經食道超聲心動圖(transesophageal echocardiography,TEE),術前評估二尖瓣反流情況;見圖2。
 圖2
術前 TEE 評估二尖瓣反流情況VIV 植入前 TEE 評估二尖瓣反流,TEE 可見二尖瓣位人工瓣反射清晰,后葉稍增厚;多普勒血流頻譜:二尖瓣口左房側收縮期可見中度偏心性反流血流信號及湍流頻譜
圖2
術前 TEE 評估二尖瓣反流情況VIV 植入前 TEE 評估二尖瓣反流,TEE 可見二尖瓣位人工瓣反射清晰,后葉稍增厚;多普勒血流頻譜:二尖瓣口左房側收縮期可見中度偏心性反流血流信號及湍流頻譜
以股鞘(6FDemax , 北京迪瑪克醫藥科技有限公司,CN)于患者右側股靜脈穿刺置管。于6F股鞘置入電生理電極導管(6F BIPOLAR TriguyTM,惠泰醫療,CN),雙極端置入右心室,另一端連接臨時起搏器(livetec,medtronic,USA)后調整其參數:模式為VVI,起搏頻率為120 ppm,起搏閾值為5.0 V,感知靈敏度為2.0 mV,觀察心電監護儀可見起搏信號,心率為120 bpm,確認臨時起搏器功能正常,斷開起搏器置一旁備用。于射線及經胸超聲引導下定位心尖部位,以左胸第5肋間心尖處切開皮膚作一約3 cm切口,逐層切開皮下脂肪、肌肉、心包。縫線(3-0 VICRYLTM Plus,Johnson & Johnson Medtech,USA)懸吊心包以充分暴露術野,以2根縫線(3-0 Prolene,Johnson & Johnson Medtech,USA)帶毛氈片預置心尖荷包。經6F股鞘推注6000U肝素鈉溶液以預防血栓形成及栓塞,于心尖荷包內穿刺置入軟導絲(0.035″-150cm Blackeel?,APT Medical,CN),導絲引導下植入造影導管(5F-0.035″-100 cm PIG-CSC-20,COOK Medical,USA),于左心室造影提示二尖瓣大量反流。射線引導下造影導管進入左心房,測得左心房壓力為26/10 (17)mm Hg。調整C臂機于RAO65° CAUD21°瓣膜釋放位。用彎血管鉗將硬導絲(0.035″-260 cm Amplatz,Boston Scientific Corporation,USA)頭端進行預塑形以減少對心肌損傷,交換硬導絲,于硬導絲、射線引導下植入支架瓣膜(J-Valve,杰成醫療科技有限公司,CN)輸送系統,輸送系統跨瓣后打開1號鍵,釋放定位器并使其入原生物瓣“竇”,旋回1號鍵,將外鞘頂住瓣架下緣,防止瓣膜釋放時向心室側回彈,脫出二尖瓣生物瓣瓣環;旋3號鍵,待瓣膜大部分緩慢自膨后稍松開1號鍵,使J-Valve瓣膜的瓣架整體充分打開;釋放瓣膜支架。射線下提示瓣膜支架位置滿意,撤出支架輸送系統。設置臨時起搏器起搏頻率180次/分,監護儀示血壓55/36 mm Hg,用球囊(24D MicroPort,上海微創醫療器械(集團)有限公司,CN)于射線引導下擴張瓣膜支架(圖3)。停止起搏,藥物輔助恢復循環穩定,血壓117/82 mm Hg。置入測壓導管測得術后左心房壓力為23/10(15)mm Hg。TEE評估二尖瓣反流消失,無明顯瓣周漏。留置30號胸腔引流管1根,止血縫合切口(圖4)。
 圖3
術中造影
圖3
術中造影
a:射線下定位心尖;b:造影導管左心室造影見二尖瓣大量反流;c:跨瓣后打開1號鍵釋放定位系統;d:VIV準確釋放后,撤出輸送系統;e:起搏狀態下球囊擴張瓣膜支架;f:球囊擴張后造影提示二尖瓣反流消失
 圖4
瓣中瓣植入后 TEE 評估二尖瓣反流
圖4
瓣中瓣植入后 TEE 評估二尖瓣反流
TEE 可見二尖瓣位人工瓣反射清晰,開放可,多普勒血流頻譜下二尖瓣口未見反流血流信號,左室流出道未見梗阻,未見明顯心包積液
手術時長4 h 10 min,未使用體外循環,術中無輸血。術后麻醉狀態、氣管插管狀態下返回重癥監護室。泵入丙泊酚/長鏈脂肪乳注射液、硝酸甘油注射液、鹽酸多巴胺注射液、重酒石酸去甲腎上腺素注射液調整血壓心率,查動脈血氣行靜脈補鉀、補鈣糾正穩定內環境。患者于術后16 h拔除氣管插管,24 h轉出重癥監護室。
術后第1 d于患者床旁行超聲心動圖示:(1)右室流出道不增寬,升主動脈近端增寬(38 mm),主動脈瓣位人工瓣反射清晰,開放可;(2)左房不擴大,左室不擴大,右房不擴大,右室不擴大;(3)二尖瓣位人工瓣反射清晰,開放可;(4)室間隔不增厚,左室后壁不增厚,二者呈逆向運動,未見明顯節段性室壁運動異常;(5)多普勒血流頻譜:血流信號顯示不清6.左心收縮功能測定:EF:60%
術后第6 d超聲心動圖示:(1)主動脈瓣環處不寬,升主動脈近端增寬,主動脈瓣位人工瓣反射清晰,開放可,肺動脈主干不寬;(2)左房不擴大,左室不擴大,右房不擴大,右室不擴大;(3)二尖瓣前葉活動呈雙峰,前后葉呈逆向運動,瓣膜回聲正常,開放可;(4)室間隔不增厚,左室后壁不增厚,二者呈逆向運動,未見明顯節段性室壁運動異;(5)多普勒血流頻譜:主動脈瓣位人工瓣口收縮期血流頻譜測值:PFV:2.2 m/s,PG 19 mm Hg。主動脈瓣位人工瓣口舒張期可見輕度反流血流信號及湍流頻譜,三尖瓣口右房側收縮期可見輕度反流血流信號及湍流頻譜;(6)左心收縮功能測定:EF:59%
討論 二尖瓣疾病是常見的心臟瓣膜疾病,當二尖瓣疾病導致心臟結構和功能改變引發臨床癥狀時,需要對其進行外科修復或置換。因生物瓣具有組織親和力強,無需長期服用抗凝藥物等優點,成為了高齡瓣膜疾病患者的優先選擇。生物瓣理論壽命約為10~15年,在二尖瓣生物瓣膜置換術后的前10年內,多達35%的患者需要再次手術[1]。本例患者術后4個月即出現瓣膜損壞,遠低于生物瓣平均壽命時間,這或許與術中操作失誤、使用不當等原因有關。對于這類高齡、身體基礎條件差的患者再次開胸換瓣手術難度及風險高,圍術期并發癥發生率、死亡率更高,輸血(38%二次開胸換瓣 vs. 7.6% TMVIV)、急性腎功能損傷(36.7%二次開胸換瓣 vs. 13.9% TMVIV)、肺部感染(10.1% 二次開胸換瓣vs. 2.8% TMVIV)、死亡率(7.6%二次開胸換瓣 vs. 2.8% TMVIV)[2],部分患者因此放棄再次開胸手術治療。自2009年有報道的首例經導管內二尖瓣瓣中瓣技術[3],研究[4]發現經導管二尖瓣置換術(transcatheter mitral valve replacement,TMVR)不僅可用于天然二尖瓣病變也可用于退化的成形后二尖瓣或人工二尖瓣,并且在二尖瓣嚴重鈣化、成形后二尖瓣、人工生物二尖瓣條件下,針對主動脈瓣位置設計的導管瓣膜可以以較高的安全性、成功率進行植入。Kamioka等[5]的研究表明,二尖瓣人工瓣衰敗后行二次開胸二尖瓣置換術和TMVIV術,術后臨床效果與超聲心動圖效果無明顯差異。因此對此類高齡、高危患者實施TMVIV術會是一個更好的選擇。TMVIV入路方式包含經股靜脈、房間隔入路和經心尖入路。Whisenant等[6]認為經股靜脈、房間隔入路比經心尖入路更安全,1年全因死亡率更低(15.8%股靜脈、房間隔入路 vs. 21.7%心尖入路)。然而經心尖入路為TMVIV術更好的保證瓣膜的同軸性,提供了更合適的手術入路。對手術入路的選擇應該術前對患者進行全方位評估,充分考慮患者靜脈情況、出血風險、瓣膜角度等,以選擇最佳的手術路線。然而,TMVIVI術也存在其自身的局限性。TMVIV手術禁忌證包含:感染性心內膜炎、嚴重瓣周漏(perivalvular leakage,PVL)、生物瓣膜撕裂等, 且原人工瓣膜必須滿足特定的解剖和血流動力學標準,并且操作員需要豐富的操作經驗[7]。術后PVL以及LVOTO發生率高于常規換瓣手術。除此之外還面臨瓣膜移位、血栓形成及栓塞、心律失常、術后低心排血量綜合征等風險。部分患者出現嚴重的心力衰竭導致死亡,提示圍術期心功能管理對患者恢復至關重要[8]。術前多層螺旋CT三維重建和超聲心動圖慎重評估不可或缺,有助于評估左室流出道梗阻風險并有助于瓣膜尺寸選擇,避免瓣膜移位[9]。
隨著介入技術的發展,越來越多的患者可以通過介入技術獲得更好的治療效果,但許多技術問題,諸如瓣膜大小和通路選擇、介入瓣膜的使用壽命、術后抗凝策略仍然沒有統一答案,術后遠期治療效果及不良事件需進一步研究明確[10-11]。謹慎的患者選擇和術前規劃對于最大化收益和避免并發癥是必要的,并且有必要進一步開發研究TMVR設備,以便為更多患者提供更合適的經導管治療。
利益沖突:無。
貢獻說明:馮異負責數據收集、文章撰寫;朱章強、馬先桃負責數據收集、文章校對;李師亮、Akilu Wajeehullahi負責方案實施;程才負責方案設計、方案實施、研究管理。