術后新發心房顫動(postoperative atrial fibrillation,POAF)是心臟術后最常見的并發癥之一,不僅延長了住院時間,增加了醫藥與護理費用[1],更是與心血管疾病的發病風險和死亡風險直接相關[2]。既往相關研究表明心臟術后POAF發生率約為10%~60%[3-5],其中單純主動脈瓣置換術(aortic valve replacement,AVR)術后POAF發生率約為28%~60%[6-8]。因此,早期識別POAF患者并積極預防顯得尤為重要。據報道,POAF為急性心房顫動(atrial fibrillation,AF)的一種,其與心肌細胞炎癥、心房纖維化、局部機械應激、氧化應激、電解質失衡和自主神經張力的改變等有關[9-10]。POAF病理生理機制復雜,目前未能完全闡明,所以臨床較難以對POAF進行預測。根據既往研究[11-13],常見的預測因素為年齡、性別、慢性阻塞性肺疾病、糖尿病、左室射血分數、再次心臟手術等。
現有的POAF預測模型(如POAF-AF評分、CHA2DS2-VASc評分、AF風險指數等),因研究對象接受心臟手術類型不同,它們的預測能力差異很大[14-16]。目前POAF預測研究多集中在冠狀動脈粥樣硬化性心臟病或二尖瓣疾病上,對單純AVR患者的研究較少。沒有簡單、有效的單純AVR術后POAF的預測模型。本研究結合患者基線資料、術前血液指標、心臟彩色超聲和7 d動態心電圖中心率變異率(heart rate variability,HRV)指標,建立了一個有效的列線圖模型,旨在提前識別POAF患者并積極干預,降低POAF發生率。
1 資料與方法
1.1 臨床資料和分組
回顧性收集2020年6月—2022年6月在北部戰區總醫院心血管外科接受單純AVR患者的臨床資料。納入標準為:行單純AVR;年齡>18歲且≤80歲;有7 d動態心電圖結果。排除標準:入院前有AF或其他心律失常病史;植入心臟起搏器或除顫器;同期需要二尖瓣手術或主動脈-冠狀動脈搭橋手術;臨床資料不完整。根據術后7 d內是否出現POAF,將單純AVR術后患者分為POAF組與非POAF組。
1.2 診斷及定義
全組患者術前和術后都接受了連續7 d的動態心電圖監測。POAF定義為術前為正常竇性心律,但術后7 d內出現POAF。AF定義為心律不規則,P波消失,持續至少30 s。POAF 評分由年齡、慢性阻塞性肺疾病、估算腎小球濾過率(estimated glomerular filtration rate,eGFR)<15 mL/(min·1.73m2)或透析、緊急操作、術前主動脈內球囊泵、左室射血分數<30%和任何心臟瓣膜手術組成。POAF評分總分為0~9分,年齡60~69歲計1分;70~79歲計2分;≥80歲計3分;慢性阻塞性肺疾病計1分;eGFR<15 mL/(min·1.73m2)或透析計1分;緊急操作計1分;術前使用主動脈內球囊反搏術計1分;左室射血分數<30%計1分;任何心臟瓣膜手術計1分。
1.3 觀察指標
觀察并記錄患者紐約心臟協會心功能分級,心率,體重指數(body mass index,BMI),吸煙史,飲酒史,合并高血壓,糖尿病,腦血管病,慢性阻塞性肺疾病,術前心臟超聲指標[左房內徑、左室舒張末內徑、左室收縮末內徑、二尖瓣(mitral valve,MV)舒張早期峰值速度、MV舒張晚期峰值速度、室間隔部(interventricular septum,IVS)舒張早期峰值速度、IVS舒張晚期峰值速度、左室射血分數],術前實驗室指標(白細胞計數、中性粒細胞計數、淋巴細胞計數、單核細胞計數、血小板壓積、血尿素、血肌酐),7 d動態心電圖中HRV指標[正常心搏間期標準差(standard deviation of all normal-to-normal intervals,SDNN)、相鄰正常心搏間期差的均方根(root mean square of successive differences,RMSSD)、相鄰正常心搏間期的差值>50 ms的心搏數占正常心搏間期總心搏數的百分比(percetange of adjacent normal-to-normal intervals differing by more than 50 ms,pNN50)、低頻功率(low frequency power,LF)、高頻功率(high frequency power,HF)、LF/HF]。
1.4 統計學分析
所有數據分析均采用SPSS軟件(版本27.0)和R軟件(版本4.2.2)。分類變量以頻數和百分比(%)表示,分類變量比較采用χ2檢驗。連續變量以均數±標準差( ±s)或中位數(上下四分位數)[M(P25,P75)]表示,兩組間比較采用獨立樣本t檢驗或Mann-Whitney U檢驗。通過單因素logistic回歸分析探討POAF的危險因素,將P<0.1的變量納入多因素logistic回歸,以研究POAF的獨立危險因素。構造列線圖模型,并通過十折交叉驗證重采樣對列線圖模型進行內部驗證,并計算重采樣后的AUC和Kappa值。對模型的ROC曲線、校正程度、臨床決策曲線、臨床影響曲線進行了分析。同時進行了霍斯黙-萊梅肖擬合優度檢驗(Hosmer and Lemeshow test,H-L檢驗)。并比較列線圖模型與POAF-AF評分之間的曲線下面積。根據樣本數據,計算POAF-AF評分。所有檢驗均為雙側檢驗,P≤0.05為差異有統計學意義。
±s)或中位數(上下四分位數)[M(P25,P75)]表示,兩組間比較采用獨立樣本t檢驗或Mann-Whitney U檢驗。通過單因素logistic回歸分析探討POAF的危險因素,將P<0.1的變量納入多因素logistic回歸,以研究POAF的獨立危險因素。構造列線圖模型,并通過十折交叉驗證重采樣對列線圖模型進行內部驗證,并計算重采樣后的AUC和Kappa值。對模型的ROC曲線、校正程度、臨床決策曲線、臨床影響曲線進行了分析。同時進行了霍斯黙-萊梅肖擬合優度檢驗(Hosmer and Lemeshow test,H-L檢驗)。并比較列線圖模型與POAF-AF評分之間的曲線下面積。根據樣本數據,計算POAF-AF評分。所有檢驗均為雙側檢驗,P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過北部戰區總醫院倫理委員會批準,批號:倫審Y(2023)136號。
2 結果
2.1 患者一般資料
根據納入排除標準,行單純AVR且術前無AF患者369例,排除患者178例:植入心臟起搏器或除顫器(n=2);同期需要二尖瓣手術或主動脈-冠狀動脈搭橋手術(n=170);臨床資料不完整(n=4);年齡<18或>80歲(n=2)。共納入191例患者,POAF組66例,非POAF組125例,兩組間的基線特征見表1。POAF組患者平均年齡(60.97±8.41)歲,女16例(24%),高血壓25例(38%),糖尿病4例(6%),平均BMI(24.00±2.77)kg/m2。非POAF組平均年齡(54.65±11.85)歲,女59例(47%),高血壓44例(35%),糖尿病6例(5%),平均BMI(24.54±3.32)kg/m2。
 ±s/ M(P25,P75)]
±s/ M(P25,P75)]
2.2 術后AF預測因素
單因素分析結果顯示,年齡、性別、飲酒史、吸煙史、腦血管病、慢性阻塞性肺疾病、白細胞計數、單核細胞計數、血小板壓積、左心房內徑、MV舒張早期峰值速度、IVS舒張早期峰值速度、HF與單純AVR患者發生POAF的風險相關。將上述因素進一步進行多因素logistic回歸,結果顯示年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積、HF是孤立性心臟瓣膜手術患者發生POAF的獨立影響因素(P<0.05);見表2。其中年齡、飲酒史、COPD、HF為患者術后POAF發生的危險因素(OR>1),而性別為女性、血小板壓積則為保護因素(OR<1)。
2.3 預測模型的建立
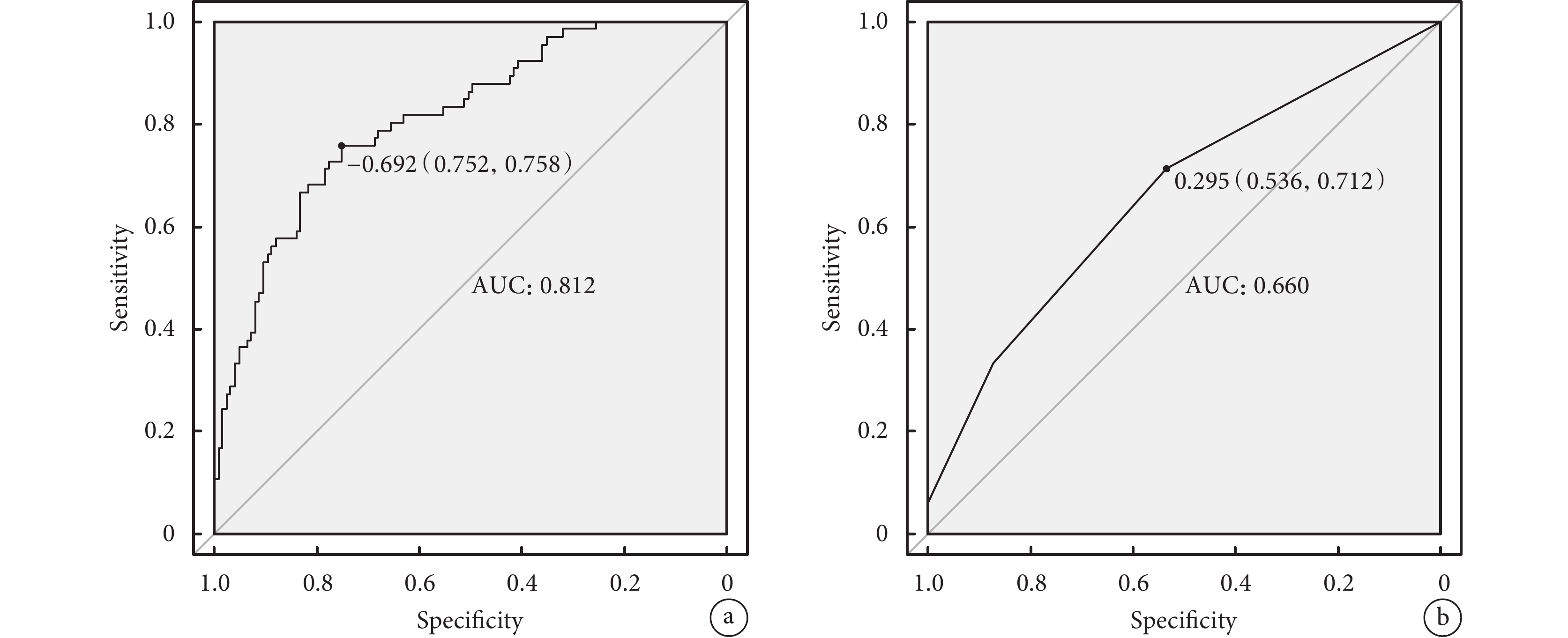
基于研究結果,我們構建了列線圖模型,我們使用以下6個變量預測單純AVR術后患者POAF的發生:年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積、HF。觀察每個獨立預測因子向上投影到列線圖頂部的值點,得到單項得分,然后通過記錄總賦分,得到POAF的發生概率;見圖1。ROC曲線分析顯示,AUC=0.812,95%CI(0.7493,0.8752);見圖2a。通過十折交叉驗證重采樣,對模型進行內部驗證,AUC=0.757,Kappa=0.438。
 圖1
預測單純主動脈瓣置換術后新發心房顫動的列線圖
圖1
預測單純主動脈瓣置換術后新發心房顫動的列線圖
HF:高頻功率;COPD:慢性阻塞性肺疾病;PCT:血小板壓積
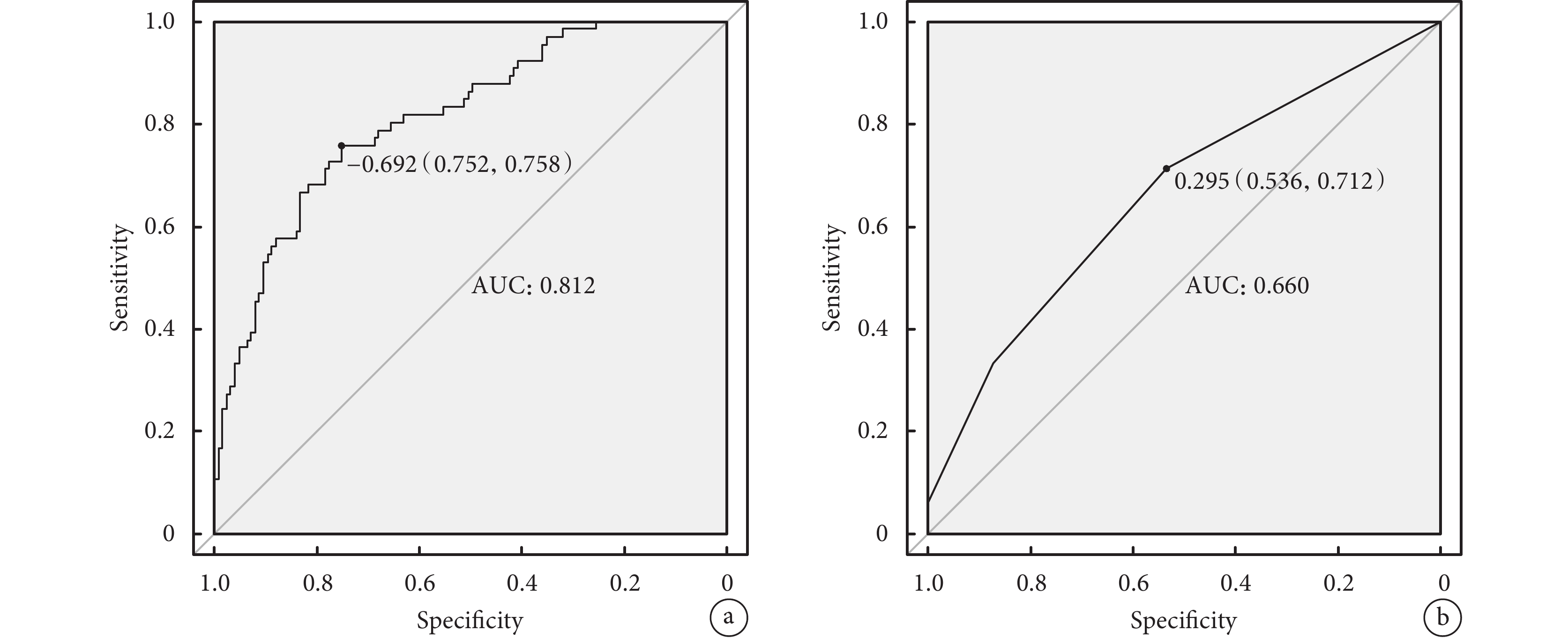 圖2
預測單純主動脈瓣置換術后POAF的ROC曲線
圖2
預測單純主動脈瓣置換術后POAF的ROC曲線
a:列線圖的ROC曲線;b:POAF-AF評分的ROC曲線;ROC:受試者工作特征;POAF:術后新發心房顫動;AF:心房顫動
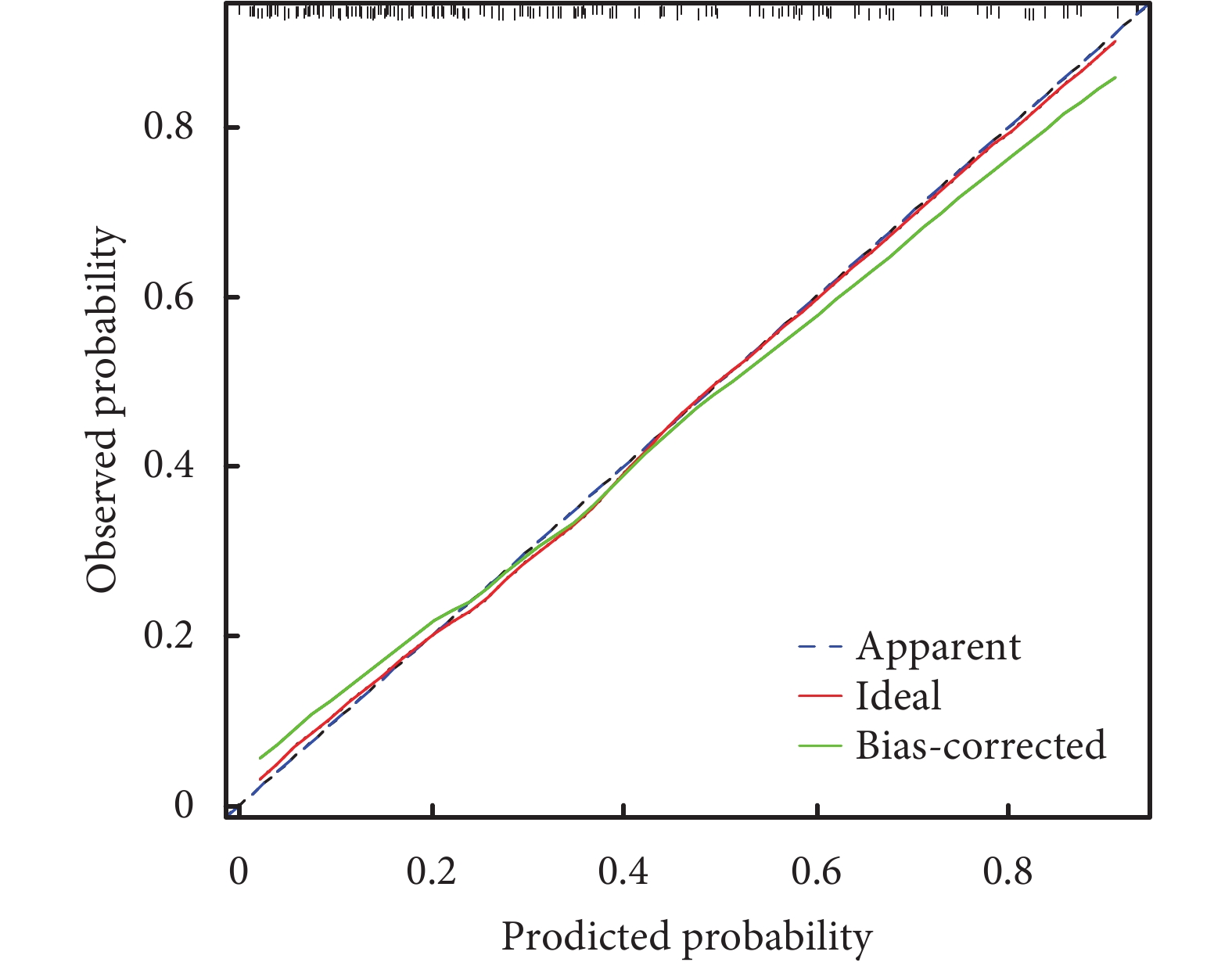
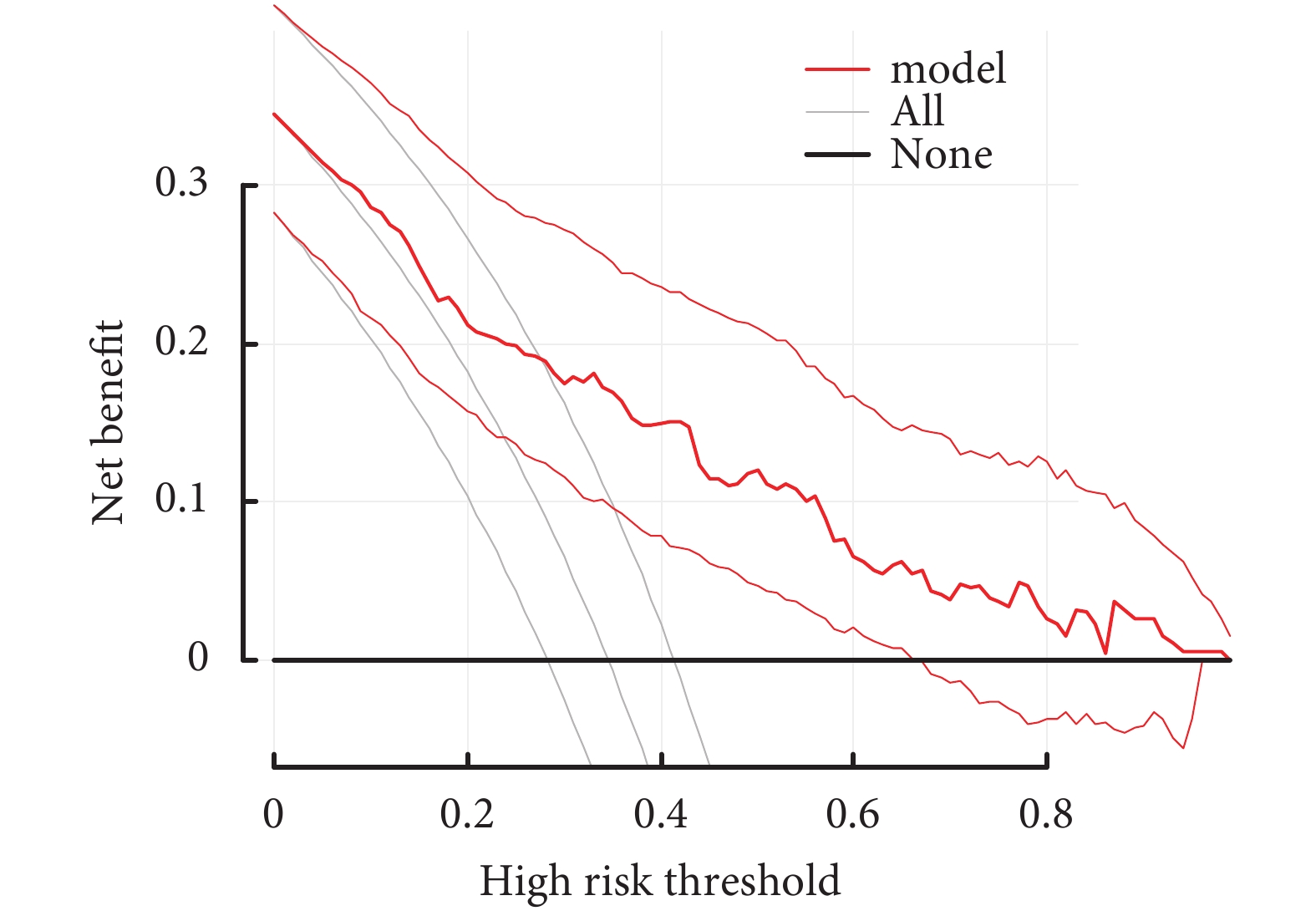
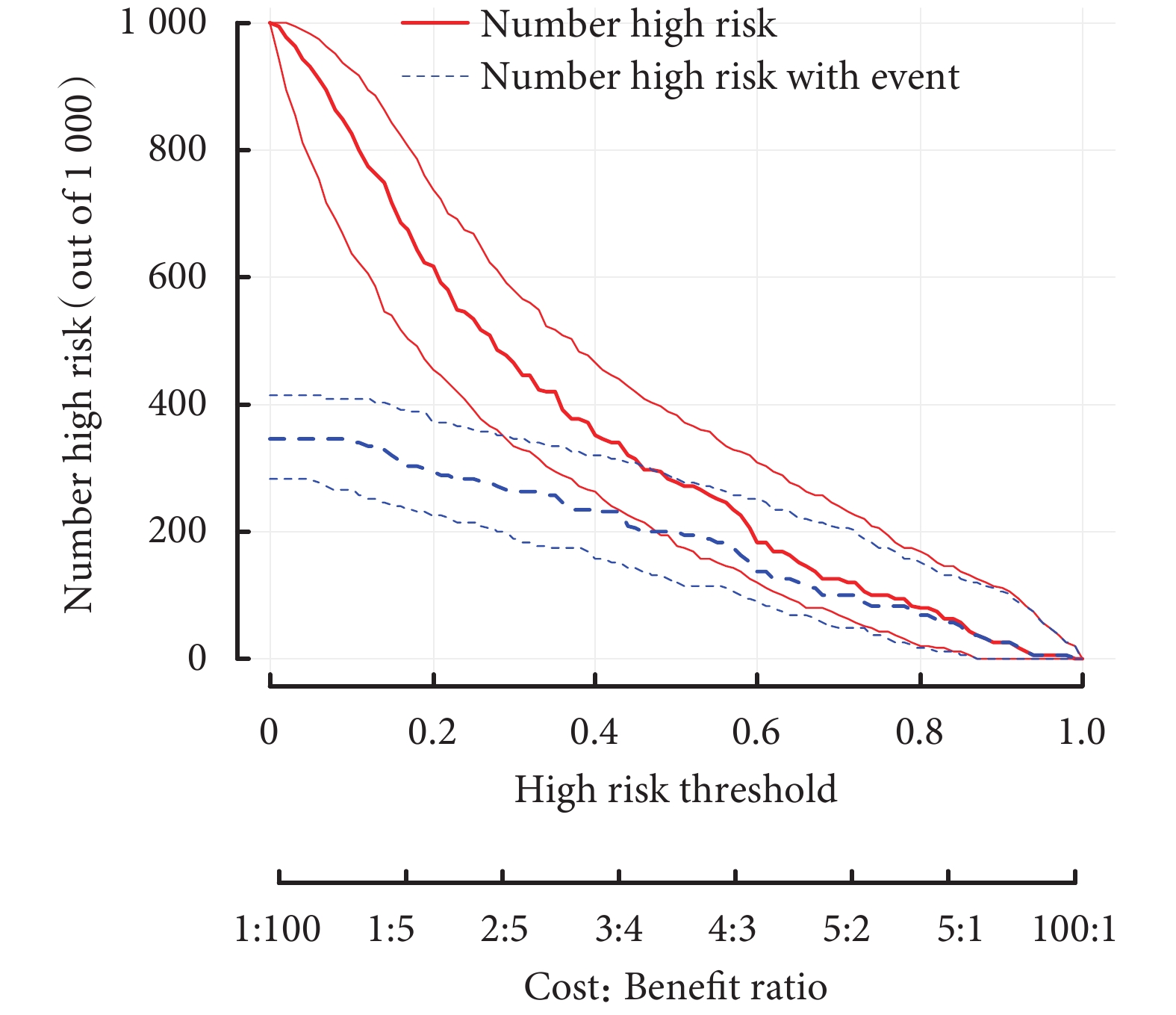
模型的校準曲線顯示列線圖模型的預測概率和觀測概率之間有很好的一致性(圖3),同時進行H-L檢驗,P=0.496,表示模型擬合良好。此外,該列線圖ROC曲線下面積為0.81,而POAF-AF評分僅為0.66,就單純AVR術后POAF而言,該列線圖模型比POAF-AF評分有更強的預測能力;見圖2。決策曲線分析及臨床影響曲線分析顯示,該模型可有效適用于臨床;見圖4~5。
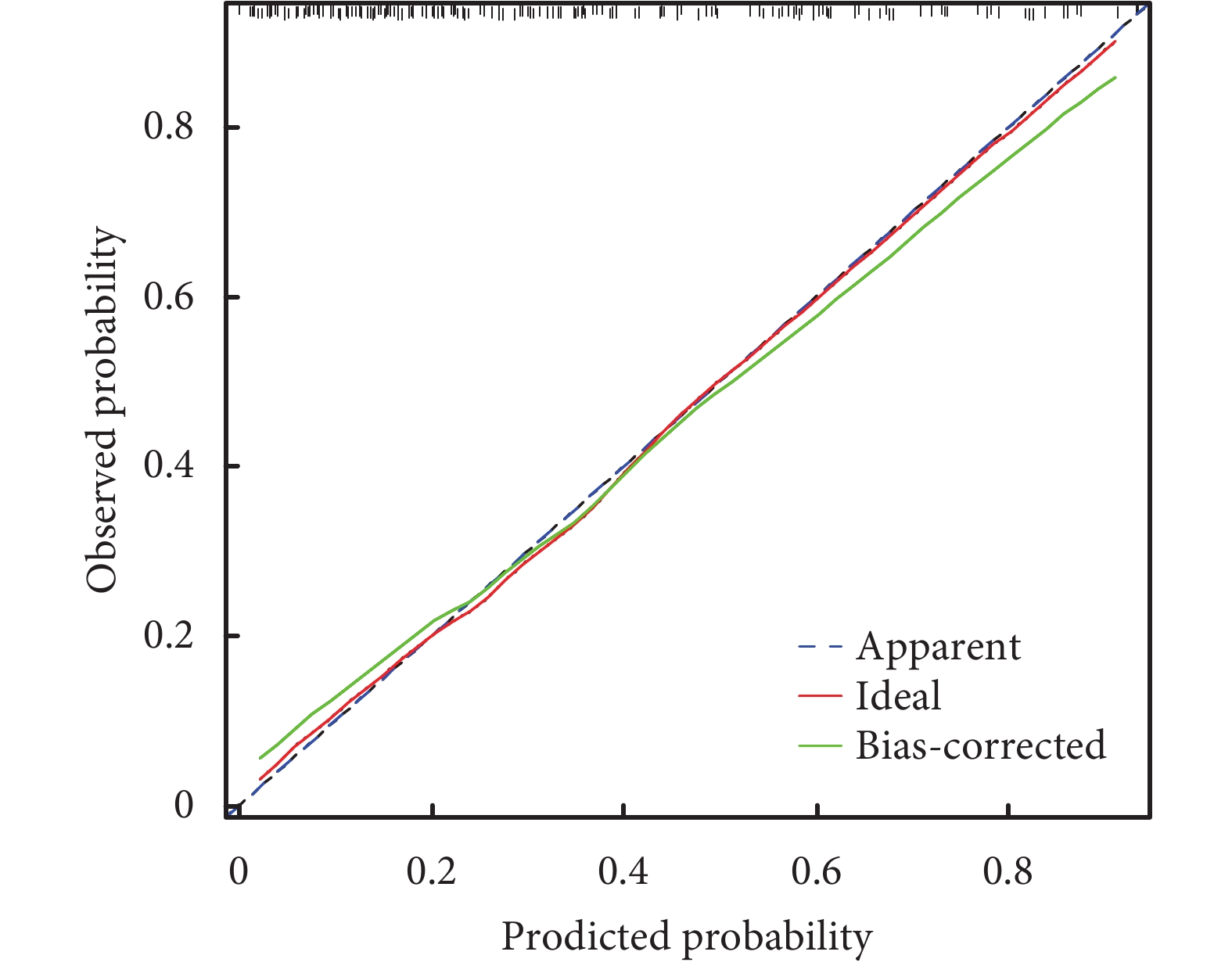 圖3
預測單純主動脈瓣置換術后新發心房顫動的校準曲線
圖3
預測單純主動脈瓣置換術后新發心房顫動的校準曲線
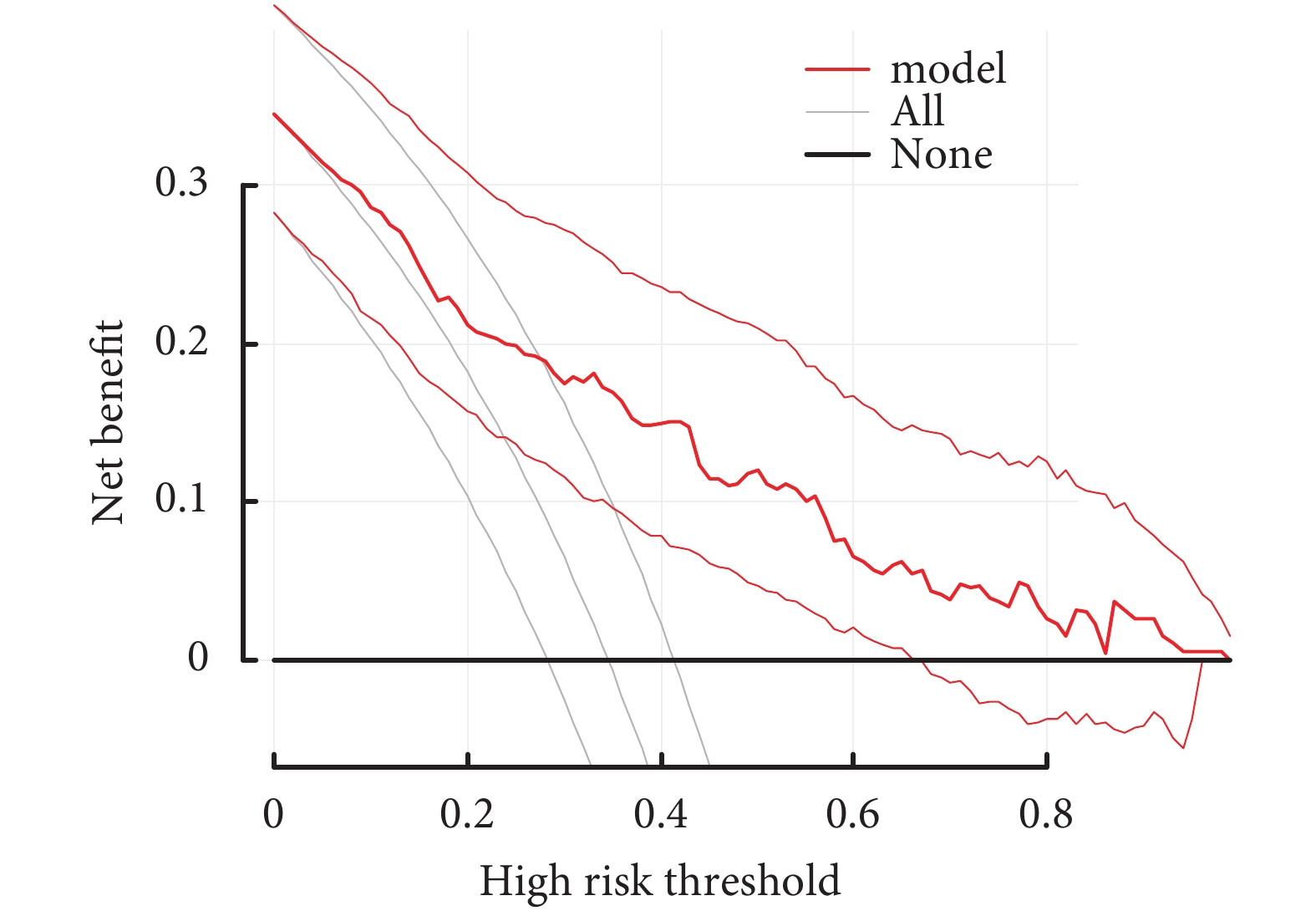 圖4
預測單純主動脈瓣置換術后新發心房顫動房顫的臨床決策曲線
圖4
預測單純主動脈瓣置換術后新發心房顫動房顫的臨床決策曲線
紅色曲線代表不同心房顫動危險程度患者的臨床獲益,橫線表示所有樣本均為陰性的情況,斜線表示所有樣本均為陽性的情況
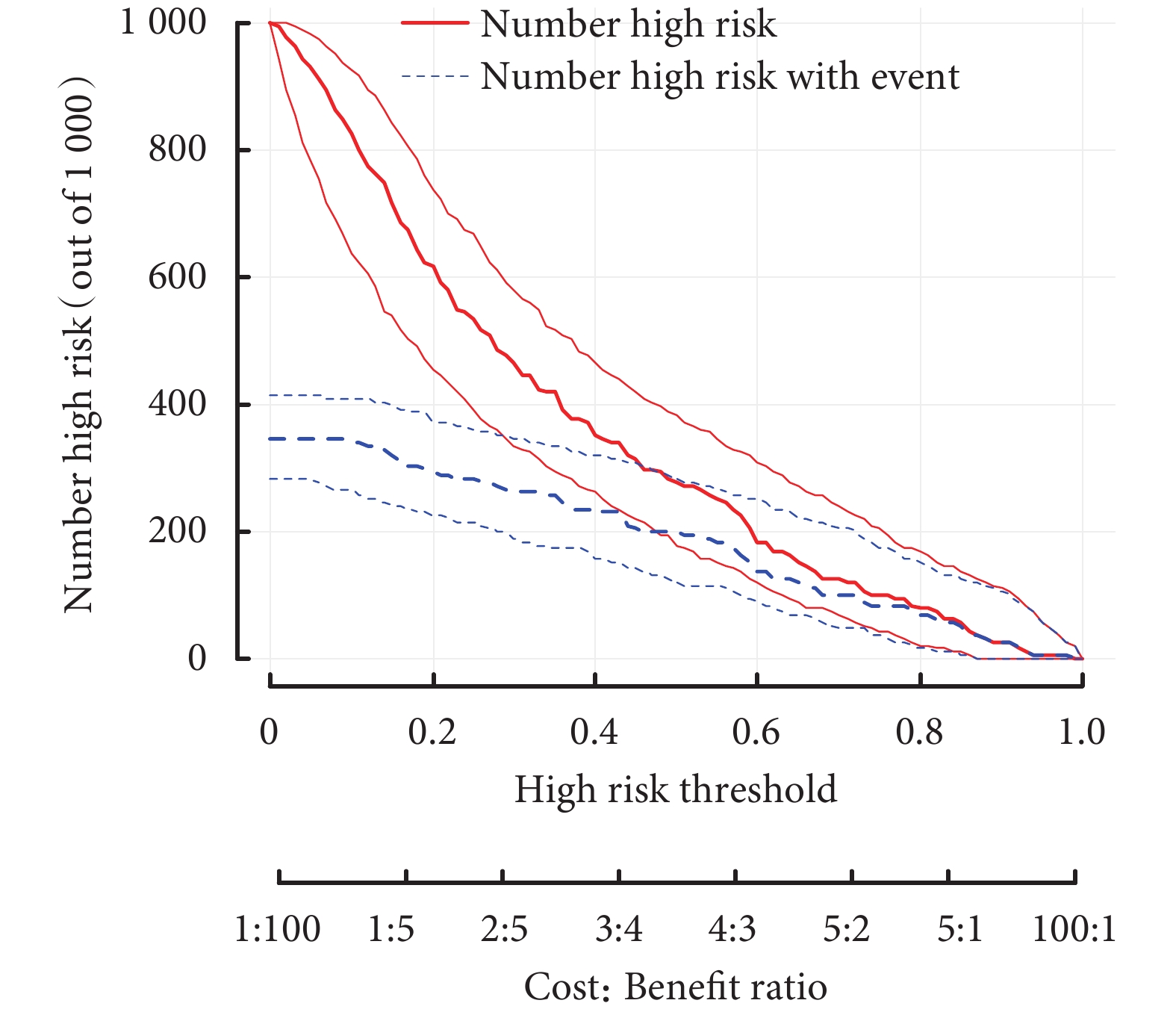 圖5
預測單純主動脈瓣置換術后新發心房顫動的臨床影響曲線
圖5
預測單純主動脈瓣置換術后新發心房顫動的臨床影響曲線
紅色表示各個閾值概率下,被模型劃分為陽性的人數,而藍色曲線表示各個閾概率下真陽性人數
3 討論
本研究POAF發生率為34.55%,與既往單純AVR研究[6-8]中28%~60%的POAF發生率一致,同樣在心臟手術后POAF 10%~60%的發生率范圍內[3-5]。本研究結合患者基線資料、術前血液指標、心臟彩色超聲和7 d動態心電圖指標,我們最終納入了年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積和HF建立了一個列線圖模型,臨床醫生可在術前使用它對患者基本情況進行直觀的評估,根據各危險因素評分的總和對患者POAF進行早期篩查,并提前預防。我們發現這比POAF-AF評分的預測價值更高,且變量易于獲得。
年齡是POAF的獨立危險因素,這已被多個研究[17-19]證實,在此列線圖中年齡也是得分占比最高的因素。高齡同樣也是多種心血管疾病的高危因素。這與衰老導致的心房心肌的退行性變及心肌纖維化有關,老年人對氧化應激及自主神經變化較差的適應能力同樣會導致AF的發生[20-21]。越來越多的證據證明,AF與慢性阻塞性肺疾病相關,這已在Christos[22]的綜述中有詳細的闡述。我們的結果也顯示,慢性阻塞性肺疾病是POAF的獨立危險因素。其發病機制與慢性肺病導致的氧合降低、高碳酸血癥、肺動脈高壓、舒張功能障礙、氧化應激和炎癥等有關[22]。
既往研究表明,自主神經系統的異常參與了POAF的發病機制。心臟迷走神經和交感神經相互協調和平衡維持心臟的正常活動,它們的異常變化會導致心律失常發生[23]。有研究[24]表明,AF可在心臟的自主神經的電刺激下被誘發。HRV是一種評估自主神經系統的無創方法,可在7 d動態心電圖指標中獲得。術前HRV頻域指標HF與迷走神經活動有關。本研究結合動態心電圖參數,首次發現術前7 d平均HF的升高與單純AVR術后POAF風險的升高獨立相關。可能是因為迷走神經受刺激會縮短動作電位持續時間和不應期,從而引起AF[25]。在單因素分析中,我們發現左房內徑是一個潛在的危險因素,但獨立預測分析顯示左房內徑差異無統計學意義。我們的結果與Andrea團隊[26]對AVR術后研究結果相似,然而他們發現,左房內徑為術后長期AF的獨立危險因素。
既往相關文獻報道,男性比女性更易發生POAF。Alam等[27]在對冠狀動脈旁路移植術的研究中發現女性發生POAF的風險較低,Filardo等[28]也有相似的發現。這與我們的研究一致。我們確定男性為單純AVR術后POAF的獨立預測因子。飲酒同樣也是POAF的獨立預測因子。Kiran等[29]在一項大樣本研究中指出,任何程度的飲酒史都與心血管風險增加有關。此外,多個臨床研究[30-31]證實,飲酒同樣也會增加POAF的風險。本研究發現術前血小板壓積與POAF的發生呈負相關。血小板的壓積越高,發生POAF的風險就越低。我們的結論與Ahmet等[32]在對冠狀動脈旁路移植術研究中的結果一致,卻與Ozge等[33]的研究中血小板壓積是POAF的危險因素的結論不同,血小板壓積與AF的關系有待進一步的研究。
有學者[29]認為,AF可能在手術之前就存在于個體中,其有AF易感性,因手術誘發不利因素如缺血、炎癥、氧化應激和自主神經失衡才導致POAF發生,即AF患者可在術前被發現,因此該模型具有較高的臨床應用價值,值得進一步臨床推廣應用。
本研究有許多局限性,首先,本研究是一項回顧性、單中心、小樣本量的研究,可能會有一定的選擇偏倚。其次,本研究缺乏外部驗證。因受限于樣本容量,已通過內部重采樣進行驗證。第三,我們暫未對患者進行遠期隨訪,不能對AF發生的遠期結果進行預測。
綜上所述,我們認為年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積、HF是單純AVR術后POAF的獨立預測因素,該列線圖模型可以幫助臨床醫生直觀地預測POAF的發生概率,并采取必要的預防措施。
利益沖突:無。
作者貢獻:李瑞負責數據分析和論文撰寫;梁漢青負責對文章的知識性內容作批評性審閱;韓勁松參與論文選題、設計和審閱。
術后新發心房顫動(postoperative atrial fibrillation,POAF)是心臟術后最常見的并發癥之一,不僅延長了住院時間,增加了醫藥與護理費用[1],更是與心血管疾病的發病風險和死亡風險直接相關[2]。既往相關研究表明心臟術后POAF發生率約為10%~60%[3-5],其中單純主動脈瓣置換術(aortic valve replacement,AVR)術后POAF發生率約為28%~60%[6-8]。因此,早期識別POAF患者并積極預防顯得尤為重要。據報道,POAF為急性心房顫動(atrial fibrillation,AF)的一種,其與心肌細胞炎癥、心房纖維化、局部機械應激、氧化應激、電解質失衡和自主神經張力的改變等有關[9-10]。POAF病理生理機制復雜,目前未能完全闡明,所以臨床較難以對POAF進行預測。根據既往研究[11-13],常見的預測因素為年齡、性別、慢性阻塞性肺疾病、糖尿病、左室射血分數、再次心臟手術等。
現有的POAF預測模型(如POAF-AF評分、CHA2DS2-VASc評分、AF風險指數等),因研究對象接受心臟手術類型不同,它們的預測能力差異很大[14-16]。目前POAF預測研究多集中在冠狀動脈粥樣硬化性心臟病或二尖瓣疾病上,對單純AVR患者的研究較少。沒有簡單、有效的單純AVR術后POAF的預測模型。本研究結合患者基線資料、術前血液指標、心臟彩色超聲和7 d動態心電圖中心率變異率(heart rate variability,HRV)指標,建立了一個有效的列線圖模型,旨在提前識別POAF患者并積極干預,降低POAF發生率。
1 資料與方法
1.1 臨床資料和分組
回顧性收集2020年6月—2022年6月在北部戰區總醫院心血管外科接受單純AVR患者的臨床資料。納入標準為:行單純AVR;年齡>18歲且≤80歲;有7 d動態心電圖結果。排除標準:入院前有AF或其他心律失常病史;植入心臟起搏器或除顫器;同期需要二尖瓣手術或主動脈-冠狀動脈搭橋手術;臨床資料不完整。根據術后7 d內是否出現POAF,將單純AVR術后患者分為POAF組與非POAF組。
1.2 診斷及定義
全組患者術前和術后都接受了連續7 d的動態心電圖監測。POAF定義為術前為正常竇性心律,但術后7 d內出現POAF。AF定義為心律不規則,P波消失,持續至少30 s。POAF 評分由年齡、慢性阻塞性肺疾病、估算腎小球濾過率(estimated glomerular filtration rate,eGFR)<15 mL/(min·1.73m2)或透析、緊急操作、術前主動脈內球囊泵、左室射血分數<30%和任何心臟瓣膜手術組成。POAF評分總分為0~9分,年齡60~69歲計1分;70~79歲計2分;≥80歲計3分;慢性阻塞性肺疾病計1分;eGFR<15 mL/(min·1.73m2)或透析計1分;緊急操作計1分;術前使用主動脈內球囊反搏術計1分;左室射血分數<30%計1分;任何心臟瓣膜手術計1分。
1.3 觀察指標
觀察并記錄患者紐約心臟協會心功能分級,心率,體重指數(body mass index,BMI),吸煙史,飲酒史,合并高血壓,糖尿病,腦血管病,慢性阻塞性肺疾病,術前心臟超聲指標[左房內徑、左室舒張末內徑、左室收縮末內徑、二尖瓣(mitral valve,MV)舒張早期峰值速度、MV舒張晚期峰值速度、室間隔部(interventricular septum,IVS)舒張早期峰值速度、IVS舒張晚期峰值速度、左室射血分數],術前實驗室指標(白細胞計數、中性粒細胞計數、淋巴細胞計數、單核細胞計數、血小板壓積、血尿素、血肌酐),7 d動態心電圖中HRV指標[正常心搏間期標準差(standard deviation of all normal-to-normal intervals,SDNN)、相鄰正常心搏間期差的均方根(root mean square of successive differences,RMSSD)、相鄰正常心搏間期的差值>50 ms的心搏數占正常心搏間期總心搏數的百分比(percetange of adjacent normal-to-normal intervals differing by more than 50 ms,pNN50)、低頻功率(low frequency power,LF)、高頻功率(high frequency power,HF)、LF/HF]。
1.4 統計學分析
所有數據分析均采用SPSS軟件(版本27.0)和R軟件(版本4.2.2)。分類變量以頻數和百分比(%)表示,分類變量比較采用χ2檢驗。連續變量以均數±標準差( ±s)或中位數(上下四分位數)[M(P25,P75)]表示,兩組間比較采用獨立樣本t檢驗或Mann-Whitney U檢驗。通過單因素logistic回歸分析探討POAF的危險因素,將P<0.1的變量納入多因素logistic回歸,以研究POAF的獨立危險因素。構造列線圖模型,并通過十折交叉驗證重采樣對列線圖模型進行內部驗證,并計算重采樣后的AUC和Kappa值。對模型的ROC曲線、校正程度、臨床決策曲線、臨床影響曲線進行了分析。同時進行了霍斯黙-萊梅肖擬合優度檢驗(Hosmer and Lemeshow test,H-L檢驗)。并比較列線圖模型與POAF-AF評分之間的曲線下面積。根據樣本數據,計算POAF-AF評分。所有檢驗均為雙側檢驗,P≤0.05為差異有統計學意義。
±s)或中位數(上下四分位數)[M(P25,P75)]表示,兩組間比較采用獨立樣本t檢驗或Mann-Whitney U檢驗。通過單因素logistic回歸分析探討POAF的危險因素,將P<0.1的變量納入多因素logistic回歸,以研究POAF的獨立危險因素。構造列線圖模型,并通過十折交叉驗證重采樣對列線圖模型進行內部驗證,并計算重采樣后的AUC和Kappa值。對模型的ROC曲線、校正程度、臨床決策曲線、臨床影響曲線進行了分析。同時進行了霍斯黙-萊梅肖擬合優度檢驗(Hosmer and Lemeshow test,H-L檢驗)。并比較列線圖模型與POAF-AF評分之間的曲線下面積。根據樣本數據,計算POAF-AF評分。所有檢驗均為雙側檢驗,P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過北部戰區總醫院倫理委員會批準,批號:倫審Y(2023)136號。
2 結果
2.1 患者一般資料
根據納入排除標準,行單純AVR且術前無AF患者369例,排除患者178例:植入心臟起搏器或除顫器(n=2);同期需要二尖瓣手術或主動脈-冠狀動脈搭橋手術(n=170);臨床資料不完整(n=4);年齡<18或>80歲(n=2)。共納入191例患者,POAF組66例,非POAF組125例,兩組間的基線特征見表1。POAF組患者平均年齡(60.97±8.41)歲,女16例(24%),高血壓25例(38%),糖尿病4例(6%),平均BMI(24.00±2.77)kg/m2。非POAF組平均年齡(54.65±11.85)歲,女59例(47%),高血壓44例(35%),糖尿病6例(5%),平均BMI(24.54±3.32)kg/m2。
 ±s/ M(P25,P75)]
±s/ M(P25,P75)]
2.2 術后AF預測因素
單因素分析結果顯示,年齡、性別、飲酒史、吸煙史、腦血管病、慢性阻塞性肺疾病、白細胞計數、單核細胞計數、血小板壓積、左心房內徑、MV舒張早期峰值速度、IVS舒張早期峰值速度、HF與單純AVR患者發生POAF的風險相關。將上述因素進一步進行多因素logistic回歸,結果顯示年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積、HF是孤立性心臟瓣膜手術患者發生POAF的獨立影響因素(P<0.05);見表2。其中年齡、飲酒史、COPD、HF為患者術后POAF發生的危險因素(OR>1),而性別為女性、血小板壓積則為保護因素(OR<1)。
2.3 預測模型的建立
基于研究結果,我們構建了列線圖模型,我們使用以下6個變量預測單純AVR術后患者POAF的發生:年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積、HF。觀察每個獨立預測因子向上投影到列線圖頂部的值點,得到單項得分,然后通過記錄總賦分,得到POAF的發生概率;見圖1。ROC曲線分析顯示,AUC=0.812,95%CI(0.7493,0.8752);見圖2a。通過十折交叉驗證重采樣,對模型進行內部驗證,AUC=0.757,Kappa=0.438。
 圖1
預測單純主動脈瓣置換術后新發心房顫動的列線圖
圖1
預測單純主動脈瓣置換術后新發心房顫動的列線圖
HF:高頻功率;COPD:慢性阻塞性肺疾病;PCT:血小板壓積
 圖2
預測單純主動脈瓣置換術后POAF的ROC曲線
圖2
預測單純主動脈瓣置換術后POAF的ROC曲線
a:列線圖的ROC曲線;b:POAF-AF評分的ROC曲線;ROC:受試者工作特征;POAF:術后新發心房顫動;AF:心房顫動
模型的校準曲線顯示列線圖模型的預測概率和觀測概率之間有很好的一致性(圖3),同時進行H-L檢驗,P=0.496,表示模型擬合良好。此外,該列線圖ROC曲線下面積為0.81,而POAF-AF評分僅為0.66,就單純AVR術后POAF而言,該列線圖模型比POAF-AF評分有更強的預測能力;見圖2。決策曲線分析及臨床影響曲線分析顯示,該模型可有效適用于臨床;見圖4~5。
 圖3
預測單純主動脈瓣置換術后新發心房顫動的校準曲線
圖3
預測單純主動脈瓣置換術后新發心房顫動的校準曲線
 圖4
預測單純主動脈瓣置換術后新發心房顫動房顫的臨床決策曲線
圖4
預測單純主動脈瓣置換術后新發心房顫動房顫的臨床決策曲線
紅色曲線代表不同心房顫動危險程度患者的臨床獲益,橫線表示所有樣本均為陰性的情況,斜線表示所有樣本均為陽性的情況
 圖5
預測單純主動脈瓣置換術后新發心房顫動的臨床影響曲線
圖5
預測單純主動脈瓣置換術后新發心房顫動的臨床影響曲線
紅色表示各個閾值概率下,被模型劃分為陽性的人數,而藍色曲線表示各個閾概率下真陽性人數
3 討論
本研究POAF發生率為34.55%,與既往單純AVR研究[6-8]中28%~60%的POAF發生率一致,同樣在心臟手術后POAF 10%~60%的發生率范圍內[3-5]。本研究結合患者基線資料、術前血液指標、心臟彩色超聲和7 d動態心電圖指標,我們最終納入了年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積和HF建立了一個列線圖模型,臨床醫生可在術前使用它對患者基本情況進行直觀的評估,根據各危險因素評分的總和對患者POAF進行早期篩查,并提前預防。我們發現這比POAF-AF評分的預測價值更高,且變量易于獲得。
年齡是POAF的獨立危險因素,這已被多個研究[17-19]證實,在此列線圖中年齡也是得分占比最高的因素。高齡同樣也是多種心血管疾病的高危因素。這與衰老導致的心房心肌的退行性變及心肌纖維化有關,老年人對氧化應激及自主神經變化較差的適應能力同樣會導致AF的發生[20-21]。越來越多的證據證明,AF與慢性阻塞性肺疾病相關,這已在Christos[22]的綜述中有詳細的闡述。我們的結果也顯示,慢性阻塞性肺疾病是POAF的獨立危險因素。其發病機制與慢性肺病導致的氧合降低、高碳酸血癥、肺動脈高壓、舒張功能障礙、氧化應激和炎癥等有關[22]。
既往研究表明,自主神經系統的異常參與了POAF的發病機制。心臟迷走神經和交感神經相互協調和平衡維持心臟的正常活動,它們的異常變化會導致心律失常發生[23]。有研究[24]表明,AF可在心臟的自主神經的電刺激下被誘發。HRV是一種評估自主神經系統的無創方法,可在7 d動態心電圖指標中獲得。術前HRV頻域指標HF與迷走神經活動有關。本研究結合動態心電圖參數,首次發現術前7 d平均HF的升高與單純AVR術后POAF風險的升高獨立相關。可能是因為迷走神經受刺激會縮短動作電位持續時間和不應期,從而引起AF[25]。在單因素分析中,我們發現左房內徑是一個潛在的危險因素,但獨立預測分析顯示左房內徑差異無統計學意義。我們的結果與Andrea團隊[26]對AVR術后研究結果相似,然而他們發現,左房內徑為術后長期AF的獨立危險因素。
既往相關文獻報道,男性比女性更易發生POAF。Alam等[27]在對冠狀動脈旁路移植術的研究中發現女性發生POAF的風險較低,Filardo等[28]也有相似的發現。這與我們的研究一致。我們確定男性為單純AVR術后POAF的獨立預測因子。飲酒同樣也是POAF的獨立預測因子。Kiran等[29]在一項大樣本研究中指出,任何程度的飲酒史都與心血管風險增加有關。此外,多個臨床研究[30-31]證實,飲酒同樣也會增加POAF的風險。本研究發現術前血小板壓積與POAF的發生呈負相關。血小板的壓積越高,發生POAF的風險就越低。我們的結論與Ahmet等[32]在對冠狀動脈旁路移植術研究中的結果一致,卻與Ozge等[33]的研究中血小板壓積是POAF的危險因素的結論不同,血小板壓積與AF的關系有待進一步的研究。
有學者[29]認為,AF可能在手術之前就存在于個體中,其有AF易感性,因手術誘發不利因素如缺血、炎癥、氧化應激和自主神經失衡才導致POAF發生,即AF患者可在術前被發現,因此該模型具有較高的臨床應用價值,值得進一步臨床推廣應用。
本研究有許多局限性,首先,本研究是一項回顧性、單中心、小樣本量的研究,可能會有一定的選擇偏倚。其次,本研究缺乏外部驗證。因受限于樣本容量,已通過內部重采樣進行驗證。第三,我們暫未對患者進行遠期隨訪,不能對AF發生的遠期結果進行預測。
綜上所述,我們認為年齡、性別、飲酒史、慢性阻塞性肺疾病、血小板壓積、HF是單純AVR術后POAF的獨立預測因素,該列線圖模型可以幫助臨床醫生直觀地預測POAF的發生概率,并采取必要的預防措施。
利益沖突:無。
作者貢獻:李瑞負責數據分析和論文撰寫;梁漢青負責對文章的知識性內容作批評性審閱;韓勁松參與論文選題、設計和審閱。