對于經優化藥物和器械治療仍有心力衰竭癥狀的中重度功能性二尖瓣反流(FMR)患者,經導管二尖瓣緣對緣修復術(TEER)逐漸成為可靠的治療方案。隨著TEER相關器械的不斷研發和改進,我國目前已有數十款自主研發的TEER器械正在進行臨床試驗。在本研究中,我們報道了第1例X-Clip?經導管二尖瓣緣對緣修復裝置治療重度FMR患者的病例。
二尖瓣反流(mitral regurgitation,MR)是最為常見的心臟瓣膜病[1],按發生機制可分為原發性(退行性)二尖瓣反流(degenerative mitral regurgitation,DMR)和繼發性(功能性)二尖瓣反流(functional mitral regurgitation,FMR)。盡管外科手術是除藥物治療外的主要治療方式,然而對于不適合外科手術的患者,經導管二尖瓣緣對緣修復術(transcatheter edge?to?edge repair,TEER)逐漸成為了一種新的治療選擇。根據最新的歐美指南和我國的專家共識[2-3],對于外科手術風險高或存在禁忌證的原發性MR可考慮行TEER(Ⅱa類推薦),而對于重度繼發性MR患者,若無需血運重建、外科修復或置換手術風險較高、藥物和器械治療對癥狀無改善,TEER推薦級別也高達Ⅱa 類。目前國外已獲批的TEER器械包括MitraClip (雅培公司,美國)和PASCAL經導管修復系統(Edwards Lifesciences,美國),兩款器械瓣膜設計上有較大差異,核心鎖定方式也不相同,但在臨床研究中均展現出良好的安全性和療效[4-9]。進口器械價格昂貴,近年來,我國自主研發的新型TEER系統陸續獲得了NMPA批準開展臨床試驗。在本研究中,我們報告全新設計的X-Clip?經導管瓣膜修復裝置首次人體植入并分享其設計及應用經驗。
臨床資料 患者,男,60歲,因反復活動后胸悶、氣促10年入院,既往診斷擴張型心肌病、二尖瓣關閉不全。入院時患者紐約心臟學會(New York Heart Association,NYHA)心功能Ⅲ級,患者由于擴張性心肌病,長期規范服用藥物治療(ARNI、β受體阻滯劑、醛固酮受體拮抗劑、SGLT-2i、利尿劑),但在經指南指導下藥物治療(guideline-directed medical therapy,GDMT)達到最大耐受劑量(血壓、心率)后仍反復出現胸悶、氣促、呼吸困難、心悸等心衰癥狀,評估冠脈無明顯病變。既往史包括腔隙性腦梗死、肺氣腫和外周動脈粥樣硬化。經胸超聲心動圖提示全心增大,二尖瓣對合錯位,二尖瓣大量反流(4+),左室舒張末期內徑74 mm,射血分數30%。經食管超聲心動圖(transesophageal echocardiography,TEE)提示二尖瓣前葉長度34 mm,后葉長度32 mm,對合深度9 mm,對合緣2.6 mm,二尖瓣口最大開放面積約5.4 cm2,射流緊縮口寬度(VC)7 mm×11 mm,有效反流口面積(EROA)0.47 cm2,反流容積371.4 mL(圖1)。經心臟團隊評估,其解剖結構適合行TEER且適合使用試驗用醫療器械,經過倫理委員會批準及患者知情同意后,擬采用X-Clip?裝置(深圳健心醫療)對患者行經皮修復術。
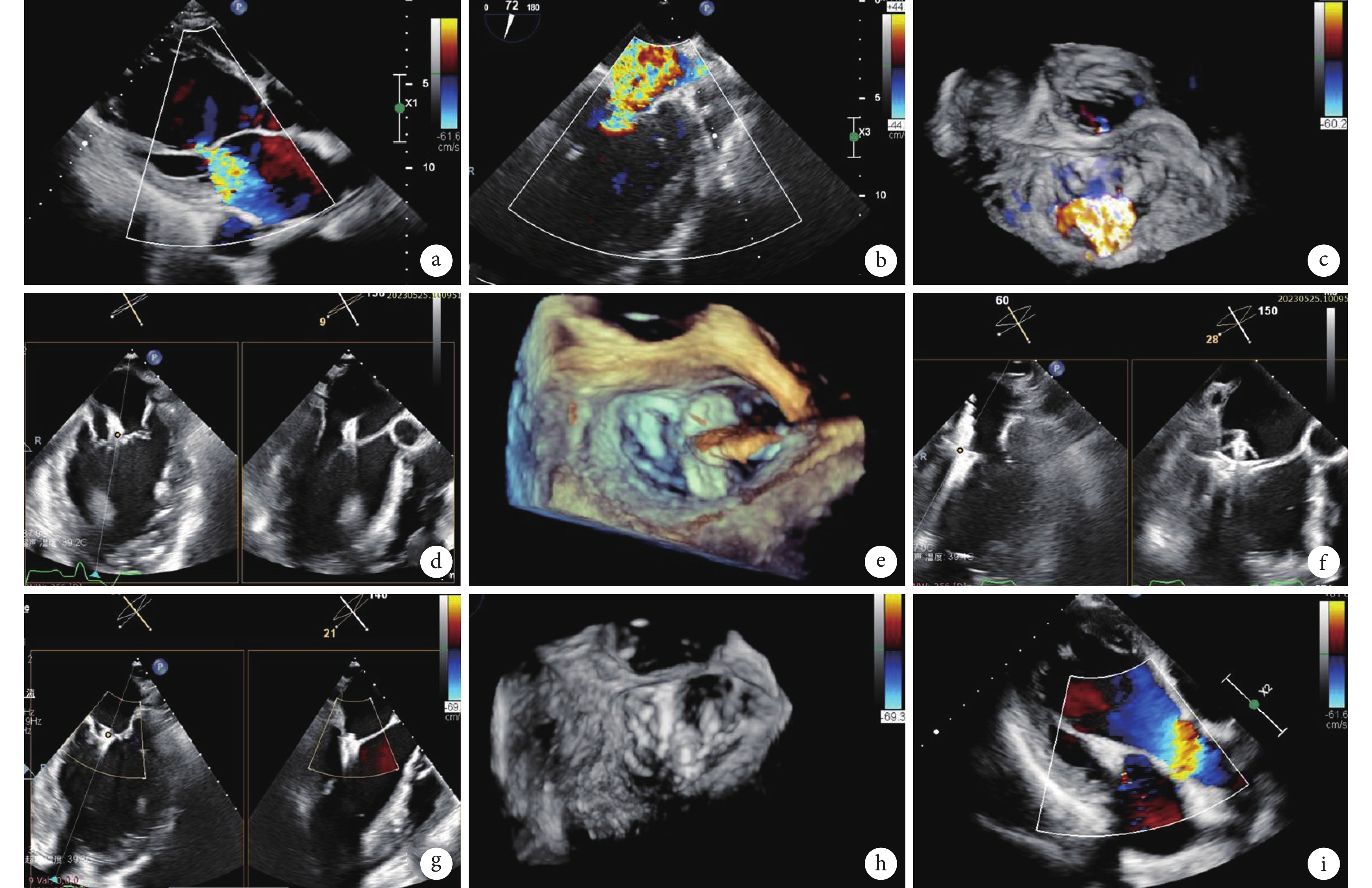
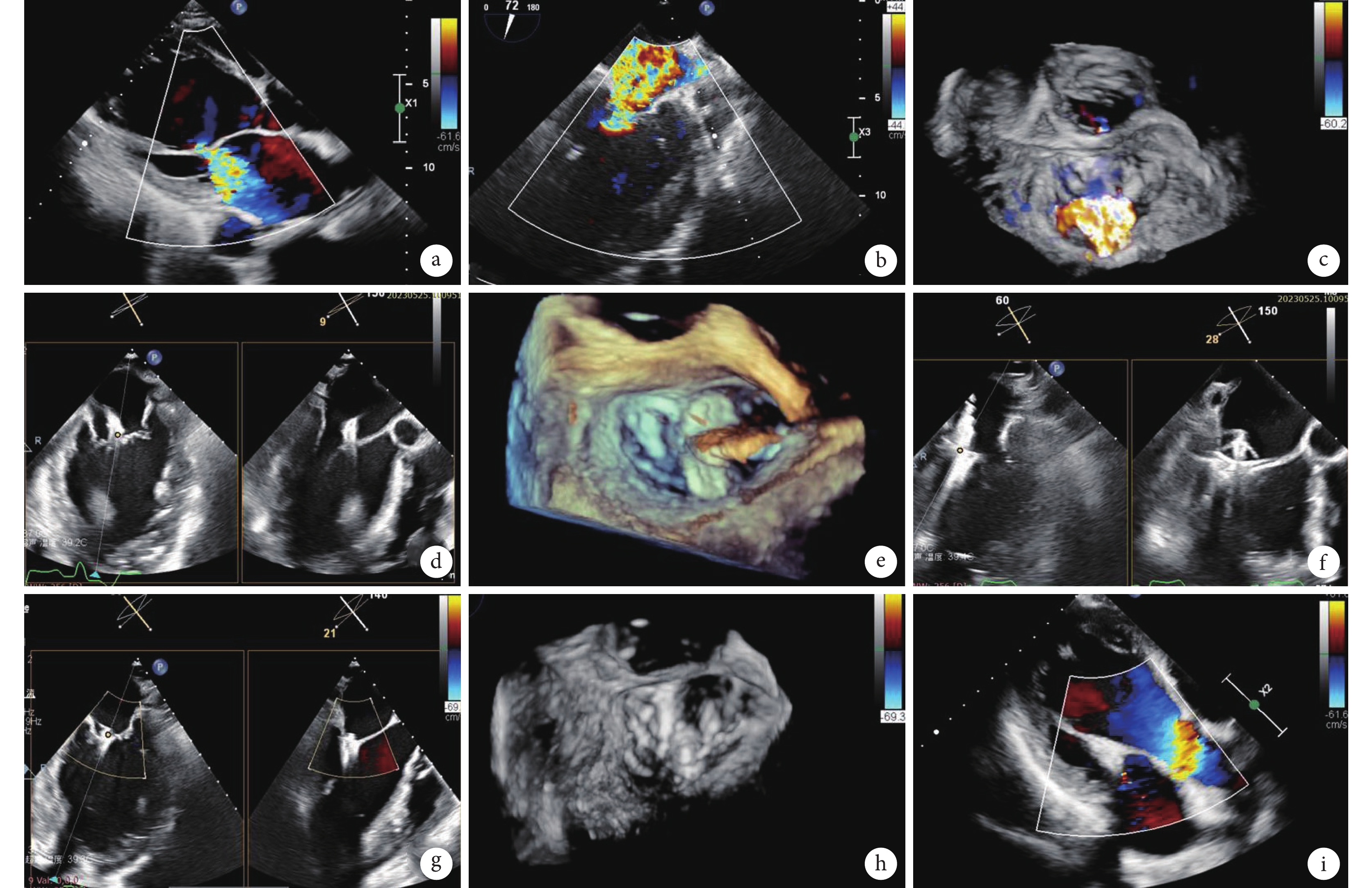 圖1
患者術前、術中和術后經胸/食管超聲心動圖
圖1
患者術前、術中和術后經胸/食管超聲心動圖
a:術前TTE二尖瓣反流;b~c:術前TEE二尖瓣重度反流;d~f:術中TEE引導二尖瓣夾準確植入A2/P2區;g~h:瓣膜夾植入后二尖瓣反流消失;i:1個月隨訪二尖瓣無反流
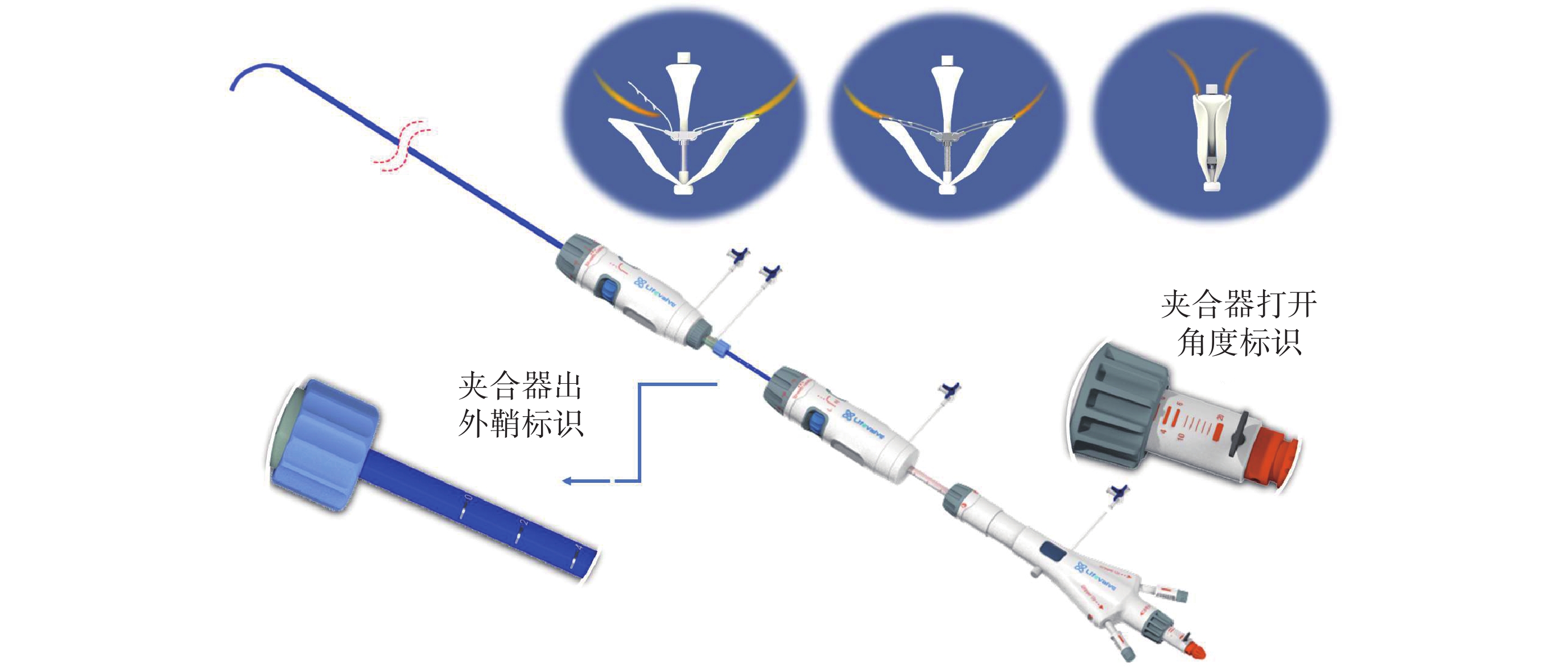
X-Clip?系統是我國自主研發的一種新型經導管二尖瓣緣對緣修復系統(圖2),其采用經典的三層輸送系統設計,其核心設計特點體現在:(1)夾合器具有彈性自適應特點,可緩解瓣葉夾合后的張力,降低瓣葉損傷風險,同時經過對彈性夾和器械材料及設計的改進,做到更大且更穩定的閉合力;(2)輸送系統及夾合器操控系統具有前進、后退標尺,以及打開、關閉角度的操作指示標尺,使得該器械可以進行不依賴射線的純超聲引導手術;(3)夾合器型號豐富,設計兩個寬度6 mm/8 mm及兩個臂長10 mm/12 mm參數的4個型號,以適合各種不同類型解剖條件,尤其有利于捕獲返流口較大,脫垂面積較寬的復雜病變;(4)夾合器具有單獨捕獲瓣葉的功能,及穩定的多向調彎功能,做到精準的瓣葉捕獲及釋放,具備第四代經導管二尖瓣緣對緣修復器械的特點。
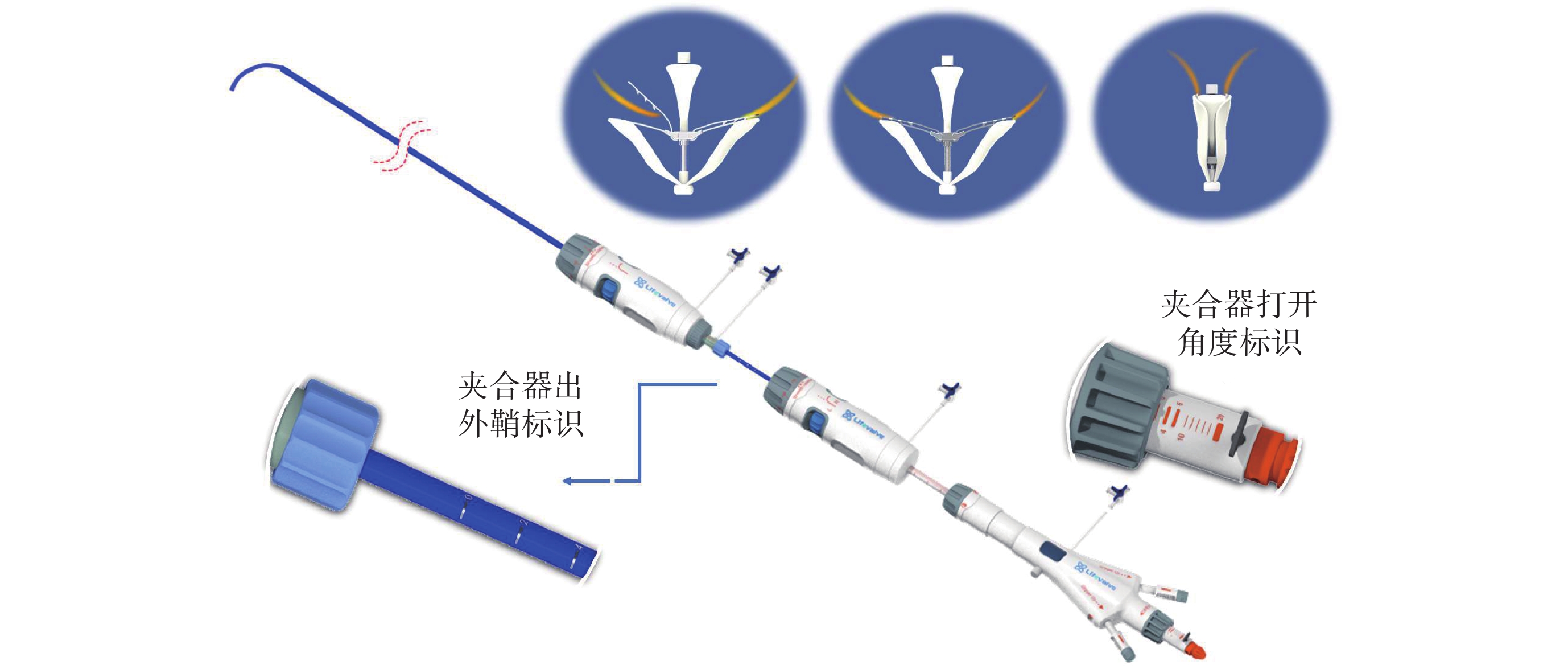 圖2
X-Clip?經導管二尖瓣緣對緣修復系統
圖2
X-Clip?經導管二尖瓣緣對緣修復系統
手術在全身麻醉、氣管插管的條件下在雜交手術室進行。在TEE引導下進行(圖1),經右股靜脈穿刺房間隔(房間隔穿刺點平面距二尖瓣瓣環平面的高度>4.0 cm),植入25F引導鞘于左心房,通過引導鞘將X-Clip?二尖瓣夾輸送系統送入左心房,通過調彎鞘,使得二尖瓣夾到達二尖瓣反流處,夾子彈道垂直于瓣環,夾臂垂直于對合緣,定位準確后進行精準夾合A2/P2,成功植入二尖瓣夾1枚(夾臂寬6 mm,臂長12 mm型號),撤出引導鞘及輸送系統。術后即刻超聲提示:夾合器位置正確,二尖瓣有效瓣口面積2.0 cm2,跨瓣最大壓差4 mm Hg(1 mm Hg=0.133 kPa),平均壓差2 mm Hg,二尖瓣反流從大量減少至微量。患者麻醉管理采用快通道模式,術后拔管轉入普通病房,患者術后恢復良好,病情改善,未出現手術相關并發癥(包括血管并發癥、心衰及其他器官相關嚴重并發癥),術后5 d出院。出院時,經胸超聲心動圖證實了二尖瓣夾位置穩定,二尖瓣微量反流。
1個月隨訪提示,患者感心衰癥狀較前緩解,NYHA 心功能Ⅱ級,堪薩斯城心肌病質量問卷(KCCQ)評分提高了19分(術前67.27分,術后1月86.36分),6分鐘步行距離增加了103 m(術前287 m,術后390 m)。經胸超聲心動圖復查顯示微量二尖瓣反流(1+)(圖1)。
討論 隨著TEER技術的成熟和廣泛應用,其逐漸成為目前治療中重度MR常用的技術。對于重度FMR,最新的歐洲指南將TEER推薦級別升級為Ⅱa 類,我國專家結合國外研究進展和我國國情,建議FMR行TEER的患者需滿足經優化GDMT或心臟再同步化治療(cardiac resynchronization therapy,CRT)等器械輔助治療仍有心衰癥狀(NYHA心功能Ⅲ/Ⅳ級)[3]。在考慮介入治療之前,優化GDMT治療非常關鍵,FMR患者推薦盡早啟動心衰四聯療法,包括血管緊張素轉換酶抑制劑(ACEI)/血管緊張素受體阻斷劑(ARB)/血管緊張素受體-腦啡肽酶抑制劑(ARNI)、β受體阻滯劑、醛固酮受體拮抗劑(MRA)和鈉-葡萄糖協同轉運體2抑制劑(SGLT2is)。在啟動四聯療法后,根據患者的基礎疾病、血壓、心率/心律、腎功能和血鉀來調整新四聯藥物的滴定,每1~2周考慮一次GDMT的滴定和優化,藥物劑量逐漸增加到可耐受的目標劑量,以達到最佳的個體化治療。經優化的GDMT治療下,患者達到目標血壓和心率的控制并穩定30 d以上,若仍表現為中重度的MR,且有心衰癥狀,才考慮行TEER。本研究參考相關指南和共識,患者經優化的GDMT治療30 d以上(包括使用了最新指南推薦的ARNI及SGLT-2i抗心衰藥物)仍有心衰癥狀,經評估滿足TEER適應證,遂接受了TEER介入治療。
近年來,國外專家提出了TEER治療的“綠區-黃區-紅區”概念,其中綠區病變即為符合EVEREST Ⅱ和COAPT研究入選標準的簡單病變,即無鈣化、裂隙、寬的反流束、及較小的二尖瓣解剖瓣口面積;黃區病變為超越指南推薦標準的復雜病變,其在病變區域、瓣口面積、后葉長度、對合高度、脫垂范圍等方面的解剖特點增加了TEER的難度,使其頗具挑戰性[10]。而隨著TEER技術的成熟和國產創新TEER器械的研發,TEER適應證拓展到有解剖限制的人群將成為未來的發展趨勢。不同于目前常用的機械鎖定Mitraclip,健心醫療X-Clip?的夾子采用彈性自鎖的設計,通過改進,平衡了彈性自鎖定力不足的問題,在降低瓣葉應力從而保護瓣葉的前提下,達到了更好的力學閉合作用。同時,依托超聲引導技術體系,改進器械設計提供了一種簡化的、直觀的操控導引系統(輸送系統及夾子操控系統均帶有指示標尺),該裝置提供4種不同的尺寸,臂寬和臂長不同,其較大的臂展寬度有助于捕獲返流口較大的瓣葉,彈性夾的設計在保證抓取力的同時,可有效降低瓣葉損傷的風險和操作難度。因此,與經典的PASCAL系統相比,其輸送系統操作更加靈活,各組件具有獨特設計的刻度標識,便于TEE引導下的準確定位,彈性自鎖夾合器流線型設計,減少瓣葉應力的同時抓取力更強。從而實現對復雜的二尖瓣解剖結構的修復治療,以達到預期療效。當然,我們需要更多的病例實踐和研究數據來進一步評估其可行性、安全性和與其他器械裝置的療效比較,并確定其對遠期臨床預后的影響。
該病例報告展示了健心醫療X-Clip?經導管二尖瓣夾系統及可操控導引系統首次用于FMR患者的短期效果和短期隨訪結果。相關前瞻性臨床試驗正在進行中。
利益沖突:無。
作者貢獻:戴佳祁負責病歷數據收集和文章撰寫;朱達負責數據整理和文章修改;王首正、朱達負責手術操作;潘湘斌負責選題與設計,文章審閱。
二尖瓣反流(mitral regurgitation,MR)是最為常見的心臟瓣膜病[1],按發生機制可分為原發性(退行性)二尖瓣反流(degenerative mitral regurgitation,DMR)和繼發性(功能性)二尖瓣反流(functional mitral regurgitation,FMR)。盡管外科手術是除藥物治療外的主要治療方式,然而對于不適合外科手術的患者,經導管二尖瓣緣對緣修復術(transcatheter edge?to?edge repair,TEER)逐漸成為了一種新的治療選擇。根據最新的歐美指南和我國的專家共識[2-3],對于外科手術風險高或存在禁忌證的原發性MR可考慮行TEER(Ⅱa類推薦),而對于重度繼發性MR患者,若無需血運重建、外科修復或置換手術風險較高、藥物和器械治療對癥狀無改善,TEER推薦級別也高達Ⅱa 類。目前國外已獲批的TEER器械包括MitraClip (雅培公司,美國)和PASCAL經導管修復系統(Edwards Lifesciences,美國),兩款器械瓣膜設計上有較大差異,核心鎖定方式也不相同,但在臨床研究中均展現出良好的安全性和療效[4-9]。進口器械價格昂貴,近年來,我國自主研發的新型TEER系統陸續獲得了NMPA批準開展臨床試驗。在本研究中,我們報告全新設計的X-Clip?經導管瓣膜修復裝置首次人體植入并分享其設計及應用經驗。
臨床資料 患者,男,60歲,因反復活動后胸悶、氣促10年入院,既往診斷擴張型心肌病、二尖瓣關閉不全。入院時患者紐約心臟學會(New York Heart Association,NYHA)心功能Ⅲ級,患者由于擴張性心肌病,長期規范服用藥物治療(ARNI、β受體阻滯劑、醛固酮受體拮抗劑、SGLT-2i、利尿劑),但在經指南指導下藥物治療(guideline-directed medical therapy,GDMT)達到最大耐受劑量(血壓、心率)后仍反復出現胸悶、氣促、呼吸困難、心悸等心衰癥狀,評估冠脈無明顯病變。既往史包括腔隙性腦梗死、肺氣腫和外周動脈粥樣硬化。經胸超聲心動圖提示全心增大,二尖瓣對合錯位,二尖瓣大量反流(4+),左室舒張末期內徑74 mm,射血分數30%。經食管超聲心動圖(transesophageal echocardiography,TEE)提示二尖瓣前葉長度34 mm,后葉長度32 mm,對合深度9 mm,對合緣2.6 mm,二尖瓣口最大開放面積約5.4 cm2,射流緊縮口寬度(VC)7 mm×11 mm,有效反流口面積(EROA)0.47 cm2,反流容積371.4 mL(圖1)。經心臟團隊評估,其解剖結構適合行TEER且適合使用試驗用醫療器械,經過倫理委員會批準及患者知情同意后,擬采用X-Clip?裝置(深圳健心醫療)對患者行經皮修復術。
 圖1
患者術前、術中和術后經胸/食管超聲心動圖
圖1
患者術前、術中和術后經胸/食管超聲心動圖
a:術前TTE二尖瓣反流;b~c:術前TEE二尖瓣重度反流;d~f:術中TEE引導二尖瓣夾準確植入A2/P2區;g~h:瓣膜夾植入后二尖瓣反流消失;i:1個月隨訪二尖瓣無反流
X-Clip?系統是我國自主研發的一種新型經導管二尖瓣緣對緣修復系統(圖2),其采用經典的三層輸送系統設計,其核心設計特點體現在:(1)夾合器具有彈性自適應特點,可緩解瓣葉夾合后的張力,降低瓣葉損傷風險,同時經過對彈性夾和器械材料及設計的改進,做到更大且更穩定的閉合力;(2)輸送系統及夾合器操控系統具有前進、后退標尺,以及打開、關閉角度的操作指示標尺,使得該器械可以進行不依賴射線的純超聲引導手術;(3)夾合器型號豐富,設計兩個寬度6 mm/8 mm及兩個臂長10 mm/12 mm參數的4個型號,以適合各種不同類型解剖條件,尤其有利于捕獲返流口較大,脫垂面積較寬的復雜病變;(4)夾合器具有單獨捕獲瓣葉的功能,及穩定的多向調彎功能,做到精準的瓣葉捕獲及釋放,具備第四代經導管二尖瓣緣對緣修復器械的特點。
 圖2
X-Clip?經導管二尖瓣緣對緣修復系統
圖2
X-Clip?經導管二尖瓣緣對緣修復系統
手術在全身麻醉、氣管插管的條件下在雜交手術室進行。在TEE引導下進行(圖1),經右股靜脈穿刺房間隔(房間隔穿刺點平面距二尖瓣瓣環平面的高度>4.0 cm),植入25F引導鞘于左心房,通過引導鞘將X-Clip?二尖瓣夾輸送系統送入左心房,通過調彎鞘,使得二尖瓣夾到達二尖瓣反流處,夾子彈道垂直于瓣環,夾臂垂直于對合緣,定位準確后進行精準夾合A2/P2,成功植入二尖瓣夾1枚(夾臂寬6 mm,臂長12 mm型號),撤出引導鞘及輸送系統。術后即刻超聲提示:夾合器位置正確,二尖瓣有效瓣口面積2.0 cm2,跨瓣最大壓差4 mm Hg(1 mm Hg=0.133 kPa),平均壓差2 mm Hg,二尖瓣反流從大量減少至微量。患者麻醉管理采用快通道模式,術后拔管轉入普通病房,患者術后恢復良好,病情改善,未出現手術相關并發癥(包括血管并發癥、心衰及其他器官相關嚴重并發癥),術后5 d出院。出院時,經胸超聲心動圖證實了二尖瓣夾位置穩定,二尖瓣微量反流。
1個月隨訪提示,患者感心衰癥狀較前緩解,NYHA 心功能Ⅱ級,堪薩斯城心肌病質量問卷(KCCQ)評分提高了19分(術前67.27分,術后1月86.36分),6分鐘步行距離增加了103 m(術前287 m,術后390 m)。經胸超聲心動圖復查顯示微量二尖瓣反流(1+)(圖1)。
討論 隨著TEER技術的成熟和廣泛應用,其逐漸成為目前治療中重度MR常用的技術。對于重度FMR,最新的歐洲指南將TEER推薦級別升級為Ⅱa 類,我國專家結合國外研究進展和我國國情,建議FMR行TEER的患者需滿足經優化GDMT或心臟再同步化治療(cardiac resynchronization therapy,CRT)等器械輔助治療仍有心衰癥狀(NYHA心功能Ⅲ/Ⅳ級)[3]。在考慮介入治療之前,優化GDMT治療非常關鍵,FMR患者推薦盡早啟動心衰四聯療法,包括血管緊張素轉換酶抑制劑(ACEI)/血管緊張素受體阻斷劑(ARB)/血管緊張素受體-腦啡肽酶抑制劑(ARNI)、β受體阻滯劑、醛固酮受體拮抗劑(MRA)和鈉-葡萄糖協同轉運體2抑制劑(SGLT2is)。在啟動四聯療法后,根據患者的基礎疾病、血壓、心率/心律、腎功能和血鉀來調整新四聯藥物的滴定,每1~2周考慮一次GDMT的滴定和優化,藥物劑量逐漸增加到可耐受的目標劑量,以達到最佳的個體化治療。經優化的GDMT治療下,患者達到目標血壓和心率的控制并穩定30 d以上,若仍表現為中重度的MR,且有心衰癥狀,才考慮行TEER。本研究參考相關指南和共識,患者經優化的GDMT治療30 d以上(包括使用了最新指南推薦的ARNI及SGLT-2i抗心衰藥物)仍有心衰癥狀,經評估滿足TEER適應證,遂接受了TEER介入治療。
近年來,國外專家提出了TEER治療的“綠區-黃區-紅區”概念,其中綠區病變即為符合EVEREST Ⅱ和COAPT研究入選標準的簡單病變,即無鈣化、裂隙、寬的反流束、及較小的二尖瓣解剖瓣口面積;黃區病變為超越指南推薦標準的復雜病變,其在病變區域、瓣口面積、后葉長度、對合高度、脫垂范圍等方面的解剖特點增加了TEER的難度,使其頗具挑戰性[10]。而隨著TEER技術的成熟和國產創新TEER器械的研發,TEER適應證拓展到有解剖限制的人群將成為未來的發展趨勢。不同于目前常用的機械鎖定Mitraclip,健心醫療X-Clip?的夾子采用彈性自鎖的設計,通過改進,平衡了彈性自鎖定力不足的問題,在降低瓣葉應力從而保護瓣葉的前提下,達到了更好的力學閉合作用。同時,依托超聲引導技術體系,改進器械設計提供了一種簡化的、直觀的操控導引系統(輸送系統及夾子操控系統均帶有指示標尺),該裝置提供4種不同的尺寸,臂寬和臂長不同,其較大的臂展寬度有助于捕獲返流口較大的瓣葉,彈性夾的設計在保證抓取力的同時,可有效降低瓣葉損傷的風險和操作難度。因此,與經典的PASCAL系統相比,其輸送系統操作更加靈活,各組件具有獨特設計的刻度標識,便于TEE引導下的準確定位,彈性自鎖夾合器流線型設計,減少瓣葉應力的同時抓取力更強。從而實現對復雜的二尖瓣解剖結構的修復治療,以達到預期療效。當然,我們需要更多的病例實踐和研究數據來進一步評估其可行性、安全性和與其他器械裝置的療效比較,并確定其對遠期臨床預后的影響。
該病例報告展示了健心醫療X-Clip?經導管二尖瓣夾系統及可操控導引系統首次用于FMR患者的短期效果和短期隨訪結果。相關前瞻性臨床試驗正在進行中。
利益沖突:無。
作者貢獻:戴佳祁負責病歷數據收集和文章撰寫;朱達負責數據整理和文章修改;王首正、朱達負責手術操作;潘湘斌負責選題與設計,文章審閱。