感染性心內膜炎(infectious endocarditis,IE)是臨床上相對少見的心臟疾病,總發病率相對較低,約為5/10萬[1]。但IE是一種非常嚴重的疾病,盡管在診斷和治療方面取得了進展,住院死亡率仍高達15%~30%[2]。針對IE的治療主要包括積極的藥物治療和早期手術治療[3-5]。Meta分析[6-7]結果提示,早期手術可顯著降低感染性心內膜炎患者的死亡風險,國際指南[8]推薦感染性心內膜炎出現難治性感染、耐藥菌感染、大的贅生物、反復栓塞、瓣膜毀損引起心力衰竭等情況時應盡早手術,并根據患者情況制定個性化手術方案,但尚無具體手術方式推薦。因此,目前IE的手術方式大多依照其他瓣膜病(如風濕性/退行性瓣膜病)的標準進行選擇。國外多項回顧性研究[9-11]顯示,與瓣膜置換相比,瓣膜成形可為IE患者帶來更好的預后。與以上這些針對某個瓣膜手術(如二尖瓣)的IE研究不同,梅奧診所一項包含各個瓣膜手術的IE研究[12]顯示,機械瓣膜與最佳的長期生存率相關。此外,IE術后死亡率較高,缺乏有效的術前預測模型。國內IE外科治療相關研究較少,從現有的資料可知,國內心臟外科醫生對IE導致瓣膜毀損的成形比較排斥,瓣膜成形率遠低于國外[13]。本研究對接受手術治療的IE患者進行最長達12年的隨訪,探索了術后早期和遠期預后的影響因素并比較不同手術方式的臨床療效。
1 資料與方法
1.1 臨床資料
回顧性納入2010—2022年在北京安貞醫院瓣膜心臟外科行心臟瓣膜手術的IE患者。納入標準:(1)年齡18~65歲;(2)明確診斷IE并行瓣膜置換術和/或瓣膜成形術患者。排除標準:接受肋間小切口、胸腔鏡、手術機器人等非傳統正中開胸術式。所有患者手術均在全身麻醉低溫體外循環下進行,遵循IE手術的一般原則,包括盡量完全切除感染組織和適當的清創以及之后的重建或置換。IE的診斷依照最新Duke診斷標準,超聲心動圖評價瓣膜毀損及贅生物情況,瓣結構毀損情況包括斷裂、穿孔、攣縮、脫垂、膿腫、竇道和贅生物附著。
1.2 資料收集和隨訪
回顧性收集患者的臨床特征、檢查結果、手術及圍手術期情況、隨訪結果資料。隨訪采用電話、門診復診等方式。主要終點為死亡,次要終點為復合終點事件,包括死亡、腦卒中、感染復發、再手術。
1.3 統計學分析
采用SPSS 25.0軟件進行統計學分析。服從正態分布的計量資料以均數±標準差(x±s)描述,組間比較采用t檢驗;非正態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用非參數檢驗。分類變量以頻數和百分比描述,組間比較采用χ2檢驗。采用logistic回歸分析術后早期死亡的影響因素,采用Cox比例風險模型分析術后遠期死亡的影響因素。將所有與結局變量相關的風險因素納入單因素分析,再將P<0.2的因素納入多因素分析,分析結果以比值比(odds ratio,OR)或風險比(hazard ratio,HR)表示。采用log-rank檢驗比較術后死亡率和復合終點事件發生率,并以生存曲線進行統計描述。P≤0.05為差異有統計學意義。
1.4 倫理審查
本研究已通過首都醫科大學附屬北京安貞醫院醫學倫理委員會審查,編號:KS2022064。
2 結果
2.1 患者一般資料
共納入343例IE患者,其中男238例(69.4%),平均年齡(44.2±14.8)歲。共60例(17.5%)患者術前發生各系統栓塞事件,包括腦、腎、脾、肺栓塞等,其中32例(9.3%)發生腦栓塞。此外,7例患者發生多個系統的多次栓塞事件。239例(69.7%)患者術前長期發熱,合并糖尿病20例(5.8%)、高血壓59例(17.2%)、先天性心臟病80例(23.3%)。26例(7.6%)患者為人工瓣膜IE,手術指征包括難治性感染、耐藥菌感染、大的贅生物、反復栓塞、瓣膜毀損引起心力衰竭等。145例(42.3%)患者術前紐約心臟協會(New York Heart Association,NYHA)心功能分級為Ⅲ~Ⅳ級,143例(41.7%)患者≥2個瓣膜受累,單獨主動脈瓣受累患者76例(22.2%),單獨二尖瓣受累患者108例(31.5%);見表1。
2.2 手術結果
應用最多的瓣膜手術是機械瓣瓣膜置換術(197例,57.4%),另有84例(24.5%)行單純瓣膜成形術,62例(18.1%)行生物瓣瓣膜置換術。65例(19.0%)患者同期行非瓣膜心臟手術。平均隨訪時間為(60.6±43.8)個月,術后8例(2.3%)患者行透析治療,術后1個月內早期死亡17例(5.0%)。
2.2.1 不同瓣膜手術結局比較
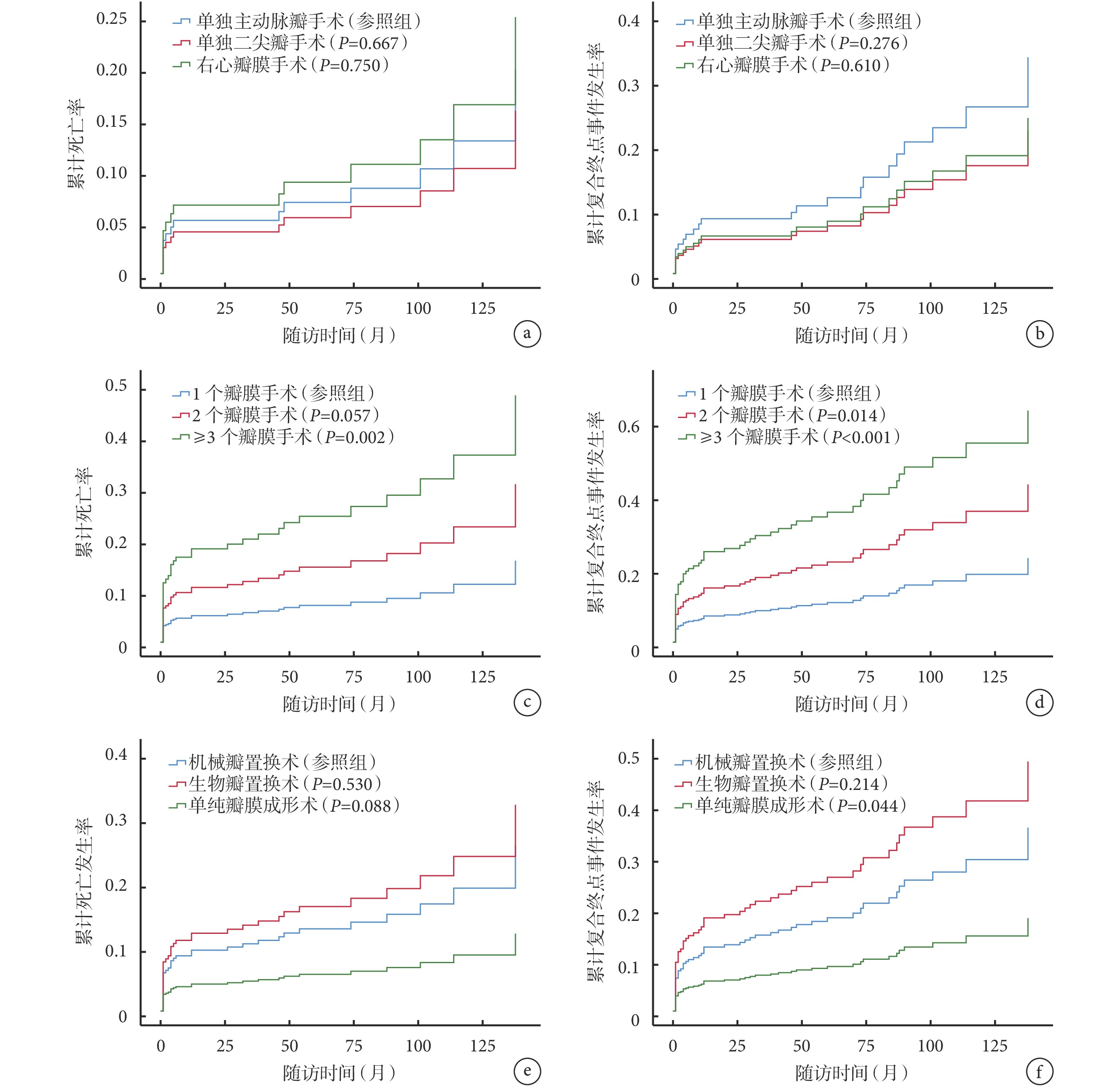
IE可造成心臟任一瓣膜毀損,常累及左心瓣膜即二尖瓣和主動脈瓣,較少累及右心瓣膜即三尖瓣和肺動脈瓣,不同瓣膜毀損術預后差異仍不明確。本研究比較了單純主動脈瓣手術、單純二尖瓣手術和單純右心瓣膜手術的術后累積死亡率和術后復合終點事件發生率,差異無統計學意義(P>0.05);見圖1a~b。
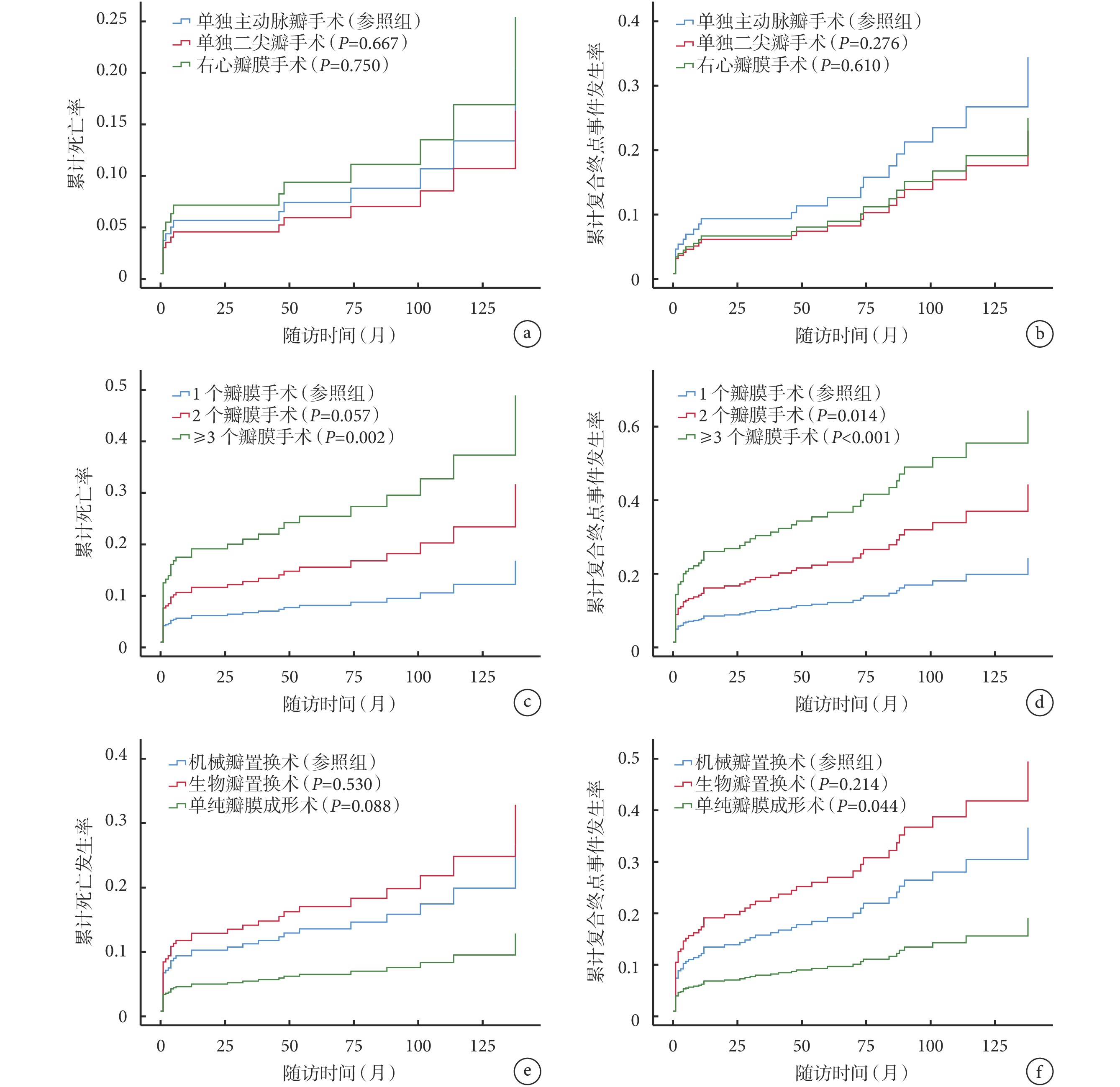 圖1
術后死亡率和復合終點事件發生率
圖1
術后死亡率和復合終點事件發生率
a:不同瓣膜術后累計死亡率;b:不同瓣膜術后累計復合終點事件發生率;c:不同數量瓣膜術后累計死亡率;d:不同數量瓣膜術后累計復合終點事件發生率;e:不同手術方式術后累計死亡發生率;f:不同手術方式術后累計復合終點事件發生率
2.2.2 不同數量瓣膜的手術結局比較
IE往往更容易造成多個瓣膜的毀損,本研究中92例(26.8%)患者接受2個瓣膜的手術,50例(14.6%)患者接受3個瓣膜的手術,還有1例(0.3%)患者接受4個瓣膜的手術。結果顯示多瓣膜手術的術后累積死亡率和復合終點事件發生率明顯升高,且差異有統計學意義(P<0.05);見圖1c~d。
2.2.3 不同瓣膜手術方式結局比較
343例患者中,197例(57.4%)患者使用了人工機械瓣膜,62例(18.1%)患者使用人工生物瓣膜,其余84例(24.5%)患者行單純瓣膜成形術,未使用任何人工瓣膜。結果顯示人工生物瓣膜置換術患者的累積死亡率最高,瓣膜成形術患者的累積死亡率最低,但差異無統計學意義;見圖1e。人工生物瓣膜置換術患者的復合終點事件發生率最高,瓣膜成形術患者的復合終點事件發生率最低,差異有統計學意義(P=0.044);見圖1f。
2.3 術后早期和遠期預后的影響因素
結合文獻報道與臨床實踐將所有與結局變量相關的風險因素納入單因素分析,然后將P<0.2的因素納入多元logistic回歸方程和Cox比例風險模型進行多因素分析。共線性檢驗顯示方差膨脹因子<5,提示變量間不存在嚴重共線性。Logistic回歸分析顯示,吸煙(P=0.002)、術前栓塞事件(P=0.001)、手術時間(P=0.001)、術后透析(P=0.001)是術后早期死亡的危險因素,左室射血分數(left ventricular ejection fraction,LVEF)≥60%(P=0.022)是術后早期死亡的保護因素;見表2。Cox比例風險模型顯示術前NYHA心功能分級Ⅲ~Ⅳ級(HR=2.391,P=0.010)、≥3個瓣膜手術(HR=4.019,P=0.028)是術后遠期死亡的顯著危險因素;見表3。
3 討論
IE是一種瓣膜或非瓣膜內皮、心內人工材料的微生物感染,IE的典型病變是心內贅生物,由纖維蛋白和血小板組成,細菌和/或真菌病原體在其中增殖。此外,往往還伴有瓣膜的嚴重毀損[14]。因此,IE的外科治療主要是圍繞瓣膜的手術干預,目前為止,IE的診斷和管理仍然存在一些挑戰,總體來看IE的預后較差。盡管指南中IE手術的適應證似乎很清楚,但大部分外科醫生對于IE的手術時機把握不好,臨床醫生只能依照其他瓣膜病(如風濕性/退行性瓣膜病)的標準對患者進行管理。顯然,IE有其獨特的發病機制和病理進展,其治療方式應區別于其他瓣膜疾病,包括外科手術的時機和方式。亟待IE相關臨床研究為IE的外科治療提供經驗和指導。
本研究通過對單中心接受手術的IE患者進行遠期隨訪發現:吸煙、LVEF≥60%、術前栓塞事件、手術時間、術后透析是術后早期死亡的影響因素,其中LVEF≥60%是保護因素,然而在同一模型中合并糖尿病、高血壓以及既往心臟手術都未對術后早期死亡產生影響。盡管術前反復栓塞是IE的手術適應證,但它也同時預示著較差的術后早期結果。因此,外科醫生應該靈活把握IE的手術指征,不應等到出現危及生命的并發癥才考慮手術治療,在IE整個進展過程中都應該考慮外科干預的可能,早期外科干預可為患者帶來更佳的預后[15]。
Cox回歸分析顯示術前心功能差(NYHA心功能分級Ⅲ~Ⅳ級)和多個瓣膜手術是術后遠期死亡的顯著影響因素。不同于其他瓣膜疾病,IE可能在短時間內造成廣泛的瓣膜破壞,從而導致心功能的急劇下降。本研究表明IE術前廣泛瓣膜毀損特征與較差的術后遠期預后顯著相關,對手術瓣膜數量進行比較的結果顯示,手術瓣膜數量與術后死亡率和復合終點事件發生率呈正相關。推測多瓣膜手術較差預后與其不可逆的嚴重心功能損傷和心臟重構相關,即使不同數量瓣膜組術前心臟泵血功能還未顯現出差異或表現為同等程度的心力衰竭,但是多瓣膜毀損的患者心臟重構更加嚴重,而這種心臟重構與術后心力衰竭的發生和遠期預后相關[16]。然而指南中的手術指征和手術時機均未提及IE多瓣膜毀損情況。本研究認為IE多瓣膜毀損患者是風險更高的人群,對于這類人群需要更加密切的隨訪監測以及更早的外科干預,IE患者不存在指南中的手術指征時應該考慮將多瓣膜的廣泛受累作為手術干預的提示指征。
IE可以累及心臟的任一瓣膜,但是較常累及左心脈瓣膜,較少累及右心瓣膜。本研究探討了手術干預不同瓣膜的術后預后差異,結果顯示術后累積死亡率和術后復合終點事件發生率差異無統計學意義。
IE常因瓣膜毀損嚴重而無法進行瓣膜成形,這更增加了外科醫生對IE行瓣膜成形的排斥。IE成形率最高的瓣膜是二尖瓣,國外文獻[17-18]報道IE患者二尖瓣成形的比例高達50%~80%。本中心的IE二尖瓣成形率為46.7%,總成形率為24.5%,由于本中心較早開展瓣膜成形術,故接近國外IE成形率。但是國內瓣膜手術方式對IE患者術后預后影響的研究較少,本研究旨在探究人工瓣膜對于IE患者術后的影響,包括術后生存率、栓塞性腦卒中、IE復發等。因此,在總體人群中(包括各個瓣膜的手術)比較了機械瓣瓣膜置換術、生物瓣瓣膜置換術和瓣膜成形術的預后,結果表明人工生物瓣膜置換術后患者的復合終點事件發生率最高,而瓣膜成形術后患者的復合終點事件發生率最低,更有優勢,應積極推廣瓣膜成形技術在IE患者中的應用。
本研究結果提示IE多瓣膜毀損患者是風險更高的人群,對于這類人群需要更加密切的隨訪監測以及更早的外科干預,瓣膜成形比瓣膜置換更有優勢,在IE患者的外科治療中應積極嘗試瓣膜成形術。
利益沖突:無。
作者貢獻:趙雙雷負責數據收集、處理,論文撰寫;劉周負責數據收集、處理;溫明修、李前賢、胡熠負責數據收集;王賓、孫兆慶負責統計學指導;姜文劍、韓杰、王堅剛、貢鳴負責研究指導,論文修改。
感染性心內膜炎(infectious endocarditis,IE)是臨床上相對少見的心臟疾病,總發病率相對較低,約為5/10萬[1]。但IE是一種非常嚴重的疾病,盡管在診斷和治療方面取得了進展,住院死亡率仍高達15%~30%[2]。針對IE的治療主要包括積極的藥物治療和早期手術治療[3-5]。Meta分析[6-7]結果提示,早期手術可顯著降低感染性心內膜炎患者的死亡風險,國際指南[8]推薦感染性心內膜炎出現難治性感染、耐藥菌感染、大的贅生物、反復栓塞、瓣膜毀損引起心力衰竭等情況時應盡早手術,并根據患者情況制定個性化手術方案,但尚無具體手術方式推薦。因此,目前IE的手術方式大多依照其他瓣膜病(如風濕性/退行性瓣膜病)的標準進行選擇。國外多項回顧性研究[9-11]顯示,與瓣膜置換相比,瓣膜成形可為IE患者帶來更好的預后。與以上這些針對某個瓣膜手術(如二尖瓣)的IE研究不同,梅奧診所一項包含各個瓣膜手術的IE研究[12]顯示,機械瓣膜與最佳的長期生存率相關。此外,IE術后死亡率較高,缺乏有效的術前預測模型。國內IE外科治療相關研究較少,從現有的資料可知,國內心臟外科醫生對IE導致瓣膜毀損的成形比較排斥,瓣膜成形率遠低于國外[13]。本研究對接受手術治療的IE患者進行最長達12年的隨訪,探索了術后早期和遠期預后的影響因素并比較不同手術方式的臨床療效。
1 資料與方法
1.1 臨床資料
回顧性納入2010—2022年在北京安貞醫院瓣膜心臟外科行心臟瓣膜手術的IE患者。納入標準:(1)年齡18~65歲;(2)明確診斷IE并行瓣膜置換術和/或瓣膜成形術患者。排除標準:接受肋間小切口、胸腔鏡、手術機器人等非傳統正中開胸術式。所有患者手術均在全身麻醉低溫體外循環下進行,遵循IE手術的一般原則,包括盡量完全切除感染組織和適當的清創以及之后的重建或置換。IE的診斷依照最新Duke診斷標準,超聲心動圖評價瓣膜毀損及贅生物情況,瓣結構毀損情況包括斷裂、穿孔、攣縮、脫垂、膿腫、竇道和贅生物附著。
1.2 資料收集和隨訪
回顧性收集患者的臨床特征、檢查結果、手術及圍手術期情況、隨訪結果資料。隨訪采用電話、門診復診等方式。主要終點為死亡,次要終點為復合終點事件,包括死亡、腦卒中、感染復發、再手術。
1.3 統計學分析
采用SPSS 25.0軟件進行統計學分析。服從正態分布的計量資料以均數±標準差(x±s)描述,組間比較采用t檢驗;非正態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用非參數檢驗。分類變量以頻數和百分比描述,組間比較采用χ2檢驗。采用logistic回歸分析術后早期死亡的影響因素,采用Cox比例風險模型分析術后遠期死亡的影響因素。將所有與結局變量相關的風險因素納入單因素分析,再將P<0.2的因素納入多因素分析,分析結果以比值比(odds ratio,OR)或風險比(hazard ratio,HR)表示。采用log-rank檢驗比較術后死亡率和復合終點事件發生率,并以生存曲線進行統計描述。P≤0.05為差異有統計學意義。
1.4 倫理審查
本研究已通過首都醫科大學附屬北京安貞醫院醫學倫理委員會審查,編號:KS2022064。
2 結果
2.1 患者一般資料
共納入343例IE患者,其中男238例(69.4%),平均年齡(44.2±14.8)歲。共60例(17.5%)患者術前發生各系統栓塞事件,包括腦、腎、脾、肺栓塞等,其中32例(9.3%)發生腦栓塞。此外,7例患者發生多個系統的多次栓塞事件。239例(69.7%)患者術前長期發熱,合并糖尿病20例(5.8%)、高血壓59例(17.2%)、先天性心臟病80例(23.3%)。26例(7.6%)患者為人工瓣膜IE,手術指征包括難治性感染、耐藥菌感染、大的贅生物、反復栓塞、瓣膜毀損引起心力衰竭等。145例(42.3%)患者術前紐約心臟協會(New York Heart Association,NYHA)心功能分級為Ⅲ~Ⅳ級,143例(41.7%)患者≥2個瓣膜受累,單獨主動脈瓣受累患者76例(22.2%),單獨二尖瓣受累患者108例(31.5%);見表1。
2.2 手術結果
應用最多的瓣膜手術是機械瓣瓣膜置換術(197例,57.4%),另有84例(24.5%)行單純瓣膜成形術,62例(18.1%)行生物瓣瓣膜置換術。65例(19.0%)患者同期行非瓣膜心臟手術。平均隨訪時間為(60.6±43.8)個月,術后8例(2.3%)患者行透析治療,術后1個月內早期死亡17例(5.0%)。
2.2.1 不同瓣膜手術結局比較
IE可造成心臟任一瓣膜毀損,常累及左心瓣膜即二尖瓣和主動脈瓣,較少累及右心瓣膜即三尖瓣和肺動脈瓣,不同瓣膜毀損術預后差異仍不明確。本研究比較了單純主動脈瓣手術、單純二尖瓣手術和單純右心瓣膜手術的術后累積死亡率和術后復合終點事件發生率,差異無統計學意義(P>0.05);見圖1a~b。
 圖1
術后死亡率和復合終點事件發生率
圖1
術后死亡率和復合終點事件發生率
a:不同瓣膜術后累計死亡率;b:不同瓣膜術后累計復合終點事件發生率;c:不同數量瓣膜術后累計死亡率;d:不同數量瓣膜術后累計復合終點事件發生率;e:不同手術方式術后累計死亡發生率;f:不同手術方式術后累計復合終點事件發生率
2.2.2 不同數量瓣膜的手術結局比較
IE往往更容易造成多個瓣膜的毀損,本研究中92例(26.8%)患者接受2個瓣膜的手術,50例(14.6%)患者接受3個瓣膜的手術,還有1例(0.3%)患者接受4個瓣膜的手術。結果顯示多瓣膜手術的術后累積死亡率和復合終點事件發生率明顯升高,且差異有統計學意義(P<0.05);見圖1c~d。
2.2.3 不同瓣膜手術方式結局比較
343例患者中,197例(57.4%)患者使用了人工機械瓣膜,62例(18.1%)患者使用人工生物瓣膜,其余84例(24.5%)患者行單純瓣膜成形術,未使用任何人工瓣膜。結果顯示人工生物瓣膜置換術患者的累積死亡率最高,瓣膜成形術患者的累積死亡率最低,但差異無統計學意義;見圖1e。人工生物瓣膜置換術患者的復合終點事件發生率最高,瓣膜成形術患者的復合終點事件發生率最低,差異有統計學意義(P=0.044);見圖1f。
2.3 術后早期和遠期預后的影響因素
結合文獻報道與臨床實踐將所有與結局變量相關的風險因素納入單因素分析,然后將P<0.2的因素納入多元logistic回歸方程和Cox比例風險模型進行多因素分析。共線性檢驗顯示方差膨脹因子<5,提示變量間不存在嚴重共線性。Logistic回歸分析顯示,吸煙(P=0.002)、術前栓塞事件(P=0.001)、手術時間(P=0.001)、術后透析(P=0.001)是術后早期死亡的危險因素,左室射血分數(left ventricular ejection fraction,LVEF)≥60%(P=0.022)是術后早期死亡的保護因素;見表2。Cox比例風險模型顯示術前NYHA心功能分級Ⅲ~Ⅳ級(HR=2.391,P=0.010)、≥3個瓣膜手術(HR=4.019,P=0.028)是術后遠期死亡的顯著危險因素;見表3。
3 討論
IE是一種瓣膜或非瓣膜內皮、心內人工材料的微生物感染,IE的典型病變是心內贅生物,由纖維蛋白和血小板組成,細菌和/或真菌病原體在其中增殖。此外,往往還伴有瓣膜的嚴重毀損[14]。因此,IE的外科治療主要是圍繞瓣膜的手術干預,目前為止,IE的診斷和管理仍然存在一些挑戰,總體來看IE的預后較差。盡管指南中IE手術的適應證似乎很清楚,但大部分外科醫生對于IE的手術時機把握不好,臨床醫生只能依照其他瓣膜病(如風濕性/退行性瓣膜病)的標準對患者進行管理。顯然,IE有其獨特的發病機制和病理進展,其治療方式應區別于其他瓣膜疾病,包括外科手術的時機和方式。亟待IE相關臨床研究為IE的外科治療提供經驗和指導。
本研究通過對單中心接受手術的IE患者進行遠期隨訪發現:吸煙、LVEF≥60%、術前栓塞事件、手術時間、術后透析是術后早期死亡的影響因素,其中LVEF≥60%是保護因素,然而在同一模型中合并糖尿病、高血壓以及既往心臟手術都未對術后早期死亡產生影響。盡管術前反復栓塞是IE的手術適應證,但它也同時預示著較差的術后早期結果。因此,外科醫生應該靈活把握IE的手術指征,不應等到出現危及生命的并發癥才考慮手術治療,在IE整個進展過程中都應該考慮外科干預的可能,早期外科干預可為患者帶來更佳的預后[15]。
Cox回歸分析顯示術前心功能差(NYHA心功能分級Ⅲ~Ⅳ級)和多個瓣膜手術是術后遠期死亡的顯著影響因素。不同于其他瓣膜疾病,IE可能在短時間內造成廣泛的瓣膜破壞,從而導致心功能的急劇下降。本研究表明IE術前廣泛瓣膜毀損特征與較差的術后遠期預后顯著相關,對手術瓣膜數量進行比較的結果顯示,手術瓣膜數量與術后死亡率和復合終點事件發生率呈正相關。推測多瓣膜手術較差預后與其不可逆的嚴重心功能損傷和心臟重構相關,即使不同數量瓣膜組術前心臟泵血功能還未顯現出差異或表現為同等程度的心力衰竭,但是多瓣膜毀損的患者心臟重構更加嚴重,而這種心臟重構與術后心力衰竭的發生和遠期預后相關[16]。然而指南中的手術指征和手術時機均未提及IE多瓣膜毀損情況。本研究認為IE多瓣膜毀損患者是風險更高的人群,對于這類人群需要更加密切的隨訪監測以及更早的外科干預,IE患者不存在指南中的手術指征時應該考慮將多瓣膜的廣泛受累作為手術干預的提示指征。
IE可以累及心臟的任一瓣膜,但是較常累及左心脈瓣膜,較少累及右心瓣膜。本研究探討了手術干預不同瓣膜的術后預后差異,結果顯示術后累積死亡率和術后復合終點事件發生率差異無統計學意義。
IE常因瓣膜毀損嚴重而無法進行瓣膜成形,這更增加了外科醫生對IE行瓣膜成形的排斥。IE成形率最高的瓣膜是二尖瓣,國外文獻[17-18]報道IE患者二尖瓣成形的比例高達50%~80%。本中心的IE二尖瓣成形率為46.7%,總成形率為24.5%,由于本中心較早開展瓣膜成形術,故接近國外IE成形率。但是國內瓣膜手術方式對IE患者術后預后影響的研究較少,本研究旨在探究人工瓣膜對于IE患者術后的影響,包括術后生存率、栓塞性腦卒中、IE復發等。因此,在總體人群中(包括各個瓣膜的手術)比較了機械瓣瓣膜置換術、生物瓣瓣膜置換術和瓣膜成形術的預后,結果表明人工生物瓣膜置換術后患者的復合終點事件發生率最高,而瓣膜成形術后患者的復合終點事件發生率最低,更有優勢,應積極推廣瓣膜成形技術在IE患者中的應用。
本研究結果提示IE多瓣膜毀損患者是風險更高的人群,對于這類人群需要更加密切的隨訪監測以及更早的外科干預,瓣膜成形比瓣膜置換更有優勢,在IE患者的外科治療中應積極嘗試瓣膜成形術。
利益沖突:無。
作者貢獻:趙雙雷負責數據收集、處理,論文撰寫;劉周負責數據收集、處理;溫明修、李前賢、胡熠負責數據收集;王賓、孫兆慶負責統計學指導;姜文劍、韓杰、王堅剛、貢鳴負責研究指導,論文修改。