大動脈調轉手術(arterial switch operation,ASO)為治療完全性大動脈轉位合并室間隔完整(D-transposition of the great arteries with intact ventricular septum,D-TGA/IVS)、完全性大動脈轉位合并室間隔缺損(D-transposition of the great arteries with ventricular septal defect,D-TGA/VSD)及右室雙出口合并肺動脈下室間隔缺損(又稱Taussig-Bing畸形)的首選手術方式。通過調換兩大動脈位置和移植冠狀動脈,不僅能從解剖上恢復左心室-主動脈及右心室-肺動脈連接的正常結構,還能從生理上平衡左心系統-體循環及右心系統-肺循環的正常發育,遠期預后令人滿意。ASO手術效果良好,中遠期隨訪患兒生活質量良好,但仍有部分患兒因右心系統梗阻、左心系統梗阻及瓣膜關閉不全等殘余問題接受二次手術干預[1]。本文通過回顧性分析2006年1月—2022年1月于我院實施ASO手術隨訪患兒的臨床資料,探討中遠期殘余的高危因素及再干預策略。
1 資料與方法
1.1 臨床資料
2006年1月—2022年6月共952例復雜先心病患兒于上海兒童醫學中心行ASO。患者納入標準:(1)影像學檢查明確診斷D-TGA/IVS、D-TGA/VSD或Taussig-Bing畸形,且完成Ⅰ期或Ⅱ期ASO者;(2)ASO術后規律隨訪超過1年,因殘余問題行外科再干預者。排除標準:(1)明確診斷糾正型大動脈轉位或房室連接不一致右室雙出口行雙調轉手術者;(2)Ⅰ期行姑息手術后未行Ⅱ期ASO者。
1.2 殘余再干預標準
所有患兒均接受超聲心動圖檢查,殘余再干預標準[2-3]為:(1)右心系統梗阻[流出道、肺動脈總干、分支或過瓣流速>3.5 m/s,壓差>50 mm Hg(1 mm Hg=0.133 kPa)];(2)左心系統梗阻(流出道、主動脈瓣上、弓部或過瓣流速>3 m/s,壓差>36 mm Hg):(3)主動脈瓣中度以上關閉不全伴左心室擴張(主動脈瓣反流束寬>4 mm伴左心室舒張末容積大小Z值>2);(4)三尖瓣中度以上關閉不全(三尖瓣反流束寬>4 mm伴瓣環明顯擴張);(5)室間隔缺損殘余分流>3 mm。28例大血管狹窄患者接受心臟CT檢查,明確主動脈或肺動脈的狹窄程度及部位;5例主動脈瓣中度關閉不全患者完善心臟磁共振成像檢查評估左心室功能(左心室舒張期末容積)。
1.3 統計學分析
采用SPSS 19.0軟件進行統計學分析。正態分布的計量資料以均數±標準差(x±s)描述,非正態分布的計量資料以中位數(范圍)描述,組間比較采用Wilcoxon秩和檢驗或t檢驗;分類資料以例數和百分比描述,組間比較采用χ2檢驗或Fisher確切概率法。采用多元logistic回歸模型進行ASO術后中遠期殘余的獨立危險因素分析。P≤0.05為差異有統計學意義。
1.4 倫理審查
本研究經上海交通大學醫學院附屬上海兒童醫學中心倫理委員會審批,批準號:SCMCIRBY2022059。
2 結果
2.1 大動脈調轉術后結果
共納入952例患者,其中男654例、女298例,平均年齡(102.9±90.1)d,平均體重(4.6±1.6)kg。診斷包括D-TGA/IVS 421例、D-TGA/VSD 357例及Taussig-Bing畸形174例。Ⅰ期ASO 855例,Ⅱ期ASO 97例(Ⅱ期ASO與姑息手術間隔時間為14 d至6個月),術后早期死亡89例,死亡率為9.3%。746例生存患兒術后定期隨訪(術后1、3、6、12個月各隨訪1次,之后每1~2年隨訪1次),隨訪率86.4%。中位隨訪時間79.4(12.0~188.0)個月。
隨訪過程中,53例患兒出現殘余行外科再干預,其中男30例、女23例,中位手術年齡62.5(17.0~214.0)個月,中位手術體重19.0(8.2~86.0)kg,平均再干預時間為ASO術后28.0~170.0(77.5±45.4)個月。
2.2 殘余外科再干預結果
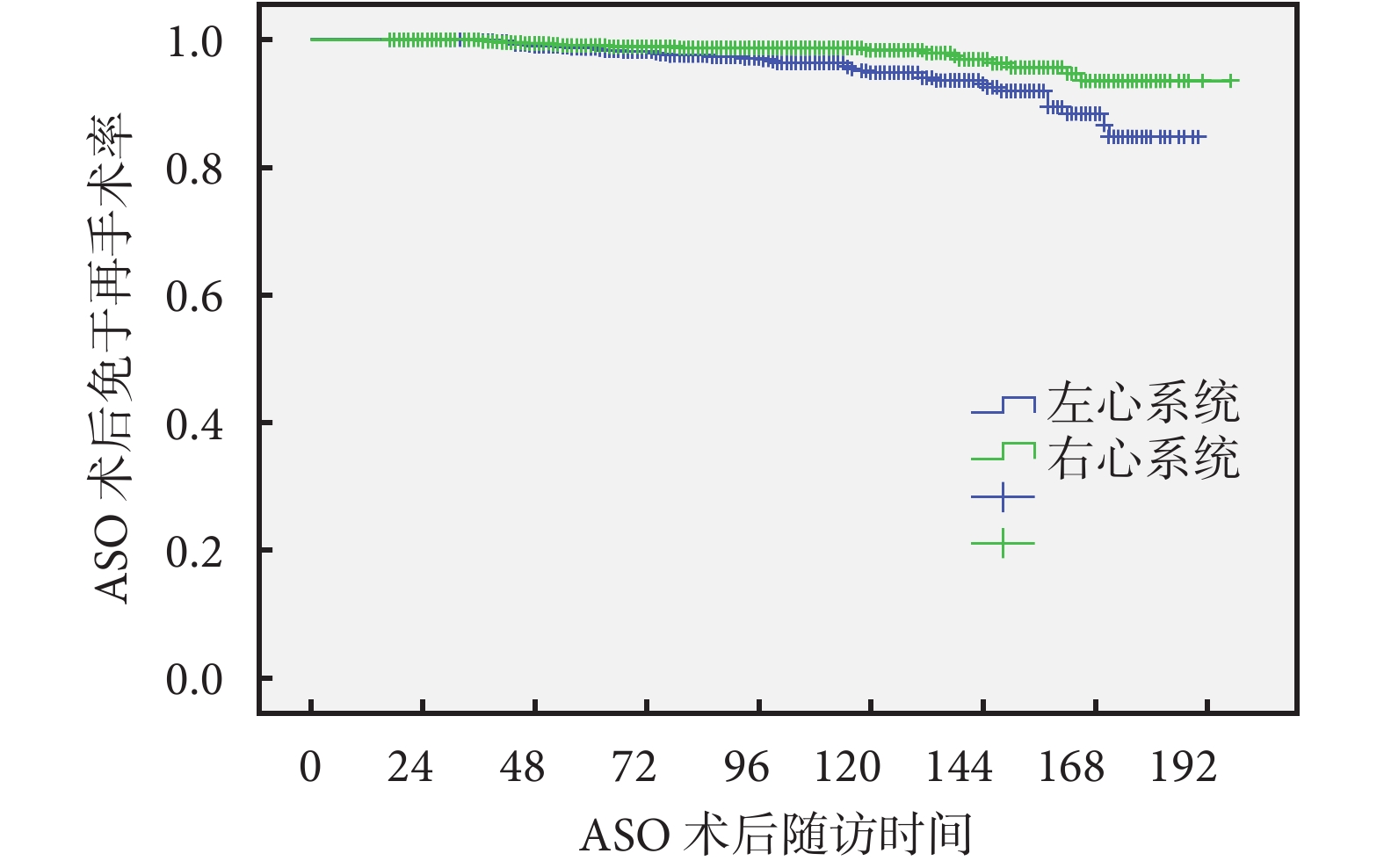
按照不同診斷將952例ASO術后患兒分為D-TGA/IVS組、D-TGA/VSD組及Taussig-Bing組。肺動脈分支狹窄在D-TGA/IVS組發生率明顯高于其他兩組(P=0.022);D-TGA/VSD組右室流出道梗阻(right ventricular outlet tract obstruction,RVOTO)發生率最高(P=0.030);而主動脈弓再狹窄多發生于Taussig-Bing組(P=0.005),其余殘余問題發生率差異無統計學意義(P>0.05);見表1。69.8%(37/53)為右心系統殘余,且術后右心系統再干預時間[(46.5±21.6)個月]明顯早于左心系統[(97.6±47.3)個月];見圖1。
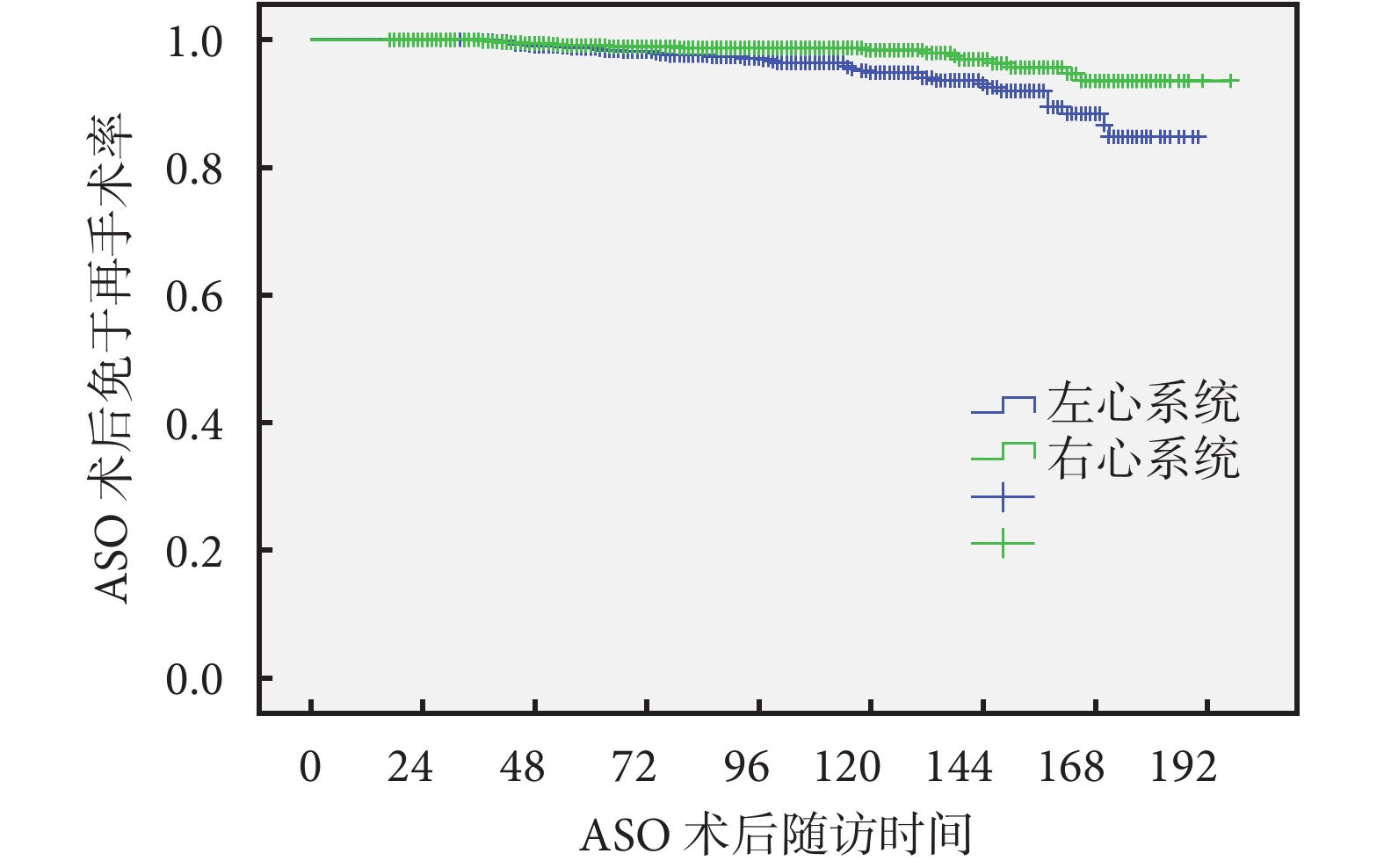 圖1
ASO術后左心及右心系統殘余免于再手術率
圖1
ASO術后左心及右心系統殘余免于再手術率
ASO:大動脈轉位術
53例患兒均于體外循環下行再干預,手術策略包括肺動脈補片擴大術(16例)、右室流出道(right ventricular outlet tract,RVOT)疏通+肺動脈補片擴大術(7例)、升主動脈重建術(6例)、RVOT疏通術(4例)、左室流出道(left ventricular outlet tract,LVOT)疏通術(4例)等。所有患兒平均體外循環時間(176.3±46.5)min,平均主動脈阻斷時間(86.2±36.3)min,其中1例患兒左右肺動脈發育均差(Mcgoon比值1.0,Nakata指數98 mm2/m2),用14號Gore-tex管道連接左右肺動脈至肺門,再用24號Maquet管道連接肺動脈與RVOT,實現RVOT肺動脈全管道化;1例患兒因體外停機困難術中安置體外膜肺氧合輔助循環,于術后5 d順利撤機;術后平均氣管插管時間(52.5±31.6)h,平均監護室滯留時間(7.0±3.2)d,平均住院時間(19.8±10.4)d,術后早期死亡2例(3.8%),1例為Ⅱ期開胸分離縱隔粘連過程中損傷冠狀動脈導致急性心肌梗死,另1例死亡原因為主動脈瓣置換術后急性左心衰竭。早期并發癥包括低心排血量綜合征20例[連續心臟指數<2.5 L/(min·m2)],心律失常5例(3例室上性心動過速,1例交界性異位心動過速,1例Ⅱ度1型房室傳導阻滯),腎功能不全11例[術后持續少尿狀態,尿量<1 mL/(kg·h),乳酸進行性升高],肝功能不全4例(肝轉氨酶升高2倍以上,凝血指標異常)等。
生存患者出院后第1、3、6、12個月常規隨訪,術后1年起每半年至一年隨訪1次,隨訪14.0~166.0(52.4±28.6)個月。隨訪內容包括:超聲心動圖、心電圖及心肺運動試驗等。所有患兒紐約心臟協會心功能分級均為Ⅰ~Ⅱ級,心臟及大血管解剖結構問題均有明顯改善,干預后瓣膜反流程度均保持在中度以內,狹窄處流速較術前明顯降低[LVOT疏通術前后:(2.33±0.30)m/s vs.(3.81±0.51)m/s,RVOT疏通術前后:(1.75±0.58)m/s vs.(3.94±0.79)m/s,P<0.05]。5例心律失常患兒藥物控制良好,心電圖未見明顯異常表現。中期隨訪無死亡病例,2例患兒因殘余行第三次手術,1例患兒因肺動脈分支再狹窄行肺動脈補片擴大術,另1例患兒因肺動脈總干狹窄合并肺動脈瓣關閉不全行Rastelli手術(22號自制Gore-tex帶瓣管道)。
2.3 大動脈轉位術后殘余的危險因素
單因素分析顯示,肺/主動脈瓣環比>1.5、肺動脈環縮術、合并主動脈弓手術、術后早期RVOT流速>3 m/s,術后早期主動脈瓣下狹窄(subaortic stenosis,SAS)流速>2.5 m/s是中遠期殘余的影響因素。將上述因素納入二分類logistic回歸分析,得到回歸方程:Logit P=?2.03+1.70×合并主動脈弓手術+1.49×術后早期RVOT流速>3 m/s。結果提示,合并主動脈弓手術及術后早期RVOT流速>3 m/s是ASO術后中遠期發生殘余的獨立危險因素;見表2。
3 討論
我院于1989年率先在國內開展嬰幼兒ASO外科治療,經過30余年的不斷積累,ASO術后早期死亡率已控制在10%以內,逐漸接近國際先進中心水平[3]。隨著術后隨訪體系的不斷完善,ASO術后中遠期殘余問題逐漸引起我們的關注。多中心回顧性研究[4-5]結果顯示,ASO術后中遠期殘余再干預率約為3.8%~10.9%,以右心系統殘余問題為主。本研究中746例ASO術后生存患兒中遠期殘余外科再手術率為7.1%。
肺動脈狹窄是ASO術后中遠期最常見的并發癥[6]。肺動脈狹窄多發生于新建肺動脈總干吻合口處及肺動脈分支開口位置[7]。由于嬰幼兒期主肺動脈血管發育不平衡,瓣環內徑不匹配(肺動脈瓣環往往大于主動脈瓣環),不對稱的縫合容易導致吻合口兩端生長不一;另一方面,重建肺動脈所用的心包補片缺乏足夠的生長潛能進一步加重狹窄,所以肺動脈吻合口狹窄發生率明顯高于主動脈吻合口。肺動脈分支狹窄常由Lecompt換位后擴張的主動脈根部擠壓推移主肺動脈共匯致使分支開口牽拉成角造成。本研究中共23例患兒術后發生肺動脈狹窄,其中14例為肺動脈總干吻合口狹窄,9例為肺動脈分支狹窄;再干預率方面,D-TGA/IVS術后肺動脈分支狹窄再干預率均明顯高于D-TGA/VSD和Taussig-Bing(P<0.05),這可能與D-TGA/IVS患兒多于新生兒期手術、肺動脈血管發育欠佳以及Lecompt換位的應用有關。
RVOTO也是ASO術后中遠期常見并發癥。TGA/IVS患者罕見合并RVOTO,而在D-TGA/VSD群體中,約25%的患者存在RVOTO。研究[8]顯示Taussig-Bing畸形以及合并主動脈弓梗阻也是ASO術后RVOTO的高危因素。原發性RVOTO由于室間隔缺損上緣圓錐會向上移位擠壓流出道形成,而不同程度的主動脈弓及瓣環發育不良會增加解剖右心室的后負荷,從而引發心室腔內壓力升高,導致右心室肌肉增厚繼發流出道梗阻。嬰幼兒期患兒右心室腔小,操作困難,過多的操作會影響術后心室傳導及心肌收縮;而疏通不充分的流出道中,殘存的肥厚肌束仍會進行性生長導致中遠期RVOTO復發。因此我們建議對于術前存在RVOTO的患兒,在實施ASO縫合關閉室間隔缺損前常規探查主動脈瓣下圓錐,盡可能剪除室間隔與右室前壁間的肌性流出道壁束以及增生纖維,從而降低遠期RVOTO風險。本研究中共11例患兒因RVOTO行再干預,其中8例為D-TGA/VSD患兒,明顯高于D-TGA/IVS和Taussig-Bing患兒,手術均為流出道肥厚肌束切除術,術后隨訪無RVOTO再發生。
相較于RVOTO,左室流出道梗阻(left ventricular outlet tract obstruction,LVOTO)在ASO術后并不常見[9]。狹窄部位多發生在主動脈瓣下或主動脈吻合口處。本研究中共6例患兒出現LVOTO,再干預率為0.8%(6/746),其中SAS 4例,主動脈吻合口狹窄2例。SAS多為主動脈瓣環下方纖維組織緩慢增生并伴有不同程度的肌肉增厚。主動脈瓣下纖維組織增生與術后左心室幾何形態改變有關:血流通過LVOT時出現湍流,造成纖維組織堆積形成纖維嵴或纖維環。本中心前期研究[10]發現:Ⅰ期肺動脈環縮手術患者鍛煉后的左室心肌及室間隔明顯增厚,即使解剖畸形糾正,隨著患兒的生長發育,中遠期仍可能逐漸出現SAS。ASO術后主動脈吻合口發生狹窄的高危因素主要為瓣環發育滯后、吻合口張力過高、肺動脈根部擴大與升主動脈吻合時不匹配等。本研究中Taussig-Bing畸形術后主動脈吻合口狹窄及主動脈弓再狹窄的發生率較高,一方面由于大部分Taussig-Bing畸形患兒手術年齡較大,肺動脈瓣環明顯擴張,遠超主動脈瓣環內徑;另一方面,接近50%的Taussig-Bing患者合并不同程度的主動脈弓發育不良,重建后的升主動脈內徑也很難匹配肺動脈內徑,不對稱的吻合易發生遠期再狹窄[11-13]。
部分ASO患者術后隨訪過程中會出現不同程度的主動脈根部擴張,但僅有少數會發展成嚴重的主動脈瓣關閉不全(aortic insufficiency,AI)[1]。長時間中度以上AI會使左心室舒張期末壓力增大,影響射血功能,易發展成慢性心功能衰竭。既往研究[14]認為手術年齡偏大(>6個月)、合并室間隔缺損、術前肺動脈高壓、既往肺動脈環縮、主動脈/肺動脈內徑不匹配、二葉肺動脈瓣、LVOTO、圍術期輕度AI和“Trap-door”法冠狀動脈移植等是ASO術后中遠期發生中度以上AI的高危因素。隨著主動脈根部成形技術的不斷改進,主動脈/肺動脈內徑不匹配對新主動脈根部的影響也在逐漸減小。阜外醫院研究[15]認為術前肺動脈高壓和既往肺動脈環縮是AI的獨立危險因素。我們的經驗提示術后LVOTO同樣會影響主動脈瓣后期發育,出現SAS后,LVOT血流增快,長期的高速血流沖擊可能引起主動脈瓣損害,造成主動脈瓣葉增厚,出現狹窄或反流。本研究中再干預的5例AI患兒,中位再干預時間為ASO術后64.0(48.0~122.0)個月,2例主動脈瓣成形術均同時行LVOT疏通,1例單純主動脈瓣成形術,1例主動脈瓣置換術,另1例主動脈瓣置換術加行Konno手術擴大主動脈瓣環。
本研究中還有患者因三尖瓣關閉不全及室間隔缺損殘余分流行二次手術,因病例較少且無特異性,故不予討論。值得注意的是,所有ASO術后患兒中遠期無冠狀動脈殘余,這可能與我們近年來不斷改良多種冠狀動脈移植術以確保其通暢有關。
綜上所述,ASO是治療D-TGA/IVS、D-TGA/VSD及Taussig-Bing畸形理想的手術方式,早期生存率高,遠期生活質量滿意,但仍存在術后殘余。ASO術后中遠期殘余以右心系統為主,左心系統發生時間明顯晚于右心系統。合并主動脈弓手術及術后早期RVOT流速>3 m/s是ASO術后殘余的獨立危險因素,術前避免高危因素發生、完善術后隨訪資料和及時實施再干預是下一步工作重點。
利益沖突:無。
作者貢獻:羅凱負責論文設計,收集、分析數據,文章撰寫;張曉陽負責收集、分析數據,實施研究;何曉敏負責實施研究;潘燕軍負責論文審校;劉鑫榮負責圖表設計;施國丞負責文獻檢索;祝忠群、張蔚負責論文審校,技術/材料支持;鄭景浩負責論文總體設計,基金支持。
大動脈調轉手術(arterial switch operation,ASO)為治療完全性大動脈轉位合并室間隔完整(D-transposition of the great arteries with intact ventricular septum,D-TGA/IVS)、完全性大動脈轉位合并室間隔缺損(D-transposition of the great arteries with ventricular septal defect,D-TGA/VSD)及右室雙出口合并肺動脈下室間隔缺損(又稱Taussig-Bing畸形)的首選手術方式。通過調換兩大動脈位置和移植冠狀動脈,不僅能從解剖上恢復左心室-主動脈及右心室-肺動脈連接的正常結構,還能從生理上平衡左心系統-體循環及右心系統-肺循環的正常發育,遠期預后令人滿意。ASO手術效果良好,中遠期隨訪患兒生活質量良好,但仍有部分患兒因右心系統梗阻、左心系統梗阻及瓣膜關閉不全等殘余問題接受二次手術干預[1]。本文通過回顧性分析2006年1月—2022年1月于我院實施ASO手術隨訪患兒的臨床資料,探討中遠期殘余的高危因素及再干預策略。
1 資料與方法
1.1 臨床資料
2006年1月—2022年6月共952例復雜先心病患兒于上海兒童醫學中心行ASO。患者納入標準:(1)影像學檢查明確診斷D-TGA/IVS、D-TGA/VSD或Taussig-Bing畸形,且完成Ⅰ期或Ⅱ期ASO者;(2)ASO術后規律隨訪超過1年,因殘余問題行外科再干預者。排除標準:(1)明確診斷糾正型大動脈轉位或房室連接不一致右室雙出口行雙調轉手術者;(2)Ⅰ期行姑息手術后未行Ⅱ期ASO者。
1.2 殘余再干預標準
所有患兒均接受超聲心動圖檢查,殘余再干預標準[2-3]為:(1)右心系統梗阻[流出道、肺動脈總干、分支或過瓣流速>3.5 m/s,壓差>50 mm Hg(1 mm Hg=0.133 kPa)];(2)左心系統梗阻(流出道、主動脈瓣上、弓部或過瓣流速>3 m/s,壓差>36 mm Hg):(3)主動脈瓣中度以上關閉不全伴左心室擴張(主動脈瓣反流束寬>4 mm伴左心室舒張末容積大小Z值>2);(4)三尖瓣中度以上關閉不全(三尖瓣反流束寬>4 mm伴瓣環明顯擴張);(5)室間隔缺損殘余分流>3 mm。28例大血管狹窄患者接受心臟CT檢查,明確主動脈或肺動脈的狹窄程度及部位;5例主動脈瓣中度關閉不全患者完善心臟磁共振成像檢查評估左心室功能(左心室舒張期末容積)。
1.3 統計學分析
采用SPSS 19.0軟件進行統計學分析。正態分布的計量資料以均數±標準差(x±s)描述,非正態分布的計量資料以中位數(范圍)描述,組間比較采用Wilcoxon秩和檢驗或t檢驗;分類資料以例數和百分比描述,組間比較采用χ2檢驗或Fisher確切概率法。采用多元logistic回歸模型進行ASO術后中遠期殘余的獨立危險因素分析。P≤0.05為差異有統計學意義。
1.4 倫理審查
本研究經上海交通大學醫學院附屬上海兒童醫學中心倫理委員會審批,批準號:SCMCIRBY2022059。
2 結果
2.1 大動脈調轉術后結果
共納入952例患者,其中男654例、女298例,平均年齡(102.9±90.1)d,平均體重(4.6±1.6)kg。診斷包括D-TGA/IVS 421例、D-TGA/VSD 357例及Taussig-Bing畸形174例。Ⅰ期ASO 855例,Ⅱ期ASO 97例(Ⅱ期ASO與姑息手術間隔時間為14 d至6個月),術后早期死亡89例,死亡率為9.3%。746例生存患兒術后定期隨訪(術后1、3、6、12個月各隨訪1次,之后每1~2年隨訪1次),隨訪率86.4%。中位隨訪時間79.4(12.0~188.0)個月。
隨訪過程中,53例患兒出現殘余行外科再干預,其中男30例、女23例,中位手術年齡62.5(17.0~214.0)個月,中位手術體重19.0(8.2~86.0)kg,平均再干預時間為ASO術后28.0~170.0(77.5±45.4)個月。
2.2 殘余外科再干預結果
按照不同診斷將952例ASO術后患兒分為D-TGA/IVS組、D-TGA/VSD組及Taussig-Bing組。肺動脈分支狹窄在D-TGA/IVS組發生率明顯高于其他兩組(P=0.022);D-TGA/VSD組右室流出道梗阻(right ventricular outlet tract obstruction,RVOTO)發生率最高(P=0.030);而主動脈弓再狹窄多發生于Taussig-Bing組(P=0.005),其余殘余問題發生率差異無統計學意義(P>0.05);見表1。69.8%(37/53)為右心系統殘余,且術后右心系統再干預時間[(46.5±21.6)個月]明顯早于左心系統[(97.6±47.3)個月];見圖1。
 圖1
ASO術后左心及右心系統殘余免于再手術率
圖1
ASO術后左心及右心系統殘余免于再手術率
ASO:大動脈轉位術
53例患兒均于體外循環下行再干預,手術策略包括肺動脈補片擴大術(16例)、右室流出道(right ventricular outlet tract,RVOT)疏通+肺動脈補片擴大術(7例)、升主動脈重建術(6例)、RVOT疏通術(4例)、左室流出道(left ventricular outlet tract,LVOT)疏通術(4例)等。所有患兒平均體外循環時間(176.3±46.5)min,平均主動脈阻斷時間(86.2±36.3)min,其中1例患兒左右肺動脈發育均差(Mcgoon比值1.0,Nakata指數98 mm2/m2),用14號Gore-tex管道連接左右肺動脈至肺門,再用24號Maquet管道連接肺動脈與RVOT,實現RVOT肺動脈全管道化;1例患兒因體外停機困難術中安置體外膜肺氧合輔助循環,于術后5 d順利撤機;術后平均氣管插管時間(52.5±31.6)h,平均監護室滯留時間(7.0±3.2)d,平均住院時間(19.8±10.4)d,術后早期死亡2例(3.8%),1例為Ⅱ期開胸分離縱隔粘連過程中損傷冠狀動脈導致急性心肌梗死,另1例死亡原因為主動脈瓣置換術后急性左心衰竭。早期并發癥包括低心排血量綜合征20例[連續心臟指數<2.5 L/(min·m2)],心律失常5例(3例室上性心動過速,1例交界性異位心動過速,1例Ⅱ度1型房室傳導阻滯),腎功能不全11例[術后持續少尿狀態,尿量<1 mL/(kg·h),乳酸進行性升高],肝功能不全4例(肝轉氨酶升高2倍以上,凝血指標異常)等。
生存患者出院后第1、3、6、12個月常規隨訪,術后1年起每半年至一年隨訪1次,隨訪14.0~166.0(52.4±28.6)個月。隨訪內容包括:超聲心動圖、心電圖及心肺運動試驗等。所有患兒紐約心臟協會心功能分級均為Ⅰ~Ⅱ級,心臟及大血管解剖結構問題均有明顯改善,干預后瓣膜反流程度均保持在中度以內,狹窄處流速較術前明顯降低[LVOT疏通術前后:(2.33±0.30)m/s vs.(3.81±0.51)m/s,RVOT疏通術前后:(1.75±0.58)m/s vs.(3.94±0.79)m/s,P<0.05]。5例心律失常患兒藥物控制良好,心電圖未見明顯異常表現。中期隨訪無死亡病例,2例患兒因殘余行第三次手術,1例患兒因肺動脈分支再狹窄行肺動脈補片擴大術,另1例患兒因肺動脈總干狹窄合并肺動脈瓣關閉不全行Rastelli手術(22號自制Gore-tex帶瓣管道)。
2.3 大動脈轉位術后殘余的危險因素
單因素分析顯示,肺/主動脈瓣環比>1.5、肺動脈環縮術、合并主動脈弓手術、術后早期RVOT流速>3 m/s,術后早期主動脈瓣下狹窄(subaortic stenosis,SAS)流速>2.5 m/s是中遠期殘余的影響因素。將上述因素納入二分類logistic回歸分析,得到回歸方程:Logit P=?2.03+1.70×合并主動脈弓手術+1.49×術后早期RVOT流速>3 m/s。結果提示,合并主動脈弓手術及術后早期RVOT流速>3 m/s是ASO術后中遠期發生殘余的獨立危險因素;見表2。
3 討論
我院于1989年率先在國內開展嬰幼兒ASO外科治療,經過30余年的不斷積累,ASO術后早期死亡率已控制在10%以內,逐漸接近國際先進中心水平[3]。隨著術后隨訪體系的不斷完善,ASO術后中遠期殘余問題逐漸引起我們的關注。多中心回顧性研究[4-5]結果顯示,ASO術后中遠期殘余再干預率約為3.8%~10.9%,以右心系統殘余問題為主。本研究中746例ASO術后生存患兒中遠期殘余外科再手術率為7.1%。
肺動脈狹窄是ASO術后中遠期最常見的并發癥[6]。肺動脈狹窄多發生于新建肺動脈總干吻合口處及肺動脈分支開口位置[7]。由于嬰幼兒期主肺動脈血管發育不平衡,瓣環內徑不匹配(肺動脈瓣環往往大于主動脈瓣環),不對稱的縫合容易導致吻合口兩端生長不一;另一方面,重建肺動脈所用的心包補片缺乏足夠的生長潛能進一步加重狹窄,所以肺動脈吻合口狹窄發生率明顯高于主動脈吻合口。肺動脈分支狹窄常由Lecompt換位后擴張的主動脈根部擠壓推移主肺動脈共匯致使分支開口牽拉成角造成。本研究中共23例患兒術后發生肺動脈狹窄,其中14例為肺動脈總干吻合口狹窄,9例為肺動脈分支狹窄;再干預率方面,D-TGA/IVS術后肺動脈分支狹窄再干預率均明顯高于D-TGA/VSD和Taussig-Bing(P<0.05),這可能與D-TGA/IVS患兒多于新生兒期手術、肺動脈血管發育欠佳以及Lecompt換位的應用有關。
RVOTO也是ASO術后中遠期常見并發癥。TGA/IVS患者罕見合并RVOTO,而在D-TGA/VSD群體中,約25%的患者存在RVOTO。研究[8]顯示Taussig-Bing畸形以及合并主動脈弓梗阻也是ASO術后RVOTO的高危因素。原發性RVOTO由于室間隔缺損上緣圓錐會向上移位擠壓流出道形成,而不同程度的主動脈弓及瓣環發育不良會增加解剖右心室的后負荷,從而引發心室腔內壓力升高,導致右心室肌肉增厚繼發流出道梗阻。嬰幼兒期患兒右心室腔小,操作困難,過多的操作會影響術后心室傳導及心肌收縮;而疏通不充分的流出道中,殘存的肥厚肌束仍會進行性生長導致中遠期RVOTO復發。因此我們建議對于術前存在RVOTO的患兒,在實施ASO縫合關閉室間隔缺損前常規探查主動脈瓣下圓錐,盡可能剪除室間隔與右室前壁間的肌性流出道壁束以及增生纖維,從而降低遠期RVOTO風險。本研究中共11例患兒因RVOTO行再干預,其中8例為D-TGA/VSD患兒,明顯高于D-TGA/IVS和Taussig-Bing患兒,手術均為流出道肥厚肌束切除術,術后隨訪無RVOTO再發生。
相較于RVOTO,左室流出道梗阻(left ventricular outlet tract obstruction,LVOTO)在ASO術后并不常見[9]。狹窄部位多發生在主動脈瓣下或主動脈吻合口處。本研究中共6例患兒出現LVOTO,再干預率為0.8%(6/746),其中SAS 4例,主動脈吻合口狹窄2例。SAS多為主動脈瓣環下方纖維組織緩慢增生并伴有不同程度的肌肉增厚。主動脈瓣下纖維組織增生與術后左心室幾何形態改變有關:血流通過LVOT時出現湍流,造成纖維組織堆積形成纖維嵴或纖維環。本中心前期研究[10]發現:Ⅰ期肺動脈環縮手術患者鍛煉后的左室心肌及室間隔明顯增厚,即使解剖畸形糾正,隨著患兒的生長發育,中遠期仍可能逐漸出現SAS。ASO術后主動脈吻合口發生狹窄的高危因素主要為瓣環發育滯后、吻合口張力過高、肺動脈根部擴大與升主動脈吻合時不匹配等。本研究中Taussig-Bing畸形術后主動脈吻合口狹窄及主動脈弓再狹窄的發生率較高,一方面由于大部分Taussig-Bing畸形患兒手術年齡較大,肺動脈瓣環明顯擴張,遠超主動脈瓣環內徑;另一方面,接近50%的Taussig-Bing患者合并不同程度的主動脈弓發育不良,重建后的升主動脈內徑也很難匹配肺動脈內徑,不對稱的吻合易發生遠期再狹窄[11-13]。
部分ASO患者術后隨訪過程中會出現不同程度的主動脈根部擴張,但僅有少數會發展成嚴重的主動脈瓣關閉不全(aortic insufficiency,AI)[1]。長時間中度以上AI會使左心室舒張期末壓力增大,影響射血功能,易發展成慢性心功能衰竭。既往研究[14]認為手術年齡偏大(>6個月)、合并室間隔缺損、術前肺動脈高壓、既往肺動脈環縮、主動脈/肺動脈內徑不匹配、二葉肺動脈瓣、LVOTO、圍術期輕度AI和“Trap-door”法冠狀動脈移植等是ASO術后中遠期發生中度以上AI的高危因素。隨著主動脈根部成形技術的不斷改進,主動脈/肺動脈內徑不匹配對新主動脈根部的影響也在逐漸減小。阜外醫院研究[15]認為術前肺動脈高壓和既往肺動脈環縮是AI的獨立危險因素。我們的經驗提示術后LVOTO同樣會影響主動脈瓣后期發育,出現SAS后,LVOT血流增快,長期的高速血流沖擊可能引起主動脈瓣損害,造成主動脈瓣葉增厚,出現狹窄或反流。本研究中再干預的5例AI患兒,中位再干預時間為ASO術后64.0(48.0~122.0)個月,2例主動脈瓣成形術均同時行LVOT疏通,1例單純主動脈瓣成形術,1例主動脈瓣置換術,另1例主動脈瓣置換術加行Konno手術擴大主動脈瓣環。
本研究中還有患者因三尖瓣關閉不全及室間隔缺損殘余分流行二次手術,因病例較少且無特異性,故不予討論。值得注意的是,所有ASO術后患兒中遠期無冠狀動脈殘余,這可能與我們近年來不斷改良多種冠狀動脈移植術以確保其通暢有關。
綜上所述,ASO是治療D-TGA/IVS、D-TGA/VSD及Taussig-Bing畸形理想的手術方式,早期生存率高,遠期生活質量滿意,但仍存在術后殘余。ASO術后中遠期殘余以右心系統為主,左心系統發生時間明顯晚于右心系統。合并主動脈弓手術及術后早期RVOT流速>3 m/s是ASO術后殘余的獨立危險因素,術前避免高危因素發生、完善術后隨訪資料和及時實施再干預是下一步工作重點。
利益沖突:無。
作者貢獻:羅凱負責論文設計,收集、分析數據,文章撰寫;張曉陽負責收集、分析數據,實施研究;何曉敏負責實施研究;潘燕軍負責論文審校;劉鑫榮負責圖表設計;施國丞負責文獻檢索;祝忠群、張蔚負責論文審校,技術/材料支持;鄭景浩負責論文總體設計,基金支持。