重癥肌無力(myasthenia gravis,MG)是由T細胞輔助、補體參與,可以產生特異性的乙酰膽堿受體抗體(anti. acetylcholine receptor antibody,AChRab)影響神經肌肉接頭處信號傳遞,導致骨骼肌收縮乏力的自身免疫性疾病[1]。其特征是波動性的肌肉乏力和易疲勞,早期常累及眼肌,后可逐漸發展到全身[2]。MG在國內并不少見,流行病學顯示我國每年MG發病率約為6.8/100萬,其中女性發病較為常見,大部分MG患者均會出現AChRab陽性[3]。目前對于MG的發病機制還尚未明確,大多數觀點認為胸腺中可以產生特異性的抗體,從而參與了MG的發生、發展過程[4]。胸腺切除術對MG患者臨床癥狀的長期改善逐漸被大家認可,因此胸腺切除術聯合藥物治療成為目前MG首選的治療方式[5]。胸腺被認為是MG自身免疫機制的始動和維持的主要原因,而胸腺濾泡生發中心(follicular germinal center,GC)的發現讓胸腺和MG關系更加清晰,GC不僅作為TFH細胞增殖、激活和導入形成的特殊結構,在抗原刺激后次級淋巴組織中B細胞也在GC成熟,也是自身免疫性疾病中形成致病抗體的重要部位[6]。
2000年Schaerli等[7]發現了一類特殊的CD4+T細胞亞群,其主要負責輔助 B細胞遷移、增殖、分化為漿細胞和記憶B細胞,并產生特異性抗體[8],被命名為濾泡輔助性T(T follicular helper,TFH)細胞。TFH細胞在很多自身免疫性疾病中發揮重大作用,例如 系統性紅斑狼瘡[9]、自身免疫性疾病[10]、多發性硬化[11]等。研究[12]發現, TFH細胞是輔助B細胞發揮功能最主要的細胞,TFH分泌IL-4促進B細胞分化為記憶細胞,而IL-10、IL-21可以促進B細胞向漿細胞分化,從而產生特異性的AChRab。而MG發病主要是因為AChRab破壞了神經肌肉接頭處的信號傳遞過程,導致肌肉收縮乏力,所以TFH細胞和B細胞的相互作用在MG的發生、發展過程中起至關重要的作用。
α7煙堿樣乙酰膽堿受體(α7 nicotinic acetylcholine receptor, α7nAChR)作為非神經元型膽堿能系統(non-neuronal cholinergic system,NNCS)其中一個重要亞型,已經被證實廣泛分布于免疫細胞表面。有研究[13]發現,激活α7nAChR可增強T淋巴細胞的免疫抑制功能,抑制免疫細胞因子的釋放。TFH細胞屬于CD4+T細胞一個重要亞群,與MG發生息息相關[14],那么α7nAChR在TFH細胞上的表達高低是否可以通過影響其功能,導致細胞因子釋放發生變化,進一步影響B細胞產生特異性抗體導致MG的發生,這是一個值得思考的問題。所以我們將α7nAChR在MG患者胸腺TFH細胞的表達情況作為研究的創新點,去探討α7nAChR的表達差異可能通過何種途徑來影響MG的發生。本研究通過檢測TFH細胞α7nAChR的表達情況,分析α7nAChR的表達水平與TFH細胞的聯系,旨在探究MG胸腺TFH細胞α7nAChR的表達水平是否可以通過影響其功能而間接參與MG的發生、發展過程,同時可以為后續進一步探索MG胸腺中致病性抗體產生的具體途徑奠定基礎。
1 資料與方法
1.1 臨床資料和分組
選取2022年6月—2023年6月就診于河南省人民醫院重癥肌無力綜合診療中心行手術治療的MG患者15例為MG組,其中男7例、女8例,年齡12~30歲;選取2022年6月—2023年6月在阜外華中心血管病醫院行心臟手術過程中為不阻礙術野行部分胸腺切除術的患者12例為對照組,其中男5例、女7例,年齡20~35歲。納入標準:(1)MG組患者診斷均已明確,即有典型的MG臨床特征,并滿足以下任意一點,包括藥理學檢查、電生理學檢查、抗乙酰膽堿受體抗體檢查等檢測;(2)入組患者均未接受過激素、免疫抑制劑等治療;(3)臨床資料未見缺失。排除標準:(1)合并多臟器感染、多器官衰竭、嚴重精神疾患等;(2)合并胸腺瘤、其他自身免疫性疾病等;(3)中途退出者。
1.2 主要試劑耗材
PBS緩沖液、80目無菌不銹鋼鋼絲網、RPMI-1640培養基、Ficoll細胞分離液、流式CD3/CD4/CD8/CD45/CXCR5抗體、CD4+ T細胞分選試劑盒、磁珠CXCR5抗體、LS分選柱、α7nAChR抗體、RNA-easy Isolation Reagent試劑盒、引物、逆轉錄試劑盒、BCA試劑盒等。
1.3 方法
1.3.1 細胞提取及純化
胸腺組織離體后立刻置于冷的PBS緩沖液中清洗,無菌操作臺上去除胸腺表面的脂肪和結締組織,將胸腺組織放于80目的不銹鋼網上剪成小塊,然后輕柔研磨組織,吸取PBS沖洗不銹鋼網得到胸腺細胞懸液,1 200 r/min離心5 min,棄上清。加入紅細胞裂解液裂解4~5 min,用PBS洗滌1~2遍后,重懸計數。
1.3.2 密度梯度離心純化胸腺細胞
取4~5 mL Ficoll細胞分離液(取用前恢復至室溫并搖勻)將研磨后的胸腺細胞重懸,轉移至15 mL離心管中,緩慢加入500~1 000 μL的RPMI-1640培養基,盡量保持兩層液面分界明顯。室溫,800 g離心30 min。離心過程中均要設置較慢的加速度和減速度,待離心結束后根據密度不同會分為3層。緩慢吸出中間的胸腺細胞層,再加入培養基顛倒洗滌。室溫,250 g離心10 min收集細胞。
1.3.3 流式細胞術檢驗α7nAChR在TFH細胞的表達情況
使用冷的 PBS 緩沖液洗滌胸腺細胞,再用緩沖液配制成1×106細胞/mL的細胞懸液。分別向各樣品管加入適量的細胞表面熒光抗體,2~8℃避光孵育30 min,隨后加1 mL PBS緩沖液清洗細胞,1 200 r/min離心5 min,棄上清,用500 uL流式細胞鞘液重懸,等待流式上機檢測。
1.3.4 磁珠分選獲得TFH細胞
取部分純化后的胸腺細胞懸液,每 個細胞離心重懸于40 μL磁珠分選緩沖液中,先加入 CD4+ Biotin-Antibody Cocktail孵育10 min后,加入Anti-Biotin Microbeads孵育15 min,混勻后加入到LS分選柱中,收集全部流出液。300 g,4℃離心10 min,棄上清,即為我們要的CD4+ T細胞。將分選出的CD4+ T細胞計數,300 g,4℃離心10 min,棄上清。加入CXCR5 Antibody孵育10 min后,加入Anti-APC Microbeads孵育15 min,混勻后加入到LS分選柱,收集全部流出液。將LS柱取下,用1 mL磁珠分選緩沖液將結合在 LS柱內的帶有磁珠標記的細胞洗出,300 g,4℃離心10 min,棄上清,得到的即 CD4+CXCR5+ TFH細胞。
個細胞離心重懸于40 μL磁珠分選緩沖液中,先加入 CD4+ Biotin-Antibody Cocktail孵育10 min后,加入Anti-Biotin Microbeads孵育15 min,混勻后加入到LS分選柱中,收集全部流出液。300 g,4℃離心10 min,棄上清,即為我們要的CD4+ T細胞。將分選出的CD4+ T細胞計數,300 g,4℃離心10 min,棄上清。加入CXCR5 Antibody孵育10 min后,加入Anti-APC Microbeads孵育15 min,混勻后加入到LS分選柱,收集全部流出液。將LS柱取下,用1 mL磁珠分選緩沖液將結合在 LS柱內的帶有磁珠標記的細胞洗出,300 g,4℃離心10 min,棄上清,得到的即 CD4+CXCR5+ TFH細胞。
1.3.5 RT-PCR
分選后的胸腺TFH細胞用RNA-easy Isolation Reagent試劑盒提取總的RNA,然后根據逆轉錄試劑盒說明書,將總RNA逆轉錄為cDNA。以cDNA為轉錄模版按實時熒光聚合酶鏈式反應試劑盒進行目的基因特異性擴增,GAPDH為內參,以2-△△Ct法計算胸腺TFH細胞中α7nAChR相對表達量。引物序列見表1。
1.3.6 Western blot
RIPA蛋白裂解液提取胸腺TFH細胞蛋白,BCA試劑盒測量蛋白濃度,提前制備好預制膠,將蛋白質溶液與樣品緩沖液按比例混合,100℃水浴加熱3~5 min,離心取上清,上樣后開始聚丙烯酰胺凝膠電泳(SDS-PAGE),待電泳結束后將蛋白轉膜至PVDF膜上,轉膜后封閉。α7nAChR一抗4℃過夜孵育、洗滌,再加入二抗室溫孵育、洗滌。配置顯色液后孵育顯影,上機檢測。
1.4 統計學分析
本實驗數據均應用SPSS 26.0統計軟件進行分析,符合正態分布的計量資料以均數±標準差(x±s)描述,兩組間比較采用t檢驗。P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過河南省人民醫院醫學倫理委員會批準,倫理批號:(2021)倫審第(176)號,所有入組患者對本研究皆支持,并簽署相關知情同意書。
2 結果
2.1 一般資料
兩組患者年齡差異有統計學意義(P=0.035),兩組患者性別差異無統計學意義(P=0.795);見表2。
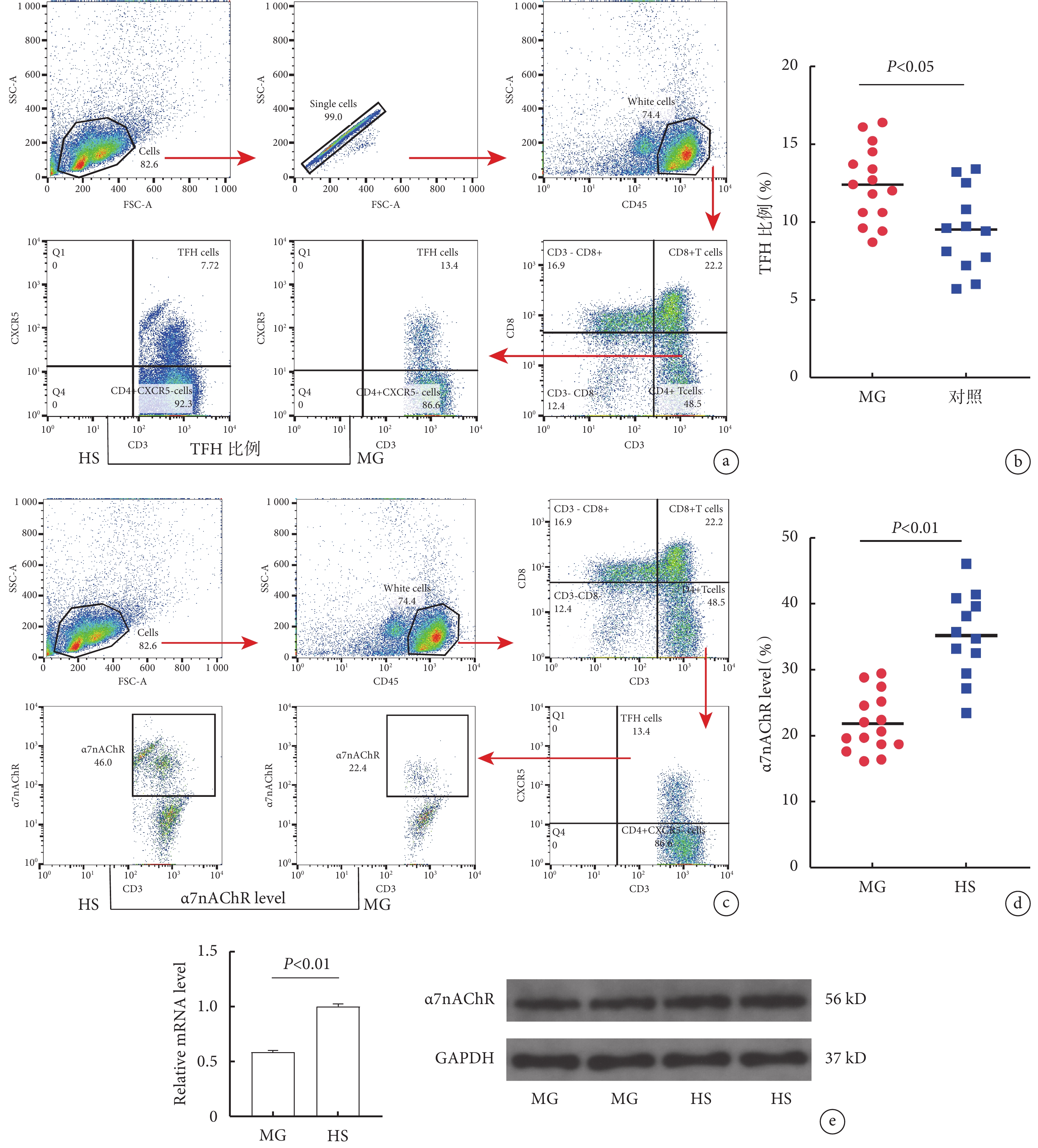
2.2 流式間接標記檢測MG組與對照組胸腺TFH細胞比例
MG組胸腺TFH細胞的比例較對照組明顯升高(P<0.05);見圖1a~b。
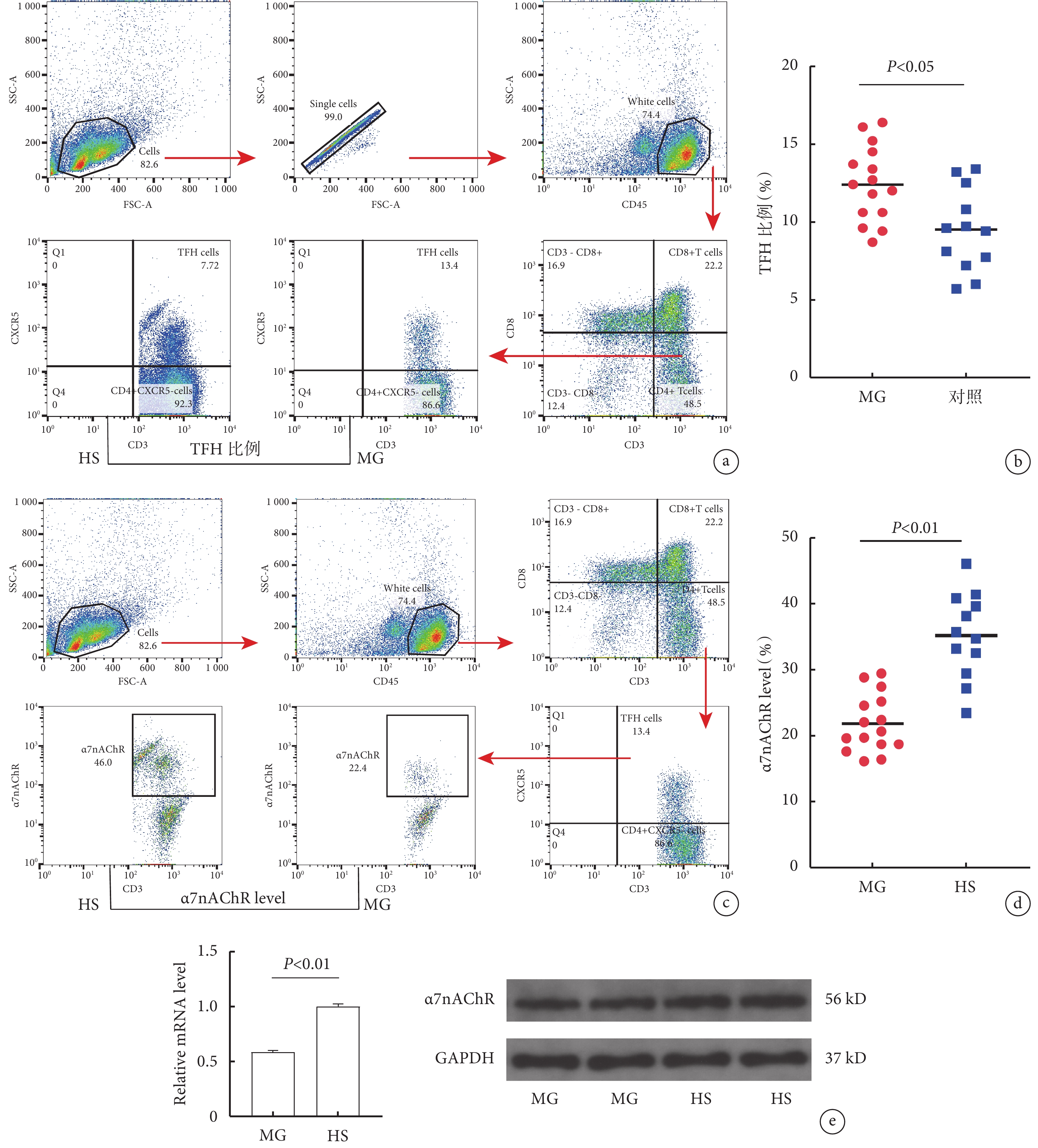 圖1
XXX
圖1
XXX
2.3 流式間接標記檢測MG組與對照組胸腺TFH細胞α7nAChR水平
MG組胸腺TFH細胞α7nAChR的水平較對照組明顯降低(P<0.001);見圖1c~d。
2.4 MG組與對照組胸腺TFH細胞中α7nAChR水平比較
MG組胸腺TFH細胞α7nAChR mRNA、蛋白水平較對照組明顯降低(P<0. 01);見圖1e。
3 討論
MG的發病機制涉及多方面的因素,其發生主要是由于特異性AchRab的產生,而活化的TFH細胞、B細胞、漿細胞和相關細胞因子在MG致病性自身抗體的產生中起至關重要的作用[14]。目前發現患MG的人群中,女性是要略多于男性,整體發病率也在逐年上升。因此,研究MG的發病機制對MG的診斷和治療非常有意義。
研究[15]表明,TFH細胞表面標志物是 CXCR5、ICOS、PD-l、CCR7,同時特異性的表達Bcl-6,分泌IL-21,這是TFH細胞與其他T細胞亞群相互鑒別的關鍵特征。同時,這些分子在調控TFH細胞的發育以及其輔助B細胞分泌特異性抗體的過程中都發揮著非常重要作用。TFH分泌的IL-6對生發中心的形成是非常重要的,GC是高親和力B細胞選擇的位點,在GC中,TFH細胞和B細胞的相互作用是通過一系列的表面分子和細胞因子實現的,如 ICOS-ICOSL、PD-1–PD-1L、CD40-CD40L、IL-21–IL-21R,這些分子信號的傳導促進了記憶B細胞和漿細胞的形成[16-17]。TFH分泌的細胞因子在GC中T-B 細胞之間的相互作用中決定了B細胞的分化方向,IL-4 促進B細胞分化為記憶細胞,而IL-10、IL-21可以促進 B 細胞向漿細胞分化[18]。研究表明,MG患者的臨床癥狀嚴重程度與細胞因子IFN-γ、IL-4、IL-6、IL-10、IL-21均存在相關性[19]。
研究[20]發現,MG患者外周血中的TFH細胞比例增高,且TFH細胞的增高與抗乙酰膽堿受體抗體的水平有正相關性。有動物研究顯示,通過抑制TFH細胞的分化,可以降低EAMG模型小鼠中抗體的水平,改善EAMG模型小鼠的重癥肌無力癥狀[21]。這充分說明TFH細胞在重癥肌無力的發生、發展過程中發揮重要作用。研究發現[22],在 MG 患者的外周血的 TFH細胞及細胞因子IL-21的表達都高于對照組。同時在MG患者的胸腺中有TFH細胞的高表達,并且TFH細胞的比例與疾病的嚴重程度相關,以上都充分說明胸腺中的TFH可能參與了MG的發病[23]。我們研究發現,MG患者胸腺中TFH細胞比例顯著高于正常對照組。結合之前研究,說明TFH細胞的比例增加與MG的關系十分密切。
有研究[12]發現,激活α7nAChR可增強T淋巴細胞的免疫抑制功能,抑制免疫細胞因子的釋放。那么α7nAChR的表達降低減弱了對TFH細胞的免疫抑制功能,從而使其TFH細胞的功能活躍,增加細胞因子IFN-γ、IL-4、IL-6、IL-10、IL-21等的釋放,促進了記憶B細胞和漿細胞的形成,使致病性抗體的產生增加,從而參與MG的發病過程。我們本次研究首先通過流式細胞術檢測胸腺細胞懸液中TFH細胞的比例,發現MG組TFH細胞的比例是要明顯高于對照組的,但是TFH細胞中α7nAChR的表達是要比對照組明顯降低的,這也驗證了我們的猜想。TFH細胞作為主要輔助B細胞增殖分化為漿細胞并產生特異性抗體,在重癥肌無力中是會明顯升高的。而α7nAChR作為TFH細胞表面的靶點,是對TFH細胞起免疫抑制作用,所以α7nAChR表達降低會減少對TFH細胞的免疫抑制作用,使其活化并產生更多的細胞因子,刺激B細胞活化增殖為漿細胞,產生特異性抗體,從而可能參與MG的發生發展過程。
我們發現α7nAChR在TFH細胞表達降低與MG的發生密切相關,但具體是通過何種途徑來介導該種免疫反應還暫未明確。有研究發現,Ach與免疫細胞上的α7nAChR結合,通過因子核因子κB (nuclear factor κB,NF- κB)、JAK2/STAT3、PI3K/AKT 等信號通路調控多種細胞因子的產生與釋放,發揮免疫作用[24]。其中JAK2/STAT3 通路主要介導細胞增殖、細胞分化、細胞凋亡及生物體免疫調節,在免疫調節過程中發揮重要作用[25]。NF-κB是在炎性反應中無法代替的轉錄因子,NF-κB 在炎性反應中能夠與多種炎性反應調控基因的啟動子相結合,從而調控炎癥反應[26]。PI3K/AKT 是生物體內非常重要的一條細胞內信號傳導通路,PI3K是一種脂質激酶,當針刺刺激導致α7nAChR釋放激活膽堿能通路,使胞內RTKs發生磷酸化從而激活PI3K 蛋白,進而調控下游介質的表達[27]。那么α7nAChR表達降低會通過何種信號通路來影響細胞因子的釋放,將是我們下一步研究的重點方向,是MG發病機制研究更深一步的跨越。
綜上所述,本研究表明α7nAChR可以通過影響TFH細胞的功能而間接影響B細胞產生特異性致病性抗體的產生,從而在MG發病中起一定的作用,能夠為MG治療提供新的思路,使得以α7nAChR為中心靶點的治療成為可能。同時我們下一步將重點放在與α7nAChR密切相關的NF-κB、JAK2/STAT3、PI3K/AKT等信號通路上,希望可以更進一步的了解MG的發病機制。
利益沖突:無。
作者貢獻:王猛負責文獻檢索,繪制圖表,初稿撰寫;王猛、楊夢豪負責論文設計、數據分析;孫子瑞、史宸碩、張志文、鄭理想負責資料收集,提出修改意見;崔新征負責內容指導;張清勇負責參與制定研究思路,全文審校。
重癥肌無力(myasthenia gravis,MG)是由T細胞輔助、補體參與,可以產生特異性的乙酰膽堿受體抗體(anti. acetylcholine receptor antibody,AChRab)影響神經肌肉接頭處信號傳遞,導致骨骼肌收縮乏力的自身免疫性疾病[1]。其特征是波動性的肌肉乏力和易疲勞,早期常累及眼肌,后可逐漸發展到全身[2]。MG在國內并不少見,流行病學顯示我國每年MG發病率約為6.8/100萬,其中女性發病較為常見,大部分MG患者均會出現AChRab陽性[3]。目前對于MG的發病機制還尚未明確,大多數觀點認為胸腺中可以產生特異性的抗體,從而參與了MG的發生、發展過程[4]。胸腺切除術對MG患者臨床癥狀的長期改善逐漸被大家認可,因此胸腺切除術聯合藥物治療成為目前MG首選的治療方式[5]。胸腺被認為是MG自身免疫機制的始動和維持的主要原因,而胸腺濾泡生發中心(follicular germinal center,GC)的發現讓胸腺和MG關系更加清晰,GC不僅作為TFH細胞增殖、激活和導入形成的特殊結構,在抗原刺激后次級淋巴組織中B細胞也在GC成熟,也是自身免疫性疾病中形成致病抗體的重要部位[6]。
2000年Schaerli等[7]發現了一類特殊的CD4+T細胞亞群,其主要負責輔助 B細胞遷移、增殖、分化為漿細胞和記憶B細胞,并產生特異性抗體[8],被命名為濾泡輔助性T(T follicular helper,TFH)細胞。TFH細胞在很多自身免疫性疾病中發揮重大作用,例如 系統性紅斑狼瘡[9]、自身免疫性疾病[10]、多發性硬化[11]等。研究[12]發現, TFH細胞是輔助B細胞發揮功能最主要的細胞,TFH分泌IL-4促進B細胞分化為記憶細胞,而IL-10、IL-21可以促進B細胞向漿細胞分化,從而產生特異性的AChRab。而MG發病主要是因為AChRab破壞了神經肌肉接頭處的信號傳遞過程,導致肌肉收縮乏力,所以TFH細胞和B細胞的相互作用在MG的發生、發展過程中起至關重要的作用。
α7煙堿樣乙酰膽堿受體(α7 nicotinic acetylcholine receptor, α7nAChR)作為非神經元型膽堿能系統(non-neuronal cholinergic system,NNCS)其中一個重要亞型,已經被證實廣泛分布于免疫細胞表面。有研究[13]發現,激活α7nAChR可增強T淋巴細胞的免疫抑制功能,抑制免疫細胞因子的釋放。TFH細胞屬于CD4+T細胞一個重要亞群,與MG發生息息相關[14],那么α7nAChR在TFH細胞上的表達高低是否可以通過影響其功能,導致細胞因子釋放發生變化,進一步影響B細胞產生特異性抗體導致MG的發生,這是一個值得思考的問題。所以我們將α7nAChR在MG患者胸腺TFH細胞的表達情況作為研究的創新點,去探討α7nAChR的表達差異可能通過何種途徑來影響MG的發生。本研究通過檢測TFH細胞α7nAChR的表達情況,分析α7nAChR的表達水平與TFH細胞的聯系,旨在探究MG胸腺TFH細胞α7nAChR的表達水平是否可以通過影響其功能而間接參與MG的發生、發展過程,同時可以為后續進一步探索MG胸腺中致病性抗體產生的具體途徑奠定基礎。
1 資料與方法
1.1 臨床資料和分組
選取2022年6月—2023年6月就診于河南省人民醫院重癥肌無力綜合診療中心行手術治療的MG患者15例為MG組,其中男7例、女8例,年齡12~30歲;選取2022年6月—2023年6月在阜外華中心血管病醫院行心臟手術過程中為不阻礙術野行部分胸腺切除術的患者12例為對照組,其中男5例、女7例,年齡20~35歲。納入標準:(1)MG組患者診斷均已明確,即有典型的MG臨床特征,并滿足以下任意一點,包括藥理學檢查、電生理學檢查、抗乙酰膽堿受體抗體檢查等檢測;(2)入組患者均未接受過激素、免疫抑制劑等治療;(3)臨床資料未見缺失。排除標準:(1)合并多臟器感染、多器官衰竭、嚴重精神疾患等;(2)合并胸腺瘤、其他自身免疫性疾病等;(3)中途退出者。
1.2 主要試劑耗材
PBS緩沖液、80目無菌不銹鋼鋼絲網、RPMI-1640培養基、Ficoll細胞分離液、流式CD3/CD4/CD8/CD45/CXCR5抗體、CD4+ T細胞分選試劑盒、磁珠CXCR5抗體、LS分選柱、α7nAChR抗體、RNA-easy Isolation Reagent試劑盒、引物、逆轉錄試劑盒、BCA試劑盒等。
1.3 方法
1.3.1 細胞提取及純化
胸腺組織離體后立刻置于冷的PBS緩沖液中清洗,無菌操作臺上去除胸腺表面的脂肪和結締組織,將胸腺組織放于80目的不銹鋼網上剪成小塊,然后輕柔研磨組織,吸取PBS沖洗不銹鋼網得到胸腺細胞懸液,1 200 r/min離心5 min,棄上清。加入紅細胞裂解液裂解4~5 min,用PBS洗滌1~2遍后,重懸計數。
1.3.2 密度梯度離心純化胸腺細胞
取4~5 mL Ficoll細胞分離液(取用前恢復至室溫并搖勻)將研磨后的胸腺細胞重懸,轉移至15 mL離心管中,緩慢加入500~1 000 μL的RPMI-1640培養基,盡量保持兩層液面分界明顯。室溫,800 g離心30 min。離心過程中均要設置較慢的加速度和減速度,待離心結束后根據密度不同會分為3層。緩慢吸出中間的胸腺細胞層,再加入培養基顛倒洗滌。室溫,250 g離心10 min收集細胞。
1.3.3 流式細胞術檢驗α7nAChR在TFH細胞的表達情況
使用冷的 PBS 緩沖液洗滌胸腺細胞,再用緩沖液配制成1×106細胞/mL的細胞懸液。分別向各樣品管加入適量的細胞表面熒光抗體,2~8℃避光孵育30 min,隨后加1 mL PBS緩沖液清洗細胞,1 200 r/min離心5 min,棄上清,用500 uL流式細胞鞘液重懸,等待流式上機檢測。
1.3.4 磁珠分選獲得TFH細胞
取部分純化后的胸腺細胞懸液,每 個細胞離心重懸于40 μL磁珠分選緩沖液中,先加入 CD4+ Biotin-Antibody Cocktail孵育10 min后,加入Anti-Biotin Microbeads孵育15 min,混勻后加入到LS分選柱中,收集全部流出液。300 g,4℃離心10 min,棄上清,即為我們要的CD4+ T細胞。將分選出的CD4+ T細胞計數,300 g,4℃離心10 min,棄上清。加入CXCR5 Antibody孵育10 min后,加入Anti-APC Microbeads孵育15 min,混勻后加入到LS分選柱,收集全部流出液。將LS柱取下,用1 mL磁珠分選緩沖液將結合在 LS柱內的帶有磁珠標記的細胞洗出,300 g,4℃離心10 min,棄上清,得到的即 CD4+CXCR5+ TFH細胞。
個細胞離心重懸于40 μL磁珠分選緩沖液中,先加入 CD4+ Biotin-Antibody Cocktail孵育10 min后,加入Anti-Biotin Microbeads孵育15 min,混勻后加入到LS分選柱中,收集全部流出液。300 g,4℃離心10 min,棄上清,即為我們要的CD4+ T細胞。將分選出的CD4+ T細胞計數,300 g,4℃離心10 min,棄上清。加入CXCR5 Antibody孵育10 min后,加入Anti-APC Microbeads孵育15 min,混勻后加入到LS分選柱,收集全部流出液。將LS柱取下,用1 mL磁珠分選緩沖液將結合在 LS柱內的帶有磁珠標記的細胞洗出,300 g,4℃離心10 min,棄上清,得到的即 CD4+CXCR5+ TFH細胞。
1.3.5 RT-PCR
分選后的胸腺TFH細胞用RNA-easy Isolation Reagent試劑盒提取總的RNA,然后根據逆轉錄試劑盒說明書,將總RNA逆轉錄為cDNA。以cDNA為轉錄模版按實時熒光聚合酶鏈式反應試劑盒進行目的基因特異性擴增,GAPDH為內參,以2-△△Ct法計算胸腺TFH細胞中α7nAChR相對表達量。引物序列見表1。
1.3.6 Western blot
RIPA蛋白裂解液提取胸腺TFH細胞蛋白,BCA試劑盒測量蛋白濃度,提前制備好預制膠,將蛋白質溶液與樣品緩沖液按比例混合,100℃水浴加熱3~5 min,離心取上清,上樣后開始聚丙烯酰胺凝膠電泳(SDS-PAGE),待電泳結束后將蛋白轉膜至PVDF膜上,轉膜后封閉。α7nAChR一抗4℃過夜孵育、洗滌,再加入二抗室溫孵育、洗滌。配置顯色液后孵育顯影,上機檢測。
1.4 統計學分析
本實驗數據均應用SPSS 26.0統計軟件進行分析,符合正態分布的計量資料以均數±標準差(x±s)描述,兩組間比較采用t檢驗。P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過河南省人民醫院醫學倫理委員會批準,倫理批號:(2021)倫審第(176)號,所有入組患者對本研究皆支持,并簽署相關知情同意書。
2 結果
2.1 一般資料
兩組患者年齡差異有統計學意義(P=0.035),兩組患者性別差異無統計學意義(P=0.795);見表2。
2.2 流式間接標記檢測MG組與對照組胸腺TFH細胞比例
MG組胸腺TFH細胞的比例較對照組明顯升高(P<0.05);見圖1a~b。
 圖1
XXX
圖1
XXX
2.3 流式間接標記檢測MG組與對照組胸腺TFH細胞α7nAChR水平
MG組胸腺TFH細胞α7nAChR的水平較對照組明顯降低(P<0.001);見圖1c~d。
2.4 MG組與對照組胸腺TFH細胞中α7nAChR水平比較
MG組胸腺TFH細胞α7nAChR mRNA、蛋白水平較對照組明顯降低(P<0. 01);見圖1e。
3 討論
MG的發病機制涉及多方面的因素,其發生主要是由于特異性AchRab的產生,而活化的TFH細胞、B細胞、漿細胞和相關細胞因子在MG致病性自身抗體的產生中起至關重要的作用[14]。目前發現患MG的人群中,女性是要略多于男性,整體發病率也在逐年上升。因此,研究MG的發病機制對MG的診斷和治療非常有意義。
研究[15]表明,TFH細胞表面標志物是 CXCR5、ICOS、PD-l、CCR7,同時特異性的表達Bcl-6,分泌IL-21,這是TFH細胞與其他T細胞亞群相互鑒別的關鍵特征。同時,這些分子在調控TFH細胞的發育以及其輔助B細胞分泌特異性抗體的過程中都發揮著非常重要作用。TFH分泌的IL-6對生發中心的形成是非常重要的,GC是高親和力B細胞選擇的位點,在GC中,TFH細胞和B細胞的相互作用是通過一系列的表面分子和細胞因子實現的,如 ICOS-ICOSL、PD-1–PD-1L、CD40-CD40L、IL-21–IL-21R,這些分子信號的傳導促進了記憶B細胞和漿細胞的形成[16-17]。TFH分泌的細胞因子在GC中T-B 細胞之間的相互作用中決定了B細胞的分化方向,IL-4 促進B細胞分化為記憶細胞,而IL-10、IL-21可以促進 B 細胞向漿細胞分化[18]。研究表明,MG患者的臨床癥狀嚴重程度與細胞因子IFN-γ、IL-4、IL-6、IL-10、IL-21均存在相關性[19]。
研究[20]發現,MG患者外周血中的TFH細胞比例增高,且TFH細胞的增高與抗乙酰膽堿受體抗體的水平有正相關性。有動物研究顯示,通過抑制TFH細胞的分化,可以降低EAMG模型小鼠中抗體的水平,改善EAMG模型小鼠的重癥肌無力癥狀[21]。這充分說明TFH細胞在重癥肌無力的發生、發展過程中發揮重要作用。研究發現[22],在 MG 患者的外周血的 TFH細胞及細胞因子IL-21的表達都高于對照組。同時在MG患者的胸腺中有TFH細胞的高表達,并且TFH細胞的比例與疾病的嚴重程度相關,以上都充分說明胸腺中的TFH可能參與了MG的發病[23]。我們研究發現,MG患者胸腺中TFH細胞比例顯著高于正常對照組。結合之前研究,說明TFH細胞的比例增加與MG的關系十分密切。
有研究[12]發現,激活α7nAChR可增強T淋巴細胞的免疫抑制功能,抑制免疫細胞因子的釋放。那么α7nAChR的表達降低減弱了對TFH細胞的免疫抑制功能,從而使其TFH細胞的功能活躍,增加細胞因子IFN-γ、IL-4、IL-6、IL-10、IL-21等的釋放,促進了記憶B細胞和漿細胞的形成,使致病性抗體的產生增加,從而參與MG的發病過程。我們本次研究首先通過流式細胞術檢測胸腺細胞懸液中TFH細胞的比例,發現MG組TFH細胞的比例是要明顯高于對照組的,但是TFH細胞中α7nAChR的表達是要比對照組明顯降低的,這也驗證了我們的猜想。TFH細胞作為主要輔助B細胞增殖分化為漿細胞并產生特異性抗體,在重癥肌無力中是會明顯升高的。而α7nAChR作為TFH細胞表面的靶點,是對TFH細胞起免疫抑制作用,所以α7nAChR表達降低會減少對TFH細胞的免疫抑制作用,使其活化并產生更多的細胞因子,刺激B細胞活化增殖為漿細胞,產生特異性抗體,從而可能參與MG的發生發展過程。
我們發現α7nAChR在TFH細胞表達降低與MG的發生密切相關,但具體是通過何種途徑來介導該種免疫反應還暫未明確。有研究發現,Ach與免疫細胞上的α7nAChR結合,通過因子核因子κB (nuclear factor κB,NF- κB)、JAK2/STAT3、PI3K/AKT 等信號通路調控多種細胞因子的產生與釋放,發揮免疫作用[24]。其中JAK2/STAT3 通路主要介導細胞增殖、細胞分化、細胞凋亡及生物體免疫調節,在免疫調節過程中發揮重要作用[25]。NF-κB是在炎性反應中無法代替的轉錄因子,NF-κB 在炎性反應中能夠與多種炎性反應調控基因的啟動子相結合,從而調控炎癥反應[26]。PI3K/AKT 是生物體內非常重要的一條細胞內信號傳導通路,PI3K是一種脂質激酶,當針刺刺激導致α7nAChR釋放激活膽堿能通路,使胞內RTKs發生磷酸化從而激活PI3K 蛋白,進而調控下游介質的表達[27]。那么α7nAChR表達降低會通過何種信號通路來影響細胞因子的釋放,將是我們下一步研究的重點方向,是MG發病機制研究更深一步的跨越。
綜上所述,本研究表明α7nAChR可以通過影響TFH細胞的功能而間接影響B細胞產生特異性致病性抗體的產生,從而在MG發病中起一定的作用,能夠為MG治療提供新的思路,使得以α7nAChR為中心靶點的治療成為可能。同時我們下一步將重點放在與α7nAChR密切相關的NF-κB、JAK2/STAT3、PI3K/AKT等信號通路上,希望可以更進一步的了解MG的發病機制。
利益沖突:無。
作者貢獻:王猛負責文獻檢索,繪制圖表,初稿撰寫;王猛、楊夢豪負責論文設計、數據分析;孫子瑞、史宸碩、張志文、鄭理想負責資料收集,提出修改意見;崔新征負責內容指導;張清勇負責參與制定研究思路,全文審校。