目前,經皮介入封堵是解剖條件合適的房間隔缺損患者的首選治療方法,但是,介入手術使用的鎳鈦合金封堵器植入后終生存于體內,導致部分患者發生金屬過敏、心律失常等并發癥。為克服金屬存留的近遠期并發癥,同時避免放射線和金屬毒性等醫源性損傷,本文報道1例單純超聲引導完全可降解封堵器經皮介入治療金屬過敏的兒童房間隔缺損患者,取得良好手術效果。
由于其微創和低費用的優勢,經皮介入房間隔缺損(atrial septal defect,ASD)封堵術成為ASD的重要治療方法。但現有封堵器一般由鎳鈦合金制成,植入體內后可能會引發金屬過敏、頭痛、機械性壓迫造成心律失常等并發癥[1]。為克服上述并發癥,可降解封堵器成為近20年的研究熱點。但是,由于可降解材料在放射線下不顯影,第一代可降解封堵器都帶有顯影的金屬骨架,2006年,Mullen等[2]報道采用金屬骨架上被覆可降解基質制成的ASD封堵器,其近期臨床效果安全可行,但長期隨訪發現金屬支架磨蝕導致心臟穿孔的發生率較高,故該類部分可降解封堵器未能在臨床推廣應用。隨著材料學進步和影像學發展,國內多款完全可降解ASD封堵器進入臨床研究階段,取得滿意的近期臨床效果[3]。在本文中,我們報道1例單純超聲引導完全可降解封堵器經皮介入治療金屬過敏的兒童ASD患者。
臨床資料 患者,男,13歲,印裔美籍,因“發現心臟雜音2年余”入住中國醫學科學院阜外醫院。患者2年余前體檢發現心臟雜音,心臟超聲心動圖提示“先天性心臟病:房間隔缺損”。患者平素感冒不多,無心力衰竭史,無紫紺和暈厥史,有金屬過敏史,生長發育及活動量較正常同齡人無明顯差異。患者家屬拒絕擇期外科手術,有金屬過敏史,且擔心放射線損傷和主動脈磨蝕并發癥,受美國同行推薦來我院行超聲引導完全可降解封堵器植入術,門診以“先天性心臟病:房間隔缺損”于2023年5月30日收入結構性心臟病三病區。患兒自發病以來,精神狀況良好,睡眠和食欲正常,大小便正常,體重變化不明顯。
入院后體格檢查:左上肢血壓98/50 mm Hg,心律齊,心率81次/min,在胸骨左緣第2肋間聞及Ⅱ級收縮期吹風樣雜音,腹部觸診無異常,肝脾肋下不能觸及,雙下肢不水腫。經胸超聲心動圖示:房間隔總長42 mm,中部回聲脫失15 mm,主動脈側無邊緣,其對側8 mm,距二尖瓣12 mm,距上腔靜脈11 mm,距下腔靜脈18 mm,距冠狀靜脈竇 7 mm。右心房、右心室擴大,三尖瓣微量反流,左心室射血分數67%。患者“先天性心臟病:房間隔缺損”診斷明確,有干預指征,綜合家屬治療意愿及現有技術和器材條件,經結構性心臟病多學科團隊進一步評估后,擬在單純超聲引導下行完全可降解封堵器植入術。
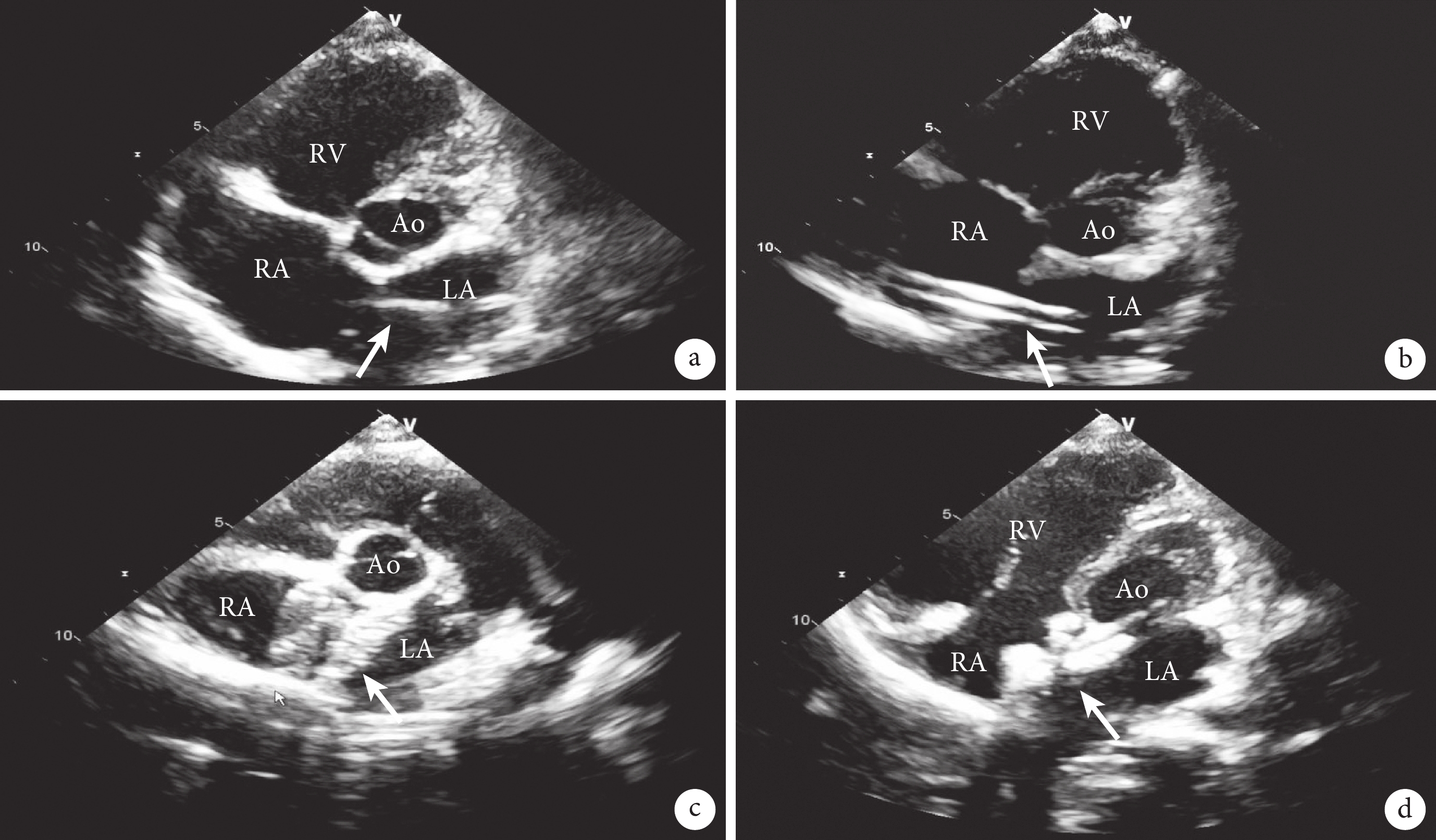
手術在日間手術室進行,患者取仰臥位,基礎麻醉后常規消毒、鋪無菌孔單。右側股靜脈穿刺并置入6Fr血管鞘,工作距離是指穿刺點到右鎖骨中線第3肋間的距離,術前在導管及導絲上標記該距離。靜脈給予普通肝素100 U/kg。經血管鞘按術前標記送入特硬導絲和6Fr MPA2導管至右心房,而后調整導管方向將導絲送入左心房并予以保留(圖1a)。退出導管后測量導管在體內的深度,該深度作為輸送鞘管應置入體內的安全深度。退出血管鞘,沿特硬導絲置入14Fr輸送鞘至左心房(圖1b),退出導絲及輸送鞘內芯。選擇24 mm ASD完全可降解封堵器(上海形狀記憶合金材料有限公司,中國),沿輸送鞘管送入封堵器至左心房,釋放出左心房側傘盤時輕拉成型線,待封堵器成傘狀后使其緊貼房間隔,后撤輸送鞘釋放封堵器右心房側傘盤。封堵器安置成功后,經胸超聲確認封堵器對缺損周圍組織無影響,無殘余分流,塑形形態良好后(圖1c),拉成型線將封堵器完全鎖定,而后撤除成形線并完全釋放封堵器(圖1d)。超聲再次確認封堵器位置、形態無異常后,撤除輸送鞘,壓迫穿刺點,并繃帶加壓包扎。本次手術操作時間28 min。術后口服阿司匹林腸溶片100 mg/d抗血小板治療,服用6個月。術后第1 d復查超聲心動圖示:右心房、室較術前回縮,房間隔中部探及封堵器,位置形態良好,與周圍房間隔組織延續完整,無殘余分流。各瓣膜形態,結構,啟閉正常。住院時間3 d。
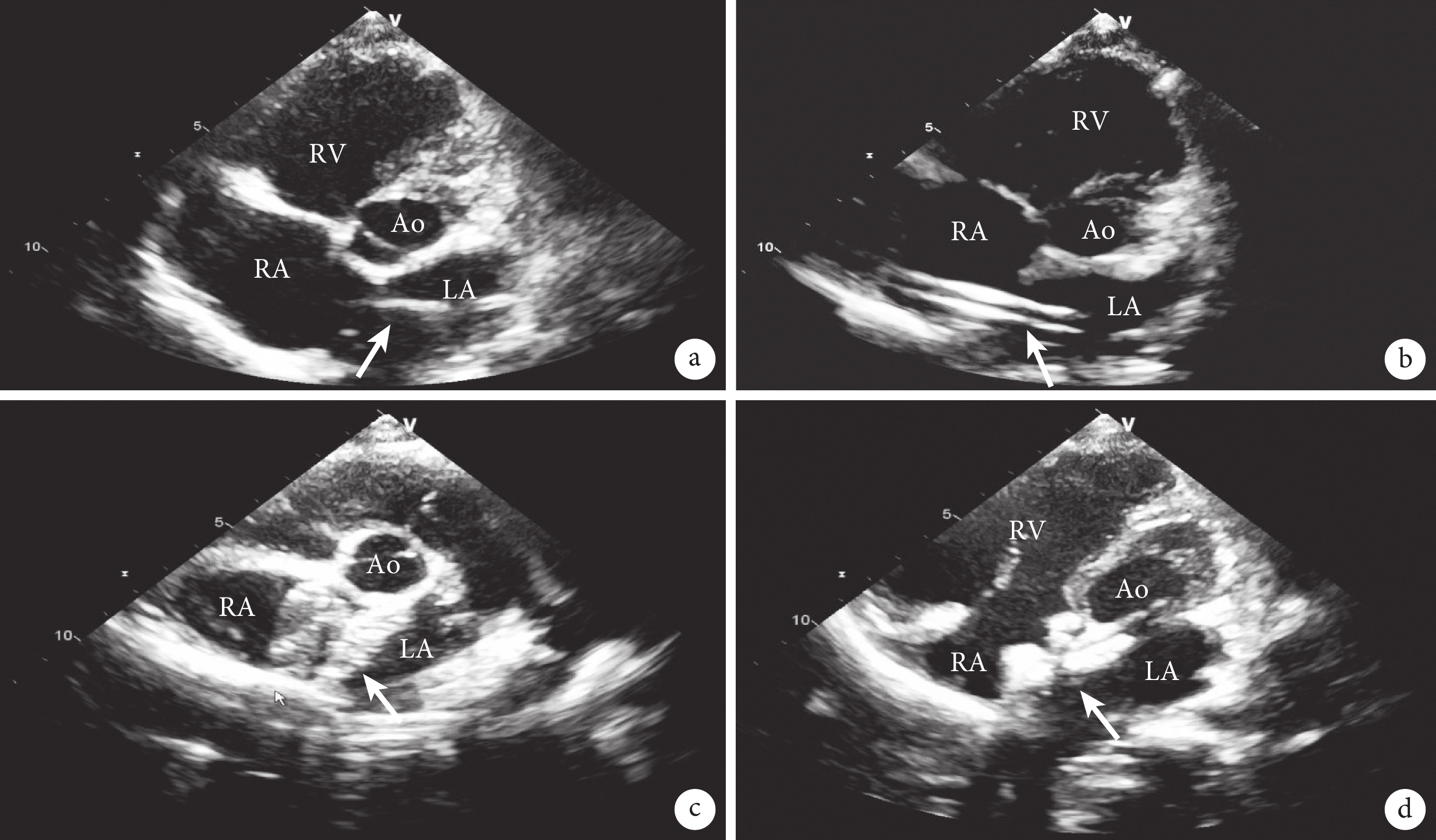 圖1
單純超聲引導完全可降解封堵器植入過程
圖1
單純超聲引導完全可降解封堵器植入過程
a:特硬導絲(箭頭所示)通過ASD;b:輸送鞘管(箭頭所示)通過ASD;c:封堵器(箭頭所示)鎖定前圖像;d:封堵器(箭頭所示)鎖定并釋放后圖像;Ao:主動脈;RA:右心房;LA:左心房;RV:右心室;LV:左心室
隨訪及轉歸:患者術后1個月(圖2)及6個月復查超聲心動圖:各房室內徑正常,房間隔中部探及封堵器,位置形態良好,與周圍房間隔組織延續完整,無殘余分流。各瓣膜形態、結構、啟閉正常。心電圖:竇性心律;正常心電圖。
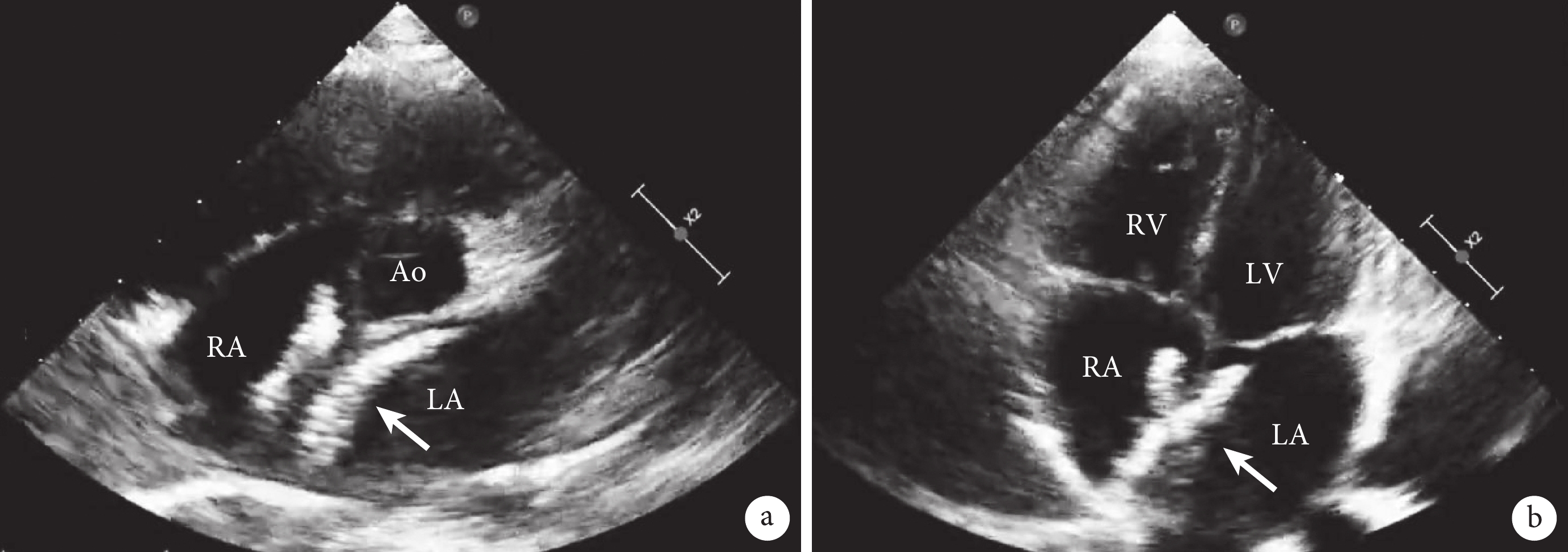 圖2
術后1月超聲復查結果
圖2
術后1月超聲復查結果
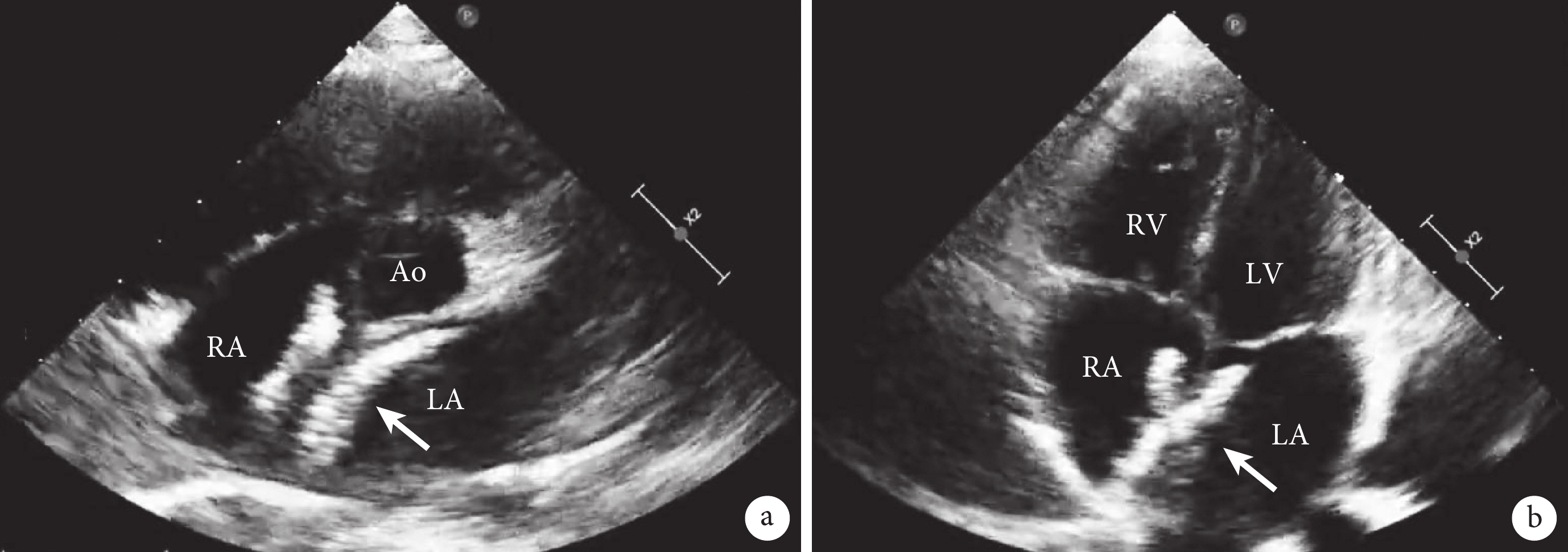
a:胸骨旁大動脈短軸切面顯示封堵器(箭頭所示);b:心尖四腔心切面顯示封堵器(箭頭所示);Ao:主動脈;RA:右心房;LA:左心房;RV:右心室;LV:左心室
本病例通過阜外醫院醫療新技術倫理委員會的批準,并獲得患者家屬的知情同意,術前簽署了知情同意書。
討論 ASD是先天性心臟病的一種,其發病率相對較高,約占所有先天性心臟病的6%~10%。大多數ASD患者在兒童期通常沒有癥狀,直到青春期時才發現心臟雜音、心臟增大或心電圖異常。這些異常的出現是顯著的左向右分流導致右心室容量負荷過重和肺血流量增加所致。如果不及時診斷和治療,ASD早期會有疲勞和運動不耐受等臨床表現,最終可能發展為肺動脈高壓和右心衰等[4]。ASD 均可以在常規開胸體外循環下修補,其中,約80%繼發孔型ASD能通過經皮介入封堵治療[5]。自1976年King等[6]報道首例經皮ASD封堵術以來,經過近50年的發展,目前經皮介入封堵已經成為解剖條件合適的ASD患者的首選治療方法[7]。介入治療不僅避免體外循環,大大降低創傷,而且手術及住院時間短,顯著降低住院費用。本例患者ASD有明確干預指征,但是患者家屬拒絕擇期外科手術,要求行介入治療且擔憂發生放射線損傷和主動脈磨蝕并發癥。而目前臨床所用的封堵器由鎳鈦合金制成,金屬封堵器機械壓迫會刺激房室結及其周圍組織,導致房室傳導阻滯、房性早搏等心律失常[8];此外,封堵術后金屬離子釋放誘導局部炎癥,進而導致血栓形成并脫落栓塞到腦部引起頭痛[9]。本例患者有金屬過敏史,且主動脈側無邊緣,屬于術后金屬過敏、主動脈磨蝕和心律失常等并發癥的高危人群,所以傳統介入治療方案亦不適合該患者,需使用新技術及新器械來克服上述并發癥。
近年來,隨著單純超聲引導介入技術的發展,諸如ASD、室間隔缺損、動脈導管未閉等10余種結構性心臟病均能在超聲引導下安全有效地開展[10-15],而可降解材料在超聲下顯影清晰,這為完全可降解封堵器的研發和臨床植入奠定了扎實的技術基礎。在解決“看得見”封堵器的關鍵問題后,本款完全可降解ASD封堵器為解決封堵器成形、降解速率和組織壓迫等問題,在設計上有如下創新:(1)使用力學性能好的聚二氧環己烷(PDO)制作骨架,使用降解速率較慢的聚乳酸(PLA)做為阻隔膜,既保證了支架的機械強度,又實現了在封堵器內皮化之前有效封堵ASD[16-17];(2)特制成形鎖扣結構設計,保證封堵器在釋放過程中左、右盤面緊貼房間隔,實現封堵器優異的成形效果;(3)左盤面單鉚設計,植入后左盤面更平整,有助于減少器械相關血栓形成,加快封堵器內皮化進程;(4)網狀編織結構的封堵器盤面柔軟,避免封堵器植入后對周邊組織造成磨損和侵蝕。
本例為單純超聲引導下完全可降解ASD封堵器植入治療金屬過敏兒童的首次臨床應用,該方法不僅避免了金屬過敏、放射線等醫源性損傷,還能最大程度降低主動脈磨蝕和心律失常等并發癥發生風險,而且封堵器降解后,最終轉化為二氧化碳和水排出體外,從而實現了“植入無殘留”的效果。盡管本例患者在半年隨訪時封堵效果良好,但由于封堵器完全降解時間在1~2年左右,長期隨訪仍然非常重要,特別需要關注缺損再通的潛在并發癥。
利益沖突:無。
作者貢獻:趙迎澳負責論文初稿撰寫;閆一鳴、李子平和李航負責數據收集、文獻檢索;潘湘斌、歐陽文斌、董靖負責手術;張鳳文、房芳、趙廣智、董靖和王闖世參與資料收集,負責患者及家屬的溝通及圍術期管理;王建德負責臨床影像學檢查;潘湘斌、歐陽文斌負責論文審閱。
由于其微創和低費用的優勢,經皮介入房間隔缺損(atrial septal defect,ASD)封堵術成為ASD的重要治療方法。但現有封堵器一般由鎳鈦合金制成,植入體內后可能會引發金屬過敏、頭痛、機械性壓迫造成心律失常等并發癥[1]。為克服上述并發癥,可降解封堵器成為近20年的研究熱點。但是,由于可降解材料在放射線下不顯影,第一代可降解封堵器都帶有顯影的金屬骨架,2006年,Mullen等[2]報道采用金屬骨架上被覆可降解基質制成的ASD封堵器,其近期臨床效果安全可行,但長期隨訪發現金屬支架磨蝕導致心臟穿孔的發生率較高,故該類部分可降解封堵器未能在臨床推廣應用。隨著材料學進步和影像學發展,國內多款完全可降解ASD封堵器進入臨床研究階段,取得滿意的近期臨床效果[3]。在本文中,我們報道1例單純超聲引導完全可降解封堵器經皮介入治療金屬過敏的兒童ASD患者。
臨床資料 患者,男,13歲,印裔美籍,因“發現心臟雜音2年余”入住中國醫學科學院阜外醫院。患者2年余前體檢發現心臟雜音,心臟超聲心動圖提示“先天性心臟病:房間隔缺損”。患者平素感冒不多,無心力衰竭史,無紫紺和暈厥史,有金屬過敏史,生長發育及活動量較正常同齡人無明顯差異。患者家屬拒絕擇期外科手術,有金屬過敏史,且擔心放射線損傷和主動脈磨蝕并發癥,受美國同行推薦來我院行超聲引導完全可降解封堵器植入術,門診以“先天性心臟病:房間隔缺損”于2023年5月30日收入結構性心臟病三病區。患兒自發病以來,精神狀況良好,睡眠和食欲正常,大小便正常,體重變化不明顯。
入院后體格檢查:左上肢血壓98/50 mm Hg,心律齊,心率81次/min,在胸骨左緣第2肋間聞及Ⅱ級收縮期吹風樣雜音,腹部觸診無異常,肝脾肋下不能觸及,雙下肢不水腫。經胸超聲心動圖示:房間隔總長42 mm,中部回聲脫失15 mm,主動脈側無邊緣,其對側8 mm,距二尖瓣12 mm,距上腔靜脈11 mm,距下腔靜脈18 mm,距冠狀靜脈竇 7 mm。右心房、右心室擴大,三尖瓣微量反流,左心室射血分數67%。患者“先天性心臟病:房間隔缺損”診斷明確,有干預指征,綜合家屬治療意愿及現有技術和器材條件,經結構性心臟病多學科團隊進一步評估后,擬在單純超聲引導下行完全可降解封堵器植入術。
手術在日間手術室進行,患者取仰臥位,基礎麻醉后常規消毒、鋪無菌孔單。右側股靜脈穿刺并置入6Fr血管鞘,工作距離是指穿刺點到右鎖骨中線第3肋間的距離,術前在導管及導絲上標記該距離。靜脈給予普通肝素100 U/kg。經血管鞘按術前標記送入特硬導絲和6Fr MPA2導管至右心房,而后調整導管方向將導絲送入左心房并予以保留(圖1a)。退出導管后測量導管在體內的深度,該深度作為輸送鞘管應置入體內的安全深度。退出血管鞘,沿特硬導絲置入14Fr輸送鞘至左心房(圖1b),退出導絲及輸送鞘內芯。選擇24 mm ASD完全可降解封堵器(上海形狀記憶合金材料有限公司,中國),沿輸送鞘管送入封堵器至左心房,釋放出左心房側傘盤時輕拉成型線,待封堵器成傘狀后使其緊貼房間隔,后撤輸送鞘釋放封堵器右心房側傘盤。封堵器安置成功后,經胸超聲確認封堵器對缺損周圍組織無影響,無殘余分流,塑形形態良好后(圖1c),拉成型線將封堵器完全鎖定,而后撤除成形線并完全釋放封堵器(圖1d)。超聲再次確認封堵器位置、形態無異常后,撤除輸送鞘,壓迫穿刺點,并繃帶加壓包扎。本次手術操作時間28 min。術后口服阿司匹林腸溶片100 mg/d抗血小板治療,服用6個月。術后第1 d復查超聲心動圖示:右心房、室較術前回縮,房間隔中部探及封堵器,位置形態良好,與周圍房間隔組織延續完整,無殘余分流。各瓣膜形態,結構,啟閉正常。住院時間3 d。
 圖1
單純超聲引導完全可降解封堵器植入過程
圖1
單純超聲引導完全可降解封堵器植入過程
a:特硬導絲(箭頭所示)通過ASD;b:輸送鞘管(箭頭所示)通過ASD;c:封堵器(箭頭所示)鎖定前圖像;d:封堵器(箭頭所示)鎖定并釋放后圖像;Ao:主動脈;RA:右心房;LA:左心房;RV:右心室;LV:左心室
隨訪及轉歸:患者術后1個月(圖2)及6個月復查超聲心動圖:各房室內徑正常,房間隔中部探及封堵器,位置形態良好,與周圍房間隔組織延續完整,無殘余分流。各瓣膜形態、結構、啟閉正常。心電圖:竇性心律;正常心電圖。
 圖2
術后1月超聲復查結果
圖2
術后1月超聲復查結果
a:胸骨旁大動脈短軸切面顯示封堵器(箭頭所示);b:心尖四腔心切面顯示封堵器(箭頭所示);Ao:主動脈;RA:右心房;LA:左心房;RV:右心室;LV:左心室
本病例通過阜外醫院醫療新技術倫理委員會的批準,并獲得患者家屬的知情同意,術前簽署了知情同意書。
討論 ASD是先天性心臟病的一種,其發病率相對較高,約占所有先天性心臟病的6%~10%。大多數ASD患者在兒童期通常沒有癥狀,直到青春期時才發現心臟雜音、心臟增大或心電圖異常。這些異常的出現是顯著的左向右分流導致右心室容量負荷過重和肺血流量增加所致。如果不及時診斷和治療,ASD早期會有疲勞和運動不耐受等臨床表現,最終可能發展為肺動脈高壓和右心衰等[4]。ASD 均可以在常規開胸體外循環下修補,其中,約80%繼發孔型ASD能通過經皮介入封堵治療[5]。自1976年King等[6]報道首例經皮ASD封堵術以來,經過近50年的發展,目前經皮介入封堵已經成為解剖條件合適的ASD患者的首選治療方法[7]。介入治療不僅避免體外循環,大大降低創傷,而且手術及住院時間短,顯著降低住院費用。本例患者ASD有明確干預指征,但是患者家屬拒絕擇期外科手術,要求行介入治療且擔憂發生放射線損傷和主動脈磨蝕并發癥。而目前臨床所用的封堵器由鎳鈦合金制成,金屬封堵器機械壓迫會刺激房室結及其周圍組織,導致房室傳導阻滯、房性早搏等心律失常[8];此外,封堵術后金屬離子釋放誘導局部炎癥,進而導致血栓形成并脫落栓塞到腦部引起頭痛[9]。本例患者有金屬過敏史,且主動脈側無邊緣,屬于術后金屬過敏、主動脈磨蝕和心律失常等并發癥的高危人群,所以傳統介入治療方案亦不適合該患者,需使用新技術及新器械來克服上述并發癥。
近年來,隨著單純超聲引導介入技術的發展,諸如ASD、室間隔缺損、動脈導管未閉等10余種結構性心臟病均能在超聲引導下安全有效地開展[10-15],而可降解材料在超聲下顯影清晰,這為完全可降解封堵器的研發和臨床植入奠定了扎實的技術基礎。在解決“看得見”封堵器的關鍵問題后,本款完全可降解ASD封堵器為解決封堵器成形、降解速率和組織壓迫等問題,在設計上有如下創新:(1)使用力學性能好的聚二氧環己烷(PDO)制作骨架,使用降解速率較慢的聚乳酸(PLA)做為阻隔膜,既保證了支架的機械強度,又實現了在封堵器內皮化之前有效封堵ASD[16-17];(2)特制成形鎖扣結構設計,保證封堵器在釋放過程中左、右盤面緊貼房間隔,實現封堵器優異的成形效果;(3)左盤面單鉚設計,植入后左盤面更平整,有助于減少器械相關血栓形成,加快封堵器內皮化進程;(4)網狀編織結構的封堵器盤面柔軟,避免封堵器植入后對周邊組織造成磨損和侵蝕。
本例為單純超聲引導下完全可降解ASD封堵器植入治療金屬過敏兒童的首次臨床應用,該方法不僅避免了金屬過敏、放射線等醫源性損傷,還能最大程度降低主動脈磨蝕和心律失常等并發癥發生風險,而且封堵器降解后,最終轉化為二氧化碳和水排出體外,從而實現了“植入無殘留”的效果。盡管本例患者在半年隨訪時封堵效果良好,但由于封堵器完全降解時間在1~2年左右,長期隨訪仍然非常重要,特別需要關注缺損再通的潛在并發癥。
利益沖突:無。
作者貢獻:趙迎澳負責論文初稿撰寫;閆一鳴、李子平和李航負責數據收集、文獻檢索;潘湘斌、歐陽文斌、董靖負責手術;張鳳文、房芳、趙廣智、董靖和王闖世參與資料收集,負責患者及家屬的溝通及圍術期管理;王建德負責臨床影像學檢查;潘湘斌、歐陽文斌負責論文審閱。