隨著人口的老齡化,我國退行性主動脈瓣患者數明顯增加[1]。外科主動脈瓣手術仍是治療主動脈瓣疾病的金標準。盡管技術不斷改進,傳統的正中胸骨切開仍會帶來相當大的醫源性負擔。在過去的十幾年中,微創主動脈瓣手術變得越來越受歡迎,其通過右側胸骨旁小切口代替了胸骨正中切口,具有手術創傷更小、患者住院時間更短、恢復完全活動更快的優勢[2-4]。然而國內右前小切口微創主動脈瓣手術起步較晚,普及程度不高,仍需要更多的研究來對比分析其與正中切口的優劣。本文回顧性分析了我院接受單純主動脈瓣手術患者的臨床資料,采用傾向性評分匹配分析的方法比較兩種術式的臨床療效,旨在探討右前小切口手術方式的安全性和有效性,為推廣微創主動脈瓣手術提供臨床經驗。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2021年5月—2023年8月于我院行單純主動脈瓣置換術的患者。均通過超聲心動圖測量主動脈瓣反流束長度、寬度、面積及反流分數,確診主動脈瓣關閉不全的程度為中重度以上。納入標準:(1)首次行心臟手術;(2)單純主動脈瓣疾病患者(主動脈瓣關閉不全),無其他瓣膜病變、冠脈病變或升主動脈病變;(3)紐約心臟協會(New York Heart Association,NYHA)心功能分級Ⅲ級及以上;(4)既往無右側胸壁外傷、手術及放射治療史;(5)髂動脈、腹主動脈及股動脈無嚴重畸形。排除標準:(1)急診手術或二次心臟手術或合并其他結構性心臟病;(2)胸廓畸形、極度胸膜粘連或極度肥胖(體重指數>30 kg/m2);(3)嚴重慢性阻塞性肺疾病、肺纖維化或既往行肺部手術;(4)心功能明顯下降者,左心室射血分數(left ventricular ejection fraction,LVEF)<30%;(5)伴有嚴重的肝腎基礎疾病;(6)心室撲動或心室顫動或重度房室傳導阻滯等嚴重心律失常;(7)進行性低血壓、休克、急性心力衰竭、心肌梗死、意識障礙等血流動力學不穩定的患者。
根據手術方式將患者分為微創組和正中切口組。微創組以前20例手術作為手術學習的第1階段,之后為手術學習的第2階段,比較兩階段的手術時間、體外循環時間及主動脈阻斷時間。
1.2 手術方法
1.2.1 微創組手術方法
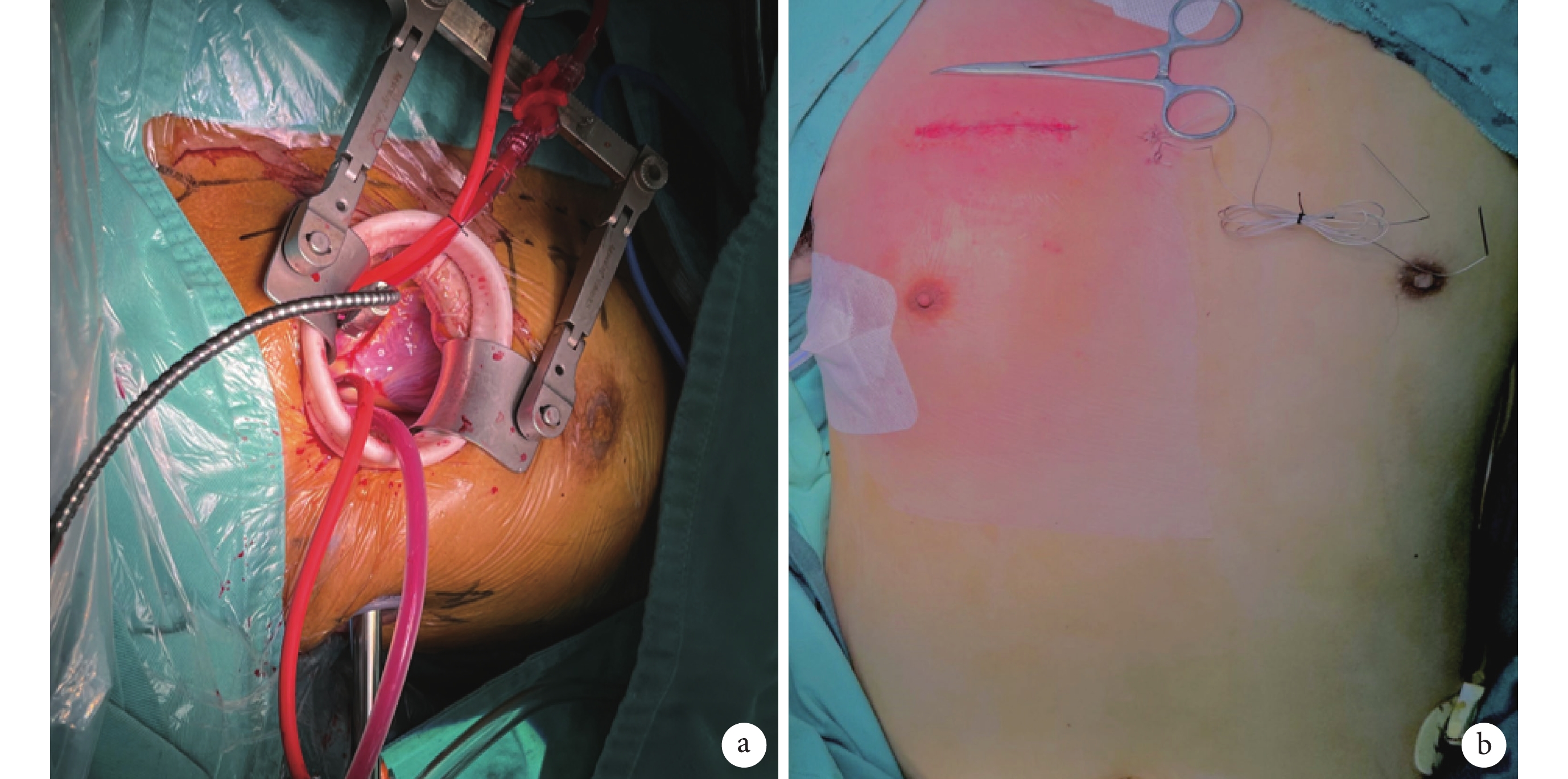
患者取仰臥位,右側墊高,全身麻醉成功后,置雙腔氣管內插管,術中保證右側肺部塌陷,常規心電、有創動靜脈壓力監測,必要時Swan-Ganz漂浮導管監測心排血量等指標,連接體外自動除顫儀。常規消毒鋪巾后,暴露胸部及雙側腹股溝區,先行腹股溝切口,游離股動靜脈,全身肝素化后,經股動靜脈建立外周體外循環,同時經胸骨旁第2肋間直切口長約6~8 cm,逐層切開皮下組織、肌肉及胸膜進入胸腔。置入切口保護套,利用肋間牽開器顯露手術視野,于膈神經上方2 cm切開心包,充分懸吊心包,顯露主動脈根部。經右上肺靜脈插管行左心引流。轉流降溫,術區持續吹入二氧化碳,阻斷升主動脈,橫行切口切開升主動脈,直視下經左右冠開口分別順行性灌注心肌保護液。心臟停跳滿意后,探查并切除病變主動脈瓣瓣葉,間斷褥式縫合置入人工主動脈瓣,落座打結,測試瓣膜開啟關閉功能正常,探查左右冠脈開口無阻擋。復溫,水平連續褥式+單純連續雙層縫合關閉主動脈切口。頭低位,左心及主動脈根部充分排氣,右室表面放置臨時起搏電極,開放升主動脈,心臟自動復跳。調整血管活性藥物劑量,漸減體外循環流量至停機。魚精蛋白中和肝素,逐次拔除股動靜脈插管。徹底止血,敞開心包腔,放置右側胸腔引流管,逐層縫合關閉胸部切口及腹股溝切口;見圖1。
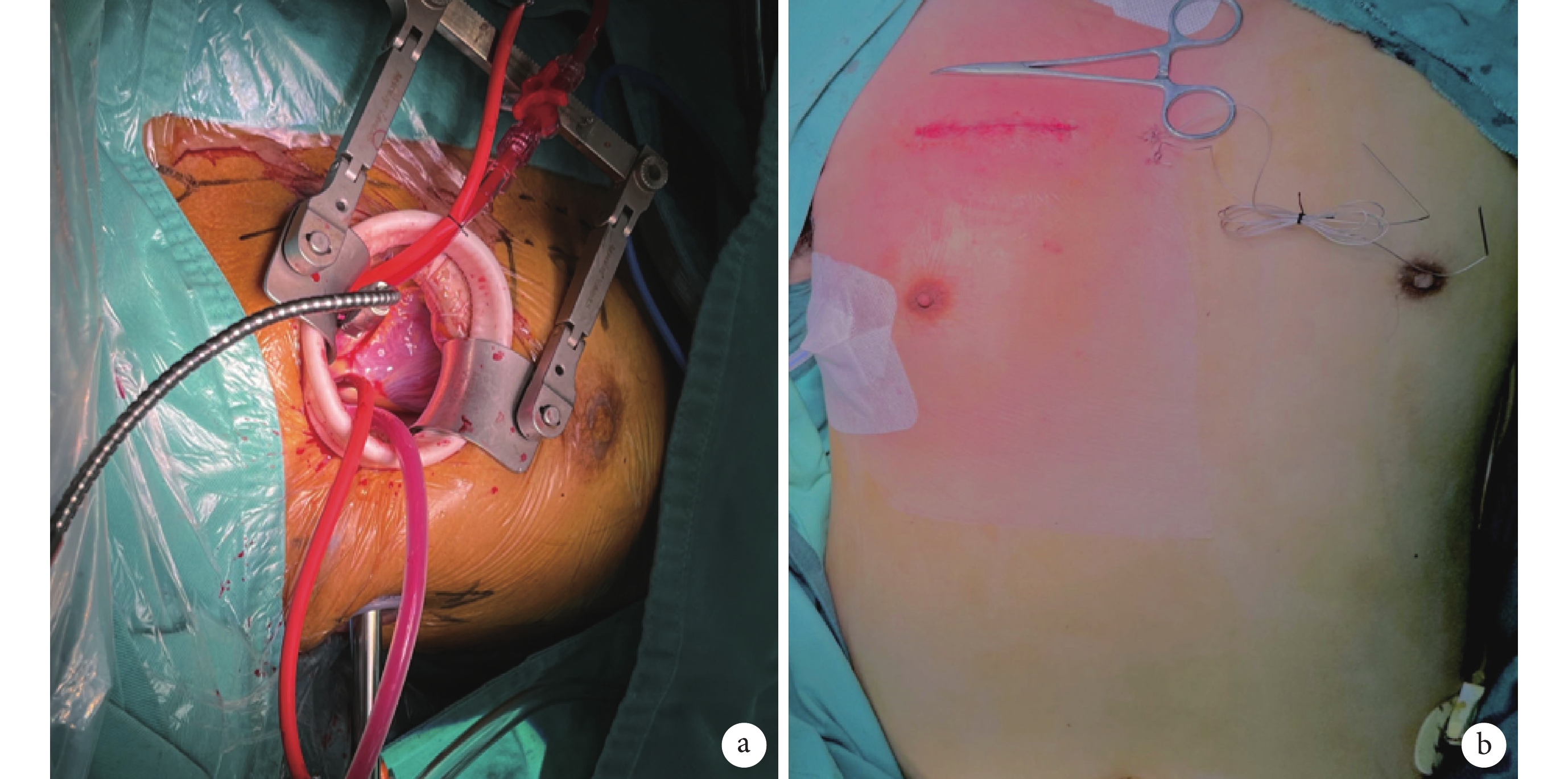 圖1
患者手術示意
圖1
患者手術示意
a:經右前第2肋間手術切口直視下操作;b:術后效果圖
1.2.2 正中切口組手術方法
全身麻醉后采用平臥位。正中劈開胸骨并左右撐開,切開并懸吊心包,經升主動脈及上下腔靜脈建立體外循環,切開主動脈完成主動脈瓣置換,縫合主動脈切口,放置縱隔及心包引流管,固定胸骨,縫合切口。
1.3 觀察指標
收集兩組患者術前臨床基線資料如性別、年齡、體重指數、吸煙史、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等基礎疾病。記錄兩組患者圍手術期資料,包括手術時間、體外循環時間、主動脈阻斷時間、出血量、術后24 h引流量、呼吸機使用時間、ICU停留時間、術后住院時間等。此外還收集了圍手術期各種并發癥的發生情況,包括新發房顫、新發腎功能不全,切口愈合不良、氣胸或胸腔積液和輸血、任何原因導致的二次手術率、主動脈球囊反搏(intra-aortic balloon pump,IABP)植入、體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)植入率、術后主要心腦血管不良事件(major adverse cardiac and cerebrovascular event,MACCE)等。MACCE主要包括圍術期心肌梗死、圍術期腦卒中、惡性心律失常、心率衰竭和心源性猝死等。
1.4 統計學分析
采用 SPSS 26.0軟件進行統計學分析。計量資料符合正態分布的采用均數±標準差(x±s)描述,組間比較采用t檢驗;偏態分布的資料采用中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用秩和檢驗;分類資料采用例數(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。為去除混雜因素,本研究將微創組和正中切口組的術前臨床資料按照傾向性評分匹配的方法進行1∶1配對,卡鉗值選擇0.05[5]。通過logistic回歸分析建立傾向性評分模型。P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過阜外華中心血管病醫院科研與新技術、新業務倫理委員會審查,編號:(2020)倫審第(7)號。
2 結果
2.1 兩組患者基線臨床資料比較
共納入患者186例。微創組共58例,其中男46例(79.3%),平均年齡(52.0±14.1)歲,正中切口組共128例,其中男87例(67.4%),平均年齡(60.0±12.4)歲。傾向性評分匹配前兩組患者年齡、高血壓、左室舒張末期內徑和LVEF差異有統計學意義(P均<0.05)。
以兩組患者術前資料為匹配因素,按照1∶1的比例通過傾向性評分匹配后,兩組各得到51例,匹配后兩組患者術前資料差異均無統計學意義(P均>0.05);見表1。
2.2 兩組患者圍術期情況比較
匹配后的兩組患者圍術期資料對比顯示,微創組手術時間、體外循環時間及主動脈阻斷時間長于正中切口組(P均<0.001),但微創組術后24 h引流量較正中切口組少(P=0.006),呼吸機使用時間(P=0.014)、ICU停留時間(P=0.025)、術后住院時間(P=0.004)較正中切口組短。微創組無中轉開胸手術。兩組匹配病例均無住院死亡、腦卒中、心肌梗死、腎功能衰竭等并發癥。微創組患者有1例因Ⅲ度房室傳導阻滯而植入永久起搏器,兩組患者各有1例因出血進行二次手術。微創組患者有1例因術中體外循環撤離后循環不能維持而置入ECMO,正中切口組患者有2例因術后出現血壓低、心功能差而置入IABP。雖然微創組在輸血、新發房顫、切口愈合不良和IABP 使用率方面低于正中切口組,胸腔積液發生率高于正中切口組,但兩組差異均無統計學意義(P>0.05);見表2、3。
2.3 微創組不同階段手術時間的比較
微創組兩階段手術資料對比顯示,微創組第2階段手術時間、體外循環時間及主動脈阻斷時間均較第1階段縮短(P均<0.05);見表4。
3 討論
新技術的發展、手術和麻醉技術的改進使微創心臟手術成為一種安全有效的治療方式,患者需求越來越大要。由于主動脈瓣的位置偏向胸骨右側且距離胸骨較近,右側肋間小切口的手術方式得以發展。國外已有多篇文獻[6-8]報道,右側肋間小切口與傳統正中切口相比,其術后輸血及房顫發生率更低,機械通氣時間及術后住院時間更短,且遠期療效相近。然而,微創主動脈瓣手術技術難度相對較大,需要一定的技術學習曲線,并且初學者對安全性、手術風險及成本增加的擔憂一定程度阻礙了微創主動脈瓣技術在國內的普及。
國內研究[9-12]結果表明,與正中切口相比,右前小切口主動脈瓣置換術能夠減少術中出血量及術后24 h引流量、縮短機械通氣及術后住院時間,但同時也延長了主動脈阻斷時間以及體外循環時間。然而,這些研究都是回顧性對比研究。為了排除混雜因素的影響,更加真實地對比兩種不同的手術入路對術前臨床基線水平相同患者的影響,本研究采用了傾向性評分匹配方法按照1∶1的比例對兩組患者的術前臨床資料進行了匹配。匹配后的結果顯示,微創組手術時間、體外循環時間及主動脈阻斷時間較長,而呼吸機使用時間、ICU停留時間以及術后住院時間短于正中切口組。此外,微創組術后24 h引流量明顯減少。微創組的輸血需求也更少,但兩組差異無統計學意義。微創組手術學習的第1階段由于操作流程未固定,手術時間相對較長,同時肋間小切口的狹窄視野增加了手術的操作難度及止血難度,延長了手術時間。而隨著手術流程的固定,器械操作的熟練,手術時間逐漸處于可控范圍內。手術時間和體外循環時間的延長體現了手術部位的暴露和人工瓣膜植入更具有挑戰性,但微創組并未增加不良結局的風險,這與國外的研究[13]保持一致。隨著手術經驗的積累,程序化的操作流程以及免縫合主動脈瓣技術的應用[14],手術時間有可能進一步縮短。既往研究[15]表明,盡管微創心臟手術的體外循環時間更長,但是微創組患者的肺功能恢復得更快。微創組的患者由于較小的切口、胸骨的保留和肋軟骨的完整性將減少術后疼痛,改善呼吸功能。而胸廓的穩定性增加和胸腔的完整性使患者能夠更早地活動和更有效地咳嗽。此外,微創組呼吸機使用時間及ICU停留時間縮短的另一個可能原因是ICU團隊的護理心態,由于切口小,他們有意無意地對微創組患者進行不同的治療,包括減少輸血、早期拔管和加速轉出ICU等。
國外有研究[16]提出了微創心臟手術可能會增加術后腦卒中的風險,主要歸因于降主動脈中的逆向血流灌注難以徹底清洗心腔,或是體外循環時間較長。而在一些傾向性匹配研究[17-19]中,微創心臟手術的腦卒中發生率并無明顯差異。在Seitz等[20]的研究中,逆行性灌注被認為是老年患者術后腦卒中的獨立危險因素,更推薦沒有血管疾病的年輕患者采用這種方式。由于升主動脈及股動脈的嚴重動脈粥樣硬化可能會出現斑塊脫落導致血管栓塞的并發癥,影響手術的安全性,因此我們建議對所有具有動脈粥樣硬化高危因素的患者進行主動脈和股動脈的CT血管造影檢查,必要時可以考慮升主動脈或腋動脈插管等替代插管方式。
右前小切口的手術方式可能會對一些特定患者人群有益。Pojar等[21]的研究表明,在COPD患者中,肋間切口比正中切口手術具有更低的并發癥發生率及死亡率。Chivasso[22]則研究了老年人行肋間切口微創心臟手術的MACCE發生率與正中切口相比并無明顯差異。由于保留了患者的胸骨及胸廓的完整性,患者疼痛更輕,且能夠更好地自由活動[23]。Abud等[24]的研究表明在肥胖人群中,肋間小切口降低了胸骨深部傷口感染的風險。由于微創心臟手術需要使用一些特殊器械,這可能給患者帶來了額外的花費,但是微創手術與更短的呼吸機使用時間、ICU停留時間以及更少的血液制品用量有關,這些節省的費用可以抵消手術費用,從而使微創主動脈瓣置換術可以與傳統正中開胸手術保持相近甚至更低的成本,這也與顏磊等[9]的研究保持了一致。
微創主動脈瓣手術應當遵循4個基本原則[25]:(1)充分暴露操作視野;(2)建立和維持適當的插管及灌注;(3)完善的心肌保護;(4)適合患者個體化疾病的流程。微創組患者中有1例因低心排血量綜合征而植入ECMO,這可能是心臟循環阻斷期間的缺血、缺氧對心肌造成了損害,致使心肌收縮功能不全。因此在微創手術延長了體外循環時間的情況下,完善的心肌保護尤其重要。此外,右側肋間小切口由于手術區域較深,暴漏和操作空間有限,對術者的技術提出了更高的要求,需要一定的學習曲線。而Murzi等[22]評估了單個外科醫生該手術的學習曲線,證明外科醫生初始經驗積累中不會增加額外的手術風險,應當鼓勵和進一步調整右前小切口的手術方法。初學者應當慎重選擇患者對象[9, 26],充分考慮完整手術流程,注重心肌保護,快速流暢地完成手術操作,以保證患者安全及達到手術目的。心臟外科醫生也無需過度畏懼微創心臟手術,應當不斷完善并發展微創手術技術,從而給患者帶來更多的收益。
本研究存在一定的局限性,為單中心回顧性研究,病例數較少,且微創手術患者的選擇仍可能具有一定的人為偏倚。我們期待多中心、更大樣本量、更長隨訪時間的研究來進一步驗證右前小切口主動脈瓣手術的臨床價值。
綜上所述,右側第2肋間小切口主動脈瓣手術安全有效,與傳統正中開胸手術相比具有創傷更小、恢復更快、術后引流量更少、住院時間更短的優勢,值得進一步推廣。
利益沖突:無。
作者貢獻:趙澤原負責論文設計、初稿撰寫;崔晨藝、李嘉輝負責數據收集、整理和分析;王圣實施手術、協助患者管理;陳現杰負責撰寫手術步驟、收集圖片;李昭及齊振昌負責論文總體設想和撰寫修改;程兆云負責論文審閱和經費支持。
隨著人口的老齡化,我國退行性主動脈瓣患者數明顯增加[1]。外科主動脈瓣手術仍是治療主動脈瓣疾病的金標準。盡管技術不斷改進,傳統的正中胸骨切開仍會帶來相當大的醫源性負擔。在過去的十幾年中,微創主動脈瓣手術變得越來越受歡迎,其通過右側胸骨旁小切口代替了胸骨正中切口,具有手術創傷更小、患者住院時間更短、恢復完全活動更快的優勢[2-4]。然而國內右前小切口微創主動脈瓣手術起步較晚,普及程度不高,仍需要更多的研究來對比分析其與正中切口的優劣。本文回顧性分析了我院接受單純主動脈瓣手術患者的臨床資料,采用傾向性評分匹配分析的方法比較兩種術式的臨床療效,旨在探討右前小切口手術方式的安全性和有效性,為推廣微創主動脈瓣手術提供臨床經驗。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2021年5月—2023年8月于我院行單純主動脈瓣置換術的患者。均通過超聲心動圖測量主動脈瓣反流束長度、寬度、面積及反流分數,確診主動脈瓣關閉不全的程度為中重度以上。納入標準:(1)首次行心臟手術;(2)單純主動脈瓣疾病患者(主動脈瓣關閉不全),無其他瓣膜病變、冠脈病變或升主動脈病變;(3)紐約心臟協會(New York Heart Association,NYHA)心功能分級Ⅲ級及以上;(4)既往無右側胸壁外傷、手術及放射治療史;(5)髂動脈、腹主動脈及股動脈無嚴重畸形。排除標準:(1)急診手術或二次心臟手術或合并其他結構性心臟病;(2)胸廓畸形、極度胸膜粘連或極度肥胖(體重指數>30 kg/m2);(3)嚴重慢性阻塞性肺疾病、肺纖維化或既往行肺部手術;(4)心功能明顯下降者,左心室射血分數(left ventricular ejection fraction,LVEF)<30%;(5)伴有嚴重的肝腎基礎疾病;(6)心室撲動或心室顫動或重度房室傳導阻滯等嚴重心律失常;(7)進行性低血壓、休克、急性心力衰竭、心肌梗死、意識障礙等血流動力學不穩定的患者。
根據手術方式將患者分為微創組和正中切口組。微創組以前20例手術作為手術學習的第1階段,之后為手術學習的第2階段,比較兩階段的手術時間、體外循環時間及主動脈阻斷時間。
1.2 手術方法
1.2.1 微創組手術方法
患者取仰臥位,右側墊高,全身麻醉成功后,置雙腔氣管內插管,術中保證右側肺部塌陷,常規心電、有創動靜脈壓力監測,必要時Swan-Ganz漂浮導管監測心排血量等指標,連接體外自動除顫儀。常規消毒鋪巾后,暴露胸部及雙側腹股溝區,先行腹股溝切口,游離股動靜脈,全身肝素化后,經股動靜脈建立外周體外循環,同時經胸骨旁第2肋間直切口長約6~8 cm,逐層切開皮下組織、肌肉及胸膜進入胸腔。置入切口保護套,利用肋間牽開器顯露手術視野,于膈神經上方2 cm切開心包,充分懸吊心包,顯露主動脈根部。經右上肺靜脈插管行左心引流。轉流降溫,術區持續吹入二氧化碳,阻斷升主動脈,橫行切口切開升主動脈,直視下經左右冠開口分別順行性灌注心肌保護液。心臟停跳滿意后,探查并切除病變主動脈瓣瓣葉,間斷褥式縫合置入人工主動脈瓣,落座打結,測試瓣膜開啟關閉功能正常,探查左右冠脈開口無阻擋。復溫,水平連續褥式+單純連續雙層縫合關閉主動脈切口。頭低位,左心及主動脈根部充分排氣,右室表面放置臨時起搏電極,開放升主動脈,心臟自動復跳。調整血管活性藥物劑量,漸減體外循環流量至停機。魚精蛋白中和肝素,逐次拔除股動靜脈插管。徹底止血,敞開心包腔,放置右側胸腔引流管,逐層縫合關閉胸部切口及腹股溝切口;見圖1。
 圖1
患者手術示意
圖1
患者手術示意
a:經右前第2肋間手術切口直視下操作;b:術后效果圖
1.2.2 正中切口組手術方法
全身麻醉后采用平臥位。正中劈開胸骨并左右撐開,切開并懸吊心包,經升主動脈及上下腔靜脈建立體外循環,切開主動脈完成主動脈瓣置換,縫合主動脈切口,放置縱隔及心包引流管,固定胸骨,縫合切口。
1.3 觀察指標
收集兩組患者術前臨床基線資料如性別、年齡、體重指數、吸煙史、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等基礎疾病。記錄兩組患者圍手術期資料,包括手術時間、體外循環時間、主動脈阻斷時間、出血量、術后24 h引流量、呼吸機使用時間、ICU停留時間、術后住院時間等。此外還收集了圍手術期各種并發癥的發生情況,包括新發房顫、新發腎功能不全,切口愈合不良、氣胸或胸腔積液和輸血、任何原因導致的二次手術率、主動脈球囊反搏(intra-aortic balloon pump,IABP)植入、體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)植入率、術后主要心腦血管不良事件(major adverse cardiac and cerebrovascular event,MACCE)等。MACCE主要包括圍術期心肌梗死、圍術期腦卒中、惡性心律失常、心率衰竭和心源性猝死等。
1.4 統計學分析
采用 SPSS 26.0軟件進行統計學分析。計量資料符合正態分布的采用均數±標準差(x±s)描述,組間比較采用t檢驗;偏態分布的資料采用中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用秩和檢驗;分類資料采用例數(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。為去除混雜因素,本研究將微創組和正中切口組的術前臨床資料按照傾向性評分匹配的方法進行1∶1配對,卡鉗值選擇0.05[5]。通過logistic回歸分析建立傾向性評分模型。P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過阜外華中心血管病醫院科研與新技術、新業務倫理委員會審查,編號:(2020)倫審第(7)號。
2 結果
2.1 兩組患者基線臨床資料比較
共納入患者186例。微創組共58例,其中男46例(79.3%),平均年齡(52.0±14.1)歲,正中切口組共128例,其中男87例(67.4%),平均年齡(60.0±12.4)歲。傾向性評分匹配前兩組患者年齡、高血壓、左室舒張末期內徑和LVEF差異有統計學意義(P均<0.05)。
以兩組患者術前資料為匹配因素,按照1∶1的比例通過傾向性評分匹配后,兩組各得到51例,匹配后兩組患者術前資料差異均無統計學意義(P均>0.05);見表1。
2.2 兩組患者圍術期情況比較
匹配后的兩組患者圍術期資料對比顯示,微創組手術時間、體外循環時間及主動脈阻斷時間長于正中切口組(P均<0.001),但微創組術后24 h引流量較正中切口組少(P=0.006),呼吸機使用時間(P=0.014)、ICU停留時間(P=0.025)、術后住院時間(P=0.004)較正中切口組短。微創組無中轉開胸手術。兩組匹配病例均無住院死亡、腦卒中、心肌梗死、腎功能衰竭等并發癥。微創組患者有1例因Ⅲ度房室傳導阻滯而植入永久起搏器,兩組患者各有1例因出血進行二次手術。微創組患者有1例因術中體外循環撤離后循環不能維持而置入ECMO,正中切口組患者有2例因術后出現血壓低、心功能差而置入IABP。雖然微創組在輸血、新發房顫、切口愈合不良和IABP 使用率方面低于正中切口組,胸腔積液發生率高于正中切口組,但兩組差異均無統計學意義(P>0.05);見表2、3。
2.3 微創組不同階段手術時間的比較
微創組兩階段手術資料對比顯示,微創組第2階段手術時間、體外循環時間及主動脈阻斷時間均較第1階段縮短(P均<0.05);見表4。
3 討論
新技術的發展、手術和麻醉技術的改進使微創心臟手術成為一種安全有效的治療方式,患者需求越來越大要。由于主動脈瓣的位置偏向胸骨右側且距離胸骨較近,右側肋間小切口的手術方式得以發展。國外已有多篇文獻[6-8]報道,右側肋間小切口與傳統正中切口相比,其術后輸血及房顫發生率更低,機械通氣時間及術后住院時間更短,且遠期療效相近。然而,微創主動脈瓣手術技術難度相對較大,需要一定的技術學習曲線,并且初學者對安全性、手術風險及成本增加的擔憂一定程度阻礙了微創主動脈瓣技術在國內的普及。
國內研究[9-12]結果表明,與正中切口相比,右前小切口主動脈瓣置換術能夠減少術中出血量及術后24 h引流量、縮短機械通氣及術后住院時間,但同時也延長了主動脈阻斷時間以及體外循環時間。然而,這些研究都是回顧性對比研究。為了排除混雜因素的影響,更加真實地對比兩種不同的手術入路對術前臨床基線水平相同患者的影響,本研究采用了傾向性評分匹配方法按照1∶1的比例對兩組患者的術前臨床資料進行了匹配。匹配后的結果顯示,微創組手術時間、體外循環時間及主動脈阻斷時間較長,而呼吸機使用時間、ICU停留時間以及術后住院時間短于正中切口組。此外,微創組術后24 h引流量明顯減少。微創組的輸血需求也更少,但兩組差異無統計學意義。微創組手術學習的第1階段由于操作流程未固定,手術時間相對較長,同時肋間小切口的狹窄視野增加了手術的操作難度及止血難度,延長了手術時間。而隨著手術流程的固定,器械操作的熟練,手術時間逐漸處于可控范圍內。手術時間和體外循環時間的延長體現了手術部位的暴露和人工瓣膜植入更具有挑戰性,但微創組并未增加不良結局的風險,這與國外的研究[13]保持一致。隨著手術經驗的積累,程序化的操作流程以及免縫合主動脈瓣技術的應用[14],手術時間有可能進一步縮短。既往研究[15]表明,盡管微創心臟手術的體外循環時間更長,但是微創組患者的肺功能恢復得更快。微創組的患者由于較小的切口、胸骨的保留和肋軟骨的完整性將減少術后疼痛,改善呼吸功能。而胸廓的穩定性增加和胸腔的完整性使患者能夠更早地活動和更有效地咳嗽。此外,微創組呼吸機使用時間及ICU停留時間縮短的另一個可能原因是ICU團隊的護理心態,由于切口小,他們有意無意地對微創組患者進行不同的治療,包括減少輸血、早期拔管和加速轉出ICU等。
國外有研究[16]提出了微創心臟手術可能會增加術后腦卒中的風險,主要歸因于降主動脈中的逆向血流灌注難以徹底清洗心腔,或是體外循環時間較長。而在一些傾向性匹配研究[17-19]中,微創心臟手術的腦卒中發生率并無明顯差異。在Seitz等[20]的研究中,逆行性灌注被認為是老年患者術后腦卒中的獨立危險因素,更推薦沒有血管疾病的年輕患者采用這種方式。由于升主動脈及股動脈的嚴重動脈粥樣硬化可能會出現斑塊脫落導致血管栓塞的并發癥,影響手術的安全性,因此我們建議對所有具有動脈粥樣硬化高危因素的患者進行主動脈和股動脈的CT血管造影檢查,必要時可以考慮升主動脈或腋動脈插管等替代插管方式。
右前小切口的手術方式可能會對一些特定患者人群有益。Pojar等[21]的研究表明,在COPD患者中,肋間切口比正中切口手術具有更低的并發癥發生率及死亡率。Chivasso[22]則研究了老年人行肋間切口微創心臟手術的MACCE發生率與正中切口相比并無明顯差異。由于保留了患者的胸骨及胸廓的完整性,患者疼痛更輕,且能夠更好地自由活動[23]。Abud等[24]的研究表明在肥胖人群中,肋間小切口降低了胸骨深部傷口感染的風險。由于微創心臟手術需要使用一些特殊器械,這可能給患者帶來了額外的花費,但是微創手術與更短的呼吸機使用時間、ICU停留時間以及更少的血液制品用量有關,這些節省的費用可以抵消手術費用,從而使微創主動脈瓣置換術可以與傳統正中開胸手術保持相近甚至更低的成本,這也與顏磊等[9]的研究保持了一致。
微創主動脈瓣手術應當遵循4個基本原則[25]:(1)充分暴露操作視野;(2)建立和維持適當的插管及灌注;(3)完善的心肌保護;(4)適合患者個體化疾病的流程。微創組患者中有1例因低心排血量綜合征而植入ECMO,這可能是心臟循環阻斷期間的缺血、缺氧對心肌造成了損害,致使心肌收縮功能不全。因此在微創手術延長了體外循環時間的情況下,完善的心肌保護尤其重要。此外,右側肋間小切口由于手術區域較深,暴漏和操作空間有限,對術者的技術提出了更高的要求,需要一定的學習曲線。而Murzi等[22]評估了單個外科醫生該手術的學習曲線,證明外科醫生初始經驗積累中不會增加額外的手術風險,應當鼓勵和進一步調整右前小切口的手術方法。初學者應當慎重選擇患者對象[9, 26],充分考慮完整手術流程,注重心肌保護,快速流暢地完成手術操作,以保證患者安全及達到手術目的。心臟外科醫生也無需過度畏懼微創心臟手術,應當不斷完善并發展微創手術技術,從而給患者帶來更多的收益。
本研究存在一定的局限性,為單中心回顧性研究,病例數較少,且微創手術患者的選擇仍可能具有一定的人為偏倚。我們期待多中心、更大樣本量、更長隨訪時間的研究來進一步驗證右前小切口主動脈瓣手術的臨床價值。
綜上所述,右側第2肋間小切口主動脈瓣手術安全有效,與傳統正中開胸手術相比具有創傷更小、恢復更快、術后引流量更少、住院時間更短的優勢,值得進一步推廣。
利益沖突:無。
作者貢獻:趙澤原負責論文設計、初稿撰寫;崔晨藝、李嘉輝負責數據收集、整理和分析;王圣實施手術、協助患者管理;陳現杰負責撰寫手術步驟、收集圖片;李昭及齊振昌負責論文總體設想和撰寫修改;程兆云負責論文審閱和經費支持。