對于累及主動脈弓部的夾層、動脈瘤等病變,主流的外科開胸手術治療仍有較高的手術風險及并發癥發生率[1]。近年來,腔內修復及雜交手術技術快速發展,已經逐漸成為治療主動脈弓部疾病的重要術式[2-3]。但常規技術仍限于將主動脈支架頭端置于Z2區,對于錨定區需前移到Z1區的病變行介入治療,需要重建左頸總動脈(left common carotid artery,LCCA)及左鎖骨下動脈(left subclavian artery,LSA)2個分支,其最佳方案仍在探索中,目前尚無標準術式。我中心使用Castor單分支支架(上海微創公司),將支架分支置入LCCA,以雜交技術重建LSA血供,治療近端錨定區不足的主動脈弓部病變患者,取得良好效果,現報道如下。
1 資料與方法
1.1 臨床資料
回顧性分析2020年8月—2023年11月南京大學醫學院附屬鼓樓醫院心臟外科收治的采用Castor支架聯合頸鎖轉流治療的主動脈弓部病變患者的臨床資料。所有患者術前均經計算機斷層掃描血管造影(computed tomographic angiography,CTA)確診,其DICOM文件導入Endosize工作站(Therenva SAS,Rennes,France)以評估病變。分別測量主動脈弓部病變近端至LCCA及頭臂干動脈(brachiocephalic trunk artery,BTA)開口遠端的距離(L1、L2),近遠端錨定區主動脈真腔直徑(D1、D2)及LCCA直徑(D3)。納入標準:(1)主動脈夾層或主動脈弓部瘤,L1<15 mm;(2)D1<40 mm;(3)L2>15 mm;(4)D3在6~12 mm范圍內。排除標準:(1)合并結締組織病;(2)有需要開胸手術處理的心臟疾病;(3)下肢動脈入路狹窄、鈣化,直徑<7 mm;(4)造影劑過敏史。術前根據測量結果選擇Castor支架型號,支架近端放大率為5%~10%(夾層)或15%~20%(弓部瘤),遠端放大率為0%~20%,分支放大率為0%~20%。
1.2 手術方法
手術在全身麻醉及X線透視下進行,患者平臥位,游離LCCA、LSA及一側股動脈,穿刺左肱動脈備用。肝素化后,行主動脈造影,將超硬導絲經股動脈切口置入主動脈,頭端在主動脈根部成絆,如胸主動脈與Castor支架尾端直徑不匹配,則先在降主動脈植入限制性支架,經LCCA送入單彎導管,導絲引導下進入降主動脈,進而從股動脈切口引出。取Castor單分支主動脈支架,沿導絲送入,分支導絲經單彎導管從LCCA鞘管引出,推送支架同時牽拉分支導絲,使支架頭端置于BTA開口遠端,分支進入LCCA,經左肱動脈送入豬尾導管再次造影確認支架位置,釋放主體及分支支架。再取直徑8 mm的人工血管,行端側吻合做LCCA-LSA的旁路移植。經左肱動脈置入單彎導管,在LSA根部造影,如有造影劑滲漏則送入彈簧圈或者血管塞行根部栓塞。頸部切口深部放置引流管,逐層縫合各切口。術后口服阿司匹林及氯吡格雷抗栓6個月,此后改為阿司匹林終生服用。
1.3 觀察指標
統計手術技術成功率、手術時間、LCCA阻斷時間、LSA處理方式、術后住院時間、圍術期主要并發癥發生率(如支架內漏、腦梗、急性腎損傷、截癱等)。術后3個月、6個月及之后每年復查主動脈CTA以明確病變轉歸。
1.4 統計學分析
采用SPSS 26.0進行統計學分析。計量資料進行正態性檢驗,服從正態分布的計量資料采用均數±標準差(x±s)描述,不服從正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述。計數資料采用頻數或百分比描述。
1.5 倫理審查
本研究已通過南京鼓樓醫院倫理委員會審查,批準號為2024-128-01。
2 結果
2.1 患者一般資料
共納入22例患者,其中男19例、女3例,平均年齡(56±16)歲。主動脈夾層患者18例,15例為急性發病,平均病程為(12±6)d,3例為慢性;主動脈弓部瘤4例,均為慢性疾病。所有患者均合并高血壓。術前評估均存在病變近端錨定區不足,需要以Z1區作為錨定區。患者術前資料見表1。
2.2 手術結果
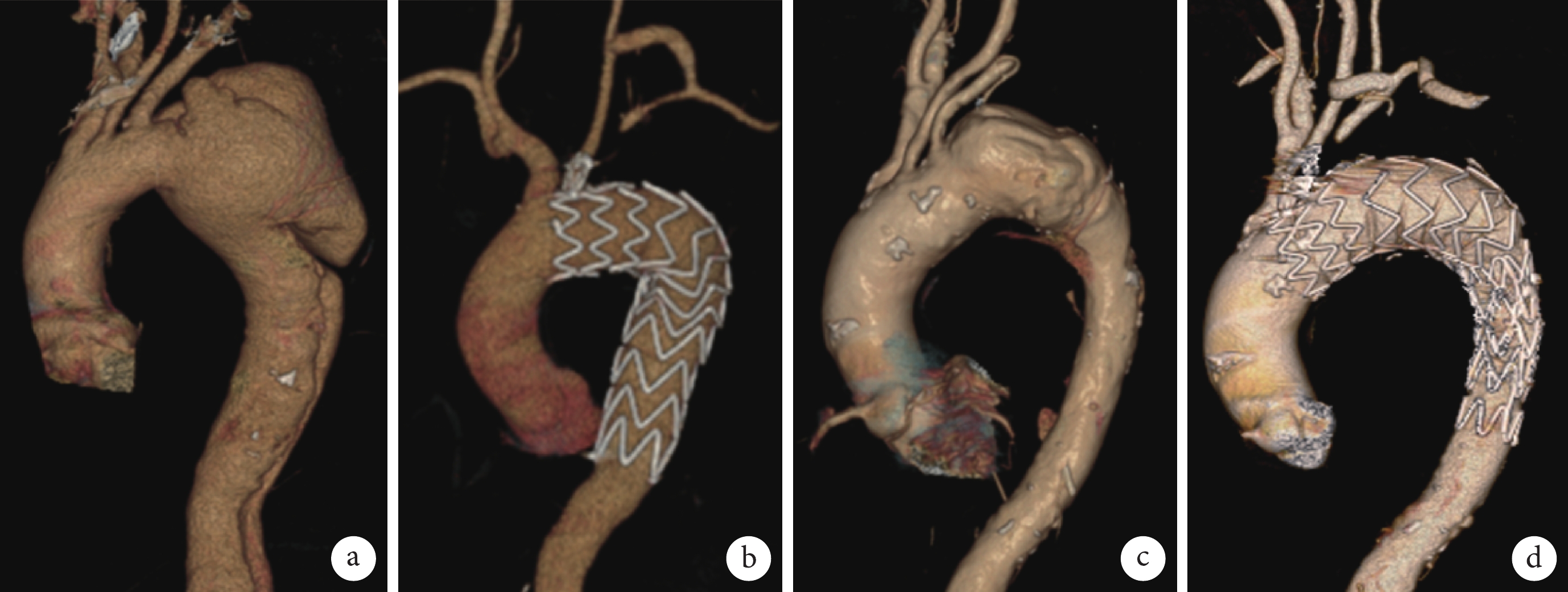
22例患者手術技術成功率100.0%,平均手術時間(291±48)min,術中阻斷LCCA時間(12±2)min,術中15例行左鎖骨下動脈根部栓塞,12例在降主動脈植入限制性支架。平均術后住院時間(10±4)d。中位隨訪時間20個月,隨訪期間無內漏、截癱、腦梗死、腎功能不全等主要并發癥發生,復查主動脈CTA顯示支架位置及形態良好,無內漏、分支支架或轉流血管閉塞等情況。夾層患者主動脈真腔增大,假腔內血栓化滿意;主動脈弓部瘤患者瘤腔內完全血栓化;見圖1。所有患者無再次入院情況。
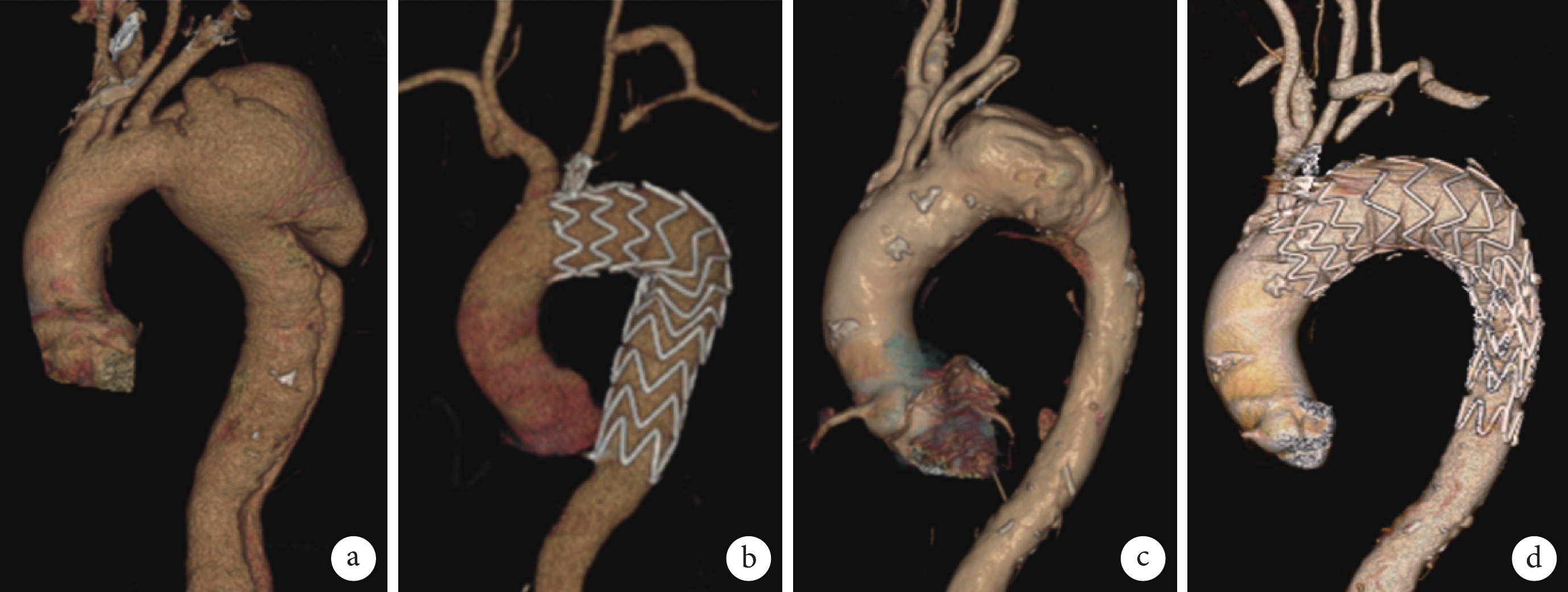 圖1
患者的術前術后CTA圖像
圖1
患者的術前術后CTA圖像
a~b:同一主動脈弓部瘤患者的術前術后CTA對比;c~d:同一主動脈夾層患者的術前術后CTA對比;CTA:計算機斷層掃描血管造影
3 討論
主動脈弓部病變實施腔內修復的關鍵在于使用覆膜支架隔絕病變的同時,保留或重建錨定區內的重要分支動脈。主流的腔內輔助技術包括平行支架技術、開窗技術、分支支架技術等[4]。分支支架主體與分支之間無縫銜接,是理論上符合解剖的最佳設計。Castor支架是目前國內僅有的一款單分支胸主動脈支架,支架分支常規置入LSA,易于精準定位且可有效延長錨定區至Z2區[5]。但臨床上許多主動脈弓部病變累及范圍較大,需要以Z1區作為錨定區。有文獻[6]報道將Castor支架分支放置于LCCA,以支架原位或體外開窗重建LSA血供,取得較好短期療效。但開窗操作仍存在許多問題:Castor支架覆膜為滌綸材質,較膨體聚四氟乙烯堅韌,行原位開窗操作中穿刺針破膜及球囊擴張均存在一定難度,特別是LSA與支架主體成角較小的情況下更為困難,反復操作將大大增加手術風險;行體外開窗有支架窗口與LSA開口對位失敗的可能性,特別是弓部扭曲患者,更加難以準確控制。開窗操作破壞了支架固有結構,增加內漏風險,遠期療效仍有待于進一步驗證[7]。亦有研究[8]選用較長后移距離的Castor支架,覆蓋LCCA開口,再以煙囪技術重建LCCA血供,從而獲得較長的錨定區。但采用煙囪技術本身會犧牲一定錨定區,且增加內漏特別是主動脈大彎側內漏的可能性[9],只適用于部分病例。而本文采用的方法可充分利用BTA開口以遠的錨定區,適應證更加廣泛。
對于部分弓形陡峭或者降主動脈起始部存在巨大瘤體或主動脈內膜破口的患者,支架主體通過弓部末端面臨挑戰。特別是采用本方法需要將支架頭端放置到BTA開口遠端,向前推送支架存在一定困難。我們從另一側股動脈置入圈套器,推送支架過弓時牽引固定住支架前端,避免支架主體因導絲支撐力不足而無法前進。必要時從前往后反復更換牽引部位,輔助支架逐漸到位。
因LSA開口被封閉可能導致左上肢缺血并增加腦梗風險[10],我們常規通過轉流手術重建LSA血供,轉流完成后經左肱動脈行LSA根部造影以確定是否行栓塞處理。文獻[11-12]報道使用Amplatz血管塞操作簡便且不易移位,但我們的經驗是在LSA根部盲端操作,填塞彈簧圈不需要更換鞘管,更加簡單易行。當LSA開口起自巨大瘤體或夾層假腔時,造影顯示支架主體距LSA開口尚有距離,彈簧圈難以安放,則采用血管塞栓塞LSA根部。AmplatzⅠ型血管塞具有較高殘余滲漏發生率[13],我們常規選擇AmplatzⅡ型血管塞,但Ⅱ型血管塞較長,釋放時需注意避免影響左椎動脈開口[14]。
Caster支架植入術后的抗栓方案尚無統一標準,對于本組患者,因LCCA內置入分支支架,LCCA與LSA之間存在人造血管,術后所有患者均需行抗栓治療。我們參照《2021年歐洲心臟病學會主動脈和外周動脈疾病的抗血栓診療共識》[15],采用阿司匹林聯合氯吡格雷抗血小板治療6個月,此后改為阿司匹林長期口服。對于出血高危的患者,僅使用阿司匹林單抗。
本研究表明,應用Castor支架,將支架頭端置于BTA開口遠端、分支置于LCCA內,使錨定區擴展至Z1區,發揮了Castor支架定位準確及錨定區利用充分的優點,聯合頸鎖轉流,切實保留LSA血供并避免內漏發生,術中即刻造影結果及術后隨訪提示該手術方法安全可行。本研究僅是單中心回顧性研究,樣本量較小,缺乏長期隨訪結果,本組患者的遠期療效仍需要進一步觀察隨訪。
利益沖突:無。
作者貢獻:李樹春負責研究設計,論文撰寫;金珉負責資料收集,數據統計;周慶、王東進負責論文指導。
對于累及主動脈弓部的夾層、動脈瘤等病變,主流的外科開胸手術治療仍有較高的手術風險及并發癥發生率[1]。近年來,腔內修復及雜交手術技術快速發展,已經逐漸成為治療主動脈弓部疾病的重要術式[2-3]。但常規技術仍限于將主動脈支架頭端置于Z2區,對于錨定區需前移到Z1區的病變行介入治療,需要重建左頸總動脈(left common carotid artery,LCCA)及左鎖骨下動脈(left subclavian artery,LSA)2個分支,其最佳方案仍在探索中,目前尚無標準術式。我中心使用Castor單分支支架(上海微創公司),將支架分支置入LCCA,以雜交技術重建LSA血供,治療近端錨定區不足的主動脈弓部病變患者,取得良好效果,現報道如下。
1 資料與方法
1.1 臨床資料
回顧性分析2020年8月—2023年11月南京大學醫學院附屬鼓樓醫院心臟外科收治的采用Castor支架聯合頸鎖轉流治療的主動脈弓部病變患者的臨床資料。所有患者術前均經計算機斷層掃描血管造影(computed tomographic angiography,CTA)確診,其DICOM文件導入Endosize工作站(Therenva SAS,Rennes,France)以評估病變。分別測量主動脈弓部病變近端至LCCA及頭臂干動脈(brachiocephalic trunk artery,BTA)開口遠端的距離(L1、L2),近遠端錨定區主動脈真腔直徑(D1、D2)及LCCA直徑(D3)。納入標準:(1)主動脈夾層或主動脈弓部瘤,L1<15 mm;(2)D1<40 mm;(3)L2>15 mm;(4)D3在6~12 mm范圍內。排除標準:(1)合并結締組織病;(2)有需要開胸手術處理的心臟疾病;(3)下肢動脈入路狹窄、鈣化,直徑<7 mm;(4)造影劑過敏史。術前根據測量結果選擇Castor支架型號,支架近端放大率為5%~10%(夾層)或15%~20%(弓部瘤),遠端放大率為0%~20%,分支放大率為0%~20%。
1.2 手術方法
手術在全身麻醉及X線透視下進行,患者平臥位,游離LCCA、LSA及一側股動脈,穿刺左肱動脈備用。肝素化后,行主動脈造影,將超硬導絲經股動脈切口置入主動脈,頭端在主動脈根部成絆,如胸主動脈與Castor支架尾端直徑不匹配,則先在降主動脈植入限制性支架,經LCCA送入單彎導管,導絲引導下進入降主動脈,進而從股動脈切口引出。取Castor單分支主動脈支架,沿導絲送入,分支導絲經單彎導管從LCCA鞘管引出,推送支架同時牽拉分支導絲,使支架頭端置于BTA開口遠端,分支進入LCCA,經左肱動脈送入豬尾導管再次造影確認支架位置,釋放主體及分支支架。再取直徑8 mm的人工血管,行端側吻合做LCCA-LSA的旁路移植。經左肱動脈置入單彎導管,在LSA根部造影,如有造影劑滲漏則送入彈簧圈或者血管塞行根部栓塞。頸部切口深部放置引流管,逐層縫合各切口。術后口服阿司匹林及氯吡格雷抗栓6個月,此后改為阿司匹林終生服用。
1.3 觀察指標
統計手術技術成功率、手術時間、LCCA阻斷時間、LSA處理方式、術后住院時間、圍術期主要并發癥發生率(如支架內漏、腦梗、急性腎損傷、截癱等)。術后3個月、6個月及之后每年復查主動脈CTA以明確病變轉歸。
1.4 統計學分析
采用SPSS 26.0進行統計學分析。計量資料進行正態性檢驗,服從正態分布的計量資料采用均數±標準差(x±s)描述,不服從正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述。計數資料采用頻數或百分比描述。
1.5 倫理審查
本研究已通過南京鼓樓醫院倫理委員會審查,批準號為2024-128-01。
2 結果
2.1 患者一般資料
共納入22例患者,其中男19例、女3例,平均年齡(56±16)歲。主動脈夾層患者18例,15例為急性發病,平均病程為(12±6)d,3例為慢性;主動脈弓部瘤4例,均為慢性疾病。所有患者均合并高血壓。術前評估均存在病變近端錨定區不足,需要以Z1區作為錨定區。患者術前資料見表1。
2.2 手術結果
22例患者手術技術成功率100.0%,平均手術時間(291±48)min,術中阻斷LCCA時間(12±2)min,術中15例行左鎖骨下動脈根部栓塞,12例在降主動脈植入限制性支架。平均術后住院時間(10±4)d。中位隨訪時間20個月,隨訪期間無內漏、截癱、腦梗死、腎功能不全等主要并發癥發生,復查主動脈CTA顯示支架位置及形態良好,無內漏、分支支架或轉流血管閉塞等情況。夾層患者主動脈真腔增大,假腔內血栓化滿意;主動脈弓部瘤患者瘤腔內完全血栓化;見圖1。所有患者無再次入院情況。
 圖1
患者的術前術后CTA圖像
圖1
患者的術前術后CTA圖像
a~b:同一主動脈弓部瘤患者的術前術后CTA對比;c~d:同一主動脈夾層患者的術前術后CTA對比;CTA:計算機斷層掃描血管造影
3 討論
主動脈弓部病變實施腔內修復的關鍵在于使用覆膜支架隔絕病變的同時,保留或重建錨定區內的重要分支動脈。主流的腔內輔助技術包括平行支架技術、開窗技術、分支支架技術等[4]。分支支架主體與分支之間無縫銜接,是理論上符合解剖的最佳設計。Castor支架是目前國內僅有的一款單分支胸主動脈支架,支架分支常規置入LSA,易于精準定位且可有效延長錨定區至Z2區[5]。但臨床上許多主動脈弓部病變累及范圍較大,需要以Z1區作為錨定區。有文獻[6]報道將Castor支架分支放置于LCCA,以支架原位或體外開窗重建LSA血供,取得較好短期療效。但開窗操作仍存在許多問題:Castor支架覆膜為滌綸材質,較膨體聚四氟乙烯堅韌,行原位開窗操作中穿刺針破膜及球囊擴張均存在一定難度,特別是LSA與支架主體成角較小的情況下更為困難,反復操作將大大增加手術風險;行體外開窗有支架窗口與LSA開口對位失敗的可能性,特別是弓部扭曲患者,更加難以準確控制。開窗操作破壞了支架固有結構,增加內漏風險,遠期療效仍有待于進一步驗證[7]。亦有研究[8]選用較長后移距離的Castor支架,覆蓋LCCA開口,再以煙囪技術重建LCCA血供,從而獲得較長的錨定區。但采用煙囪技術本身會犧牲一定錨定區,且增加內漏特別是主動脈大彎側內漏的可能性[9],只適用于部分病例。而本文采用的方法可充分利用BTA開口以遠的錨定區,適應證更加廣泛。
對于部分弓形陡峭或者降主動脈起始部存在巨大瘤體或主動脈內膜破口的患者,支架主體通過弓部末端面臨挑戰。特別是采用本方法需要將支架頭端放置到BTA開口遠端,向前推送支架存在一定困難。我們從另一側股動脈置入圈套器,推送支架過弓時牽引固定住支架前端,避免支架主體因導絲支撐力不足而無法前進。必要時從前往后反復更換牽引部位,輔助支架逐漸到位。
因LSA開口被封閉可能導致左上肢缺血并增加腦梗風險[10],我們常規通過轉流手術重建LSA血供,轉流完成后經左肱動脈行LSA根部造影以確定是否行栓塞處理。文獻[11-12]報道使用Amplatz血管塞操作簡便且不易移位,但我們的經驗是在LSA根部盲端操作,填塞彈簧圈不需要更換鞘管,更加簡單易行。當LSA開口起自巨大瘤體或夾層假腔時,造影顯示支架主體距LSA開口尚有距離,彈簧圈難以安放,則采用血管塞栓塞LSA根部。AmplatzⅠ型血管塞具有較高殘余滲漏發生率[13],我們常規選擇AmplatzⅡ型血管塞,但Ⅱ型血管塞較長,釋放時需注意避免影響左椎動脈開口[14]。
Caster支架植入術后的抗栓方案尚無統一標準,對于本組患者,因LCCA內置入分支支架,LCCA與LSA之間存在人造血管,術后所有患者均需行抗栓治療。我們參照《2021年歐洲心臟病學會主動脈和外周動脈疾病的抗血栓診療共識》[15],采用阿司匹林聯合氯吡格雷抗血小板治療6個月,此后改為阿司匹林長期口服。對于出血高危的患者,僅使用阿司匹林單抗。
本研究表明,應用Castor支架,將支架頭端置于BTA開口遠端、分支置于LCCA內,使錨定區擴展至Z1區,發揮了Castor支架定位準確及錨定區利用充分的優點,聯合頸鎖轉流,切實保留LSA血供并避免內漏發生,術中即刻造影結果及術后隨訪提示該手術方法安全可行。本研究僅是單中心回顧性研究,樣本量較小,缺乏長期隨訪結果,本組患者的遠期療效仍需要進一步觀察隨訪。
利益沖突:無。
作者貢獻:李樹春負責研究設計,論文撰寫;金珉負責資料收集,數據統計;周慶、王東進負責論文指導。