大隱靜脈是冠狀動脈旁路移植術中最常用的橋血管之一,然而其高衰敗率嚴重影響患者預后。因此,如何有效預防大隱靜脈衰敗成為亟待解決的臨床問題,并引起了廣泛關注。本文對大隱靜脈衰敗的相關研究進行綜述,旨在為臨床診療和未來的研究提供參考。
上世紀60年代,大隱靜脈(saphenous vein graft,SVG)作為橋血管首次在冠狀動脈(冠脈)旁路移植術(coronary artery bypass grafting,CABG)中使用。近年來,多支動脈橋CABG或全動脈化CABG受到越來越廣泛的關注。研究[1]表明,多支動脈橋CABG或全動脈CABG能顯著降低心肌梗死、冠脈再干預及死亡率,為患者帶來更佳的臨床預后。但多支動脈橋CABG或全動脈CABG有其自身局限性,限制其臨床應用,如雙側胸廓內動脈的使用會導致胸骨并發癥顯著增加;橈動脈對病變冠脈狹窄程度要求高。我國目前多支動脈橋CABG的使用率僅6.3%[2],因此SVG仍將是未來CABG中最常用的橋血管。然而,SVG極易發生衰敗,術后1個月的衰敗率約為6.0%,術后1年約為13.0%,術后10年的衰敗率達60.0%[3]。出現SVG衰敗的患者,其心肌梗死、冠脈再干預及死亡率顯著增加[4]。因此,如何降低SVG衰敗率、改善CABG術后患者預后,成為目前亟待解決的臨床問題。本文對SVG衰敗的機制及預防相關研究進行綜述,為臨床診療和后續研究提供一定參考。
1 大隱靜脈衰敗的機制
SVG衰敗大致可分為3個階段,第一階段(早期):術后1個月內的急性血栓形成;第二階段(中期):術后1個月至1年的內膜增生;第三階段(晚期):術后1年后的粥樣硬化病變[5]。
在CABG術中,SVG常受缺血-再灌注損傷與機械性損傷,導致內皮損傷與平滑肌細胞表型的改變。當內皮損傷時,細胞外基質和組織因子暴露,激活凝血瀑布;前列環素和一氧化氮的合成減少,導致微血管收縮和血流淤滯,進一步促進纖維蛋白原聚集,血小板和白細胞黏附于管腔,最終急性血栓形成。術中粗暴獲取的SVG常因廣泛的內皮損傷而發生早期衰敗。當SVG吻合冠脈直徑過小時,由于SVG流量不足,血小板和白細胞黏附增加,進而促使SVG發生早期衰敗[6]。此外,高凝狀態(例如D-二聚體升高)和血小板活性增強也會增加SVG衰敗風險[7-8]。平滑肌細胞(smooth muscle cell,SMC)表型由靜止的收縮型轉變為去分化的增殖型或合成型,從而分泌金屬蛋白酶,改變細胞外基質成分并遷移至內膜,導致SVG內膜增生。此外,炎癥反應是促進內膜增生的重要因素,尤其是巨噬細胞在其中扮演重要角色。它們通過細胞因子的表達和釋放,加速炎癥反應,從而促進內膜增生。淋巴細胞與單核細胞比例降低的患者,其SVG衰敗風險增加[7]。增生的內膜是SVG粥樣硬化病變的基礎。與冠脈粥樣硬化病變相比,SVG的粥樣硬化病變進展迅速且彌漫,極易發生破裂。其可能的原因之一是增殖型或合成型SMC與巨噬細胞分泌基質金屬蛋白酶,破壞膠原纖維,導致斑塊的纖維帽變薄[9]。除了常見的粥樣硬化危險因素(如高血壓、高脂血癥、糖尿病等),心功能不全和腎功能不全同樣會促使SVG衰敗[10-12]。因此,保護內皮細胞、抑制平滑肌表型轉換以及控制粥樣硬化危險因素,是預防SVG衰敗的核心。
2 大隱靜脈衰敗的預防
2.1 吻合口的選擇
吻合口的選擇對SVG通暢率有重要影響。一般而言,冠脈與SVG之間的直徑差異越小,橋通暢性也就越好[13]。因此,吻合口應當盡量靠近冠脈近端,冠脈直徑越大,SVG通暢率越好。
回顧性研究[14]表明,冠脈血流儲備分數與SVG閉塞率相關,若吻合冠脈血流儲備分數正常,則SVG衰敗率增加。但隨后進行的FARGO和GRAFFITT研究[15-16]表明,與傳統造影指導相比,血流儲備分數指導下的CABG未能降低SVG衰敗率。這個可能是因為SVG缺乏豐富的平滑肌層,因此相較于橈動脈,競爭血流對SVG的影響較小。
2.2 手術操作過程中的預防
2.2.1 SVG的獲取
目前,SVG最常用的獲取方法為長切口骨骼化法。該法操作簡單,但獲取的SVG極易發生痙攣。此外,由于手術切口大,患者術后疼痛明顯,傷口感染、血腫、感覺障礙等切口并發癥發生率高,且切口恢復時間也長。
間斷小切口骨骼化法和內窺鏡法(endoscopic vein harvesting,EVH)可以縮小手術切口,降低切口并發癥風險。間斷小切口骨骼化法采用分段式皮膚切口的方式,通過皮下隧道獲取SVG。這種方法的缺點是在結扎側支過程中會造成SVG的過度牽拉,進而損傷內皮層,減弱SVG內皮依賴性舒張功能。如使用導光拉鉤輔助,可在一定程度上減少血管牽拉,減輕對內皮結構與功能的損傷。
EVH法切口更小,更大程度上減少了切口并發癥的發生。早期研究[17-18]表明,相較于傳統長切口骨骼化法,EVH法會顯著增加SVG術后閉塞率,并增加患者再次冠脈血運重建率甚至死亡率。但最新的臨床試驗[19]及Meta分析[20]表明兩種獲取方式在SVG通暢率、再次冠脈血運重建率及死亡率等方面并無顯著差異。有學者[21]認為,各研究中操作者的經驗差異導致結果間的矛盾,不熟練的EVH操作會增加SVG的閉塞率。因此,由經驗豐富的術者實施EVH可能使患者獲益更為顯著。
SVG的另一種獲取方式是“no-touch”法。該法保留SVG的外膜以及周圍的脂肪和結締組織。研究[22]表明,no-touch法獲取的SVG較傳統法術后1年的閉塞率顯著降低,術后16年的長期通暢率可達82.7%。對于老齡合并眾多伴隨疾病的患者,吻合LAD的no-touch法獲取的SVG中期通暢率為95.6%,與左胸廓內動脈(left internal thoracic artery,LITA)相當。一項自身隨機對照試驗[23]表明,no-touch獲取的SVG較橈動脈的吻合口閉塞率顯著下降。此外,使用no-touch法獲取SVG的患者再發心絞痛明顯減少,心功能也顯著改善。No-touch法獲益來源于其保留了血管外脂肪和結締組織,減少SVG痙攣,避免其被擴張;保留外膜中的滋養血管,減輕SVG的缺血性損傷。此外,血管外脂肪和結締組織可作為生物性血管外支架,減輕動脈血流的機械性損傷;還可作為血管活性物質來源,減輕SVG痙攣,擴張外膜中滋養血管,減輕SVG缺血性損傷。因此,與傳統法相比,no-touch法獲取的SVG內皮及內皮型一氧化氮合酶活性保存更為完善,平滑肌表型轉換及內膜增生顯著減少,SVG血管流量顯著增加,從而改善SVG衰敗率[24]。較傳統長切口骨骼化法,no-touch法切口并發癥的發生率有所增加,但其隨著術者熟練度的增加而降低。值得注意的是,最近有研究[25]表明,使用no-touch法獲取SVG的患者冠脈再干預率顯著上升。
總的來說,與傳統骨骼化法、EVH法相比,no-touch法獲取的SVG血管損傷小,內皮、外膜及其滋養血管保存更為完整[26]。Meta分析[27-28]表明,no-touch法較EVH法和傳統法能顯著降低SVG衰敗率,但切口并發癥發生率最高。因此,有術者[29]將EVH法與no-touch法結合,以結合兩者優勢,在維持最佳通暢率的同時,減少切口并發癥的發生,以帶給患者最佳的臨床獲益。
2.2.2 SVG與冠脈靶點的吻合方式
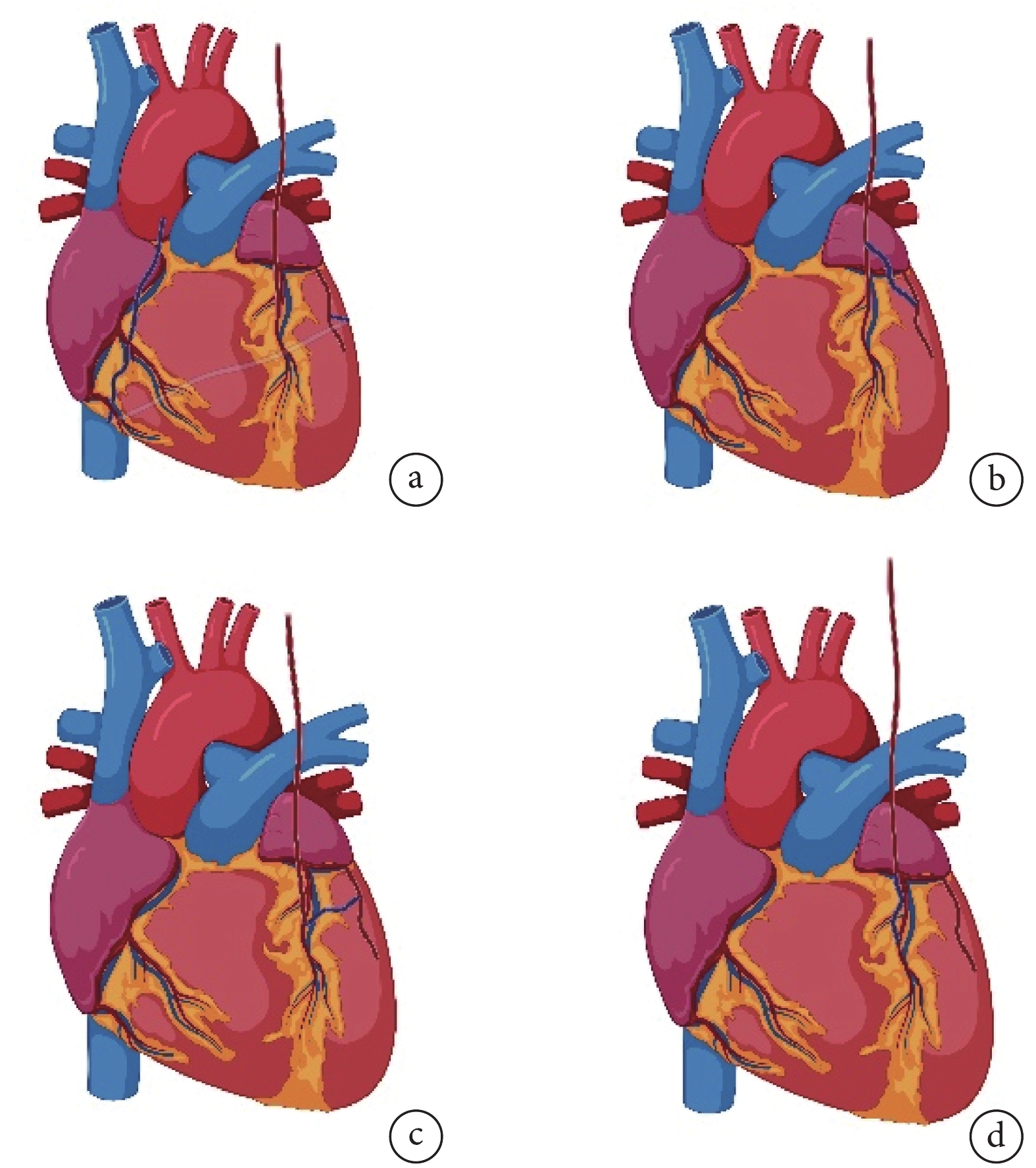
SVG常見的吻合方式為單支端側吻合和序貫吻合(圖1a)。理論上,序貫吻合節約大隱靜脈材料、減少主動脈操作。但由于多個遠端吻合口依賴于同一近端吻合口,若后者閉塞或狹窄,可能會導致大范圍的心肌缺血或梗死。早期研究[30-31]顯示,序貫吻合使得圍術期冠脈再干預率和SVG術后1年衰敗率顯著升高,但最新研究[32-33]表明序貫吻合能顯著降低SVG衰敗率,進而降低患者死亡率。序貫吻合的臨床獲益與其吻合路徑無關,但與遠端吻合口數目相關,近端吻合口的衰敗率隨遠端吻合口數目的增加而降低[34-35]。
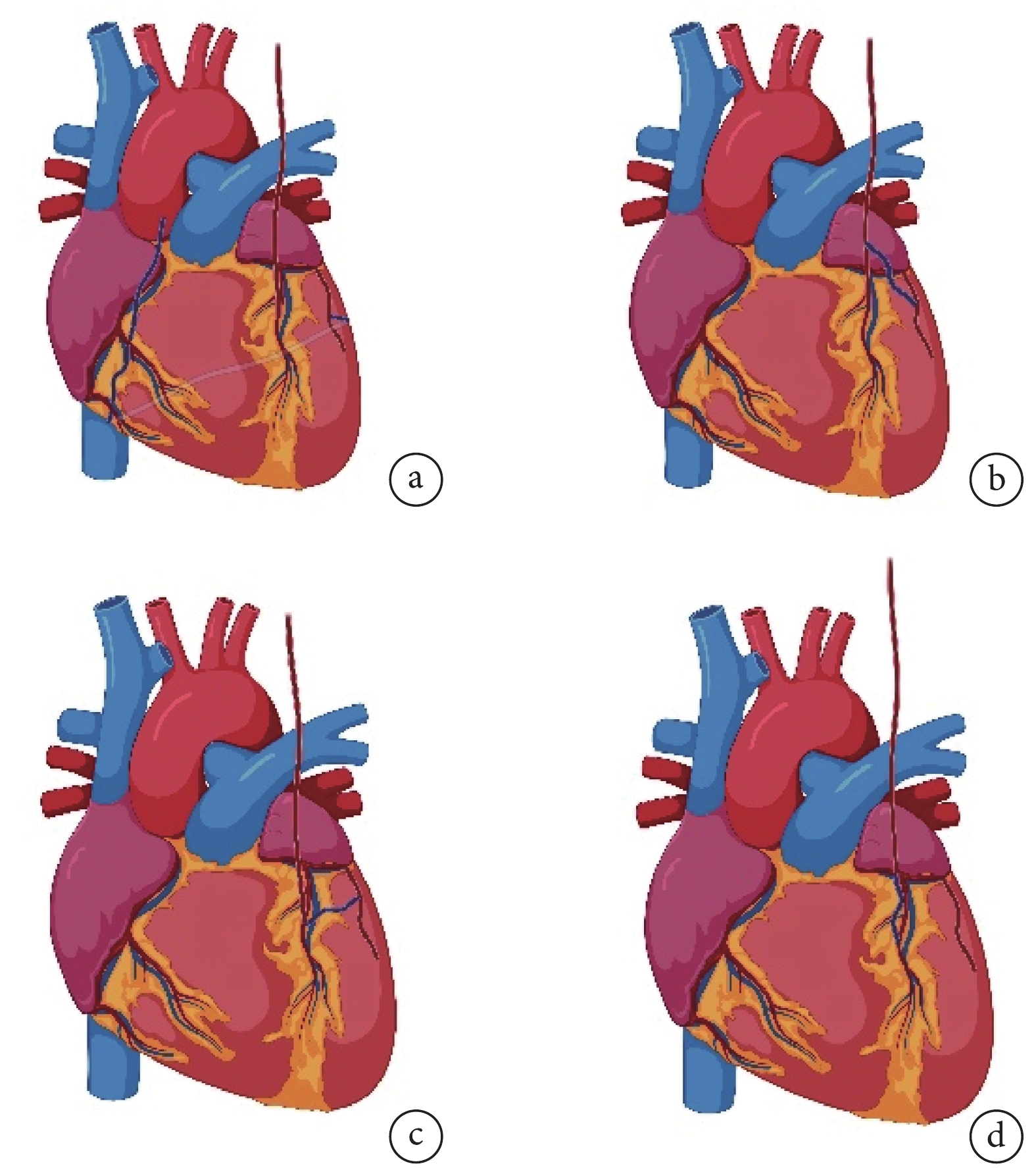 圖1
大隱靜脈與冠狀動脈吻合示意圖
圖1
大隱靜脈與冠狀動脈吻合示意圖
有術者提出可借助LITA分泌的內皮保護物質(如一氧化氮等)來改善SVG衰敗率,有研究[36]表明動-靜脈復合橋的長期通暢率與全動脈橋相似。在Y型橋(SVG近端與LITA進行端-側吻合,SVG遠端與病變冠脈相吻合)中(圖1b),其SVG的5年通暢率可達95.7%。但Y型橋需要將SVG吻合于LITA上,這種術式可能會對LITA的血管完整性及其血流造成損傷,從而影響其遠期通暢率[37]。Stevens等[38]提出了L型橋(首先SVG與心臟前外側病變冠脈吻合,接著將SVG端-側吻合于LAD,最后將LITA吻合至LAD上的SVG)(圖1c)。AIM-PONT研究[38]表明,L型橋使得LITA血流流速顯著增加,且SVG通暢率并不劣于傳統構型。此外,在某些情況下(如左心擴大、LITA中段或遠端明顯鈣化等),LITA難以直接與LAD吻合。因此,有術者[39]提出使用LITA-SVG-LAD的I型橋(SVG近端與LITA末端進行端-端吻合,SVG遠端與LAD進行端-側吻合)(圖1d)。就通暢率而言,I型橋與單純LITA橋無顯著差異,而其通暢率高于升主動脈至非LAD冠脈的SVG通暢率(94.1% vs. 83.9%)[40]。
2.2.3 停跳與非停跳CABG
CABG中停跳和不停跳孰優孰劣一直以來是心外科的熱門話題。最近的3項大型隨機對照試驗[41-47]并未發現不停跳CABG具有額外的臨床獲益,而有研究[46]表明采用不停跳CABG的患者術后1年SVG通暢率顯著降低,術后5年全因死亡率顯著增加[47]。同時,一項納入16項隨機對照臨床實驗的Meta分析[48]表明,采用不停跳CABG的患者橋血管閉塞率增加33.0%,其中SVG閉塞率增加40.0%。同時,研究[49-50]表明,不停跳CABG的冠脈再干預率和長期死亡率顯著增加。因此,2018年歐洲心臟病學會(ESC)心肌血運重建指南[51]強調只在處理嚴重主動脈粥樣硬化(Ⅰ類推薦)或高風險(ⅡA類推薦)患者時,由經驗豐富的外科醫生行不停跳CABG。
2.2.4 術中大隱靜脈橋血管流量檢測
在早期閉塞的SVG中,部分是因為術中技術原因導致。因此,術中發現血流不佳的橋血管,可及時進行糾正,進而減少橋血管早期閉塞及其引起的不良事件。術中瞬時血流測定(transient-time flow measurement,TTFM)通過測量搏動指數和平均橋血管流量來實現術中橋血管的評估,有利于術者判斷橋血管是否存在問題。現有研究[52]表明,高搏動指數和低平均橋血管流量與橋血管的衰敗存在關聯。2018年ESC心肌血運重建指南[51]將術中常規使用TTFM來檢測橋血管質量作為ⅡA類推薦,但TTFM各指標的界值尚未達成共識。基于我國CABG人群的研究[53-54]表明,平均橋血管流量<15.0 mL/min,搏動指數>3.6的SVG衰敗發生率顯著增高。
2.3 藥物預防
目前各項指南建議CABG術后應積極進行二級預防,以降低主要不良心腦血管事件的發生率,提高生活質量。規范的二級預防措施不僅可以延緩冠脈病變進展,還可降低橋血管閉塞率。在CABG術后的二級預防中,抗栓治療與降脂治療已被證明可以顯著降低SVG的閉塞率,從而進一步改善患者的預后。
2.3.1 抗栓治療
急性血栓形成是SVG早期衰敗的主要原因之一。因此,規范化的抗血栓藥物使用對降低SVG閉塞率至關重要。阿司匹林是一種經典的抗血小板藥物,可顯著降低SVG閉塞率。此外,與單用阿司匹林相比,雙抗治療,即聯合使用阿司匹林和血小板P2Y12受體抑制劑,能更顯著地降低SVG閉塞率[55]。就雙抗治療而言,阿司匹林聯合替格瑞洛比阿司匹林聯合氯吡格雷能更有效地抑制血小板聚集[56]。我國患者因CYP2C19基因多態性引起的氯吡格雷抵抗現象較歐美患者更為常見,理論上可以優先考慮使用阿司匹林聯合替格瑞洛治療[57]。然而,最新的Meta分析[58]表明,阿司匹林聯合替格瑞洛會顯著提高出血事件發生率。因此,有研究者[59]提出縮短雙抗治療時間以降低出血事件發生率。目前,一項大型多中心隨機對照試驗(NCT05380063)正在開展,以探討與術后12個月的雙抗治療相比,術后3個月的雙抗治療是否能顯著降低出血事件發生率,且不以SVG衰敗率增加為代價。此外,一些研究者曾嘗試以單用替格瑞洛來取代單用阿司匹林,但研究[60]表明,兩者的SVG通暢率并無顯著差異。目前指南[57, 61]推薦使用SVG的CABG術后應盡早開始雙抗治療,以減少血栓相關的SVG衰敗,但對具體的雙抗治療方案未作出明確推薦。
抗凝藥物(如華法林)同樣能減少血栓形成,從而能夠降低SVG閉塞率,但單用華法林與單用阿司匹林在降低SVG閉塞率方面并無顯著差異[55]。此外,使用華法林還存在許多不便,例如需要定期監測國際標準化比值,同時還需要注意藥物、食物相互作用。因此,目前指南[61]不推薦CABG術后單獨使用華法林預防SVG閉塞。有研究者[62]提出聯合抗血小板藥物和抗凝藥物的雙通道抗栓治療,以期獲得比單用阿司匹林更佳的通暢率。阿司匹林聯合華法林的Post-CABG研究[63]和阿司匹林聯合新型口服抗凝藥的COMPASS-CABG研究[64],均未顯示雙通道抗栓治療能帶來SVG通暢率的獲益。但研究[65]表明,阿司匹林聯合華法林的雙通道抗栓治療需維持國際標準化比值>1.6時,才可降低橋血管衰敗率。
2.3.2 降脂治療
CABG術后患者均屬于動脈粥樣硬化性心血管疾病的極高危人群,甚至大部分屬于超高危人群。這些患者血脂管理的核心是降低膽固醇水平,尤其是低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)水平。LDL-C升高是SVG內膜增生和粥樣硬化斑塊形成的高危因素之一。
他汀類藥物是一種HMG-COA還原酶抑制劑,能夠降低肝細胞內膽固醇合成,從而反饋上調肝細胞表面LDL-C受體,加速循環血液中LDL-C的清除。此外,他汀還能夠改善內皮功能,抑制SMC增生,起到抗炎、穩定斑塊等作用。研究表明,他汀類藥物能夠顯著延緩冠脈和靜脈橋血管粥樣硬化進展[63],且高劑量他汀類藥物還能顯著降低不良心血管事件風險[66]。當前指南[57, 61]建議所有CABG術后患者均應長期接受中強度或高強度的他汀治療。
除LDL-C外,研究[67]也表明PCSK9水平與術后1年SVG衰敗相關。聯合應用他汀類藥物和PCSK9抑制劑(如依洛尤單抗)能明顯延緩冠脈粥樣硬化斑塊進展。目前,一項多中心隨機對照試驗(NCT03900026)正在探討PCSK9抑制劑聯合他汀治療是否能減少SVG衰敗的發生。
低水平的HDL-C和高水平的甘油三脂也是導致SVG粥樣硬化進展的危險因素。根據LOCAT研究[68]結果,吉非羅齊的使用可顯著提高HDL-C水平并降低甘油三脂水平,進而有效抑制SVG中新生病變的進展。同時,REDUCE-IT研究[69]顯示,在他汀治療中加入高純度ω-3脂肪酸可以顯著降低甘油三脂水平,降低約20.0%心血管死亡率。對于合并高甘油三酯血癥的患者,當前指南[57]推薦可以考慮補充高純度ω-3脂肪酸,以進一步減少不良心血管事件的發生。需要注意的是,吉非貝齊聯合他汀類藥物會增加肌溶解或急性腎功能衰竭的風險,而高純度ω-3脂肪酸聯合他汀的安全性和有效性有待進一步評價。
2.4 治療新進展
目前預防SVG衰敗的研究主要集中于兩個方面,一是減少SVG術中內皮損傷,二是抑制SVG內膜增生。例如,通過基因轉染技術或抗增殖藥物來抑制SMC的過度增殖,或者采用新型術中存儲液來更完整地保存SVG內皮。靜脈外支架則通過減少SVG機械性損傷,既減少SVG術中內皮損傷,又減少SVG內膜增生(圖2)。
 圖2
XXXX
圖2
XXXX
2.4.1 基因療法
許多研究利用基因轉染技術來抑制或促進特定基因的表達,以實現對內膜增生的抑制或內皮功能的改善。近年來,人們對microRNA的認識越來越深入,其參與轉錄后基因的表達調控。動物實驗[70-71]表明,microRNA-423、microRNA-145的表達上調可促進內皮細胞增殖而抑制SMC的增殖、遷移和表型轉換,從而顯著減少靜脈橋的內膜增生;而microRNA-21的表達上調則促使成纖維細胞轉化為肌成纖維細胞,從而促進內膜增生的形成[72]。此外,APOA1基因過表達可以顯著減少靜脈橋血管中的脂質聚集,有望延緩靜脈橋粥樣硬化病變進展[73]。
2.4.2 藥物治療
SMC過度增殖會導致SVG狹窄甚至閉塞,因此抑制SMC的過度增殖是有效預防SVG衰敗的治療靶點之一。許多抑制SMC增殖的藥物已在動物模型中顯示出具有抑制靜脈橋血管內膜增生的作用,如作用于p38 MAPK-MK2通路的己酮可可堿和MK2肽類抑制劑、作用于Rb-E2F通路的全反式視黃酸[74-76]。此外,亦有研究通過進一步優化降脂或抗栓治療來減少靜脈橋血管衰敗。在動物研究[77]中,膽固醇酯轉移蛋白抑制劑可以增加HDL-C濃度,抑制內皮炎癥、改善內皮功能、減少SMC增殖,從而抑制靜脈橋血管內膜增生;使用新型納米輸送裝置的替羅非班亦可顯著改善橋血管通暢率[78]。
2.4.3 大隱靜脈存儲液
SVG獲取后常需短暫體外儲存以待吻合至冠脈。在此期間,SVG會受缺血性損傷,吻合后還會進一步受再灌注損傷。因此,如何減輕SVG的缺血-再灌注損傷以改善SVG通暢率成為一個新的治療方向。目前術中常使用肝素化生理鹽水或全血儲存SVG,但生理鹽水或全血并不具有良好的生物相容性。正常人動脈血液的酸堿度(pH值)為7.4~7.5,而生理鹽水的pH值為7.0,且缺乏營養物質。此外,體外全血中的中性粒細胞因空氣暴露而被激活,進一步導致組織損傷。研究[79]表明,與肝素化生理鹽水或全血相比,平衡鹽溶液顯著降低術后1年SVG衰敗率,降低術后5年死亡、心肌梗死及再次冠脈血運重建的復合事件發生率。盡管平衡鹽溶液具有良好的生物相容性,但其缺少抗缺血-再灌注損傷的作用。因此,含有谷胱甘肽、L-抗壞血酸和L-精氨酸的平衡鹽溶液(DuraGraft液)被用以減少SVG缺血-再灌注損傷。與生理鹽水、全血和平衡鹽溶液相比,存儲于DuraGraft液的SVG具有更高的內皮活性,更低氧化應激水平,更少的細胞凋亡,更良好的舒張功能及更少的痙攣[80-83]。臨床研究[84-85]表明,術中將SVG暫存于DuraGraft液可顯著降低非致死性心肌梗死和再次冠脈血運重建的風險,且能更有效地延緩SVG的內膜增生。一項歐洲多中心注冊研究(NCT02922088)擬前瞻性評估DuraGraft液的臨床獲益。
2.4.4 靜脈外支架
靜脈外支架的概念在上世紀60年代被提出。靜脈外支架可以減少SVG與吻合動脈之間的直徑差異,增強剪切應力并減弱周向拉伸力。臨床研究[86]已表明,VEST靜脈外支架可顯著減少SVG的內膜增生,并增加SVG管腔的均勻度。但VEST為合金支架,存在異物相關的感染風險,因此,可降解外支架被認為更具有臨床應用前景。目前,在動物模型中,可降解外支架能顯著抑制SMC細胞增殖,抑制靜脈橋血管的內膜增生[87-89]。此外,將抑制SMC增生的藥物與可降解外支架相結合能更有效地抑制靜脈橋血管內膜增生[89]。Zhang等[90]將可降解外支架與藥物相結合,通過使用不同降解性的材料使藥物釋放速率不同,從而能更有效地針對靜脈橋衰敗的三階段,結果表明該支架不僅更為有效地保存內皮細胞,還能抑制SMC增殖及表型轉換,從而顯著減少內膜增生。
2.4.5 其他
因為術中靜脈外支架的使用增加了手術難度,有研究者[91]對靜脈外膜進行光化學組織鈍化或乙二醛浸潤,使外膜中膠原纖維交聯,以獲得類似于靜脈外支架的作用,從而使得靜脈硬度增加、順應性降低。動物實驗[92-93]表明,靜脈外膜中膠原纖維交聯可以顯著抑制靜脈橋的內膜增生。
有術者[94]認為SVG中的靜脈瓣會使得舒張期血流減緩乃至相對停滯,使得SVG衰敗率增加。研究[94-95]表明,靜脈瓣切除使得SVG流量顯著增加,術后1年通暢率約為97.1%,術后3年通暢率約為96.1%。此外,有術者[96]認為吻合于后降支的SVG高閉塞率是因為遠端吻合口受膈肌擠壓所致。研究[97]表明,增強后降支遠段吻合口穩定性可以顯著降低SVG閉塞率。
3 總結與展望
SVG衰敗是一個多因素、多階段的過程,需要從多方面進行預防。其中最為關鍵的是手術因素,包括SVG獲取方式、吻合口以及吻合方式的選擇等。此外,抗栓藥物與降脂藥物的使用也至關重要。此外,基因療法、藥物治療、術中存儲液及靜脈外支架都有望進一步降低SVG衰敗發生率,從而改善CABG術后患者的預后。
利益沖突:無。
作者貢獻:何廖銘負責論文設計、文獻查閱和論文初稿撰寫;希爾艾力·鐵木爾尼亞孜負責文獻查閱分析和論文初稿撰寫;宋仰午負責論文審閱與修改;鳳瑋負責論文設計,定稿。
上世紀60年代,大隱靜脈(saphenous vein graft,SVG)作為橋血管首次在冠狀動脈(冠脈)旁路移植術(coronary artery bypass grafting,CABG)中使用。近年來,多支動脈橋CABG或全動脈化CABG受到越來越廣泛的關注。研究[1]表明,多支動脈橋CABG或全動脈CABG能顯著降低心肌梗死、冠脈再干預及死亡率,為患者帶來更佳的臨床預后。但多支動脈橋CABG或全動脈CABG有其自身局限性,限制其臨床應用,如雙側胸廓內動脈的使用會導致胸骨并發癥顯著增加;橈動脈對病變冠脈狹窄程度要求高。我國目前多支動脈橋CABG的使用率僅6.3%[2],因此SVG仍將是未來CABG中最常用的橋血管。然而,SVG極易發生衰敗,術后1個月的衰敗率約為6.0%,術后1年約為13.0%,術后10年的衰敗率達60.0%[3]。出現SVG衰敗的患者,其心肌梗死、冠脈再干預及死亡率顯著增加[4]。因此,如何降低SVG衰敗率、改善CABG術后患者預后,成為目前亟待解決的臨床問題。本文對SVG衰敗的機制及預防相關研究進行綜述,為臨床診療和后續研究提供一定參考。
1 大隱靜脈衰敗的機制
SVG衰敗大致可分為3個階段,第一階段(早期):術后1個月內的急性血栓形成;第二階段(中期):術后1個月至1年的內膜增生;第三階段(晚期):術后1年后的粥樣硬化病變[5]。
在CABG術中,SVG常受缺血-再灌注損傷與機械性損傷,導致內皮損傷與平滑肌細胞表型的改變。當內皮損傷時,細胞外基質和組織因子暴露,激活凝血瀑布;前列環素和一氧化氮的合成減少,導致微血管收縮和血流淤滯,進一步促進纖維蛋白原聚集,血小板和白細胞黏附于管腔,最終急性血栓形成。術中粗暴獲取的SVG常因廣泛的內皮損傷而發生早期衰敗。當SVG吻合冠脈直徑過小時,由于SVG流量不足,血小板和白細胞黏附增加,進而促使SVG發生早期衰敗[6]。此外,高凝狀態(例如D-二聚體升高)和血小板活性增強也會增加SVG衰敗風險[7-8]。平滑肌細胞(smooth muscle cell,SMC)表型由靜止的收縮型轉變為去分化的增殖型或合成型,從而分泌金屬蛋白酶,改變細胞外基質成分并遷移至內膜,導致SVG內膜增生。此外,炎癥反應是促進內膜增生的重要因素,尤其是巨噬細胞在其中扮演重要角色。它們通過細胞因子的表達和釋放,加速炎癥反應,從而促進內膜增生。淋巴細胞與單核細胞比例降低的患者,其SVG衰敗風險增加[7]。增生的內膜是SVG粥樣硬化病變的基礎。與冠脈粥樣硬化病變相比,SVG的粥樣硬化病變進展迅速且彌漫,極易發生破裂。其可能的原因之一是增殖型或合成型SMC與巨噬細胞分泌基質金屬蛋白酶,破壞膠原纖維,導致斑塊的纖維帽變薄[9]。除了常見的粥樣硬化危險因素(如高血壓、高脂血癥、糖尿病等),心功能不全和腎功能不全同樣會促使SVG衰敗[10-12]。因此,保護內皮細胞、抑制平滑肌表型轉換以及控制粥樣硬化危險因素,是預防SVG衰敗的核心。
2 大隱靜脈衰敗的預防
2.1 吻合口的選擇
吻合口的選擇對SVG通暢率有重要影響。一般而言,冠脈與SVG之間的直徑差異越小,橋通暢性也就越好[13]。因此,吻合口應當盡量靠近冠脈近端,冠脈直徑越大,SVG通暢率越好。
回顧性研究[14]表明,冠脈血流儲備分數與SVG閉塞率相關,若吻合冠脈血流儲備分數正常,則SVG衰敗率增加。但隨后進行的FARGO和GRAFFITT研究[15-16]表明,與傳統造影指導相比,血流儲備分數指導下的CABG未能降低SVG衰敗率。這個可能是因為SVG缺乏豐富的平滑肌層,因此相較于橈動脈,競爭血流對SVG的影響較小。
2.2 手術操作過程中的預防
2.2.1 SVG的獲取
目前,SVG最常用的獲取方法為長切口骨骼化法。該法操作簡單,但獲取的SVG極易發生痙攣。此外,由于手術切口大,患者術后疼痛明顯,傷口感染、血腫、感覺障礙等切口并發癥發生率高,且切口恢復時間也長。
間斷小切口骨骼化法和內窺鏡法(endoscopic vein harvesting,EVH)可以縮小手術切口,降低切口并發癥風險。間斷小切口骨骼化法采用分段式皮膚切口的方式,通過皮下隧道獲取SVG。這種方法的缺點是在結扎側支過程中會造成SVG的過度牽拉,進而損傷內皮層,減弱SVG內皮依賴性舒張功能。如使用導光拉鉤輔助,可在一定程度上減少血管牽拉,減輕對內皮結構與功能的損傷。
EVH法切口更小,更大程度上減少了切口并發癥的發生。早期研究[17-18]表明,相較于傳統長切口骨骼化法,EVH法會顯著增加SVG術后閉塞率,并增加患者再次冠脈血運重建率甚至死亡率。但最新的臨床試驗[19]及Meta分析[20]表明兩種獲取方式在SVG通暢率、再次冠脈血運重建率及死亡率等方面并無顯著差異。有學者[21]認為,各研究中操作者的經驗差異導致結果間的矛盾,不熟練的EVH操作會增加SVG的閉塞率。因此,由經驗豐富的術者實施EVH可能使患者獲益更為顯著。
SVG的另一種獲取方式是“no-touch”法。該法保留SVG的外膜以及周圍的脂肪和結締組織。研究[22]表明,no-touch法獲取的SVG較傳統法術后1年的閉塞率顯著降低,術后16年的長期通暢率可達82.7%。對于老齡合并眾多伴隨疾病的患者,吻合LAD的no-touch法獲取的SVG中期通暢率為95.6%,與左胸廓內動脈(left internal thoracic artery,LITA)相當。一項自身隨機對照試驗[23]表明,no-touch獲取的SVG較橈動脈的吻合口閉塞率顯著下降。此外,使用no-touch法獲取SVG的患者再發心絞痛明顯減少,心功能也顯著改善。No-touch法獲益來源于其保留了血管外脂肪和結締組織,減少SVG痙攣,避免其被擴張;保留外膜中的滋養血管,減輕SVG的缺血性損傷。此外,血管外脂肪和結締組織可作為生物性血管外支架,減輕動脈血流的機械性損傷;還可作為血管活性物質來源,減輕SVG痙攣,擴張外膜中滋養血管,減輕SVG缺血性損傷。因此,與傳統法相比,no-touch法獲取的SVG內皮及內皮型一氧化氮合酶活性保存更為完善,平滑肌表型轉換及內膜增生顯著減少,SVG血管流量顯著增加,從而改善SVG衰敗率[24]。較傳統長切口骨骼化法,no-touch法切口并發癥的發生率有所增加,但其隨著術者熟練度的增加而降低。值得注意的是,最近有研究[25]表明,使用no-touch法獲取SVG的患者冠脈再干預率顯著上升。
總的來說,與傳統骨骼化法、EVH法相比,no-touch法獲取的SVG血管損傷小,內皮、外膜及其滋養血管保存更為完整[26]。Meta分析[27-28]表明,no-touch法較EVH法和傳統法能顯著降低SVG衰敗率,但切口并發癥發生率最高。因此,有術者[29]將EVH法與no-touch法結合,以結合兩者優勢,在維持最佳通暢率的同時,減少切口并發癥的發生,以帶給患者最佳的臨床獲益。
2.2.2 SVG與冠脈靶點的吻合方式
SVG常見的吻合方式為單支端側吻合和序貫吻合(圖1a)。理論上,序貫吻合節約大隱靜脈材料、減少主動脈操作。但由于多個遠端吻合口依賴于同一近端吻合口,若后者閉塞或狹窄,可能會導致大范圍的心肌缺血或梗死。早期研究[30-31]顯示,序貫吻合使得圍術期冠脈再干預率和SVG術后1年衰敗率顯著升高,但最新研究[32-33]表明序貫吻合能顯著降低SVG衰敗率,進而降低患者死亡率。序貫吻合的臨床獲益與其吻合路徑無關,但與遠端吻合口數目相關,近端吻合口的衰敗率隨遠端吻合口數目的增加而降低[34-35]。
 圖1
大隱靜脈與冠狀動脈吻合示意圖
圖1
大隱靜脈與冠狀動脈吻合示意圖
有術者提出可借助LITA分泌的內皮保護物質(如一氧化氮等)來改善SVG衰敗率,有研究[36]表明動-靜脈復合橋的長期通暢率與全動脈橋相似。在Y型橋(SVG近端與LITA進行端-側吻合,SVG遠端與病變冠脈相吻合)中(圖1b),其SVG的5年通暢率可達95.7%。但Y型橋需要將SVG吻合于LITA上,這種術式可能會對LITA的血管完整性及其血流造成損傷,從而影響其遠期通暢率[37]。Stevens等[38]提出了L型橋(首先SVG與心臟前外側病變冠脈吻合,接著將SVG端-側吻合于LAD,最后將LITA吻合至LAD上的SVG)(圖1c)。AIM-PONT研究[38]表明,L型橋使得LITA血流流速顯著增加,且SVG通暢率并不劣于傳統構型。此外,在某些情況下(如左心擴大、LITA中段或遠端明顯鈣化等),LITA難以直接與LAD吻合。因此,有術者[39]提出使用LITA-SVG-LAD的I型橋(SVG近端與LITA末端進行端-端吻合,SVG遠端與LAD進行端-側吻合)(圖1d)。就通暢率而言,I型橋與單純LITA橋無顯著差異,而其通暢率高于升主動脈至非LAD冠脈的SVG通暢率(94.1% vs. 83.9%)[40]。
2.2.3 停跳與非停跳CABG
CABG中停跳和不停跳孰優孰劣一直以來是心外科的熱門話題。最近的3項大型隨機對照試驗[41-47]并未發現不停跳CABG具有額外的臨床獲益,而有研究[46]表明采用不停跳CABG的患者術后1年SVG通暢率顯著降低,術后5年全因死亡率顯著增加[47]。同時,一項納入16項隨機對照臨床實驗的Meta分析[48]表明,采用不停跳CABG的患者橋血管閉塞率增加33.0%,其中SVG閉塞率增加40.0%。同時,研究[49-50]表明,不停跳CABG的冠脈再干預率和長期死亡率顯著增加。因此,2018年歐洲心臟病學會(ESC)心肌血運重建指南[51]強調只在處理嚴重主動脈粥樣硬化(Ⅰ類推薦)或高風險(ⅡA類推薦)患者時,由經驗豐富的外科醫生行不停跳CABG。
2.2.4 術中大隱靜脈橋血管流量檢測
在早期閉塞的SVG中,部分是因為術中技術原因導致。因此,術中發現血流不佳的橋血管,可及時進行糾正,進而減少橋血管早期閉塞及其引起的不良事件。術中瞬時血流測定(transient-time flow measurement,TTFM)通過測量搏動指數和平均橋血管流量來實現術中橋血管的評估,有利于術者判斷橋血管是否存在問題。現有研究[52]表明,高搏動指數和低平均橋血管流量與橋血管的衰敗存在關聯。2018年ESC心肌血運重建指南[51]將術中常規使用TTFM來檢測橋血管質量作為ⅡA類推薦,但TTFM各指標的界值尚未達成共識。基于我國CABG人群的研究[53-54]表明,平均橋血管流量<15.0 mL/min,搏動指數>3.6的SVG衰敗發生率顯著增高。
2.3 藥物預防
目前各項指南建議CABG術后應積極進行二級預防,以降低主要不良心腦血管事件的發生率,提高生活質量。規范的二級預防措施不僅可以延緩冠脈病變進展,還可降低橋血管閉塞率。在CABG術后的二級預防中,抗栓治療與降脂治療已被證明可以顯著降低SVG的閉塞率,從而進一步改善患者的預后。
2.3.1 抗栓治療
急性血栓形成是SVG早期衰敗的主要原因之一。因此,規范化的抗血栓藥物使用對降低SVG閉塞率至關重要。阿司匹林是一種經典的抗血小板藥物,可顯著降低SVG閉塞率。此外,與單用阿司匹林相比,雙抗治療,即聯合使用阿司匹林和血小板P2Y12受體抑制劑,能更顯著地降低SVG閉塞率[55]。就雙抗治療而言,阿司匹林聯合替格瑞洛比阿司匹林聯合氯吡格雷能更有效地抑制血小板聚集[56]。我國患者因CYP2C19基因多態性引起的氯吡格雷抵抗現象較歐美患者更為常見,理論上可以優先考慮使用阿司匹林聯合替格瑞洛治療[57]。然而,最新的Meta分析[58]表明,阿司匹林聯合替格瑞洛會顯著提高出血事件發生率。因此,有研究者[59]提出縮短雙抗治療時間以降低出血事件發生率。目前,一項大型多中心隨機對照試驗(NCT05380063)正在開展,以探討與術后12個月的雙抗治療相比,術后3個月的雙抗治療是否能顯著降低出血事件發生率,且不以SVG衰敗率增加為代價。此外,一些研究者曾嘗試以單用替格瑞洛來取代單用阿司匹林,但研究[60]表明,兩者的SVG通暢率并無顯著差異。目前指南[57, 61]推薦使用SVG的CABG術后應盡早開始雙抗治療,以減少血栓相關的SVG衰敗,但對具體的雙抗治療方案未作出明確推薦。
抗凝藥物(如華法林)同樣能減少血栓形成,從而能夠降低SVG閉塞率,但單用華法林與單用阿司匹林在降低SVG閉塞率方面并無顯著差異[55]。此外,使用華法林還存在許多不便,例如需要定期監測國際標準化比值,同時還需要注意藥物、食物相互作用。因此,目前指南[61]不推薦CABG術后單獨使用華法林預防SVG閉塞。有研究者[62]提出聯合抗血小板藥物和抗凝藥物的雙通道抗栓治療,以期獲得比單用阿司匹林更佳的通暢率。阿司匹林聯合華法林的Post-CABG研究[63]和阿司匹林聯合新型口服抗凝藥的COMPASS-CABG研究[64],均未顯示雙通道抗栓治療能帶來SVG通暢率的獲益。但研究[65]表明,阿司匹林聯合華法林的雙通道抗栓治療需維持國際標準化比值>1.6時,才可降低橋血管衰敗率。
2.3.2 降脂治療
CABG術后患者均屬于動脈粥樣硬化性心血管疾病的極高危人群,甚至大部分屬于超高危人群。這些患者血脂管理的核心是降低膽固醇水平,尤其是低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)水平。LDL-C升高是SVG內膜增生和粥樣硬化斑塊形成的高危因素之一。
他汀類藥物是一種HMG-COA還原酶抑制劑,能夠降低肝細胞內膽固醇合成,從而反饋上調肝細胞表面LDL-C受體,加速循環血液中LDL-C的清除。此外,他汀還能夠改善內皮功能,抑制SMC增生,起到抗炎、穩定斑塊等作用。研究表明,他汀類藥物能夠顯著延緩冠脈和靜脈橋血管粥樣硬化進展[63],且高劑量他汀類藥物還能顯著降低不良心血管事件風險[66]。當前指南[57, 61]建議所有CABG術后患者均應長期接受中強度或高強度的他汀治療。
除LDL-C外,研究[67]也表明PCSK9水平與術后1年SVG衰敗相關。聯合應用他汀類藥物和PCSK9抑制劑(如依洛尤單抗)能明顯延緩冠脈粥樣硬化斑塊進展。目前,一項多中心隨機對照試驗(NCT03900026)正在探討PCSK9抑制劑聯合他汀治療是否能減少SVG衰敗的發生。
低水平的HDL-C和高水平的甘油三脂也是導致SVG粥樣硬化進展的危險因素。根據LOCAT研究[68]結果,吉非羅齊的使用可顯著提高HDL-C水平并降低甘油三脂水平,進而有效抑制SVG中新生病變的進展。同時,REDUCE-IT研究[69]顯示,在他汀治療中加入高純度ω-3脂肪酸可以顯著降低甘油三脂水平,降低約20.0%心血管死亡率。對于合并高甘油三酯血癥的患者,當前指南[57]推薦可以考慮補充高純度ω-3脂肪酸,以進一步減少不良心血管事件的發生。需要注意的是,吉非貝齊聯合他汀類藥物會增加肌溶解或急性腎功能衰竭的風險,而高純度ω-3脂肪酸聯合他汀的安全性和有效性有待進一步評價。
2.4 治療新進展
目前預防SVG衰敗的研究主要集中于兩個方面,一是減少SVG術中內皮損傷,二是抑制SVG內膜增生。例如,通過基因轉染技術或抗增殖藥物來抑制SMC的過度增殖,或者采用新型術中存儲液來更完整地保存SVG內皮。靜脈外支架則通過減少SVG機械性損傷,既減少SVG術中內皮損傷,又減少SVG內膜增生(圖2)。
 圖2
XXXX
圖2
XXXX
2.4.1 基因療法
許多研究利用基因轉染技術來抑制或促進特定基因的表達,以實現對內膜增生的抑制或內皮功能的改善。近年來,人們對microRNA的認識越來越深入,其參與轉錄后基因的表達調控。動物實驗[70-71]表明,microRNA-423、microRNA-145的表達上調可促進內皮細胞增殖而抑制SMC的增殖、遷移和表型轉換,從而顯著減少靜脈橋的內膜增生;而microRNA-21的表達上調則促使成纖維細胞轉化為肌成纖維細胞,從而促進內膜增生的形成[72]。此外,APOA1基因過表達可以顯著減少靜脈橋血管中的脂質聚集,有望延緩靜脈橋粥樣硬化病變進展[73]。
2.4.2 藥物治療
SMC過度增殖會導致SVG狹窄甚至閉塞,因此抑制SMC的過度增殖是有效預防SVG衰敗的治療靶點之一。許多抑制SMC增殖的藥物已在動物模型中顯示出具有抑制靜脈橋血管內膜增生的作用,如作用于p38 MAPK-MK2通路的己酮可可堿和MK2肽類抑制劑、作用于Rb-E2F通路的全反式視黃酸[74-76]。此外,亦有研究通過進一步優化降脂或抗栓治療來減少靜脈橋血管衰敗。在動物研究[77]中,膽固醇酯轉移蛋白抑制劑可以增加HDL-C濃度,抑制內皮炎癥、改善內皮功能、減少SMC增殖,從而抑制靜脈橋血管內膜增生;使用新型納米輸送裝置的替羅非班亦可顯著改善橋血管通暢率[78]。
2.4.3 大隱靜脈存儲液
SVG獲取后常需短暫體外儲存以待吻合至冠脈。在此期間,SVG會受缺血性損傷,吻合后還會進一步受再灌注損傷。因此,如何減輕SVG的缺血-再灌注損傷以改善SVG通暢率成為一個新的治療方向。目前術中常使用肝素化生理鹽水或全血儲存SVG,但生理鹽水或全血并不具有良好的生物相容性。正常人動脈血液的酸堿度(pH值)為7.4~7.5,而生理鹽水的pH值為7.0,且缺乏營養物質。此外,體外全血中的中性粒細胞因空氣暴露而被激活,進一步導致組織損傷。研究[79]表明,與肝素化生理鹽水或全血相比,平衡鹽溶液顯著降低術后1年SVG衰敗率,降低術后5年死亡、心肌梗死及再次冠脈血運重建的復合事件發生率。盡管平衡鹽溶液具有良好的生物相容性,但其缺少抗缺血-再灌注損傷的作用。因此,含有谷胱甘肽、L-抗壞血酸和L-精氨酸的平衡鹽溶液(DuraGraft液)被用以減少SVG缺血-再灌注損傷。與生理鹽水、全血和平衡鹽溶液相比,存儲于DuraGraft液的SVG具有更高的內皮活性,更低氧化應激水平,更少的細胞凋亡,更良好的舒張功能及更少的痙攣[80-83]。臨床研究[84-85]表明,術中將SVG暫存于DuraGraft液可顯著降低非致死性心肌梗死和再次冠脈血運重建的風險,且能更有效地延緩SVG的內膜增生。一項歐洲多中心注冊研究(NCT02922088)擬前瞻性評估DuraGraft液的臨床獲益。
2.4.4 靜脈外支架
靜脈外支架的概念在上世紀60年代被提出。靜脈外支架可以減少SVG與吻合動脈之間的直徑差異,增強剪切應力并減弱周向拉伸力。臨床研究[86]已表明,VEST靜脈外支架可顯著減少SVG的內膜增生,并增加SVG管腔的均勻度。但VEST為合金支架,存在異物相關的感染風險,因此,可降解外支架被認為更具有臨床應用前景。目前,在動物模型中,可降解外支架能顯著抑制SMC細胞增殖,抑制靜脈橋血管的內膜增生[87-89]。此外,將抑制SMC增生的藥物與可降解外支架相結合能更有效地抑制靜脈橋血管內膜增生[89]。Zhang等[90]將可降解外支架與藥物相結合,通過使用不同降解性的材料使藥物釋放速率不同,從而能更有效地針對靜脈橋衰敗的三階段,結果表明該支架不僅更為有效地保存內皮細胞,還能抑制SMC增殖及表型轉換,從而顯著減少內膜增生。
2.4.5 其他
因為術中靜脈外支架的使用增加了手術難度,有研究者[91]對靜脈外膜進行光化學組織鈍化或乙二醛浸潤,使外膜中膠原纖維交聯,以獲得類似于靜脈外支架的作用,從而使得靜脈硬度增加、順應性降低。動物實驗[92-93]表明,靜脈外膜中膠原纖維交聯可以顯著抑制靜脈橋的內膜增生。
有術者[94]認為SVG中的靜脈瓣會使得舒張期血流減緩乃至相對停滯,使得SVG衰敗率增加。研究[94-95]表明,靜脈瓣切除使得SVG流量顯著增加,術后1年通暢率約為97.1%,術后3年通暢率約為96.1%。此外,有術者[96]認為吻合于后降支的SVG高閉塞率是因為遠端吻合口受膈肌擠壓所致。研究[97]表明,增強后降支遠段吻合口穩定性可以顯著降低SVG閉塞率。
3 總結與展望
SVG衰敗是一個多因素、多階段的過程,需要從多方面進行預防。其中最為關鍵的是手術因素,包括SVG獲取方式、吻合口以及吻合方式的選擇等。此外,抗栓藥物與降脂藥物的使用也至關重要。此外,基因療法、藥物治療、術中存儲液及靜脈外支架都有望進一步降低SVG衰敗發生率,從而改善CABG術后患者的預后。
利益沖突:無。
作者貢獻:何廖銘負責論文設計、文獻查閱和論文初稿撰寫;希爾艾力·鐵木爾尼亞孜負責文獻查閱分析和論文初稿撰寫;宋仰午負責論文審閱與修改;鳳瑋負責論文設計,定稿。