急性主動脈夾層(acute aortic dissection,AAD)是指發病2周以內的主動脈內膜撕裂,起病急、進展迅速、死亡率高[1],臨床主要依靠計算機斷層血管造影(computed tomography angiography,CTA)明確診斷、分型及對病情嚴重程度評估。Stanford分型是AAD最常用的解剖分型之一,其依據夾層撕裂范圍是否累及升主動脈將AAD分為急性A型主動脈夾層(acute type A aortic dissection,ATAAD)和急性B型主動脈夾層(acute type B aortic dissection,ATBAD)[2]。ATAAD及復雜型ATBAD(伴隨破裂或臟器灌注異常),往往亟需行緊急外科手術治療。近20年來,我們在AAD的診斷和治療領域取得了顯著進展,非復雜型ATBAD更傾向于采用手術腔內修復治療,顯示出外科手術治療在AAD治療中的廣泛應用趨勢。雖然最新研究[3]表明,AAD患者手術死亡率已降至5.8%~8.0%,但臨床上仍然存在一部分AAD患者在手術前或手術中出現主動脈突然破裂或術后并發癥等原因導致死亡。因此,充分利用患者術前的臨床資料及CTA數據,深入探討AAD患者圍手術期內死亡的相關危險因素,對于術前精準預測患者死亡風險、術中及術后有效規避和糾正這些風險,以及加強醫患間的有效溝通,均具有極其重要的意義。
關于AAD患者死亡風險的研究,既往多聚焦于術后死亡情況,揭示了多種生物標志物、影像學特征和手術相關因素均是影響AAD患者預后的危險因素,然而部分生物標志物臨床獲取困難或缺乏特異性[4]。此外,先前的研究在探討AAD患者預后時,大部分僅納入ATAAD患者為研究對象,關于ATBAD患者預后的相關危險因素研究報道較少。本研究回顧性收集AAD患者術前臨床資料和CTA數據,旨在定量評估并早期預測圍手術期死亡風險,不受術中及術后各種客觀因素影響,適用于不同醫療水平的機構。研究同時納入ATAAD和ATBAD患者,以構建一個簡單、快速、有效且適用范圍廣的圍手術期死亡風險預測模型,為臨床醫師快速識別高風險患者提供更具價值的參考依據,從而制定更為精準的治療方案。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2013年2月—2023年7月在遵義醫科大學附屬醫院診治的AAD患者,其中圍手術期內死亡的患者納入死亡組,隨機篩選同時期治療好轉的AAD患者納入未死亡組。納入標準:① 發病時間<2周;② 所有AAD患者均于我院行CTA明確診斷。排除標準:① 外傷或醫源性所致主動脈夾層者;② 既往曾行主動脈手術者;③ 數據不完整者。收集患者入院時的臨床基線資料及CTA檢查數據,并將缺省值≥20%的變量排除,缺省值<20%的變量采用多重插補法填補。主動脈夾層按Stanford標準進行分類。所有納入研究的患者在急診救治中均接受了標準的醫療救治措施,包括血壓控制、心率控制和必要的疼痛緩解,以最大程度降低以上因素對疾病進展的潛在影響。
1.2 發病時間、主動脈夾層破口形態定義
發病時間定義為患者首次突發胸背部劇烈、撕裂樣疼痛的確切發作時間。主動脈夾層撕裂破口形態呈圓形或類圓形為規則形,其他形狀為不規則形。
1.3 統計學分析
運用 SPSS 18.0對所有數據進行統計分析。采用 Shapiro-Wilk 檢驗對計量資料進行正態性分析,符合正態分布數據用均數±標準差(x±s)表示,兩組間比較采用獨立樣本t檢驗;非正態分布數據采用中位數及四分位數間距[M(IQR)]表示,兩組間比較采用Mann-Whitney U檢驗。計數資料以例數和百分比描述,兩組間比較采用獨立樣本χ2檢驗或Fisher確切概率法。選取差異有統計學意義的變量(P<0.05)作為自變量進行多因素二分類logistic回歸分析,篩選患者死亡的獨立預測因素,并構建Nonogram預測模型。P≤0.05為差異有統計學意義。
2 結果
2.1 兩組患者臨床資料的比較
共納入AAD患者270例,其中死亡組60例[男42例、女18例,平均年齡(56.89±13.42)歲],未死亡組210例[男163例、女47例,平均年齡(56.15±13.77)歲]。死亡組中,ATAAD患者32例(53.3%),ATBAD患者28例(46.7%);未死亡組中,ATAAD患者37例(17.6%),ATBAD患者173例(82.4%)。
死亡組和未死亡組在年齡、性別、主動脈形態、主動脈潰瘍及壁間血腫情況、平掃及增強時真腔CT值及二者差值、假腔內附壁血栓情況、冠狀動脈及其他主要分支血管受累情況、腹膜后積液積血、丙氨酸轉氨酶等生化指標方面,以及吸煙史、飲酒史、糖尿病病史、高血壓病史、心腦血管病史等既往病史方面差異均無統計學意義(P>0.05)。
死亡組與未死亡組在主動脈夾層分型、升主動脈及降主動脈最大管徑值、主動脈斑塊分布情況、夾層破口數目、位置及形態、假腔增強CT值及假腔增強與平掃CT差值、胸腔及心包積液情況、入院時血壓情況、血紅蛋白、血糖、尿酸、門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、AST/丙氨酸氨基轉移酶、凝血酶原時間及主動脈夾層手術等方面差異均有統計學意義(P<0.05)。ATAAD較ATBAD死亡率更高,死亡組收縮壓、舒張壓、血紅蛋白計數較未死亡組降低(P<0.05);見表1。
2.2 多因素logistic回歸分析
多因素logistic回歸分析顯示,主動脈夾層A型、破口形態不規則、血紅蛋白降低、尿酸增高、AST增高是AAD患者圍手術期死亡的獨立危險因素(P<0.05);見表2。
2.3 圍手術期死亡風險預測評分模型的建立及效能評價
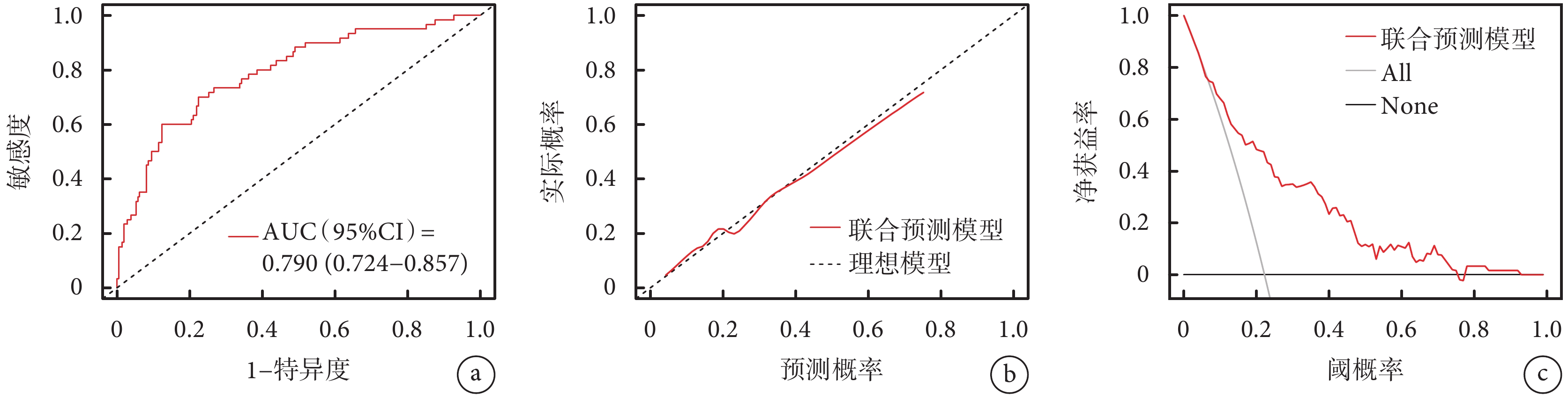
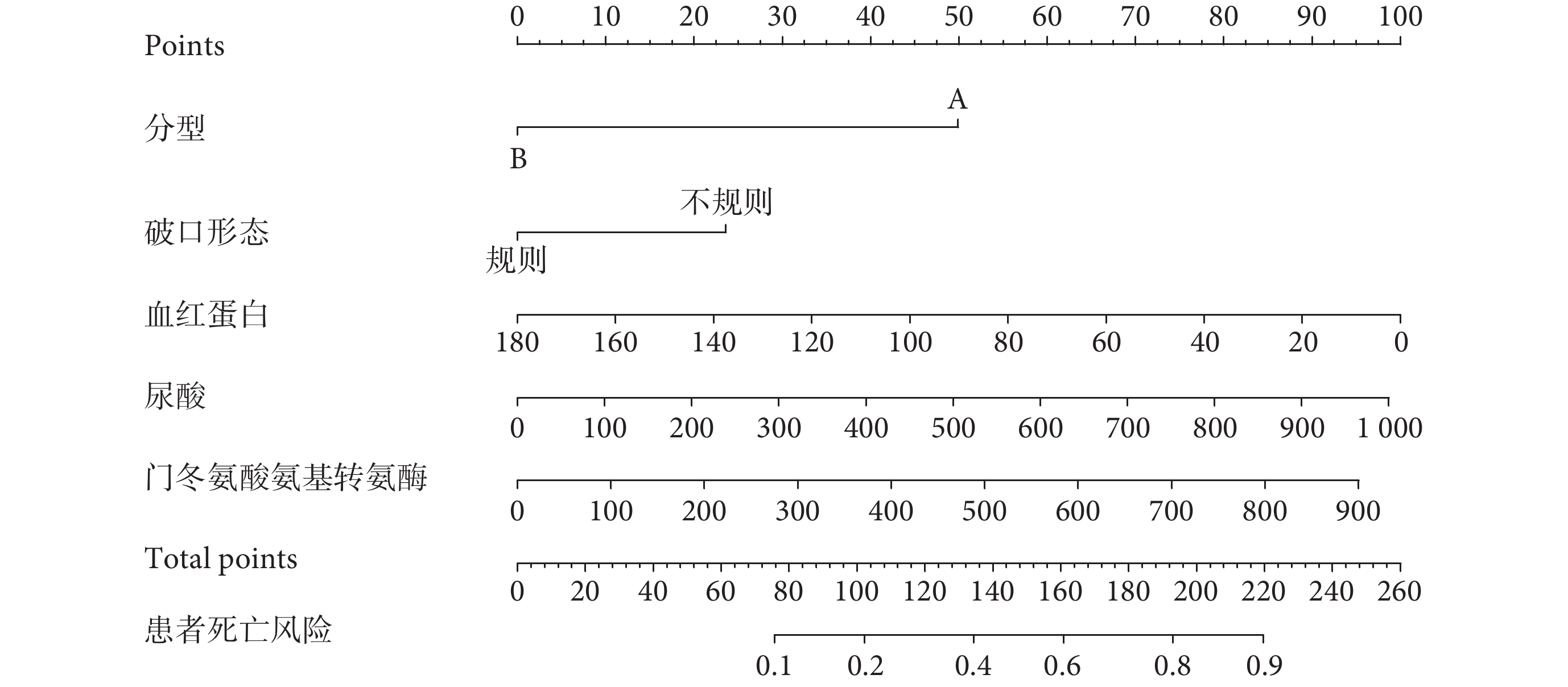
基于多因素logistic回歸分析中的5個獨立危險因素建立預測模型。利用受試者工作特征曲線下面積(area under the curve,AUC)對模型的預測效能進行評價。一般認為AUC>0.8為優秀,0.71~0.8為中等,0.6~0.7為差,<0.6為無意義,AUC≥0.71時具有較好的區分度,模型有臨床預測價值。該預測模型的AUC為0.790[95%CI(0.724,0.857)];見圖1a。預測模型的校準曲線顯示,該模型具有良好的一致性和穩定性。臨床決策曲線顯示,預測模型呈顯著正效應,患者獲益概率范圍廣,具有臨床實用價值;見圖1b~c。對模型進行內部驗證:1000次重復抽樣bootstrap的C-index(AUC)為0.771,十折交叉驗證的AUC為0.795,最佳截斷值為0.223;預測準確度0.759,敏感度0.700,特異度0.776,陽性預測值0.472,陰性預測值0.901,該模型性能良好。最后,將該預測模型以Nomogram的形式展現;見圖2。患者的每個獨立預測因素分值之和為總得分,總得分對應在AAD患者圍手術期死亡風險軸上的數值即為死亡發生的風險,總分越高,死亡風險越高。
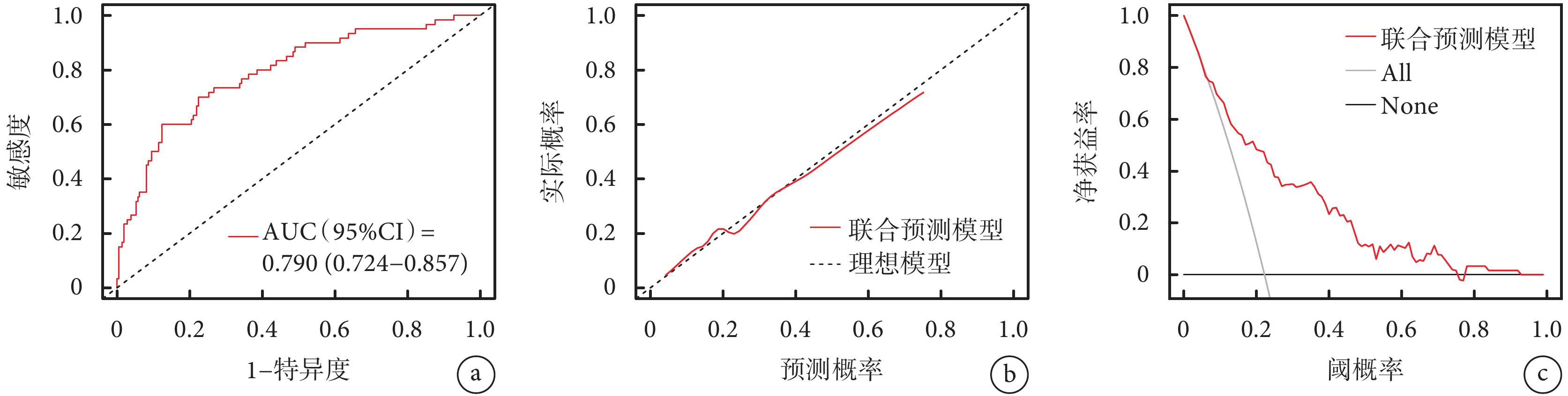 圖1
模型的效能評價
圖1
模型的效能評價
a:預測模型的受試者工作特征曲線;b:預測模型的校準曲線;c:預測模型的臨床決策曲線
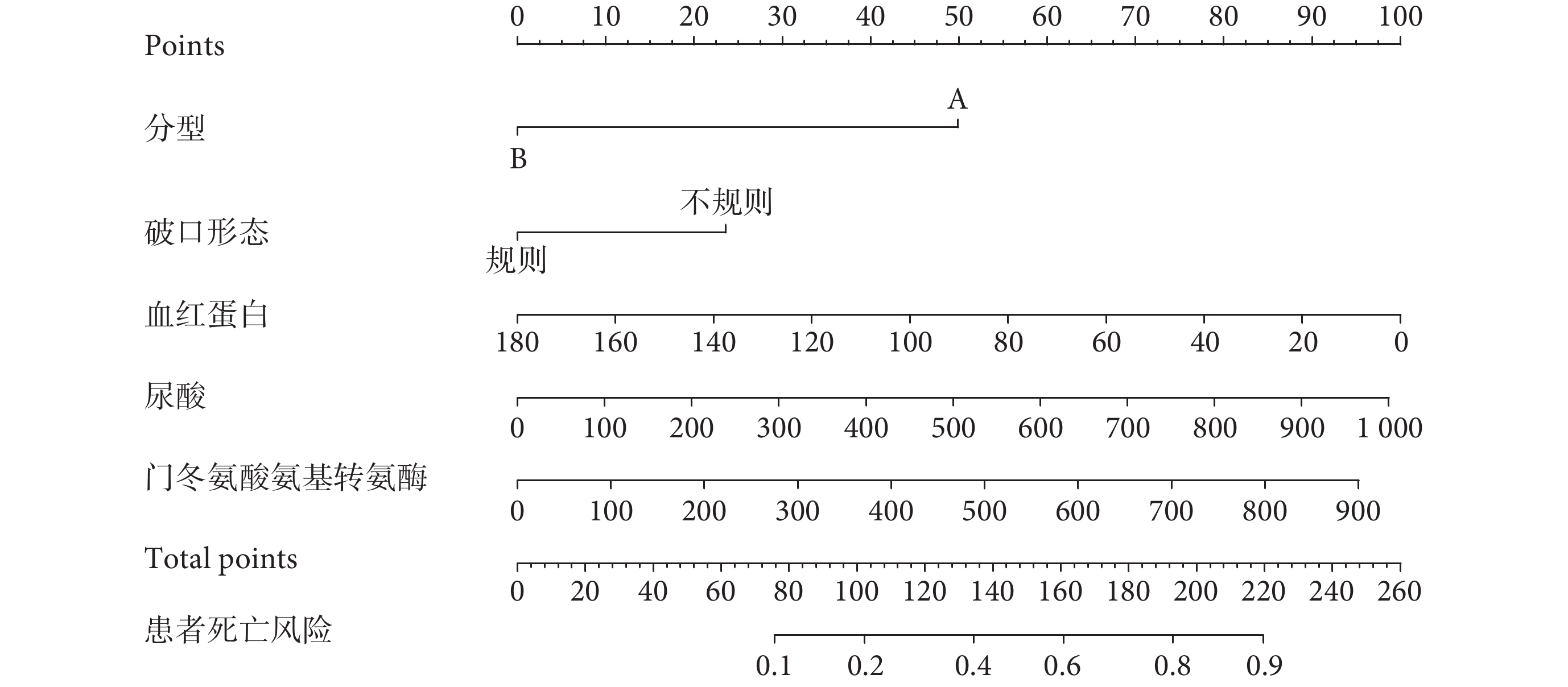 圖2
圍手術期死亡的Nomogram預測模型
圖2
圍手術期死亡的Nomogram預測模型
3 討論
本研究結果顯示,主動脈夾層A型、破口形態不規則、血紅蛋白降低、尿酸增高、AST增高是AAD患者圍手術期死亡的獨立風險因素。基于上述5個獨立危險因素建立的預測模型AUC為0.790,具有較好的預測效能。
3.1 本研究與既往預后研究的比較
既往關于AAD患者的研究多聚焦于術后死亡風險相關性研究,然而,由于AAD患者術前發病到確診時間差異,病情進展迅速,以及受到患者心臟功能、肝腎功能、手術技術、手術方式、手術時間、插管方法、輸血量、術后護理等多方面因素的復雜影響,導致既往文獻報道的AAD術后早期死亡危險因素存在較大差異。同時,雖然既往研究納入的變量眾多且相對全面,但這也意味著術前難以實現對患者圍手術期死亡風險的預測。本研究構建了一個基于AAD患者術前相關資料早期預判AAD患者圍手術期死亡風險的Nomogram預測模型,且校準曲線顯示模型結果具有良好的一致性和穩定性,臨床決策曲線顯示模型呈顯著正效應,患者獲益概率范圍廣,具有臨床實用價值。同時,在研究過程中,我們發現部分AAD患者病情兇險、進展迅猛,甚至在術前或術中短時間內死亡,為挽救生命往往需要緊急行外科手術治療。這類患者的術前資料往往存在嚴重缺失,包括D-二聚體、C反應蛋白、腎功能等已被證實的危險因素[1]。為確保模型的準確性、可靠性及實用性,我們將缺省值≥20%的變量排除在外,最終,用于構建模型的變量在臨床上易于獲取,即使在患者危重的情況下也能實現。
關于ATBAD患者院內死亡風險因素的研究相對較少。馬倩倩等[5]、張煥耀等[6]對AAD患者院內死亡的危險因素進行分析,研究中未納入影像學資料,且未能建立有效的預測模型。李末寒等[7]利用急診室測得的生命體征及血常規、肝腎功能、凝血功能等實驗標志物建立了AAD患者住院期間死亡的預警評分模型。張煒宗等[8]通過Bayes判別方程的方法建立預測模型,對AD 患者的院內結局進行初步預測。以上兩個模型納入了ATAAD及ATBAD患者,但這兩個預測模型都缺乏對影像學資料的全面納入和分析,并且Bayes判別方程建立的模型在臨床應用中需要量化并計算各項指標,臨床易用性較差。相較之下,本研究在變量資料的納入上更為全面,最終納入研究的變量在臨床上易于獲取且缺失幾率較小。利用以上資料建立的預測模型不僅臨床實用性更強,而且還可以將模型可視化,臨床應用更加便捷。
3.2 主動脈夾層分型對預后的影響
AAD分型對患者的預后至關重要。Stanford A型是公認的AD中最為兇險的類型,其死亡率顯著高于Stanford B型[9]。盡管我們在AD的診斷和治療方面取得了顯著進展,但ATAAD的短期生存率依然遠低于ATBAD[10]。近來,Chi等[11]利用壁面剪切應力對主動脈進行了深入評估,并發現升主動脈灌注不良是主動脈破裂的高風險因素,尤其是主動脈弓部更容易發生破裂。ATAAD夾層累及升主動脈,其主動脈破裂風險比ATBAD高。主動脈一旦破裂,主動脈腔內的血液會迅速通過破裂口進入胸腔或者心包,造成血胸、心包壓塞、呼吸困難以及低血容量休克等一系列嚴重癥狀,導致患者死亡風險驟升。此外,當ATAAD夾層撕裂累及主動脈根部或冠狀動脈時,冠狀動脈的撕裂或夾層假腔的壓迫可能引起心肌缺血,進而導致急性心肌梗死。AAD合并急性心肌梗死的病情極為嚴重,其死亡率極高。有研究[12]表明,ATAAD同時累及左冠狀動脈和右冠狀動脈的患者死亡率近100%。
3.3 破口形態對預后的影響
影像學資料在AAD患者的診斷及預后判斷中發揮至關重要的作用。本研究顯示,AAD的破口形態是AAD患者圍手術期死亡風險的獨立危險因素。主動脈作為人體的主干血管,管腔內血流量巨大,同時承受著心臟搏動帶來的持續壓力,因此主動脈夾層破裂的風險極高。破口形態影響著主動脈夾層真腔與假腔內血流速度。AD每種破口類型的血流速度分布既存在共性,又呈現出既定的規律。通常,假腔內血流速度相較于真腔內血流更為緩慢,且血流速度在破裂入口及破裂出口處有明顯的加快,最大血流速度以破裂入口處分布居多,且隨著破口形態不同有所變化,常在真腔破口處見到明顯的渦流[13]。真腔及假腔內血流動力學的變化往往引起血管灌注不良,血管灌注不良不僅會導致腎功能障礙、肝臟功能不全等嚴重并發癥,還可能影響冠狀動脈的灌注,從而增加AAD患者圍手術期死亡風險[14]。
3.4 血紅蛋白、尿酸、AST對預后的影響
生物標志物在AD預后研究中的應用已日益廣泛。由于AAD撕裂范圍差異顯著,受累血管各不相同,其灌注不良可能導致肝臟、腎臟等臟器的功能受損,這些生物標志物為評估AAD患者臟器功能狀態提供了客觀依據。多項研究已證實,D-二聚體[15]、C-反應蛋白[16]、尿酸[14,17]、腎功能不全[15,18]、肝功能障礙[19]等指標與ATAAD術后早期死亡風險密切相關,與本研究結果基本相似。在本研究中,血紅蛋白是AAD患者圍手術期死亡的重要危險因素之一。AAD患者由于夾層血管破裂出血,常導致紅細胞丟失和血容量不足,進而表現為血紅蛋白水平降低。血紅蛋白的下降不僅會導致血液稀釋和組織氧合不足,還可能引起一系列并發癥,如營養不良、心肌缺血和腎功能不全,甚至可能導致主動脈功能障礙[12]。然而,在研究過程中,我們觀察到部分AAD患者雖然伴有血紅蛋白下降、心包或胸腔積血,但在手術中并未發現明顯的夾層血管破裂口。我們推測,這可能是由于主動脈夾層真腔與假腔之間的壓力差過大,導致滲透壓增加,進而使得血液通過血管壁滲透到心包或胸腔中。這一發現為我們深入理解AAD的病理生理過程提供了新的視角,也為未來的治療策略制定提供了重要參考。
本研究存在一定的局限性。第一,本研究為單中心回顧性研究,受限于病例數較少和部分變量數據的缺失,研究結果可能存在一定偏倚。第二,本研究以圍手術期死亡作為研究終點,雖然能在一定程度上反映患者的短期預后,但缺乏中長期隨訪結果,這可能導致我們對患者長期生存情況的了解不夠充分,進而影響到結果的準確性。第三,雖然本研究建立了預測模型并進行了內部檢驗,但為提高模型的預測效率和準確性,還需要進一步進行外部驗證。第四,CTA圖像結果的獲得存在一定的主觀性和測量誤差,未來我們擬采用深度學習及影像組學對CTA圖像進行分析處理,為預測模型提供更多的影像特征參數。
綜上所述,本研究基于術前血紅蛋白、尿酸、AST、夾層分型和夾層破口形態這5個獨立危險因素,成功構建了AAD圍手術期死亡風險預測模型。該模型不僅簡單易行,而且其所需指標在臨床實踐中易于獲取。因此,該模型能夠幫助臨床醫師在早期階段快速識別高風險患者,為制定更為精準和有效的醫療決策提供有力支持。
利益沖突:無。
作者貢獻:鄧鐵負責實施研究,收集、分析數據,論文撰寫;李邦國負責收集、分析數據,論文指導性評閱,支持性貢獻;余洪負責論文選題與設計,數據分析與解釋,修改論文。
急性主動脈夾層(acute aortic dissection,AAD)是指發病2周以內的主動脈內膜撕裂,起病急、進展迅速、死亡率高[1],臨床主要依靠計算機斷層血管造影(computed tomography angiography,CTA)明確診斷、分型及對病情嚴重程度評估。Stanford分型是AAD最常用的解剖分型之一,其依據夾層撕裂范圍是否累及升主動脈將AAD分為急性A型主動脈夾層(acute type A aortic dissection,ATAAD)和急性B型主動脈夾層(acute type B aortic dissection,ATBAD)[2]。ATAAD及復雜型ATBAD(伴隨破裂或臟器灌注異常),往往亟需行緊急外科手術治療。近20年來,我們在AAD的診斷和治療領域取得了顯著進展,非復雜型ATBAD更傾向于采用手術腔內修復治療,顯示出外科手術治療在AAD治療中的廣泛應用趨勢。雖然最新研究[3]表明,AAD患者手術死亡率已降至5.8%~8.0%,但臨床上仍然存在一部分AAD患者在手術前或手術中出現主動脈突然破裂或術后并發癥等原因導致死亡。因此,充分利用患者術前的臨床資料及CTA數據,深入探討AAD患者圍手術期內死亡的相關危險因素,對于術前精準預測患者死亡風險、術中及術后有效規避和糾正這些風險,以及加強醫患間的有效溝通,均具有極其重要的意義。
關于AAD患者死亡風險的研究,既往多聚焦于術后死亡情況,揭示了多種生物標志物、影像學特征和手術相關因素均是影響AAD患者預后的危險因素,然而部分生物標志物臨床獲取困難或缺乏特異性[4]。此外,先前的研究在探討AAD患者預后時,大部分僅納入ATAAD患者為研究對象,關于ATBAD患者預后的相關危險因素研究報道較少。本研究回顧性收集AAD患者術前臨床資料和CTA數據,旨在定量評估并早期預測圍手術期死亡風險,不受術中及術后各種客觀因素影響,適用于不同醫療水平的機構。研究同時納入ATAAD和ATBAD患者,以構建一個簡單、快速、有效且適用范圍廣的圍手術期死亡風險預測模型,為臨床醫師快速識別高風險患者提供更具價值的參考依據,從而制定更為精準的治療方案。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2013年2月—2023年7月在遵義醫科大學附屬醫院診治的AAD患者,其中圍手術期內死亡的患者納入死亡組,隨機篩選同時期治療好轉的AAD患者納入未死亡組。納入標準:① 發病時間<2周;② 所有AAD患者均于我院行CTA明確診斷。排除標準:① 外傷或醫源性所致主動脈夾層者;② 既往曾行主動脈手術者;③ 數據不完整者。收集患者入院時的臨床基線資料及CTA檢查數據,并將缺省值≥20%的變量排除,缺省值<20%的變量采用多重插補法填補。主動脈夾層按Stanford標準進行分類。所有納入研究的患者在急診救治中均接受了標準的醫療救治措施,包括血壓控制、心率控制和必要的疼痛緩解,以最大程度降低以上因素對疾病進展的潛在影響。
1.2 發病時間、主動脈夾層破口形態定義
發病時間定義為患者首次突發胸背部劇烈、撕裂樣疼痛的確切發作時間。主動脈夾層撕裂破口形態呈圓形或類圓形為規則形,其他形狀為不規則形。
1.3 統計學分析
運用 SPSS 18.0對所有數據進行統計分析。采用 Shapiro-Wilk 檢驗對計量資料進行正態性分析,符合正態分布數據用均數±標準差(x±s)表示,兩組間比較采用獨立樣本t檢驗;非正態分布數據采用中位數及四分位數間距[M(IQR)]表示,兩組間比較采用Mann-Whitney U檢驗。計數資料以例數和百分比描述,兩組間比較采用獨立樣本χ2檢驗或Fisher確切概率法。選取差異有統計學意義的變量(P<0.05)作為自變量進行多因素二分類logistic回歸分析,篩選患者死亡的獨立預測因素,并構建Nonogram預測模型。P≤0.05為差異有統計學意義。
2 結果
2.1 兩組患者臨床資料的比較
共納入AAD患者270例,其中死亡組60例[男42例、女18例,平均年齡(56.89±13.42)歲],未死亡組210例[男163例、女47例,平均年齡(56.15±13.77)歲]。死亡組中,ATAAD患者32例(53.3%),ATBAD患者28例(46.7%);未死亡組中,ATAAD患者37例(17.6%),ATBAD患者173例(82.4%)。
死亡組和未死亡組在年齡、性別、主動脈形態、主動脈潰瘍及壁間血腫情況、平掃及增強時真腔CT值及二者差值、假腔內附壁血栓情況、冠狀動脈及其他主要分支血管受累情況、腹膜后積液積血、丙氨酸轉氨酶等生化指標方面,以及吸煙史、飲酒史、糖尿病病史、高血壓病史、心腦血管病史等既往病史方面差異均無統計學意義(P>0.05)。
死亡組與未死亡組在主動脈夾層分型、升主動脈及降主動脈最大管徑值、主動脈斑塊分布情況、夾層破口數目、位置及形態、假腔增強CT值及假腔增強與平掃CT差值、胸腔及心包積液情況、入院時血壓情況、血紅蛋白、血糖、尿酸、門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、AST/丙氨酸氨基轉移酶、凝血酶原時間及主動脈夾層手術等方面差異均有統計學意義(P<0.05)。ATAAD較ATBAD死亡率更高,死亡組收縮壓、舒張壓、血紅蛋白計數較未死亡組降低(P<0.05);見表1。
2.2 多因素logistic回歸分析
多因素logistic回歸分析顯示,主動脈夾層A型、破口形態不規則、血紅蛋白降低、尿酸增高、AST增高是AAD患者圍手術期死亡的獨立危險因素(P<0.05);見表2。
2.3 圍手術期死亡風險預測評分模型的建立及效能評價
基于多因素logistic回歸分析中的5個獨立危險因素建立預測模型。利用受試者工作特征曲線下面積(area under the curve,AUC)對模型的預測效能進行評價。一般認為AUC>0.8為優秀,0.71~0.8為中等,0.6~0.7為差,<0.6為無意義,AUC≥0.71時具有較好的區分度,模型有臨床預測價值。該預測模型的AUC為0.790[95%CI(0.724,0.857)];見圖1a。預測模型的校準曲線顯示,該模型具有良好的一致性和穩定性。臨床決策曲線顯示,預測模型呈顯著正效應,患者獲益概率范圍廣,具有臨床實用價值;見圖1b~c。對模型進行內部驗證:1000次重復抽樣bootstrap的C-index(AUC)為0.771,十折交叉驗證的AUC為0.795,最佳截斷值為0.223;預測準確度0.759,敏感度0.700,特異度0.776,陽性預測值0.472,陰性預測值0.901,該模型性能良好。最后,將該預測模型以Nomogram的形式展現;見圖2。患者的每個獨立預測因素分值之和為總得分,總得分對應在AAD患者圍手術期死亡風險軸上的數值即為死亡發生的風險,總分越高,死亡風險越高。
 圖1
模型的效能評價
圖1
模型的效能評價
a:預測模型的受試者工作特征曲線;b:預測模型的校準曲線;c:預測模型的臨床決策曲線
 圖2
圍手術期死亡的Nomogram預測模型
圖2
圍手術期死亡的Nomogram預測模型
3 討論
本研究結果顯示,主動脈夾層A型、破口形態不規則、血紅蛋白降低、尿酸增高、AST增高是AAD患者圍手術期死亡的獨立風險因素。基于上述5個獨立危險因素建立的預測模型AUC為0.790,具有較好的預測效能。
3.1 本研究與既往預后研究的比較
既往關于AAD患者的研究多聚焦于術后死亡風險相關性研究,然而,由于AAD患者術前發病到確診時間差異,病情進展迅速,以及受到患者心臟功能、肝腎功能、手術技術、手術方式、手術時間、插管方法、輸血量、術后護理等多方面因素的復雜影響,導致既往文獻報道的AAD術后早期死亡危險因素存在較大差異。同時,雖然既往研究納入的變量眾多且相對全面,但這也意味著術前難以實現對患者圍手術期死亡風險的預測。本研究構建了一個基于AAD患者術前相關資料早期預判AAD患者圍手術期死亡風險的Nomogram預測模型,且校準曲線顯示模型結果具有良好的一致性和穩定性,臨床決策曲線顯示模型呈顯著正效應,患者獲益概率范圍廣,具有臨床實用價值。同時,在研究過程中,我們發現部分AAD患者病情兇險、進展迅猛,甚至在術前或術中短時間內死亡,為挽救生命往往需要緊急行外科手術治療。這類患者的術前資料往往存在嚴重缺失,包括D-二聚體、C反應蛋白、腎功能等已被證實的危險因素[1]。為確保模型的準確性、可靠性及實用性,我們將缺省值≥20%的變量排除在外,最終,用于構建模型的變量在臨床上易于獲取,即使在患者危重的情況下也能實現。
關于ATBAD患者院內死亡風險因素的研究相對較少。馬倩倩等[5]、張煥耀等[6]對AAD患者院內死亡的危險因素進行分析,研究中未納入影像學資料,且未能建立有效的預測模型。李末寒等[7]利用急診室測得的生命體征及血常規、肝腎功能、凝血功能等實驗標志物建立了AAD患者住院期間死亡的預警評分模型。張煒宗等[8]通過Bayes判別方程的方法建立預測模型,對AD 患者的院內結局進行初步預測。以上兩個模型納入了ATAAD及ATBAD患者,但這兩個預測模型都缺乏對影像學資料的全面納入和分析,并且Bayes判別方程建立的模型在臨床應用中需要量化并計算各項指標,臨床易用性較差。相較之下,本研究在變量資料的納入上更為全面,最終納入研究的變量在臨床上易于獲取且缺失幾率較小。利用以上資料建立的預測模型不僅臨床實用性更強,而且還可以將模型可視化,臨床應用更加便捷。
3.2 主動脈夾層分型對預后的影響
AAD分型對患者的預后至關重要。Stanford A型是公認的AD中最為兇險的類型,其死亡率顯著高于Stanford B型[9]。盡管我們在AD的診斷和治療方面取得了顯著進展,但ATAAD的短期生存率依然遠低于ATBAD[10]。近來,Chi等[11]利用壁面剪切應力對主動脈進行了深入評估,并發現升主動脈灌注不良是主動脈破裂的高風險因素,尤其是主動脈弓部更容易發生破裂。ATAAD夾層累及升主動脈,其主動脈破裂風險比ATBAD高。主動脈一旦破裂,主動脈腔內的血液會迅速通過破裂口進入胸腔或者心包,造成血胸、心包壓塞、呼吸困難以及低血容量休克等一系列嚴重癥狀,導致患者死亡風險驟升。此外,當ATAAD夾層撕裂累及主動脈根部或冠狀動脈時,冠狀動脈的撕裂或夾層假腔的壓迫可能引起心肌缺血,進而導致急性心肌梗死。AAD合并急性心肌梗死的病情極為嚴重,其死亡率極高。有研究[12]表明,ATAAD同時累及左冠狀動脈和右冠狀動脈的患者死亡率近100%。
3.3 破口形態對預后的影響
影像學資料在AAD患者的診斷及預后判斷中發揮至關重要的作用。本研究顯示,AAD的破口形態是AAD患者圍手術期死亡風險的獨立危險因素。主動脈作為人體的主干血管,管腔內血流量巨大,同時承受著心臟搏動帶來的持續壓力,因此主動脈夾層破裂的風險極高。破口形態影響著主動脈夾層真腔與假腔內血流速度。AD每種破口類型的血流速度分布既存在共性,又呈現出既定的規律。通常,假腔內血流速度相較于真腔內血流更為緩慢,且血流速度在破裂入口及破裂出口處有明顯的加快,最大血流速度以破裂入口處分布居多,且隨著破口形態不同有所變化,常在真腔破口處見到明顯的渦流[13]。真腔及假腔內血流動力學的變化往往引起血管灌注不良,血管灌注不良不僅會導致腎功能障礙、肝臟功能不全等嚴重并發癥,還可能影響冠狀動脈的灌注,從而增加AAD患者圍手術期死亡風險[14]。
3.4 血紅蛋白、尿酸、AST對預后的影響
生物標志物在AD預后研究中的應用已日益廣泛。由于AAD撕裂范圍差異顯著,受累血管各不相同,其灌注不良可能導致肝臟、腎臟等臟器的功能受損,這些生物標志物為評估AAD患者臟器功能狀態提供了客觀依據。多項研究已證實,D-二聚體[15]、C-反應蛋白[16]、尿酸[14,17]、腎功能不全[15,18]、肝功能障礙[19]等指標與ATAAD術后早期死亡風險密切相關,與本研究結果基本相似。在本研究中,血紅蛋白是AAD患者圍手術期死亡的重要危險因素之一。AAD患者由于夾層血管破裂出血,常導致紅細胞丟失和血容量不足,進而表現為血紅蛋白水平降低。血紅蛋白的下降不僅會導致血液稀釋和組織氧合不足,還可能引起一系列并發癥,如營養不良、心肌缺血和腎功能不全,甚至可能導致主動脈功能障礙[12]。然而,在研究過程中,我們觀察到部分AAD患者雖然伴有血紅蛋白下降、心包或胸腔積血,但在手術中并未發現明顯的夾層血管破裂口。我們推測,這可能是由于主動脈夾層真腔與假腔之間的壓力差過大,導致滲透壓增加,進而使得血液通過血管壁滲透到心包或胸腔中。這一發現為我們深入理解AAD的病理生理過程提供了新的視角,也為未來的治療策略制定提供了重要參考。
本研究存在一定的局限性。第一,本研究為單中心回顧性研究,受限于病例數較少和部分變量數據的缺失,研究結果可能存在一定偏倚。第二,本研究以圍手術期死亡作為研究終點,雖然能在一定程度上反映患者的短期預后,但缺乏中長期隨訪結果,這可能導致我們對患者長期生存情況的了解不夠充分,進而影響到結果的準確性。第三,雖然本研究建立了預測模型并進行了內部檢驗,但為提高模型的預測效率和準確性,還需要進一步進行外部驗證。第四,CTA圖像結果的獲得存在一定的主觀性和測量誤差,未來我們擬采用深度學習及影像組學對CTA圖像進行分析處理,為預測模型提供更多的影像特征參數。
綜上所述,本研究基于術前血紅蛋白、尿酸、AST、夾層分型和夾層破口形態這5個獨立危險因素,成功構建了AAD圍手術期死亡風險預測模型。該模型不僅簡單易行,而且其所需指標在臨床實踐中易于獲取。因此,該模型能夠幫助臨床醫師在早期階段快速識別高風險患者,為制定更為精準和有效的醫療決策提供有力支持。
利益沖突:無。
作者貢獻:鄧鐵負責實施研究,收集、分析數據,論文撰寫;李邦國負責收集、分析數據,論文指導性評閱,支持性貢獻;余洪負責論文選題與設計,數據分析與解釋,修改論文。