特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是一種病因不明的慢性、進行性肺間質疾病[1]。近年,IPF發病率及診斷率逐年上升[2],但其具體機制仍不明確,機體內部因素(遺傳易感性、胃食管反流、微生物共生失衡等)和外界環境暴露(吸煙、大氣污染等)所致的肺穩態失衡在IPF發生發展中可能扮演關鍵角色[3-6]。
近年來腸道菌群與肺穩態相互作用在IPF研究中逐漸受到重視。腸道菌群通過調控免疫應答、能量代謝、物質交換等過程[7],與肺穩態產生雙向調節關系[8]。臨床證據表明,腸道菌群比例失調與肺纖維化患者發病及病情加重有相關性[9];動物實驗[10-13]亦表明,兩種肺纖維化動物模型均表現出腸道菌群多樣性與豐度改變。調控腸道菌群或將成為IPF防治的新方向。然而,目前對于腸道菌群的認識仍然處于起步階段,腸道菌群與IPF之間的因果關系仍然有待進一步明確。
孟德爾隨機化(Mendelian randomization,MR)是遺傳流行病學的一種新興因果推斷方法,將遺傳變異作為工具變量(instrumental variables,IVs),依賴于均等、隨機、獨立分布的規則,有效規避了混雜因素和反向因果關系的影響,可探索臨床研究中難以或不能進一步觀察的暴露與結局之間的因果關系[14-16]。目前已有研究[17]利用MR探究了腸道菌群和慢性呼吸系統疾病(包括IPF)的因果關系,然而其缺乏雙向驗證,且未對兩者關聯機制進行深入探討。因此,本研究采用全基因組關聯研究(genome-wide association studies,GWAS)數據,運用兩樣本、雙向MR分析方法,以單核苷酸多態性(single nucleotide polymorphisms,SNPs)作為IVs,進一步探索腸道菌群與IPF之間的雙向因果關系,為IPF研究提供新的生物標志物、治療策略和理論基礎。
1 資料與方法
1.1 數據來源
腸道菌群GWAS數據來自MiBioGen,包括9門、16綱、20目、35科和131屬(
1.2 研究方法
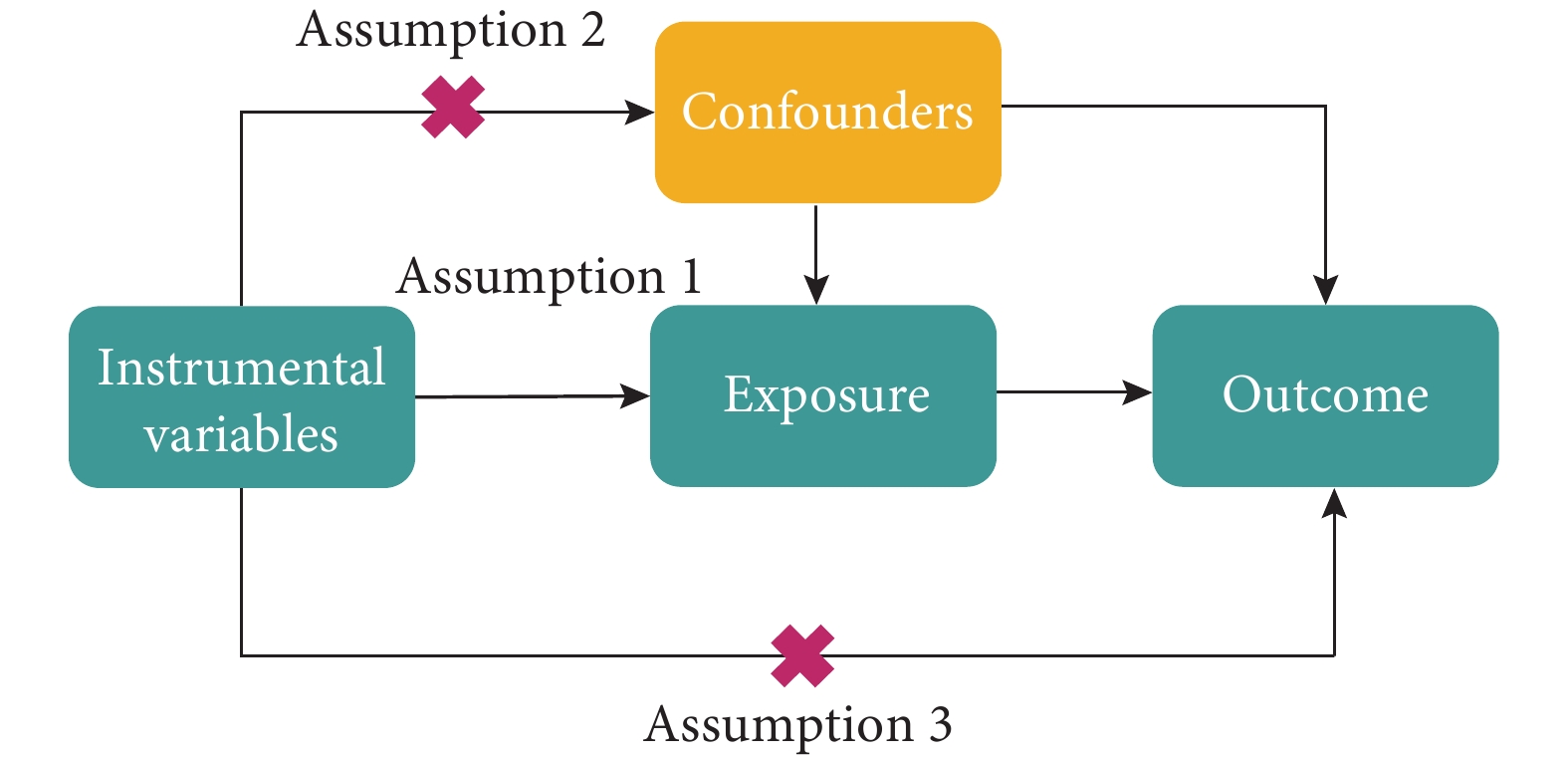
MR是一種基于遺傳變異,運用IVs進行分析的研究方法,包括以下3個核心假設(圖1):(1)最終用于因果分析的IVs必須與暴露因素密切相關;(2)IVs與影響暴露因素、結局因素的混雜因素沒有直接關系;(3)IVs僅通過暴露因素影響結局因素,而不直接對結局產生作用。本研究首先以腸道菌群5個水平(門、綱、目、科和屬)為暴露因素、IPF為結局進行雙樣本MR,研究腸道菌群對IPF的致病作用。隨后,為進一步確認篩選所得腸道菌群與IPF之間的正反因果關系,對正向MR結果進行反向分析[18]:以IPF為暴露因素,腸道菌群為結局進行MR分析。
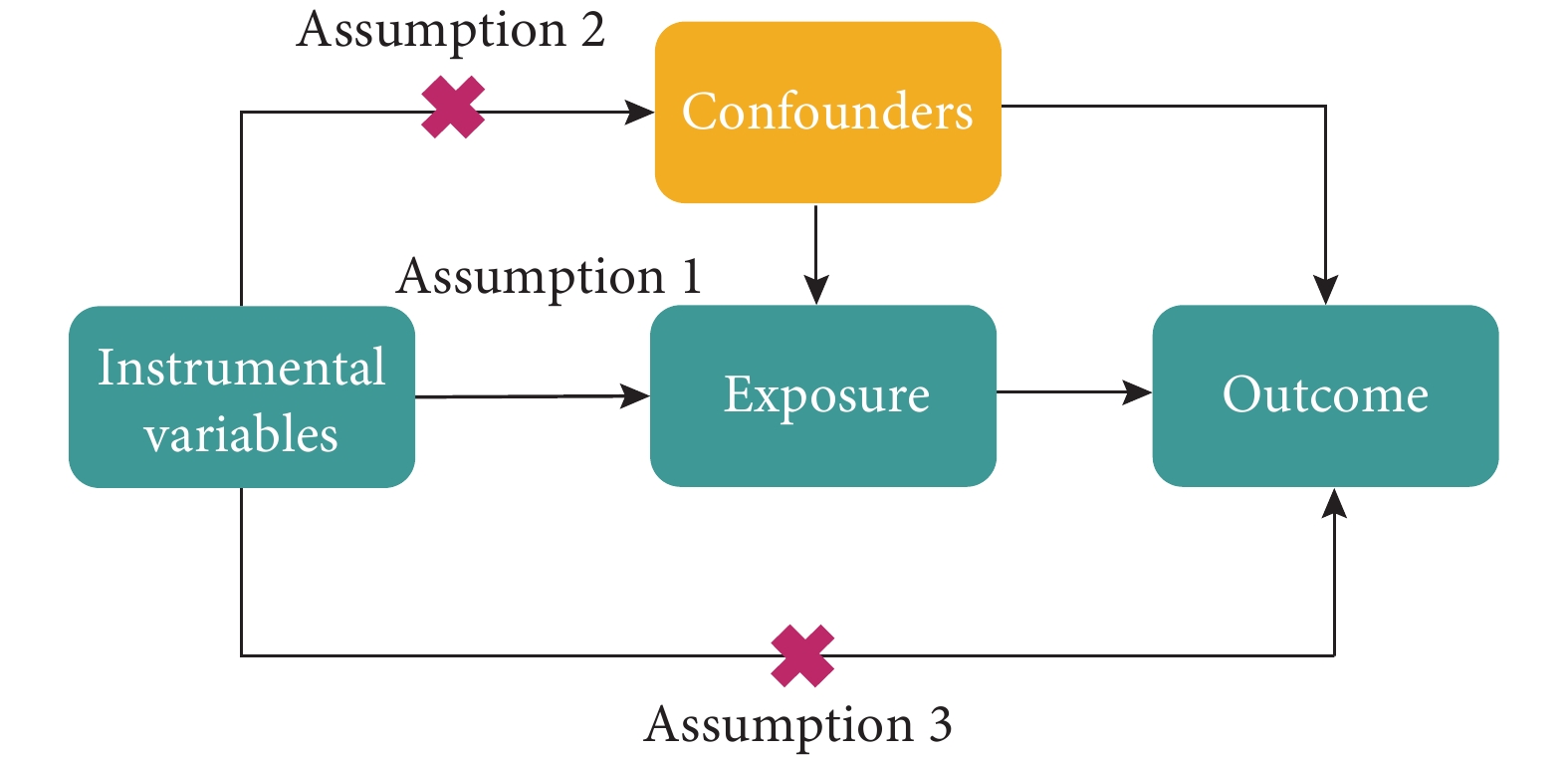 圖1
孟德爾隨機化分析假設模型圖
圖1
孟德爾隨機化分析假設模型圖
1.3 工具變量的篩選與去除
以P<5×10?8為篩選條件[19],從暴露因素中選擇差異有統計學意義的SNPs作為初步篩選的IVs。設置連鎖不平衡系數r2=0.001,區域寬度kb=10000,以消除連鎖不平衡關系,保證SNPs相互獨立,避免偏倚。使用PhenoScanner V2( ,其中R2=
,其中R2=
 ,式中EAF為效果等位基因的頻率,N為樣本量,β為等位基因的效應值,SE為標準誤差,若F<10提示該SNPs為弱IVs,對其進行剔除。在最后協調暴露和結局數據時,刪除具有中間等位基因頻率的回文SNPs。
,式中EAF為效果等位基因的頻率,N為樣本量,β為等位基因的效應值,SE為標準誤差,若F<10提示該SNPs為弱IVs,對其進行剔除。在最后協調暴露和結局數據時,刪除具有中間等位基因頻率的回文SNPs。
1.4 統計學分析
所有數據分析與可視化均使用R語言(4.3.2)“Two-Sample-MR”和“MR-PRESSO”軟件包。MR分析前剔除SNPs數目<3個的腸道菌群。將逆方差加權法(inverse variance weighted,IVW)作為主要MR分析方法。同時,采用加權中位數法(weighted median,WM)、簡單眾數法(simple mode,SM)、MR-Egger回歸、加權眾數法(weighted mode,WME)補充進行MR分析以評估IVW方法的穩健性。計算結果以比值比(odds ratio,OR)和95%置信區間(confidence interval,CI)表示。
Cochrane’s Q檢驗用于計算個體遺傳變異估計值。使用孟德爾隨機多態性殘差和離群值(Mendelian randomization pleiotropy residual sum and outlier,MR-PRESSO)法,對SNP數目≥4個的腸道菌群進行離群值檢驗,若SNP數目<4,則默認不存在離群值。使用MR-Egger進行水平多效性測試。使用留一法(leave-one-out,LOO)逐一剔除SNPs后計算合并效應量,檢驗研究結果是否穩健。Cochrane’s Q、LOO檢驗中,P>0.05表示研究中SNPs無顯著異質性。MR-PRESSO中,P>0.05表示未觀察到離群值。MR-Egger回歸中,P>0.05為研究中不存在水平多效性,從而滿足MR的核心假設。使用Steiger檢驗分析方向性,以駁斥由反向因果關系引起的偏差,驗證雙向MR分析結果的可靠性。P≤0.05為差異有統計學意義。
2 結果
2.1 腸道菌群與特發性肺纖維化的因果關聯
本研究發現6種腸道菌群與IPF發生相關:放線菌門(Actinobacteria),壞疽毒素梭狀芽胞桿菌屬(Erysipelatoclostridium),鏈球菌屬(Streptococcus),雙歧桿菌屬(Bifidobacterium),瘤胃球菌屬(Ruminococcus),泰氏菌屬(Tyzzerella)。相關SNPs信息見附表1~2(https://www.tcsurg.org/article/10.7507/1007-4848.202403050)。
IVW結果顯示,放線菌門(OR=1.773,P<0.001)、壞疽毒素梭狀芽胞桿菌屬(OR=2.077,P=0.023)和鏈球菌屬(OR=1.350,P=0.004)與IPF發病風險呈正相關;雙歧桿菌屬(OR=0.668,P<0.001)、瘤胃球菌屬(OR=0.434,P=0.015)和泰氏菌屬(OR=0.479,P=0.001)與IPF發病風險呈負相關。其余幾種計算方法的效應方向與IVW基本一致,提示IVW結果具有良好的穩健性;見表2。
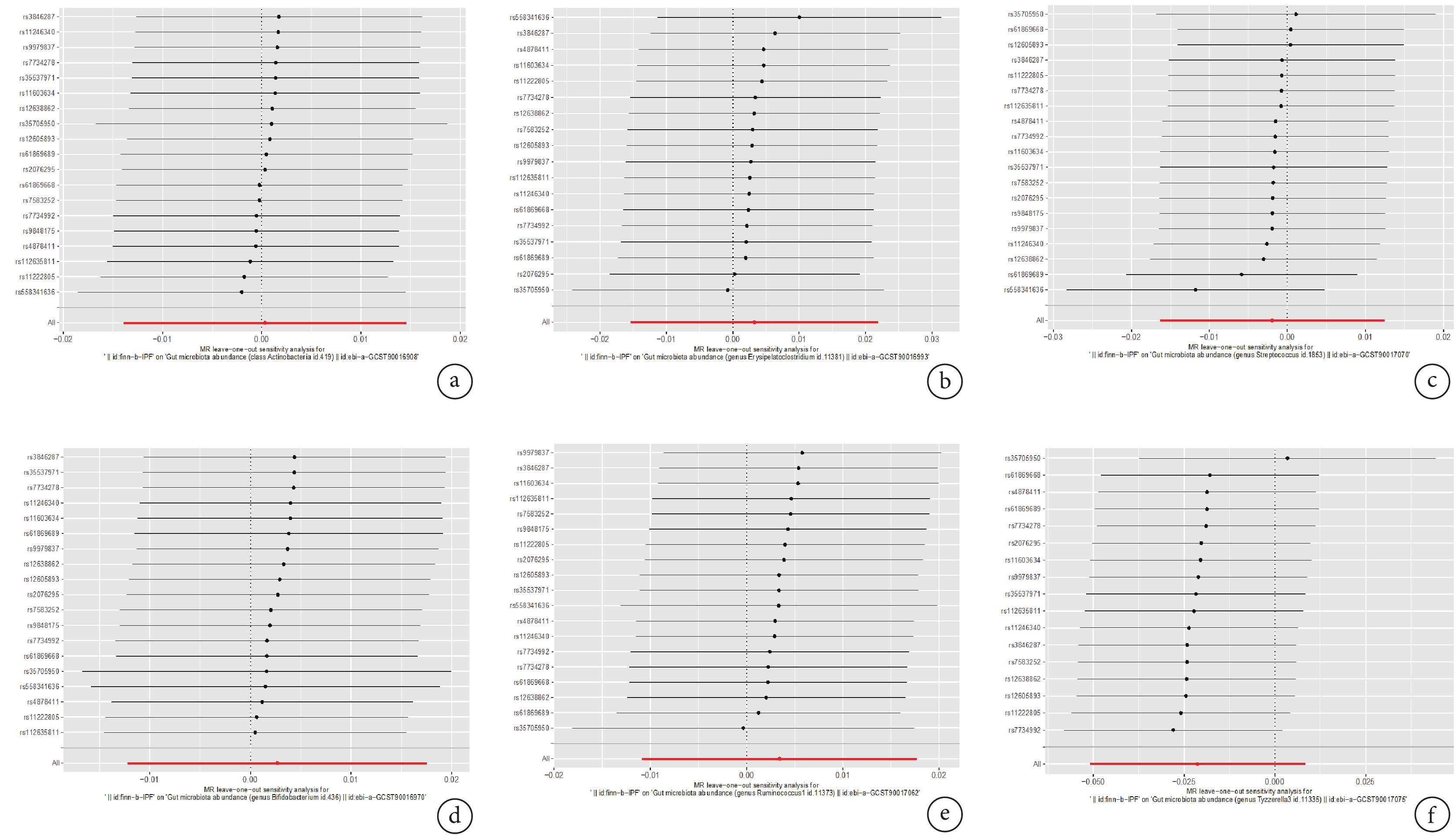
Cochrane’s Q檢驗顯示,Q值在0.018~114.620之間,P>0.05,表明不存在異質性;MR-PRESSO結果P>0.05,表明不存在離群值;MR-Egger-intercept結果P>0.05,表明MR分析結果不存在水平多效性;Steiger檢驗結果顯示,SNPs對暴露因素的影響大于對結局的影響,提示不存在反向因果關聯;見表3。LOO檢驗結果顯示,因果效應不受單個SNPs的影響,說明結果敏感性良好;見圖2。
 圖2
MR的留一法敏感性分析結果
圖2
MR的留一法敏感性分析結果
a:放線菌門-IPF;b:壞疽毒素梭狀芽胞桿菌屬-IPF;c:鏈球菌屬-IPF;d:雙歧桿菌屬-IPF;e:瘤胃球菌屬-IPF;f:泰氏菌屬-IPF;IPF:特發性肺纖維化;MR:孟德爾隨機化
2.2 腸道菌群與特發性肺纖維化的反向因果關聯
以IPF為暴露因素,腸道菌群為結局,進行反向MR分析,發現IPF對上述腸道菌群的改變并無顯著影響(IVW法P>0.05);見表4。
Cochrane's Q 檢驗顯示,Q值在16.440~25.420之間,P>0.05,表明不存在異質性;MR-PRESSO結果P>0.05,表明不存在離群值。MR-Egger-intercept結果P>0.05,表明不存在水平多效性;見表5。LOO檢驗結果顯示,因果效應不受單個SNPs影響;見圖3。
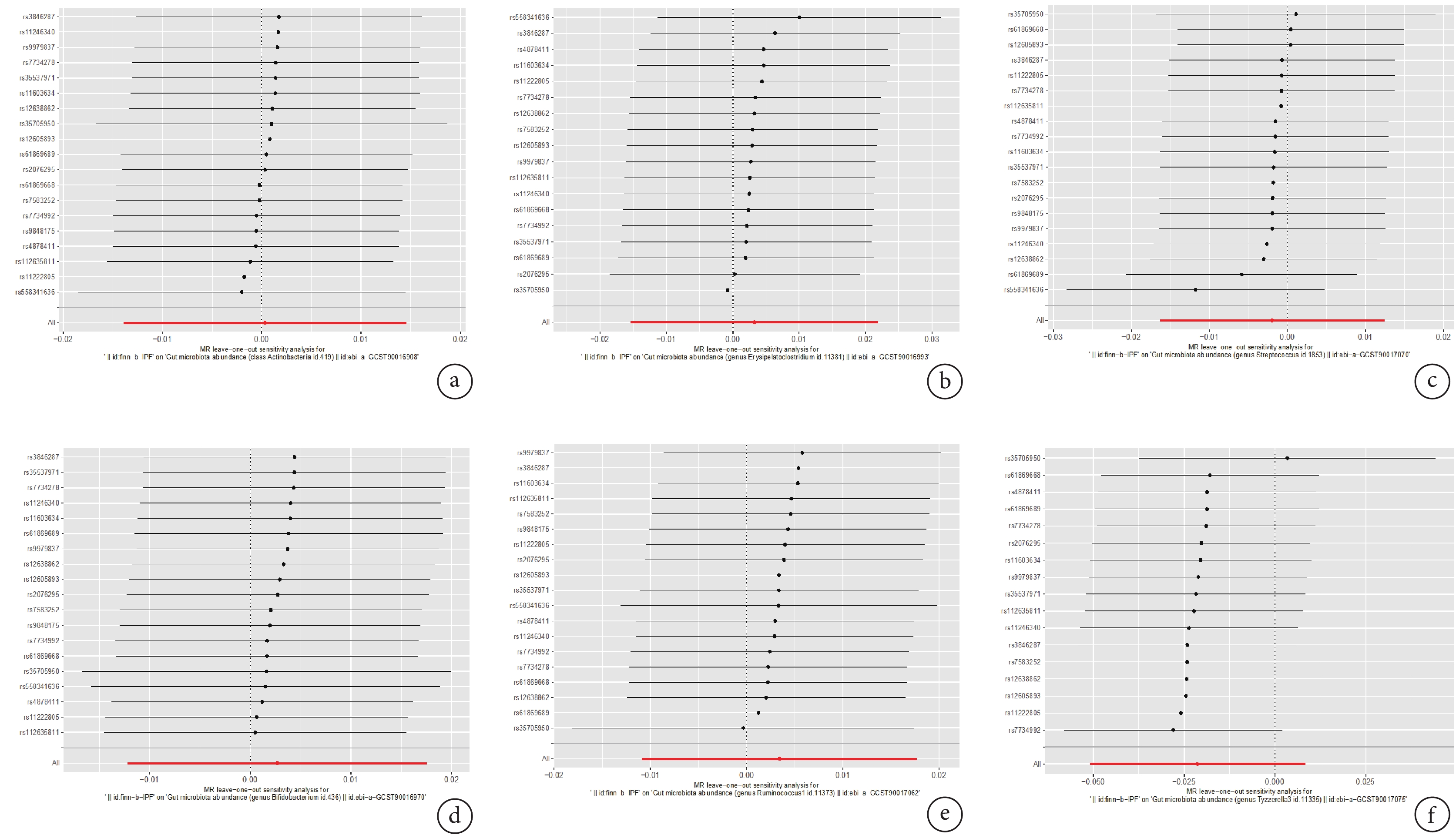 圖3
反向MR的留一法敏感性分析結果
圖3
反向MR的留一法敏感性分析結果
a:IPF-放線菌門;b:IPF-壞疽毒素梭狀芽胞桿菌屬;c:IPF-鏈球菌屬;d:IPF-雙歧桿菌屬;e:IPF-瘤胃球菌屬;f:IPF-泰氏菌屬;IPF:特發性肺纖維化;MR:孟德爾隨機化
3 討論
本研究運用全球最大的腸道菌群數據庫MiBioGen和芬蘭聯盟發布的IPF統計數據,進行了兩樣本、雙向MR分析,鑒定出6種與IPF發病具有因果關聯的腸道菌群,包括:放線菌門、壞疽毒素梭狀芽胞桿菌屬、鏈球菌屬、雙歧桿菌屬、瘤胃球菌屬、泰氏菌屬,而IPF對上述腸道菌群不存在反向因果調節作用。
放線菌門是腸道主要菌群之一,在腸道穩態中起重要作用。放線菌是革蘭氏陽性、多分支桿菌、非運動、非孢子形成和厭氧菌,雙歧桿菌是其中最具代表的菌群。放線菌門與多種疾病有關,在抑郁狀態、慢性疲勞綜合征、潰瘍性結腸炎、銀屑病等多種疾病中具有顯著改善作用[24-25]。研究發現,放線菌門在慢性阻塞性肺疾病[26]、SARS-CoV-2[27]、急性呼吸窘迫綜合征[28]等呼吸系統疾病的發生發展中也有重要作用。在IPF患者肺泡灌洗液中,放線菌門豐度顯著上調,證實放線菌門與IPF密切相關[29]。本研究則為二者的因果關聯提供了實證依據。
壞疽毒素梭狀芽胞桿菌屬是革蘭氏陽性、專性厭氧桿菌,是一種機會性病原體,免疫系統受損或患有癌癥[30]、糖尿病等慢性疾病的宿主是其易感人群。此外,壞疽毒素梭狀芽胞桿菌屬與某些創傷后感染有關,引發壞死性筋膜炎甚至敗血癥[31]。研究[32]發現,壞疽毒素梭狀芽胞桿菌屬在急性期和恢復期SARS-CoV-2患者腸道中富集并誘導慢性炎癥。此外,下調壞疽毒素梭狀芽胞桿菌屬豐度可能使克羅恩病相關肺損傷患者潛在獲益[33]。先前的一項MR分析[34]發現赭色嗜酸內腸菌屬也存在潛在的促肺癌發生作用。上述證據表明,壞疽毒素梭狀芽胞桿菌屬在呼吸系統疾病發生發展中扮演重要角色,盡管尚無直接證據,但本研究提示其或許在IPF發生中也具有重要作用,值得進一步研究。
鏈球菌屬是最常見的革蘭氏陽性、化膿性球菌之一,廣泛分布于人體鼻咽、胃腸道等處,是人類口腔和呼吸道中最主要的共生和機會性菌群[35]。致病性鏈球菌可引起多種化膿性炎癥及超敏反應性疾病。研究發現,鏈球菌屬是食管鱗癌[36]、自身免疫性甲狀腺疾病[37]、原發性膽汁性肝硬化[38]的主要危險因素。作為呼吸道主要共生菌群,鏈球菌在肺部相關疾病中同樣重要,可通過IL-22表達缺陷促使慢性阻塞性肺疾病惡化[39],還可通過血栓形成[40]、血管炎癥[41]等途徑誘發肺部繼發惡性腫瘤。此外,IPF患者的無進展生存期、用力肺活量等與鏈球菌屬豐度相關[42],且鏈球菌感染可通過釋放肺炎球菌溶血素觸發肺纖維化的進展[43]。可見,鏈球菌屬與IPF的發生發展密切相關,上述證據進一步證實了本研究的發現。
雙歧桿菌屬廣泛存在于消化道、陰道和口腔等生物環境中,可發揮生物屏障、營養支持、抗腫瘤、免疫增強等多種作用。雙歧桿菌可通過“腦-腸軸”對老年小鼠的神經元再生發揮促進作用,從而改善年齡相關性大腦疾病[44];雙歧桿菌屬豐度在老年高脂血癥患者腸道內顯著下調,暗示其對老年人群血脂代謝亦具有調控作用[45]。雙歧桿菌可改善香煙暴露導致的小鼠肺部炎癥[46],減輕腸系膜缺血-再灌注引起的肺損傷[47]。體內試驗[48]發現,雙歧桿菌豐度更高的博萊霉素小鼠模型肺部纖維化程度更低,提示雙歧桿菌對肺纖維化也具有一定的改善作用,這與本研究結果一致。
瘤胃球菌屬是一種革蘭氏陽性厭氧菌,最早于胃部發現,與機體新陳代謝密切相關。瘤胃球菌屬對機體具有雙向調節作用:即可通過降解纖維素、抗性淀粉等復合碳水化合物參與新陳代謝,促進機體正常生理功能的發揮,又與消化、神經、免疫等多系統疾病的發生發展相關[49]。研究[50-53]表明,瘤胃球菌屬是腸-肺軸微生物串擾的重要標志物,在肺炎、急性肺損傷、哮喘等多種肺部疾病中豐度異常。相較正常大鼠,在肺纖維化動物模型中,瘤胃球菌豐度顯著下降,提示瘤胃球菌或許是肺纖維化的保護因素[54],這與本研究結果一致。
泰氏菌屬是近年發現的新菌屬,屬于厚壁菌門的梭菌綱,主要富集于腸道,參與宿主的能量代謝、維生素合成等生物學過程。研究表明,泰式菌屬可能與妊娠期糖尿病[55]、結腸炎[56]、脂肪肝[57]和慢性阻塞性肺疾病[58]等的發生相關。盡管尚無研究提示泰式菌屬與IPF發生發展相關,但泰式菌屬可調節機體能量代謝,而糖脂代謝異常在IPF的發生發展中亦具有重要作用[59-60]。據此推測,泰式菌屬可能通過能量代謝途徑參與IPF的發生發展。
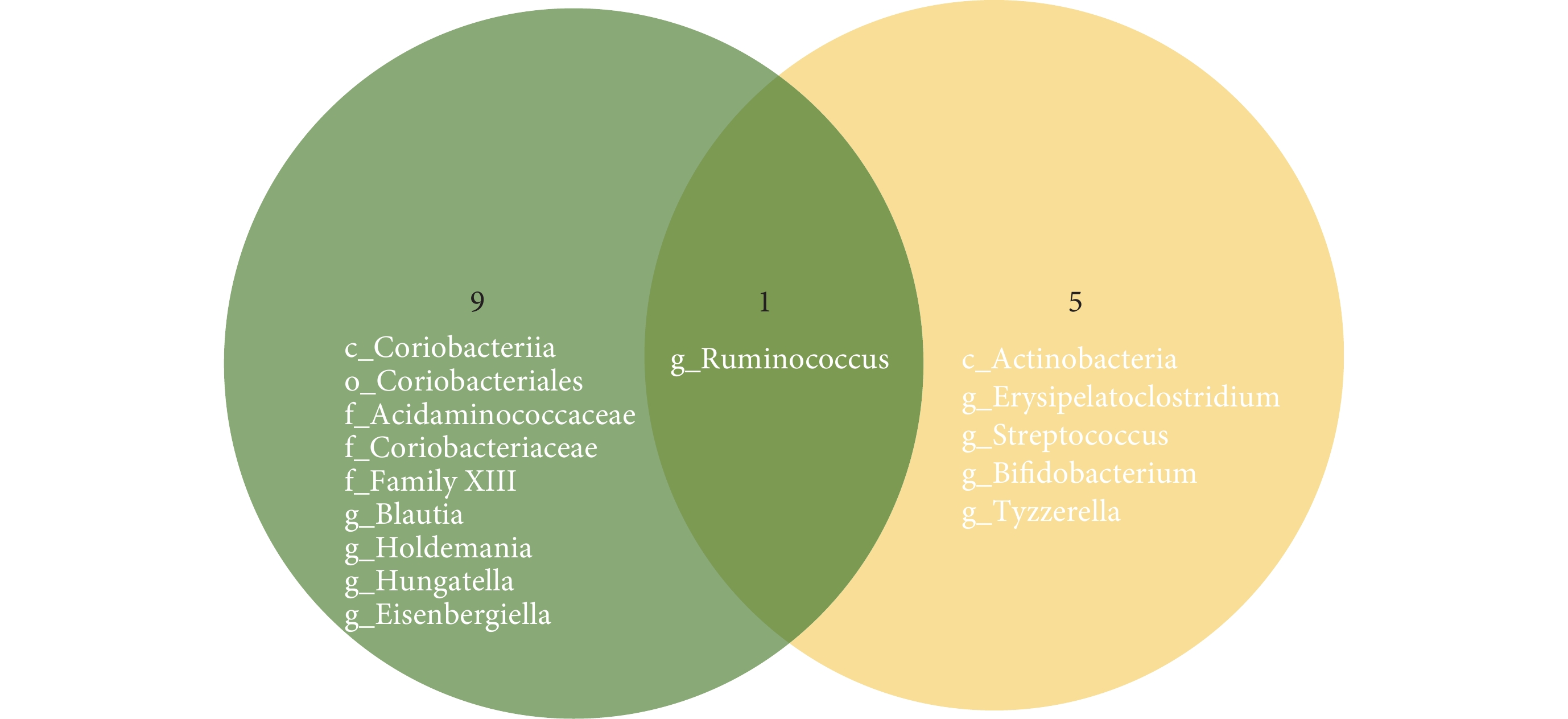
值得注意的是,將本研究與此前發表的MR研究[17]進行比較,發現兩項研究結果存在較大差異,見圖4。其原因可能是數據來源及方法學上的異質性。對于兩項研究,我們采取求同存異的態度,認為兩項研究結果可互為補充,作為外部驗證,如兩項研究都發現瘤胃球菌屬與IPF發生顯著相關,促使我們更加關注這一菌群在IPF中的作用,期待未來開展更多相關研究進行探索。
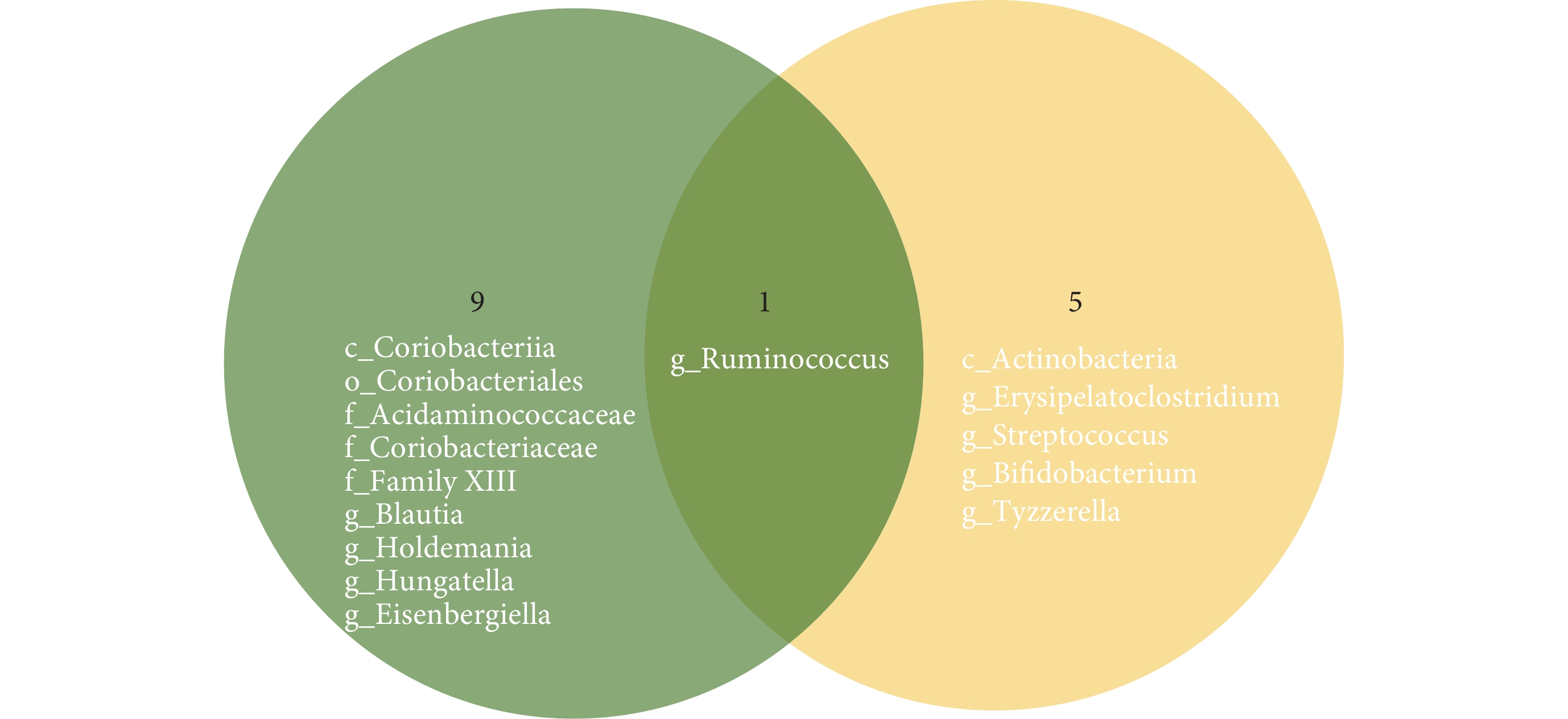 圖4
本研究與既往研究[17]結果比較
圖4
本研究與既往研究[17]結果比較
本研究具有以下創新性:(1)本研究從腸-肺軸出發,以腸道菌群為暴露因素,討論其與IPF之間的因果作用,具有較強的理論和臨床價值;(2)本研究以大樣本GWAS統計數據為研究基礎,對腸道菌群與IPF的因果關系進行了探索;(3)本研究采用兩樣本、雙向MR方法,通過嚴格的IVs篩選、多樣化的分析方法及規范的質量控制標準評估腸道菌群和IPF的雙向因果關聯,結果具有穩定性和可靠性。
本研究亦存在一定的局限性:(1)目前可用的GWAS數據多源于歐洲人群,本研究對中國人群的適用性有待考證;(2)GWAS統計數據較為籠統,未包括各樣本的一般信息,如年齡、性別、受教育程度等,可能造成潛在的非線形關系;(3)有必要進一步結合多組學數據深入挖掘腸道菌群介導IPF發生發展的生物學機制[51]。
綜上所述,我們采用兩樣本、雙向MR方法,探究了腸道菌群與IPF之間的雙向因果關系,發現放線菌門、壞疽毒素梭狀芽胞桿菌屬和鏈球菌屬可增加IPF發病風險,而雙歧桿菌屬、瘤胃球菌屬和泰氏菌屬可降低IPF發病風險。在未來的研究中,可聚焦上述菌群深入探索IPF發生發展的病理機制。
利益沖突:無。
作者貢獻:吳宣諭負責選題與研究設計,數據分析,論文撰寫與修改;肖祥負責方法整合,數據整理與分析,論文撰寫與修改;陳嘉靖、于曉敏負責論文審閱與校對;楊晗負責論文設計和整體修改。
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是一種病因不明的慢性、進行性肺間質疾病[1]。近年,IPF發病率及診斷率逐年上升[2],但其具體機制仍不明確,機體內部因素(遺傳易感性、胃食管反流、微生物共生失衡等)和外界環境暴露(吸煙、大氣污染等)所致的肺穩態失衡在IPF發生發展中可能扮演關鍵角色[3-6]。
近年來腸道菌群與肺穩態相互作用在IPF研究中逐漸受到重視。腸道菌群通過調控免疫應答、能量代謝、物質交換等過程[7],與肺穩態產生雙向調節關系[8]。臨床證據表明,腸道菌群比例失調與肺纖維化患者發病及病情加重有相關性[9];動物實驗[10-13]亦表明,兩種肺纖維化動物模型均表現出腸道菌群多樣性與豐度改變。調控腸道菌群或將成為IPF防治的新方向。然而,目前對于腸道菌群的認識仍然處于起步階段,腸道菌群與IPF之間的因果關系仍然有待進一步明確。
孟德爾隨機化(Mendelian randomization,MR)是遺傳流行病學的一種新興因果推斷方法,將遺傳變異作為工具變量(instrumental variables,IVs),依賴于均等、隨機、獨立分布的規則,有效規避了混雜因素和反向因果關系的影響,可探索臨床研究中難以或不能進一步觀察的暴露與結局之間的因果關系[14-16]。目前已有研究[17]利用MR探究了腸道菌群和慢性呼吸系統疾病(包括IPF)的因果關系,然而其缺乏雙向驗證,且未對兩者關聯機制進行深入探討。因此,本研究采用全基因組關聯研究(genome-wide association studies,GWAS)數據,運用兩樣本、雙向MR分析方法,以單核苷酸多態性(single nucleotide polymorphisms,SNPs)作為IVs,進一步探索腸道菌群與IPF之間的雙向因果關系,為IPF研究提供新的生物標志物、治療策略和理論基礎。
1 資料與方法
1.1 數據來源
腸道菌群GWAS數據來自MiBioGen,包括9門、16綱、20目、35科和131屬(
1.2 研究方法
MR是一種基于遺傳變異,運用IVs進行分析的研究方法,包括以下3個核心假設(圖1):(1)最終用于因果分析的IVs必須與暴露因素密切相關;(2)IVs與影響暴露因素、結局因素的混雜因素沒有直接關系;(3)IVs僅通過暴露因素影響結局因素,而不直接對結局產生作用。本研究首先以腸道菌群5個水平(門、綱、目、科和屬)為暴露因素、IPF為結局進行雙樣本MR,研究腸道菌群對IPF的致病作用。隨后,為進一步確認篩選所得腸道菌群與IPF之間的正反因果關系,對正向MR結果進行反向分析[18]:以IPF為暴露因素,腸道菌群為結局進行MR分析。
 圖1
孟德爾隨機化分析假設模型圖
圖1
孟德爾隨機化分析假設模型圖
1.3 工具變量的篩選與去除
以P<5×10?8為篩選條件[19],從暴露因素中選擇差異有統計學意義的SNPs作為初步篩選的IVs。設置連鎖不平衡系數r2=0.001,區域寬度kb=10000,以消除連鎖不平衡關系,保證SNPs相互獨立,避免偏倚。使用PhenoScanner V2( ,其中R2=
,其中R2=
 ,式中EAF為效果等位基因的頻率,N為樣本量,β為等位基因的效應值,SE為標準誤差,若F<10提示該SNPs為弱IVs,對其進行剔除。在最后協調暴露和結局數據時,刪除具有中間等位基因頻率的回文SNPs。
,式中EAF為效果等位基因的頻率,N為樣本量,β為等位基因的效應值,SE為標準誤差,若F<10提示該SNPs為弱IVs,對其進行剔除。在最后協調暴露和結局數據時,刪除具有中間等位基因頻率的回文SNPs。
1.4 統計學分析
所有數據分析與可視化均使用R語言(4.3.2)“Two-Sample-MR”和“MR-PRESSO”軟件包。MR分析前剔除SNPs數目<3個的腸道菌群。將逆方差加權法(inverse variance weighted,IVW)作為主要MR分析方法。同時,采用加權中位數法(weighted median,WM)、簡單眾數法(simple mode,SM)、MR-Egger回歸、加權眾數法(weighted mode,WME)補充進行MR分析以評估IVW方法的穩健性。計算結果以比值比(odds ratio,OR)和95%置信區間(confidence interval,CI)表示。
Cochrane’s Q檢驗用于計算個體遺傳變異估計值。使用孟德爾隨機多態性殘差和離群值(Mendelian randomization pleiotropy residual sum and outlier,MR-PRESSO)法,對SNP數目≥4個的腸道菌群進行離群值檢驗,若SNP數目<4,則默認不存在離群值。使用MR-Egger進行水平多效性測試。使用留一法(leave-one-out,LOO)逐一剔除SNPs后計算合并效應量,檢驗研究結果是否穩健。Cochrane’s Q、LOO檢驗中,P>0.05表示研究中SNPs無顯著異質性。MR-PRESSO中,P>0.05表示未觀察到離群值。MR-Egger回歸中,P>0.05為研究中不存在水平多效性,從而滿足MR的核心假設。使用Steiger檢驗分析方向性,以駁斥由反向因果關系引起的偏差,驗證雙向MR分析結果的可靠性。P≤0.05為差異有統計學意義。
2 結果
2.1 腸道菌群與特發性肺纖維化的因果關聯
本研究發現6種腸道菌群與IPF發生相關:放線菌門(Actinobacteria),壞疽毒素梭狀芽胞桿菌屬(Erysipelatoclostridium),鏈球菌屬(Streptococcus),雙歧桿菌屬(Bifidobacterium),瘤胃球菌屬(Ruminococcus),泰氏菌屬(Tyzzerella)。相關SNPs信息見附表1~2(https://www.tcsurg.org/article/10.7507/1007-4848.202403050)。
IVW結果顯示,放線菌門(OR=1.773,P<0.001)、壞疽毒素梭狀芽胞桿菌屬(OR=2.077,P=0.023)和鏈球菌屬(OR=1.350,P=0.004)與IPF發病風險呈正相關;雙歧桿菌屬(OR=0.668,P<0.001)、瘤胃球菌屬(OR=0.434,P=0.015)和泰氏菌屬(OR=0.479,P=0.001)與IPF發病風險呈負相關。其余幾種計算方法的效應方向與IVW基本一致,提示IVW結果具有良好的穩健性;見表2。
Cochrane’s Q檢驗顯示,Q值在0.018~114.620之間,P>0.05,表明不存在異質性;MR-PRESSO結果P>0.05,表明不存在離群值;MR-Egger-intercept結果P>0.05,表明MR分析結果不存在水平多效性;Steiger檢驗結果顯示,SNPs對暴露因素的影響大于對結局的影響,提示不存在反向因果關聯;見表3。LOO檢驗結果顯示,因果效應不受單個SNPs的影響,說明結果敏感性良好;見圖2。
 圖2
MR的留一法敏感性分析結果
圖2
MR的留一法敏感性分析結果
a:放線菌門-IPF;b:壞疽毒素梭狀芽胞桿菌屬-IPF;c:鏈球菌屬-IPF;d:雙歧桿菌屬-IPF;e:瘤胃球菌屬-IPF;f:泰氏菌屬-IPF;IPF:特發性肺纖維化;MR:孟德爾隨機化
2.2 腸道菌群與特發性肺纖維化的反向因果關聯
以IPF為暴露因素,腸道菌群為結局,進行反向MR分析,發現IPF對上述腸道菌群的改變并無顯著影響(IVW法P>0.05);見表4。
Cochrane's Q 檢驗顯示,Q值在16.440~25.420之間,P>0.05,表明不存在異質性;MR-PRESSO結果P>0.05,表明不存在離群值。MR-Egger-intercept結果P>0.05,表明不存在水平多效性;見表5。LOO檢驗結果顯示,因果效應不受單個SNPs影響;見圖3。
 圖3
反向MR的留一法敏感性分析結果
圖3
反向MR的留一法敏感性分析結果
a:IPF-放線菌門;b:IPF-壞疽毒素梭狀芽胞桿菌屬;c:IPF-鏈球菌屬;d:IPF-雙歧桿菌屬;e:IPF-瘤胃球菌屬;f:IPF-泰氏菌屬;IPF:特發性肺纖維化;MR:孟德爾隨機化
3 討論
本研究運用全球最大的腸道菌群數據庫MiBioGen和芬蘭聯盟發布的IPF統計數據,進行了兩樣本、雙向MR分析,鑒定出6種與IPF發病具有因果關聯的腸道菌群,包括:放線菌門、壞疽毒素梭狀芽胞桿菌屬、鏈球菌屬、雙歧桿菌屬、瘤胃球菌屬、泰氏菌屬,而IPF對上述腸道菌群不存在反向因果調節作用。
放線菌門是腸道主要菌群之一,在腸道穩態中起重要作用。放線菌是革蘭氏陽性、多分支桿菌、非運動、非孢子形成和厭氧菌,雙歧桿菌是其中最具代表的菌群。放線菌門與多種疾病有關,在抑郁狀態、慢性疲勞綜合征、潰瘍性結腸炎、銀屑病等多種疾病中具有顯著改善作用[24-25]。研究發現,放線菌門在慢性阻塞性肺疾病[26]、SARS-CoV-2[27]、急性呼吸窘迫綜合征[28]等呼吸系統疾病的發生發展中也有重要作用。在IPF患者肺泡灌洗液中,放線菌門豐度顯著上調,證實放線菌門與IPF密切相關[29]。本研究則為二者的因果關聯提供了實證依據。
壞疽毒素梭狀芽胞桿菌屬是革蘭氏陽性、專性厭氧桿菌,是一種機會性病原體,免疫系統受損或患有癌癥[30]、糖尿病等慢性疾病的宿主是其易感人群。此外,壞疽毒素梭狀芽胞桿菌屬與某些創傷后感染有關,引發壞死性筋膜炎甚至敗血癥[31]。研究[32]發現,壞疽毒素梭狀芽胞桿菌屬在急性期和恢復期SARS-CoV-2患者腸道中富集并誘導慢性炎癥。此外,下調壞疽毒素梭狀芽胞桿菌屬豐度可能使克羅恩病相關肺損傷患者潛在獲益[33]。先前的一項MR分析[34]發現赭色嗜酸內腸菌屬也存在潛在的促肺癌發生作用。上述證據表明,壞疽毒素梭狀芽胞桿菌屬在呼吸系統疾病發生發展中扮演重要角色,盡管尚無直接證據,但本研究提示其或許在IPF發生中也具有重要作用,值得進一步研究。
鏈球菌屬是最常見的革蘭氏陽性、化膿性球菌之一,廣泛分布于人體鼻咽、胃腸道等處,是人類口腔和呼吸道中最主要的共生和機會性菌群[35]。致病性鏈球菌可引起多種化膿性炎癥及超敏反應性疾病。研究發現,鏈球菌屬是食管鱗癌[36]、自身免疫性甲狀腺疾病[37]、原發性膽汁性肝硬化[38]的主要危險因素。作為呼吸道主要共生菌群,鏈球菌在肺部相關疾病中同樣重要,可通過IL-22表達缺陷促使慢性阻塞性肺疾病惡化[39],還可通過血栓形成[40]、血管炎癥[41]等途徑誘發肺部繼發惡性腫瘤。此外,IPF患者的無進展生存期、用力肺活量等與鏈球菌屬豐度相關[42],且鏈球菌感染可通過釋放肺炎球菌溶血素觸發肺纖維化的進展[43]。可見,鏈球菌屬與IPF的發生發展密切相關,上述證據進一步證實了本研究的發現。
雙歧桿菌屬廣泛存在于消化道、陰道和口腔等生物環境中,可發揮生物屏障、營養支持、抗腫瘤、免疫增強等多種作用。雙歧桿菌可通過“腦-腸軸”對老年小鼠的神經元再生發揮促進作用,從而改善年齡相關性大腦疾病[44];雙歧桿菌屬豐度在老年高脂血癥患者腸道內顯著下調,暗示其對老年人群血脂代謝亦具有調控作用[45]。雙歧桿菌可改善香煙暴露導致的小鼠肺部炎癥[46],減輕腸系膜缺血-再灌注引起的肺損傷[47]。體內試驗[48]發現,雙歧桿菌豐度更高的博萊霉素小鼠模型肺部纖維化程度更低,提示雙歧桿菌對肺纖維化也具有一定的改善作用,這與本研究結果一致。
瘤胃球菌屬是一種革蘭氏陽性厭氧菌,最早于胃部發現,與機體新陳代謝密切相關。瘤胃球菌屬對機體具有雙向調節作用:即可通過降解纖維素、抗性淀粉等復合碳水化合物參與新陳代謝,促進機體正常生理功能的發揮,又與消化、神經、免疫等多系統疾病的發生發展相關[49]。研究[50-53]表明,瘤胃球菌屬是腸-肺軸微生物串擾的重要標志物,在肺炎、急性肺損傷、哮喘等多種肺部疾病中豐度異常。相較正常大鼠,在肺纖維化動物模型中,瘤胃球菌豐度顯著下降,提示瘤胃球菌或許是肺纖維化的保護因素[54],這與本研究結果一致。
泰氏菌屬是近年發現的新菌屬,屬于厚壁菌門的梭菌綱,主要富集于腸道,參與宿主的能量代謝、維生素合成等生物學過程。研究表明,泰式菌屬可能與妊娠期糖尿病[55]、結腸炎[56]、脂肪肝[57]和慢性阻塞性肺疾病[58]等的發生相關。盡管尚無研究提示泰式菌屬與IPF發生發展相關,但泰式菌屬可調節機體能量代謝,而糖脂代謝異常在IPF的發生發展中亦具有重要作用[59-60]。據此推測,泰式菌屬可能通過能量代謝途徑參與IPF的發生發展。
值得注意的是,將本研究與此前發表的MR研究[17]進行比較,發現兩項研究結果存在較大差異,見圖4。其原因可能是數據來源及方法學上的異質性。對于兩項研究,我們采取求同存異的態度,認為兩項研究結果可互為補充,作為外部驗證,如兩項研究都發現瘤胃球菌屬與IPF發生顯著相關,促使我們更加關注這一菌群在IPF中的作用,期待未來開展更多相關研究進行探索。
 圖4
本研究與既往研究[17]結果比較
圖4
本研究與既往研究[17]結果比較
本研究具有以下創新性:(1)本研究從腸-肺軸出發,以腸道菌群為暴露因素,討論其與IPF之間的因果作用,具有較強的理論和臨床價值;(2)本研究以大樣本GWAS統計數據為研究基礎,對腸道菌群與IPF的因果關系進行了探索;(3)本研究采用兩樣本、雙向MR方法,通過嚴格的IVs篩選、多樣化的分析方法及規范的質量控制標準評估腸道菌群和IPF的雙向因果關聯,結果具有穩定性和可靠性。
本研究亦存在一定的局限性:(1)目前可用的GWAS數據多源于歐洲人群,本研究對中國人群的適用性有待考證;(2)GWAS統計數據較為籠統,未包括各樣本的一般信息,如年齡、性別、受教育程度等,可能造成潛在的非線形關系;(3)有必要進一步結合多組學數據深入挖掘腸道菌群介導IPF發生發展的生物學機制[51]。
綜上所述,我們采用兩樣本、雙向MR方法,探究了腸道菌群與IPF之間的雙向因果關系,發現放線菌門、壞疽毒素梭狀芽胞桿菌屬和鏈球菌屬可增加IPF發病風險,而雙歧桿菌屬、瘤胃球菌屬和泰氏菌屬可降低IPF發病風險。在未來的研究中,可聚焦上述菌群深入探索IPF發生發展的病理機制。
利益沖突:無。
作者貢獻:吳宣諭負責選題與研究設計,數據分析,論文撰寫與修改;肖祥負責方法整合,數據整理與分析,論文撰寫與修改;陳嘉靖、于曉敏負責論文審閱與校對;楊晗負責論文設計和整體修改。