版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
食管癌是常見的消化道惡性腫瘤之一。據最新全球癌癥數據統計,食管癌發病率居第7位,死亡率居第6位。每年新發病例高達60.4萬,死亡54.4萬,意味著每18例癌癥中就有1例因食管癌喪失生命[1]。最常見的組織學類型為鱗癌和腺癌。其中鱗癌占85%,超過一半的病例發生在我國,且我國約90%的食管癌組織學類型為鱗癌[2]。目前食管癌的治療策略依然是以手術為主的綜合治療,對于局部進展期食管癌新輔助治療聯合手術已成為標準的治療方案[3-7]。盡管生存獲益,但仍有多數患者出現術后復發,遠處轉移最常見[8]。近些年免疫治療的出現改變了晚期食管癌的治療策略。美國國立綜合癌癥網絡(NCCN)指南、中國臨床腫瘤學會(CSCO)指南推薦免疫治療聯合化療作為不可切除局部晚期食管癌及遠處轉移性疾病的一線治療。大量關于局部晚期食管癌的術前新輔助免疫治療也被證實安全有效[9-16]。但目前尚缺乏預測新輔助免疫治療聯合化療療效的敏感有效指標。
血液中反應免疫炎癥的中性粒細胞和淋巴細胞比值(NLR)、PLT和淋巴細胞比值(PLR)、全身免疫炎癥指數(SII)等指標在實體瘤預后預測中已有報道[17-20]。治療前高水平紅細胞分布寬度被證實與惡性腫瘤的不良生存結局相關[21-22],紅細胞分布寬度、血紅蛋白和紅細胞分布寬度比值被報道可以作為食管鱗癌的預后參數[23-26]。目前還未有關研究說明外周血細胞與新輔助免疫治療聯合化療治療食管鱗癌療效的關系,因此,本研究探討外周血細胞對食管鱗癌新輔助免疫治療聯合化療的療效預測價值。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2020年4月—2023年11月于我院接受新輔助信迪利單抗免疫治療聯合化療后手術的食管鱗癌患者。納入標準:臨床分期Ⅱ~Ⅳa期,年齡48~80歲,臨床病理資料完整。排除標準:患有其他病理類型的食管癌,合并其他類型的腫瘤或患有血液學/自身免疫性疾病,接受其他類型的抗癌治療,不能根治性切除,治療前血常規指標異常,免疫抑制劑不是同一種(非信迪利單抗)。
按治療后病理是否完全緩解,將患者分為病理完全緩解組和病理未完全緩解組;按新輔助治療后腫瘤病理退縮分級CAP標準分組(TRG=0、1定義為療效佳,TRG=2、3定義為療效差)。
1.2 治療方法
患者術前經胃鏡病理活檢確診為食管鱗癌且在術前每21 d接受2個周期的新輔助免疫治療聯合化療。化療方案包括奈達鉑(第1 d)和多西他賽/白蛋白紫杉醇(第2 d),第3 d給予信迪利單抗免疫治療。新輔助治療結束后4周進行重新評估手術可行性及排除任何存在手術禁忌證的患者。手術方式為 McKeown 食管癌根治術。
用藥2周期后復查胸部計算機斷層掃描(computed tomography,CT),由 1名經驗豐富的放射科醫生對術前 CT影像資料進行分析,測量食管腫瘤原發灶管壁厚度,評估臨床分期。若 CT成像中食管壁最厚層面管腔可見,則垂直管腔測量壁厚;若管腔閉塞,則以最大橫向直徑的 1/2為準[27]。由1名有經驗的病理科醫生重新復閱術后病理切片采用CAP標準進行腫瘤退縮程度分級。TRG 0 級=無存活癌細胞(完全反應);TRG 1 級=單個或小簇癌細胞殘留(中度反應);TRG 2 級=殘留癌灶伴間質纖維化(輕度反應);TRG 3 級=少量或無腫瘤退縮改變,大量癌細胞殘留(反應不佳)。
1.3 統計學分析
應用SPSS 26.0統計軟件進行分析。正態分布的計量資料采用兩組比較的t檢驗,計數資料采用四格表χ2檢驗、R×C列聯表χ2檢驗、Fisher精確檢驗。等級資料采用秩和檢驗。采用受試者工作特征(ROC)曲線判斷最佳截斷值。以ROC曲線的AUC評價預測模型效能。P≤0.05為差異有統計學意義。
1.4 倫理審查
川北醫學院附屬醫院醫學倫理委員會,批件編號2024ER488-1。
2 結果
2.1 基線資料
接受新輔助免疫治療聯合化療的食管癌患者共159例,術后病理證實為非食管鱗癌患者(腺癌、粘液表皮樣癌)2例,未能切除腫瘤僅行胸腔探查的患者2例,術前合并有放療史的患者2例,合并有其他惡性腫瘤(肺腺癌)患者1例,新輔助用藥前血常規異常的患者8例,術后死亡患者(呼吸衰竭)1例,接受新輔助免疫抑制劑非信迪利單抗(帕博利珠單抗、替雷利珠單抗、卡瑞利珠單抗、特瑞普利單抗)的患者49例,拒絕接受手術治療的患者1例,臨床資料欠缺的患者1例。最終共92例食管鱗癌患者納入研究,均接受了新輔助信迪利單抗免疫治療聯合化療后手術方案。平均年齡(65.86±7.66)歲,男性患者比例居多,占78.3%。43.5%的患者有吸煙史,59.8%的患者有酗酒史。高血壓患者較多,占78.3%,7.6%患者有糖尿病。腫瘤位置大部分位于中段(93.5%),管壁增厚明顯(1.54±0.38)cm,中分化類型占44.6%。
2.2 pCR組和非pCR臨床資料比較
表2顯示了按是否病理完全緩解(pCR)分組情況下臨床資料的比較。pCR組在影像學評估中腫瘤厚度明顯減小,新輔助免疫治療聯合化療前后腫瘤厚度變化顯著。病理是否完全緩解與治療前血液中淋巴細胞數目密切相關(P=0.019)。此外,關于術后并發癥,病理未完全緩解的術后肺部感染(25% vs. 5.6%,P=0.030)發生率高于pCR組。
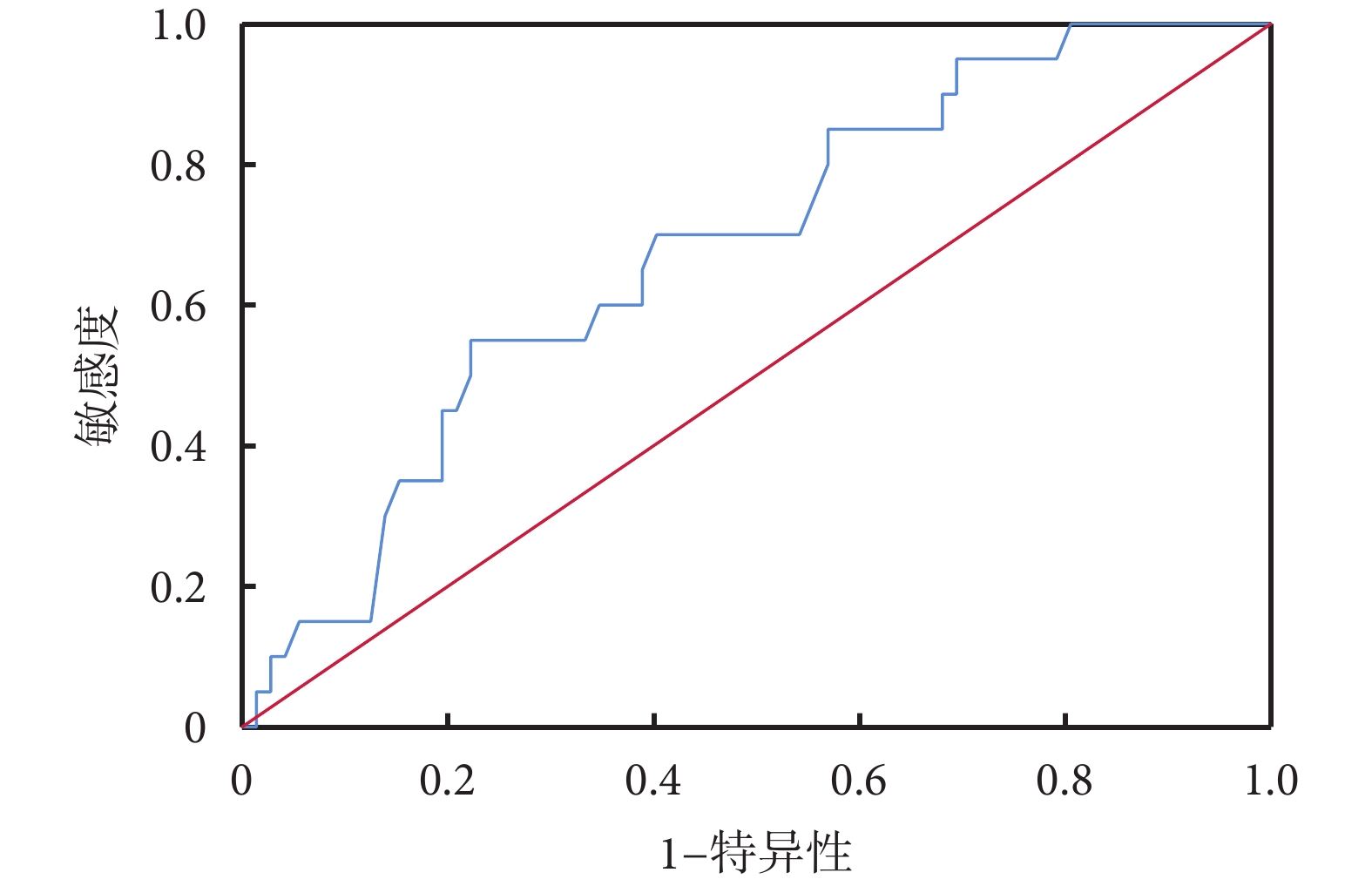
ROC曲線分析結果顯示:治療前血液淋巴細胞預測食管鱗癌新輔助免疫治療聯合化療后pCR的AUC為0.678,約登指數最大值為0.328,最佳截斷值為1.845;見圖1。將淋巴細胞數目最佳截斷值分類,<1.845 65例、≥1.845 27例,兩組病理N分期及病理TNM分期比較,差異具有統計學意義(P<0.05);見表3。
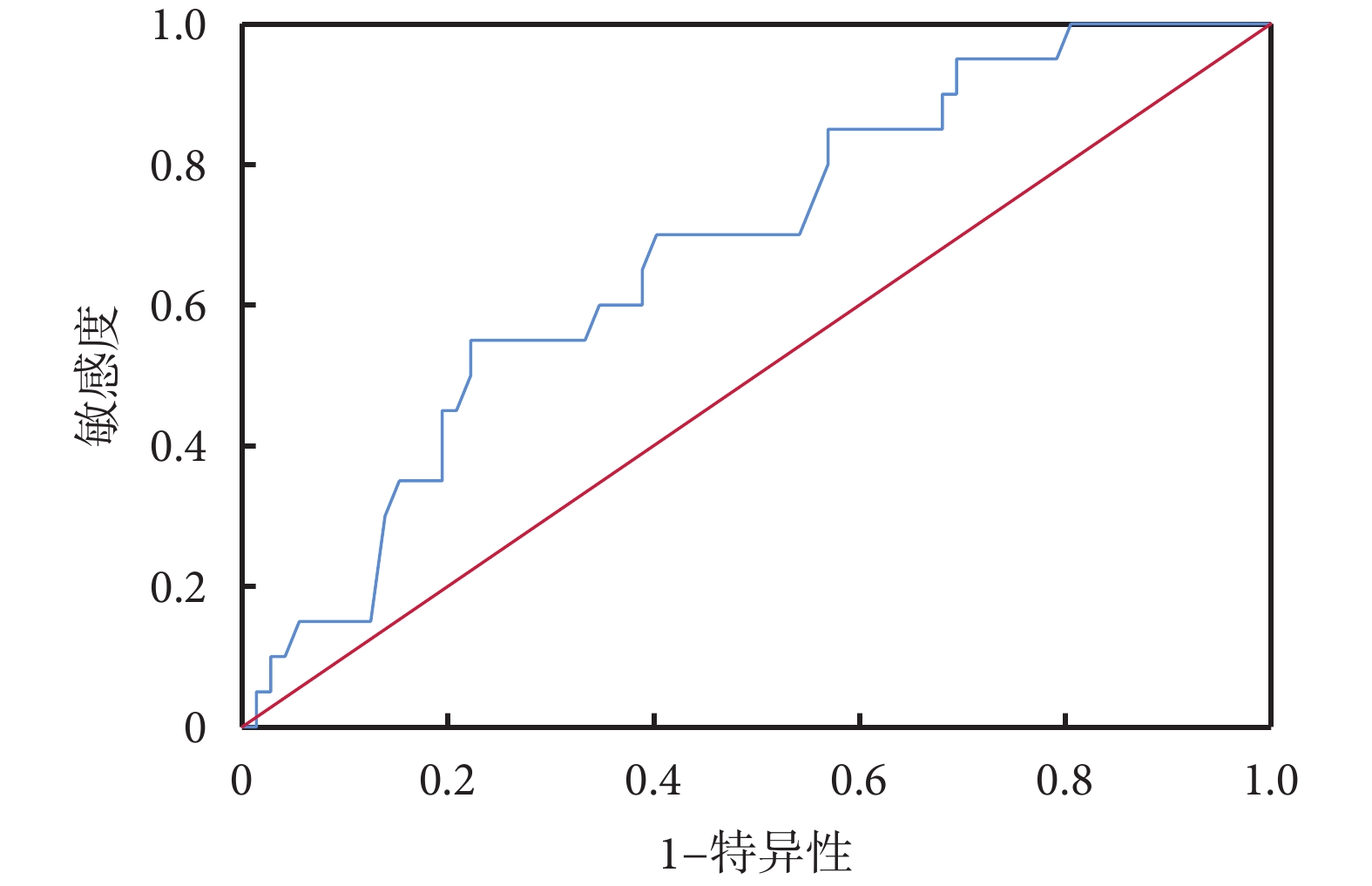 圖1
XX
圖1
XX
2.3 不同淋巴細胞計數分組的比較
表3顯示了按不同淋巴細胞計數分組情況下臨床資料的比較。兩組病理N分期及病理TNM分期比較,差異具有統計學意義(P<0.05)。
2.4 不同病理療效反應的臨床資料比較
表4顯示了按新輔助治療后腫瘤病理退縮分級CAP標準分類(TRG=0、1定義為療效佳,TRG=2、3定義為療效差),兩組進行臨床特征的比較。腫瘤位置存在統計學差異(P=0.027),療效佳的組在影像學評估中腫瘤厚度明顯減小,新輔助免疫治療聯合化療前后腫瘤厚度變化顯著。同樣,術后病理T分期(P=0.000)、N分期(P=0.041)及TNM分期(P=0.000)存在顯著性差異。療效反應與治療前血液中紅細胞數目密切相關(P=0.009)。
2.5 治療前血液紅細胞濃度預測價值
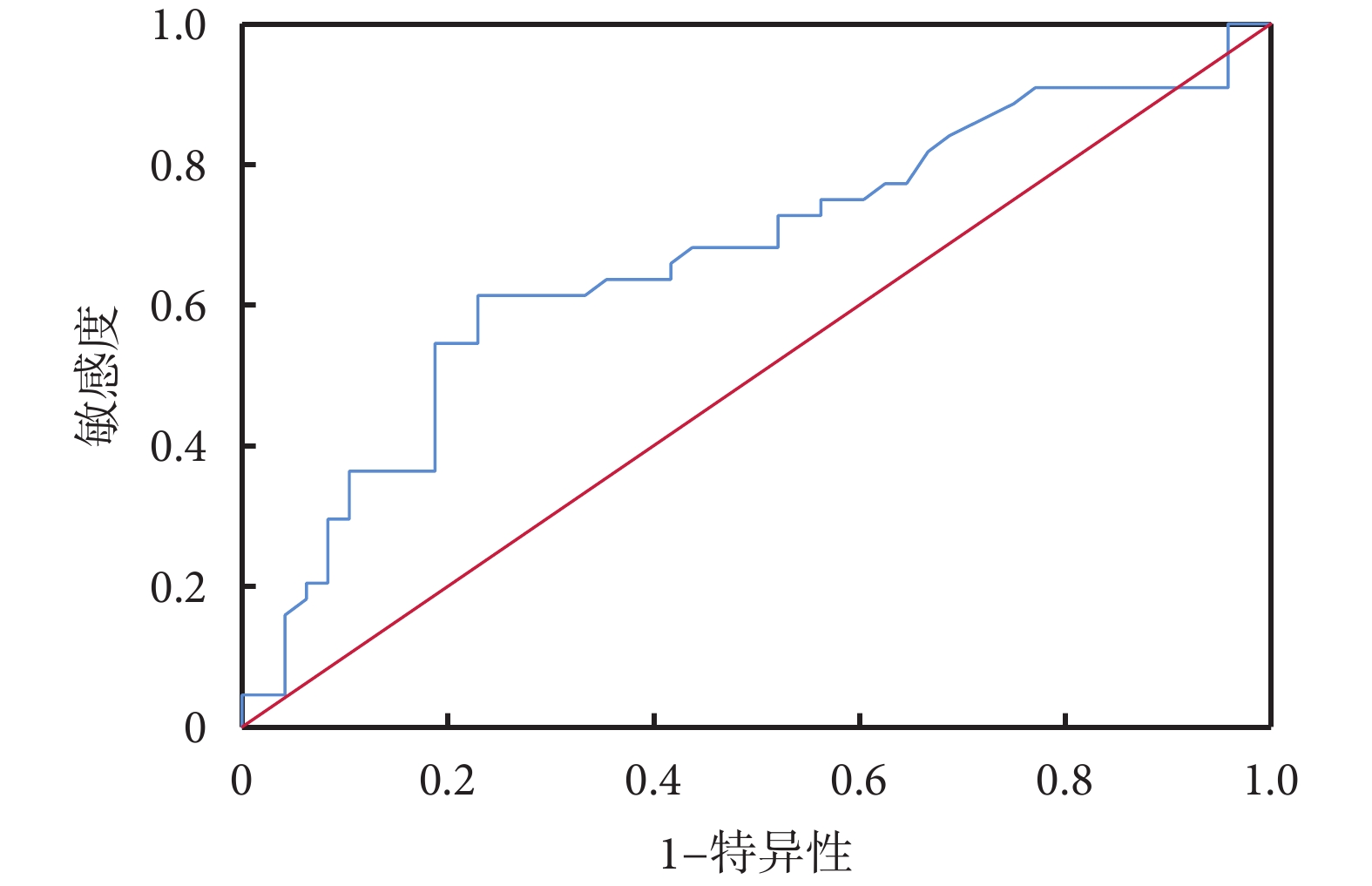
ROC曲線分析結果顯示:治療前血液紅細胞預測食管鱗癌新輔助免疫治療聯合化療后TRG反應的AUC為0.669,約登指數最大值為0.385,最佳截斷值為4.235,見圖2。將紅細胞數目最佳截斷值分類,<4.235 53例、≥4.235 39例,兩組年齡(P=0.000)、高血壓(P=0.022)差異有統計學意義;見表5。
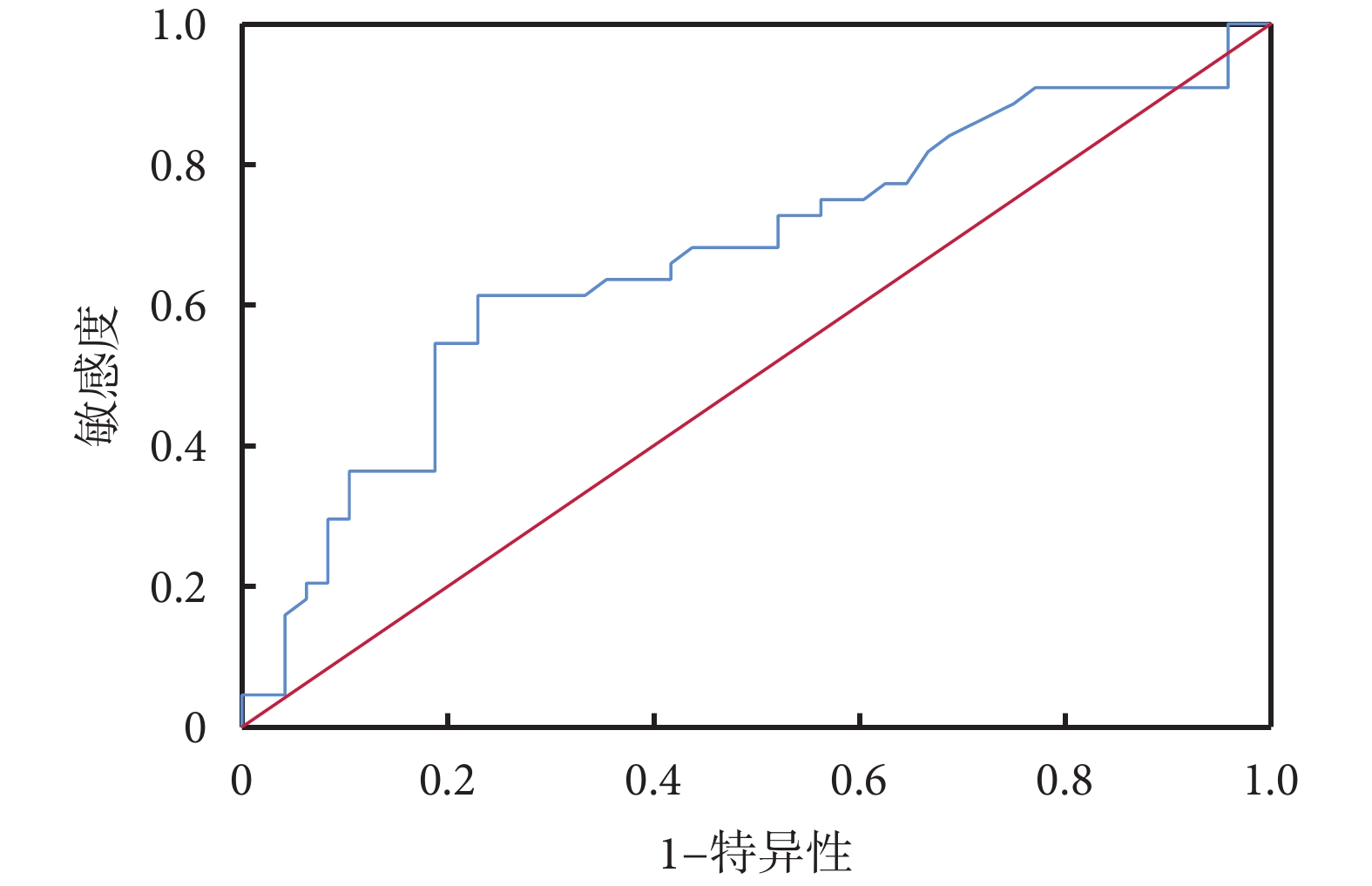 圖2
XX
圖2
XX
3 討論
對于局部進展期食管鱗癌,新輔助化療或放化療后行根治性手術是標準的治療方案。隨著免疫抑制劑的出現,免疫治療也成為晚期食管癌的主要治療方案。根據最新NCCN指南,化療聯合免疫治療方案用于晚期食管癌的一線治療。同樣,免疫治療在食管癌新輔助治療中積極探索,大量研究證實了新輔助免疫治療聯合化療在治療局部進展期食管鱗癌方面顯示出良好的安全性和有效性。在本回顧性研究中,pCR率為21.7%,新輔助治療后腫瘤退縮分級評估中,更是超過一半(52.2%)的療效反應好,腫瘤退縮明顯。
患者對新輔助治療的反應與其預后密切相關。在免疫治療過程中,雖然部分食管癌患者獲益明顯,但仍有一些接受免疫治療的患者出現了疾病的超進展或致命的不良反應。因此如何利用生物標志物有效識別可獲益患者顯得尤為關鍵。目前常用的生物標志物如程序性死亡蛋白配體1(PD-L1)、腫瘤突變負荷(TMB)、微衛星不穩定性均需要侵入性操作并且部分不能有效預測[28]。因此探索成本效益佳的有效生物標志物在篩選獲益人群中十分有意義。外周血淋巴細胞、中性粒細胞和單核細胞被大量研究證實與各種癌癥預后相關,相關計算指標如NLR、LMR和PLR與癌癥患者生存預后顯著相關[17-20]。在食管鱗癌的新輔助治療中,免疫炎癥指標有著良好的療效預測價值[29]。另外,外周血中與紅細胞相關指標比如紅細胞分布寬度、紅細胞體積被研究證實了在食管鱗癌患者中生存預后價值[23, 25, 30-31]。基于既往相關研究,本研究探討是否外周血中細胞可預測食管鱗癌新輔助免疫治療聯合化療療效,結果表明,在接受新輔助免疫治療聯合化療的局部進展期食管鱗癌患者中,治療前外周血中淋巴細胞較多者更傾向pCR。有研究表明,不僅是腫瘤微環境內的免疫細胞,外周血淋巴細胞亞群同樣也與腫瘤的發生、發展密切相關[32]。Geng 等[33]的研究探討了接受一線免疫抑制劑治療的腫瘤患者的外周淋巴細胞與免疫治療結局之間的關系。探索了高水平的外周血CD8+CD25+T細胞可能是免疫療法有效的潛在生物標志物。
紅細胞作為血液中數量最多的一種血細胞,其主要功能一直被認為是為機體運輸氧氣。一些研究表明,紅細胞與免疫也密切相關。研究發現在癌細胞分泌的細胞因子作用下,紅系祖母細胞會改變分化傾向,轉而成為免疫抑制性的髓系細胞,也就是紅系分化的髓系細胞(EDMC),從而促進腫瘤免疫逃避。朱波2018年研究發現腫瘤誘導的貧血導致的髓外造血,會產生一種功能與髓系抑制細胞類似的紅系祖細胞(CD45+EPC)[34],抑制抗腫瘤免疫。進一步研究發現癌細胞分泌粒細胞-巨噬細胞集落刺激因子(GM-CSF),促進CD45+EPC分化為EDMC。分析結果顯示EDMC表達更高水平的PD-L1、PD-L2等常見的免疫抑制靶點[35]。因此在免疫抑制劑參與的治療中,腫瘤性貧血是否更有益于抗腫瘤療效反應值得深思。本研究在評估食管鱗癌新輔助免疫治療聯合化療后腫瘤病理退縮程度過程中,證實了紅細胞與療效反應的相關性,新輔助治療前紅細胞計數<4.235的患者獲得較好的療效反應。
本研究首次探索了預測食管鱗癌新輔助免疫治療聯合化療療效的生物標志物,證實了外周血細胞與療效預測的相關性,但該研究為單中心回顧性研究,樣本量較少,不足以完全證明外周血細胞與療效預測的密切相關性。還需要更多的前瞻性及多中心研究充分驗證。另外,不僅體現在療效預測方面,在生存預后預測方面更需要大量的隨訪數據加以證實。
利益沖突:無。
作者貢獻:冉興強負責論文設計和撰寫,張程城、羅濤參與選題及設計, 徐彬文、張躍、張力文參與資料收集,付茂勇負責總體設計與審校。
食管癌是常見的消化道惡性腫瘤之一。據最新全球癌癥數據統計,食管癌發病率居第7位,死亡率居第6位。每年新發病例高達60.4萬,死亡54.4萬,意味著每18例癌癥中就有1例因食管癌喪失生命[1]。最常見的組織學類型為鱗癌和腺癌。其中鱗癌占85%,超過一半的病例發生在我國,且我國約90%的食管癌組織學類型為鱗癌[2]。目前食管癌的治療策略依然是以手術為主的綜合治療,對于局部進展期食管癌新輔助治療聯合手術已成為標準的治療方案[3-7]。盡管生存獲益,但仍有多數患者出現術后復發,遠處轉移最常見[8]。近些年免疫治療的出現改變了晚期食管癌的治療策略。美國國立綜合癌癥網絡(NCCN)指南、中國臨床腫瘤學會(CSCO)指南推薦免疫治療聯合化療作為不可切除局部晚期食管癌及遠處轉移性疾病的一線治療。大量關于局部晚期食管癌的術前新輔助免疫治療也被證實安全有效[9-16]。但目前尚缺乏預測新輔助免疫治療聯合化療療效的敏感有效指標。
血液中反應免疫炎癥的中性粒細胞和淋巴細胞比值(NLR)、PLT和淋巴細胞比值(PLR)、全身免疫炎癥指數(SII)等指標在實體瘤預后預測中已有報道[17-20]。治療前高水平紅細胞分布寬度被證實與惡性腫瘤的不良生存結局相關[21-22],紅細胞分布寬度、血紅蛋白和紅細胞分布寬度比值被報道可以作為食管鱗癌的預后參數[23-26]。目前還未有關研究說明外周血細胞與新輔助免疫治療聯合化療治療食管鱗癌療效的關系,因此,本研究探討外周血細胞對食管鱗癌新輔助免疫治療聯合化療的療效預測價值。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2020年4月—2023年11月于我院接受新輔助信迪利單抗免疫治療聯合化療后手術的食管鱗癌患者。納入標準:臨床分期Ⅱ~Ⅳa期,年齡48~80歲,臨床病理資料完整。排除標準:患有其他病理類型的食管癌,合并其他類型的腫瘤或患有血液學/自身免疫性疾病,接受其他類型的抗癌治療,不能根治性切除,治療前血常規指標異常,免疫抑制劑不是同一種(非信迪利單抗)。
按治療后病理是否完全緩解,將患者分為病理完全緩解組和病理未完全緩解組;按新輔助治療后腫瘤病理退縮分級CAP標準分組(TRG=0、1定義為療效佳,TRG=2、3定義為療效差)。
1.2 治療方法
患者術前經胃鏡病理活檢確診為食管鱗癌且在術前每21 d接受2個周期的新輔助免疫治療聯合化療。化療方案包括奈達鉑(第1 d)和多西他賽/白蛋白紫杉醇(第2 d),第3 d給予信迪利單抗免疫治療。新輔助治療結束后4周進行重新評估手術可行性及排除任何存在手術禁忌證的患者。手術方式為 McKeown 食管癌根治術。
用藥2周期后復查胸部計算機斷層掃描(computed tomography,CT),由 1名經驗豐富的放射科醫生對術前 CT影像資料進行分析,測量食管腫瘤原發灶管壁厚度,評估臨床分期。若 CT成像中食管壁最厚層面管腔可見,則垂直管腔測量壁厚;若管腔閉塞,則以最大橫向直徑的 1/2為準[27]。由1名有經驗的病理科醫生重新復閱術后病理切片采用CAP標準進行腫瘤退縮程度分級。TRG 0 級=無存活癌細胞(完全反應);TRG 1 級=單個或小簇癌細胞殘留(中度反應);TRG 2 級=殘留癌灶伴間質纖維化(輕度反應);TRG 3 級=少量或無腫瘤退縮改變,大量癌細胞殘留(反應不佳)。
1.3 統計學分析
應用SPSS 26.0統計軟件進行分析。正態分布的計量資料采用兩組比較的t檢驗,計數資料采用四格表χ2檢驗、R×C列聯表χ2檢驗、Fisher精確檢驗。等級資料采用秩和檢驗。采用受試者工作特征(ROC)曲線判斷最佳截斷值。以ROC曲線的AUC評價預測模型效能。P≤0.05為差異有統計學意義。
1.4 倫理審查
川北醫學院附屬醫院醫學倫理委員會,批件編號2024ER488-1。
2 結果
2.1 基線資料
接受新輔助免疫治療聯合化療的食管癌患者共159例,術后病理證實為非食管鱗癌患者(腺癌、粘液表皮樣癌)2例,未能切除腫瘤僅行胸腔探查的患者2例,術前合并有放療史的患者2例,合并有其他惡性腫瘤(肺腺癌)患者1例,新輔助用藥前血常規異常的患者8例,術后死亡患者(呼吸衰竭)1例,接受新輔助免疫抑制劑非信迪利單抗(帕博利珠單抗、替雷利珠單抗、卡瑞利珠單抗、特瑞普利單抗)的患者49例,拒絕接受手術治療的患者1例,臨床資料欠缺的患者1例。最終共92例食管鱗癌患者納入研究,均接受了新輔助信迪利單抗免疫治療聯合化療后手術方案。平均年齡(65.86±7.66)歲,男性患者比例居多,占78.3%。43.5%的患者有吸煙史,59.8%的患者有酗酒史。高血壓患者較多,占78.3%,7.6%患者有糖尿病。腫瘤位置大部分位于中段(93.5%),管壁增厚明顯(1.54±0.38)cm,中分化類型占44.6%。
2.2 pCR組和非pCR臨床資料比較
表2顯示了按是否病理完全緩解(pCR)分組情況下臨床資料的比較。pCR組在影像學評估中腫瘤厚度明顯減小,新輔助免疫治療聯合化療前后腫瘤厚度變化顯著。病理是否完全緩解與治療前血液中淋巴細胞數目密切相關(P=0.019)。此外,關于術后并發癥,病理未完全緩解的術后肺部感染(25% vs. 5.6%,P=0.030)發生率高于pCR組。
ROC曲線分析結果顯示:治療前血液淋巴細胞預測食管鱗癌新輔助免疫治療聯合化療后pCR的AUC為0.678,約登指數最大值為0.328,最佳截斷值為1.845;見圖1。將淋巴細胞數目最佳截斷值分類,<1.845 65例、≥1.845 27例,兩組病理N分期及病理TNM分期比較,差異具有統計學意義(P<0.05);見表3。
 圖1
XX
圖1
XX
2.3 不同淋巴細胞計數分組的比較
表3顯示了按不同淋巴細胞計數分組情況下臨床資料的比較。兩組病理N分期及病理TNM分期比較,差異具有統計學意義(P<0.05)。
2.4 不同病理療效反應的臨床資料比較
表4顯示了按新輔助治療后腫瘤病理退縮分級CAP標準分類(TRG=0、1定義為療效佳,TRG=2、3定義為療效差),兩組進行臨床特征的比較。腫瘤位置存在統計學差異(P=0.027),療效佳的組在影像學評估中腫瘤厚度明顯減小,新輔助免疫治療聯合化療前后腫瘤厚度變化顯著。同樣,術后病理T分期(P=0.000)、N分期(P=0.041)及TNM分期(P=0.000)存在顯著性差異。療效反應與治療前血液中紅細胞數目密切相關(P=0.009)。
2.5 治療前血液紅細胞濃度預測價值
ROC曲線分析結果顯示:治療前血液紅細胞預測食管鱗癌新輔助免疫治療聯合化療后TRG反應的AUC為0.669,約登指數最大值為0.385,最佳截斷值為4.235,見圖2。將紅細胞數目最佳截斷值分類,<4.235 53例、≥4.235 39例,兩組年齡(P=0.000)、高血壓(P=0.022)差異有統計學意義;見表5。
 圖2
XX
圖2
XX
3 討論
對于局部進展期食管鱗癌,新輔助化療或放化療后行根治性手術是標準的治療方案。隨著免疫抑制劑的出現,免疫治療也成為晚期食管癌的主要治療方案。根據最新NCCN指南,化療聯合免疫治療方案用于晚期食管癌的一線治療。同樣,免疫治療在食管癌新輔助治療中積極探索,大量研究證實了新輔助免疫治療聯合化療在治療局部進展期食管鱗癌方面顯示出良好的安全性和有效性。在本回顧性研究中,pCR率為21.7%,新輔助治療后腫瘤退縮分級評估中,更是超過一半(52.2%)的療效反應好,腫瘤退縮明顯。
患者對新輔助治療的反應與其預后密切相關。在免疫治療過程中,雖然部分食管癌患者獲益明顯,但仍有一些接受免疫治療的患者出現了疾病的超進展或致命的不良反應。因此如何利用生物標志物有效識別可獲益患者顯得尤為關鍵。目前常用的生物標志物如程序性死亡蛋白配體1(PD-L1)、腫瘤突變負荷(TMB)、微衛星不穩定性均需要侵入性操作并且部分不能有效預測[28]。因此探索成本效益佳的有效生物標志物在篩選獲益人群中十分有意義。外周血淋巴細胞、中性粒細胞和單核細胞被大量研究證實與各種癌癥預后相關,相關計算指標如NLR、LMR和PLR與癌癥患者生存預后顯著相關[17-20]。在食管鱗癌的新輔助治療中,免疫炎癥指標有著良好的療效預測價值[29]。另外,外周血中與紅細胞相關指標比如紅細胞分布寬度、紅細胞體積被研究證實了在食管鱗癌患者中生存預后價值[23, 25, 30-31]。基于既往相關研究,本研究探討是否外周血中細胞可預測食管鱗癌新輔助免疫治療聯合化療療效,結果表明,在接受新輔助免疫治療聯合化療的局部進展期食管鱗癌患者中,治療前外周血中淋巴細胞較多者更傾向pCR。有研究表明,不僅是腫瘤微環境內的免疫細胞,外周血淋巴細胞亞群同樣也與腫瘤的發生、發展密切相關[32]。Geng 等[33]的研究探討了接受一線免疫抑制劑治療的腫瘤患者的外周淋巴細胞與免疫治療結局之間的關系。探索了高水平的外周血CD8+CD25+T細胞可能是免疫療法有效的潛在生物標志物。
紅細胞作為血液中數量最多的一種血細胞,其主要功能一直被認為是為機體運輸氧氣。一些研究表明,紅細胞與免疫也密切相關。研究發現在癌細胞分泌的細胞因子作用下,紅系祖母細胞會改變分化傾向,轉而成為免疫抑制性的髓系細胞,也就是紅系分化的髓系細胞(EDMC),從而促進腫瘤免疫逃避。朱波2018年研究發現腫瘤誘導的貧血導致的髓外造血,會產生一種功能與髓系抑制細胞類似的紅系祖細胞(CD45+EPC)[34],抑制抗腫瘤免疫。進一步研究發現癌細胞分泌粒細胞-巨噬細胞集落刺激因子(GM-CSF),促進CD45+EPC分化為EDMC。分析結果顯示EDMC表達更高水平的PD-L1、PD-L2等常見的免疫抑制靶點[35]。因此在免疫抑制劑參與的治療中,腫瘤性貧血是否更有益于抗腫瘤療效反應值得深思。本研究在評估食管鱗癌新輔助免疫治療聯合化療后腫瘤病理退縮程度過程中,證實了紅細胞與療效反應的相關性,新輔助治療前紅細胞計數<4.235的患者獲得較好的療效反應。
本研究首次探索了預測食管鱗癌新輔助免疫治療聯合化療療效的生物標志物,證實了外周血細胞與療效預測的相關性,但該研究為單中心回顧性研究,樣本量較少,不足以完全證明外周血細胞與療效預測的密切相關性。還需要更多的前瞻性及多中心研究充分驗證。另外,不僅體現在療效預測方面,在生存預后預測方面更需要大量的隨訪數據加以證實。
利益沖突:無。
作者貢獻:冉興強負責論文設計和撰寫,張程城、羅濤參與選題及設計, 徐彬文、張躍、張力文參與資料收集,付茂勇負責總體設計與審校。