肺癌仍是全球癌癥相關死亡的首要原因[1]。根據國際癌癥研究機構2020年癌癥數據[2],估計每年有180萬人死于肺癌。隨著低劑量計算機斷層掃描技術的推廣,T1a~bN0M0期非小細胞肺癌(non-small cell lung cancer,NSCLC)的檢出率提高。亞肺葉切除(肺段切除與楔形切除)與肺葉切除比較,能夠為患者保留更多的肺實質,減少并發癥的發生,已被美國國家癌癥綜合網絡(NCCN)指南推薦作為周圍型T1a~bN0M0期NSCLC患者的手術方式。肺段切除術與楔形切除術治療周圍型T1a~bN0M0期NSCLC患者的5年總體生存期(overall survival,OS)和疾病特異性生存期(disease-specific survival,DSS)相似[3]。肺段切除術屬于解剖性切除,腫瘤學效果更好[4-7],其優勢可能在遠期得以體現。然而,目前兩種亞肺葉切除術治療T1a~bN0M0期NSCLC的遠期(10年)預后差異尚不明確。
本文從監測,流行病學和最終結果(Surveillance,Epidemiology,and End Results,SEER)數據庫納入亞肺葉切除治療T1a~bN0M0期NSCLC患者的數據,經傾向性評分匹配(propensity-score matching,PSM)后,對患者遠期預后進行分析。
1 資料與方法
1.1 臨床資料和分組
使用SEER*Stat(版本8.4.1.2)軟件下載患者數據。納入標準:(1)肺和支氣管源性惡性腫瘤患者,且診斷時間為2004—2015年;(2)年齡18~89歲;(3)部位編碼為C34.1~C34.3,且偏側為左側或右側;(4)組織學類型ICD-O-3編碼為8256/3、8257/3、8250/3、8551/3、8260/3、8265/3、8230/3、8253/3、8254/3、8480/3、8333/3、8144/3、8140/3、8070/3、8071/3、8072/3、8083/3、8082/3、8012/3、8560/3、8022/3、8031/3、8032/3、8972/3、8090/3;(5)腫瘤直徑≤2 cm;(6)行區域淋巴結檢查,數目不少于1個,且淋巴結病理檢查結果為陰性;(7)符合AJCC第6版T1、N0、M0標準;(8)未接受放療和化療,或化療情況未知;(9)手術方式為楔形切除或肺段切除。排除標準:生存時間未知或術后1個月內死亡或刪失。按手術方式分將患者為肺段組和楔形組。
1.2 觀察指標
觀察指標:(1)性別;(2)年齡,即患者初診為NSCLC時的年齡;(3)腫瘤直徑;(4)腫瘤位置:根據位置編碼和側別編碼重編碼為5個肺葉;(5)組織學類型:根據ICD-O-3重編碼為5個主要類型(腺癌、鱗癌、腺鱗癌、大細胞癌、肉瘤樣癌);(6)區域淋巴結切除數(number of regional nodes dissected,RND)。
本研究主要終點為OS,即從確診到全因死亡的時間。次要終點是DSS,即從確診到死于肺癌的時間。同時記錄末次隨訪時間。
1.3 統計學分析
統計分析和繪圖使用R軟件包(版本4.3.1,https://www.R-project.org/)。
1.3.1 基線資料分析
使用“twogrps”函數自動判斷連續變量的正態性。滿足正態分布的變量,以均數±標準差(x±s)描述,組間比較采用獨立樣本t檢驗;不滿足正態分布的變量以中位數和上下四分位數[M(P25,P75)]描述,組間比較采用Wilcoxon秩和檢驗。分類變量以例數和百分比(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
1.3.2 傾向性評分匹配
通過“matchit”函數進行PSM,匹配因素包括性別、年齡、腫瘤直徑和位置。采用logistic回歸估算傾向得分,按照1∶1比例最近鄰匹配,卡鉗值設為0.2,匹配過程中不進行替換。上述匹配因素的選擇旨在消除術式選擇時的混雜偏倚,而不干涉術后產生的變量(如組織學類型和RND)。組間的配對平衡采用標準化均數差(standard mean difference,SMD)進行評估,SMD≤0.1表示組間資料平衡。
1.3.3 生存分析
組間生存差異分析分別采用Kaplan-Meier法和受限平均生存時間(restricted mean survival time,RMST)法進行。(1)Kaplan-Meier法:使用“survfit”函數擬合生存函數、“jskm”函數估計DSS和OS,組間比較采用對數秩檢驗(log-rank test),“ggsurvplot”函數繪制生存曲線;(2)RMST法:采用“rmst2”函數估計兩組的RMST。
1.3.4 Cox比例風險回歸模型分析
未分層的單因素Cox回歸分析使用“coxph”函數,獲取log-rank P值。等比例風險假定(proportional hazards assumption,PHA)通過“cox.zph”和“ggcoxzph”函數使用Schoenfeld殘差法判定,獲得Schoenfeld P值。若某因素存在違背PHA的情況,則重新構建時間依賴的Cox回歸模型。依據單因素分析的結果結合變量的實際臨床意義納入多因素Cox回歸分析。
1.3.5 亞組分析
亞組分析時使用“surv_cutpoint”函數確定連續變量(年齡、腫瘤大小、RND)的最佳截點,“surv_categorize”函數自動將連續變量轉換為分類變量。亞組內分別計算10年內兩組OS的RMST比值及其95%置信區間(confidence interval,CI),使用“forestplot”函數繪制森林圖。
1.4 倫理審查
本研究依托于SEER數據庫,對于使用已公開的、徹底去標識化的二次數據資源進行科學研究,可免于機構倫理審查委員會的額外審查流程。因此,本研究無需經過倫理審查委員會的正式審批。
2 結果
2.1 基線資料分析
共納入
PMS后,共843對患者匹配成功,兩組患者性別(P=1.000)、年齡(P=0.771)、腫瘤直徑(P=0.692)、位置(P=0.935)和組織學亞型(P=0.764)差異無統計學意義。肺段組的RND明顯大于楔形組(P<0.001)。組間配對的平衡性良好(SMD<0.1);見表1。
2.2 生存分析
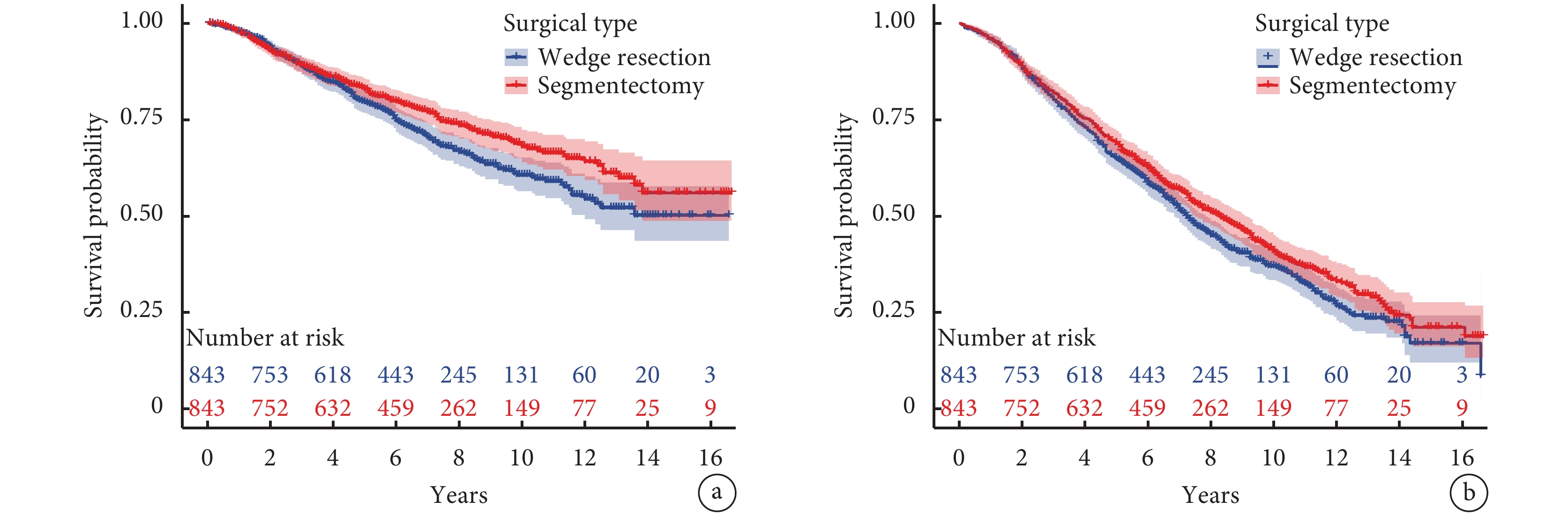
生存分析顯示,肺段組的10年DSS率和10年DSS-RMST[68.0%(63.9%,72.3%)vs. 60.6%(56.4%,65.2%),P=0.011;8.35(8.15,8.56)年vs. 8.02(7.81,8.24)年,P=0.031]及10年OS率[40.8%(37.0%,45.0%)vs. 37.0%(33.4%,41.0%),P=0.049]優于楔形組,而5年DSS率和5年DSS-RMST[82.9%(80.2%,85.6%)vs. 79.5%(76.7%,82.4%),P=0.112;4.58(4.51,4.66)年vs. 4.56(4.49,4.63)年,P=0.628]、5年OS率和5年OS-RMST[68.9%(65.8%,72.1%)vs. 64.9%(61.8%,68.3%),P=0.096;4.28(4.19,4.36)年vs. 4.21(4.12,4.30)年,P=0.341]以及10年OS-RMST[7.00(6.77,7.22)年vs. 6.69(6.47,6.92)年,P=0.063]差異無統計學意義;見圖1。
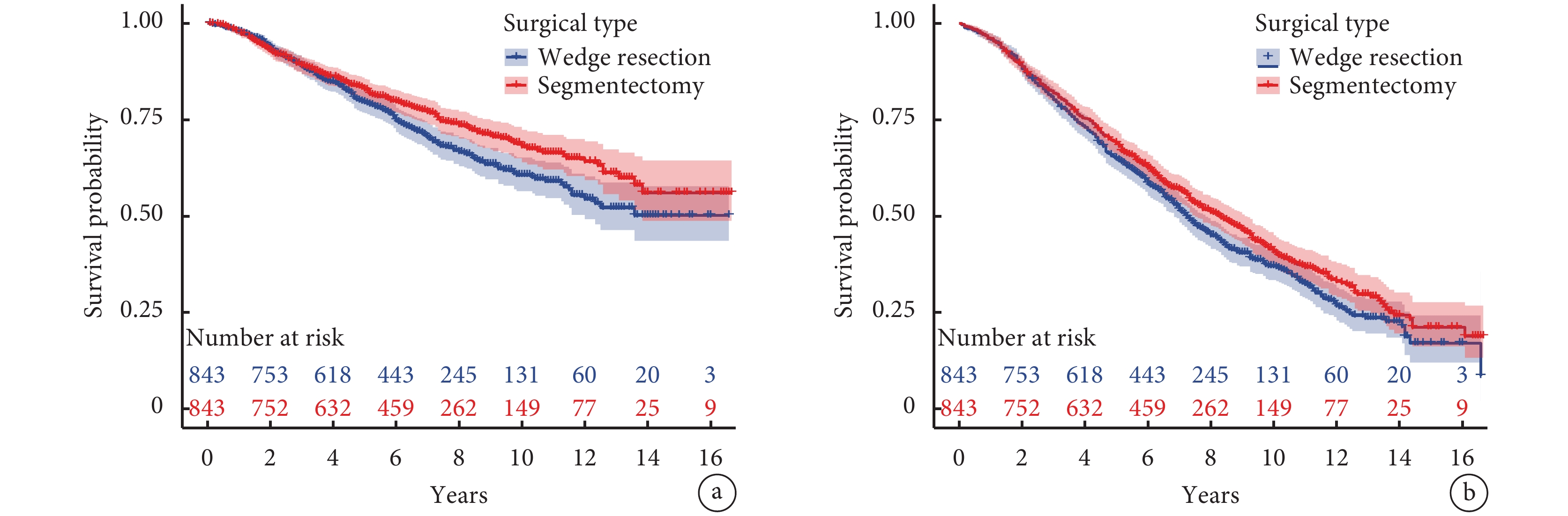 圖1
兩組生存曲線的比較
圖1
兩組生存曲線的比較
a:疾病特異性生存曲線;b:總體生存曲線
2.3 Cox比例風險回歸模型分析
未分層單因素Cox回歸分析顯示,患者性別和年齡、腫瘤組織學類型、RND和手術方式與DSS相關(P<0.05)。其中腫瘤組織學類型,雖然違反PHA假定,但根據既往報道,其仍具有臨床意義,故作為分層變量納入多因素分析。結果表明,性別、年齡、RND和手術方式是患者DSS的獨立危險因素(P<0.05);見表2。
未分層單因素Cox回歸分析顯示,患者性別和年齡、腫瘤直徑、組織學類型、RND和手術方式與OS相關(P<0.05)。多因素Cox回歸分析表明,性別、年齡、腫瘤組織學類型、RND是OS的獨立危險因素(P<0.05);見表3。
2.4 亞組分析
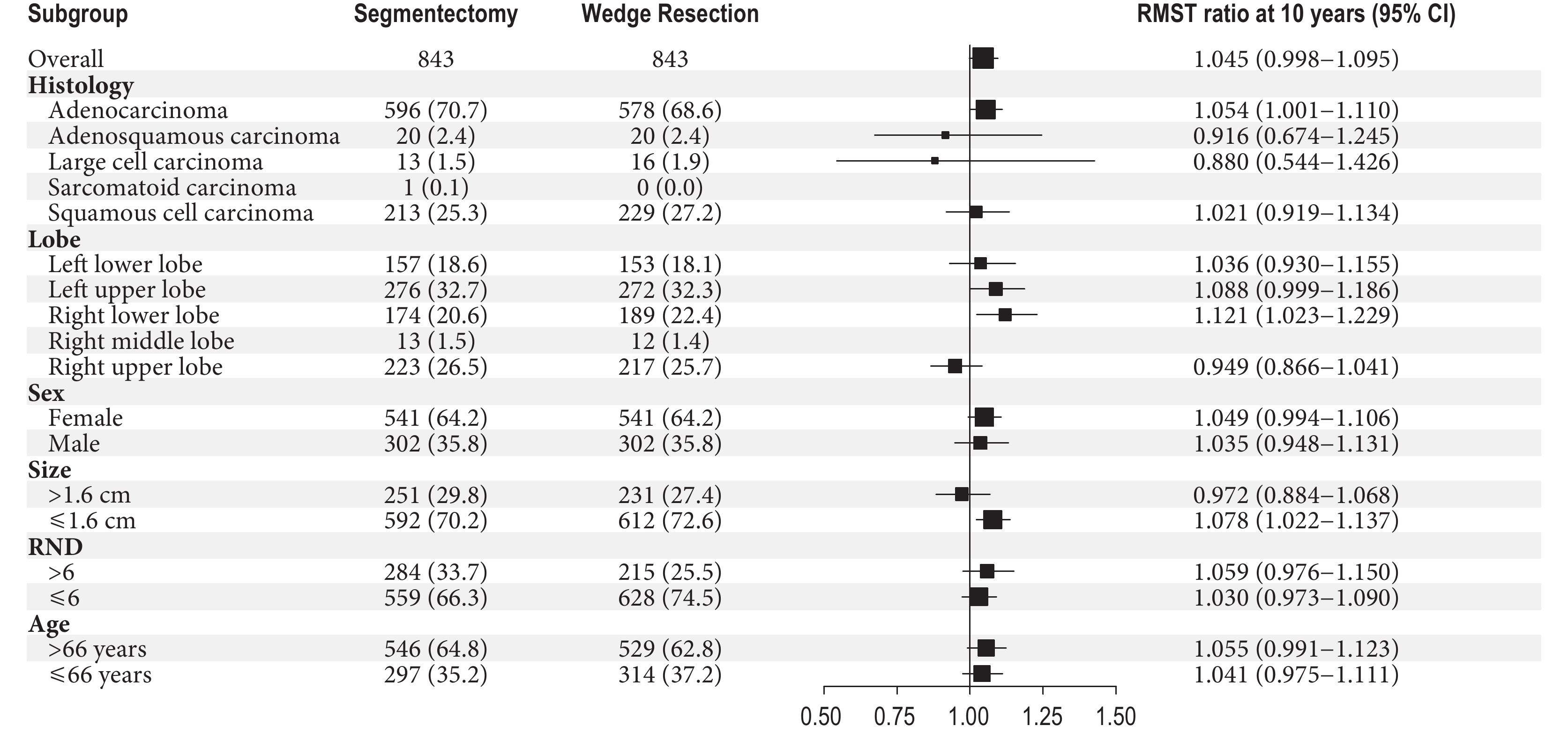
亞組分析表明,性別,年齡,RND,腫瘤組織學類型為腺鱗癌、大細胞癌、鱗癌,腫瘤位于左上、左下、右上葉和腫瘤直徑>1.6 cm的患者,兩組OS的10年RMST差異無統計學意義(P>0.05)。肺段切除優勢體現在腺癌(P=0.045)、右下葉(P=0.014)和腫瘤直徑≤1.6 cm(P=0.006)的患者中;見圖2。
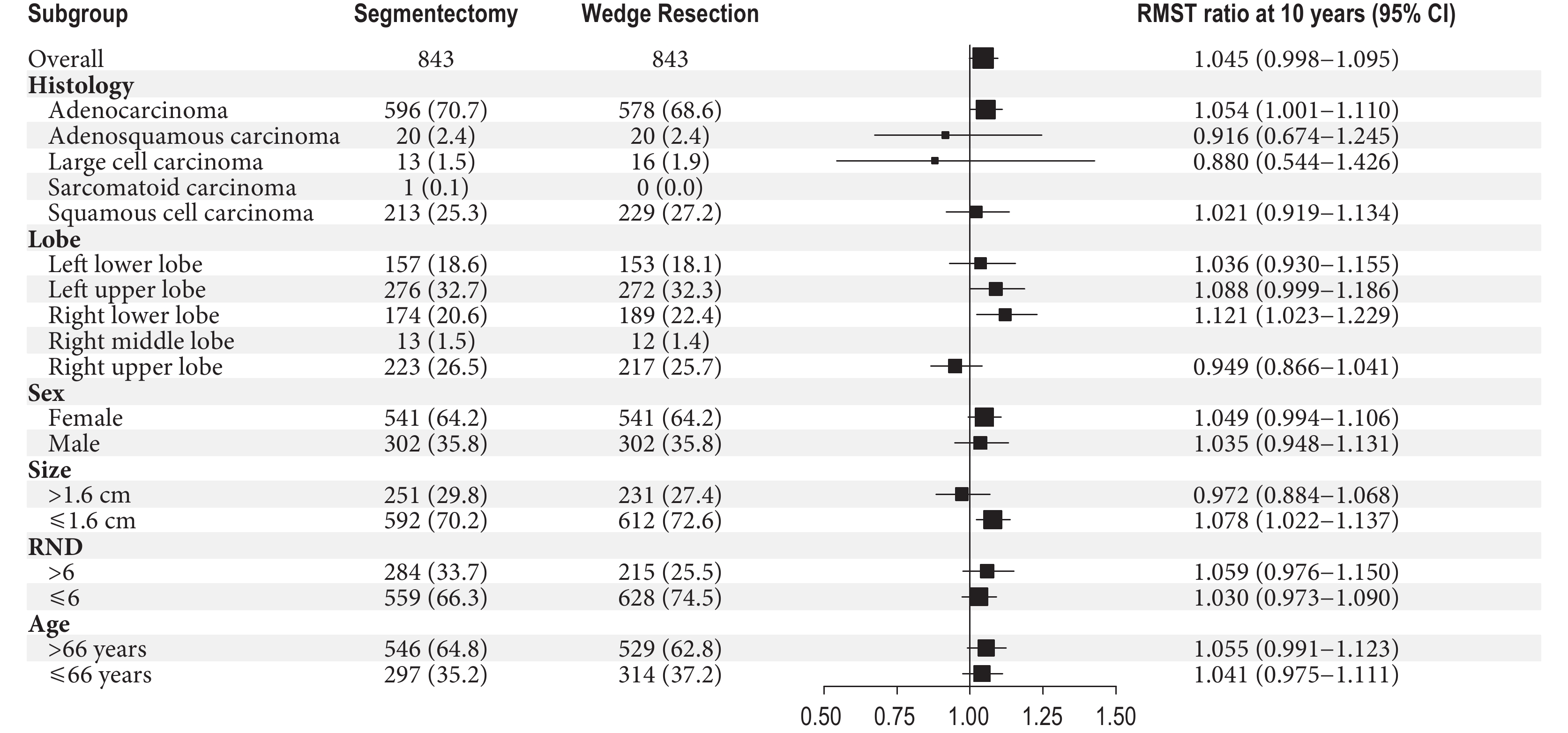 圖2
OS的10年RMST亞組分析
圖2
OS的10年RMST亞組分析
使用未分層的PMST估計了兩組(肺段組
3 討論
本研究發現,肺段切除術治療T1a~bN0M0期NSCLC患者的10年DSS率為68.0%,10年OS率為40.8%,10年DSS-RMST為8.35年,均優于楔形切除術。但兩組5年OS率、DSS率、OS-RMST、DSS-RMST和10年OS-RMST差異無統計學意義。患者的年齡、性別和RND是DSS和OS的獨立危險因素,亞肺葉切除方式僅是DSS的獨立危險因素。肺段組的10年OS-RMST僅在腺癌、腫瘤位于右肺下葉和腫瘤直徑≤1.6 cm的患者中優于楔形組。
本研究首次報道了亞肺葉切除術治療pT1a~bN0M0期NSCLC患者的OS-RMST。目前,有關亞肺葉切除術治療原發性肺癌的RMST分析仍然較少,尤其缺乏10年OS-RMST、5年DSS-RMST和OS-RMST的差異分析。Wu等[8]的回顧性研究比較了Ⅰ~ⅢA期伴第二原發肺癌患者的OS-RMST,其中第一原發肺癌接受肺段切除術(n=30)和楔形切除術(n=119)患者的5年OS-RMST分別為45.5、47.8個月,差異無統計學意義。雖然與本研究結果基本一致,但是該研究中的患者伴第二原發肺癌,且腫瘤分期為Ⅰ~ⅢA期,參考價值有限。
Potter等[9]比較了pT1a~cN0M0期NSCLC患者的預后,接受肺段切除術(n=20)和楔形切除術(n=31)患者的10年DSS率分別為81.3%和84.8%,10年OS率分別為59.9%和45.2%,差異均無統計學意義。然而,本研究發現接受肺段切除術患者的10年DSS率和10年OS率優于楔形切除術。出現這種差異的原因可能是,該研究[9]中患者的腫瘤分期為T1a~cN0M0期。由于T1cN0M0期患者的存在,樣本的10年DSS率和10年OS率表現差異不明顯。另外,該研究中接受亞肺葉切術的患者樣本量較少,缺乏足夠的統計學效力檢測兩組之間生存率差異。隨機臨床試驗(GALGB 140503)[10]比較了周圍型cT1a~bN0M0期NSCLC患者的預后,接受肺段切除術(n=131)和楔形切除術(n=204)患者5年DSS率分別為89.2%和89.7%,5年OS率分別為81.9%和79.7%,兩組差異無統計學意義。雖然肺段切除術和楔形切除術在5年OS率上可能無顯著差異,但是在某些特定情況下(如臨床ⅠA2期或純實性腫瘤),肺段切除術可能具有更好的腫瘤控制效果[11]。此外,肺段切除術在手術切緣的獲取上也可能具有優勢[12]。然而,這些結論需要進一步驗證和明確。
研究[12]指出,在實性比>0.25、分期為T1a~bN0M0期NSCLC患者中,多因素分析表明OS死亡風險與患者年齡(HR=1.09)、性別(男性,HR=4.00)、癌胚抗原(HR=1.96)和組織病理學類型(非腺癌的NCSLC,HR=1.85)相關,而與手術方式無關。一項瑞典全國范圍內肺癌人群的觀察性隊列研究[13]顯示,與男性相比,女性OS死亡風險較低(HR=0.73)。一項關于Ⅰ期肺癌患者預后的Meta分析[14]顯示,與楔形切除術相比,肺段切除術的OS死亡風險無統計學差異(HR=0.80)。有報道[15]指出,行亞肺葉切除的cT1a~bN0M0期NSCLC患者中,RND少的患者OS預后明顯更差(HR=1.50)。以上報道與本研究結果基本一致。
Li等[16]指出,與楔形切除術相比,雖然肺段切除術在腺癌患者中的OS死亡風險差異無統計學意義,但在鱗癌患者中的OS死亡風險較低(HR=0.69)。而本研究結果顯示在腺癌患者中,肺段切除術的10年OS-RMST優于楔形切除術。需要注意的是,本研究亞組分析采用的是10年OS-RMST法比較,而上述研究采用的是Cox比例風險回歸模型,兩種統計方法可能存在一定差異。
本研究存在一些局限。首先,這是一項回顧性研究,因此難免存在選擇偏倚。研究隊列中的
綜上所述,對于身體機能正常、預期壽命較長的患者,在不增加手術并發癥和死亡風險的前提下,建議優先采用肺段切除術以獲得更好的DSS;而對于身體機能較差、預期壽命<10年的患者,亞肺葉切除方式的選擇則更加靈活。亞肺葉切除中增加淋巴結清掃可能改善預后。
利益沖突:無。
作者貢獻:王朝負責研究設計,數據整理與分析,論文初稿撰寫與修改;潘宴青、孫云剛負責數據整理;邵豐負責研究設計,論文審閱與修改。
肺癌仍是全球癌癥相關死亡的首要原因[1]。根據國際癌癥研究機構2020年癌癥數據[2],估計每年有180萬人死于肺癌。隨著低劑量計算機斷層掃描技術的推廣,T1a~bN0M0期非小細胞肺癌(non-small cell lung cancer,NSCLC)的檢出率提高。亞肺葉切除(肺段切除與楔形切除)與肺葉切除比較,能夠為患者保留更多的肺實質,減少并發癥的發生,已被美國國家癌癥綜合網絡(NCCN)指南推薦作為周圍型T1a~bN0M0期NSCLC患者的手術方式。肺段切除術與楔形切除術治療周圍型T1a~bN0M0期NSCLC患者的5年總體生存期(overall survival,OS)和疾病特異性生存期(disease-specific survival,DSS)相似[3]。肺段切除術屬于解剖性切除,腫瘤學效果更好[4-7],其優勢可能在遠期得以體現。然而,目前兩種亞肺葉切除術治療T1a~bN0M0期NSCLC的遠期(10年)預后差異尚不明確。
本文從監測,流行病學和最終結果(Surveillance,Epidemiology,and End Results,SEER)數據庫納入亞肺葉切除治療T1a~bN0M0期NSCLC患者的數據,經傾向性評分匹配(propensity-score matching,PSM)后,對患者遠期預后進行分析。
1 資料與方法
1.1 臨床資料和分組
使用SEER*Stat(版本8.4.1.2)軟件下載患者數據。納入標準:(1)肺和支氣管源性惡性腫瘤患者,且診斷時間為2004—2015年;(2)年齡18~89歲;(3)部位編碼為C34.1~C34.3,且偏側為左側或右側;(4)組織學類型ICD-O-3編碼為8256/3、8257/3、8250/3、8551/3、8260/3、8265/3、8230/3、8253/3、8254/3、8480/3、8333/3、8144/3、8140/3、8070/3、8071/3、8072/3、8083/3、8082/3、8012/3、8560/3、8022/3、8031/3、8032/3、8972/3、8090/3;(5)腫瘤直徑≤2 cm;(6)行區域淋巴結檢查,數目不少于1個,且淋巴結病理檢查結果為陰性;(7)符合AJCC第6版T1、N0、M0標準;(8)未接受放療和化療,或化療情況未知;(9)手術方式為楔形切除或肺段切除。排除標準:生存時間未知或術后1個月內死亡或刪失。按手術方式分將患者為肺段組和楔形組。
1.2 觀察指標
觀察指標:(1)性別;(2)年齡,即患者初診為NSCLC時的年齡;(3)腫瘤直徑;(4)腫瘤位置:根據位置編碼和側別編碼重編碼為5個肺葉;(5)組織學類型:根據ICD-O-3重編碼為5個主要類型(腺癌、鱗癌、腺鱗癌、大細胞癌、肉瘤樣癌);(6)區域淋巴結切除數(number of regional nodes dissected,RND)。
本研究主要終點為OS,即從確診到全因死亡的時間。次要終點是DSS,即從確診到死于肺癌的時間。同時記錄末次隨訪時間。
1.3 統計學分析
統計分析和繪圖使用R軟件包(版本4.3.1,https://www.R-project.org/)。
1.3.1 基線資料分析
使用“twogrps”函數自動判斷連續變量的正態性。滿足正態分布的變量,以均數±標準差(x±s)描述,組間比較采用獨立樣本t檢驗;不滿足正態分布的變量以中位數和上下四分位數[M(P25,P75)]描述,組間比較采用Wilcoxon秩和檢驗。分類變量以例數和百分比(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
1.3.2 傾向性評分匹配
通過“matchit”函數進行PSM,匹配因素包括性別、年齡、腫瘤直徑和位置。采用logistic回歸估算傾向得分,按照1∶1比例最近鄰匹配,卡鉗值設為0.2,匹配過程中不進行替換。上述匹配因素的選擇旨在消除術式選擇時的混雜偏倚,而不干涉術后產生的變量(如組織學類型和RND)。組間的配對平衡采用標準化均數差(standard mean difference,SMD)進行評估,SMD≤0.1表示組間資料平衡。
1.3.3 生存分析
組間生存差異分析分別采用Kaplan-Meier法和受限平均生存時間(restricted mean survival time,RMST)法進行。(1)Kaplan-Meier法:使用“survfit”函數擬合生存函數、“jskm”函數估計DSS和OS,組間比較采用對數秩檢驗(log-rank test),“ggsurvplot”函數繪制生存曲線;(2)RMST法:采用“rmst2”函數估計兩組的RMST。
1.3.4 Cox比例風險回歸模型分析
未分層的單因素Cox回歸分析使用“coxph”函數,獲取log-rank P值。等比例風險假定(proportional hazards assumption,PHA)通過“cox.zph”和“ggcoxzph”函數使用Schoenfeld殘差法判定,獲得Schoenfeld P值。若某因素存在違背PHA的情況,則重新構建時間依賴的Cox回歸模型。依據單因素分析的結果結合變量的實際臨床意義納入多因素Cox回歸分析。
1.3.5 亞組分析
亞組分析時使用“surv_cutpoint”函數確定連續變量(年齡、腫瘤大小、RND)的最佳截點,“surv_categorize”函數自動將連續變量轉換為分類變量。亞組內分別計算10年內兩組OS的RMST比值及其95%置信區間(confidence interval,CI),使用“forestplot”函數繪制森林圖。
1.4 倫理審查
本研究依托于SEER數據庫,對于使用已公開的、徹底去標識化的二次數據資源進行科學研究,可免于機構倫理審查委員會的額外審查流程。因此,本研究無需經過倫理審查委員會的正式審批。
2 結果
2.1 基線資料分析
共納入
PMS后,共843對患者匹配成功,兩組患者性別(P=1.000)、年齡(P=0.771)、腫瘤直徑(P=0.692)、位置(P=0.935)和組織學亞型(P=0.764)差異無統計學意義。肺段組的RND明顯大于楔形組(P<0.001)。組間配對的平衡性良好(SMD<0.1);見表1。
2.2 生存分析
生存分析顯示,肺段組的10年DSS率和10年DSS-RMST[68.0%(63.9%,72.3%)vs. 60.6%(56.4%,65.2%),P=0.011;8.35(8.15,8.56)年vs. 8.02(7.81,8.24)年,P=0.031]及10年OS率[40.8%(37.0%,45.0%)vs. 37.0%(33.4%,41.0%),P=0.049]優于楔形組,而5年DSS率和5年DSS-RMST[82.9%(80.2%,85.6%)vs. 79.5%(76.7%,82.4%),P=0.112;4.58(4.51,4.66)年vs. 4.56(4.49,4.63)年,P=0.628]、5年OS率和5年OS-RMST[68.9%(65.8%,72.1%)vs. 64.9%(61.8%,68.3%),P=0.096;4.28(4.19,4.36)年vs. 4.21(4.12,4.30)年,P=0.341]以及10年OS-RMST[7.00(6.77,7.22)年vs. 6.69(6.47,6.92)年,P=0.063]差異無統計學意義;見圖1。
 圖1
兩組生存曲線的比較
圖1
兩組生存曲線的比較
a:疾病特異性生存曲線;b:總體生存曲線
2.3 Cox比例風險回歸模型分析
未分層單因素Cox回歸分析顯示,患者性別和年齡、腫瘤組織學類型、RND和手術方式與DSS相關(P<0.05)。其中腫瘤組織學類型,雖然違反PHA假定,但根據既往報道,其仍具有臨床意義,故作為分層變量納入多因素分析。結果表明,性別、年齡、RND和手術方式是患者DSS的獨立危險因素(P<0.05);見表2。
未分層單因素Cox回歸分析顯示,患者性別和年齡、腫瘤直徑、組織學類型、RND和手術方式與OS相關(P<0.05)。多因素Cox回歸分析表明,性別、年齡、腫瘤組織學類型、RND是OS的獨立危險因素(P<0.05);見表3。
2.4 亞組分析
亞組分析表明,性別,年齡,RND,腫瘤組織學類型為腺鱗癌、大細胞癌、鱗癌,腫瘤位于左上、左下、右上葉和腫瘤直徑>1.6 cm的患者,兩組OS的10年RMST差異無統計學意義(P>0.05)。肺段切除優勢體現在腺癌(P=0.045)、右下葉(P=0.014)和腫瘤直徑≤1.6 cm(P=0.006)的患者中;見圖2。
 圖2
OS的10年RMST亞組分析
圖2
OS的10年RMST亞組分析
使用未分層的PMST估計了兩組(肺段組
3 討論
本研究發現,肺段切除術治療T1a~bN0M0期NSCLC患者的10年DSS率為68.0%,10年OS率為40.8%,10年DSS-RMST為8.35年,均優于楔形切除術。但兩組5年OS率、DSS率、OS-RMST、DSS-RMST和10年OS-RMST差異無統計學意義。患者的年齡、性別和RND是DSS和OS的獨立危險因素,亞肺葉切除方式僅是DSS的獨立危險因素。肺段組的10年OS-RMST僅在腺癌、腫瘤位于右肺下葉和腫瘤直徑≤1.6 cm的患者中優于楔形組。
本研究首次報道了亞肺葉切除術治療pT1a~bN0M0期NSCLC患者的OS-RMST。目前,有關亞肺葉切除術治療原發性肺癌的RMST分析仍然較少,尤其缺乏10年OS-RMST、5年DSS-RMST和OS-RMST的差異分析。Wu等[8]的回顧性研究比較了Ⅰ~ⅢA期伴第二原發肺癌患者的OS-RMST,其中第一原發肺癌接受肺段切除術(n=30)和楔形切除術(n=119)患者的5年OS-RMST分別為45.5、47.8個月,差異無統計學意義。雖然與本研究結果基本一致,但是該研究中的患者伴第二原發肺癌,且腫瘤分期為Ⅰ~ⅢA期,參考價值有限。
Potter等[9]比較了pT1a~cN0M0期NSCLC患者的預后,接受肺段切除術(n=20)和楔形切除術(n=31)患者的10年DSS率分別為81.3%和84.8%,10年OS率分別為59.9%和45.2%,差異均無統計學意義。然而,本研究發現接受肺段切除術患者的10年DSS率和10年OS率優于楔形切除術。出現這種差異的原因可能是,該研究[9]中患者的腫瘤分期為T1a~cN0M0期。由于T1cN0M0期患者的存在,樣本的10年DSS率和10年OS率表現差異不明顯。另外,該研究中接受亞肺葉切術的患者樣本量較少,缺乏足夠的統計學效力檢測兩組之間生存率差異。隨機臨床試驗(GALGB 140503)[10]比較了周圍型cT1a~bN0M0期NSCLC患者的預后,接受肺段切除術(n=131)和楔形切除術(n=204)患者5年DSS率分別為89.2%和89.7%,5年OS率分別為81.9%和79.7%,兩組差異無統計學意義。雖然肺段切除術和楔形切除術在5年OS率上可能無顯著差異,但是在某些特定情況下(如臨床ⅠA2期或純實性腫瘤),肺段切除術可能具有更好的腫瘤控制效果[11]。此外,肺段切除術在手術切緣的獲取上也可能具有優勢[12]。然而,這些結論需要進一步驗證和明確。
研究[12]指出,在實性比>0.25、分期為T1a~bN0M0期NSCLC患者中,多因素分析表明OS死亡風險與患者年齡(HR=1.09)、性別(男性,HR=4.00)、癌胚抗原(HR=1.96)和組織病理學類型(非腺癌的NCSLC,HR=1.85)相關,而與手術方式無關。一項瑞典全國范圍內肺癌人群的觀察性隊列研究[13]顯示,與男性相比,女性OS死亡風險較低(HR=0.73)。一項關于Ⅰ期肺癌患者預后的Meta分析[14]顯示,與楔形切除術相比,肺段切除術的OS死亡風險無統計學差異(HR=0.80)。有報道[15]指出,行亞肺葉切除的cT1a~bN0M0期NSCLC患者中,RND少的患者OS預后明顯更差(HR=1.50)。以上報道與本研究結果基本一致。
Li等[16]指出,與楔形切除術相比,雖然肺段切除術在腺癌患者中的OS死亡風險差異無統計學意義,但在鱗癌患者中的OS死亡風險較低(HR=0.69)。而本研究結果顯示在腺癌患者中,肺段切除術的10年OS-RMST優于楔形切除術。需要注意的是,本研究亞組分析采用的是10年OS-RMST法比較,而上述研究采用的是Cox比例風險回歸模型,兩種統計方法可能存在一定差異。
本研究存在一些局限。首先,這是一項回顧性研究,因此難免存在選擇偏倚。研究隊列中的
綜上所述,對于身體機能正常、預期壽命較長的患者,在不增加手術并發癥和死亡風險的前提下,建議優先采用肺段切除術以獲得更好的DSS;而對于身體機能較差、預期壽命<10年的患者,亞肺葉切除方式的選擇則更加靈活。亞肺葉切除中增加淋巴結清掃可能改善預后。
利益沖突:無。
作者貢獻:王朝負責研究設計,數據整理與分析,論文初稿撰寫與修改;潘宴青、孫云剛負責數據整理;邵豐負責研究設計,論文審閱與修改。