全腔鏡下Ivor-Lewis食管切除手術(minimally invasive esophagectomy Ivor-Lewis,MIE-IL)是中下段食管癌常采用的手術方式[1-2]。國內早期開展MIE-IL需要在上腹部做一4~5 cm切口,經該小切口將游離好的胃提出到切口外,在直視下完成管狀胃的制作,吻合完成后,術者用手指經過上腹部小切口,在手指下引置入鼻腸管[3-4]。目前,在腔鏡下完成管狀胃的制作,并同期行空腸造瘺置入營養管的MIE-IL手術越來越普及[5-6]。
我科自2017年以來開始采用無上腹部小切口MIE-IL+空腸造瘺術治療食管中下段腫瘤。早期空腸造瘺術采用“C+I”模式,即在單荷包縫合對側縫合1根牽引線。隨著手術量的逐漸增加,造瘺相關術后并發癥被逐步發現,包括不全性腸梗阻、閉袢式腸梗阻、造瘺口周圍腸液外漏、皮膚紅腫、造瘺管堵塞等。因此我們在“C+I”空腸造瘺手術模式下進行改良,臨床觀察表明,與空腸造瘺術有關的并發癥發生率有了顯著降低。故收集近幾年行空腸造瘺手術的MIE-IL食管切除患者資料,將兩種空腸造瘺模式進行臨床比較,現報道如下。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2017—2023年在我科同一治療組連續行MIE-IL食管切除手術326例食管癌患者的臨床資料。2017—2020年按照“C+I”模式行空腸上段造瘺的患者為A組。2021—2023年在“C+I”空腸造瘺基礎上,于造瘺口肛側或者口側10~20 mm處,用3-0可吸收線在空腸對系膜緣將空腸與腹壁固定1~2針,將上段空腸與腹壁固定成“簾狀”的患者為B組。
納入標準:(1)腫瘤位于食管中下段,在全胸腔鏡下完成Ivor-Lewis食管切除+空腸造瘺手術;(2)術前行頸胸腹平掃和增強CT掃描證實腫瘤無明顯外侵及遠處轉移,鎖骨上及頸部無明顯腫大淋巴結;(3)根據國際抗癌聯盟(Union for International Cancer Control,UICC)及美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第8版食管癌TNM分期標準[7],術前綜合評估為0~Ⅲ期可手術切除的患者或者接受新輔助治療后降期能手術者[8]。
排除標準:(1)通過劍突下小切口來制作管狀胃;(2)有腹部手術史;(3)鼻腸管放置患者;(4)病例資料不完整。
1.2 術前檢查
治療前檢查包括:術前血、大小便常規檢查,肝功能,腎功能,血糖,血脂,腫瘤指標等抽血化驗檢查,頸、胸、上腹部的平掃和增強CT、上消化道造影、普通電子胃鏡或超聲胃鏡、心電圖、肺功能、超聲心動圖等。術前主要合并癥包括原發性高血壓、冠心病、糖尿病、中重度及以上呼吸功能障礙。
1.3 手術方式
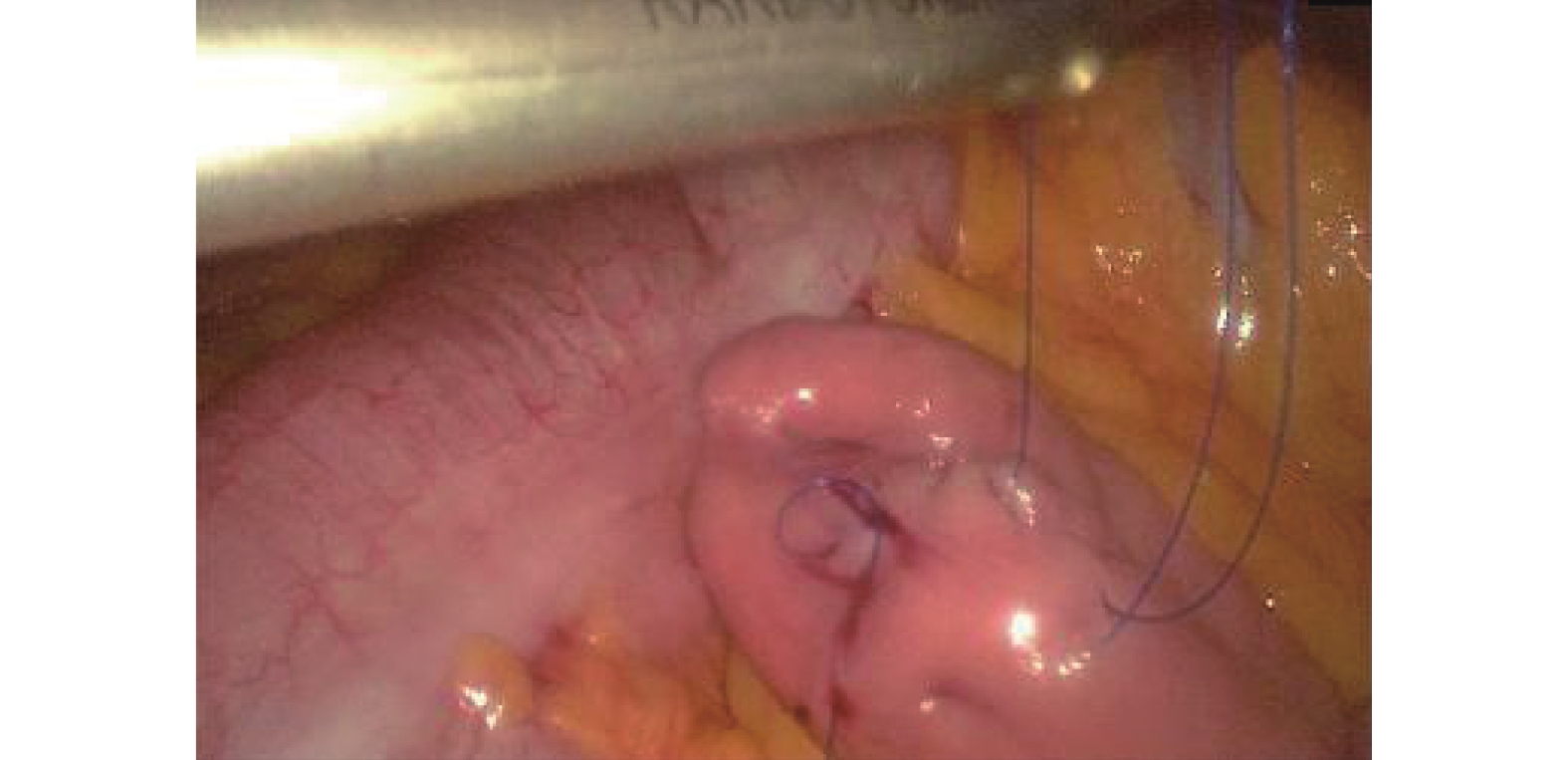
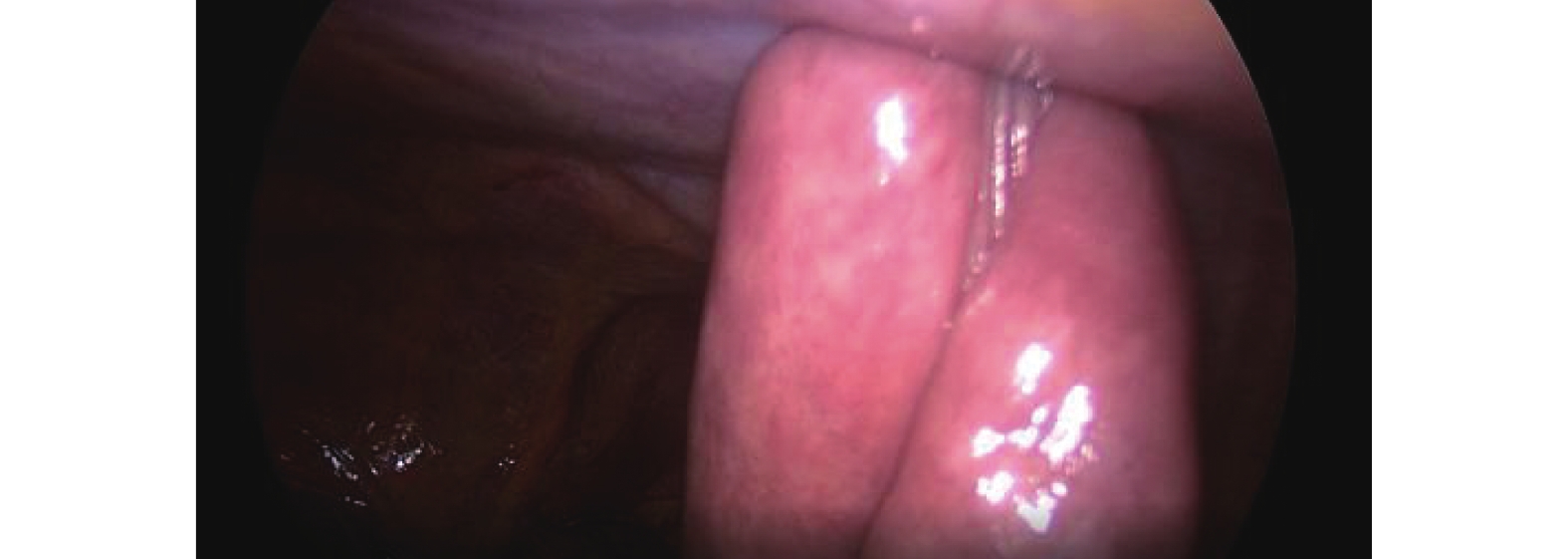
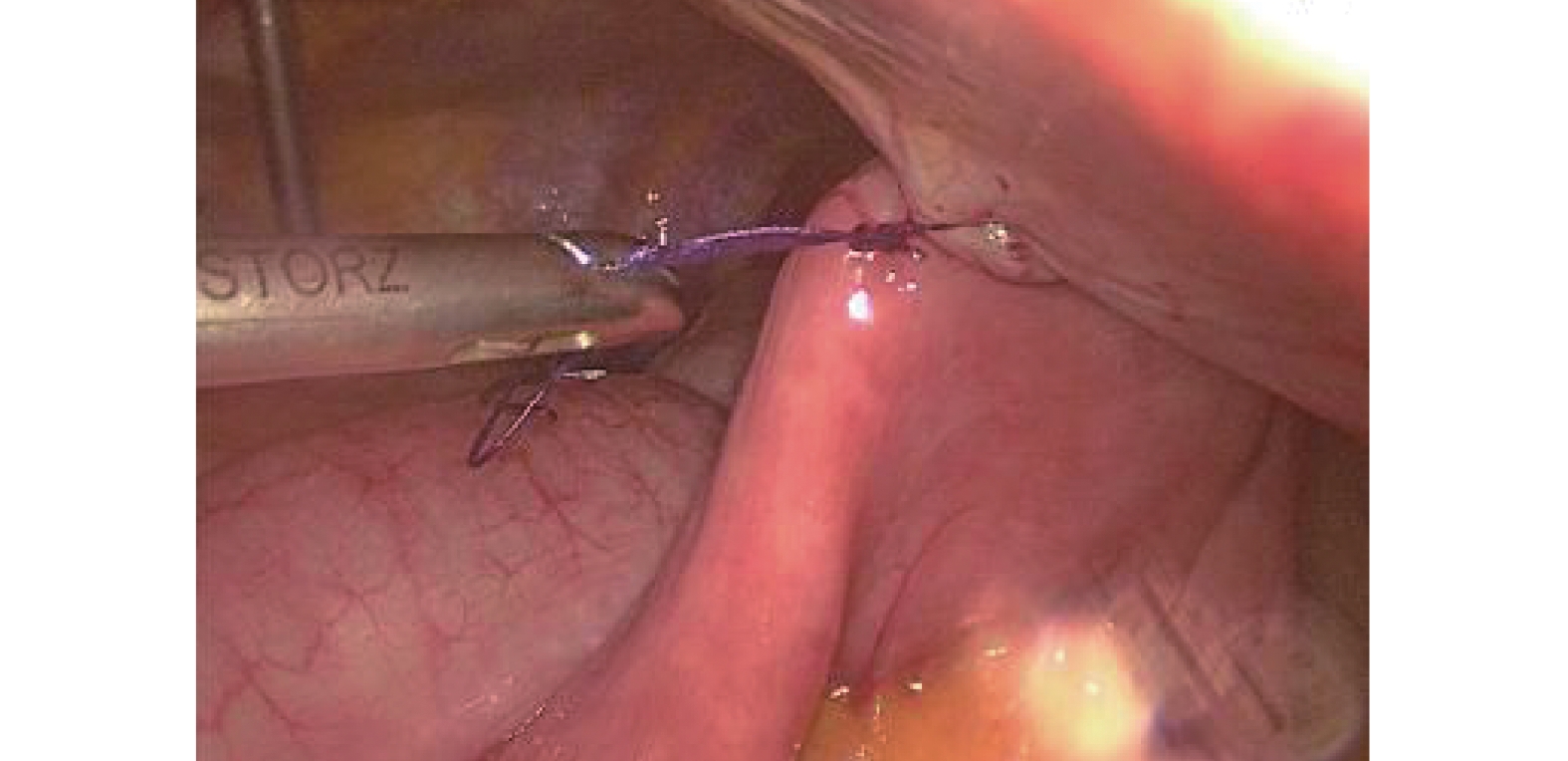
氣管插管全身麻醉,可采用雙腔氣管插管或者氣管阻塞器。(1)操作孔:腹部5孔法,置入10 mm Trocar于臍孔左下2 cm,此處為觀察孔,置入5 mm Trocar于右側鎖骨中線肋緣下1 cm,此處為主刀輔助操作孔,置入12 mm Trocar于輔助操作孔與觀察孔連線中點偏外側2 cm,此處為主操作孔;置入5 mm Trocar于劍突下,此處為輔助操作孔(通過器械牽拉肝臟以利于暴露術野);置入5 mm Trocar于左側鎖骨中線肋緣下3~4 cm,此處為助手操作孔(通過該孔置入空腸造瘺管行腹腔鏡下空腸造瘺)。(2)游離胃:首先用超聲刀切開小網膜囊,充分暴露術野,仔細分離清除胃左動靜脈根部淋巴脂肪組織,然后在胃左動脈根部離斷,切開胃膈韌帶,顯露脾臟,自小彎側離斷2~3支胃短血管;然后自大彎側游離,確保胃網膜右側動靜脈弓不損傷的前提下,離斷胃結腸韌帶、脾胃韌帶,與小彎側游離層次溝通;再游離賁門及食管下段5~8 cm。(3)腹腔鏡下管狀胃制作:保留2~3支胃右血管及分支,游離胃滿意后,用小Hem-o-lock或超聲刀夾閉胃右動脈主干,自主操作孔內置入60 mm Flex切割閉合器,根據胃壁組織厚度,使用ECR60B或者ECR60D釘倉4~5枚制作管狀胃,管狀胃寬度4~5 cm。(4)空腸造瘺:A組采用腹腔鏡下行空腸造瘺(“C+I”形式,圖1)[9]:用3/0 Prolene線在Treiz韌帶遠端下約20~25 cm空腸對系膜緣全層縫1圈荷包線(C)及1根牽引線(I),超聲刀在荷包中央戮孔,插入空腸營養管,邊插入邊用注射器打水,直至30~35 cm深度后,將牽引線及荷包縫線收緊從左側Trocar孔內引出,讓空腸造瘺口緊貼腹壁,腸管上“C+I”縫線與皮膚縫合線結扎并固定空腸造瘺管(圖2)。B組在A組縫合的基礎上,用3-0可吸收長編織線在距離空腸造瘺口近端或者遠端1~2 cm處,將空腸對系膜緣漿肌層與腹壁縫合固定1~2針,用胸腔鏡長器械經主操作孔打結固定,讓空腸造瘺口周圍腸管與腹壁“簾狀”(圖3)固定長約3~4 cm。
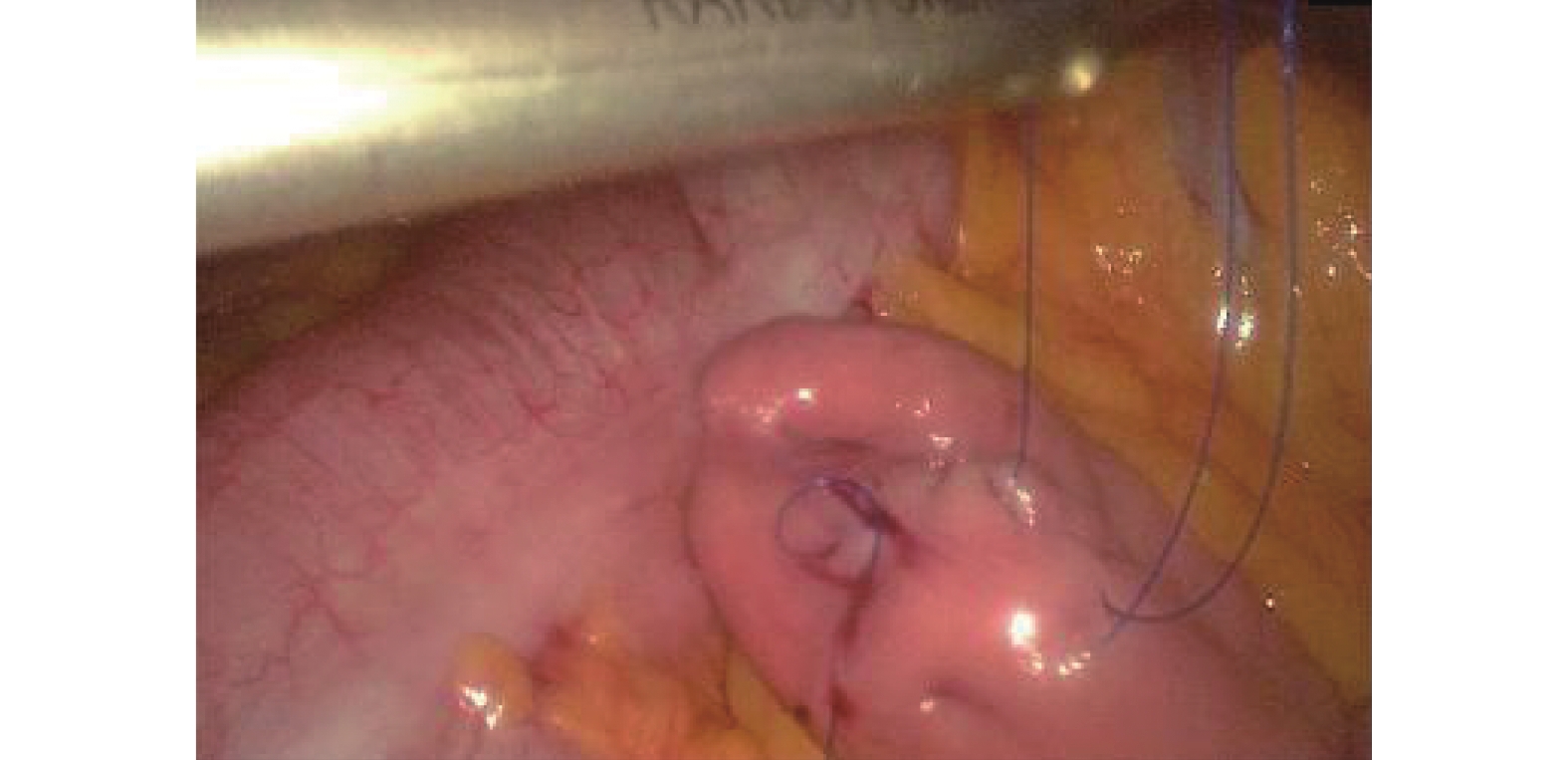 圖1
“C+I”形式縫合
圖1
“C+I”形式縫合
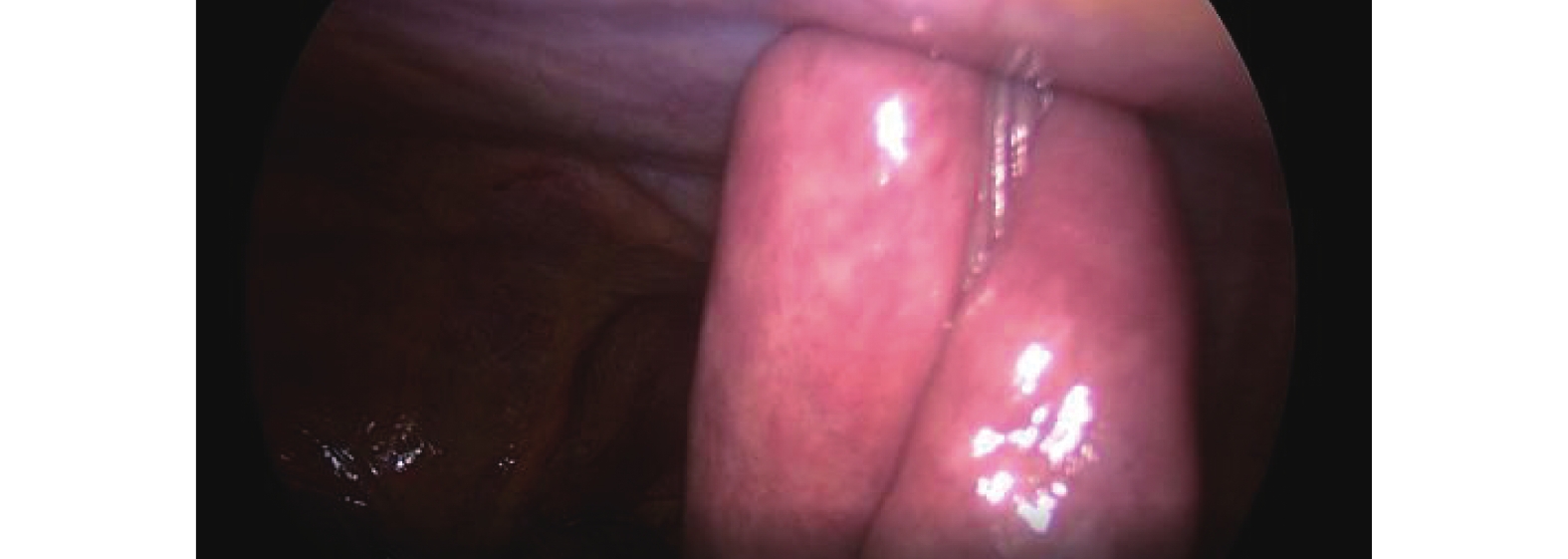 圖2
“C+I”固定(A組)
圖2
“C+I”固定(A組)
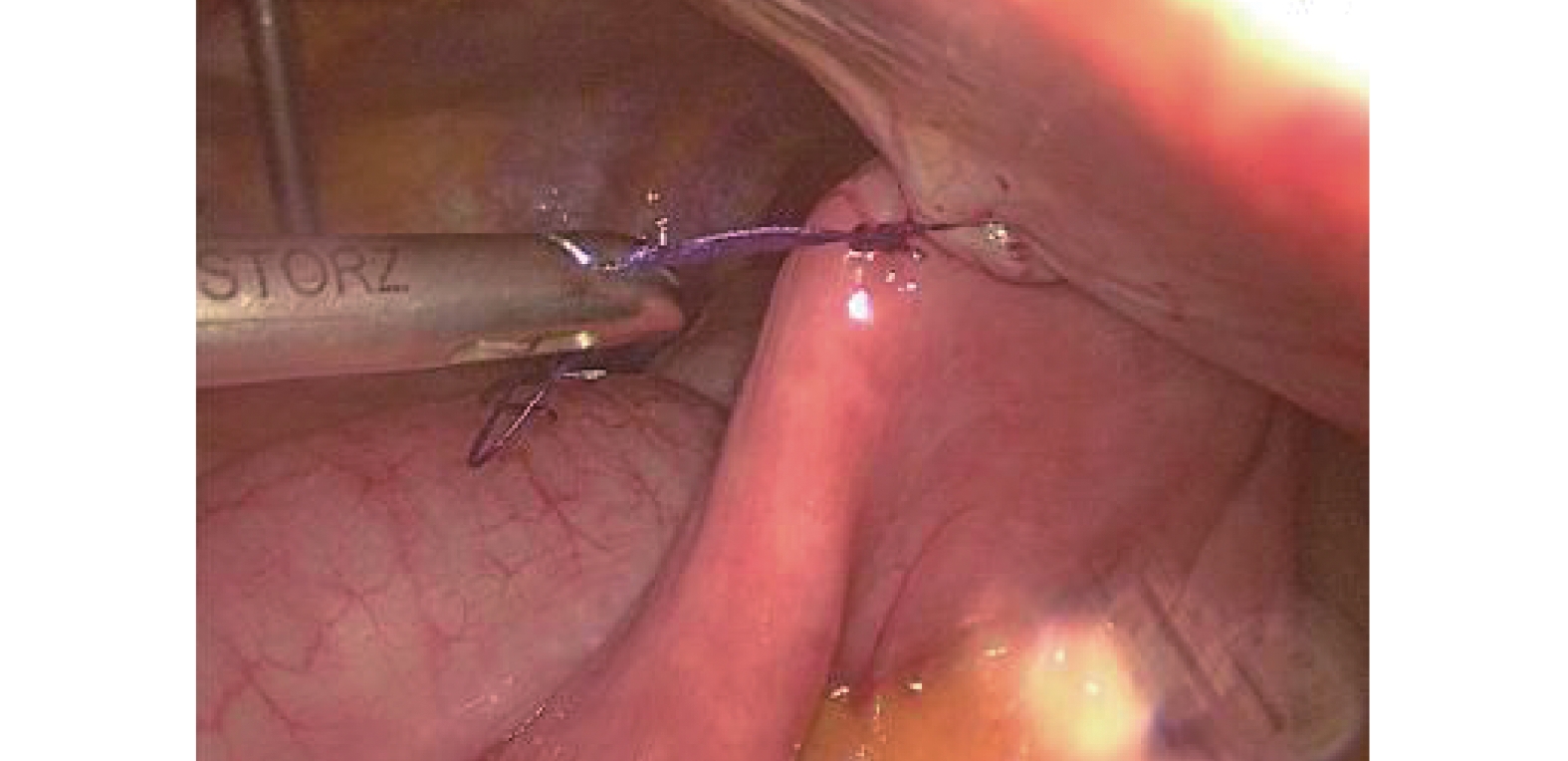 圖3
改良“簾狀”固定(B組)
圖3
改良“簾狀”固定(B組)
胸部操作采用三孔法,游離胸段食管同時清掃食管旁、隆突下及左、右喉返神經旁淋巴結,在腫瘤上方約5 cm的正常食管上,使用7號絲線手工荷包縫合,經主操作孔置入管狀吻合器釘砧后雙重結扎,錯層剪除荷包縫合處遠端食管。將游離的食管自主操作孔牽拉至切口外切除,將上提入胸腔內的管狀胃與食管用管狀吻合器完成端側吻合;腔鏡下切割縫合器閉合管胃殘端并漿肌層加縫,不常規結扎胸導管,若腫瘤較大、外侵或者術中判斷胸導管損傷可能時,在膈肌上方約6 cm處的降主動脈與奇靜脈之間大塊結扎胸導管[3, 10-12]。
1.4 觀察指標
記錄患者的年齡、性別、腫瘤位置、臨床分期、腫瘤長度、術前合并癥、手術時間、空腸造瘺手術時間、術后病理分期、術后造瘺口腸液外漏及周圍皮膚軟組織紅腫、不全性腸梗阻、閉袢式腸梗阻需要二次手術、造瘺管堵塞、意外拔管等情況。
1.5 統計學分析
采用SPSS 26.0軟件進行統計分析。滿足正態分布的計量資料以均數±標準差(x±s)表示,組間比較采用兩獨立樣本t檢驗;計數資料采用頻數及百分比(%)描述,組間比較采用四格表χ2檢驗或Fisher確切概率法。P≤0.05為差異有統計學意義。
1.6 倫理審查
本研究經安慶市立醫院倫理審查委員會批準,患者均簽署知情同意書。倫理審查批號:醫學倫審(2023)第24號。
2 結果
2.1 患者一般資料
基于納入和排除標準,共243例患者納入本研究。A組118例,其中男72例、女46例,平均年齡(64.58±6.30)歲;B組125例,其中男76例、女49例,平均年齡(65.11±6.81)歲;見表1。
2.2 觀察指標
兩組患者在年齡、性別、腫瘤位置、腫瘤長度、臨床分期、術前合并癥、術后病理分期等方面差異無統計學意義(P>0.05)。兩組患者皆順利完成手術。兩組患者均無圍手術期死亡。A、B組總手術時間分別為(192.36±27.55)min和(188.99±24.51)min(P=0.314), A、B兩組空腸造瘺時間分別為(8.26±1.84)min和(8.64±1.49)min(P=0.080)。兩組術后造瘺口腸液外漏、紅腫發生率分別為30.5%、5.6% (P<0.001),不全性腸梗阻發生率分別為8.5%、2.4%(P=0.035),出現閉袢式腸梗阻需要手術發生率分別為6.8%、0.8%(P=0.017),造瘺管堵塞發生率分別為3.4%、1.6%(P=0.435);見表2。
3 討論
食管癌本身屬于消耗性疾病,長期進食梗阻等臨床癥狀會造成每例患者住院時不同程度的營養不良。食管癌術后應激狀況下,患者處于高分解狀態,若不給予充分的營養,術后會出現吻合口及手術切口愈合不良,免疫機能會受到損害,極易引起感染從而引起各種并發癥,嚴重時危及生命,因此早期營養支持治療對于食管癌患者術后的恢復至關重要[13-14]。
空腸造瘺與鼻腸管屬于腸內營養最主要的兩種方式[15],腸內營養被公認為食管外科營養的標準方式[16-17],對食管癌患者的營養支持有重要作用,不僅有利于恢復腸道屏障功能,而且還能減少術后感染的發生率,減少住院的費用[18-19]。
鼻飼營養管作為一種傳統的腸內營養供給方式,因其操作簡便、容錯率較高、安全性能好,在食管癌術后營養支持中得到了廣泛應用。然而,鼻飼管的使用也存在一些局限性。患者在長期留置鼻飼管時可能會有鼻咽部不適、惡心嘔吐、鼻咽部黏膜破損,造成患者主動拔管幾率增加,甚至需要二次置管,對于食管手術的患者,二次置管手術風險較大,尤其是吻合口瘺的幾率增加,增加了患者的心理以及生理負擔,影響其生活質量。其次,鼻飼管的脫管率較高,在長期鼻飼過程中經常會出現鼻飼管向外移動,使得鼻飼管末端更加接近吻合口,增加了吻合口瘺的風險,這不僅增加了護理的難度,也影響了營養支持的連續性和效果以及增加術后并發癥的風險。相較于傳統的鼻飼營養管,空腸造瘺營養管在留置舒適性、穩定性及隱蔽性方面相較于鼻飼管有明顯優勢[15]。近年來,隨著臨床不斷摸索探究,空腸造瘺營養管逐漸顯示出其獨特的優勢,吻合口瘺、肺部感染等術后嚴重并發癥患者營養恢復效率方面具有顯著的優勢[20]。雖然空腸造瘺相關并發癥相對常見,但絕大多數空腸造瘺相關并發癥很容易通過簡單的措施得到糾正。加上我們對空腸造瘺進行了改良,使空腸造瘺的嚴重并發癥、再次手術率顯著降低。Koterazawa等[21]報道,年齡>75歲、新輔助治療、吻合口瘺和肺部并發癥是空腸營養管長期置入的獨立危險因素。因此,他們建議將年齡較大或術后并發癥風險較高的患者作為放置空腸營養管的選擇對象。
O'Regan 和 Scarrow在1990 年對腹腔鏡空腸造瘺進行了首次報道[22]。腔鏡下空腸造瘺術分為穿刺式空腸造瘺及荷包縫合空腸造瘺[23],穿刺術空腸造瘺需要特殊的空腸造瘺管,如德國費森尤斯卡比公生產的福瑞可空腸造口裝置(FrekaRfine needle/catheterjejunostomy)或APPLIXTM空腸細針導管穿刺造瘺裝置(fine-needle catheter jejunostomy,FCJ)等[24]。穿刺法的優點是操作較簡單,無需鏡下將腸襻縫合至腹壁及打結,易于學習與掌握。缺點是:(1)成品的空腸造口裝置價格相對普通空腸營養管要昂貴得多;(2)穿刺置入空腸營養管一般較細,容易出現堵管及脫落。林輝等[25]觀察160例食管癌手術后空腸穿刺造瘺患者,其中堵管4例,脫落2例。雙荷包縫合法空腸造瘺有可能造成空腸狹窄,造成不全性腸梗阻發生,故有作者進行了改良,在單荷包縫合對側縫合1根牽引線,也就是“C+I”模式,這種模式可以有效避免空腸的狹窄,減少術后不全腸梗阻的發生[9]。
我們早期在無腹部小切口MIE-IL食管切除+空腸造瘺手術中,空腸造瘺采用的是“C+I”模式,發現術后出現造瘺相關并發癥有一定的發生率,而改良后造瘺相關并發癥明顯減少。分析原因:(1)“C+I”的固定模式中,空腸造瘺口與腹壁接觸為一個點,腸管與腹壁點狀接觸,隨著腸管的蠕動,容易圍繞著固定點出現腸扭轉,進而出現閉袢式腸梗阻,需要二次手術。B組中,通過在造瘺口肛側或者口側增加1~2針的固定,可以在氣腹狀態下防止腸管形成局部銳角,自然狀態下,造瘺口處腸管與腹壁“簾狀”多點固定長約3~4 cm,可以有效減少腸管扭轉的發生。A組發生閉袢式腸梗阻7例,B組僅發現1例閉袢式腸梗阻需要二次開腹探查。并且開腹探查證實A組中造成閉袢式腸梗阻的主要原因就是圍繞造瘺口與腹壁固定點形成了腸扭轉,與Shiraishi等[26]報道一致。(2)A組中單純用Prolene線縫合腸壁又從Trocar孔牽拉出與皮膚縫線固定后,僅有2針縫合線將腸管與腹壁固定,縫線受力過于集中容易出現腸管與腹壁軟組織的切割,造成少量腸液外漏,甚至腐蝕腹壁出現造瘺口周圍軟組織紅腫感染,腸液的腐蝕性可能出現造瘺口周圍組織壞死甚至腸外瘺等并發癥發生,嚴重需要外接造瘺袋,增加患者痛苦和護理工作量,最終只能放棄腸內營養。B組中,在“C+I”縫合空腸造瘺的基礎上,用3-0可吸收編織線在距離“C+I”縫合近端或者遠端1~2 cm處將空腸對系膜緣與腹壁縫合固定1~2針,使造瘺口周圍空腸與腹壁“簾狀”固定長約3~4 cm,這樣有更多的縫線分擔了固定的拉力,不容易出現造瘺口處腸管及腹壁軟組織的切割,腸液外漏發生率明顯降低。A組中出現造瘺口周圍軟組織紅腫尤其是腸液外漏造成皮膚濕疹樣改變多發,較B組中發生率有顯著差異,這與楊坡等[27]所觀察到的結果一致。
我們的經驗是:(1)在腹腔鏡下用3-0 Vicryl線縫合腸管近端或者遠端皆可,根據顯露的方便以及縫合固定后空腸不能形成銳角。(2)在氣腹狀態下,將空腸與腹壁縫合后,腸管吊起打結時有一些張力,并且在視野上方,打結操作相對困難,我們用胸腔鏡下推結器經主操作孔在體外打結后推到固定點,可以保證結扎確切并節省時間。(3)目前我們使用的空腸造瘺管還是鼻腸管替代,鼻腸管長度較長,置入上段空腸30~40 cm后,還有較長的管道盤曲在腹壁外,管道越長,鼻飼阻力越大,堵管率越高,故我們正在自行研制一種管徑稍粗長度在50~60 cm的空腸造瘺管,以更加方便我們進行營養支持。
B組中僅有1例患者術后出現腸梗阻,經保守治療無效,二次腹腔探查,手術中發現在造瘺口口側漿肌層縫合腸管與腹壁過程中,漿肌層縫合腸壁跨度過大,造成腸管縮窄,并且縫合腸管對系膜緣距離空腸造瘺口的長度大于腹壁固定點與Trocar孔的長度,收緊打結后出現口側腸管皺縮,局部腸粘膜蜷縮在腸腔內造成腸梗阻。所以使造瘺口周圍空腸與腹壁“簾狀”固定,腸管自然舒展不成角是基本要求。
本研究發現在無腹部小切口MIE-IL食管切除+空腸造瘺手術中,在“C+I”空腸造瘺基礎上進行改良,在造瘺口近端或者遠端1~2 cm處將空腸對系膜緣與腹壁縫合固定1~2針,造瘺口周圍空腸與腹壁“簾狀”固定長約3~4 cm,使腸管自然舒展。可以有效減少術后不全性腸梗阻及閉袢式腸梗阻等相關并發癥,尤其是空腸造瘺口周圍皮膚濕疹、腸液外漏等發生率顯著降低。使用胸腔鏡手術機械(推結器)經過主操作孔在體外打結推入腹壁固定點結扎,手術時間和難度得以有效降低,值得推廣應用。
利益沖突:無。
作者貢獻:陳劍、劉永志、李根水負責實施研究,分析、解釋數據;王譜撰寫初稿及修訂稿件;陳劍負責研究設計及學術指導;王譜、郭昆亮、陳大慶、王嘯、王歡負責數據收集、整理及統計學分析;王譜負責數據及結果的校對;所有作者同意發表。
全腔鏡下Ivor-Lewis食管切除手術(minimally invasive esophagectomy Ivor-Lewis,MIE-IL)是中下段食管癌常采用的手術方式[1-2]。國內早期開展MIE-IL需要在上腹部做一4~5 cm切口,經該小切口將游離好的胃提出到切口外,在直視下完成管狀胃的制作,吻合完成后,術者用手指經過上腹部小切口,在手指下引置入鼻腸管[3-4]。目前,在腔鏡下完成管狀胃的制作,并同期行空腸造瘺置入營養管的MIE-IL手術越來越普及[5-6]。
我科自2017年以來開始采用無上腹部小切口MIE-IL+空腸造瘺術治療食管中下段腫瘤。早期空腸造瘺術采用“C+I”模式,即在單荷包縫合對側縫合1根牽引線。隨著手術量的逐漸增加,造瘺相關術后并發癥被逐步發現,包括不全性腸梗阻、閉袢式腸梗阻、造瘺口周圍腸液外漏、皮膚紅腫、造瘺管堵塞等。因此我們在“C+I”空腸造瘺手術模式下進行改良,臨床觀察表明,與空腸造瘺術有關的并發癥發生率有了顯著降低。故收集近幾年行空腸造瘺手術的MIE-IL食管切除患者資料,將兩種空腸造瘺模式進行臨床比較,現報道如下。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2017—2023年在我科同一治療組連續行MIE-IL食管切除手術326例食管癌患者的臨床資料。2017—2020年按照“C+I”模式行空腸上段造瘺的患者為A組。2021—2023年在“C+I”空腸造瘺基礎上,于造瘺口肛側或者口側10~20 mm處,用3-0可吸收線在空腸對系膜緣將空腸與腹壁固定1~2針,將上段空腸與腹壁固定成“簾狀”的患者為B組。
納入標準:(1)腫瘤位于食管中下段,在全胸腔鏡下完成Ivor-Lewis食管切除+空腸造瘺手術;(2)術前行頸胸腹平掃和增強CT掃描證實腫瘤無明顯外侵及遠處轉移,鎖骨上及頸部無明顯腫大淋巴結;(3)根據國際抗癌聯盟(Union for International Cancer Control,UICC)及美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第8版食管癌TNM分期標準[7],術前綜合評估為0~Ⅲ期可手術切除的患者或者接受新輔助治療后降期能手術者[8]。
排除標準:(1)通過劍突下小切口來制作管狀胃;(2)有腹部手術史;(3)鼻腸管放置患者;(4)病例資料不完整。
1.2 術前檢查
治療前檢查包括:術前血、大小便常規檢查,肝功能,腎功能,血糖,血脂,腫瘤指標等抽血化驗檢查,頸、胸、上腹部的平掃和增強CT、上消化道造影、普通電子胃鏡或超聲胃鏡、心電圖、肺功能、超聲心動圖等。術前主要合并癥包括原發性高血壓、冠心病、糖尿病、中重度及以上呼吸功能障礙。
1.3 手術方式
氣管插管全身麻醉,可采用雙腔氣管插管或者氣管阻塞器。(1)操作孔:腹部5孔法,置入10 mm Trocar于臍孔左下2 cm,此處為觀察孔,置入5 mm Trocar于右側鎖骨中線肋緣下1 cm,此處為主刀輔助操作孔,置入12 mm Trocar于輔助操作孔與觀察孔連線中點偏外側2 cm,此處為主操作孔;置入5 mm Trocar于劍突下,此處為輔助操作孔(通過器械牽拉肝臟以利于暴露術野);置入5 mm Trocar于左側鎖骨中線肋緣下3~4 cm,此處為助手操作孔(通過該孔置入空腸造瘺管行腹腔鏡下空腸造瘺)。(2)游離胃:首先用超聲刀切開小網膜囊,充分暴露術野,仔細分離清除胃左動靜脈根部淋巴脂肪組織,然后在胃左動脈根部離斷,切開胃膈韌帶,顯露脾臟,自小彎側離斷2~3支胃短血管;然后自大彎側游離,確保胃網膜右側動靜脈弓不損傷的前提下,離斷胃結腸韌帶、脾胃韌帶,與小彎側游離層次溝通;再游離賁門及食管下段5~8 cm。(3)腹腔鏡下管狀胃制作:保留2~3支胃右血管及分支,游離胃滿意后,用小Hem-o-lock或超聲刀夾閉胃右動脈主干,自主操作孔內置入60 mm Flex切割閉合器,根據胃壁組織厚度,使用ECR60B或者ECR60D釘倉4~5枚制作管狀胃,管狀胃寬度4~5 cm。(4)空腸造瘺:A組采用腹腔鏡下行空腸造瘺(“C+I”形式,圖1)[9]:用3/0 Prolene線在Treiz韌帶遠端下約20~25 cm空腸對系膜緣全層縫1圈荷包線(C)及1根牽引線(I),超聲刀在荷包中央戮孔,插入空腸營養管,邊插入邊用注射器打水,直至30~35 cm深度后,將牽引線及荷包縫線收緊從左側Trocar孔內引出,讓空腸造瘺口緊貼腹壁,腸管上“C+I”縫線與皮膚縫合線結扎并固定空腸造瘺管(圖2)。B組在A組縫合的基礎上,用3-0可吸收長編織線在距離空腸造瘺口近端或者遠端1~2 cm處,將空腸對系膜緣漿肌層與腹壁縫合固定1~2針,用胸腔鏡長器械經主操作孔打結固定,讓空腸造瘺口周圍腸管與腹壁“簾狀”(圖3)固定長約3~4 cm。
 圖1
“C+I”形式縫合
圖1
“C+I”形式縫合
 圖2
“C+I”固定(A組)
圖2
“C+I”固定(A組)
 圖3
改良“簾狀”固定(B組)
圖3
改良“簾狀”固定(B組)
胸部操作采用三孔法,游離胸段食管同時清掃食管旁、隆突下及左、右喉返神經旁淋巴結,在腫瘤上方約5 cm的正常食管上,使用7號絲線手工荷包縫合,經主操作孔置入管狀吻合器釘砧后雙重結扎,錯層剪除荷包縫合處遠端食管。將游離的食管自主操作孔牽拉至切口外切除,將上提入胸腔內的管狀胃與食管用管狀吻合器完成端側吻合;腔鏡下切割縫合器閉合管胃殘端并漿肌層加縫,不常規結扎胸導管,若腫瘤較大、外侵或者術中判斷胸導管損傷可能時,在膈肌上方約6 cm處的降主動脈與奇靜脈之間大塊結扎胸導管[3, 10-12]。
1.4 觀察指標
記錄患者的年齡、性別、腫瘤位置、臨床分期、腫瘤長度、術前合并癥、手術時間、空腸造瘺手術時間、術后病理分期、術后造瘺口腸液外漏及周圍皮膚軟組織紅腫、不全性腸梗阻、閉袢式腸梗阻需要二次手術、造瘺管堵塞、意外拔管等情況。
1.5 統計學分析
采用SPSS 26.0軟件進行統計分析。滿足正態分布的計量資料以均數±標準差(x±s)表示,組間比較采用兩獨立樣本t檢驗;計數資料采用頻數及百分比(%)描述,組間比較采用四格表χ2檢驗或Fisher確切概率法。P≤0.05為差異有統計學意義。
1.6 倫理審查
本研究經安慶市立醫院倫理審查委員會批準,患者均簽署知情同意書。倫理審查批號:醫學倫審(2023)第24號。
2 結果
2.1 患者一般資料
基于納入和排除標準,共243例患者納入本研究。A組118例,其中男72例、女46例,平均年齡(64.58±6.30)歲;B組125例,其中男76例、女49例,平均年齡(65.11±6.81)歲;見表1。
2.2 觀察指標
兩組患者在年齡、性別、腫瘤位置、腫瘤長度、臨床分期、術前合并癥、術后病理分期等方面差異無統計學意義(P>0.05)。兩組患者皆順利完成手術。兩組患者均無圍手術期死亡。A、B組總手術時間分別為(192.36±27.55)min和(188.99±24.51)min(P=0.314), A、B兩組空腸造瘺時間分別為(8.26±1.84)min和(8.64±1.49)min(P=0.080)。兩組術后造瘺口腸液外漏、紅腫發生率分別為30.5%、5.6% (P<0.001),不全性腸梗阻發生率分別為8.5%、2.4%(P=0.035),出現閉袢式腸梗阻需要手術發生率分別為6.8%、0.8%(P=0.017),造瘺管堵塞發生率分別為3.4%、1.6%(P=0.435);見表2。
3 討論
食管癌本身屬于消耗性疾病,長期進食梗阻等臨床癥狀會造成每例患者住院時不同程度的營養不良。食管癌術后應激狀況下,患者處于高分解狀態,若不給予充分的營養,術后會出現吻合口及手術切口愈合不良,免疫機能會受到損害,極易引起感染從而引起各種并發癥,嚴重時危及生命,因此早期營養支持治療對于食管癌患者術后的恢復至關重要[13-14]。
空腸造瘺與鼻腸管屬于腸內營養最主要的兩種方式[15],腸內營養被公認為食管外科營養的標準方式[16-17],對食管癌患者的營養支持有重要作用,不僅有利于恢復腸道屏障功能,而且還能減少術后感染的發生率,減少住院的費用[18-19]。
鼻飼營養管作為一種傳統的腸內營養供給方式,因其操作簡便、容錯率較高、安全性能好,在食管癌術后營養支持中得到了廣泛應用。然而,鼻飼管的使用也存在一些局限性。患者在長期留置鼻飼管時可能會有鼻咽部不適、惡心嘔吐、鼻咽部黏膜破損,造成患者主動拔管幾率增加,甚至需要二次置管,對于食管手術的患者,二次置管手術風險較大,尤其是吻合口瘺的幾率增加,增加了患者的心理以及生理負擔,影響其生活質量。其次,鼻飼管的脫管率較高,在長期鼻飼過程中經常會出現鼻飼管向外移動,使得鼻飼管末端更加接近吻合口,增加了吻合口瘺的風險,這不僅增加了護理的難度,也影響了營養支持的連續性和效果以及增加術后并發癥的風險。相較于傳統的鼻飼營養管,空腸造瘺營養管在留置舒適性、穩定性及隱蔽性方面相較于鼻飼管有明顯優勢[15]。近年來,隨著臨床不斷摸索探究,空腸造瘺營養管逐漸顯示出其獨特的優勢,吻合口瘺、肺部感染等術后嚴重并發癥患者營養恢復效率方面具有顯著的優勢[20]。雖然空腸造瘺相關并發癥相對常見,但絕大多數空腸造瘺相關并發癥很容易通過簡單的措施得到糾正。加上我們對空腸造瘺進行了改良,使空腸造瘺的嚴重并發癥、再次手術率顯著降低。Koterazawa等[21]報道,年齡>75歲、新輔助治療、吻合口瘺和肺部并發癥是空腸營養管長期置入的獨立危險因素。因此,他們建議將年齡較大或術后并發癥風險較高的患者作為放置空腸營養管的選擇對象。
O'Regan 和 Scarrow在1990 年對腹腔鏡空腸造瘺進行了首次報道[22]。腔鏡下空腸造瘺術分為穿刺式空腸造瘺及荷包縫合空腸造瘺[23],穿刺術空腸造瘺需要特殊的空腸造瘺管,如德國費森尤斯卡比公生產的福瑞可空腸造口裝置(FrekaRfine needle/catheterjejunostomy)或APPLIXTM空腸細針導管穿刺造瘺裝置(fine-needle catheter jejunostomy,FCJ)等[24]。穿刺法的優點是操作較簡單,無需鏡下將腸襻縫合至腹壁及打結,易于學習與掌握。缺點是:(1)成品的空腸造口裝置價格相對普通空腸營養管要昂貴得多;(2)穿刺置入空腸營養管一般較細,容易出現堵管及脫落。林輝等[25]觀察160例食管癌手術后空腸穿刺造瘺患者,其中堵管4例,脫落2例。雙荷包縫合法空腸造瘺有可能造成空腸狹窄,造成不全性腸梗阻發生,故有作者進行了改良,在單荷包縫合對側縫合1根牽引線,也就是“C+I”模式,這種模式可以有效避免空腸的狹窄,減少術后不全腸梗阻的發生[9]。
我們早期在無腹部小切口MIE-IL食管切除+空腸造瘺手術中,空腸造瘺采用的是“C+I”模式,發現術后出現造瘺相關并發癥有一定的發生率,而改良后造瘺相關并發癥明顯減少。分析原因:(1)“C+I”的固定模式中,空腸造瘺口與腹壁接觸為一個點,腸管與腹壁點狀接觸,隨著腸管的蠕動,容易圍繞著固定點出現腸扭轉,進而出現閉袢式腸梗阻,需要二次手術。B組中,通過在造瘺口肛側或者口側增加1~2針的固定,可以在氣腹狀態下防止腸管形成局部銳角,自然狀態下,造瘺口處腸管與腹壁“簾狀”多點固定長約3~4 cm,可以有效減少腸管扭轉的發生。A組發生閉袢式腸梗阻7例,B組僅發現1例閉袢式腸梗阻需要二次開腹探查。并且開腹探查證實A組中造成閉袢式腸梗阻的主要原因就是圍繞造瘺口與腹壁固定點形成了腸扭轉,與Shiraishi等[26]報道一致。(2)A組中單純用Prolene線縫合腸壁又從Trocar孔牽拉出與皮膚縫線固定后,僅有2針縫合線將腸管與腹壁固定,縫線受力過于集中容易出現腸管與腹壁軟組織的切割,造成少量腸液外漏,甚至腐蝕腹壁出現造瘺口周圍軟組織紅腫感染,腸液的腐蝕性可能出現造瘺口周圍組織壞死甚至腸外瘺等并發癥發生,嚴重需要外接造瘺袋,增加患者痛苦和護理工作量,最終只能放棄腸內營養。B組中,在“C+I”縫合空腸造瘺的基礎上,用3-0可吸收編織線在距離“C+I”縫合近端或者遠端1~2 cm處將空腸對系膜緣與腹壁縫合固定1~2針,使造瘺口周圍空腸與腹壁“簾狀”固定長約3~4 cm,這樣有更多的縫線分擔了固定的拉力,不容易出現造瘺口處腸管及腹壁軟組織的切割,腸液外漏發生率明顯降低。A組中出現造瘺口周圍軟組織紅腫尤其是腸液外漏造成皮膚濕疹樣改變多發,較B組中發生率有顯著差異,這與楊坡等[27]所觀察到的結果一致。
我們的經驗是:(1)在腹腔鏡下用3-0 Vicryl線縫合腸管近端或者遠端皆可,根據顯露的方便以及縫合固定后空腸不能形成銳角。(2)在氣腹狀態下,將空腸與腹壁縫合后,腸管吊起打結時有一些張力,并且在視野上方,打結操作相對困難,我們用胸腔鏡下推結器經主操作孔在體外打結后推到固定點,可以保證結扎確切并節省時間。(3)目前我們使用的空腸造瘺管還是鼻腸管替代,鼻腸管長度較長,置入上段空腸30~40 cm后,還有較長的管道盤曲在腹壁外,管道越長,鼻飼阻力越大,堵管率越高,故我們正在自行研制一種管徑稍粗長度在50~60 cm的空腸造瘺管,以更加方便我們進行營養支持。
B組中僅有1例患者術后出現腸梗阻,經保守治療無效,二次腹腔探查,手術中發現在造瘺口口側漿肌層縫合腸管與腹壁過程中,漿肌層縫合腸壁跨度過大,造成腸管縮窄,并且縫合腸管對系膜緣距離空腸造瘺口的長度大于腹壁固定點與Trocar孔的長度,收緊打結后出現口側腸管皺縮,局部腸粘膜蜷縮在腸腔內造成腸梗阻。所以使造瘺口周圍空腸與腹壁“簾狀”固定,腸管自然舒展不成角是基本要求。
本研究發現在無腹部小切口MIE-IL食管切除+空腸造瘺手術中,在“C+I”空腸造瘺基礎上進行改良,在造瘺口近端或者遠端1~2 cm處將空腸對系膜緣與腹壁縫合固定1~2針,造瘺口周圍空腸與腹壁“簾狀”固定長約3~4 cm,使腸管自然舒展。可以有效減少術后不全性腸梗阻及閉袢式腸梗阻等相關并發癥,尤其是空腸造瘺口周圍皮膚濕疹、腸液外漏等發生率顯著降低。使用胸腔鏡手術機械(推結器)經過主操作孔在體外打結推入腹壁固定點結扎,手術時間和難度得以有效降低,值得推廣應用。
利益沖突:無。
作者貢獻:陳劍、劉永志、李根水負責實施研究,分析、解釋數據;王譜撰寫初稿及修訂稿件;陳劍負責研究設計及學術指導;王譜、郭昆亮、陳大慶、王嘯、王歡負責數據收集、整理及統計學分析;王譜負責數據及結果的校對;所有作者同意發表。