迄今為止,肺移植(lung transplantation,LTx)仍是治療終末期肺疾病的唯一有效手段[1]。全球每年進行4 000多例LTx手術,且數量在不斷增加。盡管在手術技術、器官保存及圍術期管理等方面取得了一定進展,LTx后移植物功能和長期結局依舊落后于其他實體器官移植[2]。據國際心肺移植(International Society for Heart and Lung Transplantation,ISHLT)登記處的數據顯示,成人LTx后的中位生存期僅為6年[3]。其中,急性腎衰竭(acute renal failure,ARF)是LTx后常見的并發癥之一,發生率高達65%[4]。AKF的嚴重程度顯著影響移植物的功能和患者術后轉歸[5-6]。因此,識別和規避導致ARF的危險因素至關重要。
LTx后ARF和慢性腎臟病(chronic kidney disease,CKD)的確切發生機制尚不完全清楚,目前普遍認為是多種因素參與其中的一種復雜生理過程[7]。既往研究已經逐步揭示了ARF的多個獨立危險因素,包括體重指數(body mass index,BMI)、免疫抑制劑的使用以及機械通氣時間等[8-9]。然而,在臨床實踐中,移植科醫師面臨如何綜合考慮這些因素來預測和管理ARF的發生和進展的挑戰。
近年來,隨著統計理論和計算能力的提升,機器學習技術獲得了廣泛應用和關注[10]。特別是深度學習和自動智能等技術,已經在醫學領域展示出巨大的潛力,并得到了越來越的臨床醫師的認可[11]。其中,隨機森林(random forest,RF)作為機器學習常用的方式之一,已廣泛應用于各類疾病預測模型的構建中。RF是一種基于多個決策樹的集成模型,避免了單個決策樹可能出現的錯誤或過擬合等問題。同時,能夠較為直觀地評估各項臨床特征的重要性及高效處理多維數[12-15]。本文基于美國器官資源共享網絡(United Network for Organ Sharing,UNOS)數據庫,采用RF結合Lasso回歸的方法,旨在開發和驗證一種新的模型,用于預測LTx后ARF的風險。這一模型不僅有助于提高ARF的早期診斷和干預能力,還為優化臨床資源分配提供了重要的參考依據。
1 資料與方法
1.1 數據來源
本研究為回顧性隊列研究,數據來源于UNOS數據庫。UNOS數據庫廣泛用于移植領域的研究,涵蓋了美國所有器官移植中心的數據[16]。研究方法包括從器官獲取和移植網絡(Organ Procurement and Transplantation Network,OPTN)和UNOS下載2015—2022年接受LTx的患者相關數據。納入標準:2015—2022年期間接受單側或雙側LTx≥18歲的患者。排除標準:(1)多器官聯合移植;(2)既往有器官移植史;(3)臨床資料不全者。鑒于數據庫的局限性,本研究的臨床結局為LTx后接受透析的ARF患者。由于UNOS數據庫的公開性,我們團隊通過提交在線申請,已通過在線審查并獲得該數據庫的使用許可[17]。
1.2 研究內容
通過查閱相關文獻并分析UNOS數據集,獲取與LTx相關的臨床資料,包括受者的年齡、性別、種族、肺部術前診斷、BMI、肺分配評分(Lung Allocation Score,LAS)、吸煙史、糖尿病史、預計腎小球濾過率(estimated glomerular filtration rate,eGFR)、機械通氣史、移植前是否在重癥監護室(intensive care unit,ICU)接受治療、是否使用體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、移植前2周是否感染、Karnofsky功能狀態評分(Karnofsky Performance Status,KPS評分)等。根據KPS評分將患者功能分為3個層次:>70分、50~70分和<50分。>70分表明患者整體健康狀況較好,能夠在大部分時間內進行一些自我照顧的活動,不需要持續的全天候護理和監護。50~70分表明患者整體健康狀況有所下降,但仍能進行一些自我照顧的活動,需要一定程度的幫助和監護。<50分表明患者整體健康狀況嚴重受損,需要持續的全天候護理和監護[18-19]。
同時考慮供者的年齡、糖尿病史、高血壓史、吸煙史、BMI等因素。此外,還研究了受者在等待名單上的時間、是否進行雙側移植以及缺血時間等變量。本研究的主要結局為LTx后短期內是否需要透析的ARF。由于UNOS數據庫中僅有肌酐的具體數值,本研究采用CKD流行病學協作公式計算eGFR。
1.3 統計學分析
使用R軟件4.2.3版本(R Foundation for Statistical Computing,Vienna,Austria)進行統計學分析。計數資料采用頻數和百分比(%)描述,使用χ2 檢驗比較組間差異。對不符合正態分布的計量資料使用中位數(上下四分位數)[M(P25,P75)]進行描述,采用Mann-Whitney U檢驗比較組間差異。通過RF評估篩選的臨床特征變量的重要性,并結合Lasso回歸確定最佳的變量選擇數目,以確定建立預測模型過程中納入的變量。整體研究人群按7∶3的比例隨機分為訓練集和驗證集,利用訓練集建立Nomogram列線圖預測模型,并以驗證集進行內部驗證。評估Nomogram列線圖的性能使用一致性C-index、受試者工作特征曲線(receiver operating characteristic curve,ROC曲線)、校準曲線等方法。
2 結果
2.1 LTx的一般特征
共納入15 110例符合篩選標準的LTx患者。臨床基線資料見表1~2。受者的中位年齡為62.00[54.00,67.00]歲,其中術后發生接受透析的ARF患者1 180例,未接受透析的患者13 930例。男性受者占60.02%(n=9 069)。白裔受者比例最高,占77.68%(n=11 738),黑裔和西班牙裔受者比例相似,分別為9.62%和9.34%。術前診斷以肺纖維化為主(n=6 763,44.76%),其次為慢性阻塞性肺疾病(COPD)(n=3 104,20.54%)。受者中有糖尿病史的占19.07%(n=2 881)。術前機械通氣、移植前在ICU接受治療、接受ECMO及術前2周內發生感染的患者分別占9.02%(n=1 363)、12.89%(n=1 947)、7.60%(n=1 149)和9.27%(n=1 400)。KPS評分為50~70分和<50分的患者占比分別為51.13%和45.57%。
供者的中位年齡為33.00[24.00,46.00]歲,有吸煙史的比例為7.45%(n=3 681)。患者在手術等待名單上的中位時間為45.00[14.00,139.00]d。大多數LTx患者(n=11 373,75.27%)接受了雙肺移植。此外,透析組患者的缺血時間顯著長于未透析組(6.03 h vs. 5.28 h,P<0.001)。單因素logistic回歸分析結果顯示,兩組術前肺部診斷、eGFR、機械通氣、移植前是否在ICU接受治療、ECMO、移植前2周是否感染、KPS評分、供體年齡、患者在器官移植手術等待名單上的時間、是否雙肺移植、缺血時間差異具有統計學意義(P<0. 05)。
2.2 篩選變量
根據7∶3的比例將研究人群分為訓練集和驗證集,分別包括10 577例和4 533例。在訓練集中,進行了單因素logistic回歸分析(表3),篩選出具有顯著意義(P<0.01)的變量,包括:肺部術前診斷、eGFR、機械通氣史、移植前是否在ICU接受治療、ECMO使用、移植前2周內是否發生感染、KPS評分、是否進行雙肺移植以及缺血時間。這些變量將用于進一步的分析和建模,以探討其對LTx術后是否需要透析的影響
2.3 變量重要性分析
利用R語言中的“RandomForest”包對篩選出的9個變量進行了RF分析,以評估其重要性。通過計算剔除各變量后的模型精度平均減小值(Increase in Mean Squared Error,%IncMSE),確定各變量的重要性。%IncMSE值越大,表明該變量在影響因素中的重要性越高[20]。獲得%IncMSE后,利用R語言中的“ggplot2”包繪制變量重要性排序圖(圖1)。從大到小,變量的重要性依次為:ECMO、eGFR、雙肺移植、機械通氣、移植前在ICU住院、缺血時間、移植前2周感染、肺部診斷、KPS評分。
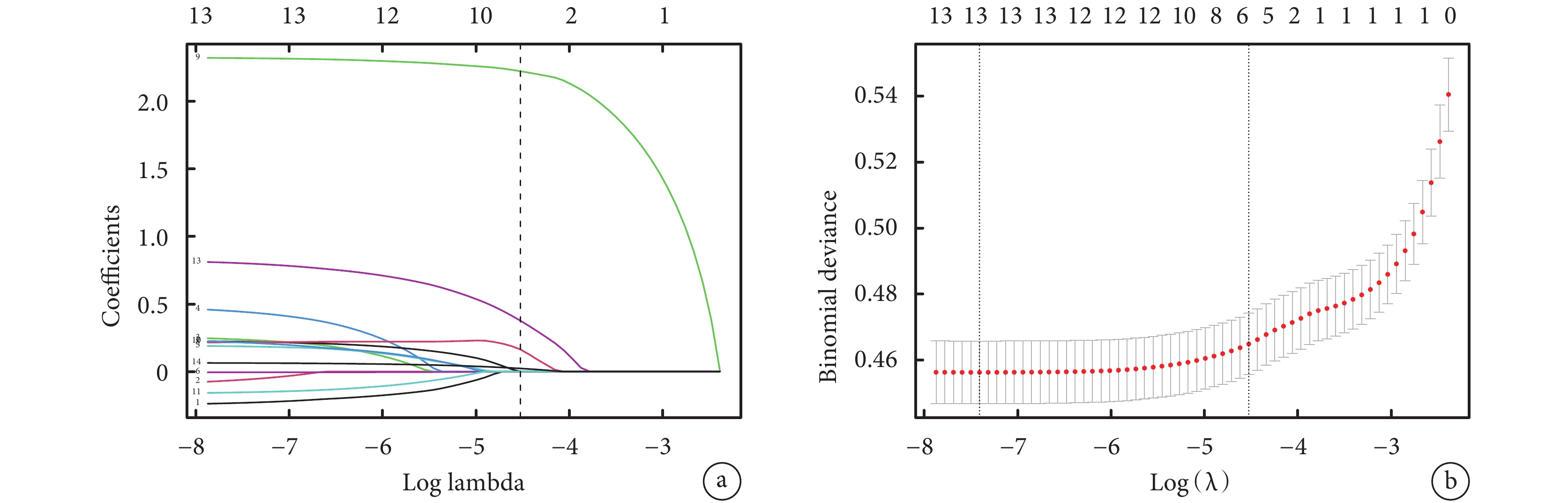 圖1
變量重要性排序
圖1
變量重要性排序
2.4 變量篩選及建模
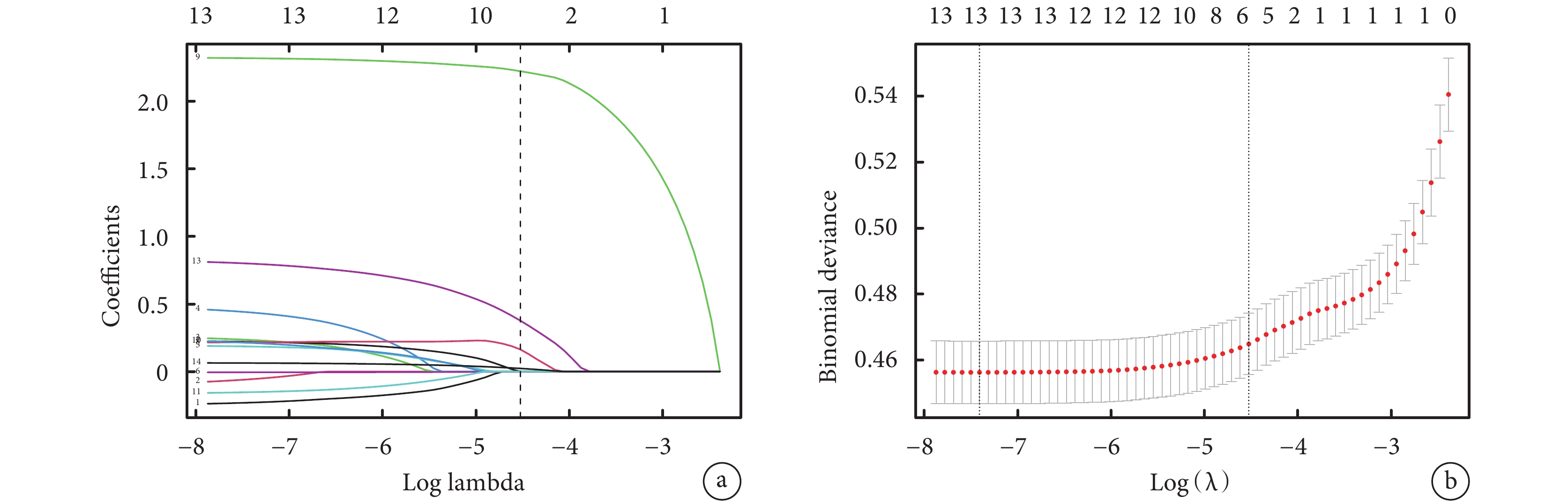
利用Lasso回歸方法對上述9個變量進行進一步篩選。根據Lasso回歸的結果(圖2),最終選擇了5個非零系數的變量,這些變量被視為對模型具有顯著貢獻。詳細的Lasso回歸系數表(表4)展示了這些被選中的5個變量及其對應的系數。因此,在建模分析中,我們最終納入了這5個變量,以探索其對于LTx后是否需要透析的影響。
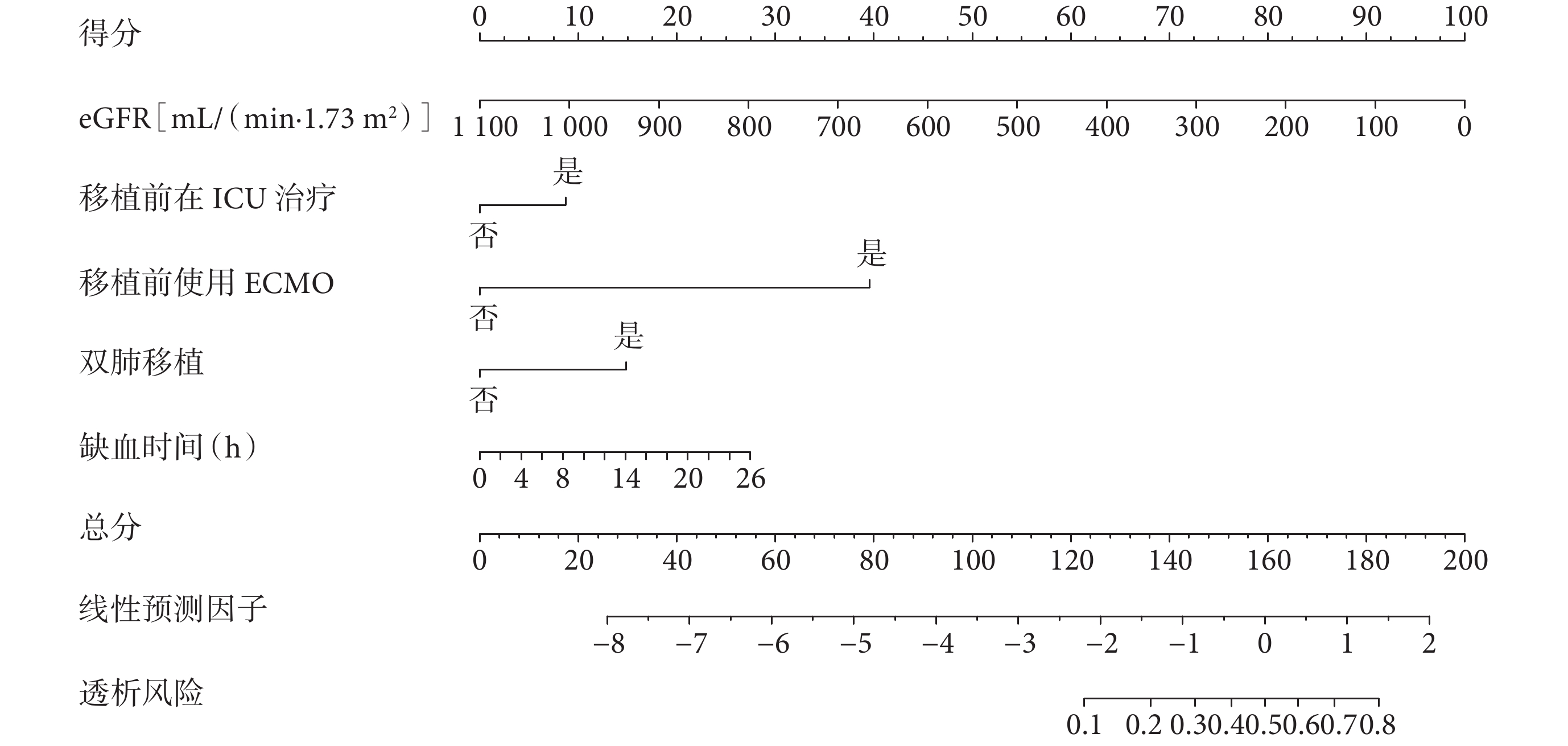 圖2
Lasso 回歸分析
圖2
Lasso 回歸分析
a:Lasso 回歸變量選擇路徑圖;b:Lasso回歸的交叉驗證圖
2.5 模型構建與驗證
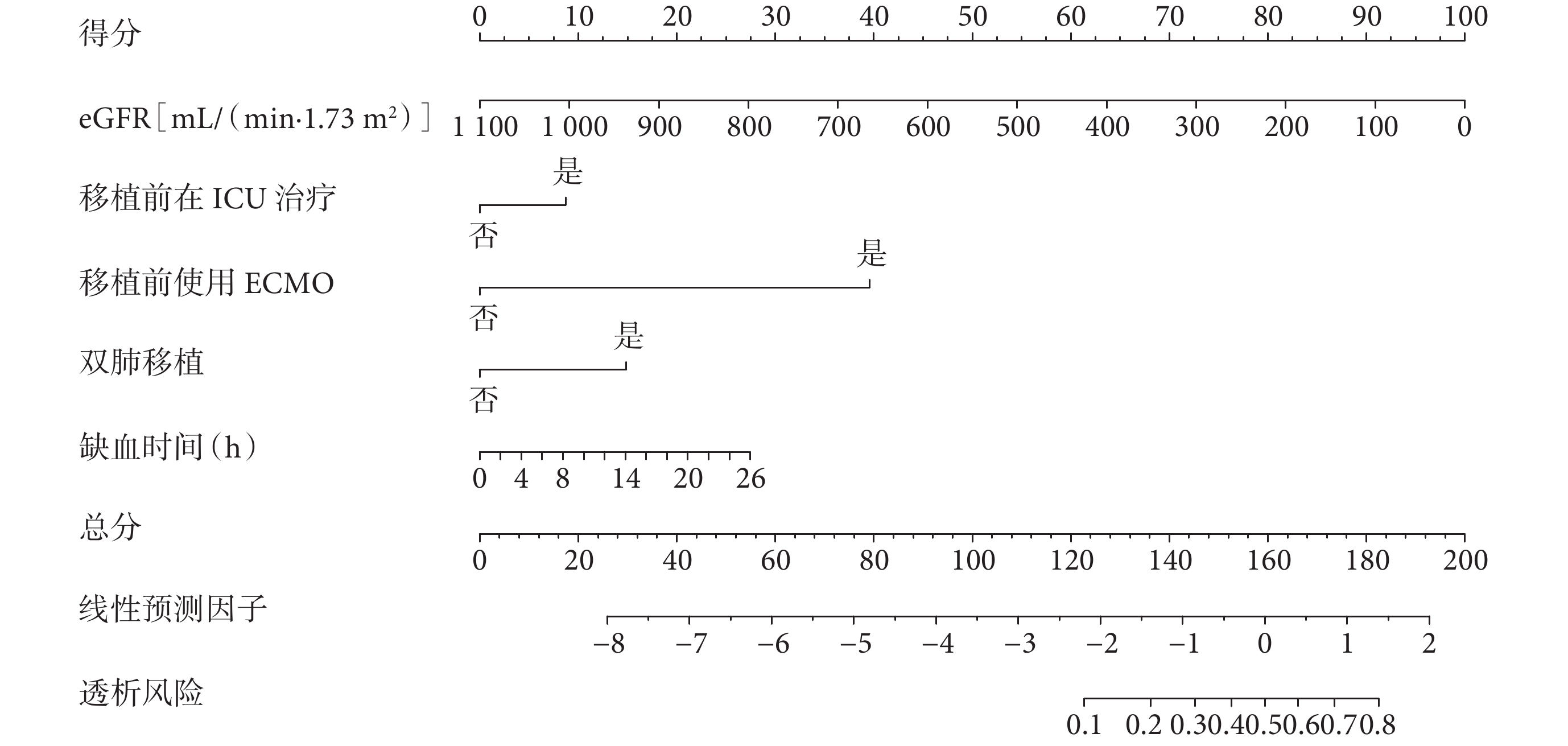
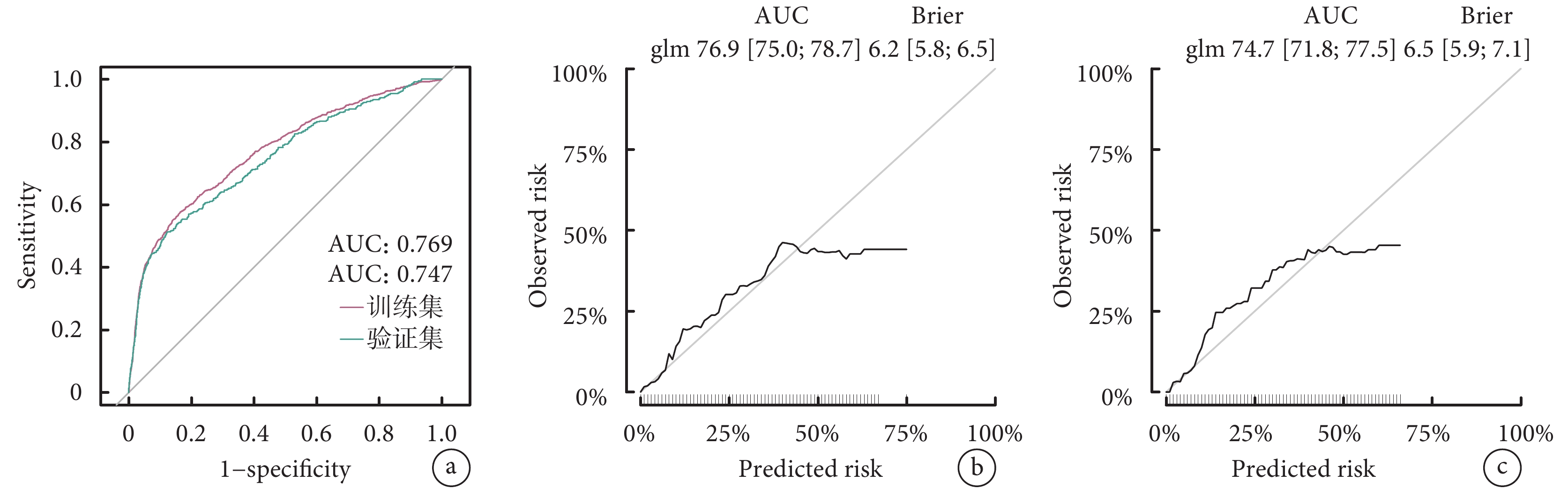
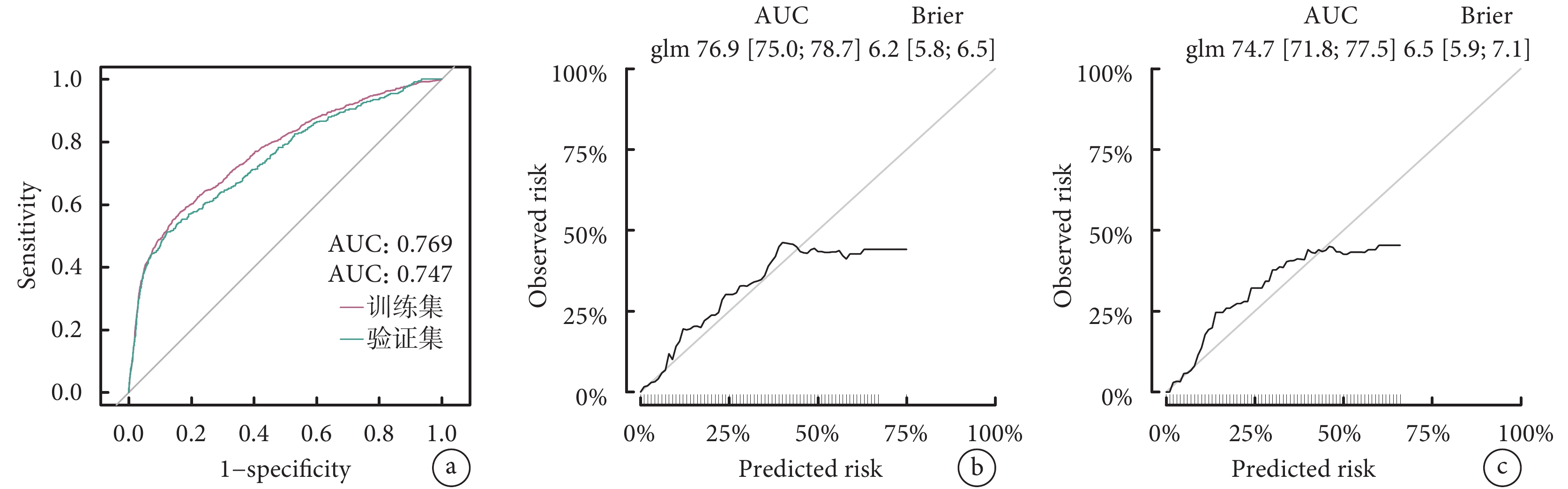
利用eGFR、移植前在ICU住院、ECMO、雙肺移植、缺血時間這6個關鍵變量構建了Nomogram預測圖(圖3)。該預測模型的C指數為0.769,表明其在預測LTx后是否需要透析方面具有較好的判別能力。進一步通過ROC曲線和校準曲線對該模型進行了評估(圖4)。結果顯示,模型表現良好,ROC曲線下面積(AUC)顯示出其較高的診斷準確性,而校準曲線表明模型的預測與實際觀察結果基本吻合。因此,該模型展現出在臨床實踐中有一定的應用潛力和價值。
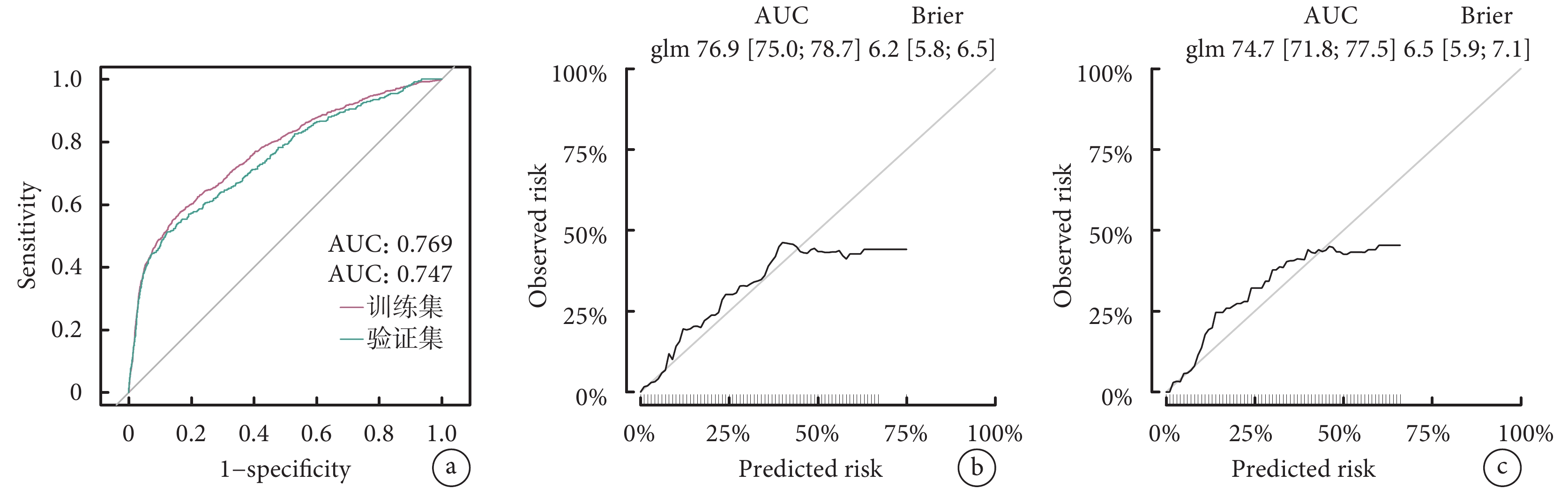 圖3
Nomogram預測模型圖
圖3
Nomogram預測模型圖
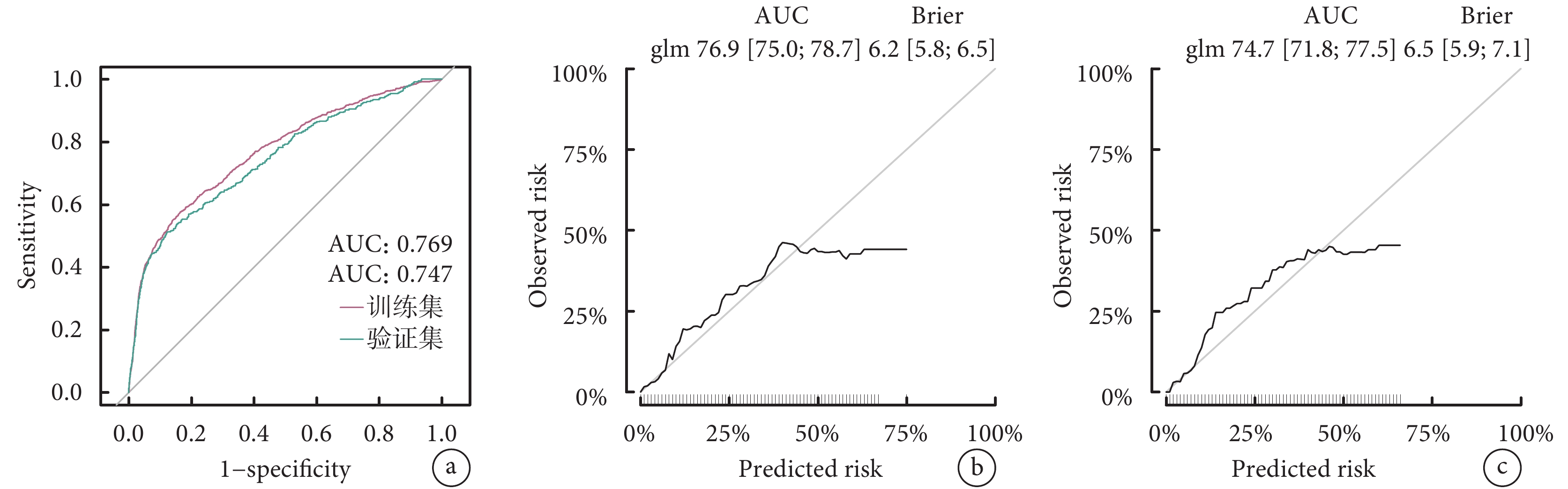 圖4
ROC曲線和校準曲線評估模型
圖4
ROC曲線和校準曲線評估模型
a:訓練集和驗證集的ROC曲線;b:訓練集校準曲線;c:驗證集校準曲線
3 討論
本研究利用RF和Lasso回歸方法對UNOS數據庫中的LTx后ARF的危險因素進行了分析,并對這些危險因素的重要性進行了排序。基于此分析結果,構建了一個包含關鍵變量的Nomogram預測模型。該模型經過評估,顯示出良好的效能和一定的臨床應用價值。此外,本研究構建的預測模型在效能上要優于已發表的類似研究[21-22]。
腎功能不全是LTx后常見的并發癥之一,通常與移植后的短期和長期死亡率密切相關[23]。國內一項單中心回顧性分析[24]顯示,LTx后的ARF發病率為45.3%,低于美國的65%,其中,術后需要接受連續性腎臟替代療法的患者占比為20.9%。盡管在LTx治療方面取得了一定進展,過去幾十年中,LTx后罹患ARF患者的預后并未顯著改善[25],既往已有相關綜述及研究[5,26]對LTx后腎功能不全進行了總結,本研究主要利用UNOS數據庫,構建了一個預測術后ARF風險的Nomogram模型,旨在為臨床醫師制定預防策略提供參考。
單因素logistic回歸顯示,肺部術前診斷、eGFR、機械通氣、移植前在ICU住院、ECMO、移植前2周感染、KPS、雙肺移植和缺血時間是影響LTx后ARF的重要危險因素。通過隨機森林方法對這些危險因素的重要性進行排序,結果依次為:ECMO、eGFR、雙肺移植、機械通氣、移植前在ICU住院、缺血時間、移植前2周感染、肺部診斷、KPS評分。
術前使用ECMO對移植受者的腎功能保護具有雙重作用,這一干預措施既可能帶來有益的腎臟保護效應,同時也存在潛在的風險。在血流動力學極不穩定的情況下,ECMO能夠有效改善全身器官灌注和氧合,從而減輕腎臟因缺血缺氧引發的急性損傷。一項回顧性研究[26]顯示,接受ECMO或體外循環的LTx成年患者并不會增加腎功能不全的風險。然而,包括ECMO啟動后的缺血-再灌注損傷、人工膜與血管接觸引起的微血管功能障礙和內皮損傷[27]及高泵速和血管內溶血也是導致腎功能不全的重要機制之一[28]。既往研究[29]顯示,基線肌酐水平較高的患者在LTx后面臨快速腎功能喪失的風險,難以耐受血流動力學變化或藥物引起的腎毒性損傷。因此,低eGFR患者在LTx后更易發生ARF。雙肺移植也增加了術后ARF的風險,這可能與手術時間延長、ECMO使用增加、出血風險高及輸血需求多等因素有關。此外,雙肺移植延長了缺血-再灌注的時間[28]。缺血時間與缺血-再灌注損傷密切相關,術后移植肺常出現透光度降低的肺水腫現象。為了應對這一情況,LTx監護醫師通常采取限制液體攝入和增加利尿劑劑量的策略。然而,血容量不足導致的腎血管收縮會加重腎灌注不足,從而導致腎損傷[30]。缺血-再灌注還會通過氧化應激、炎癥反應、細胞內鈣超載、微循環障礙、線粒體功能障礙及腎小管上皮細胞和內皮細胞損傷等機制引發腎功能不全,這些機制相互作用最終導致腎功能急性下降[31]。研究[32]表明,術前肺部診斷是LTx后腎功能不全的獨立危險因素之一。囊性纖維化(cystic fibrosis,CF)、特發性肺纖維化和結節病均已被證明是LTx后腎功能不全的預測因子。值得一提的是,KPS評分被認為是影響LTx后的ARF的危險因素,研究[33]顯示,KPS評分越高,術后發生ARF的幾率越低。KPS評分是一種衡量患者功能狀態的工具,主要用于評估患者在疾病過程中的活動能力和自理能力。考慮到高KPS評分表示患者在手術前有更好的健康狀況和較少的功能障礙,這可能是導致高KPS評分患者術后ARF發生較少的原因[34]。
本研究存在一定的局限性。首先,UNOS數據庫未提供詳細的臨床信息,例如術中ECMO轉換時間、術中輸血量及他克莫司血藥濃度等。此外,本研究納入的臨床特征有限,諸如疾病病程、體外循環時間及術中是否出現平均動脈壓<60 mm Hg(1 mm Hg=0.133 kPa)等因素均與術后腎功能急劇下降密切相關,但未被納入分析之中。其次,回顧性研究本身不可避免地存在選擇偏倚。最后,盡管UNOS數據庫中包括部分亞裔人群,但基于該數據庫構建的列線圖模型能否在中國人群中適用仍需進一步驗證,需要通過大量的現實世界臨床數據進行驗證和調整。
利益沖突:無。
作者貢獻:陳勝負責數據分析和論文撰寫;潘晨負責論文設計、審閱;張丙正負責數據分析整理;李少翔負責相關圖表繪制;矯文捷負責對文章的知識性內容作批評性審閱。
迄今為止,肺移植(lung transplantation,LTx)仍是治療終末期肺疾病的唯一有效手段[1]。全球每年進行4 000多例LTx手術,且數量在不斷增加。盡管在手術技術、器官保存及圍術期管理等方面取得了一定進展,LTx后移植物功能和長期結局依舊落后于其他實體器官移植[2]。據國際心肺移植(International Society for Heart and Lung Transplantation,ISHLT)登記處的數據顯示,成人LTx后的中位生存期僅為6年[3]。其中,急性腎衰竭(acute renal failure,ARF)是LTx后常見的并發癥之一,發生率高達65%[4]。AKF的嚴重程度顯著影響移植物的功能和患者術后轉歸[5-6]。因此,識別和規避導致ARF的危險因素至關重要。
LTx后ARF和慢性腎臟病(chronic kidney disease,CKD)的確切發生機制尚不完全清楚,目前普遍認為是多種因素參與其中的一種復雜生理過程[7]。既往研究已經逐步揭示了ARF的多個獨立危險因素,包括體重指數(body mass index,BMI)、免疫抑制劑的使用以及機械通氣時間等[8-9]。然而,在臨床實踐中,移植科醫師面臨如何綜合考慮這些因素來預測和管理ARF的發生和進展的挑戰。
近年來,隨著統計理論和計算能力的提升,機器學習技術獲得了廣泛應用和關注[10]。特別是深度學習和自動智能等技術,已經在醫學領域展示出巨大的潛力,并得到了越來越的臨床醫師的認可[11]。其中,隨機森林(random forest,RF)作為機器學習常用的方式之一,已廣泛應用于各類疾病預測模型的構建中。RF是一種基于多個決策樹的集成模型,避免了單個決策樹可能出現的錯誤或過擬合等問題。同時,能夠較為直觀地評估各項臨床特征的重要性及高效處理多維數[12-15]。本文基于美國器官資源共享網絡(United Network for Organ Sharing,UNOS)數據庫,采用RF結合Lasso回歸的方法,旨在開發和驗證一種新的模型,用于預測LTx后ARF的風險。這一模型不僅有助于提高ARF的早期診斷和干預能力,還為優化臨床資源分配提供了重要的參考依據。
1 資料與方法
1.1 數據來源
本研究為回顧性隊列研究,數據來源于UNOS數據庫。UNOS數據庫廣泛用于移植領域的研究,涵蓋了美國所有器官移植中心的數據[16]。研究方法包括從器官獲取和移植網絡(Organ Procurement and Transplantation Network,OPTN)和UNOS下載2015—2022年接受LTx的患者相關數據。納入標準:2015—2022年期間接受單側或雙側LTx≥18歲的患者。排除標準:(1)多器官聯合移植;(2)既往有器官移植史;(3)臨床資料不全者。鑒于數據庫的局限性,本研究的臨床結局為LTx后接受透析的ARF患者。由于UNOS數據庫的公開性,我們團隊通過提交在線申請,已通過在線審查并獲得該數據庫的使用許可[17]。
1.2 研究內容
通過查閱相關文獻并分析UNOS數據集,獲取與LTx相關的臨床資料,包括受者的年齡、性別、種族、肺部術前診斷、BMI、肺分配評分(Lung Allocation Score,LAS)、吸煙史、糖尿病史、預計腎小球濾過率(estimated glomerular filtration rate,eGFR)、機械通氣史、移植前是否在重癥監護室(intensive care unit,ICU)接受治療、是否使用體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、移植前2周是否感染、Karnofsky功能狀態評分(Karnofsky Performance Status,KPS評分)等。根據KPS評分將患者功能分為3個層次:>70分、50~70分和<50分。>70分表明患者整體健康狀況較好,能夠在大部分時間內進行一些自我照顧的活動,不需要持續的全天候護理和監護。50~70分表明患者整體健康狀況有所下降,但仍能進行一些自我照顧的活動,需要一定程度的幫助和監護。<50分表明患者整體健康狀況嚴重受損,需要持續的全天候護理和監護[18-19]。
同時考慮供者的年齡、糖尿病史、高血壓史、吸煙史、BMI等因素。此外,還研究了受者在等待名單上的時間、是否進行雙側移植以及缺血時間等變量。本研究的主要結局為LTx后短期內是否需要透析的ARF。由于UNOS數據庫中僅有肌酐的具體數值,本研究采用CKD流行病學協作公式計算eGFR。
1.3 統計學分析
使用R軟件4.2.3版本(R Foundation for Statistical Computing,Vienna,Austria)進行統計學分析。計數資料采用頻數和百分比(%)描述,使用χ2 檢驗比較組間差異。對不符合正態分布的計量資料使用中位數(上下四分位數)[M(P25,P75)]進行描述,采用Mann-Whitney U檢驗比較組間差異。通過RF評估篩選的臨床特征變量的重要性,并結合Lasso回歸確定最佳的變量選擇數目,以確定建立預測模型過程中納入的變量。整體研究人群按7∶3的比例隨機分為訓練集和驗證集,利用訓練集建立Nomogram列線圖預測模型,并以驗證集進行內部驗證。評估Nomogram列線圖的性能使用一致性C-index、受試者工作特征曲線(receiver operating characteristic curve,ROC曲線)、校準曲線等方法。
2 結果
2.1 LTx的一般特征
共納入15 110例符合篩選標準的LTx患者。臨床基線資料見表1~2。受者的中位年齡為62.00[54.00,67.00]歲,其中術后發生接受透析的ARF患者1 180例,未接受透析的患者13 930例。男性受者占60.02%(n=9 069)。白裔受者比例最高,占77.68%(n=11 738),黑裔和西班牙裔受者比例相似,分別為9.62%和9.34%。術前診斷以肺纖維化為主(n=6 763,44.76%),其次為慢性阻塞性肺疾病(COPD)(n=3 104,20.54%)。受者中有糖尿病史的占19.07%(n=2 881)。術前機械通氣、移植前在ICU接受治療、接受ECMO及術前2周內發生感染的患者分別占9.02%(n=1 363)、12.89%(n=1 947)、7.60%(n=1 149)和9.27%(n=1 400)。KPS評分為50~70分和<50分的患者占比分別為51.13%和45.57%。
供者的中位年齡為33.00[24.00,46.00]歲,有吸煙史的比例為7.45%(n=3 681)。患者在手術等待名單上的中位時間為45.00[14.00,139.00]d。大多數LTx患者(n=11 373,75.27%)接受了雙肺移植。此外,透析組患者的缺血時間顯著長于未透析組(6.03 h vs. 5.28 h,P<0.001)。單因素logistic回歸分析結果顯示,兩組術前肺部診斷、eGFR、機械通氣、移植前是否在ICU接受治療、ECMO、移植前2周是否感染、KPS評分、供體年齡、患者在器官移植手術等待名單上的時間、是否雙肺移植、缺血時間差異具有統計學意義(P<0. 05)。
2.2 篩選變量
根據7∶3的比例將研究人群分為訓練集和驗證集,分別包括10 577例和4 533例。在訓練集中,進行了單因素logistic回歸分析(表3),篩選出具有顯著意義(P<0.01)的變量,包括:肺部術前診斷、eGFR、機械通氣史、移植前是否在ICU接受治療、ECMO使用、移植前2周內是否發生感染、KPS評分、是否進行雙肺移植以及缺血時間。這些變量將用于進一步的分析和建模,以探討其對LTx術后是否需要透析的影響
2.3 變量重要性分析
利用R語言中的“RandomForest”包對篩選出的9個變量進行了RF分析,以評估其重要性。通過計算剔除各變量后的模型精度平均減小值(Increase in Mean Squared Error,%IncMSE),確定各變量的重要性。%IncMSE值越大,表明該變量在影響因素中的重要性越高[20]。獲得%IncMSE后,利用R語言中的“ggplot2”包繪制變量重要性排序圖(圖1)。從大到小,變量的重要性依次為:ECMO、eGFR、雙肺移植、機械通氣、移植前在ICU住院、缺血時間、移植前2周感染、肺部診斷、KPS評分。
 圖1
變量重要性排序
圖1
變量重要性排序
2.4 變量篩選及建模
利用Lasso回歸方法對上述9個變量進行進一步篩選。根據Lasso回歸的結果(圖2),最終選擇了5個非零系數的變量,這些變量被視為對模型具有顯著貢獻。詳細的Lasso回歸系數表(表4)展示了這些被選中的5個變量及其對應的系數。因此,在建模分析中,我們最終納入了這5個變量,以探索其對于LTx后是否需要透析的影響。
 圖2
Lasso 回歸分析
圖2
Lasso 回歸分析
a:Lasso 回歸變量選擇路徑圖;b:Lasso回歸的交叉驗證圖
2.5 模型構建與驗證
利用eGFR、移植前在ICU住院、ECMO、雙肺移植、缺血時間這6個關鍵變量構建了Nomogram預測圖(圖3)。該預測模型的C指數為0.769,表明其在預測LTx后是否需要透析方面具有較好的判別能力。進一步通過ROC曲線和校準曲線對該模型進行了評估(圖4)。結果顯示,模型表現良好,ROC曲線下面積(AUC)顯示出其較高的診斷準確性,而校準曲線表明模型的預測與實際觀察結果基本吻合。因此,該模型展現出在臨床實踐中有一定的應用潛力和價值。
 圖3
Nomogram預測模型圖
圖3
Nomogram預測模型圖
 圖4
ROC曲線和校準曲線評估模型
圖4
ROC曲線和校準曲線評估模型
a:訓練集和驗證集的ROC曲線;b:訓練集校準曲線;c:驗證集校準曲線
3 討論
本研究利用RF和Lasso回歸方法對UNOS數據庫中的LTx后ARF的危險因素進行了分析,并對這些危險因素的重要性進行了排序。基于此分析結果,構建了一個包含關鍵變量的Nomogram預測模型。該模型經過評估,顯示出良好的效能和一定的臨床應用價值。此外,本研究構建的預測模型在效能上要優于已發表的類似研究[21-22]。
腎功能不全是LTx后常見的并發癥之一,通常與移植后的短期和長期死亡率密切相關[23]。國內一項單中心回顧性分析[24]顯示,LTx后的ARF發病率為45.3%,低于美國的65%,其中,術后需要接受連續性腎臟替代療法的患者占比為20.9%。盡管在LTx治療方面取得了一定進展,過去幾十年中,LTx后罹患ARF患者的預后并未顯著改善[25],既往已有相關綜述及研究[5,26]對LTx后腎功能不全進行了總結,本研究主要利用UNOS數據庫,構建了一個預測術后ARF風險的Nomogram模型,旨在為臨床醫師制定預防策略提供參考。
單因素logistic回歸顯示,肺部術前診斷、eGFR、機械通氣、移植前在ICU住院、ECMO、移植前2周感染、KPS、雙肺移植和缺血時間是影響LTx后ARF的重要危險因素。通過隨機森林方法對這些危險因素的重要性進行排序,結果依次為:ECMO、eGFR、雙肺移植、機械通氣、移植前在ICU住院、缺血時間、移植前2周感染、肺部診斷、KPS評分。
術前使用ECMO對移植受者的腎功能保護具有雙重作用,這一干預措施既可能帶來有益的腎臟保護效應,同時也存在潛在的風險。在血流動力學極不穩定的情況下,ECMO能夠有效改善全身器官灌注和氧合,從而減輕腎臟因缺血缺氧引發的急性損傷。一項回顧性研究[26]顯示,接受ECMO或體外循環的LTx成年患者并不會增加腎功能不全的風險。然而,包括ECMO啟動后的缺血-再灌注損傷、人工膜與血管接觸引起的微血管功能障礙和內皮損傷[27]及高泵速和血管內溶血也是導致腎功能不全的重要機制之一[28]。既往研究[29]顯示,基線肌酐水平較高的患者在LTx后面臨快速腎功能喪失的風險,難以耐受血流動力學變化或藥物引起的腎毒性損傷。因此,低eGFR患者在LTx后更易發生ARF。雙肺移植也增加了術后ARF的風險,這可能與手術時間延長、ECMO使用增加、出血風險高及輸血需求多等因素有關。此外,雙肺移植延長了缺血-再灌注的時間[28]。缺血時間與缺血-再灌注損傷密切相關,術后移植肺常出現透光度降低的肺水腫現象。為了應對這一情況,LTx監護醫師通常采取限制液體攝入和增加利尿劑劑量的策略。然而,血容量不足導致的腎血管收縮會加重腎灌注不足,從而導致腎損傷[30]。缺血-再灌注還會通過氧化應激、炎癥反應、細胞內鈣超載、微循環障礙、線粒體功能障礙及腎小管上皮細胞和內皮細胞損傷等機制引發腎功能不全,這些機制相互作用最終導致腎功能急性下降[31]。研究[32]表明,術前肺部診斷是LTx后腎功能不全的獨立危險因素之一。囊性纖維化(cystic fibrosis,CF)、特發性肺纖維化和結節病均已被證明是LTx后腎功能不全的預測因子。值得一提的是,KPS評分被認為是影響LTx后的ARF的危險因素,研究[33]顯示,KPS評分越高,術后發生ARF的幾率越低。KPS評分是一種衡量患者功能狀態的工具,主要用于評估患者在疾病過程中的活動能力和自理能力。考慮到高KPS評分表示患者在手術前有更好的健康狀況和較少的功能障礙,這可能是導致高KPS評分患者術后ARF發生較少的原因[34]。
本研究存在一定的局限性。首先,UNOS數據庫未提供詳細的臨床信息,例如術中ECMO轉換時間、術中輸血量及他克莫司血藥濃度等。此外,本研究納入的臨床特征有限,諸如疾病病程、體外循環時間及術中是否出現平均動脈壓<60 mm Hg(1 mm Hg=0.133 kPa)等因素均與術后腎功能急劇下降密切相關,但未被納入分析之中。其次,回顧性研究本身不可避免地存在選擇偏倚。最后,盡管UNOS數據庫中包括部分亞裔人群,但基于該數據庫構建的列線圖模型能否在中國人群中適用仍需進一步驗證,需要通過大量的現實世界臨床數據進行驗證和調整。
利益沖突:無。
作者貢獻:陳勝負責數據分析和論文撰寫;潘晨負責論文設計、審閱;張丙正負責數據分析整理;李少翔負責相關圖表繪制;矯文捷負責對文章的知識性內容作批評性審閱。