主動脈瓣關閉不全,是一種以主動脈瓣不完全閉合為特征的疾病,導致血液從主動脈反流回到左心室。這種反流會影響左心室功能,并最終可能導致心力衰竭。傳統上,主動脈瓣置換術目前仍是治療該病變的最常用術式[1]。然而,瓣膜置換術后抗凝血治療相關并發癥、瓣膜損毀導致的二次手術等問題也是臨床實踐中需要考慮的重要問題。與主動脈瓣置換術相比,主動脈瓣成形術提供了保留自體瓣膜、穩定血流動力學和左心室功能恢復較快等優勢,同時降低了長期抗凝需求和再次手術的風險;這種方法對所有年齡段的患者,尤其是年輕患者,都具有顯著的優點[2-3]。在主動脈瓣關閉不全患者中,主動脈竇部擴張常作為一種伴隨情況出現[4-5]。這通常由于主動脈竇部結構改變,導致主動脈瓣環及瓣葉擴張、變形,對合高度降低,進而引發主動脈瓣關閉不全[6]。Katayama 等[7]的研究發現,在假竇模型中,缺乏竇的主動脈瓣葉承受更大應力,瓣膜開放時間更長,關閉速度更快。一些學者已針對竇部再植及成形術進行了相關研究。其中,佛羅里達袖技術(Florida sleeve technique,FST)是一種保留瓣膜的主動脈根部置換(valve-sparing aortic root replacement,VSARR)方法(圖1)。該技術由 Tomas Martin、Philip Hess 等[8]率先報道,是一種無需切除整個主動脈根壁和重建冠狀動脈(冠脈)的 VSARR 新技術。尤其是對于根部直徑<50 mm的主動脈根部擴張,而未達到David[9-10]或Yacoub[11]手術指征的患者,FST不僅能夠修復反流的主動脈瓣,同時能夠縮小主動脈瓣竇部以及主動脈瓣環直徑;此外,與傳統的VSARR相比(包括David、Yacoub等),FST不需要對冠脈開口進行再植,進而縮短手術時間以及減少冠脈開口再植的相關并發癥。近些年來,該技術在國外得到了廣泛的報道和應用,并在臨床實踐中取得了較好療效[12]。然而,在國內采用FST修復成人主動脈瓣關閉不全,尤其是合并竇部輕微擴張的報道仍較少。本研究對我院2020年8月—2024年5月接受FST的單純主動脈竇部擴張合并主動脈瓣關閉不全患者進行回顧性研究,現總結手術經驗及早期預后情況如下。
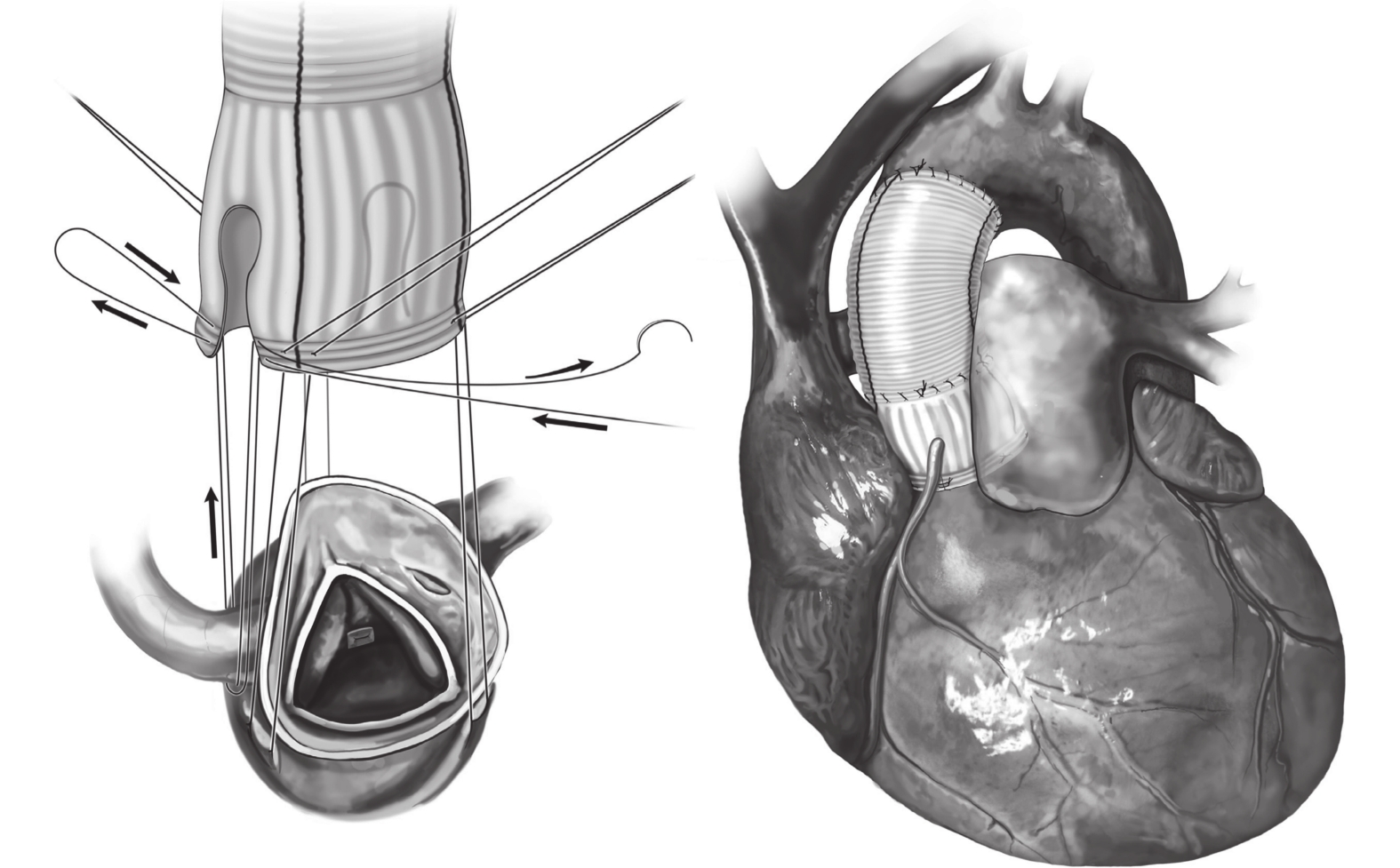
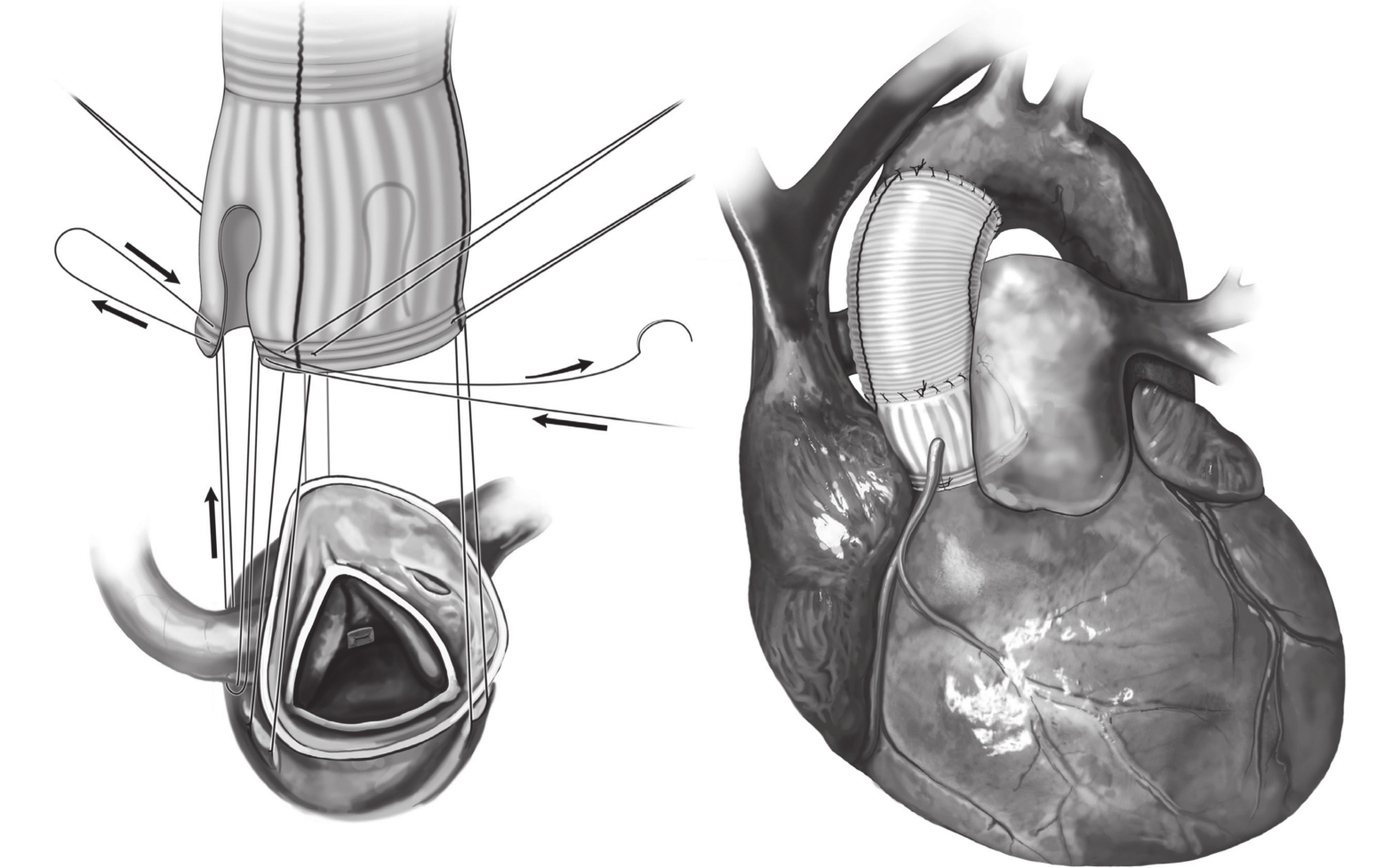 圖1
佛羅里達袖手術示意圖[13]
圖1
佛羅里達袖手術示意圖[13]
1 資料與方法
1.1 臨床資料
利用本科室臨床資料數據庫,收集2020年8月—2024年5月在南京市第一醫院接受FST治療單純竇部擴張合并主動脈瓣關閉不全患者的臨床資料。納入標準:(1)年齡>18歲;(2)正常或輕微的主動脈瓣葉異常、繼發于主動脈根部動脈瘤的Ⅰ型主動脈瓣關閉不全患者;(3)主動脈竇部擴張合并主動脈瓣二葉式畸形或其他瓣葉病變程度允許保留并修復患者。排除標準:(1)主動脈瓣嚴重受損或無功能需要主動脈瓣置換和Ⅱ型主動脈瓣關閉不全患者;(2)同期冠脈旁路移植患者;(3)伴其他瓣膜病變患者,如二尖瓣狹窄,二尖瓣關閉不全,三尖瓣關閉不全等;(4)明確其他心臟病變患者。如擴張性心肌病,肥厚性梗阻型心肌病。數據分別采集于術前、術后出院前和出院后1個月。患者術前均常規行心臟彩超、胸部CT平掃、心電圖等檢查評估主動脈瓣功能關閉不全程度及其他并存疾病。患者心肺功能均可耐受全身麻醉手術。
1.2 手術方法
全身麻醉后,取平臥位。術前置入經食管超聲心動圖(transesophageal echocardiographic,TEE)再次評估主動脈瓣功能、竇部內徑、升主動脈擴張處直徑等情況。手術均取胸骨正中切口,經升主動脈、右心房、右上肺靜脈插管建立體外循環。竇管交界上方約1 cm橫斷升主動脈。探查竇部、左右冠脈竇開口、瓣葉質地、高度。游離主動脈根部與周圍組織至主動脈瓣環水平以下1~2 mm,游離左、右冠脈。保留主動脈瓣,測量瓣葉有效高度,通過交界懸吊、瓣葉折疊等方法調整瓣葉高度一致,沿主動脈瓣功能瓣環下1 mm,間斷置線穿出至主動脈壁外側(墊片置入左室側)。根據交接高度決定人工血管直徑,并于人工血管左冠、右冠竇中點修剪成拱門形狀以利于跨過冠脈將人工血管置于主動脈瓣環外側,23#Hegar探條置入后打結均勻環縮主動脈瓣環。將主動脈殘壁與人工血管在竇管交界水平吻合。注水試驗提示主動脈瓣對合良好、無滲漏后,進一步完成升主動脈近端與升主動脈遠端吻合(圖2)。
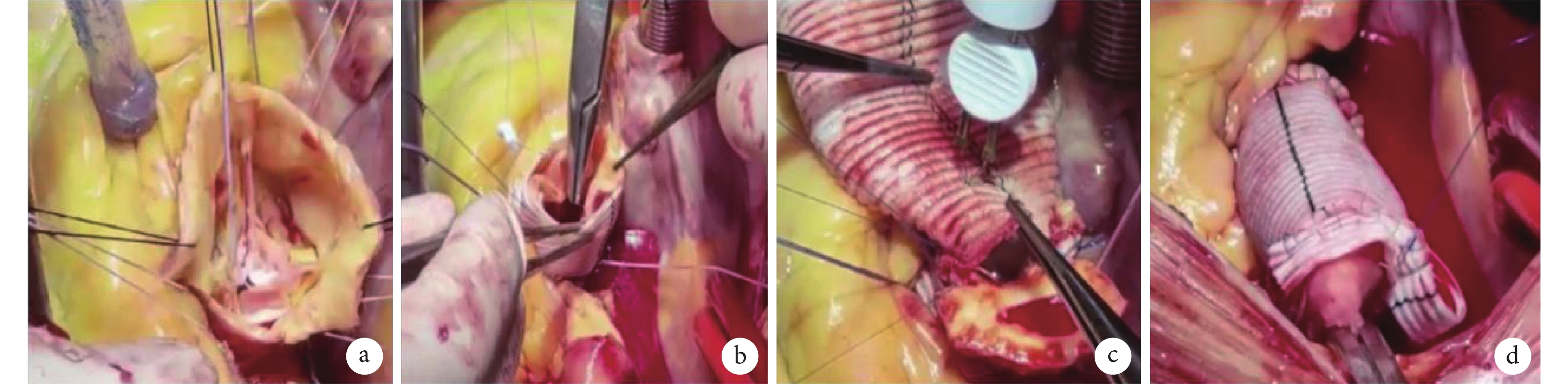
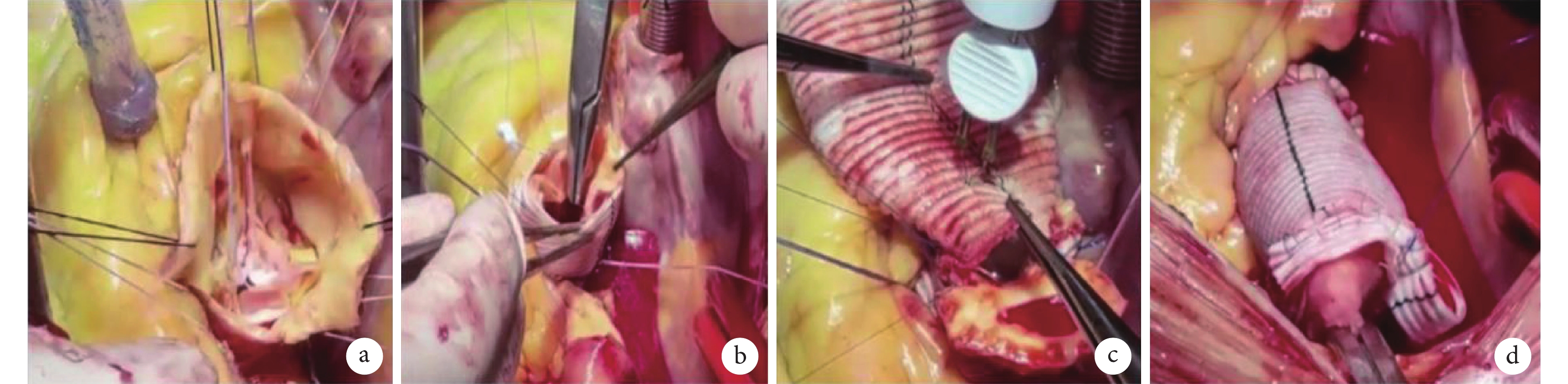 圖2
佛羅里達袖手術操作過程
圖2
佛羅里達袖手術操作過程
a:測量瓣葉高度和瓣環后水平置線;b:人工血管與自體血管縫合;c:升主動脈近端吻合與冠竇部縫合;d:注水冷灌測試與升主動脈遠端吻合
1.3 結局指標
臨床觀察指標:體外循環時間、主動脈阻斷時間、人工血管直徑、手術時間、術中輸血、同期手術處理、首次ICU滯留、機械通氣、術后24 h引流量以及術后恢復及并發癥發生情況。隨訪復查心臟彩超、胸部CT評估患者術后主動脈瓣功能;心功能情況等;以及再次住院治療情況。
1.4 統計學分析
本研究采用SPSS25.0統計分析軟件進行統計分析。計量資料采用Shapiro-Wilk檢驗進行正態性檢驗,正態分布數據采用均值±標準差(x±s)描述,非正態分布數據以中位數(四分位數間距)[M(P25,P75)]表示,計數資料以例數和百分比(%)描述。術前、術后出院前及出院后1個月期間心臟彩色超聲(彩超)相關指標采用單因素重復測量方差分析。
1.5 倫理審查
本研究已通過南京市第一醫院倫理委員會批準,編號:KY20220425-05。
2 結果
最終符合入組條件患者15例,其中男12例(80.0%)、女3例(20.0%);年齡33~71歲(53.5±12.4)歲;BMI(24.6±2.1)kg/m2。術前高血壓8例,糖尿病5例。術前主動脈瓣功能:重度關閉不全2例,中-重度關閉不全4例,中度關閉不全5例,輕-中度關閉不全4例。超聲心動圖檢查左心室舒張末期內徑44~68(53.6±6.3mm),左心室收縮末期內徑28~40(34.4±3.6)mm,竇部內徑34~49(40.1±4.8)mm,左室射血分數59%~68%(64.5%±2.4%) 。
15例患者均成功完成了主動脈瓣成形FST。其中,單純行FST患者2例(13.3%),同期行升主動脈置換11例(73.3%),同期行升主動脈置換聯合左冠竇置換1例(6.7%)。在修復主動脈瓣時,7例手術采用了交界懸吊技術,2例采用了瓣環成形術,1例采用了單純融合瓣葉脊分離技術,其余5例則采用了多種方法進行主動脈瓣修復。術中心臟復跳后均行TEE確認主動脈瓣反流程度。無圍手術期死亡,平均手術時間200~350(284.7±49.5)min,平均體外循環時間70~219(135.0±40.0 )min,平均主動脈阻斷時間54~203(109.9±38.6)min,中位首次ICU停留時間為1 d,機械通氣時間1~9 h,平均(4.4±2.6)min。術后無二次入ICU,無二次開胸止血。圍手術期無低心排血量綜合征、心臟驟停、節律失常、新發心臟傳導異常、低氧血癥、術后二次插管、急性腎損傷等嚴重并發癥。
15例行FST主動脈瓣成形術患者術中和術后住院資料見表2。
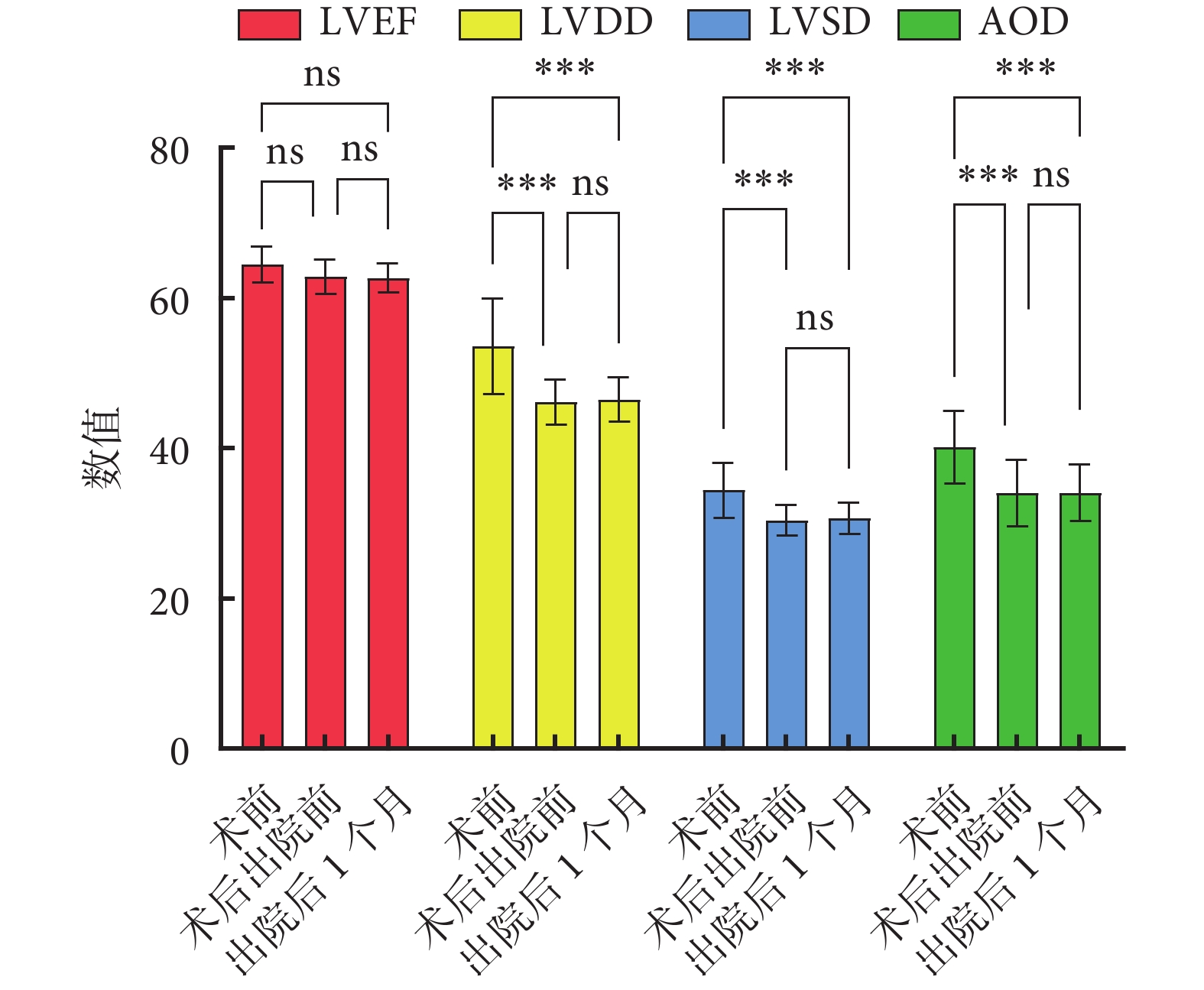
術后住院時間4~10(7.2±1.8)d;無出院前死亡病例,無出院二次手術病例;無術后30 d死亡。出院后1個月10例患者均接受隨訪,隨訪成功率100%,NYHA心功能均為Ⅰ~Ⅱ級。術前、術后出院前及出院后1個月隨訪心功能評估情況對比見表3。各時間段間相比:左心室舒張末期內徑、左心室收縮末期內徑、竇部內徑3項指標在術前、出院前及術前、出院后1個月兩組間比較差異有統計學意義(P<0.01),出院前、出院后1個月組間比較差異無統計學意義(P>0.05)。左心射血分數在術前、出院前及術前、出院后1個月組間比較時均無統計學差異(P>0.05)。術前、出院前及出院后1個月心超各內徑指標轉歸見圖3。
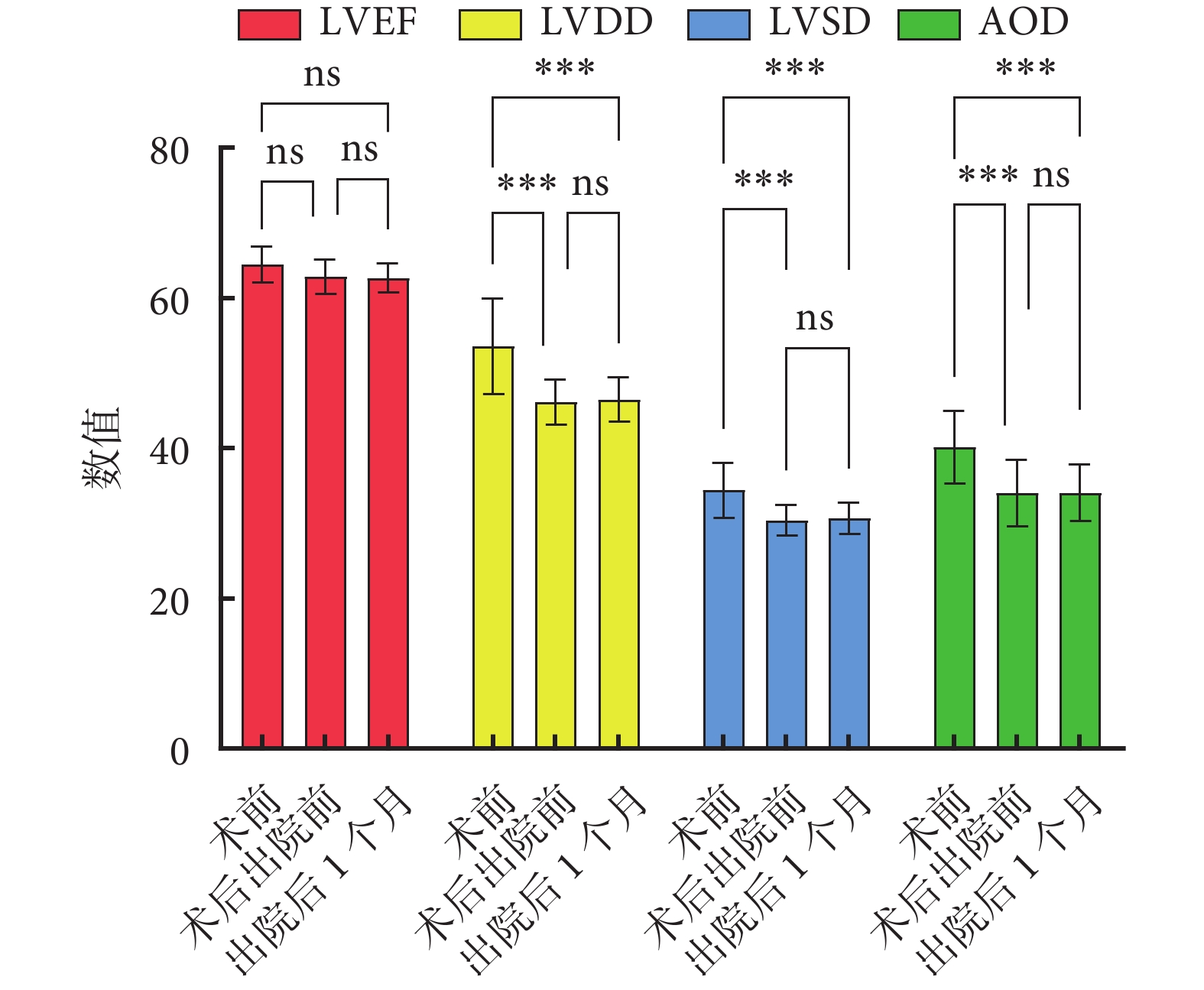 圖3
術前、術后出院前及出院后1個月心超各內徑指標轉歸
圖3
術前、術后出院前及出院后1個月心超各內徑指標轉歸
ns:
術前主動脈瓣重度關閉不全2例,中-重度關閉不全4例,中度關閉不全5例,輕-中度關閉不全4例;出院前主動脈瓣輕-中度關閉不全2例,輕度關閉不全13例;出院后1個月隨訪中主動脈瓣輕度關閉不全1例。主動脈超聲心動圖檢查主動脈瓣功能良好,療效滿意。
3 討論
主動脈瓣關閉不全其特征是主動脈瓣在舒張期未能完全關閉,導致血液從主動脈反流回左心室,使得左心室前負荷增加,心室腔擴張,心功能下降。目前國際上常用的處理方式包括主動脈瓣置換術、主動脈瓣修復術以及經導管主動脈瓣植入術(transcatheter aortic valve implantation,TAVI)[14]。開胸主動脈瓣置換術是最常用的手術方式,但機械瓣需要長期抗凝、生物瓣膜耐久度問題尚未解決、同時由術后感染性心內膜炎等相關并發癥發生可能。此外,TAVI對于治療主動脈瓣關閉不全的患者尚無有力的證據支持,且其瓣膜耐久度更差[14-15]。因此,主動脈瓣修復術越來越受到臨床醫生的青睞。主動脈瓣成形術相較于上述兩者有其獨特的優勢,其不僅保留了患者自身的瓣膜,維持了穩定的血流動力學,避免了因人工瓣膜損壞導致的多次瓣膜置換,而且相比人工瓣膜植入,發生血栓形成和感染等并發癥的風險較低。隨著對生活質量要求的提高,尤其是在年輕患者中,主動脈瓣成形術得到了越來越多的重視和應用[3,16]。
目前,主動脈瓣成形術已經包括了諸如瓣葉修復、瓣環成形術、瓣葉懸吊術、瓣葉延長術和瓣葉分離術等多種手術技術[3],這些技術在臨床中得到了廣泛的應用。而對于合并主動脈竇部瘤的主動脈瓣關閉不全患者,往往需要實施VSARR。但是,傳統的VSARR,即David或Yacoub,手術難度高,且對于合并輕微主動脈瓣竇部擴張(AOD<45 mm)的患者,VSARR顯得過于激進,但是該類患者仍然存在主動脈竇部進一步擴張的風險。FST是2005年由Tomas Martin、Philip Hess等首次報道的一種簡化的、無需切除整個主動脈根壁和重建冠脈的保瓣主動脈根部置換術。因此,針對竇部擴張但未達到David或Yacoub手術指征的主動脈瓣關閉不全患者,FST具有一定的優勢,能在修復主動脈瓣,環縮主動脈瓣環的同時降低遠期發生竇部進一步擴張的發生率。
目前,FST已經在國外取得了較好的中、遠期療效[12,17-18]。FST不需要冠脈再植,這進一步降低了手術出血的風險與手術時間。Aalaei-Andabili等[12]的回顧性臨床研究也表明了FST術后早期和晚期血栓栓塞事件的風險非常低。將FST分別與采用David或Yacoub術式比較,FST會降低主動脈瓣應力,并防止可能的主動脈根部扭曲或者損傷性的主動脈壁應力。因此,FST在生物力學方面更優于David、Yacoub兩種術式[19]。相較于FST,采用David或Yacoub術式的患者早期死亡率較高,分別為1.69%、4.8%、4.6%[11-12,20]。Hess等[17]和Aalaei-Andabili等[12]的研究結果相一致:FST可以顯著改善左心室舒張末期內徑,左心室收縮末期內徑在中期隨訪時有顯著改善,左心射血分數在隨訪期間沒有變化。
然而,在我國只有部分醫院開展該項技術,同時其對于主動脈瓣關閉不全合并輕微竇部擴張的這一患者群體尚無全面報道。因此需要更多的研究數據來支持概述是對于國人的療效。針對上述主動脈瓣關閉不全合并竇部擴張(AOD<45 mm)的患者,我院已經開展多例主動脈瓣成形FST,患者術后瓣膜功能、左心室舒張末期內徑、左心室收縮末期內徑相較術前有顯著改善。因為這類患者并未達到David或者Yacoub手術指征,本文僅對15例主動脈瓣關閉不全合并竇部擴張接受FST的患者進行回顧性分析。15為患者出院前與出院后1個月的左心室舒張末期內徑和左心室收縮末期內徑相較于術前顯著下降,竇部內徑也較術前顯著改善,提示手術對于左室大小和竇部直徑的改善顯著。本文15例患者術前左心射血分數均處于正常值范圍內,在出院前與出院后1個月,左心射血分數較術前沒有顯著變化,從另一個角度說明了FST不僅能夠維持術前正常的左室功能,還可能在術后可以較好保護心功能。主動脈瓣功能術后1周與1個月復查結果均表現為輕度,僅1例患者出院后1個月復查心超提示輕-中度,表明該術式對于主動脈瓣功能恢復的確切療效,同時能夠對主動脈竇部進行環縮。這些結果表明FST作為主動脈瓣關閉不全患者的一種安全、有效的治療方法。
本項研究初步總結了FST對于主動脈瓣關閉不全合并竇部擴張患者治療效果,但仍有很多不足之處:由于本研究樣本量較少,隨訪時間較短,仍需進一步大樣本、多中心的臨床研究來驗證手術的長期效果和安全性。此外,本研究缺乏對照組,未來研究應包括與常規主動脈瓣置換術的比較,以及對于竇部擴張明顯的主動脈瓣關閉不全患者中與David、Yacoub手術的療效比較,以全面評估FST的相對優勢和適應癥。
綜上所述,FST作為一種治療竇部輕微擴張的主動脈瓣關閉不全技術,展現了其安全性和有效性。該技術的優點包括較低的手術風險、良好的早期治療效果、較少的術后并發癥以及較為快速的恢復過程。但是由于主動脈瓣成形FST對于技術的要求較高,一味地追求主動脈瓣成形反而會導致手術、體外循環以及主動脈阻斷時間的延長對患者產生沒有必要的不利影響。
利益沖突: 所有作者均聲明不存在利益沖突。
作者貢獻:陳東良負責研究設計、數據收集和論文撰寫;陳東良、劉圣辰負責研究設計與論文內容調整、修改;黃福華負責研究設計指導、對文章知識性內容作批評性審閱。
主動脈瓣關閉不全,是一種以主動脈瓣不完全閉合為特征的疾病,導致血液從主動脈反流回到左心室。這種反流會影響左心室功能,并最終可能導致心力衰竭。傳統上,主動脈瓣置換術目前仍是治療該病變的最常用術式[1]。然而,瓣膜置換術后抗凝血治療相關并發癥、瓣膜損毀導致的二次手術等問題也是臨床實踐中需要考慮的重要問題。與主動脈瓣置換術相比,主動脈瓣成形術提供了保留自體瓣膜、穩定血流動力學和左心室功能恢復較快等優勢,同時降低了長期抗凝需求和再次手術的風險;這種方法對所有年齡段的患者,尤其是年輕患者,都具有顯著的優點[2-3]。在主動脈瓣關閉不全患者中,主動脈竇部擴張常作為一種伴隨情況出現[4-5]。這通常由于主動脈竇部結構改變,導致主動脈瓣環及瓣葉擴張、變形,對合高度降低,進而引發主動脈瓣關閉不全[6]。Katayama 等[7]的研究發現,在假竇模型中,缺乏竇的主動脈瓣葉承受更大應力,瓣膜開放時間更長,關閉速度更快。一些學者已針對竇部再植及成形術進行了相關研究。其中,佛羅里達袖技術(Florida sleeve technique,FST)是一種保留瓣膜的主動脈根部置換(valve-sparing aortic root replacement,VSARR)方法(圖1)。該技術由 Tomas Martin、Philip Hess 等[8]率先報道,是一種無需切除整個主動脈根壁和重建冠狀動脈(冠脈)的 VSARR 新技術。尤其是對于根部直徑<50 mm的主動脈根部擴張,而未達到David[9-10]或Yacoub[11]手術指征的患者,FST不僅能夠修復反流的主動脈瓣,同時能夠縮小主動脈瓣竇部以及主動脈瓣環直徑;此外,與傳統的VSARR相比(包括David、Yacoub等),FST不需要對冠脈開口進行再植,進而縮短手術時間以及減少冠脈開口再植的相關并發癥。近些年來,該技術在國外得到了廣泛的報道和應用,并在臨床實踐中取得了較好療效[12]。然而,在國內采用FST修復成人主動脈瓣關閉不全,尤其是合并竇部輕微擴張的報道仍較少。本研究對我院2020年8月—2024年5月接受FST的單純主動脈竇部擴張合并主動脈瓣關閉不全患者進行回顧性研究,現總結手術經驗及早期預后情況如下。
 圖1
佛羅里達袖手術示意圖[13]
圖1
佛羅里達袖手術示意圖[13]
1 資料與方法
1.1 臨床資料
利用本科室臨床資料數據庫,收集2020年8月—2024年5月在南京市第一醫院接受FST治療單純竇部擴張合并主動脈瓣關閉不全患者的臨床資料。納入標準:(1)年齡>18歲;(2)正常或輕微的主動脈瓣葉異常、繼發于主動脈根部動脈瘤的Ⅰ型主動脈瓣關閉不全患者;(3)主動脈竇部擴張合并主動脈瓣二葉式畸形或其他瓣葉病變程度允許保留并修復患者。排除標準:(1)主動脈瓣嚴重受損或無功能需要主動脈瓣置換和Ⅱ型主動脈瓣關閉不全患者;(2)同期冠脈旁路移植患者;(3)伴其他瓣膜病變患者,如二尖瓣狹窄,二尖瓣關閉不全,三尖瓣關閉不全等;(4)明確其他心臟病變患者。如擴張性心肌病,肥厚性梗阻型心肌病。數據分別采集于術前、術后出院前和出院后1個月。患者術前均常規行心臟彩超、胸部CT平掃、心電圖等檢查評估主動脈瓣功能關閉不全程度及其他并存疾病。患者心肺功能均可耐受全身麻醉手術。
1.2 手術方法
全身麻醉后,取平臥位。術前置入經食管超聲心動圖(transesophageal echocardiographic,TEE)再次評估主動脈瓣功能、竇部內徑、升主動脈擴張處直徑等情況。手術均取胸骨正中切口,經升主動脈、右心房、右上肺靜脈插管建立體外循環。竇管交界上方約1 cm橫斷升主動脈。探查竇部、左右冠脈竇開口、瓣葉質地、高度。游離主動脈根部與周圍組織至主動脈瓣環水平以下1~2 mm,游離左、右冠脈。保留主動脈瓣,測量瓣葉有效高度,通過交界懸吊、瓣葉折疊等方法調整瓣葉高度一致,沿主動脈瓣功能瓣環下1 mm,間斷置線穿出至主動脈壁外側(墊片置入左室側)。根據交接高度決定人工血管直徑,并于人工血管左冠、右冠竇中點修剪成拱門形狀以利于跨過冠脈將人工血管置于主動脈瓣環外側,23#Hegar探條置入后打結均勻環縮主動脈瓣環。將主動脈殘壁與人工血管在竇管交界水平吻合。注水試驗提示主動脈瓣對合良好、無滲漏后,進一步完成升主動脈近端與升主動脈遠端吻合(圖2)。
 圖2
佛羅里達袖手術操作過程
圖2
佛羅里達袖手術操作過程
a:測量瓣葉高度和瓣環后水平置線;b:人工血管與自體血管縫合;c:升主動脈近端吻合與冠竇部縫合;d:注水冷灌測試與升主動脈遠端吻合
1.3 結局指標
臨床觀察指標:體外循環時間、主動脈阻斷時間、人工血管直徑、手術時間、術中輸血、同期手術處理、首次ICU滯留、機械通氣、術后24 h引流量以及術后恢復及并發癥發生情況。隨訪復查心臟彩超、胸部CT評估患者術后主動脈瓣功能;心功能情況等;以及再次住院治療情況。
1.4 統計學分析
本研究采用SPSS25.0統計分析軟件進行統計分析。計量資料采用Shapiro-Wilk檢驗進行正態性檢驗,正態分布數據采用均值±標準差(x±s)描述,非正態分布數據以中位數(四分位數間距)[M(P25,P75)]表示,計數資料以例數和百分比(%)描述。術前、術后出院前及出院后1個月期間心臟彩色超聲(彩超)相關指標采用單因素重復測量方差分析。
1.5 倫理審查
本研究已通過南京市第一醫院倫理委員會批準,編號:KY20220425-05。
2 結果
最終符合入組條件患者15例,其中男12例(80.0%)、女3例(20.0%);年齡33~71歲(53.5±12.4)歲;BMI(24.6±2.1)kg/m2。術前高血壓8例,糖尿病5例。術前主動脈瓣功能:重度關閉不全2例,中-重度關閉不全4例,中度關閉不全5例,輕-中度關閉不全4例。超聲心動圖檢查左心室舒張末期內徑44~68(53.6±6.3mm),左心室收縮末期內徑28~40(34.4±3.6)mm,竇部內徑34~49(40.1±4.8)mm,左室射血分數59%~68%(64.5%±2.4%) 。
15例患者均成功完成了主動脈瓣成形FST。其中,單純行FST患者2例(13.3%),同期行升主動脈置換11例(73.3%),同期行升主動脈置換聯合左冠竇置換1例(6.7%)。在修復主動脈瓣時,7例手術采用了交界懸吊技術,2例采用了瓣環成形術,1例采用了單純融合瓣葉脊分離技術,其余5例則采用了多種方法進行主動脈瓣修復。術中心臟復跳后均行TEE確認主動脈瓣反流程度。無圍手術期死亡,平均手術時間200~350(284.7±49.5)min,平均體外循環時間70~219(135.0±40.0 )min,平均主動脈阻斷時間54~203(109.9±38.6)min,中位首次ICU停留時間為1 d,機械通氣時間1~9 h,平均(4.4±2.6)min。術后無二次入ICU,無二次開胸止血。圍手術期無低心排血量綜合征、心臟驟停、節律失常、新發心臟傳導異常、低氧血癥、術后二次插管、急性腎損傷等嚴重并發癥。
15例行FST主動脈瓣成形術患者術中和術后住院資料見表2。
術后住院時間4~10(7.2±1.8)d;無出院前死亡病例,無出院二次手術病例;無術后30 d死亡。出院后1個月10例患者均接受隨訪,隨訪成功率100%,NYHA心功能均為Ⅰ~Ⅱ級。術前、術后出院前及出院后1個月隨訪心功能評估情況對比見表3。各時間段間相比:左心室舒張末期內徑、左心室收縮末期內徑、竇部內徑3項指標在術前、出院前及術前、出院后1個月兩組間比較差異有統計學意義(P<0.01),出院前、出院后1個月組間比較差異無統計學意義(P>0.05)。左心射血分數在術前、出院前及術前、出院后1個月組間比較時均無統計學差異(P>0.05)。術前、出院前及出院后1個月心超各內徑指標轉歸見圖3。
 圖3
術前、術后出院前及出院后1個月心超各內徑指標轉歸
圖3
術前、術后出院前及出院后1個月心超各內徑指標轉歸
ns:
術前主動脈瓣重度關閉不全2例,中-重度關閉不全4例,中度關閉不全5例,輕-中度關閉不全4例;出院前主動脈瓣輕-中度關閉不全2例,輕度關閉不全13例;出院后1個月隨訪中主動脈瓣輕度關閉不全1例。主動脈超聲心動圖檢查主動脈瓣功能良好,療效滿意。
3 討論
主動脈瓣關閉不全其特征是主動脈瓣在舒張期未能完全關閉,導致血液從主動脈反流回左心室,使得左心室前負荷增加,心室腔擴張,心功能下降。目前國際上常用的處理方式包括主動脈瓣置換術、主動脈瓣修復術以及經導管主動脈瓣植入術(transcatheter aortic valve implantation,TAVI)[14]。開胸主動脈瓣置換術是最常用的手術方式,但機械瓣需要長期抗凝、生物瓣膜耐久度問題尚未解決、同時由術后感染性心內膜炎等相關并發癥發生可能。此外,TAVI對于治療主動脈瓣關閉不全的患者尚無有力的證據支持,且其瓣膜耐久度更差[14-15]。因此,主動脈瓣修復術越來越受到臨床醫生的青睞。主動脈瓣成形術相較于上述兩者有其獨特的優勢,其不僅保留了患者自身的瓣膜,維持了穩定的血流動力學,避免了因人工瓣膜損壞導致的多次瓣膜置換,而且相比人工瓣膜植入,發生血栓形成和感染等并發癥的風險較低。隨著對生活質量要求的提高,尤其是在年輕患者中,主動脈瓣成形術得到了越來越多的重視和應用[3,16]。
目前,主動脈瓣成形術已經包括了諸如瓣葉修復、瓣環成形術、瓣葉懸吊術、瓣葉延長術和瓣葉分離術等多種手術技術[3],這些技術在臨床中得到了廣泛的應用。而對于合并主動脈竇部瘤的主動脈瓣關閉不全患者,往往需要實施VSARR。但是,傳統的VSARR,即David或Yacoub,手術難度高,且對于合并輕微主動脈瓣竇部擴張(AOD<45 mm)的患者,VSARR顯得過于激進,但是該類患者仍然存在主動脈竇部進一步擴張的風險。FST是2005年由Tomas Martin、Philip Hess等首次報道的一種簡化的、無需切除整個主動脈根壁和重建冠脈的保瓣主動脈根部置換術。因此,針對竇部擴張但未達到David或Yacoub手術指征的主動脈瓣關閉不全患者,FST具有一定的優勢,能在修復主動脈瓣,環縮主動脈瓣環的同時降低遠期發生竇部進一步擴張的發生率。
目前,FST已經在國外取得了較好的中、遠期療效[12,17-18]。FST不需要冠脈再植,這進一步降低了手術出血的風險與手術時間。Aalaei-Andabili等[12]的回顧性臨床研究也表明了FST術后早期和晚期血栓栓塞事件的風險非常低。將FST分別與采用David或Yacoub術式比較,FST會降低主動脈瓣應力,并防止可能的主動脈根部扭曲或者損傷性的主動脈壁應力。因此,FST在生物力學方面更優于David、Yacoub兩種術式[19]。相較于FST,采用David或Yacoub術式的患者早期死亡率較高,分別為1.69%、4.8%、4.6%[11-12,20]。Hess等[17]和Aalaei-Andabili等[12]的研究結果相一致:FST可以顯著改善左心室舒張末期內徑,左心室收縮末期內徑在中期隨訪時有顯著改善,左心射血分數在隨訪期間沒有變化。
然而,在我國只有部分醫院開展該項技術,同時其對于主動脈瓣關閉不全合并輕微竇部擴張的這一患者群體尚無全面報道。因此需要更多的研究數據來支持概述是對于國人的療效。針對上述主動脈瓣關閉不全合并竇部擴張(AOD<45 mm)的患者,我院已經開展多例主動脈瓣成形FST,患者術后瓣膜功能、左心室舒張末期內徑、左心室收縮末期內徑相較術前有顯著改善。因為這類患者并未達到David或者Yacoub手術指征,本文僅對15例主動脈瓣關閉不全合并竇部擴張接受FST的患者進行回顧性分析。15為患者出院前與出院后1個月的左心室舒張末期內徑和左心室收縮末期內徑相較于術前顯著下降,竇部內徑也較術前顯著改善,提示手術對于左室大小和竇部直徑的改善顯著。本文15例患者術前左心射血分數均處于正常值范圍內,在出院前與出院后1個月,左心射血分數較術前沒有顯著變化,從另一個角度說明了FST不僅能夠維持術前正常的左室功能,還可能在術后可以較好保護心功能。主動脈瓣功能術后1周與1個月復查結果均表現為輕度,僅1例患者出院后1個月復查心超提示輕-中度,表明該術式對于主動脈瓣功能恢復的確切療效,同時能夠對主動脈竇部進行環縮。這些結果表明FST作為主動脈瓣關閉不全患者的一種安全、有效的治療方法。
本項研究初步總結了FST對于主動脈瓣關閉不全合并竇部擴張患者治療效果,但仍有很多不足之處:由于本研究樣本量較少,隨訪時間較短,仍需進一步大樣本、多中心的臨床研究來驗證手術的長期效果和安全性。此外,本研究缺乏對照組,未來研究應包括與常規主動脈瓣置換術的比較,以及對于竇部擴張明顯的主動脈瓣關閉不全患者中與David、Yacoub手術的療效比較,以全面評估FST的相對優勢和適應癥。
綜上所述,FST作為一種治療竇部輕微擴張的主動脈瓣關閉不全技術,展現了其安全性和有效性。該技術的優點包括較低的手術風險、良好的早期治療效果、較少的術后并發癥以及較為快速的恢復過程。但是由于主動脈瓣成形FST對于技術的要求較高,一味地追求主動脈瓣成形反而會導致手術、體外循環以及主動脈阻斷時間的延長對患者產生沒有必要的不利影響。
利益沖突: 所有作者均聲明不存在利益沖突。
作者貢獻:陳東良負責研究設計、數據收集和論文撰寫;陳東良、劉圣辰負責研究設計與論文內容調整、修改;黃福華負責研究設計指導、對文章知識性內容作批評性審閱。