肺純磨玻璃樣結節(pure ground glass nodule,pGGN)中腺癌占比30%~60%,浸潤性腺癌占比1.7%~24.3%[1-3]。對于浸潤性腺癌,臨床治療手段多為肺葉切除術及縱隔淋巴結清掃,而前驅體病變及微浸潤腺癌治療手段常為楔形或肺段切除術[4]。此外,浸潤性腺癌患者術后5年無病生存率為38%~95%,低于前驅體病變和微浸潤腺癌[5]。術前判斷pGGN浸潤程度對于手術方案制定及預后評估有重要意義。單純CT無法準確判斷肺pGGN浸潤程度[6]。結合CT圖像特征判斷肺pGGN浸潤程度的價值也有限,臨床應用效果并不理想[7]。此外,各研究的CT掃描參數及圖像采集和處理方案不盡相同,且結果也存在一定差異[8-10]。研究[11]顯示部分免疫炎癥指標和腫瘤標志物水平與肺結節浸潤程度相關,如血小板與淋巴細胞比值(platelet to lymphocyte ratio,PLR)和癌胚抗原(carcinoembryonic antigen,CEA)在腺體前驅病變階段就已發生變化。目前,聯合CT定量參數、CT征象、血細胞參數和腫瘤標志物,綜合預測肺pGGN浸潤程度的研究較少。本研究分析肺pGGN患者的CT定量參數、CT征象、血細胞參數和腫瘤標志物資料,篩選與浸潤程度有關的風險因素并構建預測模型,以期為臨床醫師制定手術方案及預后評估提供參考。
1 資料與方法
1.1 臨床資料
回顧性分析唐山市工人醫院2021年6月—2024年4月的CT表現為肺結節患者的臨床資料。根據手術病理結果是否為浸潤性腺癌分為非浸潤組和浸潤組。按7∶3分為訓練集和驗證集。納入標準:(1)CT表現為單發pGGN;(2)有手術病理結果;(3)結節直徑≤3 cm。排除標準:(1)術前抗腫瘤治療或穿刺活檢;(2)臨床資料不完整;(3)CT圖像存在明顯偽影或影響觀察。
1.2 樣本量計算
用R 4.3.2軟件中“pmsampsize”包計算樣本量。參照文獻[1]設定cstatistic(0.911)和prevalence(0.251)。納入研究分析因素23個,經計算得出,所需樣本量最少為523例,且需包含浸潤性腺癌132例。
1.3 CT檢查及圖像處理
用GE Revolution CT掃描患者肺部(管電壓120 kV,層厚5 mm,層間距5 mm,螺距0.992),范圍從肺尖至膈肌下方,定位結節后行靶掃描(管電壓120 kV,自適應管電流,層厚1.25 mm,層間距1.25 mm,矩陣512×512,螺距0.992,視野20~25 cm)。由1名CT室副主任醫師分析圖象,記錄結節CT征象、直徑(薄層肺窗結節的最長徑與垂直的最長短徑的平均值)和平均CT值(薄層肺窗,避開支氣管、血管及含氣空腔,在結節最大層面及其上下層面勾畫感興趣區,取其平均值)。
1.4 資料收集
收集年齡、性別、吸煙史、術前血細胞參數[中性粒細胞與淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴細胞與單核細胞比值(lymphocyte to monocyte ratio,LMR)、血小板與單核細胞比值(platelet to monocyte ratio,PMR)、PLR、系統免疫炎癥指數(systemic immune-inflammatory index,SII)和全身炎癥反應指數(systemic inflammatory response index,SIRI)]、術前腫瘤標志物[神經元特異性烯醇化酶(neuronspecific enolase,NSE)、CEA、胃泌素釋放肽前體(precursor of gastrin-releasing peptide,Pro-GRP)和細胞角蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)]和術后病理結果資料。
1.5 統計學分析
用R 4.3.2軟件進行統計學分析。偏態分布的連續性資料用中位數(上下四分位數)[M(P25,P75)]描述,組間差異比較分別用Mann-Whitney U。分類資料用例(%)表示,組間比較采用χ2檢驗。用Lasso-logistic回歸篩選浸潤性腺癌的風險因素并構建預測模型,用受試者工作特征(receiver operating characteristic,ROC)曲線、校準曲線、平均絕對誤差(mean absolute error,MAE)、均方誤差(mean square error,MSE)和準確度評價模型效能。P≤0.05為差異有統計學意義。
1.6 倫理審查
研究經唐山市工人醫院醫學倫理委員會批準,倫理批號為GRYY-LL-KJ2021-K60。
2 結果
2.1 訓練集和驗證集的臨床資料比較
共納入528例患者,其中男265例、女263例;中位年齡54(45,59)歲;非典型腺瘤樣增生52例,原位腺癌179例,微浸潤腺癌135例,浸潤性腺癌162例。訓練集和驗證集的臨床資料差異均無統計學意義(P>0.05);見表1。
2.2 非浸潤組和浸潤組的臨床資料比較
浸潤組的年齡、直徑、平均CT值、毛刺征占比、血管集束征占比、空泡征占比、胸膜凹陷征占比、充氣支氣管征占比、CEA和SIRI水平高于非浸潤組,圓形或類圓形占比、Pro-GRP、PMR和PLR水平低于非浸潤組(P<0.05);見表2。
2.3 單發肺pGGN浸潤程度的風險因素
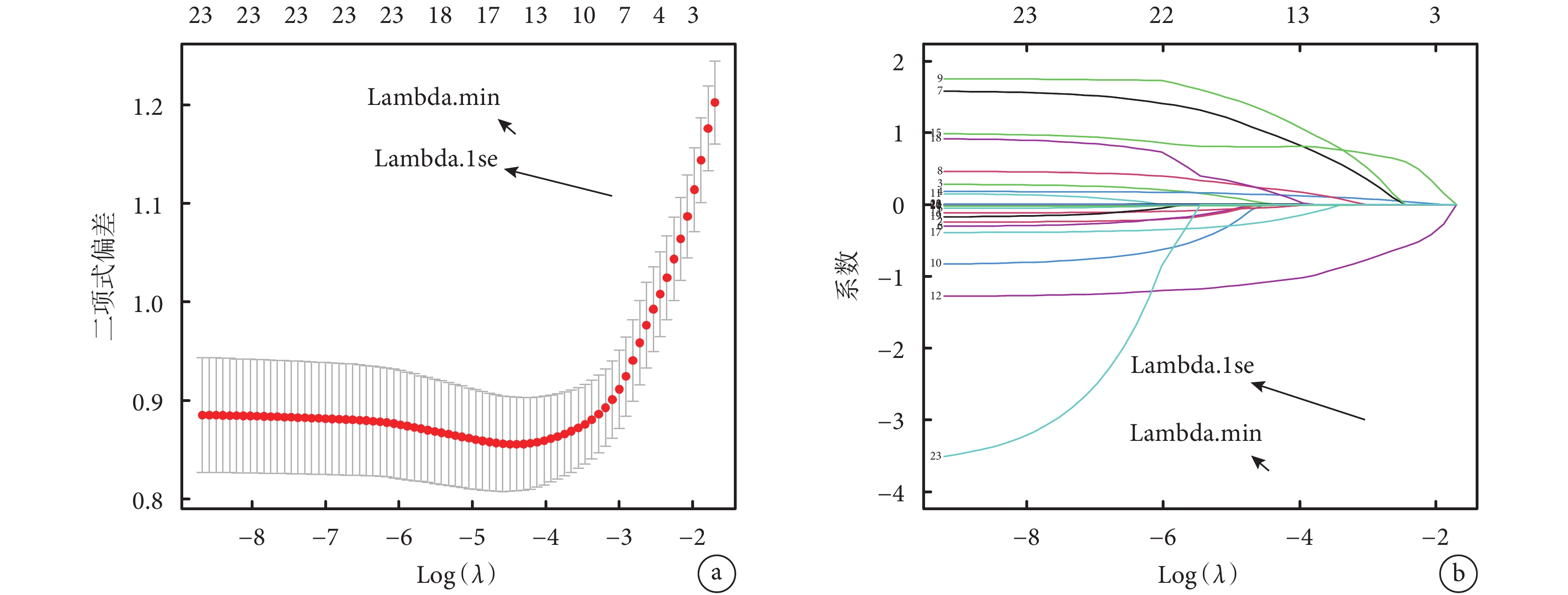
將肺pGGN浸潤程度作為因變量,將表2中指標作為自變量,10折交叉驗證,Lasso回歸分析結果顯示,λ=0.045時模型更簡潔(圖1a),直徑、血管集束征、空泡征、胸膜凹陷征、圓形或類圓形、平均CT值、CEA和PLR與單發肺pGGN浸潤程度有關,系數值分別為0.084、0.403、0.014、0.581、?0.793、0.001、0.722和?0.005(圖1b)。將肺pGGN浸潤程度作為因變量,將直徑、血管集束征、空泡征、胸膜凹陷征、圓形或類圓形、平均CT值、CEA和PLR作為自變量,logistic回歸Forward:LR法分析結果顯示,直徑增加、血管集束征、胸膜凹陷征、平均CT值升高和CEA水平升高是單發肺pGGN浸潤的獨立危險因素,圓形或類圓形、PLR水平升高是單發肺pGGN浸潤的獨立保護因素(P<0.05);見表3。
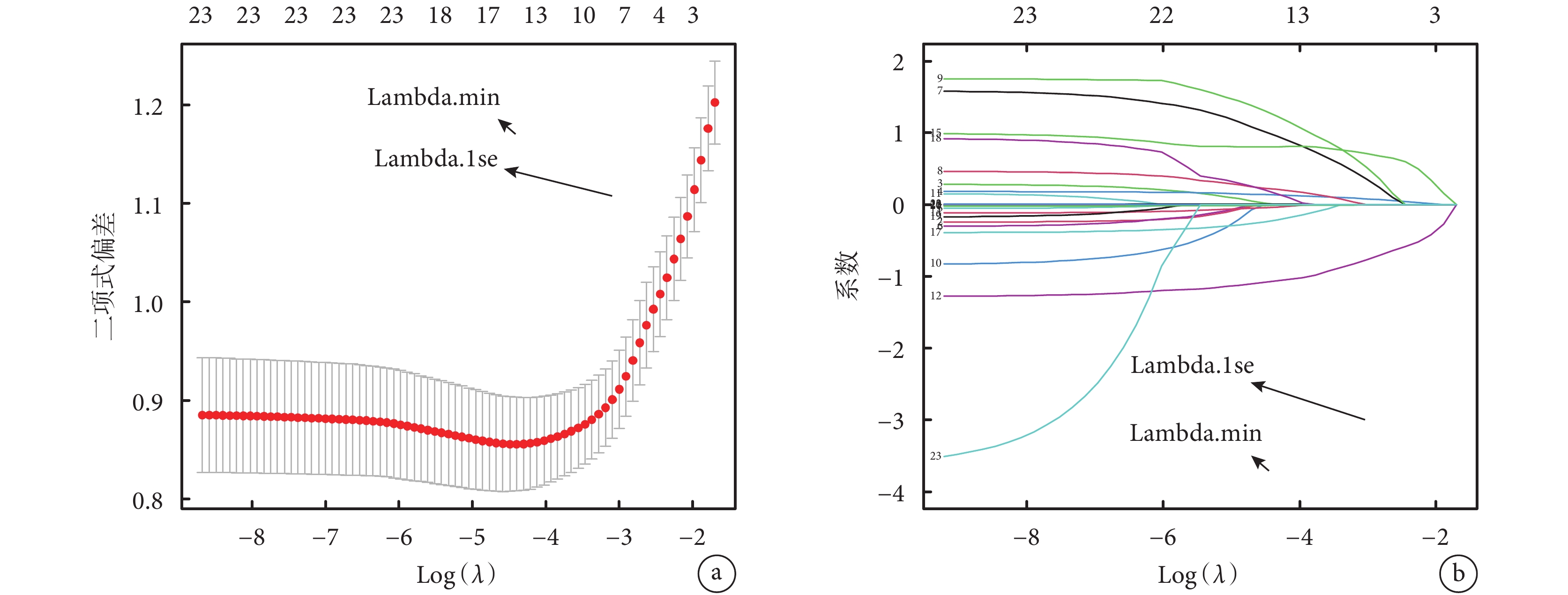 圖1
Lasso回歸分析結果
圖1
Lasso回歸分析結果
a:λ取值范圍;b:各因素系數
2.4 單發肺pGGN浸潤的預警模型構建及評價
模型Z為logit(P)=–1.665+0.156×直徑+1.254×血管集束征+1.684×胸膜凹陷征–1.291×圓形或類圓形+0.003×平均CT值+0.959×CEA?0.015×PLR;模型C為logit(P)=–1.085+0.185×直徑+1.329×血管集束征+2.028×胸膜凹陷征–1.256×圓形或類圓形+0.003×平均CT值,模型S為logit(P)=–2.919+1.718×CEA-0.015×PLR。
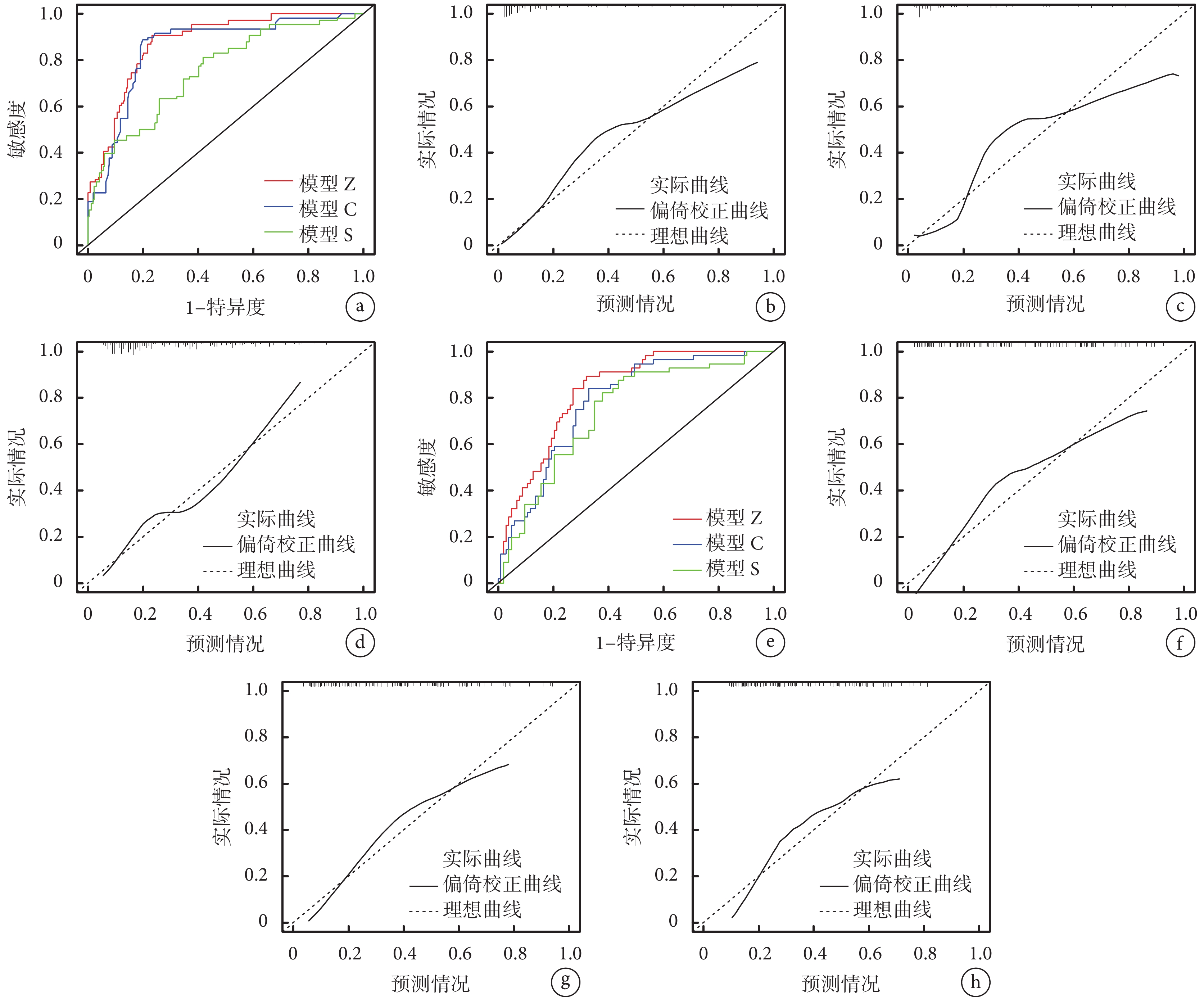
訓練集中,模型Z的ROC曲線下面積大于模型C(Z=2.125,P=0.034)和模型S(Z=4.973,P<0.001);見圖2a和表4。模型Z、模型C和模型S的校準曲線均圍繞理想曲線變化;見圖2b~d。模型Z的MAE值和MSE值均低于模型C,高于模型S;見表4。
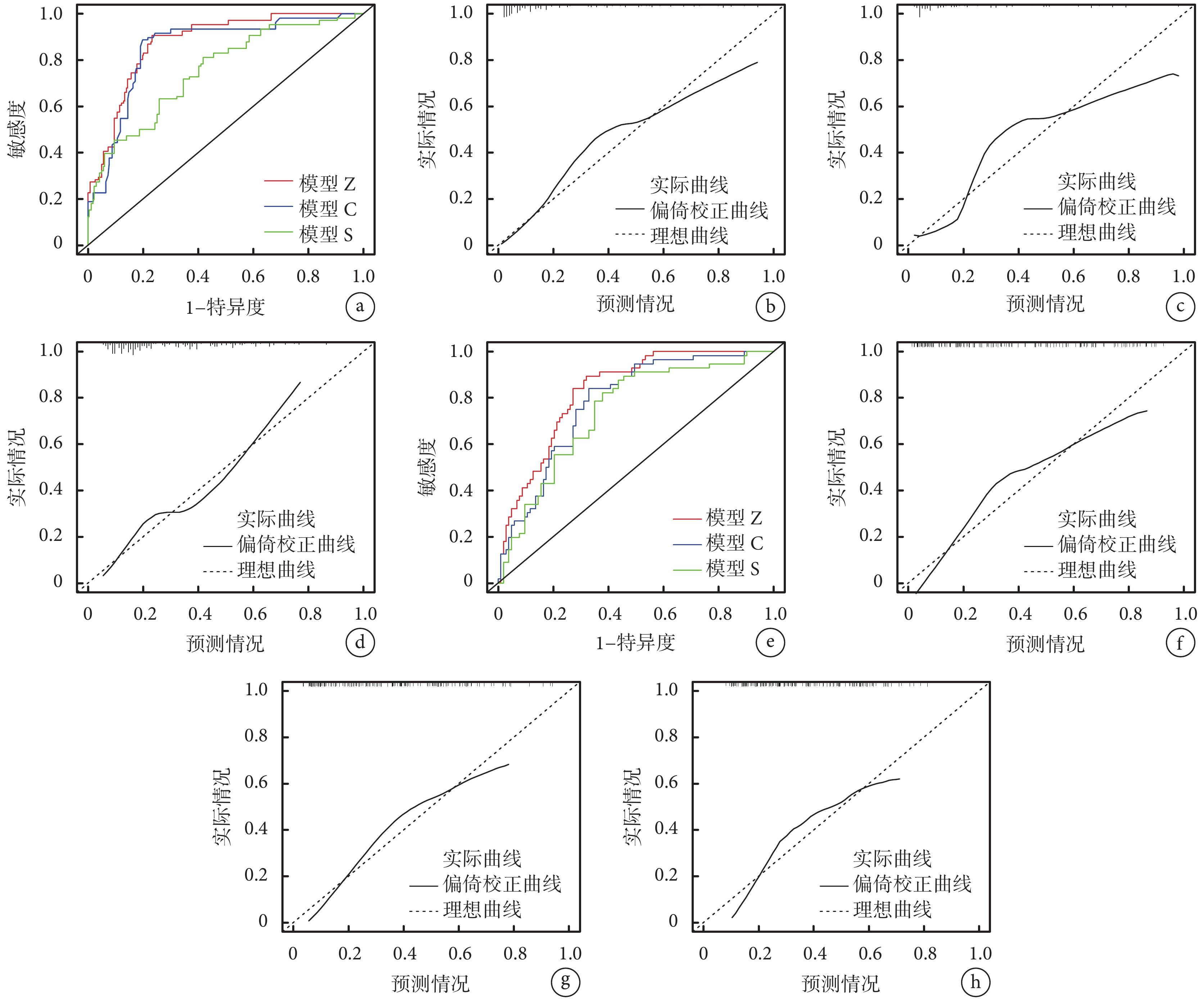 圖2
模型評價結果
圖2
模型評價結果
訓練集(a:ROC曲線;b:模型Z校準曲線;c:模型C校準曲線;d:模型S校準曲線);驗證集(e:ROC曲線;f:模型Z校準曲線;g:模型C校準曲線;h:模型S校準曲線)
驗證集中,模型Z的ROC曲線下面積大于模型C(Z=2.281,P=0.023)和模型S(Z=2.434,P=0.015);見圖2e和表4。模型Z、模型C和模型S的校準曲線均圍繞理想曲線變化;見圖2f~h。模型Z的MAE值和MSE值均高于模型C和模型S;見表4。
3 討論
3.1 肺pGGN浸潤的風險因素
本研究綜合分析CT定量參數、CT征象、腫瘤標志物和血細胞參數與單發肺pGGN浸潤程度的關系,結果顯示,浸潤組的年齡、直徑、平均CT值、毛刺征占比、血管集束征占比、空泡征占比、胸膜凹陷征占比、充氣支氣管征占比、CEA和SIRI水平高于非浸潤組,圓形或類圓形占比、Pro-GRP、PMR和PLR水平低于非浸潤組,提示上述指標與浸潤性腺癌有關。
目前,已有多數研究[12-14]顯示肺pGGN直徑和平均CT值是判斷其浸潤程度的重要指標,pGGN直徑和平均CT值越大,浸潤風險越高。血管集束征與肺癌細胞浸潤有關,在癌細胞浸潤過程中會釋放促血管生成因子,隨浸潤程度增加血管構形會發生變化,最終血管壁受牽拉影響形成血管集束征象[15]。胸膜凹陷征形成與腫瘤病灶內耗氧量增加有關,當病灶內細胞增殖及遷移等耗氧量增加時,病灶會發生纖維化收縮[16]。血管集束征和胸膜凹陷征常被用于評估肺結節良惡性,近期研究[17-18]顯示二者與肺結節浸潤程度增加有關。此外,還有研究[19-20]顯示肺結節形態與其浸潤程度有關,肺腺癌浸潤前及浸潤初期形態多呈圓形或類圓形,受細胞生長速率和分化等影響,隨其浸潤程度加深,其形態越發不規則。腺體前驅病變和微浸潤腺癌患者的CEA水平低于浸潤性腺癌,隨CEA水平升高,浸潤程度增加[11,21-22]。本研究納入因素維度及個數較多,避免各指標間共線性問題,采用Lasso-logistic回歸篩選浸潤性腺癌的風險因素,結果顯示,直徑增加、血管集束征、胸膜凹陷征、平均CT值升高和CEA水平升高是單發肺pGGN浸潤的獨立危險因素,圓形或類圓形、PLR水平升高是單發肺pGGN浸潤的獨立保護因素,與上述研究結果一致。目前,少有研究分析免疫炎癥指標PLR與單發肺pGGN浸潤程度的關系。萬輝等[11]顯示PLR在腺體前驅病變時就已發生變化,但腺體前驅病變和肺腺癌的PLR水平差異并不顯著。本研究結果提示PLR水平降低與浸潤風險增加有關,還需開展多中心、大樣本研究進一步分析驗證。
3.2 肺pGGN浸潤的模型效能分析
由于肺pGGN浸潤程度存在不確定性,若為浸潤性腺癌,患者預后不良風險增加[23-24]。預先獲知肺pGGN浸潤程度對于患者治療方案制定及預后管理大有裨益。因此,迫切需要精準確定肺pGGN浸潤程度。本研究構建了單純CT模型C(由直徑、血管集束征、胸膜凹陷征、圓形或類圓形和平均CT值構成)、腫瘤標志物和血細胞參數模型S(由CEA和PLR構成)及綜合模型Z(由直徑、血管集束征、胸膜凹陷征、圓形或類圓形、平均CT值、CEA和PLR構成),結果顯示,模型Z的ROC曲線下面積在訓練集和驗證集中均大于模型C和S,提示模型Z相較于模型C及模型S有更高的區分能力。但在訓練集中模型Z的準確度低于模型C,推測其原因是模型Z在不同截斷值下區分浸潤性肺腺癌的整體能力更強,而模型C可能在某個特定截斷值下區分浸潤性肺腺癌的準確率更高。本研究中模型Z、模型C和模型S的校準曲線均圍繞理想曲線變化,提示三模型的預測精準度尚可。訓練集中模型Z的誤差指標MAE值和MSE值均低于模型C,略高于模型S,提示模型Z的預測精準度較模型C高,略低于模型S。在驗證集中模型Z的MAE值和MSE值均高于模型C和模型S,提示模型Z的預測精準度較模型C和模型S低。模型Z在訓練集和驗證集上的表現差異較大的原因可能有以下3點:(1)訓練集和驗證集中pGGN直徑和CEA分布差異導致,盡管訓練集和驗證集的pGGN直徑(P=0.081)和CEA(P=0.060)差異無統計學意義,但二者均是構建模型的重要指標,些許差異仍會導致模型Z的泛化能力降低;(2)訓練集和驗證集的樣本量有一定差異,即便模型Z在訓練集中效能較好,它在驗證集中的泛化能力可能仍會受到樣本量大小的影響,尤其是在面對復雜特征組合時;(3)模型Z在訓練集中某個截斷值下表現較好,但在驗證集中由于數據分布的差異,可能無法在同樣的截斷值下達到最佳性能。
3.3 研究局限性
本研究有一定不足:(1)單中心研究,未增設外部驗證集驗證模型效能;(2)研究入組患者均接受手術切除治療,肺pGGN惡性程度更高,微浸潤腺癌和浸潤性腺癌占比可能較高;(3)模型Z在訓練集和驗證集中表現差異較大,后續還需大樣本研究進一步分析其泛化能力。
綜上所述,由直徑、血管集束征、胸膜凹陷征、圓形或類圓形、平均CT值、癌胚抗原和PLR構建的模型有助于判斷肺pGGN浸潤程度,其效能高于單純CT模型、腫瘤標志物和血細胞參數模型。
利益沖突:無。
作者貢獻:雷沖負責研究設計、數據整理及分析、文章撰寫及修改;徐影、陳瑋、杜金、孫杰和李欣負責數據整理及分析,劉海霞負責研究設計、文章質量評價。
肺純磨玻璃樣結節(pure ground glass nodule,pGGN)中腺癌占比30%~60%,浸潤性腺癌占比1.7%~24.3%[1-3]。對于浸潤性腺癌,臨床治療手段多為肺葉切除術及縱隔淋巴結清掃,而前驅體病變及微浸潤腺癌治療手段常為楔形或肺段切除術[4]。此外,浸潤性腺癌患者術后5年無病生存率為38%~95%,低于前驅體病變和微浸潤腺癌[5]。術前判斷pGGN浸潤程度對于手術方案制定及預后評估有重要意義。單純CT無法準確判斷肺pGGN浸潤程度[6]。結合CT圖像特征判斷肺pGGN浸潤程度的價值也有限,臨床應用效果并不理想[7]。此外,各研究的CT掃描參數及圖像采集和處理方案不盡相同,且結果也存在一定差異[8-10]。研究[11]顯示部分免疫炎癥指標和腫瘤標志物水平與肺結節浸潤程度相關,如血小板與淋巴細胞比值(platelet to lymphocyte ratio,PLR)和癌胚抗原(carcinoembryonic antigen,CEA)在腺體前驅病變階段就已發生變化。目前,聯合CT定量參數、CT征象、血細胞參數和腫瘤標志物,綜合預測肺pGGN浸潤程度的研究較少。本研究分析肺pGGN患者的CT定量參數、CT征象、血細胞參數和腫瘤標志物資料,篩選與浸潤程度有關的風險因素并構建預測模型,以期為臨床醫師制定手術方案及預后評估提供參考。
1 資料與方法
1.1 臨床資料
回顧性分析唐山市工人醫院2021年6月—2024年4月的CT表現為肺結節患者的臨床資料。根據手術病理結果是否為浸潤性腺癌分為非浸潤組和浸潤組。按7∶3分為訓練集和驗證集。納入標準:(1)CT表現為單發pGGN;(2)有手術病理結果;(3)結節直徑≤3 cm。排除標準:(1)術前抗腫瘤治療或穿刺活檢;(2)臨床資料不完整;(3)CT圖像存在明顯偽影或影響觀察。
1.2 樣本量計算
用R 4.3.2軟件中“pmsampsize”包計算樣本量。參照文獻[1]設定cstatistic(0.911)和prevalence(0.251)。納入研究分析因素23個,經計算得出,所需樣本量最少為523例,且需包含浸潤性腺癌132例。
1.3 CT檢查及圖像處理
用GE Revolution CT掃描患者肺部(管電壓120 kV,層厚5 mm,層間距5 mm,螺距0.992),范圍從肺尖至膈肌下方,定位結節后行靶掃描(管電壓120 kV,自適應管電流,層厚1.25 mm,層間距1.25 mm,矩陣512×512,螺距0.992,視野20~25 cm)。由1名CT室副主任醫師分析圖象,記錄結節CT征象、直徑(薄層肺窗結節的最長徑與垂直的最長短徑的平均值)和平均CT值(薄層肺窗,避開支氣管、血管及含氣空腔,在結節最大層面及其上下層面勾畫感興趣區,取其平均值)。
1.4 資料收集
收集年齡、性別、吸煙史、術前血細胞參數[中性粒細胞與淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴細胞與單核細胞比值(lymphocyte to monocyte ratio,LMR)、血小板與單核細胞比值(platelet to monocyte ratio,PMR)、PLR、系統免疫炎癥指數(systemic immune-inflammatory index,SII)和全身炎癥反應指數(systemic inflammatory response index,SIRI)]、術前腫瘤標志物[神經元特異性烯醇化酶(neuronspecific enolase,NSE)、CEA、胃泌素釋放肽前體(precursor of gastrin-releasing peptide,Pro-GRP)和細胞角蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)]和術后病理結果資料。
1.5 統計學分析
用R 4.3.2軟件進行統計學分析。偏態分布的連續性資料用中位數(上下四分位數)[M(P25,P75)]描述,組間差異比較分別用Mann-Whitney U。分類資料用例(%)表示,組間比較采用χ2檢驗。用Lasso-logistic回歸篩選浸潤性腺癌的風險因素并構建預測模型,用受試者工作特征(receiver operating characteristic,ROC)曲線、校準曲線、平均絕對誤差(mean absolute error,MAE)、均方誤差(mean square error,MSE)和準確度評價模型效能。P≤0.05為差異有統計學意義。
1.6 倫理審查
研究經唐山市工人醫院醫學倫理委員會批準,倫理批號為GRYY-LL-KJ2021-K60。
2 結果
2.1 訓練集和驗證集的臨床資料比較
共納入528例患者,其中男265例、女263例;中位年齡54(45,59)歲;非典型腺瘤樣增生52例,原位腺癌179例,微浸潤腺癌135例,浸潤性腺癌162例。訓練集和驗證集的臨床資料差異均無統計學意義(P>0.05);見表1。
2.2 非浸潤組和浸潤組的臨床資料比較
浸潤組的年齡、直徑、平均CT值、毛刺征占比、血管集束征占比、空泡征占比、胸膜凹陷征占比、充氣支氣管征占比、CEA和SIRI水平高于非浸潤組,圓形或類圓形占比、Pro-GRP、PMR和PLR水平低于非浸潤組(P<0.05);見表2。
2.3 單發肺pGGN浸潤程度的風險因素
將肺pGGN浸潤程度作為因變量,將表2中指標作為自變量,10折交叉驗證,Lasso回歸分析結果顯示,λ=0.045時模型更簡潔(圖1a),直徑、血管集束征、空泡征、胸膜凹陷征、圓形或類圓形、平均CT值、CEA和PLR與單發肺pGGN浸潤程度有關,系數值分別為0.084、0.403、0.014、0.581、?0.793、0.001、0.722和?0.005(圖1b)。將肺pGGN浸潤程度作為因變量,將直徑、血管集束征、空泡征、胸膜凹陷征、圓形或類圓形、平均CT值、CEA和PLR作為自變量,logistic回歸Forward:LR法分析結果顯示,直徑增加、血管集束征、胸膜凹陷征、平均CT值升高和CEA水平升高是單發肺pGGN浸潤的獨立危險因素,圓形或類圓形、PLR水平升高是單發肺pGGN浸潤的獨立保護因素(P<0.05);見表3。
 圖1
Lasso回歸分析結果
圖1
Lasso回歸分析結果
a:λ取值范圍;b:各因素系數
2.4 單發肺pGGN浸潤的預警模型構建及評價
模型Z為logit(P)=–1.665+0.156×直徑+1.254×血管集束征+1.684×胸膜凹陷征–1.291×圓形或類圓形+0.003×平均CT值+0.959×CEA?0.015×PLR;模型C為logit(P)=–1.085+0.185×直徑+1.329×血管集束征+2.028×胸膜凹陷征–1.256×圓形或類圓形+0.003×平均CT值,模型S為logit(P)=–2.919+1.718×CEA-0.015×PLR。
訓練集中,模型Z的ROC曲線下面積大于模型C(Z=2.125,P=0.034)和模型S(Z=4.973,P<0.001);見圖2a和表4。模型Z、模型C和模型S的校準曲線均圍繞理想曲線變化;見圖2b~d。模型Z的MAE值和MSE值均低于模型C,高于模型S;見表4。
 圖2
模型評價結果
圖2
模型評價結果
訓練集(a:ROC曲線;b:模型Z校準曲線;c:模型C校準曲線;d:模型S校準曲線);驗證集(e:ROC曲線;f:模型Z校準曲線;g:模型C校準曲線;h:模型S校準曲線)
驗證集中,模型Z的ROC曲線下面積大于模型C(Z=2.281,P=0.023)和模型S(Z=2.434,P=0.015);見圖2e和表4。模型Z、模型C和模型S的校準曲線均圍繞理想曲線變化;見圖2f~h。模型Z的MAE值和MSE值均高于模型C和模型S;見表4。
3 討論
3.1 肺pGGN浸潤的風險因素
本研究綜合分析CT定量參數、CT征象、腫瘤標志物和血細胞參數與單發肺pGGN浸潤程度的關系,結果顯示,浸潤組的年齡、直徑、平均CT值、毛刺征占比、血管集束征占比、空泡征占比、胸膜凹陷征占比、充氣支氣管征占比、CEA和SIRI水平高于非浸潤組,圓形或類圓形占比、Pro-GRP、PMR和PLR水平低于非浸潤組,提示上述指標與浸潤性腺癌有關。
目前,已有多數研究[12-14]顯示肺pGGN直徑和平均CT值是判斷其浸潤程度的重要指標,pGGN直徑和平均CT值越大,浸潤風險越高。血管集束征與肺癌細胞浸潤有關,在癌細胞浸潤過程中會釋放促血管生成因子,隨浸潤程度增加血管構形會發生變化,最終血管壁受牽拉影響形成血管集束征象[15]。胸膜凹陷征形成與腫瘤病灶內耗氧量增加有關,當病灶內細胞增殖及遷移等耗氧量增加時,病灶會發生纖維化收縮[16]。血管集束征和胸膜凹陷征常被用于評估肺結節良惡性,近期研究[17-18]顯示二者與肺結節浸潤程度增加有關。此外,還有研究[19-20]顯示肺結節形態與其浸潤程度有關,肺腺癌浸潤前及浸潤初期形態多呈圓形或類圓形,受細胞生長速率和分化等影響,隨其浸潤程度加深,其形態越發不規則。腺體前驅病變和微浸潤腺癌患者的CEA水平低于浸潤性腺癌,隨CEA水平升高,浸潤程度增加[11,21-22]。本研究納入因素維度及個數較多,避免各指標間共線性問題,采用Lasso-logistic回歸篩選浸潤性腺癌的風險因素,結果顯示,直徑增加、血管集束征、胸膜凹陷征、平均CT值升高和CEA水平升高是單發肺pGGN浸潤的獨立危險因素,圓形或類圓形、PLR水平升高是單發肺pGGN浸潤的獨立保護因素,與上述研究結果一致。目前,少有研究分析免疫炎癥指標PLR與單發肺pGGN浸潤程度的關系。萬輝等[11]顯示PLR在腺體前驅病變時就已發生變化,但腺體前驅病變和肺腺癌的PLR水平差異并不顯著。本研究結果提示PLR水平降低與浸潤風險增加有關,還需開展多中心、大樣本研究進一步分析驗證。
3.2 肺pGGN浸潤的模型效能分析
由于肺pGGN浸潤程度存在不確定性,若為浸潤性腺癌,患者預后不良風險增加[23-24]。預先獲知肺pGGN浸潤程度對于患者治療方案制定及預后管理大有裨益。因此,迫切需要精準確定肺pGGN浸潤程度。本研究構建了單純CT模型C(由直徑、血管集束征、胸膜凹陷征、圓形或類圓形和平均CT值構成)、腫瘤標志物和血細胞參數模型S(由CEA和PLR構成)及綜合模型Z(由直徑、血管集束征、胸膜凹陷征、圓形或類圓形、平均CT值、CEA和PLR構成),結果顯示,模型Z的ROC曲線下面積在訓練集和驗證集中均大于模型C和S,提示模型Z相較于模型C及模型S有更高的區分能力。但在訓練集中模型Z的準確度低于模型C,推測其原因是模型Z在不同截斷值下區分浸潤性肺腺癌的整體能力更強,而模型C可能在某個特定截斷值下區分浸潤性肺腺癌的準確率更高。本研究中模型Z、模型C和模型S的校準曲線均圍繞理想曲線變化,提示三模型的預測精準度尚可。訓練集中模型Z的誤差指標MAE值和MSE值均低于模型C,略高于模型S,提示模型Z的預測精準度較模型C高,略低于模型S。在驗證集中模型Z的MAE值和MSE值均高于模型C和模型S,提示模型Z的預測精準度較模型C和模型S低。模型Z在訓練集和驗證集上的表現差異較大的原因可能有以下3點:(1)訓練集和驗證集中pGGN直徑和CEA分布差異導致,盡管訓練集和驗證集的pGGN直徑(P=0.081)和CEA(P=0.060)差異無統計學意義,但二者均是構建模型的重要指標,些許差異仍會導致模型Z的泛化能力降低;(2)訓練集和驗證集的樣本量有一定差異,即便模型Z在訓練集中效能較好,它在驗證集中的泛化能力可能仍會受到樣本量大小的影響,尤其是在面對復雜特征組合時;(3)模型Z在訓練集中某個截斷值下表現較好,但在驗證集中由于數據分布的差異,可能無法在同樣的截斷值下達到最佳性能。
3.3 研究局限性
本研究有一定不足:(1)單中心研究,未增設外部驗證集驗證模型效能;(2)研究入組患者均接受手術切除治療,肺pGGN惡性程度更高,微浸潤腺癌和浸潤性腺癌占比可能較高;(3)模型Z在訓練集和驗證集中表現差異較大,后續還需大樣本研究進一步分析其泛化能力。
綜上所述,由直徑、血管集束征、胸膜凹陷征、圓形或類圓形、平均CT值、癌胚抗原和PLR構建的模型有助于判斷肺pGGN浸潤程度,其效能高于單純CT模型、腫瘤標志物和血細胞參數模型。
利益沖突:無。
作者貢獻:雷沖負責研究設計、數據整理及分析、文章撰寫及修改;徐影、陳瑋、杜金、孫杰和李欣負責數據整理及分析,劉海霞負責研究設計、文章質量評價。