食管癌是一種常見的惡性腫瘤,發病率高且預后差。傳統的治療方式無法為患者帶來遠期預后,術后復發和轉移也是導致患者治療失敗的主要原因。隨著納米醫學的不斷發展,納米顆粒載藥作為一種新型的治療手段,受到了廣泛關注。其中Fe3O4磁性納米粒子因其獨特的超順磁性和生物相容性在治療食管癌的研究中取得了一系列令人振奮的進展。本文就Fe3O4磁性納米載藥系統治療食管癌的相關研究展開論述。
食管癌是一種具有高度侵襲性的惡性腫瘤疾病,患者的生存率較低,預后不佳,5年生存率約15%~25%[1]。據2020年國際癌癥研究機構統計顯示,全球范圍內食管癌的發病率排名第7位,致死率位于第6位[2],嚴重威脅人類的生命健康。而中國更是食管癌的高發地區之一,患者數量占全球食管癌總例數的一半以上[3]。早期食管癌累及黏膜層或黏膜下層,癥狀輕微,故不被重視[4]。患者往往出現明顯吞咽困難或哽咽感時才來就診,此時已錯過最佳治療時間,無法根治性切除。傳統的治療方式以手術、放療、化療為主[5],這些治療手段雖然在一定程度上控制了疾病的發展,但是并不能給患者帶來遠期預后,其生活質量也并未提高,反而治療帶來較為嚴重的毒副作用,最終患者因局部復發和遠處轉移而死亡[6]。因此,食管癌患者迫切需要一種新的治療方式來解決這一難題。
納米技術作為一種微觀尺度上的新技術,自發現以來逐步進入人們的視野并廣泛應用在各個領域。近年來,在醫學領域由納米粒子作為載體的給藥系統逐漸成為腫瘤治療的研究熱點。相比于傳統治療方式,納米技術具有準確靶向病變部位、減少對正常組織的損傷以及提高治療效果的優勢[7]。因此,國內外研究者開發了多種納米藥物載體,如聚合物膠束、脂質體、金屬納米粒子和無機非金屬納米粒子等[8],特別是以Fe3O4磁性納米粒子為代表的金屬氧化物材料,由于自身獨特的超順磁性和生物相容性備受青睞[9-10]。本文將從Fe3O4磁性納米粒子的介紹開始,對該研究在食管癌治療進展的結果進行綜述。
1 Fe3O4磁性納米粒子
納米粒子是指尺寸在1~100 nm間的粒子,因其小粒徑、高比表面積的結構特殊性,在腫瘤組織中具有高滲透長滯留效應(enhanced permeability and retention effect,EPR),從而被動靶向聚集在腫瘤組織中[11-12]。根據此特性,可以將納米粒子作為載體構建納米載藥系統,裝載不同的藥物對腫瘤細胞協同治療。Fe3O4磁性納米粒子是一種磁性無機納米材料,除了具備其他納米材料的特性外,還具有磁導向性、超順磁性和生物相容性[13]。同時,它也是美國食品藥品監督管理局(Food and Drug Administration,FDA)唯一獲批的可生物降解和代謝的磁性材料[14]。這些優點使得Fe3O4磁性納米粒子在藥物遞送、磁共振成像、磁導向熱療等醫學領域具有廣闊的發展前景[15-17]。
雖然Fe3O4磁性納米粒子作為載體具有諸多優勢,但是未加修飾的單體也存在不穩定、易發生聚集和容易被氧化的缺點,為了優化納米粒子的載藥屬性,通常采用表面修飾來提高其穩定性、靶向性以及載藥能力[18]。因其具有較好的水溶性和生物相容性,高分子材料(如殼聚糖、聚乙二醇等)是Fe3O4納米粒子最常見的表面修飾材料[19-20]。Zhang等[21]利用溶膠-凝膠法成功將殼聚糖(chitosan,CS)包裹在Fe3O4納米粒子表面,制備出CS- Fe3O4納米顆粒,并用四甲基偶氮唑鹽比色法(MTT)證實了CS-Fe3O4納米顆粒對腫瘤細胞具有良好的低毒性和生物相容性,結合掃描電子顯微鏡(SEM)圖像顯示,CS能有效地分離納米顆粒,防止聚集。此外,CS表面富含多種官能團,可以與各種材料結合,從而表現出優異的靶向和負載性能。Yuan等[22]利用溶劑熱法制備出聚乙二醇化(polyethylene glycol,PEG)的Fe3O4納米粒子(PEG-Fe3O4),基于MTT試驗顯示,這種粒子對Hela細胞和C6細胞的活力影響較小,同樣提示PEG-Fe3O4有高度的兼容性和安全性。另外,我們的研究[22]發現該粒子在紅外激光的照射下存在光熱效應,也可以作為一種光熱治療劑,能夠有效地殺死癌細胞,這表明Fe3O4磁性納米粒子本身也可以作為一種治療藥物,參與腫瘤的治療。這些高分子材料不僅提高了載體的穩定性,也可以作為藥物或是某些靶點配體的結合位點,從而實現藥物的安全遞送。
2 磁性納米載藥系統的特性
2.1 靶向性
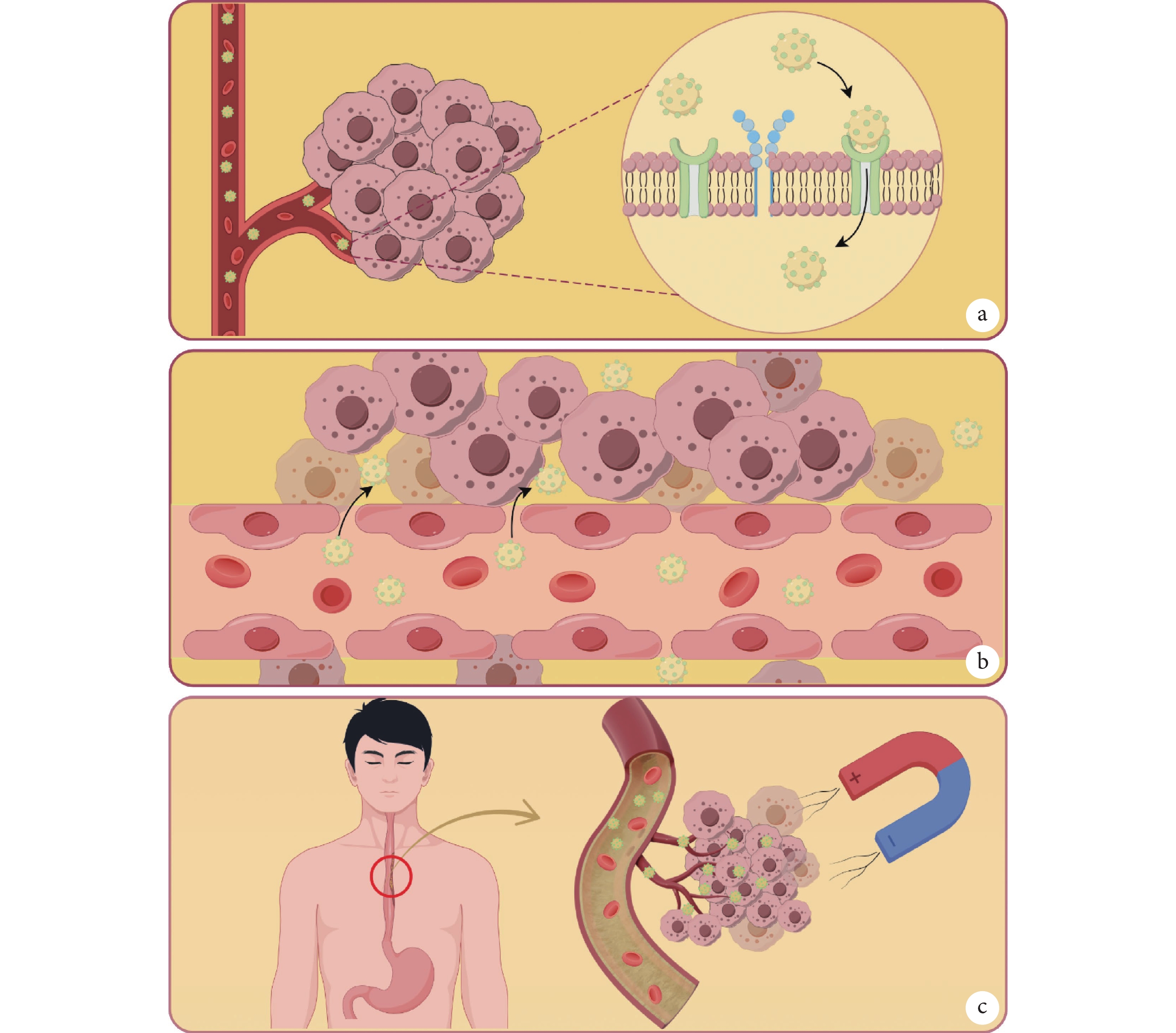
主動靶向:針對腫瘤細胞特異性表達的抗原受體,在Fe3O4納米粒子表面修飾時偶聯相應的配體,通過配體與受體的結合的方式進入腫瘤細胞內,減少正常組織的攝取,特異性識別腫瘤細胞實現主動靶向[23]。例如,先前報道證實的成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)和血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)在食管癌的發生發展中,呈現高表達的狀態[24-25]。針對該受體,由Gai等[26] 將FGFR和VEGFR雙特異性抗體(BisFV)包裹在磁性納米顆粒上,以提高對腫瘤細胞的親和力,從而實現BisFV封裝的納米粒子準確地靶向食管癌細胞,并有效結合FGFR和VEGFR。值得注意的是,此研究還發現由于在腫瘤組織中的聚集性,靶向功能化的納米粒子也可以作為一種造影劑,提高早期食管癌診斷的準確性與靈敏性。此外,Karamipour等[27]還開發了一款葉酸偶聯鍍金氧化鐵納米顆粒作為腫瘤靶向劑,這種納米顆粒可以通過與葉酸受體結合的方式將藥物精準靶向到葉酸受體過度表達的腫瘤細胞,以實現高效的藥物傳遞(圖1a)。
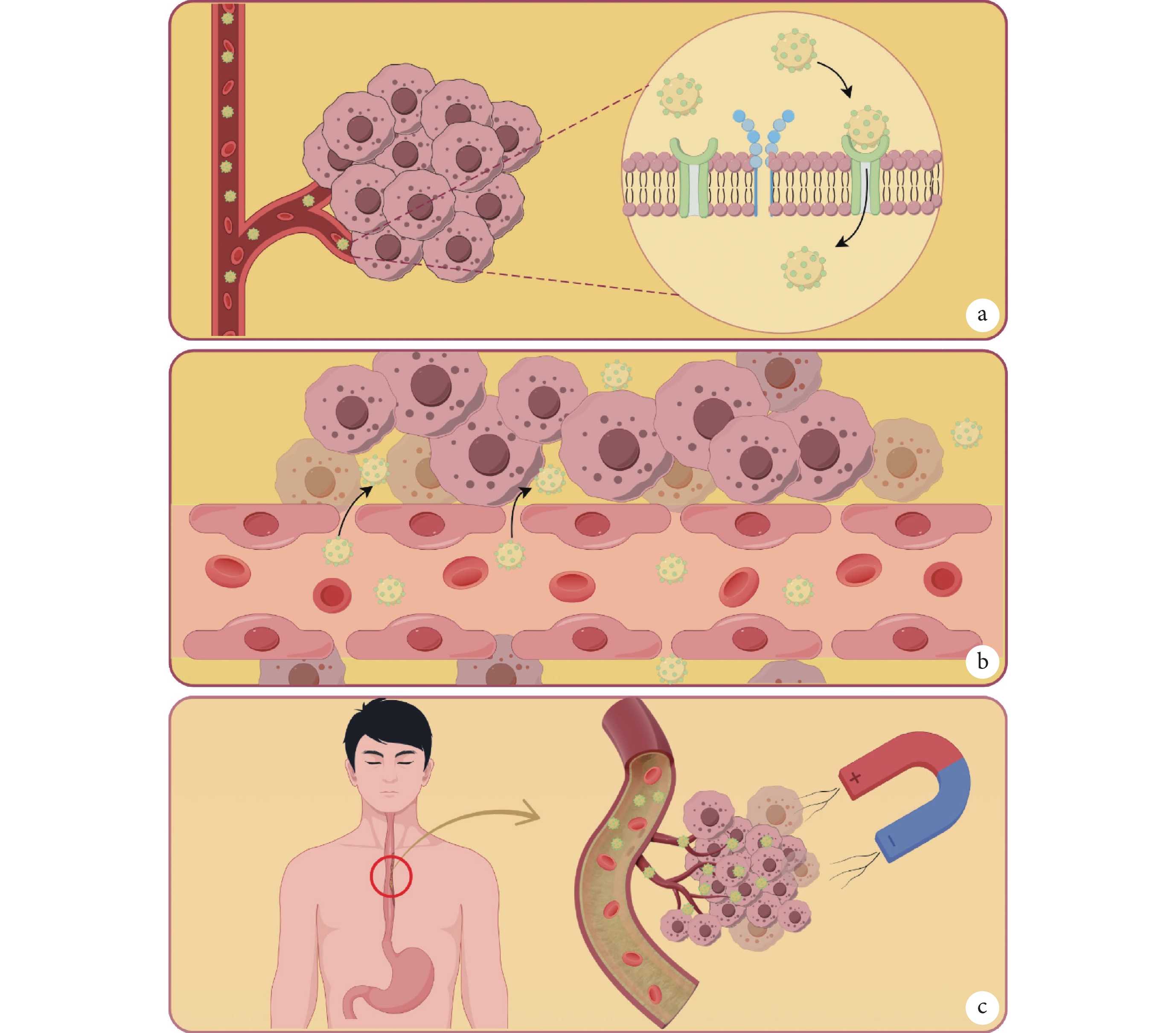 圖1
Fe3O4磁性納米粒子的靶向性
圖1
Fe3O4磁性納米粒子的靶向性
a:磁性納米粒子表面修飾配體與腫瘤細胞表面特異性表達受體相結,實現主動靶向;b:腫瘤組織內部新生血管排列松散存在EPR效應,使得納米粒子可以被動靶向在腫瘤內部;c:磁性納米粒子具有磁導向性,經靜脈注射后可以在外加磁場的引導下實現物理靶向腫瘤組織;合本圖由Figdraw繪制
被動靶向:所有納米藥物均具有被動靶向的作用效果,由于腫瘤細胞生長迅速需氧量大,促使腫瘤組織內部新生許多血管,其新生血管與正常血管差異較大。新生血管形狀不規則,血管內皮細胞排列松散、通透性大且淋巴回流缺失[28]。正是這種特殊的組織結構導致10~300 nm的藥物可以長時間滯留在腫瘤內部,能在脈管系統不健全的腫瘤組織中存在EPR效應,以此實現被動靶向[29]。例如,第一個獲得FDA批準的納米藥物Doxil,由于EPR效應的存在,Doxil能長時間滯留在腫瘤組織中并釋放阿霉素,在局部保留了較高的藥物濃度[30]。也有學者[31]認為,通過改良納米藥物,如尺寸、表面電荷量、理化性質以及腫瘤細胞的親和力這些關鍵因素,可以調節納米藥物在腫瘤組織中的 EPR效應,以此實現增強藥物遞送的效果(圖1b)。
物理靶向:由于Fe3O4納米粒子自身優異的超順磁性,作為載體可在外部磁場的引導下,向腫瘤組織聚集定向到靶組織,實現外加磁場的物理靶向[32]。Guo等[33]將不同尺寸的Fe3O4磁性納米粒子分別懸浮在磷酸緩沖液和粘度近似血液的溶液中,使兩種溶液均勻變成棕色。隨著一側外加磁場的時間增加,粒徑越大的粒子在粘度低的溶液中向磁體方向聚集速度越快,溶液顏色從棕色逐漸變為無色。這表明磁性納米粒子在外部磁場的引導下向特定部位聚集的能力增強,其結果也證實了大粒徑的磁性顆粒會表現出更好的磁響應性(圖1c)。
2.2 釋控性
磁性納米載藥系統的釋控性是指將納米粒子制備為一種刺激響應性載體,這種載體聚集在腫瘤組織內部時會根據外界環境特定的變化,像是pH和溫度的變化能夠敏感地做出反應,從而釋放藥物,實現精準的藥物治療[34]。如Wu等[35]設計的新型偶氮功能化磁性多功能納米顆粒,將阿霉素偶聯在偶氮功能化的粒子表面,利用磁性納米粒子的光熱效應,經過紅外照射使粒子產熱,達到偶氮連接體斷裂溫度,控制阿霉素在特定位置釋放。同樣,Aliabadi等[36]介紹了一種pH響應性磁性納米復合材料,該材料負載5-氟尿嘧啶(5-Fu)并在酸性環境下(pH 5.8)可以快速釋放藥物,釋放量高達91.1%。磁性納米載藥系統的釋控性使得藥物可以更加準確地靶向病灶,減少對健康組織損傷的同時,增加了局部的藥物濃度。
2.3 產熱性
在特定條件下磁性納米粒子也會表現出獨特的熱效應,例如位于交變磁場中的Fe3O4納米粒子能夠吸收磁能轉換成熱能,相關機制主要由布朗弛豫和奈爾弛豫所決定。簡單來說,即磁性納米顆粒在交變磁場的影響下發生微觀運動或磁性排列的改變,導致粒子相互之間摩擦和碰撞從而產生熱量,以此達到局部溫度升高殺傷腫瘤細胞的效果[37]。或是采用激光照射的方法,因其自身的光熱轉換效應,也可以產生足夠的熱量[38]。王煦漫等[39]采用共沉淀法合成的Fe3O4磁性納米粒子在交變磁場中能夠產生顯著的熱量,原因是這些磁性微粒在磁場中發生了自身的磁損耗。此外,研究還證實磁性納米顆粒的產熱能力與磁場強度相關,而與粒子濃度和分散介質的粘度無關。另一項研究[40]顯示,置于塑料薄膜袋中的Fe3O4磁性納米粒子粉末暴露在655、671和808 nm的激光下時,大約20 s后塑料薄膜會被產熱的粉末所破壞。這些觀察結果表明Fe3O4磁性納米粒子具有很強的熱效應,可能為腫瘤的熱療提供新的思路和方法。
2.4 安全性
作為FDA批準的生物材料,Fe3O4磁性納米粒子具有出色的生物相容性和安全性,適用于臨床轉化[41]。該粒子在體內的分布主要取決于其表面修飾、粒徑和外加磁場的作用[42]。通常情況下,這些納米顆粒會被單核巨噬細胞攝取,然后在肝臟和脾臟中積聚,并最終通過肝臟、脾臟和腎臟等多個器官代謝排出體外[43]。相關動物實驗研究[44-45]表明,小粒徑的顆粒更容易被清除且清除速度更快,而大粒徑的顆粒雖然更容易積累但最終仍會被清除,只有在極高劑量(500 mg/kg)時才會導致不良積累,引發血液毒性和肝脾的病理變化。此外,磁性納米粒子經過表面修飾后,能夠減少被單核巨噬細胞系統吞噬的情況,延長在體內的循環時間,從而有效地在腫瘤或特定區域積累[46]。在體內,Fe3O4被認為具有類似于鐵蛋白代謝的生物降解機制,粒子被巨噬細胞吞噬后可以通過溶酶體分解成鐵離子,然后形成轉鐵蛋白在體內循環,為各種組織提供鐵原料,過量的鐵離子也可以通過尿液或膽汁排出體外,對身體的影響相對較小[47-48]。
基于以上特性,將藥物加載到Fe3O4磁性納米粒子上,并使用刺激響應物質進行封閉,再覆蓋高分子材料和靶向配體,可以實現在外界磁場和靶頭的引導下,精準靶向癌細胞并在特定環境中釋放藥物。同時,載體自身的產熱性也可以協同治療腫瘤細胞。Fe3O4磁性納米粒子作為載體的載藥系統集靶向、控制以及治療于一體,憑借高效低毒的優勢,為腫瘤患者帶來了新的希望。
3 磁性納米載藥系統在食管癌治療中的應用
磁性納米載藥系統是將藥物通過納米粒子的方式輸送到癌細胞部位,利用外界環境或是靶頭修飾來控制藥物的釋放和定位,從而達到更精準的治療效果。白細胞分化抗原簇第44號(cluster of differentiation 44,CD44)是腫瘤細胞表面特異性表達的透明質酸(hyaluronan,HA)受體[49],已有諸多實驗[50-51]證實,HA修飾的納米藥物可以改善藥物的遞送效果,有效辨別健康組織與惡性組織間。另有研究[52-53]發現,淋巴管內皮細胞透明質酸受體-1(lymphatic vessel endothelial hyaluronan receptor-1,LYVE-1)在已經發生淋巴轉移的腫瘤組織中,呈現出高表達狀態。因此,由腫瘤表面CD44和淋巴內皮LYVE-1介導的胞吞作用攝取HA,在藥物遞送過程中起到至關重要的作用。對于發生淋巴轉移的食管癌患者,韓松辰[54]認為改良的介孔Fe3O4磁性納米粒子,經過表面HA修飾后,在磁導向和靶頭的介導下,不僅增加了攜帶抗腫瘤藥物的能力和靶向性,還實現對淋巴轉移的食管癌細胞圍追堵截,有效降低了腫瘤轉移和復發的風險。
研究[55]發現,當腫瘤組織局部溫度上升至42℃時便會停止生長,而健康組織卻可以耐受這種高溫不受影響。也有學者[56]認為,在40℃~44℃的范圍內可以消滅任何腫瘤細胞,但是溫度超過45℃時,則會對正常組織造成不可逆轉的損傷。腫瘤的熱療是一種通過增加局部溫度來殺滅惡性腫瘤細胞的治療方法,已被證實對晚期食管癌、胃癌和乳腺癌等惡性腫瘤疾病有效[57]。腫瘤熱療不僅創傷小、具有更好的安全性,而且與放化療聯合使用時能夠起到協同增敏作用[58]。既往研究[59]顯示,熱療可以提升腫瘤細胞對放療的敏感性,同時還能顯著增強化療藥物的抗癌效果。Fe3O4磁性納米粒子展現出優異的產熱性能,因此在食管癌的磁感應熱療或是光熱治療中具有巨大潛力。
Chu等[40]進行的Fe3O4磁性納米粒子體內體外光熱實驗顯示,在808 nm的激光照射下,能明顯抑制小鼠食管腫瘤的生長,表面功能化的納米顆粒被Eca-109細胞(人食管癌細胞)內吞且經激光照射20 min后,細胞被破環或是殺死,通過透射電子顯微鏡(TEM)圖像可以觀察到Eca-109細胞的細胞器結構變得模糊或消失,核膜遭受破壞。同樣,Chen等[60]開發了一款由Fe3O4、聚多巴胺(polydopamine,PDA)和10-羥基喜樹堿(hydroxycamptothecin,HCPT)組成的Fe3O4@PDA-HCPT磁性納米載藥系統,在激光的照射下,該系統釋放的熱量不僅達到了對食管癌細胞的殺傷作用,還通過鐵離子的芬頓反應誘導腫瘤細胞死亡,實現了化療、熱療以及鐵死亡治療的集一體的三重療法。路新麗等[61]使用浸漬法,成功將三氧化二砷(As2O3)附著在錳鋅鐵氧體(Mn0.5Zn0.5Fe2O4)上構成了磁性納米載藥系統。從實驗結果來看,吸附的抗腫瘤藥物As2O3可以在腫瘤組織周圍保持一定濃度,達到動態平衡的狀態,同時在外界磁場的影響下,復合材料可以吸收電磁波產生熱量,從而殺死Eca-109細胞,實現熱療和藥物的聯合治療并取得顯著的治療效果。
4 磁性納米載藥系統在食管癌治療中的優勢和挑戰
這種復合形成的磁性納米載藥系統在治療食管癌方面具有巨大的潛力,不僅可以精準靶向癌細胞,提高療效,減少副作用,而且無創。具體體現在:首先,磁性納米載藥系統具有高度的靶向性,通過外界磁場或是自身修飾,可以將藥物直接靶向運送到病變部位,減少藥物在體內的分布范圍,提高治療效果。其次,磁性納米載藥系統可以改善藥物的溶解度,能克服抗癌藥物水溶性差的缺點,提高了藥物的生物利用度。最后,因為磁性納米材料本身具有的磁響應性,可以實現腫瘤熱療和造影的結合,形成食管癌的多功能診療一體化。
然而,由于動物模型與癌癥患者之間存有不同之處,磁性納米載藥系統在臨床中的實際應用仍然面臨一些挑戰,有以下幾點原因:(1)磁性納米材料的制備和修飾過程復雜、成本高,且尺寸性能不易于精準把控,無法做到低價量產;(2)Fe3O4磁性納米粒子的載藥量偏低,無法保持在原有特性的基礎上實現高負載;(3)磁性納米載藥系統在血液中運輸的穩定性和代謝途徑研究不充分,臨床應用的潛在毒性也還需要持續的研究。
5 總結及展望
本文介紹了磁性納米載藥系統的特性,以及基于這些特性國內外研究學者所構建的治療食管癌的載藥系統。這些研究表明,磁性納米顆粒為腫瘤的治療提供了多種可能性,通過靶向磁性藥物在病變部位的積累,可以增加治療效果,減少全身治療的毒副作用,協同熱療以及鐵死亡治療,實現對腫瘤細胞的多重打擊。
在磁性納米載藥系統的研究領域中,科研人員致力于探索更有效的功能化修飾方法,以提高藥物的穩定性和靶向輸送效率。此外,也不斷探討如何優化藥物的負載能力和釋放機制,確保高負載量的同時實現藥物在腫瘤內部的精準釋放。隨著研究的不斷深入,藥物遞送與多種治療方式結合的綜合治療策略以及納米顆粒的生產成本和規模化生產也將成為接下來的研究重點。相信在未來,隨著納米技術的創新和改進,目前所遇到的挑戰終究會被克服,這種新型治療方式有望為癌癥患者帶來新的希望和機會。
食管癌是一種具有高度侵襲性的惡性腫瘤疾病,患者的生存率較低,預后不佳,5年生存率約15%~25%[1]。據2020年國際癌癥研究機構統計顯示,全球范圍內食管癌的發病率排名第7位,致死率位于第6位[2],嚴重威脅人類的生命健康。而中國更是食管癌的高發地區之一,患者數量占全球食管癌總例數的一半以上[3]。早期食管癌累及黏膜層或黏膜下層,癥狀輕微,故不被重視[4]。患者往往出現明顯吞咽困難或哽咽感時才來就診,此時已錯過最佳治療時間,無法根治性切除。傳統的治療方式以手術、放療、化療為主[5],這些治療手段雖然在一定程度上控制了疾病的發展,但是并不能給患者帶來遠期預后,其生活質量也并未提高,反而治療帶來較為嚴重的毒副作用,最終患者因局部復發和遠處轉移而死亡[6]。因此,食管癌患者迫切需要一種新的治療方式來解決這一難題。
納米技術作為一種微觀尺度上的新技術,自發現以來逐步進入人們的視野并廣泛應用在各個領域。近年來,在醫學領域由納米粒子作為載體的給藥系統逐漸成為腫瘤治療的研究熱點。相比于傳統治療方式,納米技術具有準確靶向病變部位、減少對正常組織的損傷以及提高治療效果的優勢[7]。因此,國內外研究者開發了多種納米藥物載體,如聚合物膠束、脂質體、金屬納米粒子和無機非金屬納米粒子等[8],特別是以Fe3O4磁性納米粒子為代表的金屬氧化物材料,由于自身獨特的超順磁性和生物相容性備受青睞[9-10]。本文將從Fe3O4磁性納米粒子的介紹開始,對該研究在食管癌治療進展的結果進行綜述。
1 Fe3O4磁性納米粒子
納米粒子是指尺寸在1~100 nm間的粒子,因其小粒徑、高比表面積的結構特殊性,在腫瘤組織中具有高滲透長滯留效應(enhanced permeability and retention effect,EPR),從而被動靶向聚集在腫瘤組織中[11-12]。根據此特性,可以將納米粒子作為載體構建納米載藥系統,裝載不同的藥物對腫瘤細胞協同治療。Fe3O4磁性納米粒子是一種磁性無機納米材料,除了具備其他納米材料的特性外,還具有磁導向性、超順磁性和生物相容性[13]。同時,它也是美國食品藥品監督管理局(Food and Drug Administration,FDA)唯一獲批的可生物降解和代謝的磁性材料[14]。這些優點使得Fe3O4磁性納米粒子在藥物遞送、磁共振成像、磁導向熱療等醫學領域具有廣闊的發展前景[15-17]。
雖然Fe3O4磁性納米粒子作為載體具有諸多優勢,但是未加修飾的單體也存在不穩定、易發生聚集和容易被氧化的缺點,為了優化納米粒子的載藥屬性,通常采用表面修飾來提高其穩定性、靶向性以及載藥能力[18]。因其具有較好的水溶性和生物相容性,高分子材料(如殼聚糖、聚乙二醇等)是Fe3O4納米粒子最常見的表面修飾材料[19-20]。Zhang等[21]利用溶膠-凝膠法成功將殼聚糖(chitosan,CS)包裹在Fe3O4納米粒子表面,制備出CS- Fe3O4納米顆粒,并用四甲基偶氮唑鹽比色法(MTT)證實了CS-Fe3O4納米顆粒對腫瘤細胞具有良好的低毒性和生物相容性,結合掃描電子顯微鏡(SEM)圖像顯示,CS能有效地分離納米顆粒,防止聚集。此外,CS表面富含多種官能團,可以與各種材料結合,從而表現出優異的靶向和負載性能。Yuan等[22]利用溶劑熱法制備出聚乙二醇化(polyethylene glycol,PEG)的Fe3O4納米粒子(PEG-Fe3O4),基于MTT試驗顯示,這種粒子對Hela細胞和C6細胞的活力影響較小,同樣提示PEG-Fe3O4有高度的兼容性和安全性。另外,我們的研究[22]發現該粒子在紅外激光的照射下存在光熱效應,也可以作為一種光熱治療劑,能夠有效地殺死癌細胞,這表明Fe3O4磁性納米粒子本身也可以作為一種治療藥物,參與腫瘤的治療。這些高分子材料不僅提高了載體的穩定性,也可以作為藥物或是某些靶點配體的結合位點,從而實現藥物的安全遞送。
2 磁性納米載藥系統的特性
2.1 靶向性
主動靶向:針對腫瘤細胞特異性表達的抗原受體,在Fe3O4納米粒子表面修飾時偶聯相應的配體,通過配體與受體的結合的方式進入腫瘤細胞內,減少正常組織的攝取,特異性識別腫瘤細胞實現主動靶向[23]。例如,先前報道證實的成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)和血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)在食管癌的發生發展中,呈現高表達的狀態[24-25]。針對該受體,由Gai等[26] 將FGFR和VEGFR雙特異性抗體(BisFV)包裹在磁性納米顆粒上,以提高對腫瘤細胞的親和力,從而實現BisFV封裝的納米粒子準確地靶向食管癌細胞,并有效結合FGFR和VEGFR。值得注意的是,此研究還發現由于在腫瘤組織中的聚集性,靶向功能化的納米粒子也可以作為一種造影劑,提高早期食管癌診斷的準確性與靈敏性。此外,Karamipour等[27]還開發了一款葉酸偶聯鍍金氧化鐵納米顆粒作為腫瘤靶向劑,這種納米顆粒可以通過與葉酸受體結合的方式將藥物精準靶向到葉酸受體過度表達的腫瘤細胞,以實現高效的藥物傳遞(圖1a)。
 圖1
Fe3O4磁性納米粒子的靶向性
圖1
Fe3O4磁性納米粒子的靶向性
a:磁性納米粒子表面修飾配體與腫瘤細胞表面特異性表達受體相結,實現主動靶向;b:腫瘤組織內部新生血管排列松散存在EPR效應,使得納米粒子可以被動靶向在腫瘤內部;c:磁性納米粒子具有磁導向性,經靜脈注射后可以在外加磁場的引導下實現物理靶向腫瘤組織;合本圖由Figdraw繪制
被動靶向:所有納米藥物均具有被動靶向的作用效果,由于腫瘤細胞生長迅速需氧量大,促使腫瘤組織內部新生許多血管,其新生血管與正常血管差異較大。新生血管形狀不規則,血管內皮細胞排列松散、通透性大且淋巴回流缺失[28]。正是這種特殊的組織結構導致10~300 nm的藥物可以長時間滯留在腫瘤內部,能在脈管系統不健全的腫瘤組織中存在EPR效應,以此實現被動靶向[29]。例如,第一個獲得FDA批準的納米藥物Doxil,由于EPR效應的存在,Doxil能長時間滯留在腫瘤組織中并釋放阿霉素,在局部保留了較高的藥物濃度[30]。也有學者[31]認為,通過改良納米藥物,如尺寸、表面電荷量、理化性質以及腫瘤細胞的親和力這些關鍵因素,可以調節納米藥物在腫瘤組織中的 EPR效應,以此實現增強藥物遞送的效果(圖1b)。
物理靶向:由于Fe3O4納米粒子自身優異的超順磁性,作為載體可在外部磁場的引導下,向腫瘤組織聚集定向到靶組織,實現外加磁場的物理靶向[32]。Guo等[33]將不同尺寸的Fe3O4磁性納米粒子分別懸浮在磷酸緩沖液和粘度近似血液的溶液中,使兩種溶液均勻變成棕色。隨著一側外加磁場的時間增加,粒徑越大的粒子在粘度低的溶液中向磁體方向聚集速度越快,溶液顏色從棕色逐漸變為無色。這表明磁性納米粒子在外部磁場的引導下向特定部位聚集的能力增強,其結果也證實了大粒徑的磁性顆粒會表現出更好的磁響應性(圖1c)。
2.2 釋控性
磁性納米載藥系統的釋控性是指將納米粒子制備為一種刺激響應性載體,這種載體聚集在腫瘤組織內部時會根據外界環境特定的變化,像是pH和溫度的變化能夠敏感地做出反應,從而釋放藥物,實現精準的藥物治療[34]。如Wu等[35]設計的新型偶氮功能化磁性多功能納米顆粒,將阿霉素偶聯在偶氮功能化的粒子表面,利用磁性納米粒子的光熱效應,經過紅外照射使粒子產熱,達到偶氮連接體斷裂溫度,控制阿霉素在特定位置釋放。同樣,Aliabadi等[36]介紹了一種pH響應性磁性納米復合材料,該材料負載5-氟尿嘧啶(5-Fu)并在酸性環境下(pH 5.8)可以快速釋放藥物,釋放量高達91.1%。磁性納米載藥系統的釋控性使得藥物可以更加準確地靶向病灶,減少對健康組織損傷的同時,增加了局部的藥物濃度。
2.3 產熱性
在特定條件下磁性納米粒子也會表現出獨特的熱效應,例如位于交變磁場中的Fe3O4納米粒子能夠吸收磁能轉換成熱能,相關機制主要由布朗弛豫和奈爾弛豫所決定。簡單來說,即磁性納米顆粒在交變磁場的影響下發生微觀運動或磁性排列的改變,導致粒子相互之間摩擦和碰撞從而產生熱量,以此達到局部溫度升高殺傷腫瘤細胞的效果[37]。或是采用激光照射的方法,因其自身的光熱轉換效應,也可以產生足夠的熱量[38]。王煦漫等[39]采用共沉淀法合成的Fe3O4磁性納米粒子在交變磁場中能夠產生顯著的熱量,原因是這些磁性微粒在磁場中發生了自身的磁損耗。此外,研究還證實磁性納米顆粒的產熱能力與磁場強度相關,而與粒子濃度和分散介質的粘度無關。另一項研究[40]顯示,置于塑料薄膜袋中的Fe3O4磁性納米粒子粉末暴露在655、671和808 nm的激光下時,大約20 s后塑料薄膜會被產熱的粉末所破壞。這些觀察結果表明Fe3O4磁性納米粒子具有很強的熱效應,可能為腫瘤的熱療提供新的思路和方法。
2.4 安全性
作為FDA批準的生物材料,Fe3O4磁性納米粒子具有出色的生物相容性和安全性,適用于臨床轉化[41]。該粒子在體內的分布主要取決于其表面修飾、粒徑和外加磁場的作用[42]。通常情況下,這些納米顆粒會被單核巨噬細胞攝取,然后在肝臟和脾臟中積聚,并最終通過肝臟、脾臟和腎臟等多個器官代謝排出體外[43]。相關動物實驗研究[44-45]表明,小粒徑的顆粒更容易被清除且清除速度更快,而大粒徑的顆粒雖然更容易積累但最終仍會被清除,只有在極高劑量(500 mg/kg)時才會導致不良積累,引發血液毒性和肝脾的病理變化。此外,磁性納米粒子經過表面修飾后,能夠減少被單核巨噬細胞系統吞噬的情況,延長在體內的循環時間,從而有效地在腫瘤或特定區域積累[46]。在體內,Fe3O4被認為具有類似于鐵蛋白代謝的生物降解機制,粒子被巨噬細胞吞噬后可以通過溶酶體分解成鐵離子,然后形成轉鐵蛋白在體內循環,為各種組織提供鐵原料,過量的鐵離子也可以通過尿液或膽汁排出體外,對身體的影響相對較小[47-48]。
基于以上特性,將藥物加載到Fe3O4磁性納米粒子上,并使用刺激響應物質進行封閉,再覆蓋高分子材料和靶向配體,可以實現在外界磁場和靶頭的引導下,精準靶向癌細胞并在特定環境中釋放藥物。同時,載體自身的產熱性也可以協同治療腫瘤細胞。Fe3O4磁性納米粒子作為載體的載藥系統集靶向、控制以及治療于一體,憑借高效低毒的優勢,為腫瘤患者帶來了新的希望。
3 磁性納米載藥系統在食管癌治療中的應用
磁性納米載藥系統是將藥物通過納米粒子的方式輸送到癌細胞部位,利用外界環境或是靶頭修飾來控制藥物的釋放和定位,從而達到更精準的治療效果。白細胞分化抗原簇第44號(cluster of differentiation 44,CD44)是腫瘤細胞表面特異性表達的透明質酸(hyaluronan,HA)受體[49],已有諸多實驗[50-51]證實,HA修飾的納米藥物可以改善藥物的遞送效果,有效辨別健康組織與惡性組織間。另有研究[52-53]發現,淋巴管內皮細胞透明質酸受體-1(lymphatic vessel endothelial hyaluronan receptor-1,LYVE-1)在已經發生淋巴轉移的腫瘤組織中,呈現出高表達狀態。因此,由腫瘤表面CD44和淋巴內皮LYVE-1介導的胞吞作用攝取HA,在藥物遞送過程中起到至關重要的作用。對于發生淋巴轉移的食管癌患者,韓松辰[54]認為改良的介孔Fe3O4磁性納米粒子,經過表面HA修飾后,在磁導向和靶頭的介導下,不僅增加了攜帶抗腫瘤藥物的能力和靶向性,還實現對淋巴轉移的食管癌細胞圍追堵截,有效降低了腫瘤轉移和復發的風險。
研究[55]發現,當腫瘤組織局部溫度上升至42℃時便會停止生長,而健康組織卻可以耐受這種高溫不受影響。也有學者[56]認為,在40℃~44℃的范圍內可以消滅任何腫瘤細胞,但是溫度超過45℃時,則會對正常組織造成不可逆轉的損傷。腫瘤的熱療是一種通過增加局部溫度來殺滅惡性腫瘤細胞的治療方法,已被證實對晚期食管癌、胃癌和乳腺癌等惡性腫瘤疾病有效[57]。腫瘤熱療不僅創傷小、具有更好的安全性,而且與放化療聯合使用時能夠起到協同增敏作用[58]。既往研究[59]顯示,熱療可以提升腫瘤細胞對放療的敏感性,同時還能顯著增強化療藥物的抗癌效果。Fe3O4磁性納米粒子展現出優異的產熱性能,因此在食管癌的磁感應熱療或是光熱治療中具有巨大潛力。
Chu等[40]進行的Fe3O4磁性納米粒子體內體外光熱實驗顯示,在808 nm的激光照射下,能明顯抑制小鼠食管腫瘤的生長,表面功能化的納米顆粒被Eca-109細胞(人食管癌細胞)內吞且經激光照射20 min后,細胞被破環或是殺死,通過透射電子顯微鏡(TEM)圖像可以觀察到Eca-109細胞的細胞器結構變得模糊或消失,核膜遭受破壞。同樣,Chen等[60]開發了一款由Fe3O4、聚多巴胺(polydopamine,PDA)和10-羥基喜樹堿(hydroxycamptothecin,HCPT)組成的Fe3O4@PDA-HCPT磁性納米載藥系統,在激光的照射下,該系統釋放的熱量不僅達到了對食管癌細胞的殺傷作用,還通過鐵離子的芬頓反應誘導腫瘤細胞死亡,實現了化療、熱療以及鐵死亡治療的集一體的三重療法。路新麗等[61]使用浸漬法,成功將三氧化二砷(As2O3)附著在錳鋅鐵氧體(Mn0.5Zn0.5Fe2O4)上構成了磁性納米載藥系統。從實驗結果來看,吸附的抗腫瘤藥物As2O3可以在腫瘤組織周圍保持一定濃度,達到動態平衡的狀態,同時在外界磁場的影響下,復合材料可以吸收電磁波產生熱量,從而殺死Eca-109細胞,實現熱療和藥物的聯合治療并取得顯著的治療效果。
4 磁性納米載藥系統在食管癌治療中的優勢和挑戰
這種復合形成的磁性納米載藥系統在治療食管癌方面具有巨大的潛力,不僅可以精準靶向癌細胞,提高療效,減少副作用,而且無創。具體體現在:首先,磁性納米載藥系統具有高度的靶向性,通過外界磁場或是自身修飾,可以將藥物直接靶向運送到病變部位,減少藥物在體內的分布范圍,提高治療效果。其次,磁性納米載藥系統可以改善藥物的溶解度,能克服抗癌藥物水溶性差的缺點,提高了藥物的生物利用度。最后,因為磁性納米材料本身具有的磁響應性,可以實現腫瘤熱療和造影的結合,形成食管癌的多功能診療一體化。
然而,由于動物模型與癌癥患者之間存有不同之處,磁性納米載藥系統在臨床中的實際應用仍然面臨一些挑戰,有以下幾點原因:(1)磁性納米材料的制備和修飾過程復雜、成本高,且尺寸性能不易于精準把控,無法做到低價量產;(2)Fe3O4磁性納米粒子的載藥量偏低,無法保持在原有特性的基礎上實現高負載;(3)磁性納米載藥系統在血液中運輸的穩定性和代謝途徑研究不充分,臨床應用的潛在毒性也還需要持續的研究。
5 總結及展望
本文介紹了磁性納米載藥系統的特性,以及基于這些特性國內外研究學者所構建的治療食管癌的載藥系統。這些研究表明,磁性納米顆粒為腫瘤的治療提供了多種可能性,通過靶向磁性藥物在病變部位的積累,可以增加治療效果,減少全身治療的毒副作用,協同熱療以及鐵死亡治療,實現對腫瘤細胞的多重打擊。
在磁性納米載藥系統的研究領域中,科研人員致力于探索更有效的功能化修飾方法,以提高藥物的穩定性和靶向輸送效率。此外,也不斷探討如何優化藥物的負載能力和釋放機制,確保高負載量的同時實現藥物在腫瘤內部的精準釋放。隨著研究的不斷深入,藥物遞送與多種治療方式結合的綜合治療策略以及納米顆粒的生產成本和規模化生產也將成為接下來的研究重點。相信在未來,隨著納米技術的創新和改進,目前所遇到的挑戰終究會被克服,這種新型治療方式有望為癌癥患者帶來新的希望和機會。