隨著醫療技術的發展,目前主動脈疾病的檢出率顯著上升[1-2]。在多數的開放主動脈手術中需采用大直徑人工血管移植物置換病變的主動脈[3-5]。為滿足治療目的,大直徑人工血管要求具有良好的生物相容性、尺寸可調性、順應性、結構穩定性、抗菌抗感染性、力學性能及抗血栓形成能力,并且還需具備易于縫合,免疫反應低等特點[6-7]。
目前臨床上所應用的大直徑人工血管,聚對苯二甲酸乙二醇酯(polyethylene terephthalate,PET)或聚四氟乙烯(polytetrafluoroethylene,PTFE)是其主要材料。該類大直徑人工血管的出現緩解了主動脈疾病手術治療中,主動脈供體/替代品缺乏的窘況[8]。但在臨床應用中卻存在一定的限制性。首先臨床上所應用的大直徑人工血管,其主要知識產權多屬于歐美國家,我國尚缺乏自主研發的相應基礎[9]。并且,雖然PET和PTFE所制備的人工血管使用廣泛,但人工血管的生物力學性能并不能與自體主動脈完美匹配[10]。此外,此類大直徑人工血管內層缺乏血管內皮細胞,組織相容性有待改進,易導致如破裂、移位、內漏、感染和再狹窄等移植物并發癥風險[7,11-12]。
基于目前大直徑人工血管存在的問題,本研究選取左旋聚乳酸(levorotatory polylactic acid,PLLA)和聚己內酯(polycaprolactone,PCL)的共混物作為制備大直徑人工血管的原材料,擬設計一種基于逐層靜電紡絲和超聲擴孔處理的復合工藝,旨在得到一種與天然血管孔徑梯度結構相似、孔徑適宜的人工血管,并可誘導人工血管早期內皮細胞形成。通過早期動物實驗評價此類人工血管設計的可行性。
1 材料與方法
1.1 仿天然血管結構大直徑人工血管制備方法
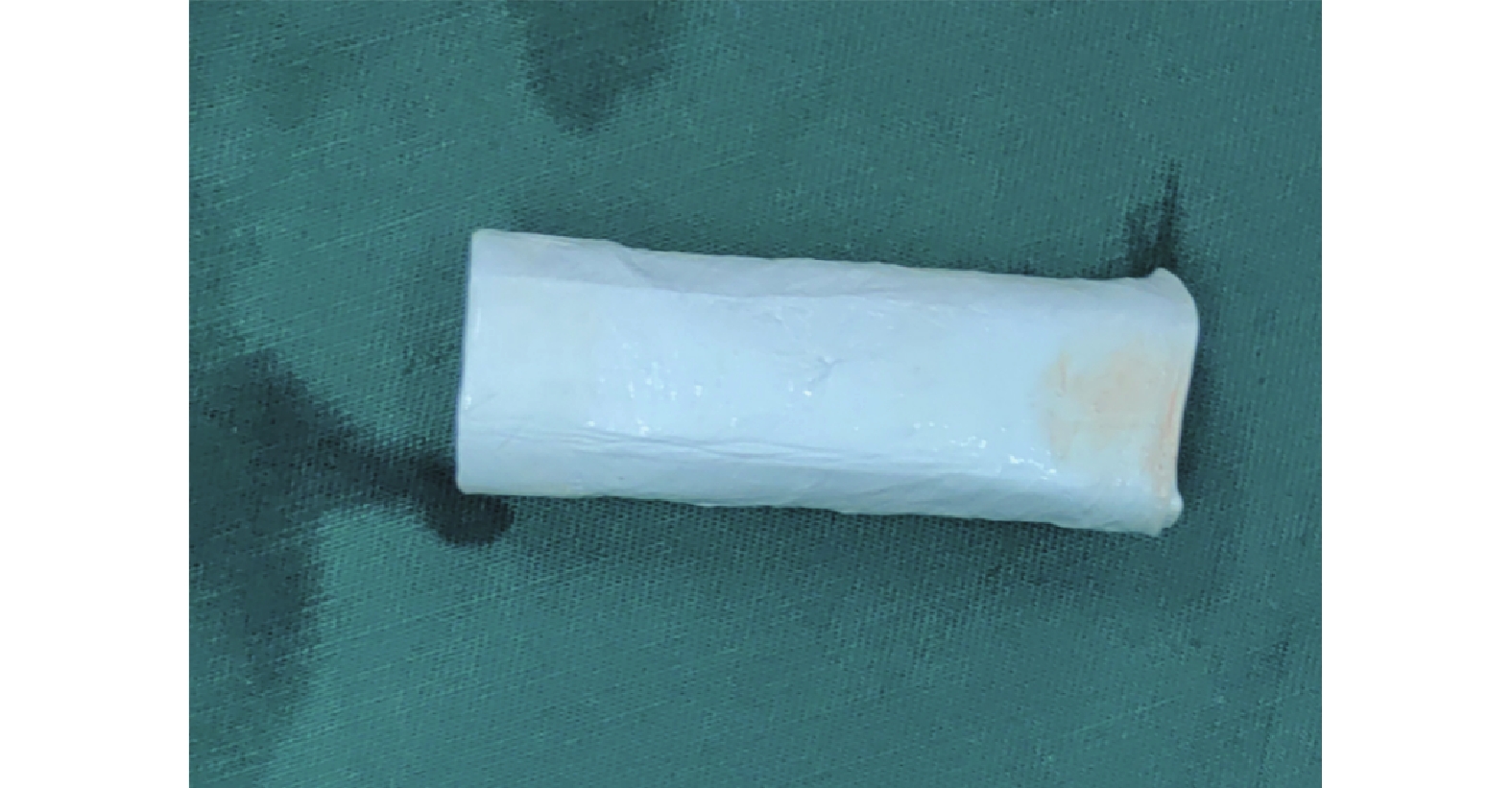
為了制備具有理想機械特性的人工血管,以PLLA和PCL為原料,通過靜電紡絲工藝,以不同直徑芯軸為靜電紡絲收集裝置構建仿天然結構人工血管材料(圖1)。
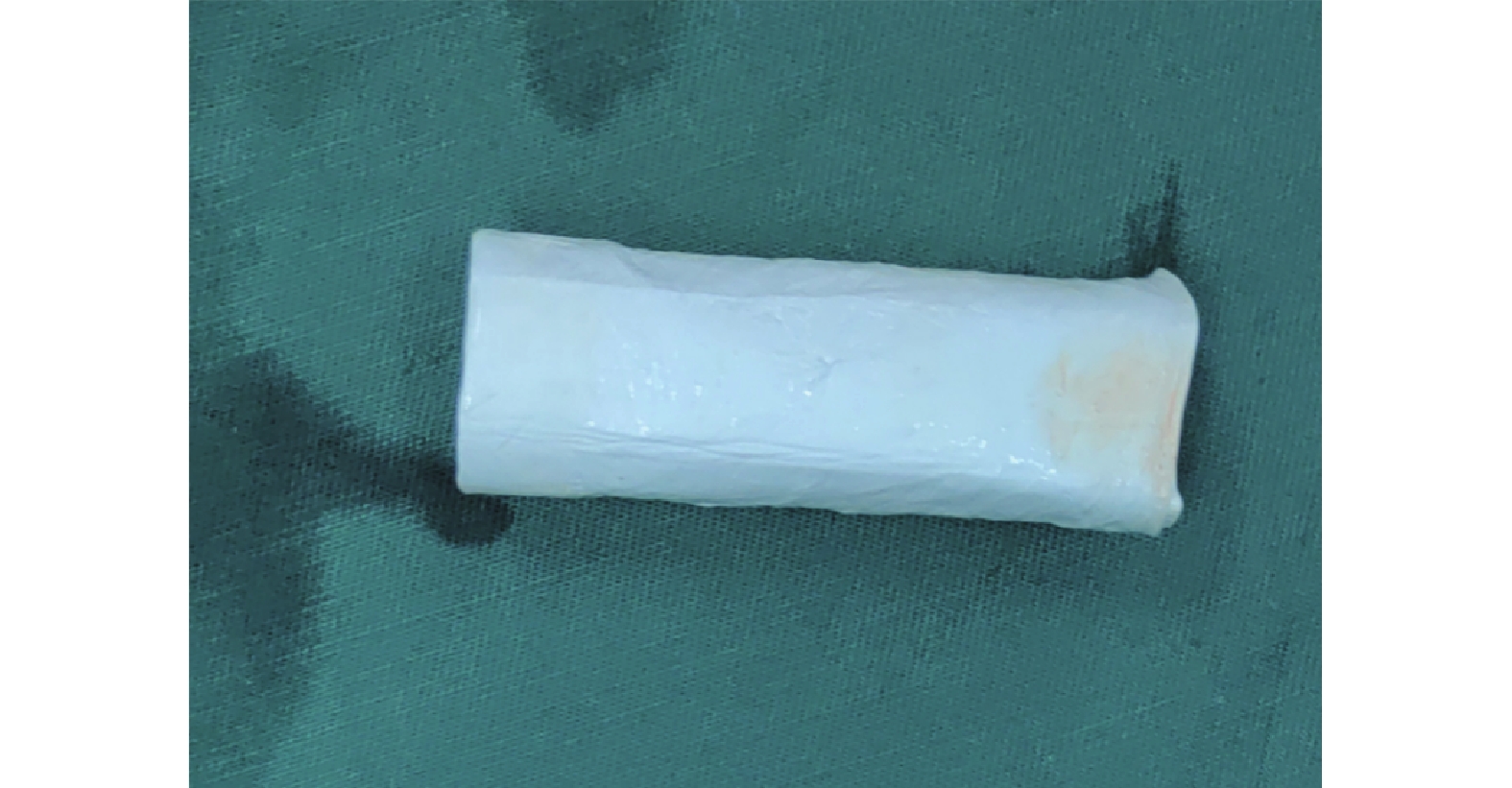 圖1
制備的人工血管
圖1
制備的人工血管
具體制備方案:(1)PCL/PLLA血管移植物電紡液的制備。將重量比為6∶4的PCL和PLLA與六氟異丙醇溶劑完全混合。將混合溶液在30℃的環境下攪拌溶解24 h,制備濃度為14 wt%的均勻、透明的PCL/PLLA電紡溶液。
(2)靜電紡絲參數設置。用10 mL注射器吸取上述配置好的PCL/PLLA電紡液,使用18號平頭針。紡絲參數設置為電壓17 kV,轉速150 rpm/min,以內層推進速度1 mL/h、中間層推進速度2 mL/h、內層推進速度 3 mL/h的推進速度構建三層梯度結構,紡絲距離為10 cm。通過連續改變擠壓速度,紡絲溶液凝固形成具有小孔徑梯度的三層管狀血管移植物。
(3)超聲擴孔處理。將制備的樣品在300 W超聲功率下超聲40 min,以擴大每層的孔徑。超聲結束后,使樣品在60℃下真空干燥24 h,以去除血管移植物中的雜質,并在室溫下密封保存。最終制備直徑為2 cm的人工血管。
1.2 實驗動物
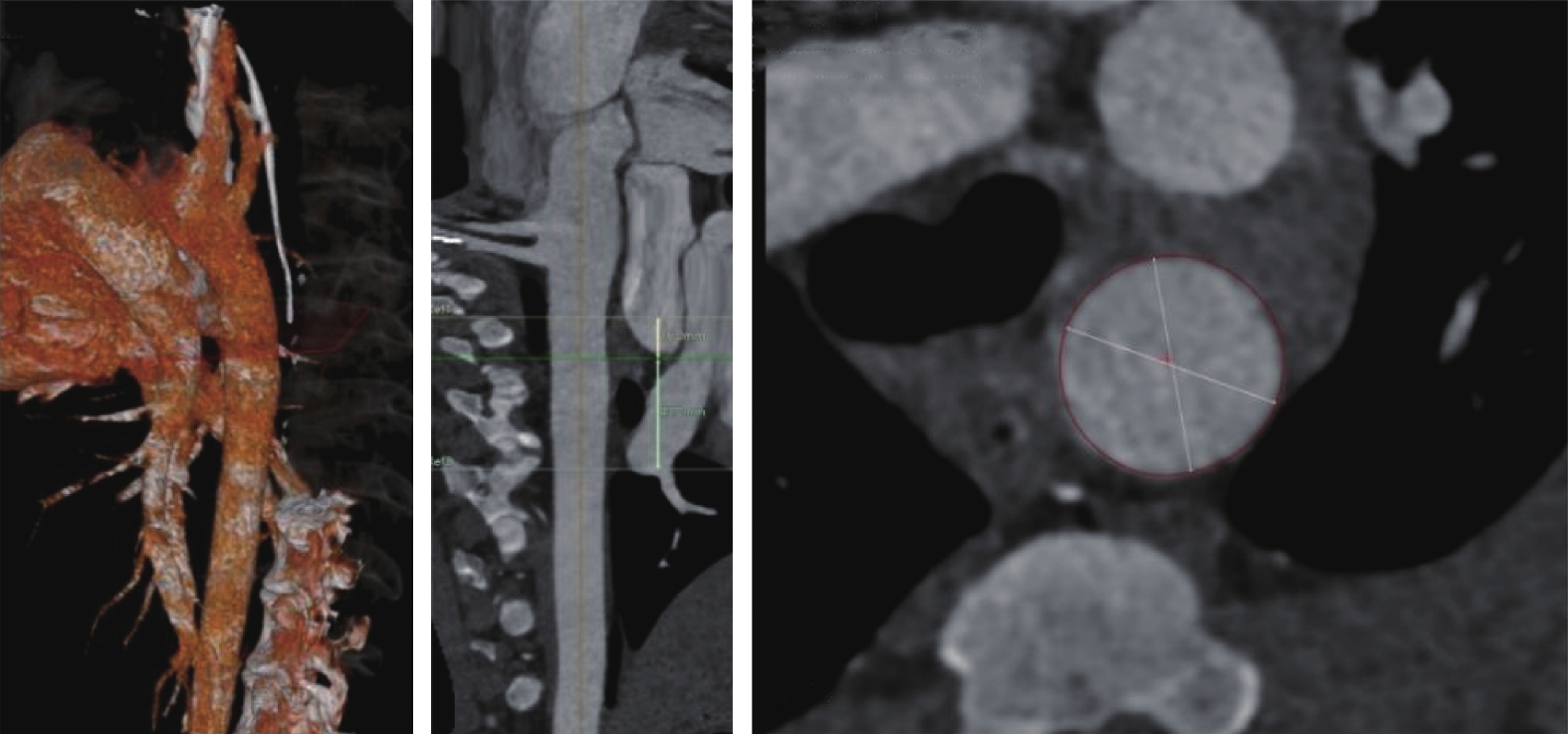
選取大長二元雜交白豬1只(雄性,95 kg,由上海銀蛇臨床實驗中心提供,實驗動物質量合格證編號:N0202301281)。實驗動物均在上海銀蛇臨床實驗中心飼養,標記耳標(編號:T0168)。術前行主動脈CT血管造影(computed tomography angiography,CTA)檢查(圖2),根據CTA胸主動脈近段直徑制作對應直徑的人工血管。
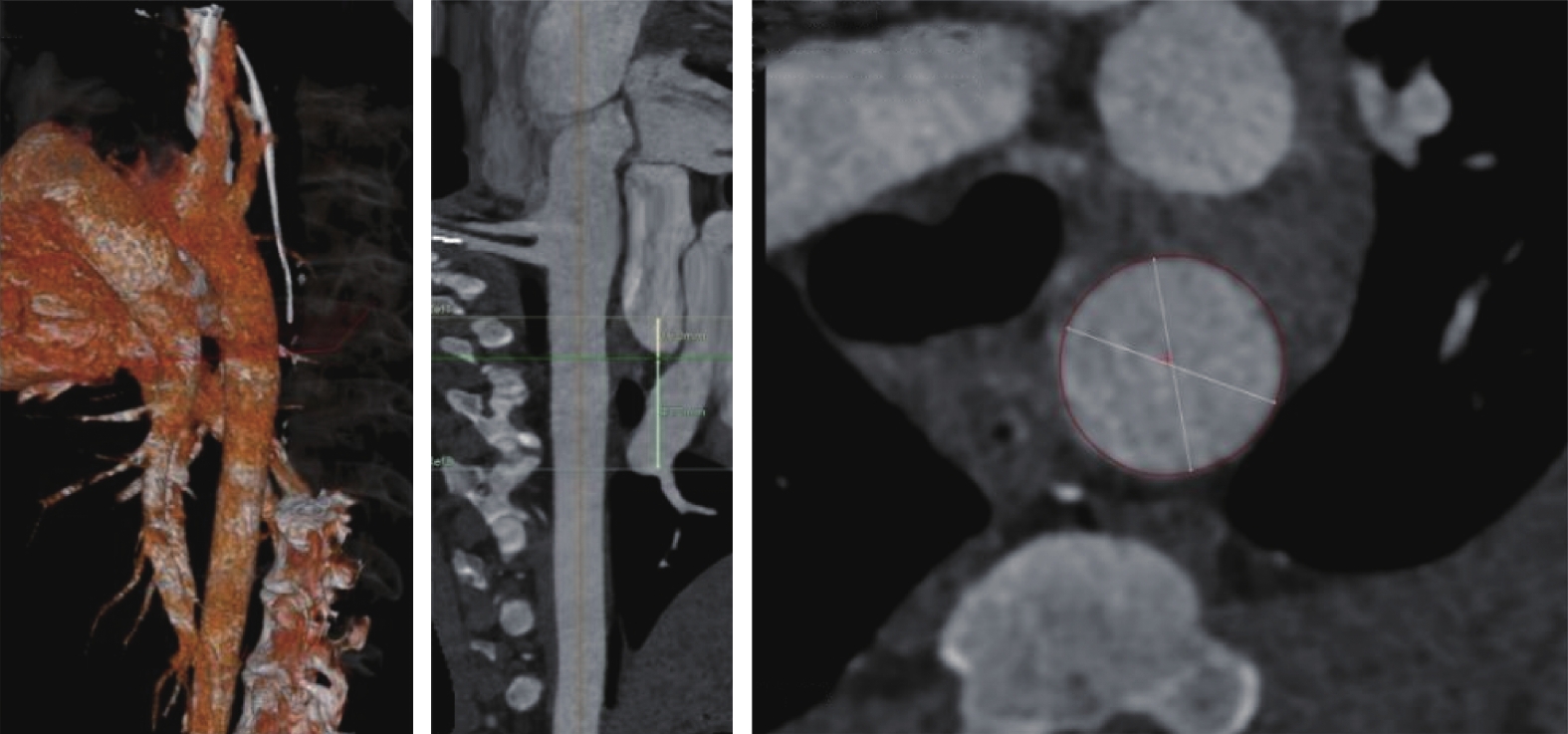 圖2
實驗動物手術前主動脈CTA圖像
圖2
實驗動物手術前主動脈CTA圖像
1.3 麻醉方法
動物術前禁食24 h,禁水12 h。麻醉期間經耳緣靜脈給予舒泰(肌松劑左拉西泮和鎮靜劑替來他明以1∶1 的比例合成的混合物)予以麻醉誘導,靜脈注射丙泊酚。待達到麻醉深度(聲門肌松弛)后,行氣管插管和外周血管血壓監測。動物轉入手術室后,吸入異氟醚維持麻醉深度,連接四肢導線進行心電監護,經耳廓動脈監測外周血壓。切皮前給予肌肉松弛藥,確保動物肌肉處于放松狀態,便于手術操作。
1.4 圍術期監測
術前肌肉注射頭孢曲松鈉2 g預防感染。術中監測心率、血壓、體溫、二氧化碳分壓。術中給予腎上腺素、去甲腎上腺素等藥物調節血壓,使術中血壓維持在80~120 mm Hg(1 mm Hg=0.133 kPa)。
1.5 手術過程
動物右臥位。左側第5肋間進胸。將皮下組織、內肋間肌和外肋間肌分開,用撐開器擴張肋間。然后仔細顯露胸主動脈,根據胸主動脈直徑選擇合適的人工血管。將選定的人工血管浸泡在混合有肝素的無菌生理鹽水中備用,浸泡時間超過10 min。
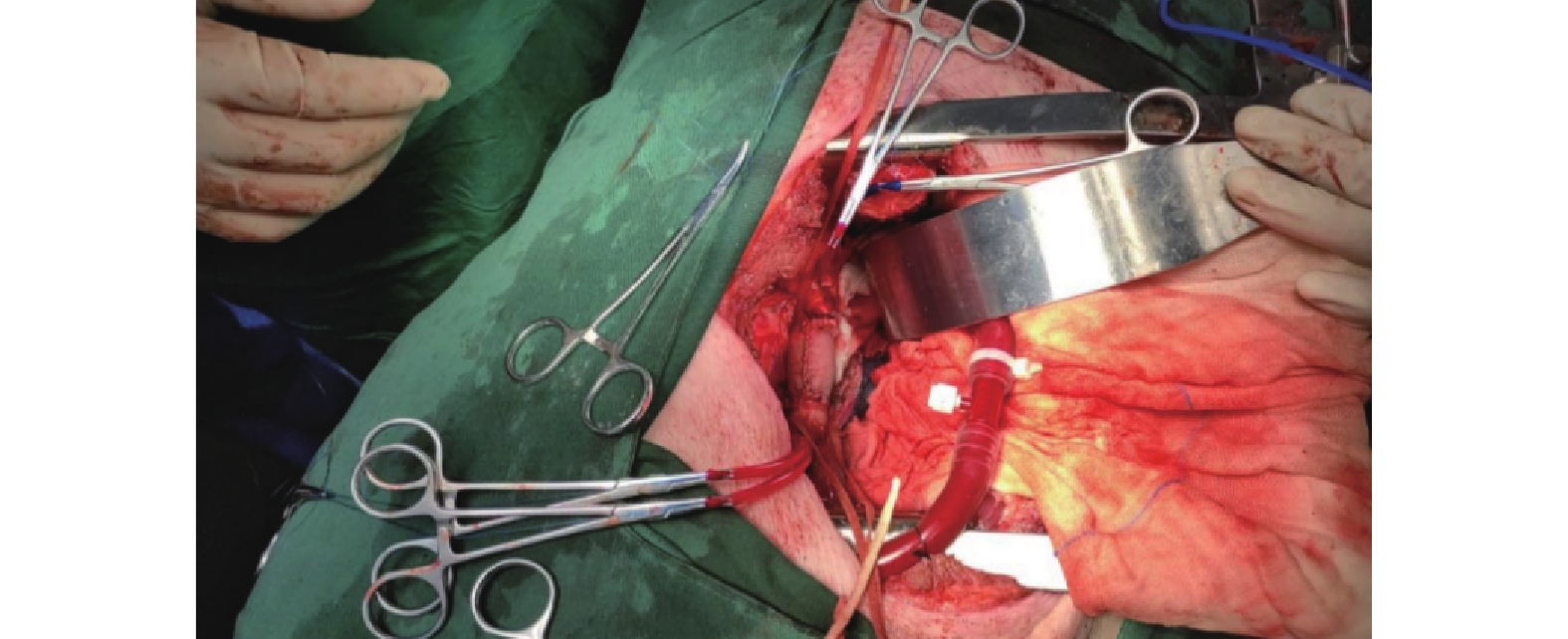
在阻斷胸主動脈之前,注射肝素以確保活化凝血時間(ACT )>250 s后。手術部位近心端和遠心端分別插入18F主動脈插管建立側枝循環。用2把阻斷鉗于胸主動脈置換部分的近端及遠端阻斷胸主動脈靶血管,縱行剪開靶血管,用5-0 Prolene縫線連續縫合靶血管和人工血管的切緣,充分排氣后撤除阻塞鉗,將自體主動脈外膜在人工血管外做一層包裹后,魚精蛋白中和肝素,逐層關胸(圖3)。
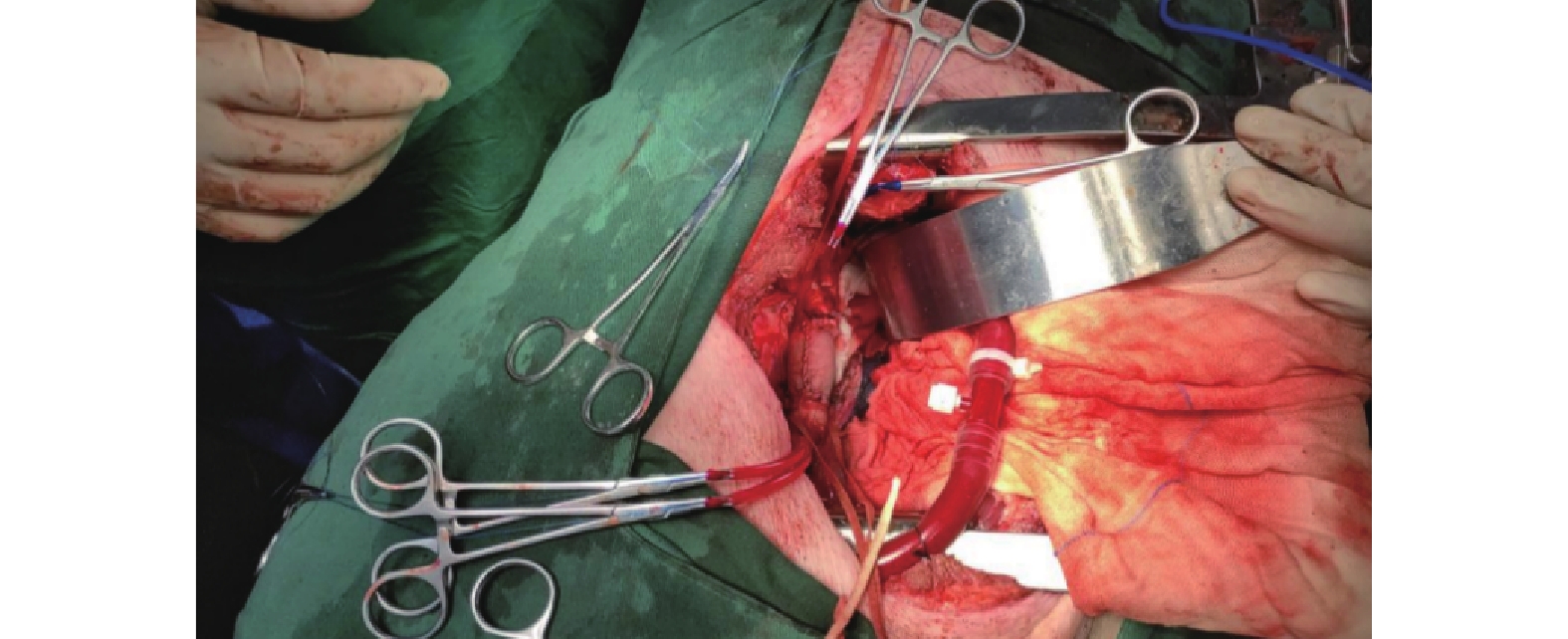 圖3
采用大型豬作為實驗動物進行胸主動脈置換術中情況
圖3
采用大型豬作為實驗動物進行胸主動脈置換術中情況
1.6 術后護理和用藥
手術后,動物被轉到動物實驗中心重癥監護室并由專人護理。動物在呼吸機輔助進行通氣,直到清醒。待它完全恢復意識并可站立活動時,再將它們送回飼養室。傷口每日2次用碘伏消毒,直至完全愈合。
1.7 實驗數據收集
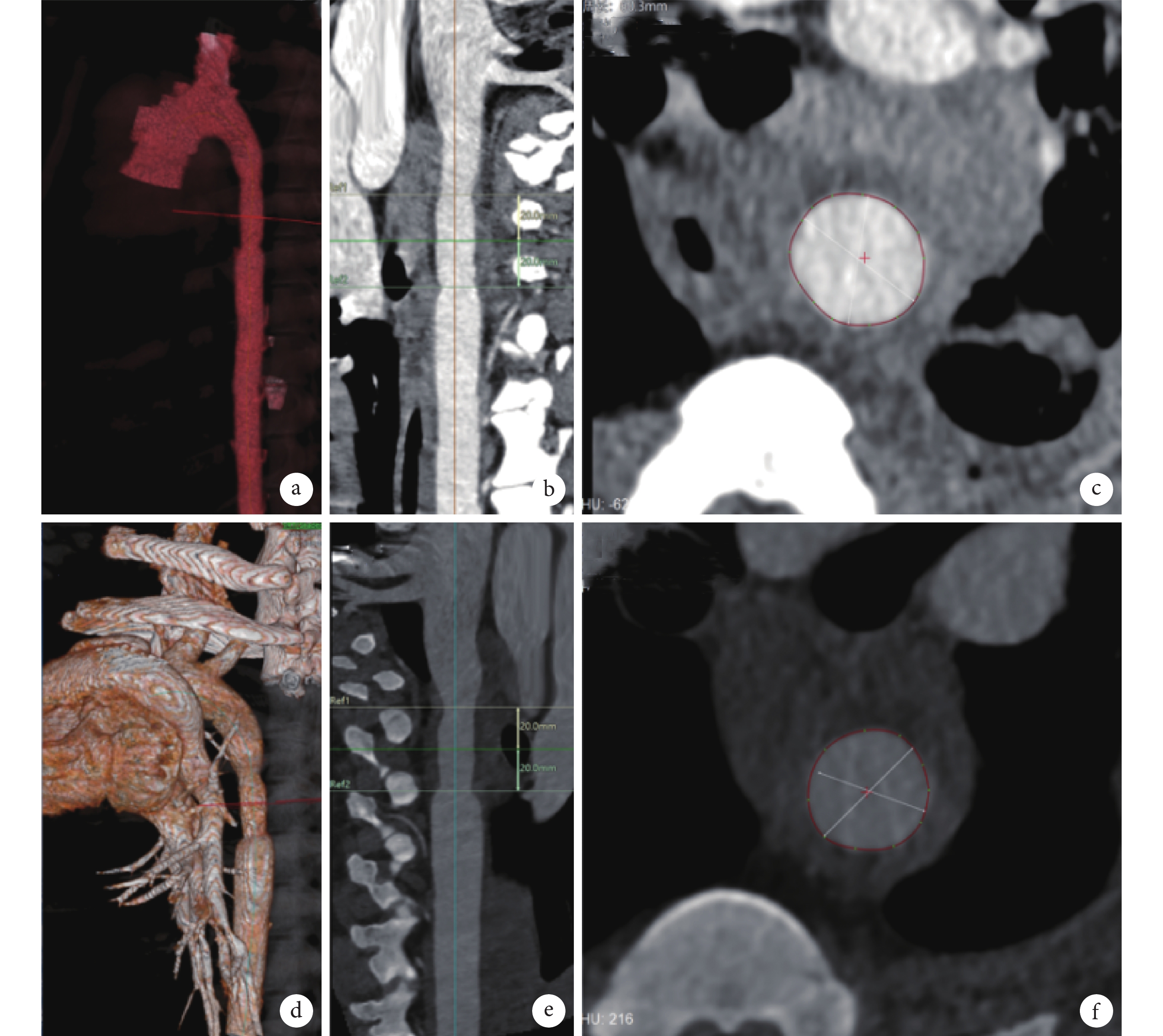
(1)人工血管植入后CTA檢查:在主動脈移植物植入后1周和6周,行CTA檢查評價植入后的人工血管通暢情況、主動脈-人工血管吻合口情況、人工血管內壁有無血栓形成(圖4)。
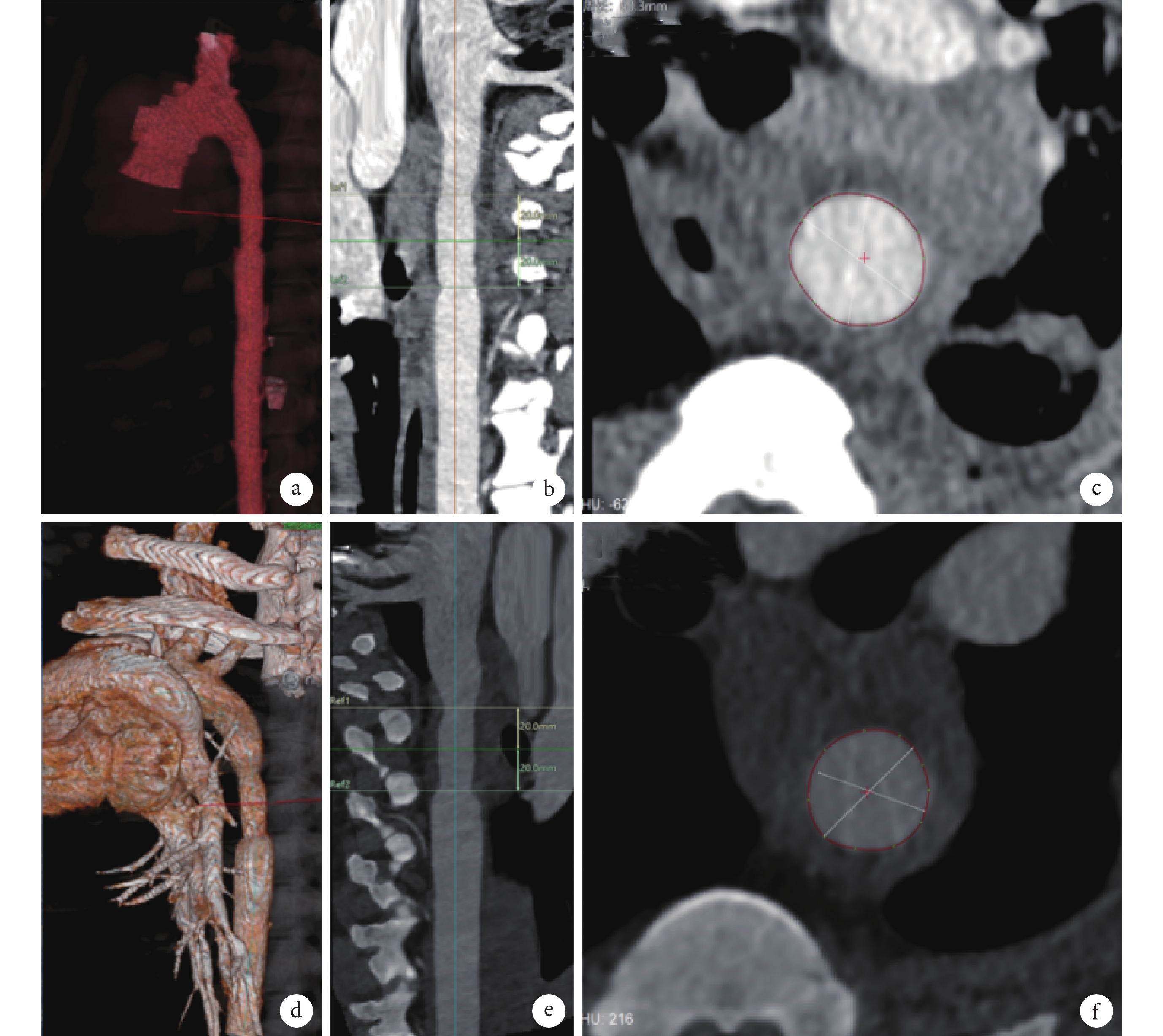 圖4
術后CTA圖像
圖4
術后CTA圖像
a~c:術后1周時CTA檢查見人工血管內血流通暢,人工血管與主動脈吻合口未見明顯狹窄;d~f:術后6周時CTA檢查見人工血管內血流通暢,人工血管與主動脈吻合口未見明顯狹窄;標記范圍為人工血管;CTA:CT血管造影
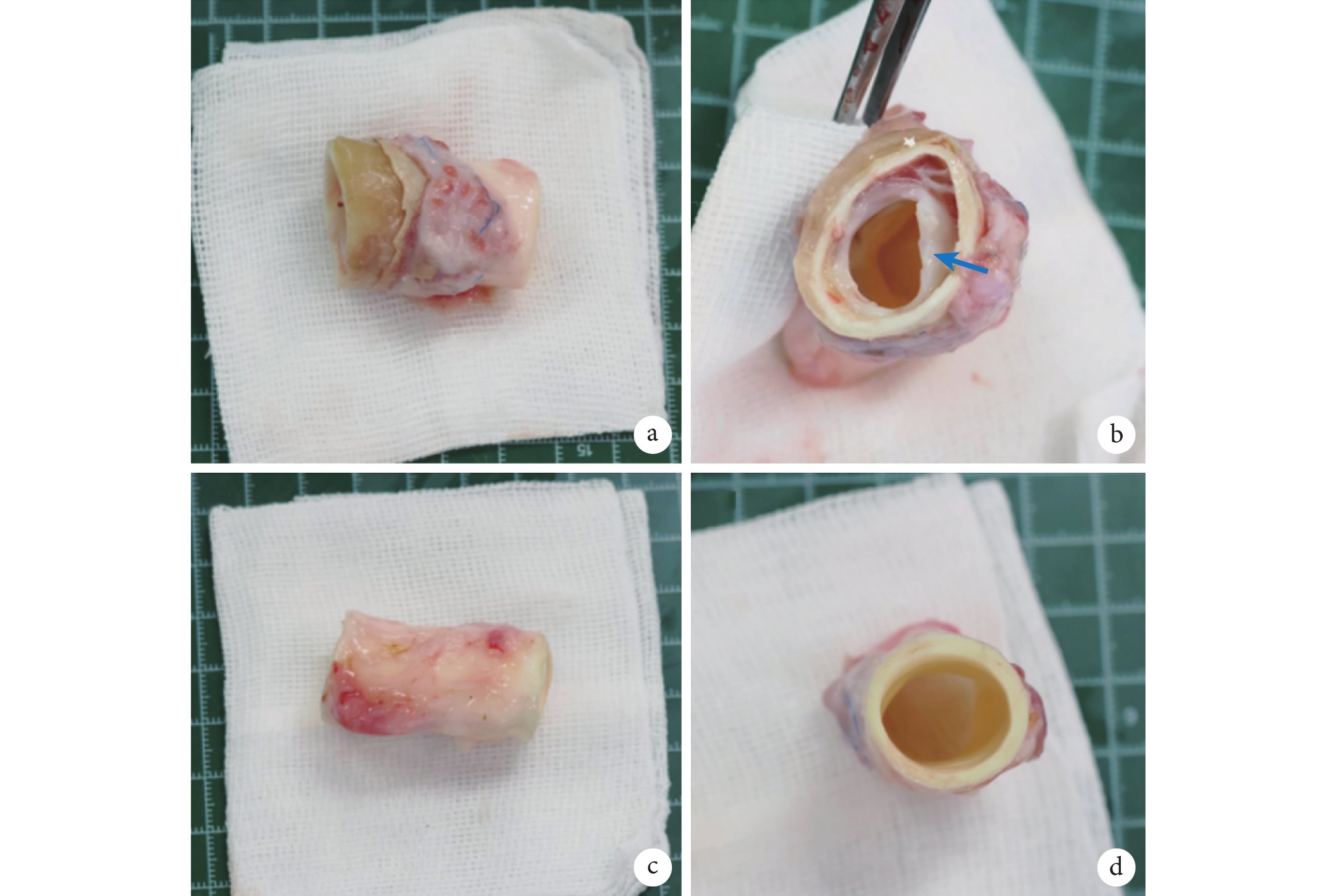
(2)解剖標本獲取:術后2個月,將實驗組動物在麻醉下用過量的氯化鉀溶液對動物實施安樂死。將實驗動物的降主動脈完整取出。肝素生理鹽水沖洗后,截取人工血管部分,及等長的降主動脈(圖5)。將人工血管平分為兩部分,分別由10%福爾馬林、2.5%戊二醛溶液保存,用于后期檢查。對降主動脈標本平分為兩部分,分別由10%福爾馬林、2.5%戊二醛溶液保存,用于后期檢查。
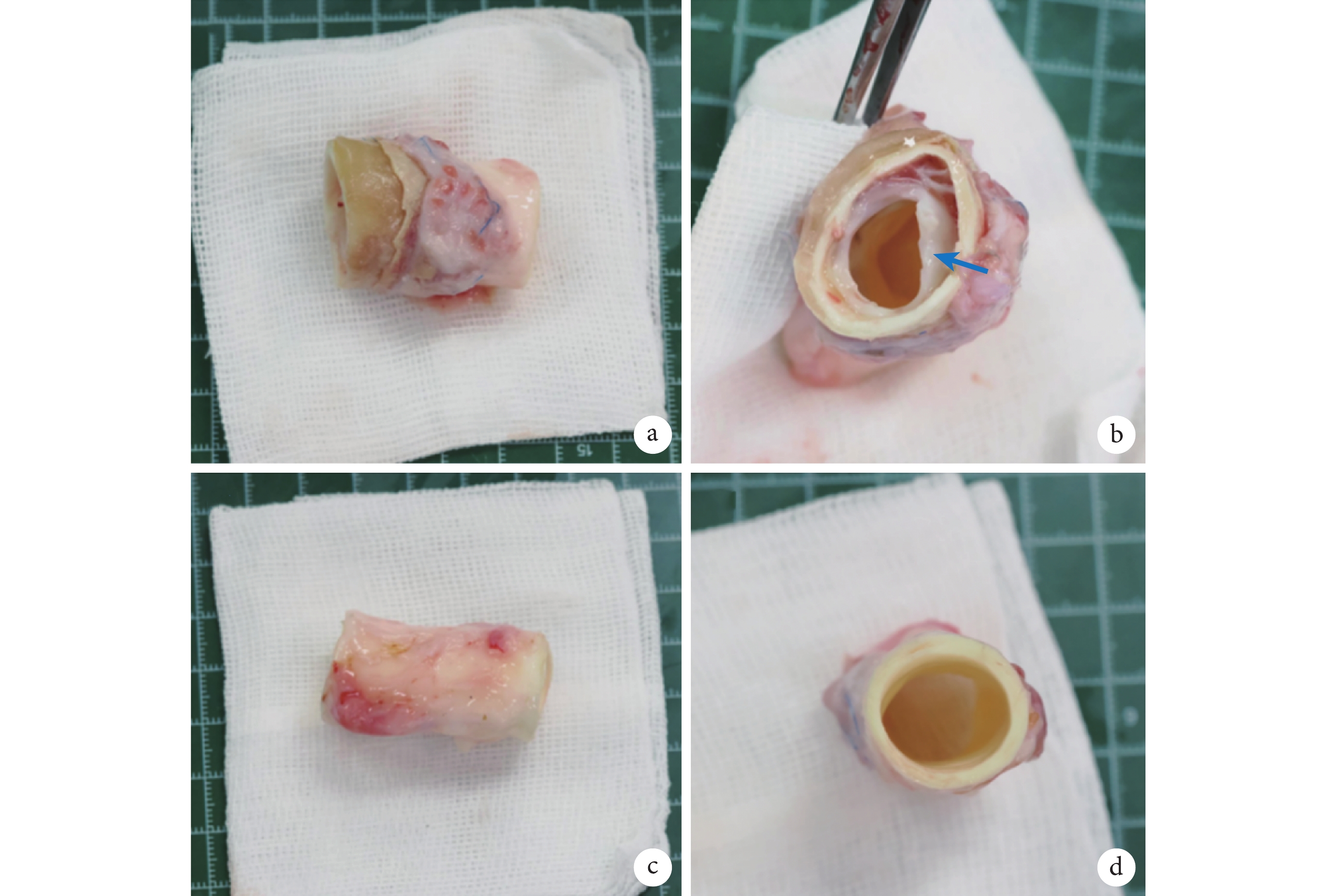 圖5
實驗動物主動脈標本
圖5
實驗動物主動脈標本
a:實驗動物人工血管置入后標本;b:實驗動物人工血管置入后標本橫斷面(箭頭所指為人工血管);c:實驗動物自體降主動脈標本;d:實驗動物自體降主動脈標本橫斷面
1.8 組織病理學、免疫組織化學及掃描電鏡評價
1.8.1 組織病理學檢測
從10%福爾馬林溶液中,將人工血管標本及將主動脈標本取出。選用石蠟組織包埋,并選用蘇木精和伊紅(hematoxylin eosin,HE)和彈力纖維(elastic tissue,ET)染色。處理后將人工血管進行切片,以動物自身降主動脈作為對照。觀察植入的人工血管組織學情況。
1.8.2 免疫組織化學染色檢測
用石蠟組織包埋樣本,為驗證剝離出的人工血管是否已形成天然血管的三層結構,即內皮細胞層,平滑肌層和成纖維細胞層,采用成紅細胞轉化特異性(E26 transformation specific,ETS)相關基因(ETS-related gene,ERG)抗體染色評價人工血管內皮細胞生成情況。采用肌動蛋白(Actin)染色評價平滑肌生成情況、波形蛋白(Vimentin)染色評價波形蛋白生成情況。明確我們的人工血管是否可能有誘導原位天然血管再生的功能,從而驗證該人工血管是否能誘導自體血管再生。
1.8.3 掃描電鏡觀察
從2.5%戊二醛溶液中,將人工血管標本及將主動脈標本取出。進行標本修剪取材,并固定。將固定好的樣品經后固定、脫水、干燥后、導電處理后,選用掃描電子顯微鏡(scanning electron microscopy,SEM)(hitachi,SU8100)進行觀察。通過對已植入體內的人工血管和對照組主動脈血管進行對比,觀察人工血管內壁是否形成與天然血管相同或相似的內皮層。
1.9 倫理審查
本實驗研究經大連市中心醫院、上海銀蛇臨床實驗中心倫理審查委員會審查通過,批準號:YN2023-059-03。
2 結果
2.1 基本情況
采用第5肋間進行人工血管置換,植入人工血管長度為4 cm。實驗動物于術后4 h內順利蘇醒,術后第2天恢復站立。
術后1周、6周CTA提示人工血管和實驗動物自體降主動脈匹配程度良好。人工血管通暢情況良好,人工血管內壁未見血栓形成。人工血管與實驗動物自體降主動脈吻合口處未見嚴重狹窄。
2.2 解剖標本結果
對動物的降主動脈及人工血管進行標本獲取發現,實驗動物體內人工血管及實驗動物自體降主動脈通暢良好,主動脈-人工血管吻合口未見明顯狹窄,人工血管內壁可見新生薄層組織。
2.3 組織病理學評價結果
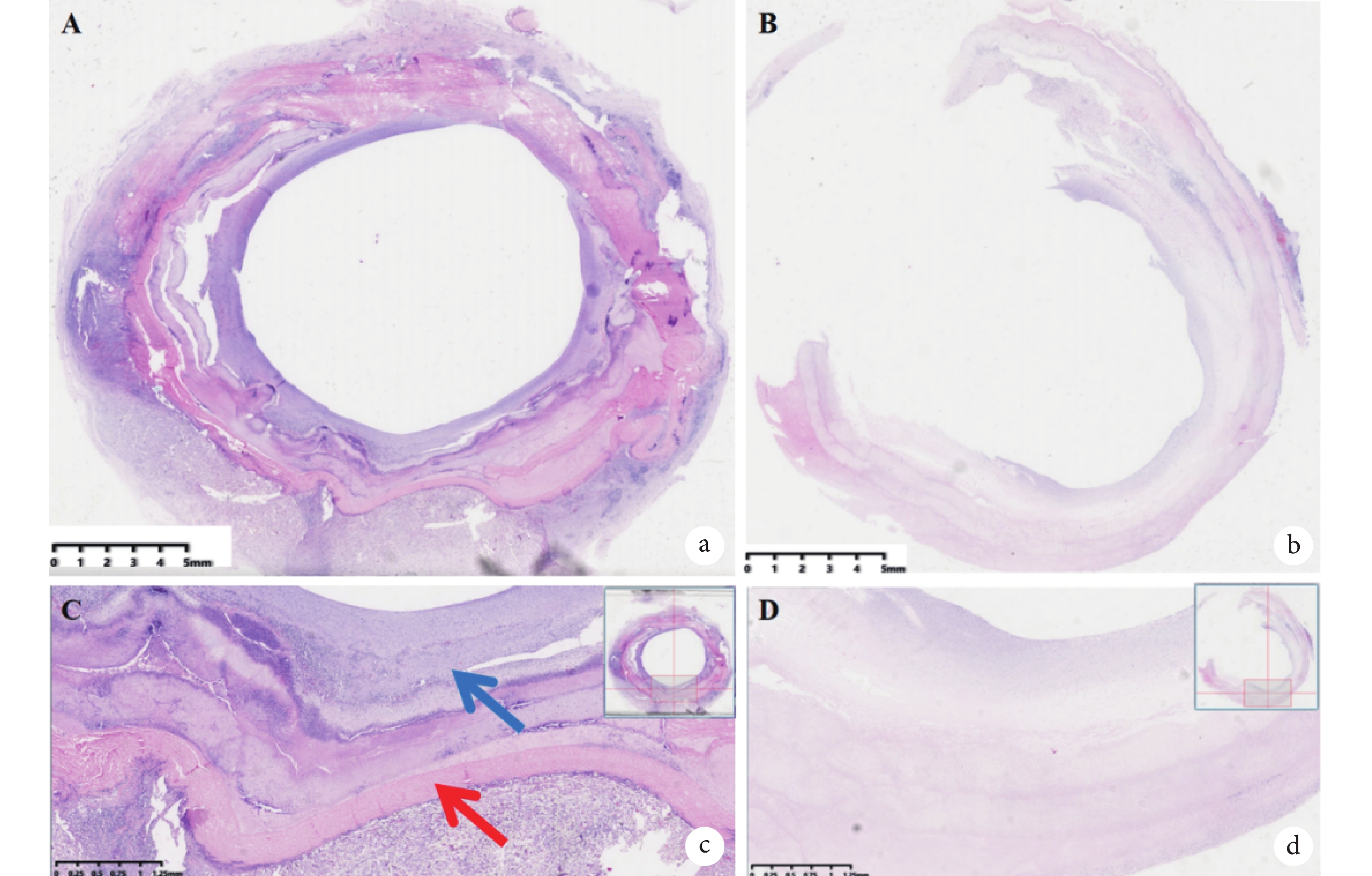
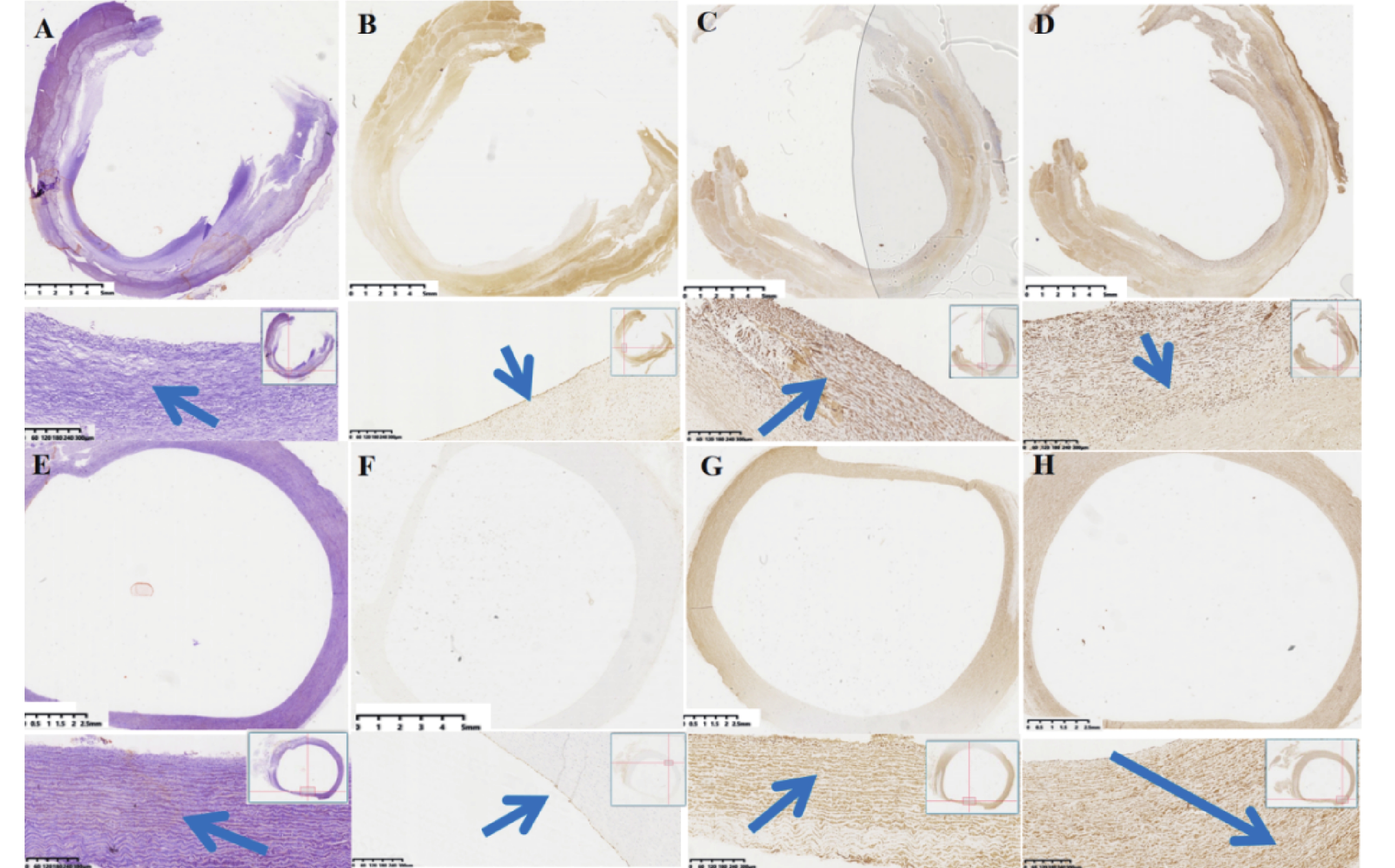
實驗動物的病理學檢查發現 ,與自體降主動脈進行對比,實驗動物人工血管通暢,未見新生組織或血栓致人工血管內狹窄/閉塞。人工血管內壁新生組織內可見內皮細胞生成,標本大體形成了類似天然主動脈的三層結構(圖6)。人工血管內新生組織對彈力纖維染色呈強烈反應,提示有彈力纖維生成,但呈現不規則排序(圖7)。
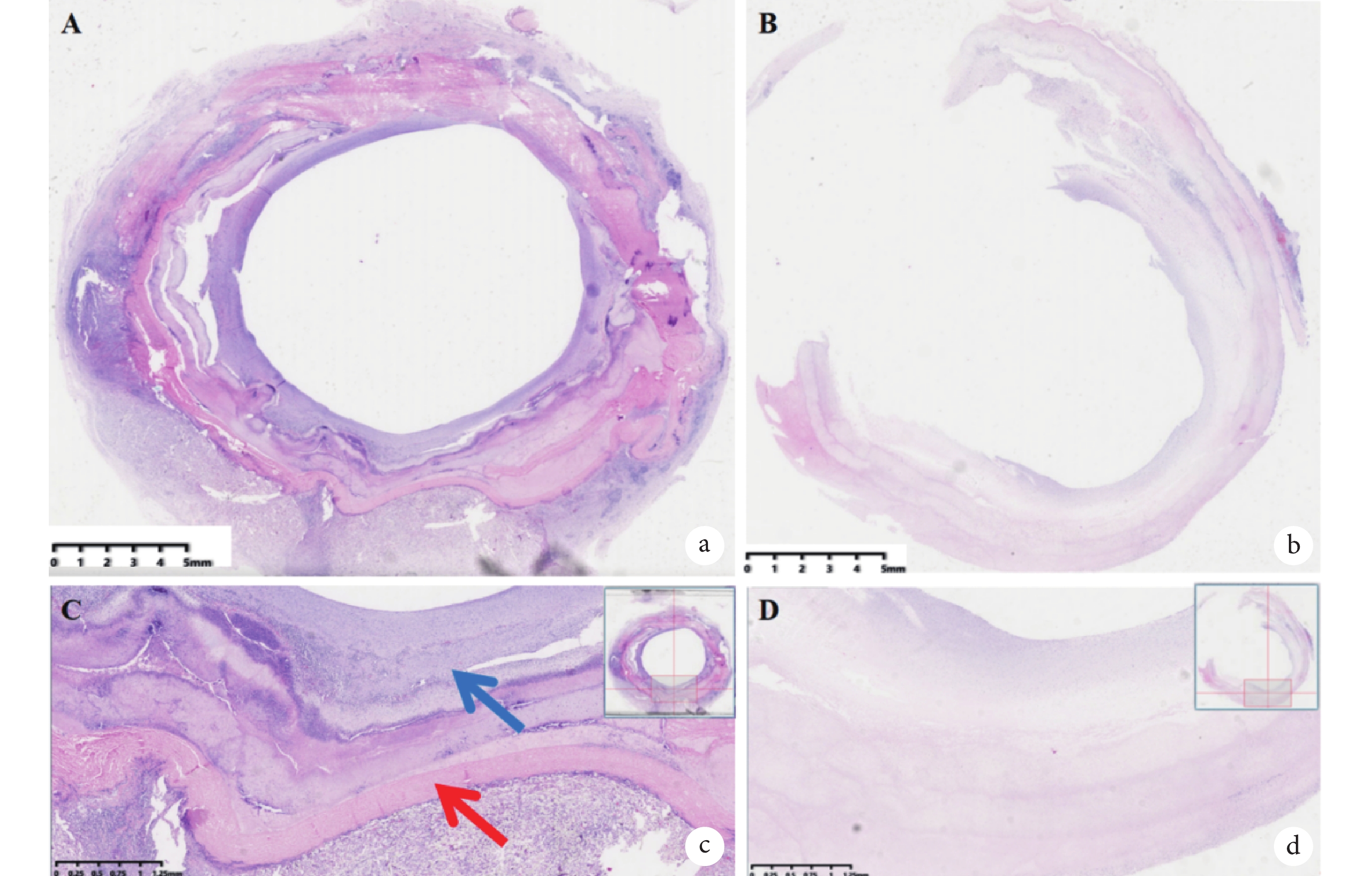 圖6
大直徑人工血管的組織學評價
圖6
大直徑人工血管的組織學評價
a:實驗動物人工血管置入后標本橫截面HE染色圖像;b:實驗動物自體降主動脈橫截面HE染色圖像;c:標本放大后可見人工血管(紅色箭頭),血管內可見新生類似新生主動脈三層結構組織(藍色箭頭);d:實驗動物降主動脈可見血管呈現三層結構
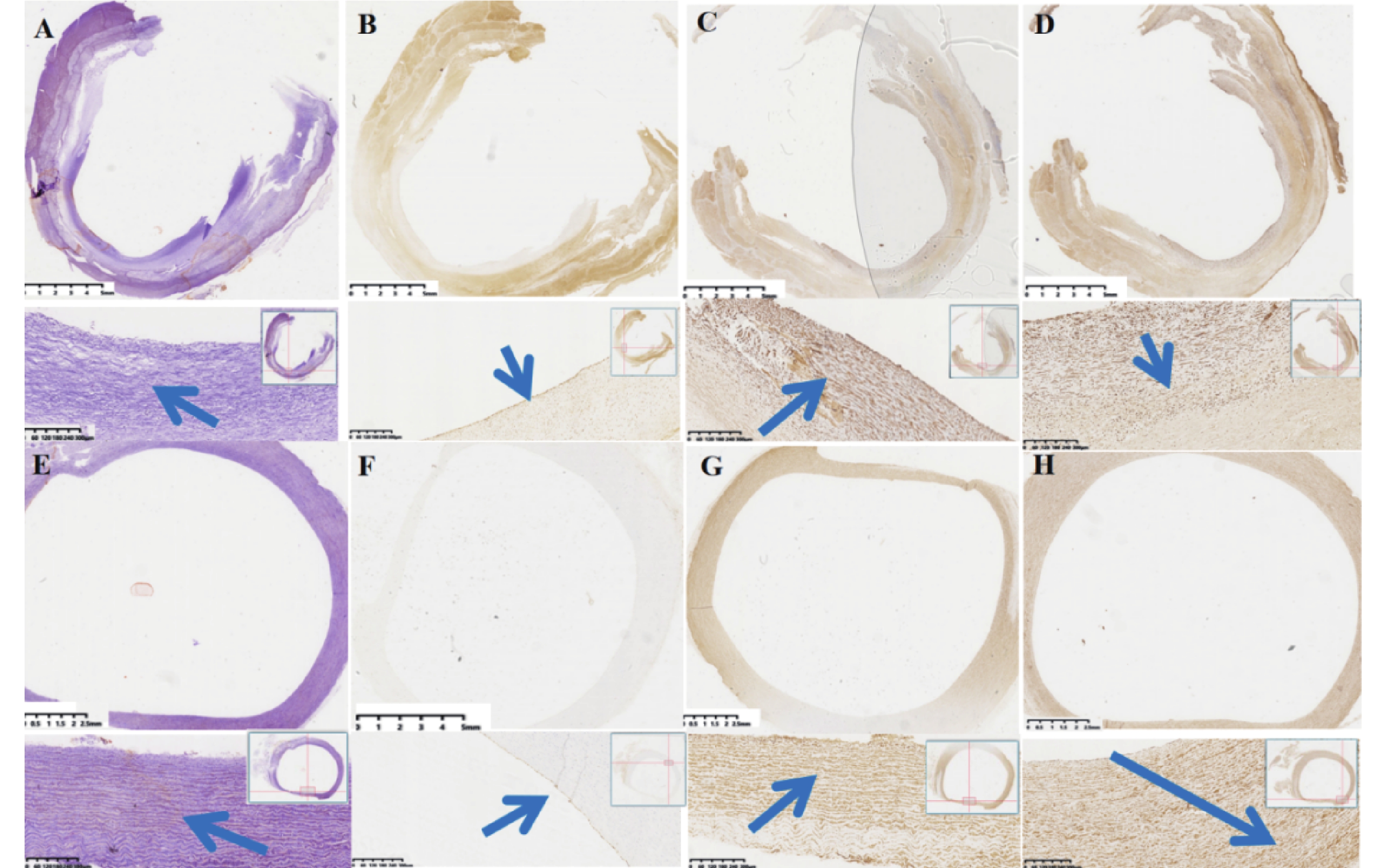 圖7
大直徑人工血管的免疫組織化學評價
圖7
大直徑人工血管的免疫組織化學評價
a:實驗動物人工血管置入后標本橫截面彈力纖維染色圖像:可見人工血管內壁新生組織中,對于彈力纖維染色呈強烈陽性反應;高倍鏡下,可見新生彈力纖維,彈力纖維排列不規整(藍色箭頭為新生彈力纖維);b:實驗動物人工血管置入后標本橫截面ERG染色圖像:可見人工血管內壁新生組織的內表面,對于ERG染色呈強烈陽性反應。高倍鏡下,可見ERG強反應細胞覆蓋于人工血管內壁新生組織的內表面(藍色箭頭為強反應細胞);c:實驗動物人工血管置入后標本橫截面Actin染色圖像:可見人工血管內壁新生組織內,對于Actin染色呈強烈陽性反應;高倍鏡下,可見新生肌動蛋白,排列不規整(藍色箭頭為新生肌動蛋白);d:實驗動物人工血管置入后標本橫截面Vimentin波形蛋白染色圖像:可見人工血管內壁新生組織內,對于Vimentin波形蛋白染色呈強烈陽性反應;高倍鏡下,可見新生Vimentin波形蛋白,排列不規整(藍色箭頭為新生波形蛋白);e:實驗動物自體降主動脈橫截面彈力纖維染色圖像,主動脈中膜可見彈力纖維染色強烈反應,高倍鏡下,可見主動脈中膜彈力纖維排列規整藍色箭頭為彈力纖維);f:實驗動物自體降主動脈橫截面彈ERG染色圖像,主動脈內膜表面對于ERG染色呈強烈陽性反應,高倍鏡下,可見ERG強反應細胞覆蓋于主動脈內膜表面,為內皮細胞;g:實驗動物自體降主動脈橫截面Actin染色圖像,主動脈中膜可見Actin染色強烈反應,高倍鏡下,可見主動脈中膜排列規整(藍色箭頭為肌動蛋白);h:實驗動物自體降主動脈橫截面Vimentin染色圖像,主動脈外膜可見Vimentin染色強烈反應,高倍鏡下,可見主動脈外膜波形蛋白排列規整(藍色箭頭為波形蛋白)
2.4 免疫組織化學評價結果
實驗動物的免疫組化檢查發現 ,人工血管內新生組織內表面對ERG染色具有強烈反應,提示新生組織內表面有內皮細胞生成覆蓋。人工血管內新生組織對Actin染色具有強烈的免疫反應,提示有平滑肌組織生成,但與自體主動脈相比呈現不規則排序。人工血管內新生組織對Vimentin染色具有強烈的免疫反應,提示新生組織內有成纖維細胞生成,但與自體主動脈相比呈現不規則排序(圖7)。
掃描電鏡評價結果
掃描電鏡檢查結果顯示,人工血管內層可見內皮細胞附著。提示人工血管內新生組織內表面存在新生血管內皮細胞(圖8)。
 圖8
掃描電鏡結果
圖8
掃描電鏡結果
a、c:掃描電鏡見人工血管內新生組織內表面可見內皮細胞附著;b、d:掃描電鏡見實驗動物自體主動脈表面光滑,內表面有內皮細胞附著
3 討論
雖然目前大直徑人工血管已經應用于臨床,但目前市場上主流的大口徑人工血管的主要知識產權多歸屬于歐美國家。并且此類人工血管多以聚酯和聚四氟乙烯作為材料,由于材料本身的血栓率高、組織相容性不佳等限制性,因此往往與生物涂層技術等技術進行結合[13-14]。目前主流的涂層技術為人工血管內層輔以水解蛋白明膠涂層預凝,或者采用白蛋白-肝素涂層[15]。即便如此,人工血管移植失敗的案例依然在不斷發生[16]。人工血管移植物失敗常見的原因是人工血管內狹窄和血栓形成,并且總是繼發于動脈粥樣硬化疾病的進展或血管內膜增生[17]。此外,感染也是移植物晚期失敗的主要原因,并且感染的炎癥反應可促進移植物狹窄[18]。人工血管無法復制天然人體血管的解剖結構以及生物力學特性的不匹配可能是導致這些情況出現的重要原因[19-20]。
人類自體的主動脈是由內皮細胞構成的內膜、平滑肌細胞構成的中膜和纖維結締組織構成的外膜組成,而目前的人工血管,并不具備相應的主動脈三層結構[21]。曾有學者利用3D打印、靜電紡絲等技術,進行了多層結構的人工血管移植物研究,發現在結構和力學性能上高度模仿天然血管,可以提高體內血運重建的成功率[22-23]。
PLLA及PCL由于其優良的特性,如生物相容性、彈性、高拉伸強度等,是制造人工血管的理想材料[24]。目前此類材料已用于各種植入式醫療器械[25-26]。
我們的前期研究[25]中,靜電紡絲和超聲擴孔技術制備了具有孔徑梯度的三層PCL/PLLA人工血管并進行了包括拉伸強度、斷裂伸長率和孔徑大小的力學性能測試,以及生物相容性評估。研究發現用此種材料和方法制作的人工血管具有良好的機械性能和生物相容性,有望作為新型大直徑人工血管材料。并且通過不同梯度的三層孔隙設計,可以為以后加入生物學成分留下了基礎,為合成有生物活性的人造血管提供了物質保障。
在本研究中,實驗動物在術后CTA及解剖時主動脈人工血管通暢情況良好,這表明PCL/PLLA人工血管有著潛在良好通暢性。
對于血管尤其是主動脈來說,血管內皮細胞有著重要的生理功能。內皮細胞可以維持血管正常舒張和收縮、保持血管張力、調節血壓的作用,尤其是其具有調節機體凝血平衡的作用,能有效防止血小板的聚集、血液的凝固和血栓的形成[27]。促進人工血管內壁內皮,或者誘導其內部生成自然血管的三層結構,是新一代主動脈人工血管材料亟需解決的關鍵問題。我們的前期研究發現,有孔徑梯度的三層PCL/PLLA大直徑人工血管可以促進大鼠血管內皮細胞的黏附和增殖[25]。
當人工血管植入體內后,能夠誘導和促進內皮細胞和平滑肌細胞的再生,形成類似于天然血管的組織,是最理想的狀態。血管內皮細胞有著諸多重要的生理功能。
既往研究[28-29]發現,人工血管在植入后也可以在人工血管內表面通過固有動脈內皮的經吻合口植入,植入部位毛細血管的透壁植入,以及循環系統的內皮經血行播種等方式進行內皮化,并在內皮細胞原本的功能外,還可以減少人工血管內血栓形成和內膜增生。
在本研究中,對于標本的HE染色發現,在我們制作的人工血管內,形成了類似天然血管的三層結構。彈力纖維染色結果也提示了人工血管內部有彈力纖維生成。免疫組織化學結果中,ERG作為血管內皮細胞的標志物,在人工血管內有顯著性的免疫反應,提示人工血管內存在內皮細胞生成。人工血管內對Actin抗體有較強烈的免疫反應,證明該層形成了平滑肌,根據顯色范圍,平滑肌層并沒有出現異常增殖情況。人工血管內Vimentin波形蛋白有較好的顯色反應,證明在人工血管內形成了成纖維細胞層。電鏡結果同樣觀察到了人工血管內壁有內皮細胞存在。這提示了證明在人工血管內形成了成纖維細胞層。這提示了我們制作的人工血管可能有著誘導人工血管內內皮細胞生成修復的作用,并且具備誘導三層結構的血管壁形成的潛力。
分析這一結果出現的原因。本研究中人工血管的制作才用了靜電紡絲技術,以及超聲擴孔工藝,制備的人工血管具備著不同層次的梯度。近期有學者研究發現,多孔移植物有助于血管的建設性重塑。通過人工血管壁微孔結構的調節作用,內皮細胞和平滑肌細胞可以在移植物內壁表現出改善的生物活性。通過設計微孔結構的仿生血管移植物,可以促進血管內的內皮層和平滑肌層的生成[30]。
本研究的不足:因研究規模所限,本研究僅應用了1只實驗動物,因此結果可能存在偶然性。需要更進一步的體外及體內實驗以證實。
綜上,PLLA和PCL為原料,采用靜電紡絲和超聲擴孔技術制備的大直徑人工血管,具備潛在良好通暢性、良好的內皮化率并可能有誘導原位天然血管再生的功能。
利益沖突:無。
作者貢獻:王文君負責檢索文獻、資料整理、撰寫文章;高洋、高峰、鄭紅、石磊負責進行實驗動物手術;劉巍、范為王負責動物實驗標本的檢查及檢驗;徐暢負責人工血管的制作;董旭峰和莊熙晶負責研究計劃方案的提出、研究過程的監督,以及對文章進行批評性審閱及修改。
隨著醫療技術的發展,目前主動脈疾病的檢出率顯著上升[1-2]。在多數的開放主動脈手術中需采用大直徑人工血管移植物置換病變的主動脈[3-5]。為滿足治療目的,大直徑人工血管要求具有良好的生物相容性、尺寸可調性、順應性、結構穩定性、抗菌抗感染性、力學性能及抗血栓形成能力,并且還需具備易于縫合,免疫反應低等特點[6-7]。
目前臨床上所應用的大直徑人工血管,聚對苯二甲酸乙二醇酯(polyethylene terephthalate,PET)或聚四氟乙烯(polytetrafluoroethylene,PTFE)是其主要材料。該類大直徑人工血管的出現緩解了主動脈疾病手術治療中,主動脈供體/替代品缺乏的窘況[8]。但在臨床應用中卻存在一定的限制性。首先臨床上所應用的大直徑人工血管,其主要知識產權多屬于歐美國家,我國尚缺乏自主研發的相應基礎[9]。并且,雖然PET和PTFE所制備的人工血管使用廣泛,但人工血管的生物力學性能并不能與自體主動脈完美匹配[10]。此外,此類大直徑人工血管內層缺乏血管內皮細胞,組織相容性有待改進,易導致如破裂、移位、內漏、感染和再狹窄等移植物并發癥風險[7,11-12]。
基于目前大直徑人工血管存在的問題,本研究選取左旋聚乳酸(levorotatory polylactic acid,PLLA)和聚己內酯(polycaprolactone,PCL)的共混物作為制備大直徑人工血管的原材料,擬設計一種基于逐層靜電紡絲和超聲擴孔處理的復合工藝,旨在得到一種與天然血管孔徑梯度結構相似、孔徑適宜的人工血管,并可誘導人工血管早期內皮細胞形成。通過早期動物實驗評價此類人工血管設計的可行性。
1 材料與方法
1.1 仿天然血管結構大直徑人工血管制備方法
為了制備具有理想機械特性的人工血管,以PLLA和PCL為原料,通過靜電紡絲工藝,以不同直徑芯軸為靜電紡絲收集裝置構建仿天然結構人工血管材料(圖1)。
 圖1
制備的人工血管
圖1
制備的人工血管
具體制備方案:(1)PCL/PLLA血管移植物電紡液的制備。將重量比為6∶4的PCL和PLLA與六氟異丙醇溶劑完全混合。將混合溶液在30℃的環境下攪拌溶解24 h,制備濃度為14 wt%的均勻、透明的PCL/PLLA電紡溶液。
(2)靜電紡絲參數設置。用10 mL注射器吸取上述配置好的PCL/PLLA電紡液,使用18號平頭針。紡絲參數設置為電壓17 kV,轉速150 rpm/min,以內層推進速度1 mL/h、中間層推進速度2 mL/h、內層推進速度 3 mL/h的推進速度構建三層梯度結構,紡絲距離為10 cm。通過連續改變擠壓速度,紡絲溶液凝固形成具有小孔徑梯度的三層管狀血管移植物。
(3)超聲擴孔處理。將制備的樣品在300 W超聲功率下超聲40 min,以擴大每層的孔徑。超聲結束后,使樣品在60℃下真空干燥24 h,以去除血管移植物中的雜質,并在室溫下密封保存。最終制備直徑為2 cm的人工血管。
1.2 實驗動物
選取大長二元雜交白豬1只(雄性,95 kg,由上海銀蛇臨床實驗中心提供,實驗動物質量合格證編號:N0202301281)。實驗動物均在上海銀蛇臨床實驗中心飼養,標記耳標(編號:T0168)。術前行主動脈CT血管造影(computed tomography angiography,CTA)檢查(圖2),根據CTA胸主動脈近段直徑制作對應直徑的人工血管。
 圖2
實驗動物手術前主動脈CTA圖像
圖2
實驗動物手術前主動脈CTA圖像
1.3 麻醉方法
動物術前禁食24 h,禁水12 h。麻醉期間經耳緣靜脈給予舒泰(肌松劑左拉西泮和鎮靜劑替來他明以1∶1 的比例合成的混合物)予以麻醉誘導,靜脈注射丙泊酚。待達到麻醉深度(聲門肌松弛)后,行氣管插管和外周血管血壓監測。動物轉入手術室后,吸入異氟醚維持麻醉深度,連接四肢導線進行心電監護,經耳廓動脈監測外周血壓。切皮前給予肌肉松弛藥,確保動物肌肉處于放松狀態,便于手術操作。
1.4 圍術期監測
術前肌肉注射頭孢曲松鈉2 g預防感染。術中監測心率、血壓、體溫、二氧化碳分壓。術中給予腎上腺素、去甲腎上腺素等藥物調節血壓,使術中血壓維持在80~120 mm Hg(1 mm Hg=0.133 kPa)。
1.5 手術過程
動物右臥位。左側第5肋間進胸。將皮下組織、內肋間肌和外肋間肌分開,用撐開器擴張肋間。然后仔細顯露胸主動脈,根據胸主動脈直徑選擇合適的人工血管。將選定的人工血管浸泡在混合有肝素的無菌生理鹽水中備用,浸泡時間超過10 min。
在阻斷胸主動脈之前,注射肝素以確保活化凝血時間(ACT )>250 s后。手術部位近心端和遠心端分別插入18F主動脈插管建立側枝循環。用2把阻斷鉗于胸主動脈置換部分的近端及遠端阻斷胸主動脈靶血管,縱行剪開靶血管,用5-0 Prolene縫線連續縫合靶血管和人工血管的切緣,充分排氣后撤除阻塞鉗,將自體主動脈外膜在人工血管外做一層包裹后,魚精蛋白中和肝素,逐層關胸(圖3)。
 圖3
采用大型豬作為實驗動物進行胸主動脈置換術中情況
圖3
采用大型豬作為實驗動物進行胸主動脈置換術中情況
1.6 術后護理和用藥
手術后,動物被轉到動物實驗中心重癥監護室并由專人護理。動物在呼吸機輔助進行通氣,直到清醒。待它完全恢復意識并可站立活動時,再將它們送回飼養室。傷口每日2次用碘伏消毒,直至完全愈合。
1.7 實驗數據收集
(1)人工血管植入后CTA檢查:在主動脈移植物植入后1周和6周,行CTA檢查評價植入后的人工血管通暢情況、主動脈-人工血管吻合口情況、人工血管內壁有無血栓形成(圖4)。
 圖4
術后CTA圖像
圖4
術后CTA圖像
a~c:術后1周時CTA檢查見人工血管內血流通暢,人工血管與主動脈吻合口未見明顯狹窄;d~f:術后6周時CTA檢查見人工血管內血流通暢,人工血管與主動脈吻合口未見明顯狹窄;標記范圍為人工血管;CTA:CT血管造影
(2)解剖標本獲取:術后2個月,將實驗組動物在麻醉下用過量的氯化鉀溶液對動物實施安樂死。將實驗動物的降主動脈完整取出。肝素生理鹽水沖洗后,截取人工血管部分,及等長的降主動脈(圖5)。將人工血管平分為兩部分,分別由10%福爾馬林、2.5%戊二醛溶液保存,用于后期檢查。對降主動脈標本平分為兩部分,分別由10%福爾馬林、2.5%戊二醛溶液保存,用于后期檢查。
 圖5
實驗動物主動脈標本
圖5
實驗動物主動脈標本
a:實驗動物人工血管置入后標本;b:實驗動物人工血管置入后標本橫斷面(箭頭所指為人工血管);c:實驗動物自體降主動脈標本;d:實驗動物自體降主動脈標本橫斷面
1.8 組織病理學、免疫組織化學及掃描電鏡評價
1.8.1 組織病理學檢測
從10%福爾馬林溶液中,將人工血管標本及將主動脈標本取出。選用石蠟組織包埋,并選用蘇木精和伊紅(hematoxylin eosin,HE)和彈力纖維(elastic tissue,ET)染色。處理后將人工血管進行切片,以動物自身降主動脈作為對照。觀察植入的人工血管組織學情況。
1.8.2 免疫組織化學染色檢測
用石蠟組織包埋樣本,為驗證剝離出的人工血管是否已形成天然血管的三層結構,即內皮細胞層,平滑肌層和成纖維細胞層,采用成紅細胞轉化特異性(E26 transformation specific,ETS)相關基因(ETS-related gene,ERG)抗體染色評價人工血管內皮細胞生成情況。采用肌動蛋白(Actin)染色評價平滑肌生成情況、波形蛋白(Vimentin)染色評價波形蛋白生成情況。明確我們的人工血管是否可能有誘導原位天然血管再生的功能,從而驗證該人工血管是否能誘導自體血管再生。
1.8.3 掃描電鏡觀察
從2.5%戊二醛溶液中,將人工血管標本及將主動脈標本取出。進行標本修剪取材,并固定。將固定好的樣品經后固定、脫水、干燥后、導電處理后,選用掃描電子顯微鏡(scanning electron microscopy,SEM)(hitachi,SU8100)進行觀察。通過對已植入體內的人工血管和對照組主動脈血管進行對比,觀察人工血管內壁是否形成與天然血管相同或相似的內皮層。
1.9 倫理審查
本實驗研究經大連市中心醫院、上海銀蛇臨床實驗中心倫理審查委員會審查通過,批準號:YN2023-059-03。
2 結果
2.1 基本情況
采用第5肋間進行人工血管置換,植入人工血管長度為4 cm。實驗動物于術后4 h內順利蘇醒,術后第2天恢復站立。
術后1周、6周CTA提示人工血管和實驗動物自體降主動脈匹配程度良好。人工血管通暢情況良好,人工血管內壁未見血栓形成。人工血管與實驗動物自體降主動脈吻合口處未見嚴重狹窄。
2.2 解剖標本結果
對動物的降主動脈及人工血管進行標本獲取發現,實驗動物體內人工血管及實驗動物自體降主動脈通暢良好,主動脈-人工血管吻合口未見明顯狹窄,人工血管內壁可見新生薄層組織。
2.3 組織病理學評價結果
實驗動物的病理學檢查發現 ,與自體降主動脈進行對比,實驗動物人工血管通暢,未見新生組織或血栓致人工血管內狹窄/閉塞。人工血管內壁新生組織內可見內皮細胞生成,標本大體形成了類似天然主動脈的三層結構(圖6)。人工血管內新生組織對彈力纖維染色呈強烈反應,提示有彈力纖維生成,但呈現不規則排序(圖7)。
 圖6
大直徑人工血管的組織學評價
圖6
大直徑人工血管的組織學評價
a:實驗動物人工血管置入后標本橫截面HE染色圖像;b:實驗動物自體降主動脈橫截面HE染色圖像;c:標本放大后可見人工血管(紅色箭頭),血管內可見新生類似新生主動脈三層結構組織(藍色箭頭);d:實驗動物降主動脈可見血管呈現三層結構
 圖7
大直徑人工血管的免疫組織化學評價
圖7
大直徑人工血管的免疫組織化學評價
a:實驗動物人工血管置入后標本橫截面彈力纖維染色圖像:可見人工血管內壁新生組織中,對于彈力纖維染色呈強烈陽性反應;高倍鏡下,可見新生彈力纖維,彈力纖維排列不規整(藍色箭頭為新生彈力纖維);b:實驗動物人工血管置入后標本橫截面ERG染色圖像:可見人工血管內壁新生組織的內表面,對于ERG染色呈強烈陽性反應。高倍鏡下,可見ERG強反應細胞覆蓋于人工血管內壁新生組織的內表面(藍色箭頭為強反應細胞);c:實驗動物人工血管置入后標本橫截面Actin染色圖像:可見人工血管內壁新生組織內,對于Actin染色呈強烈陽性反應;高倍鏡下,可見新生肌動蛋白,排列不規整(藍色箭頭為新生肌動蛋白);d:實驗動物人工血管置入后標本橫截面Vimentin波形蛋白染色圖像:可見人工血管內壁新生組織內,對于Vimentin波形蛋白染色呈強烈陽性反應;高倍鏡下,可見新生Vimentin波形蛋白,排列不規整(藍色箭頭為新生波形蛋白);e:實驗動物自體降主動脈橫截面彈力纖維染色圖像,主動脈中膜可見彈力纖維染色強烈反應,高倍鏡下,可見主動脈中膜彈力纖維排列規整藍色箭頭為彈力纖維);f:實驗動物自體降主動脈橫截面彈ERG染色圖像,主動脈內膜表面對于ERG染色呈強烈陽性反應,高倍鏡下,可見ERG強反應細胞覆蓋于主動脈內膜表面,為內皮細胞;g:實驗動物自體降主動脈橫截面Actin染色圖像,主動脈中膜可見Actin染色強烈反應,高倍鏡下,可見主動脈中膜排列規整(藍色箭頭為肌動蛋白);h:實驗動物自體降主動脈橫截面Vimentin染色圖像,主動脈外膜可見Vimentin染色強烈反應,高倍鏡下,可見主動脈外膜波形蛋白排列規整(藍色箭頭為波形蛋白)
2.4 免疫組織化學評價結果
實驗動物的免疫組化檢查發現 ,人工血管內新生組織內表面對ERG染色具有強烈反應,提示新生組織內表面有內皮細胞生成覆蓋。人工血管內新生組織對Actin染色具有強烈的免疫反應,提示有平滑肌組織生成,但與自體主動脈相比呈現不規則排序。人工血管內新生組織對Vimentin染色具有強烈的免疫反應,提示新生組織內有成纖維細胞生成,但與自體主動脈相比呈現不規則排序(圖7)。
掃描電鏡評價結果
掃描電鏡檢查結果顯示,人工血管內層可見內皮細胞附著。提示人工血管內新生組織內表面存在新生血管內皮細胞(圖8)。
 圖8
掃描電鏡結果
圖8
掃描電鏡結果
a、c:掃描電鏡見人工血管內新生組織內表面可見內皮細胞附著;b、d:掃描電鏡見實驗動物自體主動脈表面光滑,內表面有內皮細胞附著
3 討論
雖然目前大直徑人工血管已經應用于臨床,但目前市場上主流的大口徑人工血管的主要知識產權多歸屬于歐美國家。并且此類人工血管多以聚酯和聚四氟乙烯作為材料,由于材料本身的血栓率高、組織相容性不佳等限制性,因此往往與生物涂層技術等技術進行結合[13-14]。目前主流的涂層技術為人工血管內層輔以水解蛋白明膠涂層預凝,或者采用白蛋白-肝素涂層[15]。即便如此,人工血管移植失敗的案例依然在不斷發生[16]。人工血管移植物失敗常見的原因是人工血管內狹窄和血栓形成,并且總是繼發于動脈粥樣硬化疾病的進展或血管內膜增生[17]。此外,感染也是移植物晚期失敗的主要原因,并且感染的炎癥反應可促進移植物狹窄[18]。人工血管無法復制天然人體血管的解剖結構以及生物力學特性的不匹配可能是導致這些情況出現的重要原因[19-20]。
人類自體的主動脈是由內皮細胞構成的內膜、平滑肌細胞構成的中膜和纖維結締組織構成的外膜組成,而目前的人工血管,并不具備相應的主動脈三層結構[21]。曾有學者利用3D打印、靜電紡絲等技術,進行了多層結構的人工血管移植物研究,發現在結構和力學性能上高度模仿天然血管,可以提高體內血運重建的成功率[22-23]。
PLLA及PCL由于其優良的特性,如生物相容性、彈性、高拉伸強度等,是制造人工血管的理想材料[24]。目前此類材料已用于各種植入式醫療器械[25-26]。
我們的前期研究[25]中,靜電紡絲和超聲擴孔技術制備了具有孔徑梯度的三層PCL/PLLA人工血管并進行了包括拉伸強度、斷裂伸長率和孔徑大小的力學性能測試,以及生物相容性評估。研究發現用此種材料和方法制作的人工血管具有良好的機械性能和生物相容性,有望作為新型大直徑人工血管材料。并且通過不同梯度的三層孔隙設計,可以為以后加入生物學成分留下了基礎,為合成有生物活性的人造血管提供了物質保障。
在本研究中,實驗動物在術后CTA及解剖時主動脈人工血管通暢情況良好,這表明PCL/PLLA人工血管有著潛在良好通暢性。
對于血管尤其是主動脈來說,血管內皮細胞有著重要的生理功能。內皮細胞可以維持血管正常舒張和收縮、保持血管張力、調節血壓的作用,尤其是其具有調節機體凝血平衡的作用,能有效防止血小板的聚集、血液的凝固和血栓的形成[27]。促進人工血管內壁內皮,或者誘導其內部生成自然血管的三層結構,是新一代主動脈人工血管材料亟需解決的關鍵問題。我們的前期研究發現,有孔徑梯度的三層PCL/PLLA大直徑人工血管可以促進大鼠血管內皮細胞的黏附和增殖[25]。
當人工血管植入體內后,能夠誘導和促進內皮細胞和平滑肌細胞的再生,形成類似于天然血管的組織,是最理想的狀態。血管內皮細胞有著諸多重要的生理功能。
既往研究[28-29]發現,人工血管在植入后也可以在人工血管內表面通過固有動脈內皮的經吻合口植入,植入部位毛細血管的透壁植入,以及循環系統的內皮經血行播種等方式進行內皮化,并在內皮細胞原本的功能外,還可以減少人工血管內血栓形成和內膜增生。
在本研究中,對于標本的HE染色發現,在我們制作的人工血管內,形成了類似天然血管的三層結構。彈力纖維染色結果也提示了人工血管內部有彈力纖維生成。免疫組織化學結果中,ERG作為血管內皮細胞的標志物,在人工血管內有顯著性的免疫反應,提示人工血管內存在內皮細胞生成。人工血管內對Actin抗體有較強烈的免疫反應,證明該層形成了平滑肌,根據顯色范圍,平滑肌層并沒有出現異常增殖情況。人工血管內Vimentin波形蛋白有較好的顯色反應,證明在人工血管內形成了成纖維細胞層。電鏡結果同樣觀察到了人工血管內壁有內皮細胞存在。這提示了證明在人工血管內形成了成纖維細胞層。這提示了我們制作的人工血管可能有著誘導人工血管內內皮細胞生成修復的作用,并且具備誘導三層結構的血管壁形成的潛力。
分析這一結果出現的原因。本研究中人工血管的制作才用了靜電紡絲技術,以及超聲擴孔工藝,制備的人工血管具備著不同層次的梯度。近期有學者研究發現,多孔移植物有助于血管的建設性重塑。通過人工血管壁微孔結構的調節作用,內皮細胞和平滑肌細胞可以在移植物內壁表現出改善的生物活性。通過設計微孔結構的仿生血管移植物,可以促進血管內的內皮層和平滑肌層的生成[30]。
本研究的不足:因研究規模所限,本研究僅應用了1只實驗動物,因此結果可能存在偶然性。需要更進一步的體外及體內實驗以證實。
綜上,PLLA和PCL為原料,采用靜電紡絲和超聲擴孔技術制備的大直徑人工血管,具備潛在良好通暢性、良好的內皮化率并可能有誘導原位天然血管再生的功能。
利益沖突:無。
作者貢獻:王文君負責檢索文獻、資料整理、撰寫文章;高洋、高峰、鄭紅、石磊負責進行實驗動物手術;劉巍、范為王負責動物實驗標本的檢查及檢驗;徐暢負責人工血管的制作;董旭峰和莊熙晶負責研究計劃方案的提出、研究過程的監督,以及對文章進行批評性審閱及修改。