近年來,肺癌是我國發病率和死亡率第一的惡性腫瘤,并且呈上升趨勢,嚴重危害人類健康[1]。肺癌患者受益于胸部CT篩查和治療時間窗的提前,其病死率顯著降低[2]。隨著人工智能(artificial intelligence,AI)和影像組學技術的快速發展,基于胸部CT的智能影像在鑒別肺癌病理分型中的優勢日益凸顯。
肺腺癌具有明顯異質性,常呈現多種病理亞型混雜。含有微乳頭和實體成分的病理亞型往往提示患者術后容易復發和預后較差。然而,術中冰凍病理診斷識別微乳頭和實體成分不準確、并且與慢蠟病理診斷不一致等局限性和經典TNM分期無法評估病理亞型對I期IAC患者預后的影響,這2個臨床問題亟需解決。
2021年WHO依據肺腺癌主要病理亞型、高級別結構占比和患者預后差異進行分級,與Ⅰ級和Ⅱ級相比,Ⅲ級IAC患者更容易發生淋巴結轉移和術后復發,有更多的病理高危因素和更差的預后[3]。本課題組前期研究[4]表明,基于胸部CT的AI量化參數有助于鑒別惡性肺結節的浸潤程度,但其能否準確鑒別I期IAC的病理分級需要進一步研究。本研究旨在探討基于深度學習和影像組學技術的AI量化參數鑒別I期IAC病理分級的可行性和臨床價值。這對于臨床醫師術前規劃手術方式和制定術后治療方案意義重大。
1 資料與方法
1.1 臨床資料和分組
納入標準:(1)病理確診為浸潤性肺腺癌且影像學表現為7 mm≤肺結節長徑≤4 cm,影像學未見明顯腫大淋巴結和遠處臟器轉移(臨床I期,包括cIA期和cIB期);(2)術前1周內行CT檢查且圖像層厚≤1 mm;(3)術前未行抗腫瘤治療。
排除標準:(1)肺部多發性或彌漫性病變,無法排除炎癥表現;(2)圖像有質量欠佳或嚴重偽影;(3)未取得病理結果或病理診斷不明確的患者;(4)術前有惡性腫瘤病史或已行抗腫瘤治療。
回顧性分析 2018年5月—2023年5月在濱州醫學院附屬煙臺山醫院行高分辨率計算機體層X線攝影術(HRCT)掃描符合納入標準的臨床I期IAC患者的臨床資料。依據2021年WHO新分類肺腺癌病理分級標準,將267例IAC分為3組,分別為I級(48例)、Ⅱ級(89例)和Ⅲ級(130例)。
1.2 檢查方法
采用Philips 64排128層Incisive CT進行胸部HRCT掃描。掃描范圍從肺尖至肺底。掃描參數:管電壓140 kV,管電流300 mAs,自動管電流調制,螺距0.6 mm,重建層厚 0.67 mm,層間距0.335 mm。圖像分析采用肺窗(窗寬
1.3 提取參數
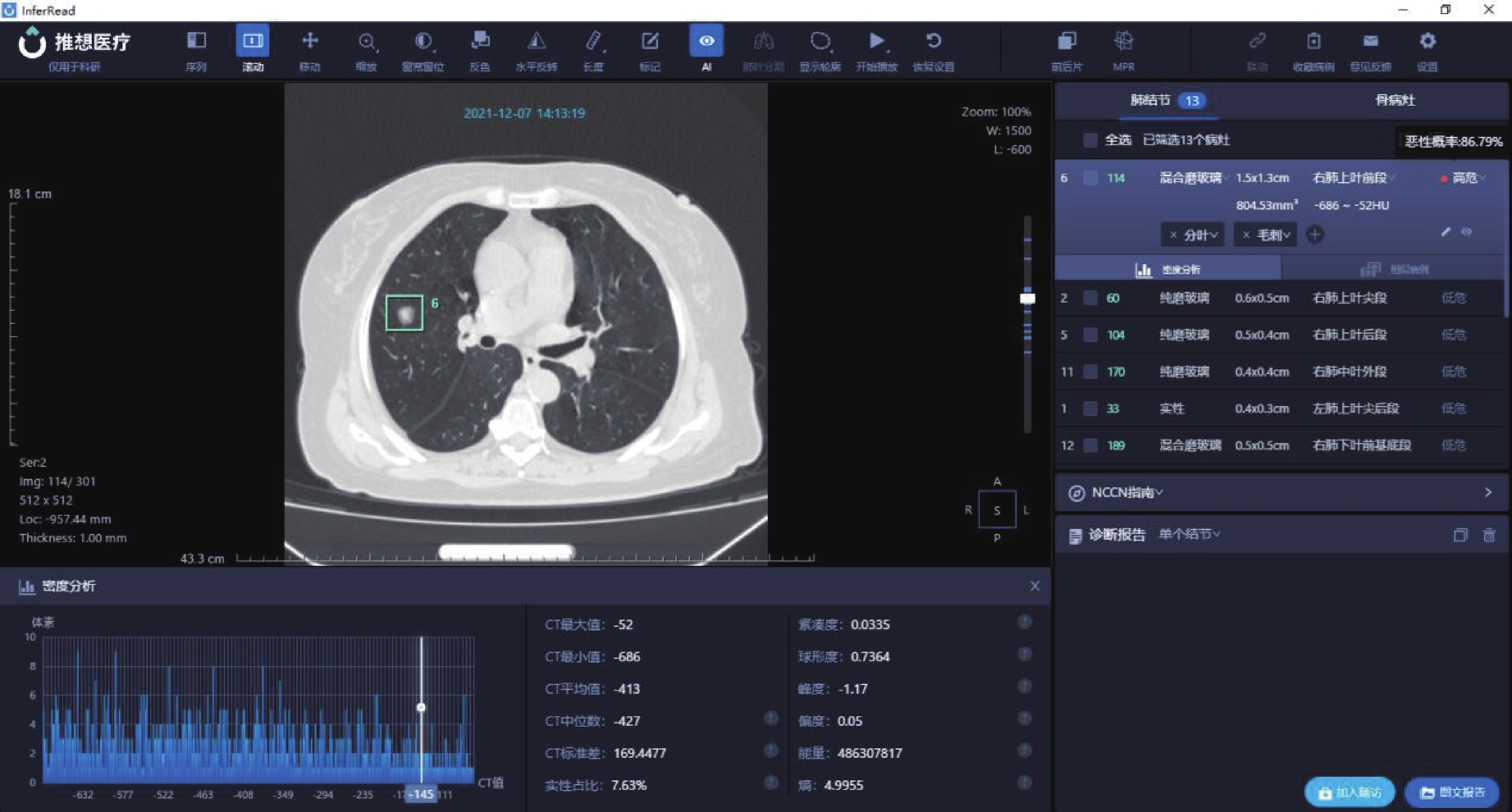
AI肺結節篩查軟件系統識別肺結節后,得到相關量化參數:長徑、短徑、CTR、惡性概率、CT平均值、CT最大值、CT最小值、CT中位值、CT標準差、緊湊度、球形度、峰度、偏度和熵。見圖1、圖2和圖3。
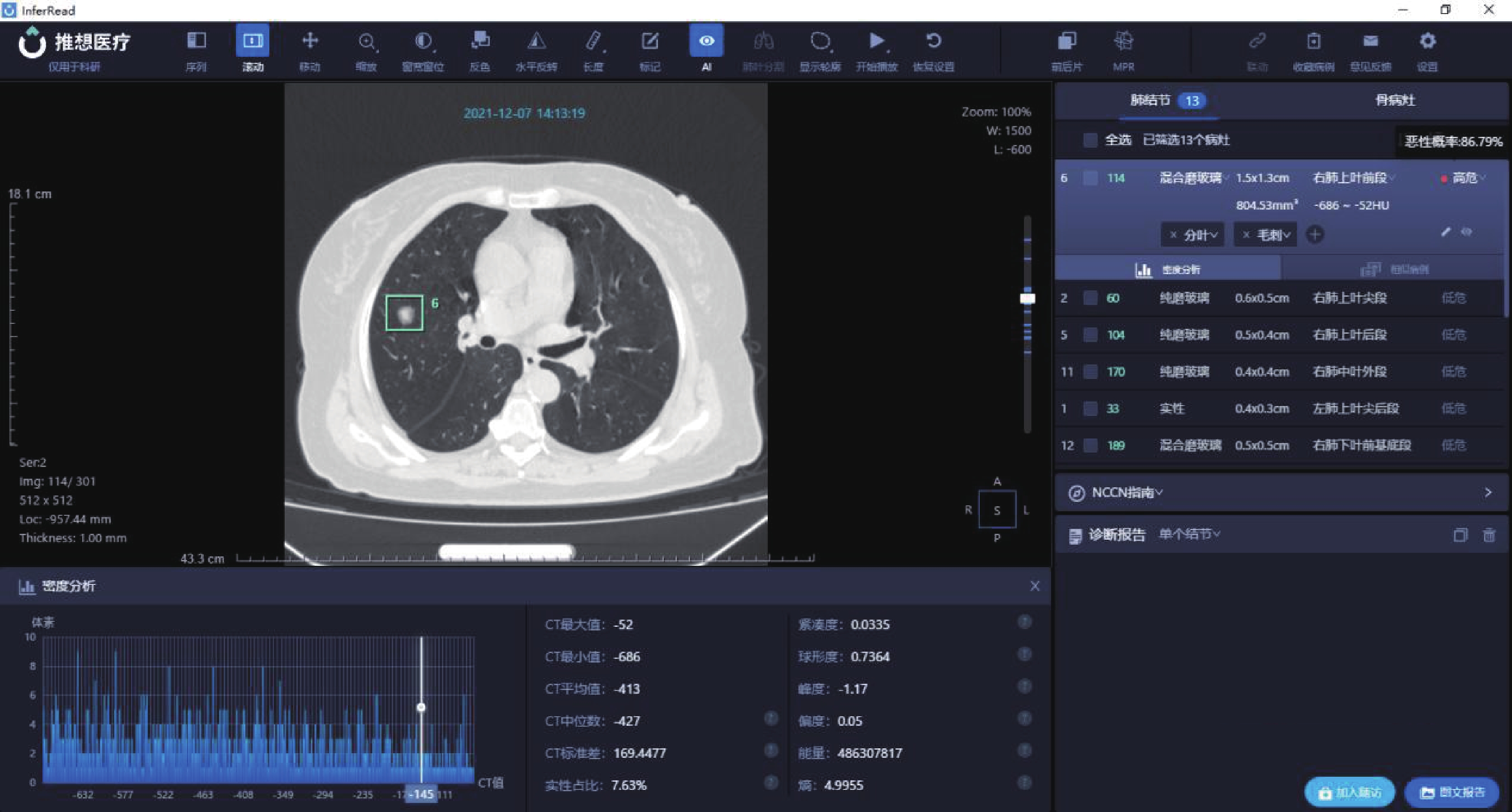 圖1
病例1的人工智能量化參數
圖1
病例1的人工智能量化參數
病例1:女,65歲,病灶位于右肺上葉前段,AI量化參數:長徑1.5 cm,短徑1.3 cm,實性成分占比 7.63%,惡性概率 86.79%,CT平均值?413 Hu,CT中位值?427 Hu,CT標準差169.4477 Hu,熵4.9955,術后病理診斷為貼壁型浸潤性腺癌(I級)
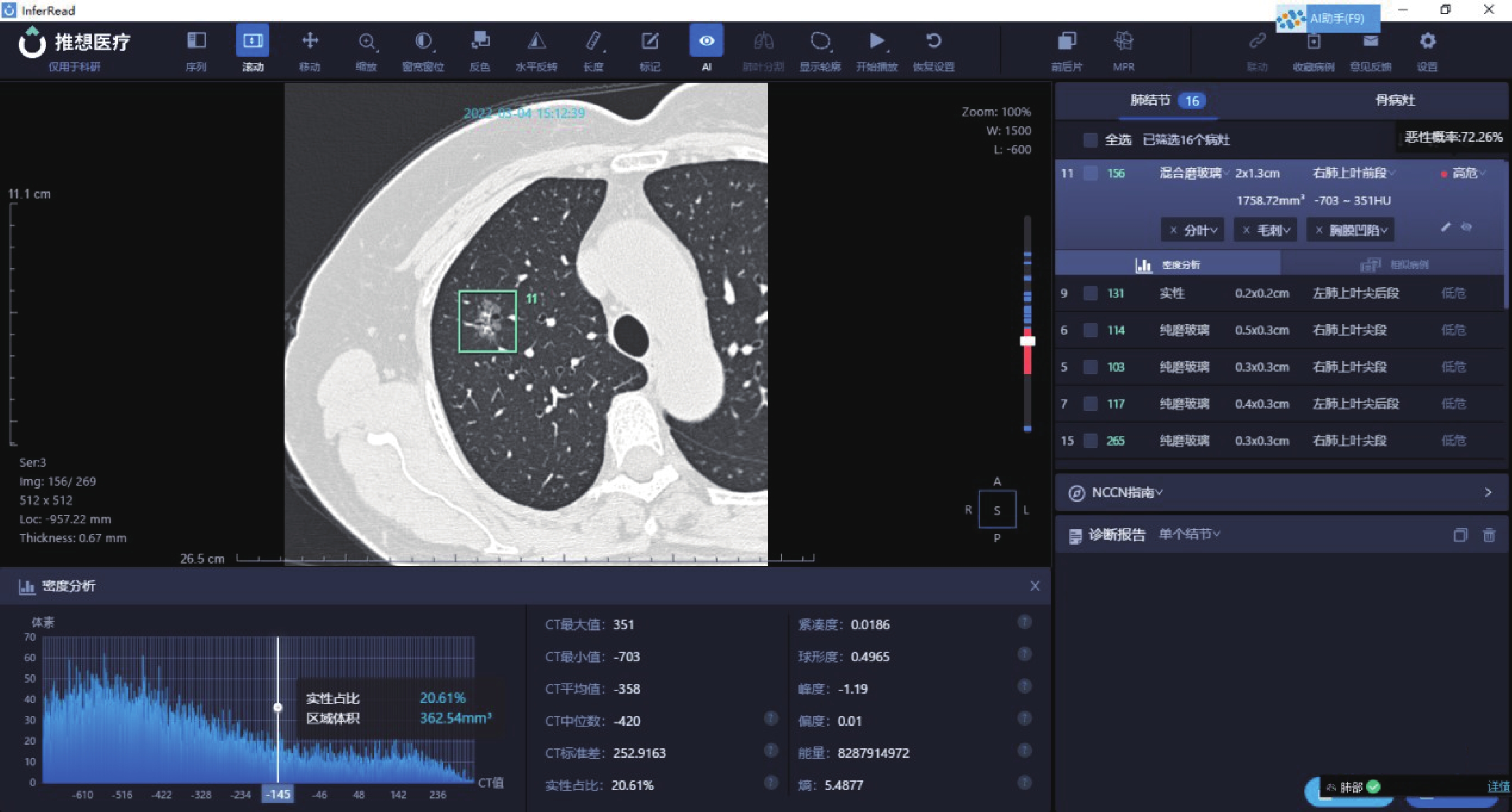
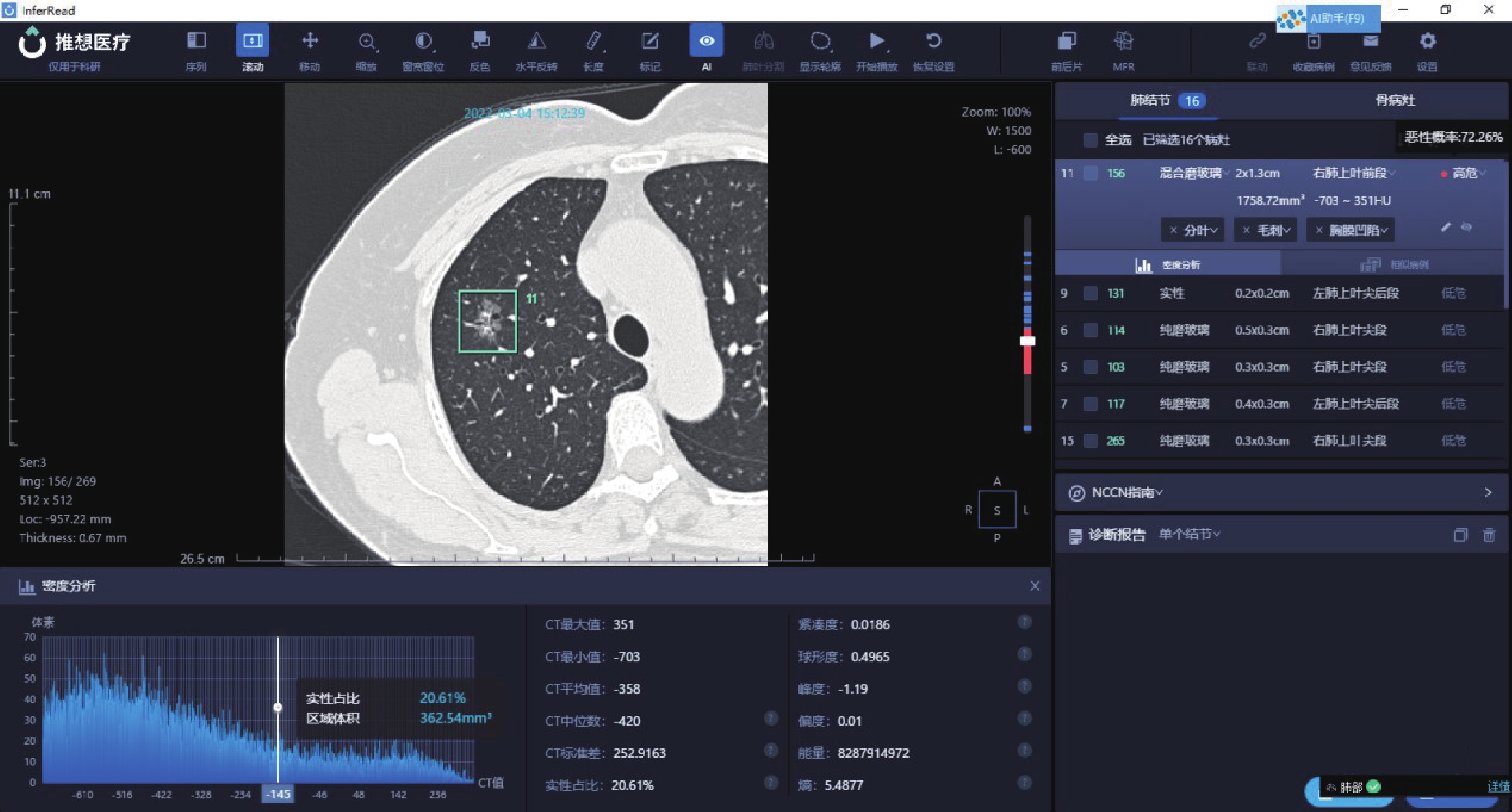 圖2
病例2的人工智能量化參數
圖2
病例2的人工智能量化參數
病例2:女,61歲,病灶位于右肺上葉前段,AI 量化參數:長徑2.0 cm,短徑1.3 cm,實性成分占比 20.61%,惡性概率72.26%,CT平均值?358 Hu,CT中位值?420 Hu,CT標準差252.9163 Hu,熵5.4877,術后病理診斷為腺泡型為主浸潤性腺癌(含10%微乳頭成分,Ⅱ級)
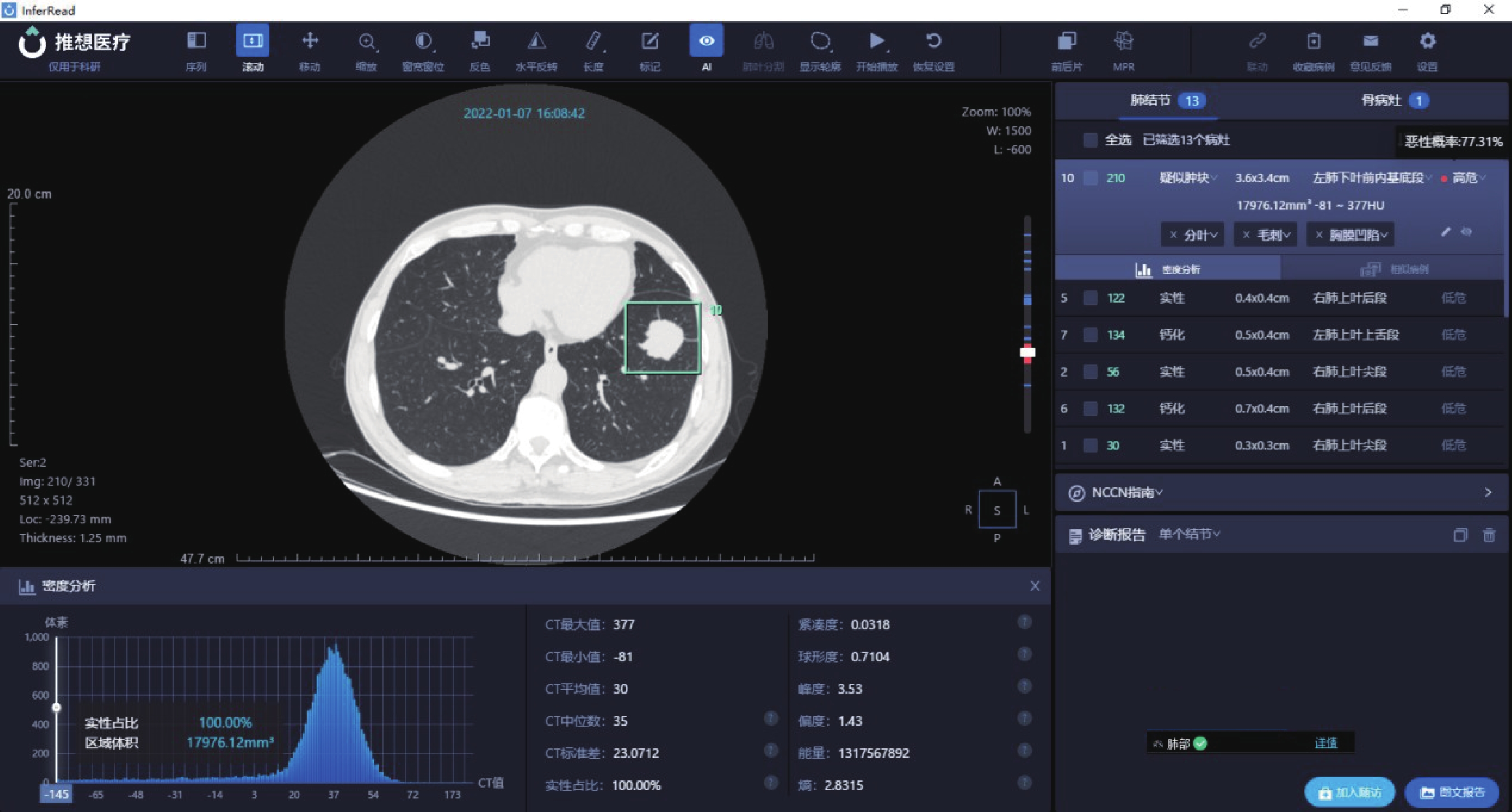
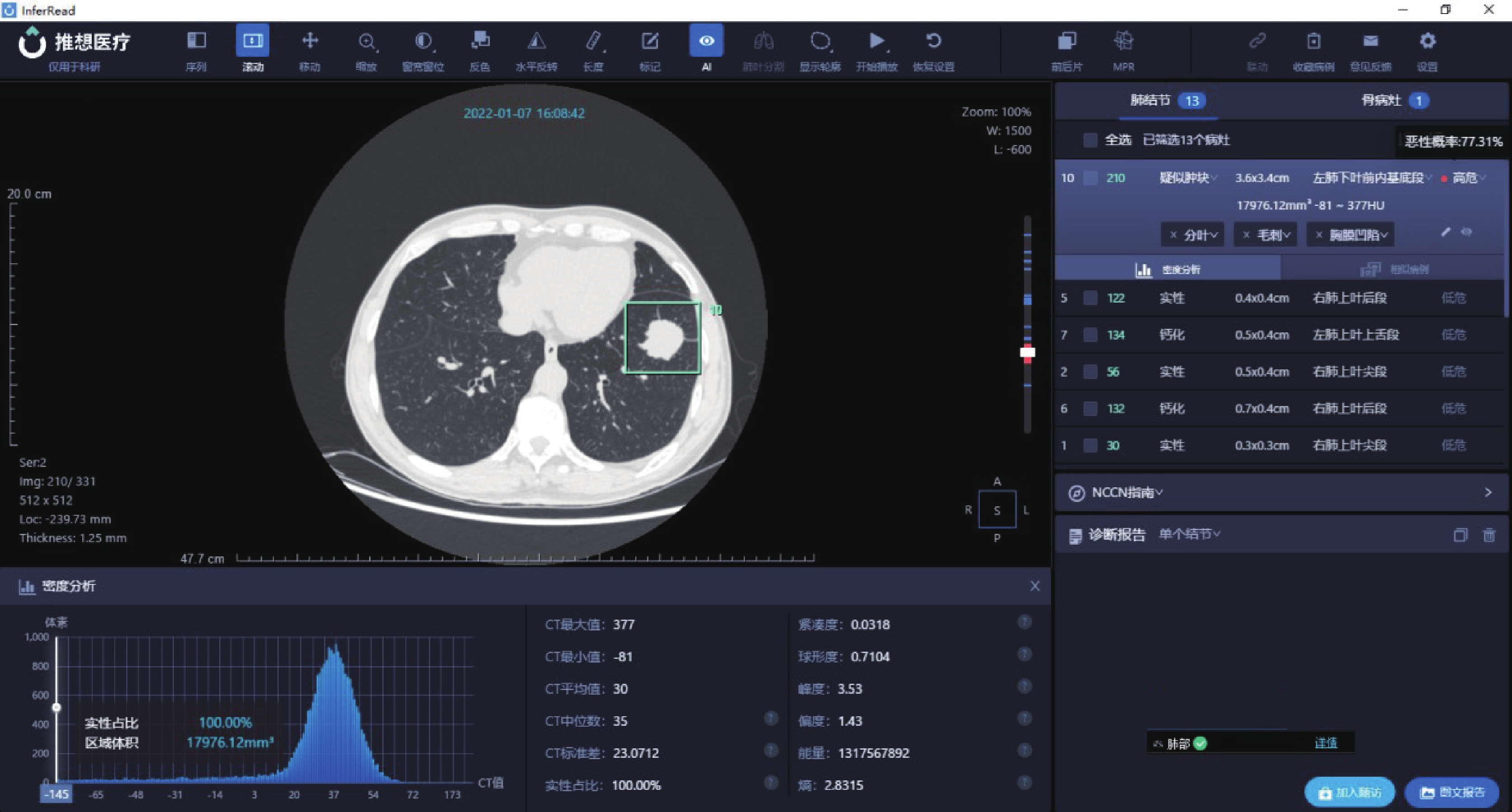 圖3
病例3的人工智能量化參數
圖3
病例3的人工智能量化參數
病例3:男,64歲,病灶位于左肺下葉前內基底段,AI 量化參數:長徑3.6 cm,短徑3.4 cm,實性成分占比100%,惡性概率77.31%,CT平均值30 Hu,CT中位值35 Hu,CT標準差23.0712 Hu,熵2.8315,術后病理診斷為微乳頭型為主浸潤性腺癌(含10%實體成分,Ⅲ級)
1.4 統計學分析
正態分布的計量資料采用均數±標準差(x±s)描述,不符合正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述。正態分布的數據中,三組數據的組間比較采用方差分析,兩組數據的組間比較采用t檢驗;非正態分布的數據中,組間比較采用秩和檢驗。并且對差異有統計學意義的三組數據的定量指標根據Bonferroni法進行兩兩比較分析。定性資料的分析采用χ2檢驗。并對所有指標進行單因素logistic回歸分析。根據最小絕對值收斂和選擇算子(least absolute shrinkage and selection operator,LASSO)回歸分析降低參數間的共線性,然后分別構建logistic回歸模型、隨機森林模型和XGBoost模型,并根據受試者工作特征(ROC)曲線、校準曲線和臨床決策曲線分別評價模型的區分度、校準度和臨床效用。最后根據列線圖進行模型的可視化。采用SPSS 26和R 4.3.2軟件進行統計學分析,LASSO回歸分析采用glmnet包,logistic回歸模型采用stats包中的glm函數,XGBoost模型采用xgboost包,隨機森林模型采用randomForest包。pROC包和ggplot2包用于模型評價和可視化、計算模型的AUC、特異度和敏感度等。擬合優度檢驗采用Hosmer-Lemeshow檢驗。雙側檢驗水準α= 0.05。
1.5 倫理審查
本研究經煙臺市煙臺山醫院醫學倫理委員會批準,煙山倫準
2 結果
最終納入261例臨床I期IAC患者的臨床資料,其中男101例、女160例,年齡 27~88(61.96±9.17)歲。所有患者經胸腔鏡手術病理證實為IAC,6例病例表現為雙發病灶,且同一患者的不同病灶作為獨立樣本進行分析。
2.1 IAC病理分級的一般臨床資料和AI量化參數組間比較
除了年齡,3組間緊湊度和球形度,性別、CTR、長徑、短徑、惡性概率、CT平均值、CT最大值、CT最小值、CT中位值、CT標準差、峰度、偏度和熵等參數差異均有統計學意義(P﹤0.05)。
三組之間的兩兩比較:與I級和Ⅱ級比較,Ⅲ級IAC具有更大的CTR、CT平均值、CT最小值、CT中位值和更小的CT標準差、峰度、偏度、熵。與Ⅱ級比較,Ⅲ級IAC具有更大的長徑、短徑、CT最大值和男性占比。與I級比較,Ⅲ級IAC具有更小的惡性概率;見表1和表2。
2.2 亞組分析中一般臨床資料和AI量化參數比較
依據高級別結構的占比進行亞組分組,其中,Ⅲ級組分為高級別結構為主亞組(高級別結構占比≥50%)和非高級別結構為主亞組(20%≤高級別結構占比<50%);而Ⅱ級組分為含有高級別結構亞組(0%<高級別結構占比<20%)和不含高級別結構亞組(高級別結構占比= 0%)。
在Ⅲ級組中,高級別結構為主亞組IAC的緊湊度和球形度更大,其男性占比高于女性占比,見表3;在Ⅱ級組中,含有高級別結構亞組IAC具有更大的長徑和短徑,見表4。
2.3 單因素logistic回歸分析
將I級組和Ⅱ級組合并,與Ⅲ級組做單因素logistic回歸分析,結果提示除了年齡外,其余變量差異均有統計學意義(P<0.05)。與I級+Ⅱ級組比較,Ⅲ級組具有更大的男性占比、緊湊度、球形度、長徑、短徑、CTR、CT最大值、CT最小值、CT平均值、CT中位值和更小的峰度、偏度、熵、惡性概率、CT標準差。見表5。
2.4 獨立危險因素及其相關性分析
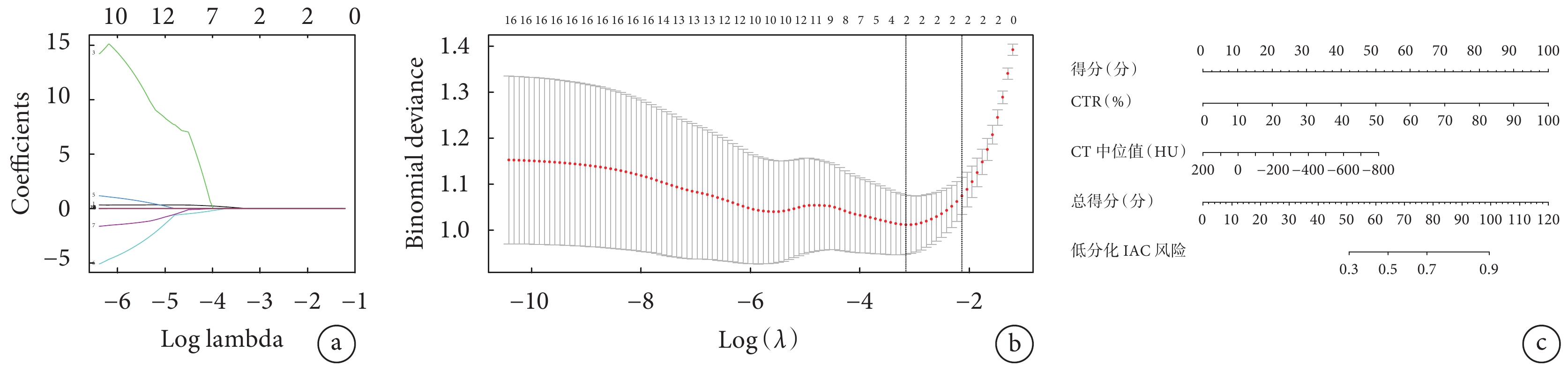
多因素logistic回歸模型參數篩選方法:納入單因素分析差異參數,參數篩選方法為向前法,保留2個模型參數,分別為CTR和CT標準差。結果提示CTR和CT標準差是鑒別Ⅲ級IAC的獨立危險因素。
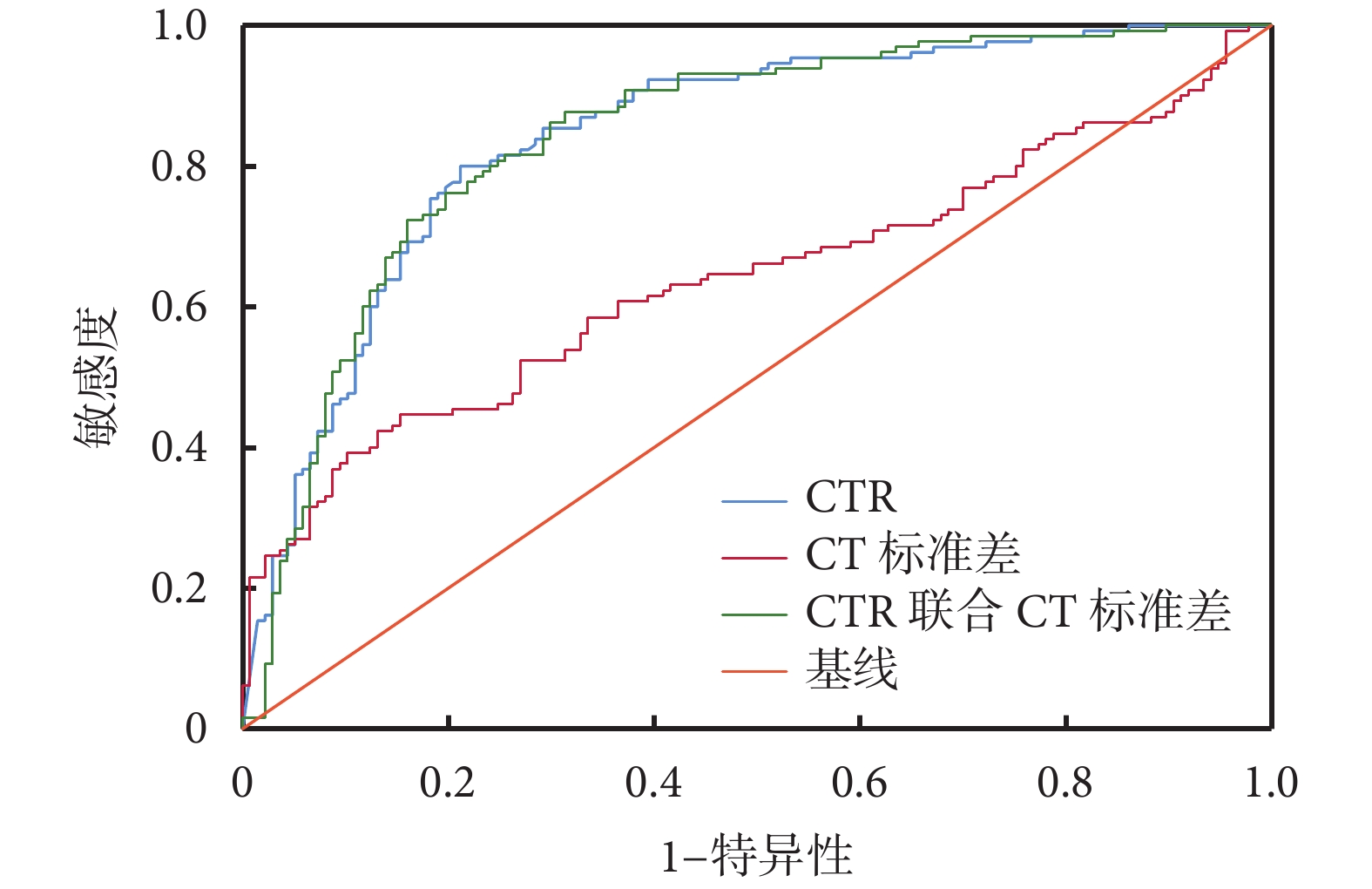
CTR的診斷閾值為39.48%,AUC為0.843(0.795,0.890),靈敏度0.800,特異度0.788。CT標準差的診斷閾值為122.75 Hu,AUC為0.638(0.571,0.706),靈敏度0.847,特異度0.446。聯合2個參數模型的AUC為0.842(0.793,0.890),靈敏度0.762,特異度0.803。見圖4、表6。
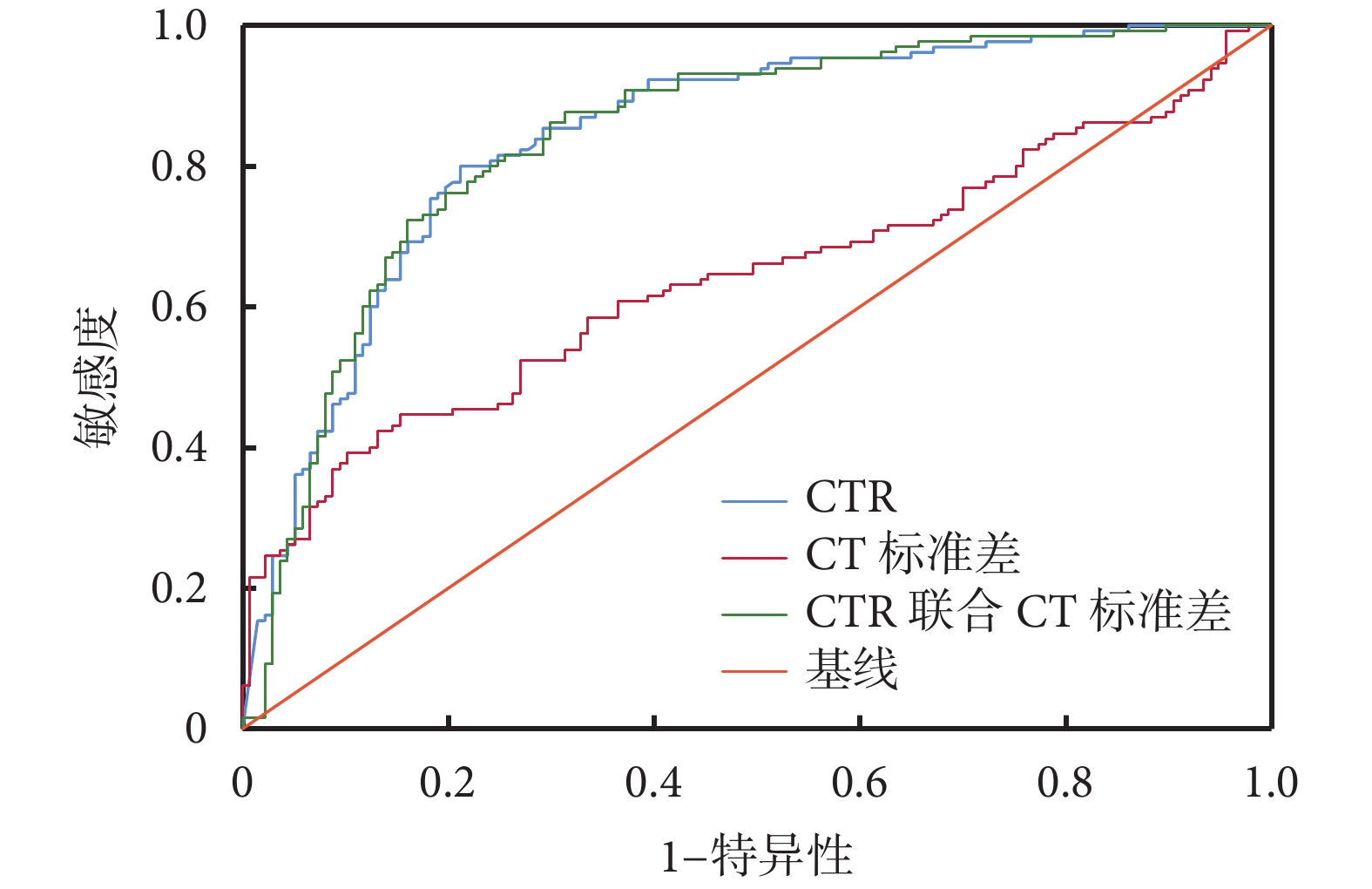 圖4
受試者工作特征曲線圖
圖4
受試者工作特征曲線圖
CTR:實性成分占比;藍色曲線?CTR;紅色曲線?CT標準差;綠色曲線?兩者聯合
相關性分析:根據Spearman秩相關計算,CTR和CT標準差之間的相關系數r =?0.487(P<0.001),兩者呈負相關。
2.5 病理特征的比較分析
I級組中無淋巴結轉移、Ⅱ級組中2例(2.25%)發生淋巴結轉移且均伴有微乳頭成分、Ⅲ級組中19例發生淋巴結轉移(14.62%)。與I級組和Ⅱ級組比較,Ⅲ級組具有更晚的TNM分期、更多的病理高危因素、更高的淋巴結轉移率和高級別結構占比;見表7。
2.6 CTR與高級別結構占比之間相關性分析
在所有患者中兩者呈正相關(r=0.612,P<0.001)。亞組分析:在Ⅲ級中兩者呈正相關(r=0.218,P=0.013),而在I級(r=?0.141,P=0.341)與Ⅱ級(r=0.175,P=0.100)中兩者之間無相關性。
2.7 LASSO回歸模型參數篩選
將本研究中全部AI量化參數納入LASSO回歸模型,降低參數之間的多重共線性,篩選出泛化能力較高,與IAC病理分級相關(系數非0)的參數。結果提示保留2個模型參數,分別為CTR和CT中位值。基于上述2個參數構建可視化模型列線圖;見圖5。
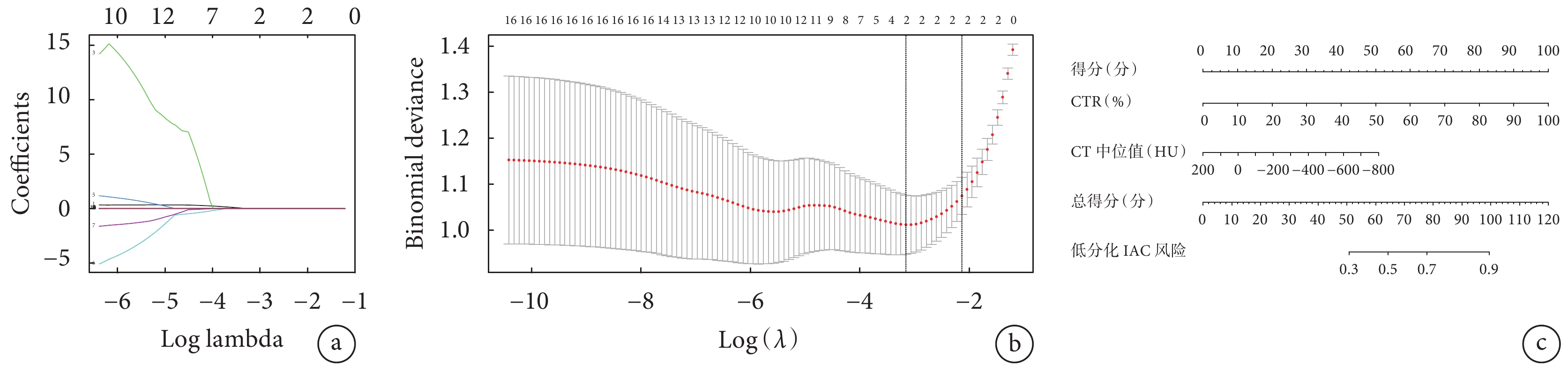 圖5
LASSO回歸模型結果
圖5
LASSO回歸模型結果
a:采用十折交叉驗證篩選參數的系數收斂圖;b:選預測IAC病理分級效能最佳的參數圖;c:預測低分化(Ⅲ級)IAC病理分級模型列線圖
按7∶3將患者劃分為訓練集和測試集,采用十折交叉驗證篩選參數的系數收斂圖(圖5a),篩選預測IAC病理分級效能最佳的參數圖(圖5b),預測低分化(Ⅲ級)IAC病理分級模型列線圖(圖5c)。
2.8 構建和驗證IAC病理分級預測模型
基于CTR和CT中位值分別構建logistic回歸模型、隨機森林模型和XGBoost模型,其中,XGBoost模型表現最佳:訓練集:AUC為0.99,靈敏度為0.93,特異度為0.96,擬合優度檢驗:χ2 = 3.41,P = 0.91;測試集:AUC為0.825,靈敏度為0.72,特異度為0.84,擬合優度檢驗:χ2 = 5.03,P = 0.75;見表8。
3 討論
傳統影像學特征依賴于影像技術的分辨率和對比度,局限于圖像灰度值一階特征和一維平面,需要手動勾畫獲取特征參數,而隨著深度學習和計算機視覺技術的快速發展,影像組學特征不僅涵蓋影像的一維特征,還包括影像的多維高階特征。與傳統影像學技術比較,影像組學通過一階特征(如熵、峰度和偏度等)和高階特征(如形狀特征、頻域特征和紋理特征等)捕捉圖像更深層次的結構和模式,在肺結節良惡性診斷、病變浸潤程度、病理分型分期、常見突變基因預測、指導治療決策、監測療效和評估預后等多方面發揮重要的作用[5-6]。
本研究使用的推想肺結節輔助診斷軟件基于深度卷積神經網絡和肺結節三維重建技術自動提取并定量胸部CT特征參數,包括一階特征和二階特征。本研究發現,CTR、長徑、短徑、惡性概率、CT平均值、CT最大值、CT最小值、CT中位值、CT標準差、峰度、偏度和熵等AI量化參數在不同病理分級的IAC中存在明顯差異。與I級和Ⅱ級比較,Ⅲ級IAC的CTR、CT平均值、CT最小值和CT中位值更大,而CT標準差、峰度、偏度和熵更小。與Ⅱ級比較,Ⅲ級IAC的長徑、短徑、CT最大值更大和男性占比更高。與I級比較,Ⅲ級IAC具有更小的惡性概率,這可能與多數良性病變鑒別困難相關。單文莉等[7]發現基于性別、胸膜牽拉征和影像組學評分的個體化預測模型可以準確鑒別IAC的病理分化程度,訓練組和測試組AUC分別為0.92和0.88。這提示基于影像組學的AI量化參數可能有助于鑒別IAC的病理分級。
本課題組前期研究[4]表明,AI量化參數準確地預測肺結節的浸潤程度,當長徑>11.45 mm、平均CT值>?503.5 Hu、CTR>1.775%時,需高度警惕為浸潤性病變。雖然AI量化參數可以準確預測肺結節的浸潤程度,但其能否準確鑒別IAC病理分級尚不清楚。何花等[8]發現基于影像組學的支持向量機分類模型有助于預測病變的浸潤程度,其相比Mayo 及 Brock 模型預測性能更佳,這提示機器學習算法和影像組學技術相結合的方法有助于鑒別疾病的病理類型。顧鑫蕾等[9]研究發現IAC復發風險分級越高的亞型,其CT平均值越大。當CT平均值>?106 Hu、CTR≥70.5% 時更傾向微乳頭/實性為主型腺癌。梁演婷等[10]研究表明CT特征聯合AI量化參數有助于術前無創評估臨床Ⅰ期的低分化IAC(高級別結構≥20%),CT平均值和峰度與低分化IAC顯著相關。而本研究表明,CTR和CT標準差是鑒別低分化(Ⅲ級)IAC的獨立危險因素,CTR的診斷閾值為39.48%,AUC為0.843,靈敏度0.800,特異度0.788;CT標準差的診斷閾值為122.75,AUC為0.638,靈敏度0.847,特異度0.446;兩者呈負相關,在Ⅲ級IAC中CTR越大,CT標準差越小。多因素logistic回歸分析提示聯合參數模型AUC為0.842,靈敏度0.762,特異度0.803。當CTR>39.48%、CT標準差<122.75時,需高度警惕為Ⅲ級IAC。既往研究側重于肺結節浸潤程度的鑒別,指導肺癌手術術式的選擇。而隨著2021年WHO新分類肺腺癌病理分級標準的提出和亞肺葉微創手術的興起,僅僅依據肺結節浸潤程度決定手術方式是不準確的。筆者認為應依據具有預后價值的IAC病理分級指導手術術式的個性化選擇,為是否術后輔助治療作參考。
與既往JCOG研究手動勾畫腫瘤實性成分二維平面直徑比值不同,本研究中CTR是指AI輔助診斷軟件自動提取IAC三維空間中實性成分與腫瘤的體積比(CT臨界值為?145 Hu),更加客觀、準確地評估腫瘤實性成分占比。既往研究[11]表明,CTR與IAC中浸潤成分多少、高級別結構占比、Ki-67高表達、病理高危因素、淋巴結轉移和患者預后等因素密切相關。JCOG研究組[12]定義了CTR≤0.25為影像學非浸潤性標準,而CTR>0.25為影像學浸潤性肺癌,創新性提出通過評估術前肺結節影像學特征指導手術術式的臨床策略,這種方法有效地彌補“僅僅依據術中快速病理診斷決定手術方案的局限性”。而本課題組前期研究發現三維空間中CTR>1.775%即考慮為IAC,兩種方法鑒別肺癌影像學浸潤性標準存在明顯差異,這種差異源于參數特征維度的不同,三維CTR更加精準、可重復性強。Tsutani等[13]研究發現,年齡、CTR、ITT和VPI是I期肺癌術后復發的獨立危險因素。Kim等[14]研究發現,STAS在常發生在實性腫瘤中,而在單純磨玻璃病變中沒有發現,進一步分析提示STAS存在于CTR>0.4的腫瘤中。既往研究[15-16]表明,CTR是I期肺癌發生淋巴結轉移的重要預測因素,CTR越大,發生淋巴結轉移的概率越高。另外,研究表明[17],CTR和淋巴結轉移是臨床IA期肺癌患者預后的獨立危險因素,CTR是預測微乳頭或實體成分的唯一危險因素。而本研究發現CTR與IAC的高級別結構占比呈正相關。亞組分析提示Ⅲ級IAC的CTR越大,提示高級別結構占比越高,淋巴結轉移風險越高;而在I級和Ⅱ級IAC中兩者無相關性,提示可能與高級別結構占比較低有關。
經典TNM分期僅對腫瘤大小、淋巴結轉移、遠處臟器轉移等方面進行患者預后評估,而缺少對IAC病理亞型和高級別結構占比的評估,尤其對評估I期IAC患者的預后存在局限性。2021 WHO新分類IAC病理分級依據主要病理組織學類型和高級別結構占比分級,該分級具有預后價值[3]。本研究表明,與I級和Ⅱ級相比,Ⅲ級IAC具有更晚的TNM分期、更高的淋巴結轉移率和高級別結構占比、更多的病理高危因素,這與Ahn等研究結果一致[18]。因其術后容易復發和轉移,選擇亞肺葉切除或淋巴結采樣應慎重,筆者認為Ⅲ級IAC在保證手術切緣和淋巴結充分評估的前提下,選擇肺葉切除聯合肺門、縱隔系統性淋巴結清掃更為恰當,應依據pTNM分期、高級別結構占比、程序性死亡受體-配體1(Programmed death receptor-ligand 1, PD-L1)表達量和基因突變狀態等因素綜合制定術后輔助治療方案。近年來,隨著高級別前瞻性實驗研究結果的陸續披露,JCOG0802研究表明[19],對于腫瘤直徑≤2cm,CTR>0.5的外周型IA期NSCLC患者,肺段切除術后患者的5年總生存率優于肺葉切除,但局部復發率略高于后者。CALGB140503研究[20]具有相似的結果,上述研究均提示亞肺葉切除可作為I期NSCLC的標準術式。JCOG1211研究表明[21],直徑≤3cm、以磨玻璃結節為主IAC術后預后較好,5年無復發生存率和總生存率分別為97%、98%。肺段切除術后6個月和12個月,患者FEV1和用力肺活量下降水平均顯著低于肺葉切除,這提示肺段切除有利于保護肺功能。另外,研究表明[22],完整淋巴結評估影響NSCLC患者的預后,尤其對伴有微乳頭或實體成分的IAC患者至關重要。I級IAC未見淋巴結轉移并且患者預后最佳,宜選擇亞肺葉切除聯合淋巴結采樣。本研究僅有2例伴有高級別結構的Ⅱ級IAC發生淋巴結轉移,臨床醫師可根據病變位置、患者心肺功能、淋巴結大小、AI量化參數等因素綜合評估,選擇適宜的肺組織切除范圍和淋巴結處理策略。
隨著人工智能和大數據時代的到來,研究人員通過深度學習技術和多模態數據構建和驗證大模型已然成為時代潮流,如盤古氣象大模型和生成式預訓練模型(ChatGPT)。機器學習是研究使用計算機模擬或實現人類學習活動的科學,是人工智能中最具智能特征、最前沿的研究領域之一。深度學習則是機器學習的一個分支,其基于人工神經網絡的概念,通過多層次的神經元結構來學習和理解數據。本研究通過深度學習、機器學習和影像組學相結合的方法構建和驗證疾病預測模型,為臨床決策提供重要參考。
XGBoost是一種高效的、靈活的機器學習算法,特別適用于回歸和分類問題。它是基于梯度提升框架開發的,由陳天奇[23]于2016年提出。與其他機器學習算法比較,其具有高預測性能、自動處理缺失值、內置正則化功能、并行化處理、特征重要性評估和可擴展性強等優點,但也存在參數調整復雜、不適合非結構化數據、計算資源需求較高和對異常值敏感等缺點。冷菲等[24]研究表明基于XGBoost算法構建模型鑒別肺腺癌和肺鱗癌的分類效果最佳,優于logistic回歸模型和支持向量機分類模型。本研究通過LASSO回歸模型降低參數之間的多重共線性并篩選出2個與IAC病理分級相關的AI量化參數,即CTR和CT中位值。基于2個參數構建并內部驗證三種機器學習模型的預測效能。其中,XGBoost模型預測效能最佳:訓練集:AUC為0.99,靈敏度為0.93,特異度為0.96;測試集:AUC為0.825,靈敏度為0.72,特異度為0.84。最佳模型由列線圖可視化展示,代入AI量化參數可得患Ⅲ級IAC的風險概率,具有簡明、方便和臨床指導性等特點,為臨床醫師提供有力的臨床決策支持。本研究結果提示基于XGboost算法和AI量化參數構建預測模型準確地鑒別IAC的病理分級,有助于臨床醫師術前充分評估IAC病理分級和患者預后情況,選擇適宜的肺組織切除范圍和淋巴結處理策略,達到精準治療的目的。這有效地解決2個重要問題:“經典TNM分期無法評估I期IAC病理分級對患者預后的影響和僅僅依據術中快速病理診斷決定手術術式不準確”,該模型是一種準確且簡便的IAC病理分級評估方法,值得臨床推廣應用。與既往研究側重于從影像學角度分析IAC量化參數的不同,本文創新性地從外科角度探討I期IAC病理分級預測模型對手術術式選擇的參考意義,具有一定的臨床應用價值。
本研究屬于單中心回顧性分析,預測模型可能存在過擬合問題,缺少外部驗證數據、前瞻性和預后隨訪數據。我們研究團隊正努力擴大樣本量、開展多中心研究和收集隨訪數據。隨著AI技術不斷發展,“AI+醫學”模式為臨床醫師提供一種嶄新的、獨特的視野:挑戰經典標準、顛覆傳統認知、精進手術技巧、指導臨床決策。但目前AI技術尚不成熟,存在一定漏診率和誤診率,機器學習算法并不完美,有待進一步完善。我們相信在不遠的將來,“AI+醫學”模式無疑會加速更加微創、更加精準的醫學時代的到來,幫助臨床醫師做出“以患者為中心”個性化的臨床決策。
利益沖突:無。
作者貢獻:梁云負責查閱資料、撰寫論文;任蒙蒙、黃德龍、刁晶艷和牟旭日負責收集、整理并分析數據;張國偉、劉曙亮、費秀渠負責審校與修改論文;謝寧、狄冬梅負責選題、論文設計。
致謝 感謝王敏潔提供推想AI軟件使用的技術支持!
近年來,肺癌是我國發病率和死亡率第一的惡性腫瘤,并且呈上升趨勢,嚴重危害人類健康[1]。肺癌患者受益于胸部CT篩查和治療時間窗的提前,其病死率顯著降低[2]。隨著人工智能(artificial intelligence,AI)和影像組學技術的快速發展,基于胸部CT的智能影像在鑒別肺癌病理分型中的優勢日益凸顯。
肺腺癌具有明顯異質性,常呈現多種病理亞型混雜。含有微乳頭和實體成分的病理亞型往往提示患者術后容易復發和預后較差。然而,術中冰凍病理診斷識別微乳頭和實體成分不準確、并且與慢蠟病理診斷不一致等局限性和經典TNM分期無法評估病理亞型對I期IAC患者預后的影響,這2個臨床問題亟需解決。
2021年WHO依據肺腺癌主要病理亞型、高級別結構占比和患者預后差異進行分級,與Ⅰ級和Ⅱ級相比,Ⅲ級IAC患者更容易發生淋巴結轉移和術后復發,有更多的病理高危因素和更差的預后[3]。本課題組前期研究[4]表明,基于胸部CT的AI量化參數有助于鑒別惡性肺結節的浸潤程度,但其能否準確鑒別I期IAC的病理分級需要進一步研究。本研究旨在探討基于深度學習和影像組學技術的AI量化參數鑒別I期IAC病理分級的可行性和臨床價值。這對于臨床醫師術前規劃手術方式和制定術后治療方案意義重大。
1 資料與方法
1.1 臨床資料和分組
納入標準:(1)病理確診為浸潤性肺腺癌且影像學表現為7 mm≤肺結節長徑≤4 cm,影像學未見明顯腫大淋巴結和遠處臟器轉移(臨床I期,包括cIA期和cIB期);(2)術前1周內行CT檢查且圖像層厚≤1 mm;(3)術前未行抗腫瘤治療。
排除標準:(1)肺部多發性或彌漫性病變,無法排除炎癥表現;(2)圖像有質量欠佳或嚴重偽影;(3)未取得病理結果或病理診斷不明確的患者;(4)術前有惡性腫瘤病史或已行抗腫瘤治療。
回顧性分析 2018年5月—2023年5月在濱州醫學院附屬煙臺山醫院行高分辨率計算機體層X線攝影術(HRCT)掃描符合納入標準的臨床I期IAC患者的臨床資料。依據2021年WHO新分類肺腺癌病理分級標準,將267例IAC分為3組,分別為I級(48例)、Ⅱ級(89例)和Ⅲ級(130例)。
1.2 檢查方法
采用Philips 64排128層Incisive CT進行胸部HRCT掃描。掃描范圍從肺尖至肺底。掃描參數:管電壓140 kV,管電流300 mAs,自動管電流調制,螺距0.6 mm,重建層厚 0.67 mm,層間距0.335 mm。圖像分析采用肺窗(窗寬
1.3 提取參數
AI肺結節篩查軟件系統識別肺結節后,得到相關量化參數:長徑、短徑、CTR、惡性概率、CT平均值、CT最大值、CT最小值、CT中位值、CT標準差、緊湊度、球形度、峰度、偏度和熵。見圖1、圖2和圖3。
 圖1
病例1的人工智能量化參數
圖1
病例1的人工智能量化參數
病例1:女,65歲,病灶位于右肺上葉前段,AI量化參數:長徑1.5 cm,短徑1.3 cm,實性成分占比 7.63%,惡性概率 86.79%,CT平均值?413 Hu,CT中位值?427 Hu,CT標準差169.4477 Hu,熵4.9955,術后病理診斷為貼壁型浸潤性腺癌(I級)
 圖2
病例2的人工智能量化參數
圖2
病例2的人工智能量化參數
病例2:女,61歲,病灶位于右肺上葉前段,AI 量化參數:長徑2.0 cm,短徑1.3 cm,實性成分占比 20.61%,惡性概率72.26%,CT平均值?358 Hu,CT中位值?420 Hu,CT標準差252.9163 Hu,熵5.4877,術后病理診斷為腺泡型為主浸潤性腺癌(含10%微乳頭成分,Ⅱ級)
 圖3
病例3的人工智能量化參數
圖3
病例3的人工智能量化參數
病例3:男,64歲,病灶位于左肺下葉前內基底段,AI 量化參數:長徑3.6 cm,短徑3.4 cm,實性成分占比100%,惡性概率77.31%,CT平均值30 Hu,CT中位值35 Hu,CT標準差23.0712 Hu,熵2.8315,術后病理診斷為微乳頭型為主浸潤性腺癌(含10%實體成分,Ⅲ級)
1.4 統計學分析
正態分布的計量資料采用均數±標準差(x±s)描述,不符合正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述。正態分布的數據中,三組數據的組間比較采用方差分析,兩組數據的組間比較采用t檢驗;非正態分布的數據中,組間比較采用秩和檢驗。并且對差異有統計學意義的三組數據的定量指標根據Bonferroni法進行兩兩比較分析。定性資料的分析采用χ2檢驗。并對所有指標進行單因素logistic回歸分析。根據最小絕對值收斂和選擇算子(least absolute shrinkage and selection operator,LASSO)回歸分析降低參數間的共線性,然后分別構建logistic回歸模型、隨機森林模型和XGBoost模型,并根據受試者工作特征(ROC)曲線、校準曲線和臨床決策曲線分別評價模型的區分度、校準度和臨床效用。最后根據列線圖進行模型的可視化。采用SPSS 26和R 4.3.2軟件進行統計學分析,LASSO回歸分析采用glmnet包,logistic回歸模型采用stats包中的glm函數,XGBoost模型采用xgboost包,隨機森林模型采用randomForest包。pROC包和ggplot2包用于模型評價和可視化、計算模型的AUC、特異度和敏感度等。擬合優度檢驗采用Hosmer-Lemeshow檢驗。雙側檢驗水準α= 0.05。
1.5 倫理審查
本研究經煙臺市煙臺山醫院醫學倫理委員會批準,煙山倫準
2 結果
最終納入261例臨床I期IAC患者的臨床資料,其中男101例、女160例,年齡 27~88(61.96±9.17)歲。所有患者經胸腔鏡手術病理證實為IAC,6例病例表現為雙發病灶,且同一患者的不同病灶作為獨立樣本進行分析。
2.1 IAC病理分級的一般臨床資料和AI量化參數組間比較
除了年齡,3組間緊湊度和球形度,性別、CTR、長徑、短徑、惡性概率、CT平均值、CT最大值、CT最小值、CT中位值、CT標準差、峰度、偏度和熵等參數差異均有統計學意義(P﹤0.05)。
三組之間的兩兩比較:與I級和Ⅱ級比較,Ⅲ級IAC具有更大的CTR、CT平均值、CT最小值、CT中位值和更小的CT標準差、峰度、偏度、熵。與Ⅱ級比較,Ⅲ級IAC具有更大的長徑、短徑、CT最大值和男性占比。與I級比較,Ⅲ級IAC具有更小的惡性概率;見表1和表2。
2.2 亞組分析中一般臨床資料和AI量化參數比較
依據高級別結構的占比進行亞組分組,其中,Ⅲ級組分為高級別結構為主亞組(高級別結構占比≥50%)和非高級別結構為主亞組(20%≤高級別結構占比<50%);而Ⅱ級組分為含有高級別結構亞組(0%<高級別結構占比<20%)和不含高級別結構亞組(高級別結構占比= 0%)。
在Ⅲ級組中,高級別結構為主亞組IAC的緊湊度和球形度更大,其男性占比高于女性占比,見表3;在Ⅱ級組中,含有高級別結構亞組IAC具有更大的長徑和短徑,見表4。
2.3 單因素logistic回歸分析
將I級組和Ⅱ級組合并,與Ⅲ級組做單因素logistic回歸分析,結果提示除了年齡外,其余變量差異均有統計學意義(P<0.05)。與I級+Ⅱ級組比較,Ⅲ級組具有更大的男性占比、緊湊度、球形度、長徑、短徑、CTR、CT最大值、CT最小值、CT平均值、CT中位值和更小的峰度、偏度、熵、惡性概率、CT標準差。見表5。
2.4 獨立危險因素及其相關性分析
多因素logistic回歸模型參數篩選方法:納入單因素分析差異參數,參數篩選方法為向前法,保留2個模型參數,分別為CTR和CT標準差。結果提示CTR和CT標準差是鑒別Ⅲ級IAC的獨立危險因素。
CTR的診斷閾值為39.48%,AUC為0.843(0.795,0.890),靈敏度0.800,特異度0.788。CT標準差的診斷閾值為122.75 Hu,AUC為0.638(0.571,0.706),靈敏度0.847,特異度0.446。聯合2個參數模型的AUC為0.842(0.793,0.890),靈敏度0.762,特異度0.803。見圖4、表6。
 圖4
受試者工作特征曲線圖
圖4
受試者工作特征曲線圖
CTR:實性成分占比;藍色曲線?CTR;紅色曲線?CT標準差;綠色曲線?兩者聯合
相關性分析:根據Spearman秩相關計算,CTR和CT標準差之間的相關系數r =?0.487(P<0.001),兩者呈負相關。
2.5 病理特征的比較分析
I級組中無淋巴結轉移、Ⅱ級組中2例(2.25%)發生淋巴結轉移且均伴有微乳頭成分、Ⅲ級組中19例發生淋巴結轉移(14.62%)。與I級組和Ⅱ級組比較,Ⅲ級組具有更晚的TNM分期、更多的病理高危因素、更高的淋巴結轉移率和高級別結構占比;見表7。
2.6 CTR與高級別結構占比之間相關性分析
在所有患者中兩者呈正相關(r=0.612,P<0.001)。亞組分析:在Ⅲ級中兩者呈正相關(r=0.218,P=0.013),而在I級(r=?0.141,P=0.341)與Ⅱ級(r=0.175,P=0.100)中兩者之間無相關性。
2.7 LASSO回歸模型參數篩選
將本研究中全部AI量化參數納入LASSO回歸模型,降低參數之間的多重共線性,篩選出泛化能力較高,與IAC病理分級相關(系數非0)的參數。結果提示保留2個模型參數,分別為CTR和CT中位值。基于上述2個參數構建可視化模型列線圖;見圖5。
 圖5
LASSO回歸模型結果
圖5
LASSO回歸模型結果
a:采用十折交叉驗證篩選參數的系數收斂圖;b:選預測IAC病理分級效能最佳的參數圖;c:預測低分化(Ⅲ級)IAC病理分級模型列線圖
按7∶3將患者劃分為訓練集和測試集,采用十折交叉驗證篩選參數的系數收斂圖(圖5a),篩選預測IAC病理分級效能最佳的參數圖(圖5b),預測低分化(Ⅲ級)IAC病理分級模型列線圖(圖5c)。
2.8 構建和驗證IAC病理分級預測模型
基于CTR和CT中位值分別構建logistic回歸模型、隨機森林模型和XGBoost模型,其中,XGBoost模型表現最佳:訓練集:AUC為0.99,靈敏度為0.93,特異度為0.96,擬合優度檢驗:χ2 = 3.41,P = 0.91;測試集:AUC為0.825,靈敏度為0.72,特異度為0.84,擬合優度檢驗:χ2 = 5.03,P = 0.75;見表8。
3 討論
傳統影像學特征依賴于影像技術的分辨率和對比度,局限于圖像灰度值一階特征和一維平面,需要手動勾畫獲取特征參數,而隨著深度學習和計算機視覺技術的快速發展,影像組學特征不僅涵蓋影像的一維特征,還包括影像的多維高階特征。與傳統影像學技術比較,影像組學通過一階特征(如熵、峰度和偏度等)和高階特征(如形狀特征、頻域特征和紋理特征等)捕捉圖像更深層次的結構和模式,在肺結節良惡性診斷、病變浸潤程度、病理分型分期、常見突變基因預測、指導治療決策、監測療效和評估預后等多方面發揮重要的作用[5-6]。
本研究使用的推想肺結節輔助診斷軟件基于深度卷積神經網絡和肺結節三維重建技術自動提取并定量胸部CT特征參數,包括一階特征和二階特征。本研究發現,CTR、長徑、短徑、惡性概率、CT平均值、CT最大值、CT最小值、CT中位值、CT標準差、峰度、偏度和熵等AI量化參數在不同病理分級的IAC中存在明顯差異。與I級和Ⅱ級比較,Ⅲ級IAC的CTR、CT平均值、CT最小值和CT中位值更大,而CT標準差、峰度、偏度和熵更小。與Ⅱ級比較,Ⅲ級IAC的長徑、短徑、CT最大值更大和男性占比更高。與I級比較,Ⅲ級IAC具有更小的惡性概率,這可能與多數良性病變鑒別困難相關。單文莉等[7]發現基于性別、胸膜牽拉征和影像組學評分的個體化預測模型可以準確鑒別IAC的病理分化程度,訓練組和測試組AUC分別為0.92和0.88。這提示基于影像組學的AI量化參數可能有助于鑒別IAC的病理分級。
本課題組前期研究[4]表明,AI量化參數準確地預測肺結節的浸潤程度,當長徑>11.45 mm、平均CT值>?503.5 Hu、CTR>1.775%時,需高度警惕為浸潤性病變。雖然AI量化參數可以準確預測肺結節的浸潤程度,但其能否準確鑒別IAC病理分級尚不清楚。何花等[8]發現基于影像組學的支持向量機分類模型有助于預測病變的浸潤程度,其相比Mayo 及 Brock 模型預測性能更佳,這提示機器學習算法和影像組學技術相結合的方法有助于鑒別疾病的病理類型。顧鑫蕾等[9]研究發現IAC復發風險分級越高的亞型,其CT平均值越大。當CT平均值>?106 Hu、CTR≥70.5% 時更傾向微乳頭/實性為主型腺癌。梁演婷等[10]研究表明CT特征聯合AI量化參數有助于術前無創評估臨床Ⅰ期的低分化IAC(高級別結構≥20%),CT平均值和峰度與低分化IAC顯著相關。而本研究表明,CTR和CT標準差是鑒別低分化(Ⅲ級)IAC的獨立危險因素,CTR的診斷閾值為39.48%,AUC為0.843,靈敏度0.800,特異度0.788;CT標準差的診斷閾值為122.75,AUC為0.638,靈敏度0.847,特異度0.446;兩者呈負相關,在Ⅲ級IAC中CTR越大,CT標準差越小。多因素logistic回歸分析提示聯合參數模型AUC為0.842,靈敏度0.762,特異度0.803。當CTR>39.48%、CT標準差<122.75時,需高度警惕為Ⅲ級IAC。既往研究側重于肺結節浸潤程度的鑒別,指導肺癌手術術式的選擇。而隨著2021年WHO新分類肺腺癌病理分級標準的提出和亞肺葉微創手術的興起,僅僅依據肺結節浸潤程度決定手術方式是不準確的。筆者認為應依據具有預后價值的IAC病理分級指導手術術式的個性化選擇,為是否術后輔助治療作參考。
與既往JCOG研究手動勾畫腫瘤實性成分二維平面直徑比值不同,本研究中CTR是指AI輔助診斷軟件自動提取IAC三維空間中實性成分與腫瘤的體積比(CT臨界值為?145 Hu),更加客觀、準確地評估腫瘤實性成分占比。既往研究[11]表明,CTR與IAC中浸潤成分多少、高級別結構占比、Ki-67高表達、病理高危因素、淋巴結轉移和患者預后等因素密切相關。JCOG研究組[12]定義了CTR≤0.25為影像學非浸潤性標準,而CTR>0.25為影像學浸潤性肺癌,創新性提出通過評估術前肺結節影像學特征指導手術術式的臨床策略,這種方法有效地彌補“僅僅依據術中快速病理診斷決定手術方案的局限性”。而本課題組前期研究發現三維空間中CTR>1.775%即考慮為IAC,兩種方法鑒別肺癌影像學浸潤性標準存在明顯差異,這種差異源于參數特征維度的不同,三維CTR更加精準、可重復性強。Tsutani等[13]研究發現,年齡、CTR、ITT和VPI是I期肺癌術后復發的獨立危險因素。Kim等[14]研究發現,STAS在常發生在實性腫瘤中,而在單純磨玻璃病變中沒有發現,進一步分析提示STAS存在于CTR>0.4的腫瘤中。既往研究[15-16]表明,CTR是I期肺癌發生淋巴結轉移的重要預測因素,CTR越大,發生淋巴結轉移的概率越高。另外,研究表明[17],CTR和淋巴結轉移是臨床IA期肺癌患者預后的獨立危險因素,CTR是預測微乳頭或實體成分的唯一危險因素。而本研究發現CTR與IAC的高級別結構占比呈正相關。亞組分析提示Ⅲ級IAC的CTR越大,提示高級別結構占比越高,淋巴結轉移風險越高;而在I級和Ⅱ級IAC中兩者無相關性,提示可能與高級別結構占比較低有關。
經典TNM分期僅對腫瘤大小、淋巴結轉移、遠處臟器轉移等方面進行患者預后評估,而缺少對IAC病理亞型和高級別結構占比的評估,尤其對評估I期IAC患者的預后存在局限性。2021 WHO新分類IAC病理分級依據主要病理組織學類型和高級別結構占比分級,該分級具有預后價值[3]。本研究表明,與I級和Ⅱ級相比,Ⅲ級IAC具有更晚的TNM分期、更高的淋巴結轉移率和高級別結構占比、更多的病理高危因素,這與Ahn等研究結果一致[18]。因其術后容易復發和轉移,選擇亞肺葉切除或淋巴結采樣應慎重,筆者認為Ⅲ級IAC在保證手術切緣和淋巴結充分評估的前提下,選擇肺葉切除聯合肺門、縱隔系統性淋巴結清掃更為恰當,應依據pTNM分期、高級別結構占比、程序性死亡受體-配體1(Programmed death receptor-ligand 1, PD-L1)表達量和基因突變狀態等因素綜合制定術后輔助治療方案。近年來,隨著高級別前瞻性實驗研究結果的陸續披露,JCOG0802研究表明[19],對于腫瘤直徑≤2cm,CTR>0.5的外周型IA期NSCLC患者,肺段切除術后患者的5年總生存率優于肺葉切除,但局部復發率略高于后者。CALGB140503研究[20]具有相似的結果,上述研究均提示亞肺葉切除可作為I期NSCLC的標準術式。JCOG1211研究表明[21],直徑≤3cm、以磨玻璃結節為主IAC術后預后較好,5年無復發生存率和總生存率分別為97%、98%。肺段切除術后6個月和12個月,患者FEV1和用力肺活量下降水平均顯著低于肺葉切除,這提示肺段切除有利于保護肺功能。另外,研究表明[22],完整淋巴結評估影響NSCLC患者的預后,尤其對伴有微乳頭或實體成分的IAC患者至關重要。I級IAC未見淋巴結轉移并且患者預后最佳,宜選擇亞肺葉切除聯合淋巴結采樣。本研究僅有2例伴有高級別結構的Ⅱ級IAC發生淋巴結轉移,臨床醫師可根據病變位置、患者心肺功能、淋巴結大小、AI量化參數等因素綜合評估,選擇適宜的肺組織切除范圍和淋巴結處理策略。
隨著人工智能和大數據時代的到來,研究人員通過深度學習技術和多模態數據構建和驗證大模型已然成為時代潮流,如盤古氣象大模型和生成式預訓練模型(ChatGPT)。機器學習是研究使用計算機模擬或實現人類學習活動的科學,是人工智能中最具智能特征、最前沿的研究領域之一。深度學習則是機器學習的一個分支,其基于人工神經網絡的概念,通過多層次的神經元結構來學習和理解數據。本研究通過深度學習、機器學習和影像組學相結合的方法構建和驗證疾病預測模型,為臨床決策提供重要參考。
XGBoost是一種高效的、靈活的機器學習算法,特別適用于回歸和分類問題。它是基于梯度提升框架開發的,由陳天奇[23]于2016年提出。與其他機器學習算法比較,其具有高預測性能、自動處理缺失值、內置正則化功能、并行化處理、特征重要性評估和可擴展性強等優點,但也存在參數調整復雜、不適合非結構化數據、計算資源需求較高和對異常值敏感等缺點。冷菲等[24]研究表明基于XGBoost算法構建模型鑒別肺腺癌和肺鱗癌的分類效果最佳,優于logistic回歸模型和支持向量機分類模型。本研究通過LASSO回歸模型降低參數之間的多重共線性并篩選出2個與IAC病理分級相關的AI量化參數,即CTR和CT中位值。基于2個參數構建并內部驗證三種機器學習模型的預測效能。其中,XGBoost模型預測效能最佳:訓練集:AUC為0.99,靈敏度為0.93,特異度為0.96;測試集:AUC為0.825,靈敏度為0.72,特異度為0.84。最佳模型由列線圖可視化展示,代入AI量化參數可得患Ⅲ級IAC的風險概率,具有簡明、方便和臨床指導性等特點,為臨床醫師提供有力的臨床決策支持。本研究結果提示基于XGboost算法和AI量化參數構建預測模型準確地鑒別IAC的病理分級,有助于臨床醫師術前充分評估IAC病理分級和患者預后情況,選擇適宜的肺組織切除范圍和淋巴結處理策略,達到精準治療的目的。這有效地解決2個重要問題:“經典TNM分期無法評估I期IAC病理分級對患者預后的影響和僅僅依據術中快速病理診斷決定手術術式不準確”,該模型是一種準確且簡便的IAC病理分級評估方法,值得臨床推廣應用。與既往研究側重于從影像學角度分析IAC量化參數的不同,本文創新性地從外科角度探討I期IAC病理分級預測模型對手術術式選擇的參考意義,具有一定的臨床應用價值。
本研究屬于單中心回顧性分析,預測模型可能存在過擬合問題,缺少外部驗證數據、前瞻性和預后隨訪數據。我們研究團隊正努力擴大樣本量、開展多中心研究和收集隨訪數據。隨著AI技術不斷發展,“AI+醫學”模式為臨床醫師提供一種嶄新的、獨特的視野:挑戰經典標準、顛覆傳統認知、精進手術技巧、指導臨床決策。但目前AI技術尚不成熟,存在一定漏診率和誤診率,機器學習算法并不完美,有待進一步完善。我們相信在不遠的將來,“AI+醫學”模式無疑會加速更加微創、更加精準的醫學時代的到來,幫助臨床醫師做出“以患者為中心”個性化的臨床決策。
利益沖突:無。
作者貢獻:梁云負責查閱資料、撰寫論文;任蒙蒙、黃德龍、刁晶艷和牟旭日負責收集、整理并分析數據;張國偉、劉曙亮、費秀渠負責審校與修改論文;謝寧、狄冬梅負責選題、論文設計。
致謝 感謝王敏潔提供推想AI軟件使用的技術支持!