肺移植是治療良性終末期肺疾病的有效方法[1]。但肺移植患者術后生存率卻低于其他實體器官移植,包括肺移植后原發性移植物失功(primary graft dysfunction,PGD)、慢性移植肺功能障礙(chronic lung allograft dysfunction,CLAD)等并發癥的發生是主要原因[2-4]。而PGD是肺移植后早期最嚴重的并發癥之一,通常出現在術后72 h內,發生率約30%[5-6],其與肺移植后的缺血-再灌注損傷密切相關[7-8]。此外,PGD 還與 CLAD 發生率的增加有關[9-10]。因此,為了明確相關發生機制并尋求解決方案,構建可模擬人肺移植的動物模型至關重要。
既往關于肺移植基礎研究使用的動物模型主要包括大、小鼠肺移植模型。血管化的肺移植模型建立為研究早期缺血-再灌注損傷和肺移植的同種免疫反應提供了有效方法[11-17]。小動物肺移植模型具有成本低、可重復性強、節約人力等優勢,基于小動物模型的相關研究結果應用于臨床轉化,則還需要在大動物移植模型中進一步的驗證[18-21]。豬肺在解剖學和生理學上與人類有高度相似性,且器官大小與人類相近,成為研究肺移植的理想實驗動物。因此,建立豬肺移植模型為實現臨床轉化研究具有舉足輕重的意義。盡管此前國外已有豬肺移植研究的相關報道[22-24],但是迄今為止國內還沒有完整的關于大動物肺移植研究的詳細報道。這種局限性阻礙了國內進一步的比較研究和數據復現。因此,研究豬肺移植不僅可以填補國內在大動物肺移植領域的空白,還建立了一套更為詳細和可操作的標準化操作流程,以適應國內實驗條件和環境,提供更具針對性的數據,從而為未來基礎研究和臨床轉化提供更可靠的實驗模型和數據支持。豬左肺的解剖結構較右肺更為簡單,血管和支氣管的吻合操作相對容易,手術成功率更高,且更易于標準化操作。此外,構建左肺移植模型在國外的肺移植研究中使用較為廣泛,選擇左肺能夠確保本研究與現有文獻之間的數據可比性和結果的可重復性。據此,本研究期望建立一套易操作、可重復的豬左肺原位移植模型,對模型構建步驟進行詳細描述,旨在模擬人類肺移植過程,進而促進肺移植基礎研究的臨床轉化。同時,本研究將評估移植物組織學特征及功能狀態,探討該模型在研究移植肺功能、免疫排斥反應以及術后并發癥等方面的應用潛力。通過構建該模型,有望為未來的肺移植研究提供堅實的實驗基礎,并推動臨床技術的進一步發展和優化。
1 材料與方法
1.1 實驗動物
4個月齡雄性約克夏豬,體重(40.0±2.5)kg,無特定病原體(specific pathogen free,SPF)、無病毒抗體(virus antibody free,VAF)。購自陜西陜藥醫科生物技術有限公司,動物使用許可證編號:SYXK(陜)2023-004。飼養于西安交通大學動物實驗中心。動物正常飲食、進水,飼養環境安靜、舒適,飼養溫度恒定在22~26℃,空氣濕度維持在60%~70%,術前8 h禁食禁飲。
1.2 實驗材料
1.2.1 主要藥品
丙泊酚注射液(嘉博制藥有限公司)、異氟烷(安特牧業科技有限公司)、頭孢唑林鈉(安替制藥有限公司)、甲潑尼龍琥珀酸鈉注射液(華邦制藥有限公司)、注射用鹽酸瑞芬太尼(人福藥業有限責任公司)、肝素鈉注射液(上藥第一生化藥業有限公司)、低鉀右旋糖酐葡萄糖保存液(Perfadex Solution,XVIVO公司)、前列地爾注射液(泰德制藥股份有限公司)、鹽酸利多卡因注射液(風華藥業有限公司)。
1.2.2 主要耗材
22G靜脈留置針(上海正邦醫療科技有限公司)、35Fr氣管插管(維力醫療器械股份有限公司)、4-0/5-0聚丙烯縫線(強生公司)、22Fr動脈插管(康心醫療器械有限公司)、無菌導尿管(斯萊達醫療用品有限公司)、直線切割吻合器(逸思醫療科技股份有限公司)、胸腔閉式引流瓶(康生醫療器械有限公司)。
1.3 移植步驟
1.3.1 供肺獲取
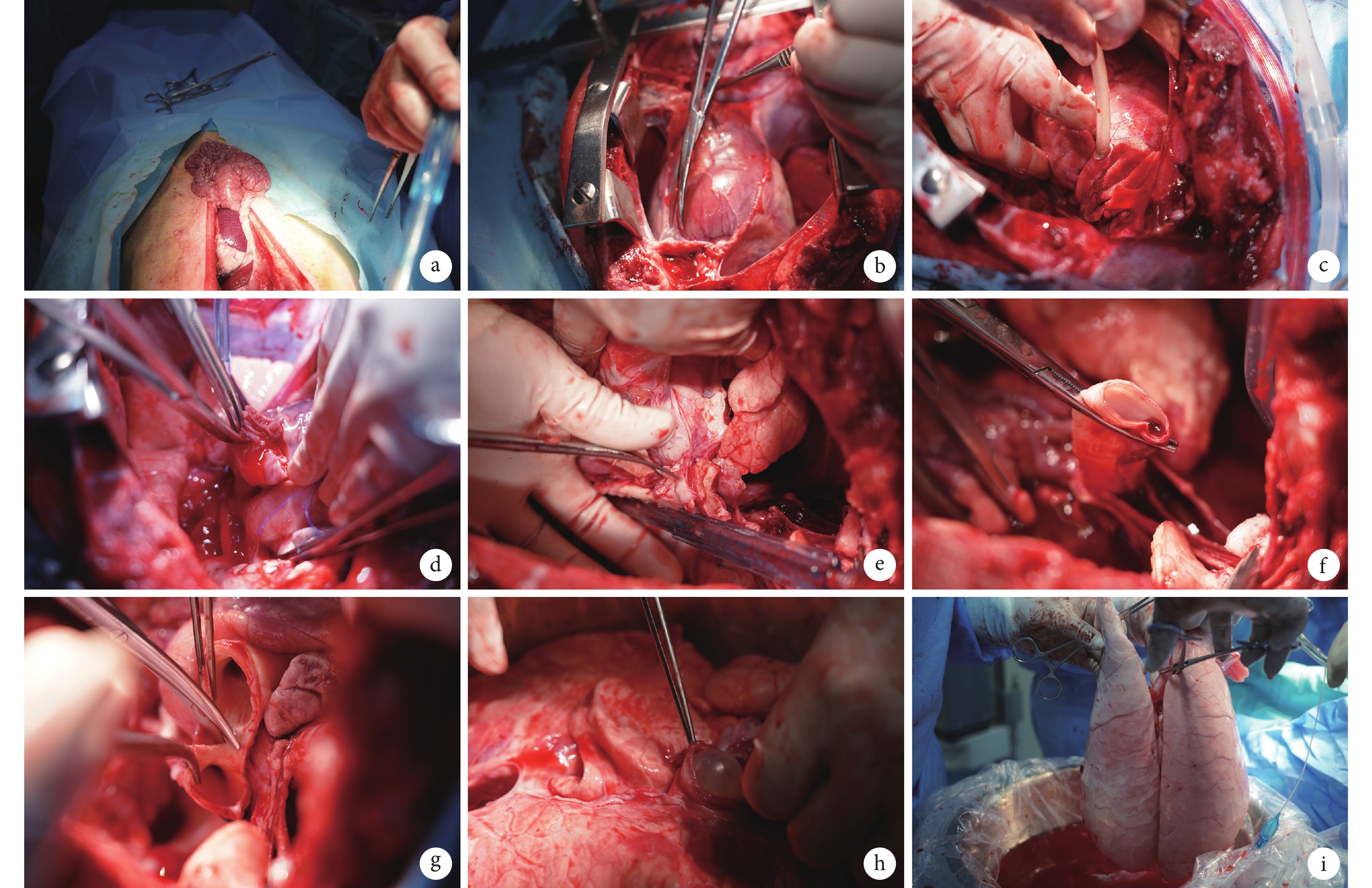
在丙泊酚誘導麻醉后,供體通過面罩吸入3%~5%的異氟烷和氧氣(3~4 L/min)。取俯臥位,用22G靜脈留置針通過耳緣靜脈建立靜脈通路,滴注頭孢唑啉鈉(20 mg/kg)和甲潑尼龍(500 mg),并用三通連接丙泊酚(100 mL)和瑞芬太尼(1 mg/100 mL)。供體仰臥位固定,監測生命體征。用紗布繃帶牽拉豬上下頜以及豬舌,暴露聲門部位,使用35Fr氣管插管,將插管通過口腔和聲門進入氣管,使用聽診器判斷插管位置,無誤后球囊充氣固定氣管插管,連接麻醉機,持續泵入丙泊酚[5~8 mg/(kg·h)]和瑞芬太尼[2~20 μg/(kg·h)]維持麻醉。設置呼吸機壓力15 cm H2O(1 cm H2O=0.098 kPa),呼氣末正壓(positive end-expiratory pressure,PEEP)為5 cm H2O,吸入氣中的氧濃度分數(fraction of inspiration O2,FiO2)為0.5,呼吸頻率為15次/min,潮氣量為6~8 mL/kg。消毒鋪巾后行正中胸腹聯合切口,取出胃腸放在無菌單上以減輕膈肌的壓力(圖1a)。使用胸骨鋸正中開胸,靜脈注射肝素鈉(12 000 U)。打開膈肌,暴露食管及胸膜,向兩側游離并離斷下肺韌帶,切除胸腺并打開心包(圖1b)。鈍性分離上腔靜脈、肺動脈和主動脈,使用4-0聚丙烯縫線在肺動脈中段縫U形荷包,在荷包的中心切開,使用止血鉗擴大肺動脈上的孔,然后將22Fr動脈插管插入肺動脈,確定位置后收緊荷包線固定(圖1c),連接灌注管路。控制氣道壓力為25 cm H2O,使用呼吸機膨肺3 s,每30 s重復一次,總共3次,注意避免過度膨肺所導致的機械損傷。結扎上、下腔靜脈,夾閉主動脈,剪開左心耳(圖1d)。在距心臟上方30 cm處,用4℃ Perfadex溶液(2000 mL溶液中加入500 μg前列地爾)經肺動脈順行性灌注,注意觀察左心房流出液體以及雙肺顏色變化,適當調整肺動脈插管的位置以保證雙肺灌注均勻。之后拔除肺動脈插管,在食管前方游離心肺塊至主動脈弓位置(圖1e),橫斷上腔靜脈、主動脈及其分支。充分暴露氣管,保持肺內充氣狀態,用阻斷鉗夾閉后切斷氣管(圖1f)。取出心肺塊放入無菌保護袋后置于冰水混合物上。沿心房后壁剪開左心房、主動脈與肺動脈(圖1g)。將無菌導尿管插入左心房,膨脹球囊后用Perfadex溶液對各支肺靜脈進行逆灌(圖1h),注意觀察肺動脈流出液體的顏色,對于灌注不充分的部位可輕柔按摩,盡可能使灌注后肺臟整體呈白色(圖1i)。在逆灌過程中,盡量保持肺通氣呼吸狀態。逆行灌結束后,用濕紗布保護肺部表面,結扎無菌保護袋,放入4℃冰箱中保存。
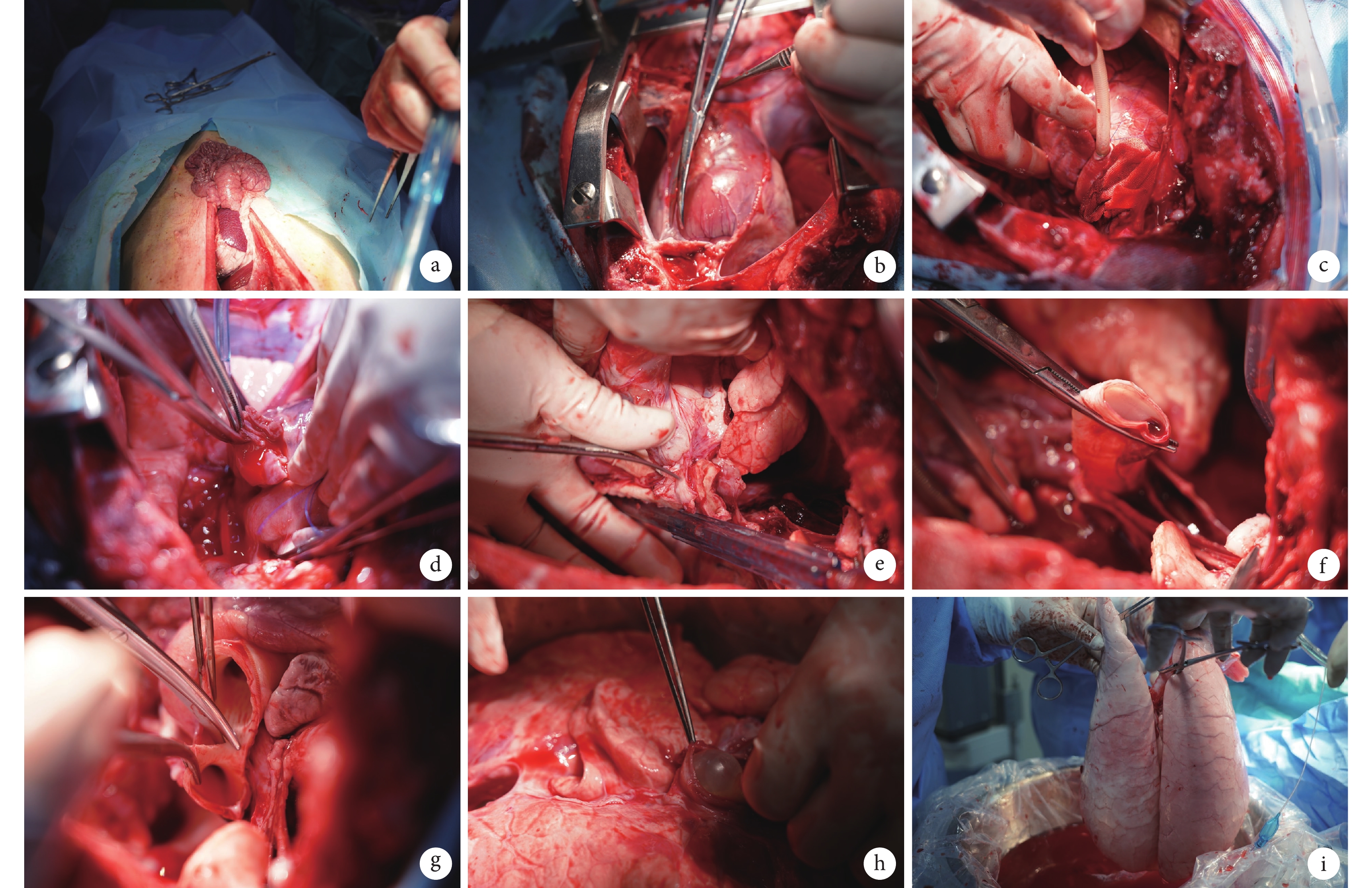 圖1
供肺獲取操作步驟
圖1
供肺獲取操作步驟
a:胸腹聯合切口腹腔減壓;b:打開心包;c:肺動脈中插入22Fr動脈插管并固定;d:剪開左心耳;e:游離后縱隔胸膜;f:通氣狀態下夾閉氣管;g:離斷主動脈弓;h:沿左心房逆灌;i:灌注后的肺臟大體觀
1.3.2 受體移植
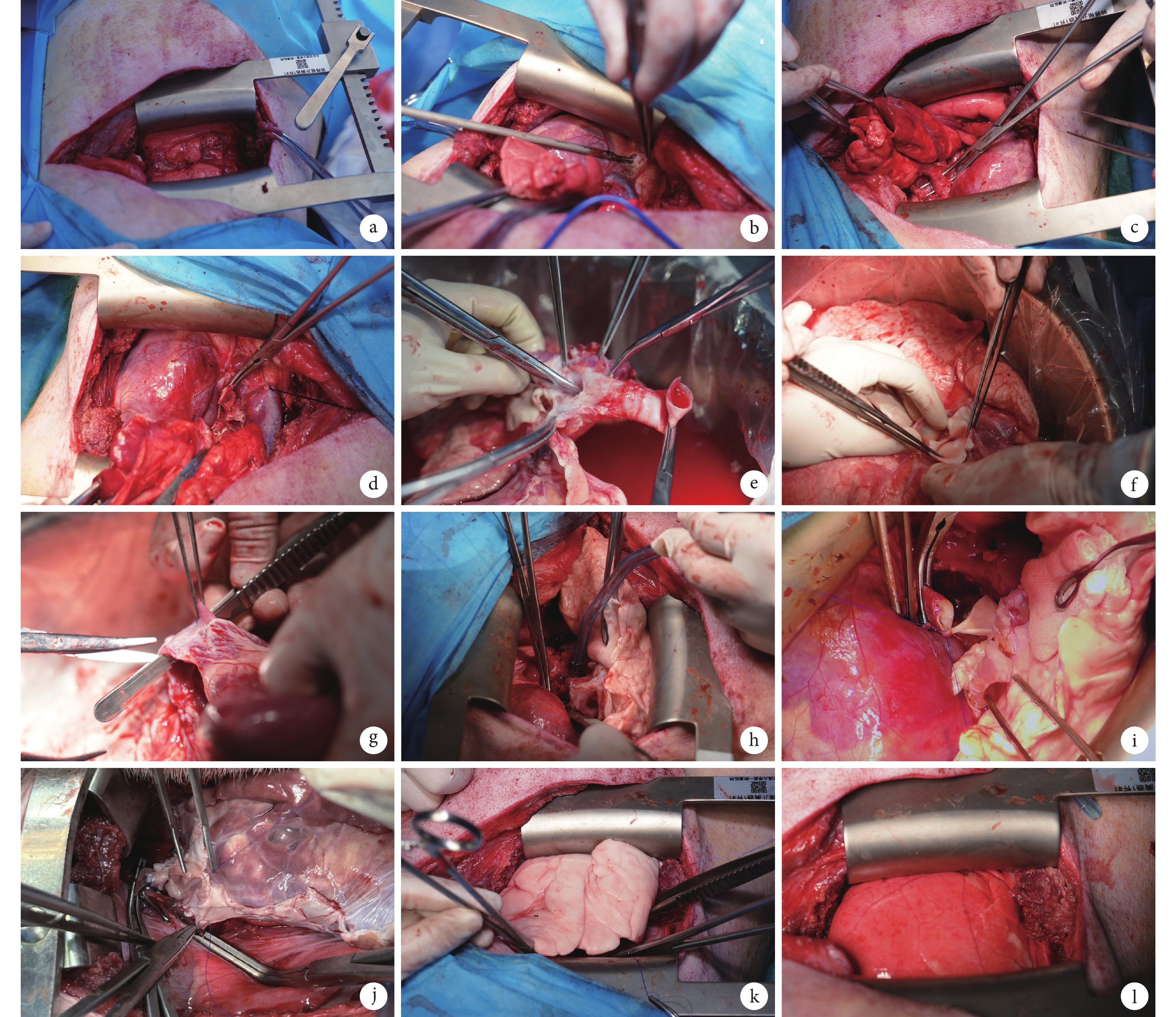
受體麻醉及氣管插管操作步驟如前所述。術前30 min靜脈滴注頭孢唑啉鈉(20 mg/kg)和甲潑尼龍(1 g),術中使用0.9% NaCl注射液補液(70~100 mL/h)。受體右側臥位,沿第四肋間切開約15 cm,充分暴露左肺(圖2a),右側單肺通氣。從左心耳向后游離左奇靜脈并結扎,剔除肺動脈周圍的淋巴結(圖2b)。從近心端開始游離左肺動脈(圖2c),保持肺動脈外膜完整性,注意保護迷走神經。松解下肺韌帶,然后游離上下肺靜脈,靜脈注射肝素3 000 U。依次離斷受體的左主支氣管、左肺動脈和左肺靜脈,從胸腔內移出左肺(圖2d)。修剪移植供體左肺:解剖左主支氣管至隆突處離斷,游離至左肺上下葉分叉以上的兩個軟骨環處(圖2e)。游離主肺動脈并將左右兩支分開,修剪左肺動脈避免發生血管扭轉(圖2f)。離斷縱隔葉靜脈和右肺靜脈,修剪左心房并切開,保留足夠長的左肺靜脈形成“心房袖”(圖2g)。用冰鹽水濕紗布包裹供體左肺,放置于手術臺上。隨后將供肺放入胸腔內進行支氣管吻合,使用4-0聚丙烯縫線對齊縫合固定頂角后,依次連續吻合支氣管后壁和前壁(圖2h);之后對齊肺動脈的兩端,用5-0聚丙烯縫線連續縫合,在打結前向動脈血管腔內注入稀釋的肝素生理鹽水以排出血管內空氣,注意檢查吻合口處是否有滲漏(圖2i);最后將心房袖對齊,使用5-0聚丙烯縫線連續縫合整個后壁(圖2j),用另一根5-0聚丙烯縫線連續縫合前壁。完成心房袖的吻合后首先開放支氣管通氣(圖2k),移植肺氣道壓達到20 cm H2O后,部分打開肺動脈,通過左心房吻合口排出肺血管內空氣后,拉緊兩根縫合線打結。左肺動脈阻斷鉗在10 min內逐漸開放,控制初始的再灌注速度(圖2l)。再灌注10 min后,將呼吸機壓力調整為15 cm H2O,通入60%的氧氣,PEEP設置為5 cm H2O,調整呼吸頻率保持動脈血氧分壓(partial atrial pressure of oxygen,PaO2)值在35~40 mm Hg(1 mm Hg=0.133 kPa),然后進行第一次血氣分析。如果PaO2>200 mm Hg且動脈血二氧化碳分壓(partial atrial pressure of carbon dioxide,PaCO2)在35~45 mm Hg之間,將FiO2值從0.6降至0.5。如果PaCO2>45 mm Hg,增加呼吸頻率降低PaCO2。再灌注1 h后再次膨肺。從肺靜脈采血進行血氣分析評估移植肺功能。若PaO2>200 mm Hg,PaCO2在35~45 mm Hg之間,則逐層關胸。若血氣分析結果不佳,繼續再灌注1 h后血氣分析結果仍較差(PaO2/FiO2<200 mm Hg),則考慮處死動物。如果再灌注1 h后血氣分析結果良好,則逐漸減少丙泊酚和瑞芬太尼輸注量,經第6肋間放置胸腔閉式引流管,肋間注入5 mL利多卡因。關胸后,受體俯臥位放置加熱毯上,當受體開始有自主呼吸時,緩慢減少呼吸機支持,直至受體開始咳嗽或擺脫插管時拔管,術后監測呼吸頻率、血氧飽和度、心率和心電圖。
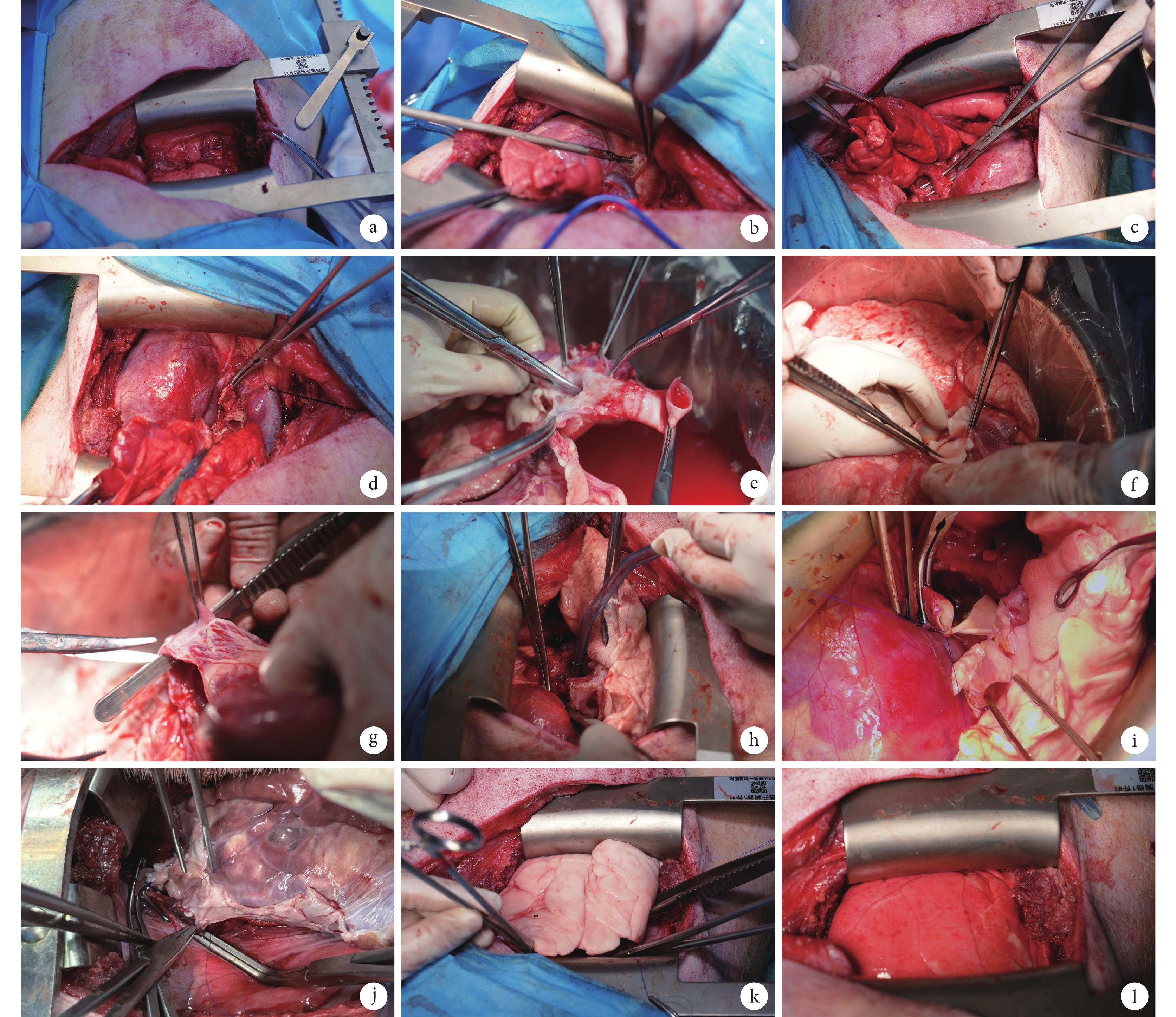 圖2
供肺移植操作步驟
圖2
供肺移植操作步驟
a:豬右側臥位沿左第四肋間開胸;b:游離左奇靜脈;c:游離左肺動脈;d:離斷受體左肺并取出;e:修剪左主支氣管;f:修剪左肺動脈;g:游離左肺靜脈形成“心房袖”;h:支氣管吻合;i:肺動脈吻合;j:心房吻合;k:移植肺再通氣;l:移植肺再灌注
1.4 倫理審查
所有實驗動物及操作步驟均符合動物倫理相關規定,實驗已獲得西安交通大學醫學部生物醫學倫理委員會批準(No.XJTUAE2024-1957)。
2 結果
2.1 移植后豬肺的組織學評價
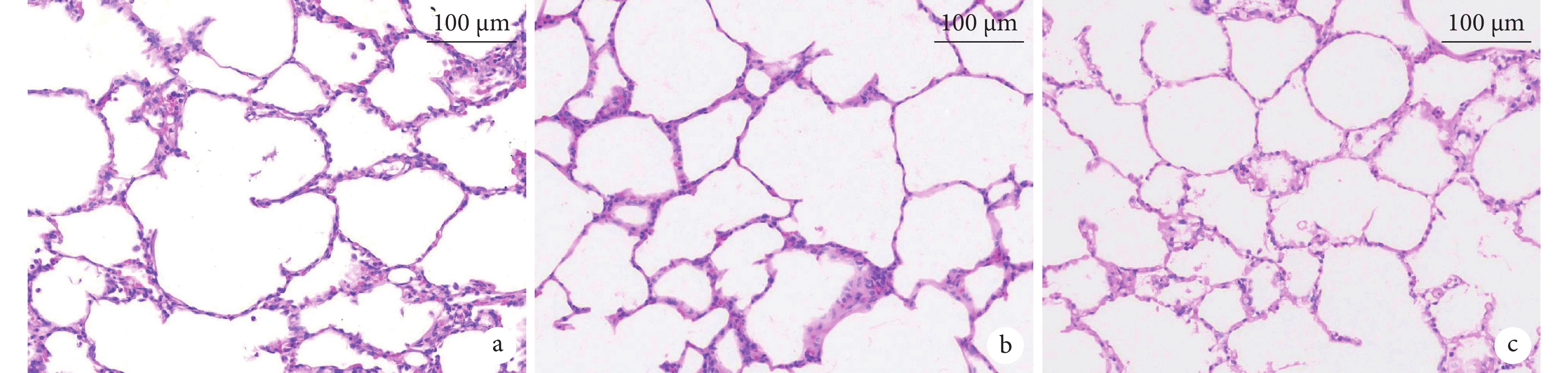
為模擬實際臨床肺移植過程,在本研究中對供體的肺臟進行常規冷保存。經上述步驟移植后的肺臟通氣及灌注均良好,表現為肺氣道阻力較低,順應性較好,動靜脈血液灌注通暢,移植肺色澤紅潤,無血管狹窄、扭轉或血栓形成。研究過程中采集正常肺組織、冷保存后肺組織以及移植后再灌注肺組織進行蘇木精-伊紅(hematoxylin-eosin,HE)染色(圖3)。組織學結果提示:與正常肺及冷保存后的肺組織相比,再灌注2 h后的移植供肺間質及肺泡水腫程度低,肺泡內紅細胞滲出較少,中性粒細胞浸潤較少,僅有少量透明膜形成。
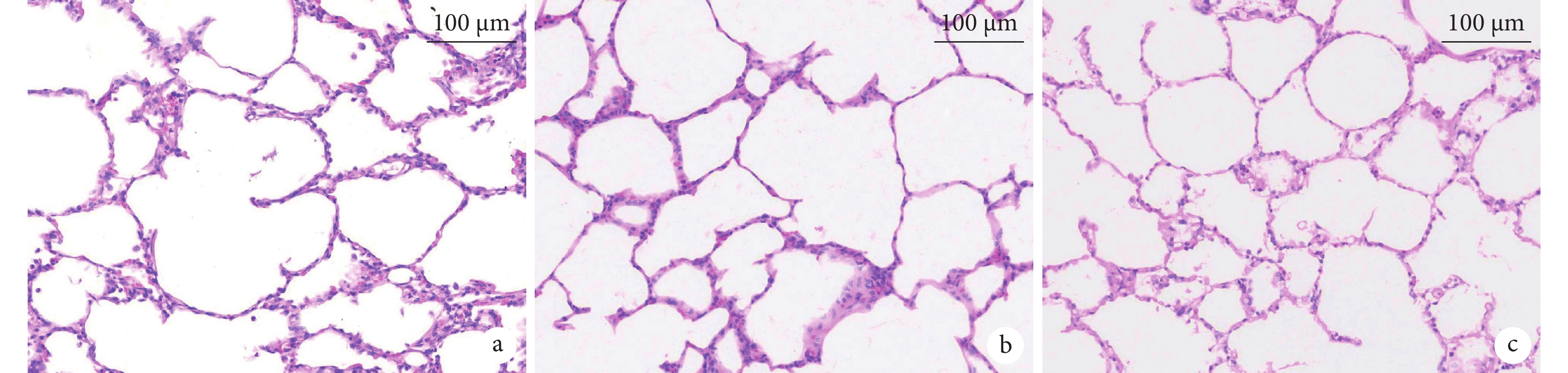 圖3
移植肺的組織學形態(200×)
圖3
移植肺的組織學形態(200×)
a:正常肺的組織學形態;b:常規冷保存后肺的組織學形態;c:移植再灌注后肺的組織學形態
2.2 移植后豬肺的血氣分析
4頭豬按照上述步驟進行左肺原位移植。移植后再灌注10 min的血氣分析結果提示,PaO2范圍為210.5~286.1 mm Hg,PaCO2范圍為39.8~47.2 mm Hg,PaO2/FiO2值范圍為350.8~476.8 mm Hg。再灌注1 h后的血氣分析結果提示,PaO2值范圍為188.3~219.0 mm Hg,PaCO2值為43.1~52.5 mm Hg,PaO2/FiO2值為376.6~438.0 mm Hg。再灌注2 h后的血氣分析結果提示,PaO2值范圍為155.4~178.6 mm Hg,PaCO2值范圍為53.1~62.4 mm Hg,PaO2/FiO2值范圍為310.8~357.2 mm Hg(表1)。該結果提示移植肺功能良好。
3 討論
相較于其他動物,豬肺具有與人肺相似的結構以及生理生化指標,以豬肺移植動物模型為基礎,促進研究臨床轉化應用具有重要的價值,同時也為異種移植奠定了模型基礎[25]。但是,豬肺與人肺有幾個重要的解剖學差異不容忽視。首先,豬肺有其特有的縱隔肺葉,屬于右肺的一部分;其次,豬肺的右肺上葉支氣管直接從主氣管中分出,不同于人類的從右主支氣管分出,這為豬右肺移植增添了難度;此外,豬的左奇靜脈的走行為向上穿過后縱隔,穿過左肺門后,直接匯入冠狀竇;最后,豬右下肺靜脈穿過正中線,緊鄰左下肺靜脈共同匯入左心房。熟悉這些解剖上的不同之處是豬肺移植成功開展的先決條件。
豬肺移植手術操作步驟繁多,很多細節處理不當都會導致移植后的效果不佳,進而引發術后PGD。在供肺獲取階段,由于豬的腔靜脈血管較人的更薄,因此在操作過程中要防止出血。供肺在體順行灌注沖洗時,保證肺動脈插管的尖端不要插入過深,要將其置于肺動脈分叉處的近心端,使得兩側肺臟灌注均勻。同時也要避免在灌注時導管放置過淺,側孔滑出肺動脈導致的灌注液外漏。此外,在灌注時要密切觀察流出道液體的顏色和流速,灌注不充分的部位可以用手輕柔地按摩紅色區域以促進灌注液循環。此外,移植肺經左心房逆行灌注是非常有必要的[27],在逆行灌注過程中可以通過改變肺臟的體位,達到良好的灌注效果。相較于人肺,豬肺更容易受到機械性損傷,表現為肺膜表面出現氣泡,再灌注后更容易出現水腫進而引發PGD,因此整個操作過程一定要輕柔,避免直接的機械損傷。
正常情況下豬肺存在少量的肺不張,因此消除肺不張是整個取肺過程的關鍵。首先松解下肺韌帶提高供肺活動度,在呼吸機壓力控制模式下,可以增加潮氣量消除肺不張。另外,膨肺是消除肺不張的有效手段[28]。但在此過程中一定要注意氣道壓力,設置呼吸機的氣道壓力為25 cm H2O后進行3 s膨肺,并且每間隔30 s重復一次,總共3次,這樣可以從最大程度上防止通氣過度導致的肺大皰產生及壓力損傷。此外,膨肺采用的氣體是50%的氧氣而非純氧,原因是濃度過高的氧氣會使供肺在保存過程中產生較多的氧自由基,進而導致再灌注后肺損傷的加重。研究[29]表明,50%的氧氣濃度下組織產生的氧自由基含量較低,血管內皮受損程度較小。
另一方面,在手術過程中,移植受體液體量的管理同樣值得關注。通常采用0.9%的NaCl溶液進行補液,速率控制在70~100 mL/h[30]。應盡可能避免補液量超負荷,從而加劇移植肺的再灌注水腫。此外在移植過程中,游離血管應十分謹慎,豬肺的血管很脆弱,要保持外膜的完整性,避免血管的過度裸化。肺門吻合的方式采用“支氣管-肺動脈-左房袖”的順序,也有研究者采用“左房袖-支氣管-肺動脈”的順序[31],這取決于術者的操作習慣。最后,在進行心房吻合時采用連續水平褥式縫合的方法,這種縫合的方式大大降低了吻合口處血栓產生的風險。此外,受體給予肝素抗凝可以有效地防止再灌注后血栓形成造成的肺栓塞,而這一步驟往往容易被忽略。
移植肺缺血-再灌注損傷的急性期發生在血液再通后的前4 h,因此,控制初始階段血液的再灌注流量是非常重要的[30]。器官長時間的缺血冷保存對血管內皮造成一定程度的損害,血管的屏障功能較為脆弱,所以應在前10 min內緩慢開放動脈阻斷鉗以控制初始灌注血流量。
總之,盡管豬肺與人肺在移植外科操作上有很多的相似之處,但是動物模型與實際臨床所面臨的情形還是存在一定區別。動物模型所采用的豬肺大多數是正常的,因而在術后測定肺功能、細胞因子、生化分子等方面的結果較為理想[32]。而在實際的臨床中,人類供肺常存在感染、水腫、肺不張、肺結節等不良因素,因此在移植之前需要對移植肺的功能進行充分的評估[27]。移植操作步驟復雜,細節繁多,在使用動物模型訓練時,應當深刻理解豬肺與人肺在解剖上的不同之處,通過不斷訓練減少操作失誤,從而提高肺移植效果。
利益沖突:無。
作者貢獻:張廣健、趙恒及馮錦騰負責論文設計;張廣健、高山、趙睿、王泓懿、孫燁、孫博睿及李碩負責實驗操作;李益行、白浩田、陶潤儀、何彬、王芝馀及張言鵬負責樣本收集與數據整理;趙恒負責論文初稿撰寫;張廣健、馮錦騰負責論文審閱與修改。
致謝 感謝西安交通大學動物實驗中心對本研究的支持與幫助。
肺移植是治療良性終末期肺疾病的有效方法[1]。但肺移植患者術后生存率卻低于其他實體器官移植,包括肺移植后原發性移植物失功(primary graft dysfunction,PGD)、慢性移植肺功能障礙(chronic lung allograft dysfunction,CLAD)等并發癥的發生是主要原因[2-4]。而PGD是肺移植后早期最嚴重的并發癥之一,通常出現在術后72 h內,發生率約30%[5-6],其與肺移植后的缺血-再灌注損傷密切相關[7-8]。此外,PGD 還與 CLAD 發生率的增加有關[9-10]。因此,為了明確相關發生機制并尋求解決方案,構建可模擬人肺移植的動物模型至關重要。
既往關于肺移植基礎研究使用的動物模型主要包括大、小鼠肺移植模型。血管化的肺移植模型建立為研究早期缺血-再灌注損傷和肺移植的同種免疫反應提供了有效方法[11-17]。小動物肺移植模型具有成本低、可重復性強、節約人力等優勢,基于小動物模型的相關研究結果應用于臨床轉化,則還需要在大動物移植模型中進一步的驗證[18-21]。豬肺在解剖學和生理學上與人類有高度相似性,且器官大小與人類相近,成為研究肺移植的理想實驗動物。因此,建立豬肺移植模型為實現臨床轉化研究具有舉足輕重的意義。盡管此前國外已有豬肺移植研究的相關報道[22-24],但是迄今為止國內還沒有完整的關于大動物肺移植研究的詳細報道。這種局限性阻礙了國內進一步的比較研究和數據復現。因此,研究豬肺移植不僅可以填補國內在大動物肺移植領域的空白,還建立了一套更為詳細和可操作的標準化操作流程,以適應國內實驗條件和環境,提供更具針對性的數據,從而為未來基礎研究和臨床轉化提供更可靠的實驗模型和數據支持。豬左肺的解剖結構較右肺更為簡單,血管和支氣管的吻合操作相對容易,手術成功率更高,且更易于標準化操作。此外,構建左肺移植模型在國外的肺移植研究中使用較為廣泛,選擇左肺能夠確保本研究與現有文獻之間的數據可比性和結果的可重復性。據此,本研究期望建立一套易操作、可重復的豬左肺原位移植模型,對模型構建步驟進行詳細描述,旨在模擬人類肺移植過程,進而促進肺移植基礎研究的臨床轉化。同時,本研究將評估移植物組織學特征及功能狀態,探討該模型在研究移植肺功能、免疫排斥反應以及術后并發癥等方面的應用潛力。通過構建該模型,有望為未來的肺移植研究提供堅實的實驗基礎,并推動臨床技術的進一步發展和優化。
1 材料與方法
1.1 實驗動物
4個月齡雄性約克夏豬,體重(40.0±2.5)kg,無特定病原體(specific pathogen free,SPF)、無病毒抗體(virus antibody free,VAF)。購自陜西陜藥醫科生物技術有限公司,動物使用許可證編號:SYXK(陜)2023-004。飼養于西安交通大學動物實驗中心。動物正常飲食、進水,飼養環境安靜、舒適,飼養溫度恒定在22~26℃,空氣濕度維持在60%~70%,術前8 h禁食禁飲。
1.2 實驗材料
1.2.1 主要藥品
丙泊酚注射液(嘉博制藥有限公司)、異氟烷(安特牧業科技有限公司)、頭孢唑林鈉(安替制藥有限公司)、甲潑尼龍琥珀酸鈉注射液(華邦制藥有限公司)、注射用鹽酸瑞芬太尼(人福藥業有限責任公司)、肝素鈉注射液(上藥第一生化藥業有限公司)、低鉀右旋糖酐葡萄糖保存液(Perfadex Solution,XVIVO公司)、前列地爾注射液(泰德制藥股份有限公司)、鹽酸利多卡因注射液(風華藥業有限公司)。
1.2.2 主要耗材
22G靜脈留置針(上海正邦醫療科技有限公司)、35Fr氣管插管(維力醫療器械股份有限公司)、4-0/5-0聚丙烯縫線(強生公司)、22Fr動脈插管(康心醫療器械有限公司)、無菌導尿管(斯萊達醫療用品有限公司)、直線切割吻合器(逸思醫療科技股份有限公司)、胸腔閉式引流瓶(康生醫療器械有限公司)。
1.3 移植步驟
1.3.1 供肺獲取
在丙泊酚誘導麻醉后,供體通過面罩吸入3%~5%的異氟烷和氧氣(3~4 L/min)。取俯臥位,用22G靜脈留置針通過耳緣靜脈建立靜脈通路,滴注頭孢唑啉鈉(20 mg/kg)和甲潑尼龍(500 mg),并用三通連接丙泊酚(100 mL)和瑞芬太尼(1 mg/100 mL)。供體仰臥位固定,監測生命體征。用紗布繃帶牽拉豬上下頜以及豬舌,暴露聲門部位,使用35Fr氣管插管,將插管通過口腔和聲門進入氣管,使用聽診器判斷插管位置,無誤后球囊充氣固定氣管插管,連接麻醉機,持續泵入丙泊酚[5~8 mg/(kg·h)]和瑞芬太尼[2~20 μg/(kg·h)]維持麻醉。設置呼吸機壓力15 cm H2O(1 cm H2O=0.098 kPa),呼氣末正壓(positive end-expiratory pressure,PEEP)為5 cm H2O,吸入氣中的氧濃度分數(fraction of inspiration O2,FiO2)為0.5,呼吸頻率為15次/min,潮氣量為6~8 mL/kg。消毒鋪巾后行正中胸腹聯合切口,取出胃腸放在無菌單上以減輕膈肌的壓力(圖1a)。使用胸骨鋸正中開胸,靜脈注射肝素鈉(12 000 U)。打開膈肌,暴露食管及胸膜,向兩側游離并離斷下肺韌帶,切除胸腺并打開心包(圖1b)。鈍性分離上腔靜脈、肺動脈和主動脈,使用4-0聚丙烯縫線在肺動脈中段縫U形荷包,在荷包的中心切開,使用止血鉗擴大肺動脈上的孔,然后將22Fr動脈插管插入肺動脈,確定位置后收緊荷包線固定(圖1c),連接灌注管路。控制氣道壓力為25 cm H2O,使用呼吸機膨肺3 s,每30 s重復一次,總共3次,注意避免過度膨肺所導致的機械損傷。結扎上、下腔靜脈,夾閉主動脈,剪開左心耳(圖1d)。在距心臟上方30 cm處,用4℃ Perfadex溶液(2000 mL溶液中加入500 μg前列地爾)經肺動脈順行性灌注,注意觀察左心房流出液體以及雙肺顏色變化,適當調整肺動脈插管的位置以保證雙肺灌注均勻。之后拔除肺動脈插管,在食管前方游離心肺塊至主動脈弓位置(圖1e),橫斷上腔靜脈、主動脈及其分支。充分暴露氣管,保持肺內充氣狀態,用阻斷鉗夾閉后切斷氣管(圖1f)。取出心肺塊放入無菌保護袋后置于冰水混合物上。沿心房后壁剪開左心房、主動脈與肺動脈(圖1g)。將無菌導尿管插入左心房,膨脹球囊后用Perfadex溶液對各支肺靜脈進行逆灌(圖1h),注意觀察肺動脈流出液體的顏色,對于灌注不充分的部位可輕柔按摩,盡可能使灌注后肺臟整體呈白色(圖1i)。在逆灌過程中,盡量保持肺通氣呼吸狀態。逆行灌結束后,用濕紗布保護肺部表面,結扎無菌保護袋,放入4℃冰箱中保存。
 圖1
供肺獲取操作步驟
圖1
供肺獲取操作步驟
a:胸腹聯合切口腹腔減壓;b:打開心包;c:肺動脈中插入22Fr動脈插管并固定;d:剪開左心耳;e:游離后縱隔胸膜;f:通氣狀態下夾閉氣管;g:離斷主動脈弓;h:沿左心房逆灌;i:灌注后的肺臟大體觀
1.3.2 受體移植
受體麻醉及氣管插管操作步驟如前所述。術前30 min靜脈滴注頭孢唑啉鈉(20 mg/kg)和甲潑尼龍(1 g),術中使用0.9% NaCl注射液補液(70~100 mL/h)。受體右側臥位,沿第四肋間切開約15 cm,充分暴露左肺(圖2a),右側單肺通氣。從左心耳向后游離左奇靜脈并結扎,剔除肺動脈周圍的淋巴結(圖2b)。從近心端開始游離左肺動脈(圖2c),保持肺動脈外膜完整性,注意保護迷走神經。松解下肺韌帶,然后游離上下肺靜脈,靜脈注射肝素3 000 U。依次離斷受體的左主支氣管、左肺動脈和左肺靜脈,從胸腔內移出左肺(圖2d)。修剪移植供體左肺:解剖左主支氣管至隆突處離斷,游離至左肺上下葉分叉以上的兩個軟骨環處(圖2e)。游離主肺動脈并將左右兩支分開,修剪左肺動脈避免發生血管扭轉(圖2f)。離斷縱隔葉靜脈和右肺靜脈,修剪左心房并切開,保留足夠長的左肺靜脈形成“心房袖”(圖2g)。用冰鹽水濕紗布包裹供體左肺,放置于手術臺上。隨后將供肺放入胸腔內進行支氣管吻合,使用4-0聚丙烯縫線對齊縫合固定頂角后,依次連續吻合支氣管后壁和前壁(圖2h);之后對齊肺動脈的兩端,用5-0聚丙烯縫線連續縫合,在打結前向動脈血管腔內注入稀釋的肝素生理鹽水以排出血管內空氣,注意檢查吻合口處是否有滲漏(圖2i);最后將心房袖對齊,使用5-0聚丙烯縫線連續縫合整個后壁(圖2j),用另一根5-0聚丙烯縫線連續縫合前壁。完成心房袖的吻合后首先開放支氣管通氣(圖2k),移植肺氣道壓達到20 cm H2O后,部分打開肺動脈,通過左心房吻合口排出肺血管內空氣后,拉緊兩根縫合線打結。左肺動脈阻斷鉗在10 min內逐漸開放,控制初始的再灌注速度(圖2l)。再灌注10 min后,將呼吸機壓力調整為15 cm H2O,通入60%的氧氣,PEEP設置為5 cm H2O,調整呼吸頻率保持動脈血氧分壓(partial atrial pressure of oxygen,PaO2)值在35~40 mm Hg(1 mm Hg=0.133 kPa),然后進行第一次血氣分析。如果PaO2>200 mm Hg且動脈血二氧化碳分壓(partial atrial pressure of carbon dioxide,PaCO2)在35~45 mm Hg之間,將FiO2值從0.6降至0.5。如果PaCO2>45 mm Hg,增加呼吸頻率降低PaCO2。再灌注1 h后再次膨肺。從肺靜脈采血進行血氣分析評估移植肺功能。若PaO2>200 mm Hg,PaCO2在35~45 mm Hg之間,則逐層關胸。若血氣分析結果不佳,繼續再灌注1 h后血氣分析結果仍較差(PaO2/FiO2<200 mm Hg),則考慮處死動物。如果再灌注1 h后血氣分析結果良好,則逐漸減少丙泊酚和瑞芬太尼輸注量,經第6肋間放置胸腔閉式引流管,肋間注入5 mL利多卡因。關胸后,受體俯臥位放置加熱毯上,當受體開始有自主呼吸時,緩慢減少呼吸機支持,直至受體開始咳嗽或擺脫插管時拔管,術后監測呼吸頻率、血氧飽和度、心率和心電圖。
 圖2
供肺移植操作步驟
圖2
供肺移植操作步驟
a:豬右側臥位沿左第四肋間開胸;b:游離左奇靜脈;c:游離左肺動脈;d:離斷受體左肺并取出;e:修剪左主支氣管;f:修剪左肺動脈;g:游離左肺靜脈形成“心房袖”;h:支氣管吻合;i:肺動脈吻合;j:心房吻合;k:移植肺再通氣;l:移植肺再灌注
1.4 倫理審查
所有實驗動物及操作步驟均符合動物倫理相關規定,實驗已獲得西安交通大學醫學部生物醫學倫理委員會批準(No.XJTUAE2024-1957)。
2 結果
2.1 移植后豬肺的組織學評價
為模擬實際臨床肺移植過程,在本研究中對供體的肺臟進行常規冷保存。經上述步驟移植后的肺臟通氣及灌注均良好,表現為肺氣道阻力較低,順應性較好,動靜脈血液灌注通暢,移植肺色澤紅潤,無血管狹窄、扭轉或血栓形成。研究過程中采集正常肺組織、冷保存后肺組織以及移植后再灌注肺組織進行蘇木精-伊紅(hematoxylin-eosin,HE)染色(圖3)。組織學結果提示:與正常肺及冷保存后的肺組織相比,再灌注2 h后的移植供肺間質及肺泡水腫程度低,肺泡內紅細胞滲出較少,中性粒細胞浸潤較少,僅有少量透明膜形成。
 圖3
移植肺的組織學形態(200×)
圖3
移植肺的組織學形態(200×)
a:正常肺的組織學形態;b:常規冷保存后肺的組織學形態;c:移植再灌注后肺的組織學形態
2.2 移植后豬肺的血氣分析
4頭豬按照上述步驟進行左肺原位移植。移植后再灌注10 min的血氣分析結果提示,PaO2范圍為210.5~286.1 mm Hg,PaCO2范圍為39.8~47.2 mm Hg,PaO2/FiO2值范圍為350.8~476.8 mm Hg。再灌注1 h后的血氣分析結果提示,PaO2值范圍為188.3~219.0 mm Hg,PaCO2值為43.1~52.5 mm Hg,PaO2/FiO2值為376.6~438.0 mm Hg。再灌注2 h后的血氣分析結果提示,PaO2值范圍為155.4~178.6 mm Hg,PaCO2值范圍為53.1~62.4 mm Hg,PaO2/FiO2值范圍為310.8~357.2 mm Hg(表1)。該結果提示移植肺功能良好。
3 討論
相較于其他動物,豬肺具有與人肺相似的結構以及生理生化指標,以豬肺移植動物模型為基礎,促進研究臨床轉化應用具有重要的價值,同時也為異種移植奠定了模型基礎[25]。但是,豬肺與人肺有幾個重要的解剖學差異不容忽視。首先,豬肺有其特有的縱隔肺葉,屬于右肺的一部分;其次,豬肺的右肺上葉支氣管直接從主氣管中分出,不同于人類的從右主支氣管分出,這為豬右肺移植增添了難度;此外,豬的左奇靜脈的走行為向上穿過后縱隔,穿過左肺門后,直接匯入冠狀竇;最后,豬右下肺靜脈穿過正中線,緊鄰左下肺靜脈共同匯入左心房。熟悉這些解剖上的不同之處是豬肺移植成功開展的先決條件。
豬肺移植手術操作步驟繁多,很多細節處理不當都會導致移植后的效果不佳,進而引發術后PGD。在供肺獲取階段,由于豬的腔靜脈血管較人的更薄,因此在操作過程中要防止出血。供肺在體順行灌注沖洗時,保證肺動脈插管的尖端不要插入過深,要將其置于肺動脈分叉處的近心端,使得兩側肺臟灌注均勻。同時也要避免在灌注時導管放置過淺,側孔滑出肺動脈導致的灌注液外漏。此外,在灌注時要密切觀察流出道液體的顏色和流速,灌注不充分的部位可以用手輕柔地按摩紅色區域以促進灌注液循環。此外,移植肺經左心房逆行灌注是非常有必要的[27],在逆行灌注過程中可以通過改變肺臟的體位,達到良好的灌注效果。相較于人肺,豬肺更容易受到機械性損傷,表現為肺膜表面出現氣泡,再灌注后更容易出現水腫進而引發PGD,因此整個操作過程一定要輕柔,避免直接的機械損傷。
正常情況下豬肺存在少量的肺不張,因此消除肺不張是整個取肺過程的關鍵。首先松解下肺韌帶提高供肺活動度,在呼吸機壓力控制模式下,可以增加潮氣量消除肺不張。另外,膨肺是消除肺不張的有效手段[28]。但在此過程中一定要注意氣道壓力,設置呼吸機的氣道壓力為25 cm H2O后進行3 s膨肺,并且每間隔30 s重復一次,總共3次,這樣可以從最大程度上防止通氣過度導致的肺大皰產生及壓力損傷。此外,膨肺采用的氣體是50%的氧氣而非純氧,原因是濃度過高的氧氣會使供肺在保存過程中產生較多的氧自由基,進而導致再灌注后肺損傷的加重。研究[29]表明,50%的氧氣濃度下組織產生的氧自由基含量較低,血管內皮受損程度較小。
另一方面,在手術過程中,移植受體液體量的管理同樣值得關注。通常采用0.9%的NaCl溶液進行補液,速率控制在70~100 mL/h[30]。應盡可能避免補液量超負荷,從而加劇移植肺的再灌注水腫。此外在移植過程中,游離血管應十分謹慎,豬肺的血管很脆弱,要保持外膜的完整性,避免血管的過度裸化。肺門吻合的方式采用“支氣管-肺動脈-左房袖”的順序,也有研究者采用“左房袖-支氣管-肺動脈”的順序[31],這取決于術者的操作習慣。最后,在進行心房吻合時采用連續水平褥式縫合的方法,這種縫合的方式大大降低了吻合口處血栓產生的風險。此外,受體給予肝素抗凝可以有效地防止再灌注后血栓形成造成的肺栓塞,而這一步驟往往容易被忽略。
移植肺缺血-再灌注損傷的急性期發生在血液再通后的前4 h,因此,控制初始階段血液的再灌注流量是非常重要的[30]。器官長時間的缺血冷保存對血管內皮造成一定程度的損害,血管的屏障功能較為脆弱,所以應在前10 min內緩慢開放動脈阻斷鉗以控制初始灌注血流量。
總之,盡管豬肺與人肺在移植外科操作上有很多的相似之處,但是動物模型與實際臨床所面臨的情形還是存在一定區別。動物模型所采用的豬肺大多數是正常的,因而在術后測定肺功能、細胞因子、生化分子等方面的結果較為理想[32]。而在實際的臨床中,人類供肺常存在感染、水腫、肺不張、肺結節等不良因素,因此在移植之前需要對移植肺的功能進行充分的評估[27]。移植操作步驟復雜,細節繁多,在使用動物模型訓練時,應當深刻理解豬肺與人肺在解剖上的不同之處,通過不斷訓練減少操作失誤,從而提高肺移植效果。
利益沖突:無。
作者貢獻:張廣健、趙恒及馮錦騰負責論文設計;張廣健、高山、趙睿、王泓懿、孫燁、孫博睿及李碩負責實驗操作;李益行、白浩田、陶潤儀、何彬、王芝馀及張言鵬負責樣本收集與數據整理;趙恒負責論文初稿撰寫;張廣健、馮錦騰負責論文審閱與修改。
致謝 感謝西安交通大學動物實驗中心對本研究的支持與幫助。