隨著低劑量CT體檢的普及,無癥狀早期肺癌得以及時檢出[1]。目前,肺葉切除術聯合淋巴結清掃仍為肺癌根治的標準術式[2]。但對于肺部存在基礎疾病、既往行肺部手術、年齡大、身體狀況差的患者,需在保證切緣的前提下盡可能為患者保留肺組織,提高患者術后生活質量。解剖性肺段切除術將腫瘤切除范圍由葉聚焦到段,既取得了楔形切除術保留肺組織的優勢,也達到了肺癌根治的效果[3-5]。但對于外科醫師來說,肺段切除術較肺葉切除術難度大,術中需面臨氣管、血管變異的挑戰。因此,術前準確了解肺段氣管、血管分支走行對于手術安全尤為重要。
三維(three dimension,3D)重建可以直觀立體地將肺部解剖結構展現給術者,術者從3D圖像中獲取結節、血管、氣管的空間位置及毗鄰關系,對于肺段切除術前規劃發揮重要作用[6]。Mimics是目前應用較多的半自動3D重建軟件,可將二維影像資料重建為3D圖像,并以不同顏色展示結節、血管、氣管等解剖結構[7]。但半自動3D重建軟件Mimics缺點顯著:首先,重建效果受圖像質量影響,識別缺失的氣管需操作者手動補全;其次,重建需胸部增強CT,動靜脈區分由人工完成,區分錯誤的動靜脈需反復修改,耗時較長。影響Mimics重建準確度的另一重要因素是操作者的耐心程度和解剖熟悉程度,但臨床更需要能很好匹配工作節奏的3D重建工具。因此,發掘人工智能(artificial intelligence,AI)在3D重建的應用符合臨床需求。
日本在AI 3D重建軟件的研發起步較早,2013年Ikeda等[8]報道了Synapse Vincent軟件用于肺部3D重建,REVORAS軟件的使用也有相關報道[9]。在國內,最早的AI 3D重建軟件是陳亮團隊[10]報道的DeepInsight軟件,其肺部重建準確性真實性已通過驗證。近年,借助AI技術加持,國產AI 3D重建軟件已具備速度快、操作簡單、精度高、智能化等特點[11]。本文通過比較AI軟件肺3D重建、Mimics軟件肺3D重建、經驗性肺段切除3種方式的臨床應用效果,探尋各種方法的優劣,以期為胸外科醫師找到更為高效、準確的術前規劃手段。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2019年10月—2024年3月于淮安市第二人民醫院胸外科行胸腔鏡肺段切除手術患者的臨床資料。納入標準:(1)術前檢查心肺功能可耐受胸腔鏡肺段切除手術;(2)腫瘤無遠處轉移;(3)結節大小≤2 cm,實性成分>50%。排除標準:(1)術前檢查及臨床評估無法耐受胸腔鏡肺段切除術;(2)腫瘤遠處轉移;(3)有肺部手術史;(4)患者拒絕肺段切除術。術前使用推想AI軟件3D重建的患者納入AI組,術前使用Mimics 3D重建的患者納入Mimics組,術前未行3D重建的患者納入對照組。
1.2 方法
1.2.1 術前3D重建及手術規劃
本研究采用Mimics 21.0軟件、推想AI軟件[產品名稱:胸部CT影像全自動手術計劃軟件-科研版,產品型號:infer Operate Thorax Planning,完整版本:H4.7.0;已獲國家藥品監督管理局三類醫療器械審批(國械注準
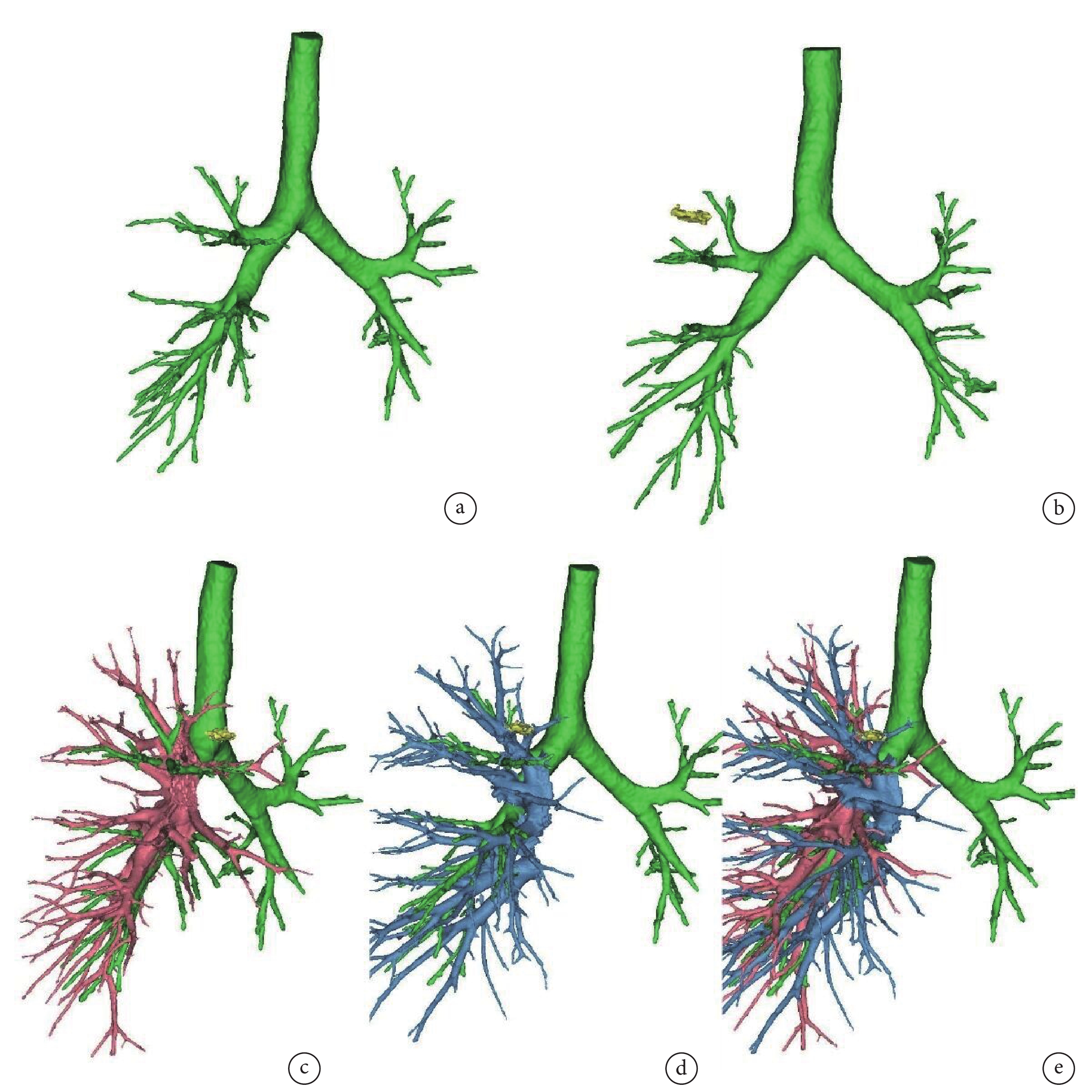
所有患者術前行胸部高分辨率CT檢查。需行3D重建的病例,于影像系統中導出DICOM壓縮包。AI組將DICOM數據包導入推想軟件進行3D重建(圖1),可在病灶列表里選擇顯示/隱藏的結節,并顯示結節的20 mm安全切緣。可使用3D控制臺切換全肺/肺葉模式,顯示/隱藏氣管、血管、肺段。根據重建的3D圖像,配合軟件工具的使用,實現手術規劃。Mimics組將DICOM壓縮包導入Mimics 21.0軟件中,由具備豐富重建經驗的醫師按照操作步驟,依次識別氣管及結節,確定安全切緣,分割動靜脈,劃分肺葉及肺段(圖2)。
 圖1
AI軟件3D重建示意圖
圖1
AI軟件3D重建示意圖
a:AI重建肺部氣管、結節;b:AI劃分肺葉肺段;c:AI重建肺靜脈;d:AI重建肺動脈;e:AI重建肺部血管;AI:人工智能;3D:三維
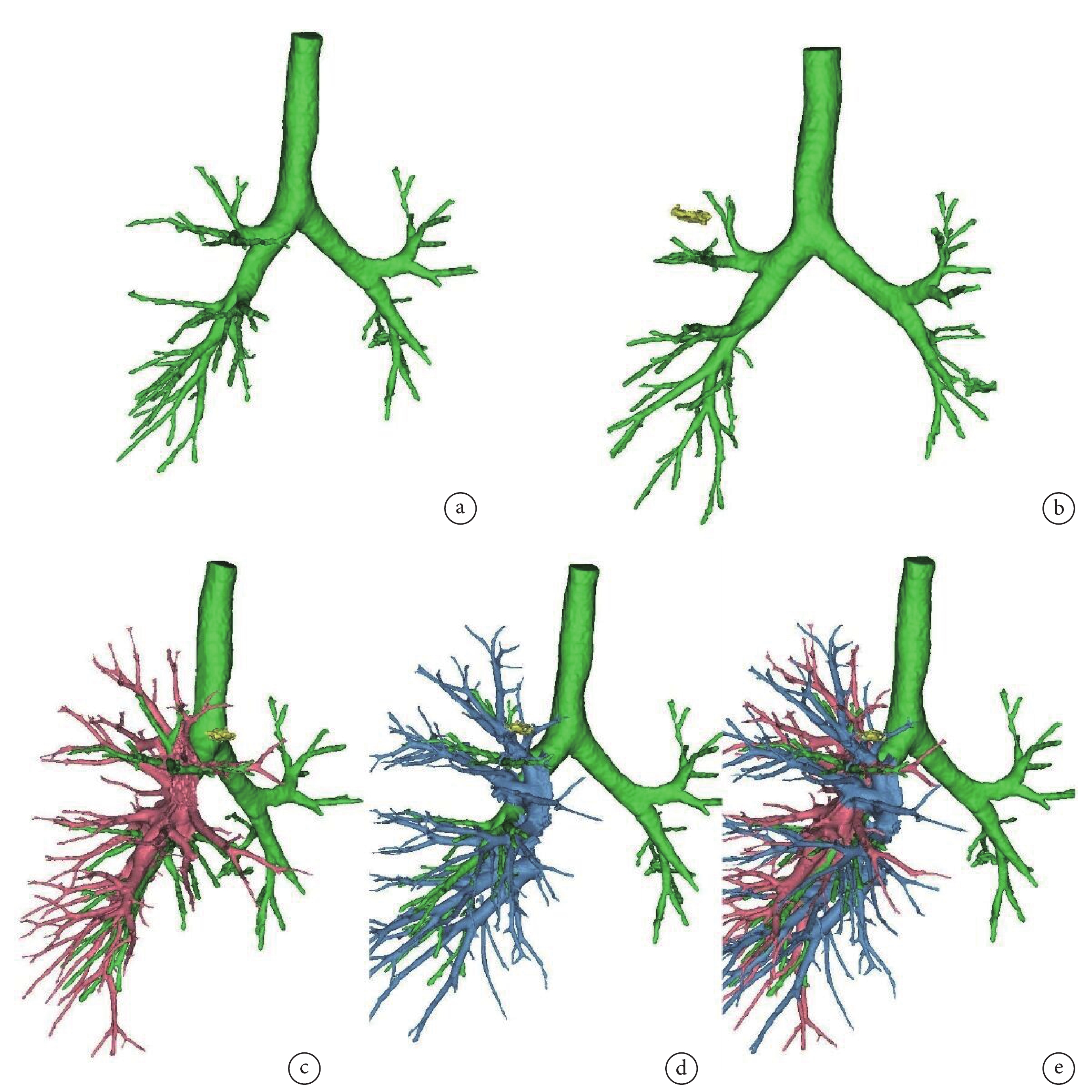 圖2
Mimics軟件3D重建示意圖
圖2
Mimics軟件3D重建示意圖
a:Mimics重建肺部氣管;b:Mimics重建肺部結節;c:Mimics重建肺動脈;d:Mimics重建肺靜脈;e:Mimics重建肺部血管;3D:三維
推想AI軟件3D重建實現方式:(1)肺結節的建模:通過CT影像及檢測框,獲得第二高斯球圖像。將CT影像與第二高斯球圖像匹配,獲得形變關系,第二高斯球依據形變關系生成第一高斯球圖像。將CT影像、第一高斯球圖像、檢測框輸入分割網絡模型(如ResUnet分割網絡),獲取肺結節的分割圖像[12]。(2)氣管的建模:從CT影像中獲取等待分類肺部支氣管的初始肺部圖像,將初始肺部圖像灰度歸一化,采用如UNet深度學習分割網絡進行氣管分割,得到支氣管掩膜圖像。對掩膜圖像中的支氣管分段,獲得兩個以上支氣管段。基于各支氣管段之間的解剖關系及特征,確定肺部支氣管的分類結果[13-14]。(3)肺血管的建模:從CT影像中分割提取目標肺血管所在3D圖像的最大外接立方體區域作為第一輸入數據。第一輸入數據導入訓練后的肺血管分段定位模型中,獲得目標肺血管的第一分段(目標肺血管的主干)、第二分段(目標肺血管的每一血管分支)及初始定位結果(目標肺血管的每一血管分支對應的起始點坐標)。利用第一分段及第二分段結果,確定目標肺血管的每一血管分支對應的定位候選區域。利用定位候選區域,對該血管分支對應的起始點坐標進行修正,獲得目標肺血管的最終定位結果[15-17]。
對照組術前手術醫師閱讀患者胸部CT,AI及Mimics組術前手術醫師閱讀患者胸部CT和3D圖像,手術醫師依據影像學檢查,規劃手術路徑。術中依據需要瀏覽CT/3D圖像。
1.2.2 手術方法
雙腔氣管插管,術中側臥位,常規消毒鋪巾。切口位于腋前線與腋中線之間,長約3~4 cm,作為操作孔及觀察孔。常規行單孔胸腔鏡手術。遇胸腔嚴重粘連可于第7肋間腋中線增加1個1 cm切口作為觀察孔。依據術前規劃結合術中實際,離斷氣管及血管后,采用膨脹-萎陷法等待15 min,顯露段間平面,完整切除肺段組織,確保結節切緣≥2 cm或超過結節直徑。送術中快速病理,切緣不能滿足≥2 cm或超過結節直徑的病例則擴大切除肺段。快速病理惡性的送檢淋巴結。快速病理良性的則不送檢、不繼續進行淋巴結清掃或采樣。患者疾病診斷標準為術后常規病理結果。
1.3 觀察指標
記錄圍手術期臨床指標,包括手術時間、術中出血量、淋巴結清掃組數、術后住院時間、引流管拔除時間、引流量、病理結果、術后并發癥、手術切除肺段。
1.4 統計學分析
研究數據采用SPSS 25.0軟件分析。符合正態分布的定量資料以均數±標準差(x±s)描述,總體差異采用F檢驗,采用Bonferroni法進行組間差異多重比較。不符合正態分布的定量資料以中位數(上下四分位數)[M(P25,P75)]描述,總體差異采用Kruskal Wallis 檢驗,采用Bonferroni 方法進行組間差異多重比較,差異有統計學意義的指標采用Mann Whitney U檢驗進行兩兩比較。分類資料以頻數及百分比描述,采用χ2檢驗或Fisher確切概率法比較總體差異。雙側檢驗水準α=0.05。
1.5 倫理審查
本研究經淮安市第二人民醫院倫理委員會審批通過,倫理審查批號:HEYLL2024044。
2 結果
2.1 患者一般資料
研究共納入168例患者,其中男73例、女95例,年齡25~81(61.61±10.55)歲。三組患者性別、年齡、吸煙史、結節大小等差異無統計學意義(P>0.05);見表1。
2.2 圍手術期資料
三組手術時間、拔管時間、引流量、出血量、術后住院時間總體差異有統計學意義(P<0.05)。三組術中淋巴結清掃組數(P=0.757)、術后病理結果(P=0.570)差異無統計學意義。三組術后切緣陰性,且滿足≥2 cm或超過結節直徑。三組術后并發癥分別為5例、4例、4例。AI組術后1例肺漏氣,檢查提示氣胸壓縮15%,術后予負壓吸引;1例因術后胸腔包裹積液,引流不暢需超聲引導下胸腔穿刺引流;2例因術中胸腔粘連較重,術后引流較多,住院時間延長;1例于術后第2天因哮喘急性發作而轉入呼吸重癥監護室。Mimics組1例術后漏氣導致皮下氣腫行負壓吸引;1例因術中胸腔粘連嚴重,術后肺漏氣行負壓吸引;1例因術前口服抗凝藥物史,術后胸腔引流顏色深且多,術后當晚血壓86/43 mm Hg(1 mm Hg=0.133 kPa),予以輸血2 U,血漿350 mL;1例術后反復咳嗽,需多種藥物止咳。對照組1例肺漏氣,術后胸部X線片提示少量氣胸,未特殊處理,后正常時間拔管出院;1例肺漏氣,需負壓吸引;1例術后胸部CT示雙肺滲出性改變、右肺局部實變,經呼吸功能訓練后復查CT肺復張良好;1例術后復查D-二聚體升高,肺動脈CT血管造影確診肺栓塞。三組術后并發癥差異無統計學意義(P>0.05);見表2~3。
3 討論
國家癌癥中心最新發布的全國癌癥統計數據[18]顯示,肺癌發病率和死亡率都位居癌癥之首。肺癌的治療方法多樣,包括手術、化療、放療、靶向治療、免疫治療等,手術是早期肺癌的首選治療手段。胸外科肺癌術式的發展最早可追溯到1933年,美國醫師埃瓦茨·格雷厄姆進行了第1例左全肺切除以根治肺癌[19]。隨后1941年,北京協和醫學院張紀正完成了國內首例全肺切除術。但全肺切除術手術風險大,對患者心肺功能影響較大,術后存在心律失常、縱膈移位、急性呼吸窘迫綜合征、肺動脈高壓及右心功能不全、全肺切除后綜合征等一系列并發癥[20]。全肺切除患者往往承受更高的圍手術期并發癥發生率和死亡率。因此,肺癌的手術發展方向一直向著盡可能切除原發灶及引流區淋巴結、盡可能保留肺功能的方向進行。肺段切除對肺功能的影響比肺葉及全肺小[21],JCOG0802/WJ0G4607L研究[22]為肺段切除術根治肺癌奠定了理論基礎,對于直徑≤2 cm,實性成分占比>0.5的結節,肺段切除5年總生存率優于肺葉切除,5年無復發生存率與肺葉切除無顯著差異。然而解剖性肺段切除對術者的解剖學基礎、閱片能力有較高要求,憑借術前CT進行手術路徑規劃對術者有極大挑戰。尤其是對于跨肺段的結節、氣管及血管復雜變異的肺葉,聯合亞段切除更依賴術前3D重建技術規劃手術路徑,確定切除范圍[23]。
對于遠離臟層胸膜的結節,肺表面通常無胸膜牽拉、凹陷征等表現。且磨玻璃結節實性成分少,術中僅憑器械滑動及手指觸摸,難以定位結節[24]。肺結節的定位方法多樣,有創定位如Hookwire、彈簧圈定位、亞甲藍標記、電磁導航支氣管鏡[25],存在疼痛、費用高、血氣胸、脫鉤、栓塞等弊端[2]。無創定位如肺3D重建,可以通過將二維的CT影像轉變為3D的肺部模型,通過放大縮小、旋轉平移等操作,可以更直觀地觀察血管、支氣管走行。通過術前觀察結節與周圍血管、氣管的毗鄰關系,術中實時查看,實現無創定位結節位置。同時也有助于外科醫師術前規劃手術路徑、保證切緣、降低血管損傷風險并提高手術安全性[26]。
AW、OSiriX等早期3D重建軟件因精度不足,已很少使用。Mimics軟件具有操作簡單、精度較高等優點,目前被多家醫院使用[27]。國產3D重建軟件DeepInsight由陳亮團隊開發,操作更為簡單且免費,目前也已在多家醫院使用,但對CT圖像質量要求較高[10]。AI技術近年來在各個領域異軍突起,AI技術在胸外科的應用經歷了肺結節識別[28]、良惡性判別[29]、預測輔助決策[30-32]、術前規劃[33]等過程。在肺3D重建方面,其具有速度快、操作簡單、精度高、智能化等特點[11]。
AI用于肺術前規劃時,其3D重建的準確性及安全性備受關注。Chen等對20例病例分別行推想AI 3D重建、Mimics人工3D重建,結果顯示,AI和Mimics分別以 85% 和 80%的準確率實現了對血管和支氣管的檢測(P=1.00)。AI 和Mimics的血管分類準確率分別為80%和95%(P=0.34)。AI與Mimics在解剖重建準確性方面差異無統計學意義[33]。Linkdoc AI團隊[34]發現,AI 3D重建系統的準確性及安全性均優于Mimics及無AI輔助。本研究結果表明,AI及Mimics 3D重建對胸腔鏡肺段切除均有指導意義,可使患者獲益,AI 3D重建在術前規劃方面不劣于Mimics 3D重建。
在重建時間方面,AI組完成3D重建約5~10 min,而Mimics組完成3D重建的時間約20~40 min。由于需要醫師完成重建中的動靜脈、段間平面識別等主要步驟,重建時間與CT圖像質量、醫師的解剖熟悉程度和工作狀態有較大關系。本研究中,AI在術前規劃方面不劣于Mimics。因此,采用AI完成3D重建能夠極大減輕醫師工作量,使其將更多的精力投入于術前手術路徑規劃及手術方案制定中。同時,AI 3D重建也使得術前3D重建+解剖性肺段切除更容易推廣到基層醫院。以往,肺3D重建需要熟悉解剖并掌握Mimics軟件操作的醫師完成,而AI僅需導入DICOM文件,即可自動完成重建工作。同時,AI 3D重建也縮短了培訓胸外科住院醫師的時間。由于重建時間及人工成本低,無論肺段還是肺葉手術術前幾乎都可以由AI完成3D重建,住院醫師通過術前3D重建3D圖像初步構思手術路徑,術中觀摩上級醫師手術操作,術后再次結合手術錄像及3D重建圖像學習解剖知識。雖然AI 3D重建在時間及人工成本上有極大優勢,但對于胸外科住院醫師來說,我們建議先行Mimics重建練習,使用半自動系統識別標記氣管、動靜脈、段間平面。并將人工重建圖像與AI重建圖像對比。通過人工重建過程,住院醫師可快速熟悉肺部血管走行及肺段結構分布。當熟練完成人工3D重建后,AI 3D重建將成為工作中的首選工具,因為醫師應該將更多的精力關注于手術本身而不是機械的重建工作。
目前,AI在手術中的應用有限,主要集中在術前規劃以提高手術安全性及準確性[35-36]。術中決策支持是未來AI在胸外科手術中的進一步運用。國外已有報道,研究者將3D圖像加載到科羅拉多州立大學開發的BananaVision 軟件中并顯示在頭戴式顯示器上[37],使外科醫師以沉浸的視角觀察解剖結構。但其只是改變了3D圖像呈現的載體,本質上還是處于術前模擬規劃階段,并未將虛擬現實技術與術中解剖實時結合。隨著技術發展,若胸腔鏡圖像與3D重建圖像自動匹配功能可以集成到推想軟件中,再結合虛擬現實視角,那么理論上胸外科醫師可以使用動態3D圖像與肺組織疊加層進行實時手術指導。3D重建對胸外科手術的意義將不再局限于術前規劃,虛擬手術模擬可以更加直觀有效地規劃手術路徑。其將重點參與手術過程,術中解剖的動靜脈將在虛擬現實視角中與3D圖像一一對應。同時3D圖像也可在手術中通過標記、指引、顯色等方式為術者提供手術路徑、結節無創定位等功能。術中3D導航或可以提高解剖切除的安全性及準確性[38-39]。如同目前磁導航技術一樣,其可將CT圖像與支氣管鏡相結合,通過生成虛擬的3D支氣管樹圖像,標記結節位置,提供通向結節的支氣管導航路徑,賦予支氣管鏡“GPS”功能,使得在錯綜復雜的氣管中精準引導至目標結節[40]。雖然AI在胸外科應用取得較好的效果,但對于AI在醫療領域的使用仍應該持有批判的態度。首先,AI軟件的使用應經歷嚴格的評估,應用于商業的AI軟件需取得國家藥品監督管理局醫療器械審批,應用于科研的AI軟件需取得患者知情同意,并符合醫學倫理。AI軟件的輸出結果極大程度上取決于算法以及數據的數量和質量,因此可能存在潛在的偏差。雖然AI軟件可以將醫師從重復機械勞動中解放,但是醫師必須充做好審查者的身份,以確保醫療質量。
綜上所述,術前采用AI 3D重建或Mimics人工3D重建進行手術規劃,可縮短手術時間、拔管時間、術后住院時間,減少術中出血量。AI 3D重建對手術指導及術后康復方面不劣于Mimics人工3D重建,可減輕臨床醫師工作量,值得推廣。AI在醫療領域的應用有廣闊前景,隨著技術進步及數據積累,未來AI在預防、診斷、治療、康復的醫療全流程中將發揮重要作用。同時,本研究也存在一定局限性。這是一個回顧性單中心研究,樣本量較小,缺乏遠期的隨訪數據及指標,需要多中心、前瞻性、大樣本的臨床試驗進一步驗證。
利益沖突:無。
作者貢獻:桑成鵬負責研究設計,撰寫論文;朱逸、王亞勤、貢力負責數據收集與整理;閔波、胡海波負責數據統計分析;唐志賢負責論文審閱與修改。
隨著低劑量CT體檢的普及,無癥狀早期肺癌得以及時檢出[1]。目前,肺葉切除術聯合淋巴結清掃仍為肺癌根治的標準術式[2]。但對于肺部存在基礎疾病、既往行肺部手術、年齡大、身體狀況差的患者,需在保證切緣的前提下盡可能為患者保留肺組織,提高患者術后生活質量。解剖性肺段切除術將腫瘤切除范圍由葉聚焦到段,既取得了楔形切除術保留肺組織的優勢,也達到了肺癌根治的效果[3-5]。但對于外科醫師來說,肺段切除術較肺葉切除術難度大,術中需面臨氣管、血管變異的挑戰。因此,術前準確了解肺段氣管、血管分支走行對于手術安全尤為重要。
三維(three dimension,3D)重建可以直觀立體地將肺部解剖結構展現給術者,術者從3D圖像中獲取結節、血管、氣管的空間位置及毗鄰關系,對于肺段切除術前規劃發揮重要作用[6]。Mimics是目前應用較多的半自動3D重建軟件,可將二維影像資料重建為3D圖像,并以不同顏色展示結節、血管、氣管等解剖結構[7]。但半自動3D重建軟件Mimics缺點顯著:首先,重建效果受圖像質量影響,識別缺失的氣管需操作者手動補全;其次,重建需胸部增強CT,動靜脈區分由人工完成,區分錯誤的動靜脈需反復修改,耗時較長。影響Mimics重建準確度的另一重要因素是操作者的耐心程度和解剖熟悉程度,但臨床更需要能很好匹配工作節奏的3D重建工具。因此,發掘人工智能(artificial intelligence,AI)在3D重建的應用符合臨床需求。
日本在AI 3D重建軟件的研發起步較早,2013年Ikeda等[8]報道了Synapse Vincent軟件用于肺部3D重建,REVORAS軟件的使用也有相關報道[9]。在國內,最早的AI 3D重建軟件是陳亮團隊[10]報道的DeepInsight軟件,其肺部重建準確性真實性已通過驗證。近年,借助AI技術加持,國產AI 3D重建軟件已具備速度快、操作簡單、精度高、智能化等特點[11]。本文通過比較AI軟件肺3D重建、Mimics軟件肺3D重建、經驗性肺段切除3種方式的臨床應用效果,探尋各種方法的優劣,以期為胸外科醫師找到更為高效、準確的術前規劃手段。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2019年10月—2024年3月于淮安市第二人民醫院胸外科行胸腔鏡肺段切除手術患者的臨床資料。納入標準:(1)術前檢查心肺功能可耐受胸腔鏡肺段切除手術;(2)腫瘤無遠處轉移;(3)結節大小≤2 cm,實性成分>50%。排除標準:(1)術前檢查及臨床評估無法耐受胸腔鏡肺段切除術;(2)腫瘤遠處轉移;(3)有肺部手術史;(4)患者拒絕肺段切除術。術前使用推想AI軟件3D重建的患者納入AI組,術前使用Mimics 3D重建的患者納入Mimics組,術前未行3D重建的患者納入對照組。
1.2 方法
1.2.1 術前3D重建及手術規劃
本研究采用Mimics 21.0軟件、推想AI軟件[產品名稱:胸部CT影像全自動手術計劃軟件-科研版,產品型號:infer Operate Thorax Planning,完整版本:H4.7.0;已獲國家藥品監督管理局三類醫療器械審批(國械注準
所有患者術前行胸部高分辨率CT檢查。需行3D重建的病例,于影像系統中導出DICOM壓縮包。AI組將DICOM數據包導入推想軟件進行3D重建(圖1),可在病灶列表里選擇顯示/隱藏的結節,并顯示結節的20 mm安全切緣。可使用3D控制臺切換全肺/肺葉模式,顯示/隱藏氣管、血管、肺段。根據重建的3D圖像,配合軟件工具的使用,實現手術規劃。Mimics組將DICOM壓縮包導入Mimics 21.0軟件中,由具備豐富重建經驗的醫師按照操作步驟,依次識別氣管及結節,確定安全切緣,分割動靜脈,劃分肺葉及肺段(圖2)。
 圖1
AI軟件3D重建示意圖
圖1
AI軟件3D重建示意圖
a:AI重建肺部氣管、結節;b:AI劃分肺葉肺段;c:AI重建肺靜脈;d:AI重建肺動脈;e:AI重建肺部血管;AI:人工智能;3D:三維
 圖2
Mimics軟件3D重建示意圖
圖2
Mimics軟件3D重建示意圖
a:Mimics重建肺部氣管;b:Mimics重建肺部結節;c:Mimics重建肺動脈;d:Mimics重建肺靜脈;e:Mimics重建肺部血管;3D:三維
推想AI軟件3D重建實現方式:(1)肺結節的建模:通過CT影像及檢測框,獲得第二高斯球圖像。將CT影像與第二高斯球圖像匹配,獲得形變關系,第二高斯球依據形變關系生成第一高斯球圖像。將CT影像、第一高斯球圖像、檢測框輸入分割網絡模型(如ResUnet分割網絡),獲取肺結節的分割圖像[12]。(2)氣管的建模:從CT影像中獲取等待分類肺部支氣管的初始肺部圖像,將初始肺部圖像灰度歸一化,采用如UNet深度學習分割網絡進行氣管分割,得到支氣管掩膜圖像。對掩膜圖像中的支氣管分段,獲得兩個以上支氣管段。基于各支氣管段之間的解剖關系及特征,確定肺部支氣管的分類結果[13-14]。(3)肺血管的建模:從CT影像中分割提取目標肺血管所在3D圖像的最大外接立方體區域作為第一輸入數據。第一輸入數據導入訓練后的肺血管分段定位模型中,獲得目標肺血管的第一分段(目標肺血管的主干)、第二分段(目標肺血管的每一血管分支)及初始定位結果(目標肺血管的每一血管分支對應的起始點坐標)。利用第一分段及第二分段結果,確定目標肺血管的每一血管分支對應的定位候選區域。利用定位候選區域,對該血管分支對應的起始點坐標進行修正,獲得目標肺血管的最終定位結果[15-17]。
對照組術前手術醫師閱讀患者胸部CT,AI及Mimics組術前手術醫師閱讀患者胸部CT和3D圖像,手術醫師依據影像學檢查,規劃手術路徑。術中依據需要瀏覽CT/3D圖像。
1.2.2 手術方法
雙腔氣管插管,術中側臥位,常規消毒鋪巾。切口位于腋前線與腋中線之間,長約3~4 cm,作為操作孔及觀察孔。常規行單孔胸腔鏡手術。遇胸腔嚴重粘連可于第7肋間腋中線增加1個1 cm切口作為觀察孔。依據術前規劃結合術中實際,離斷氣管及血管后,采用膨脹-萎陷法等待15 min,顯露段間平面,完整切除肺段組織,確保結節切緣≥2 cm或超過結節直徑。送術中快速病理,切緣不能滿足≥2 cm或超過結節直徑的病例則擴大切除肺段。快速病理惡性的送檢淋巴結。快速病理良性的則不送檢、不繼續進行淋巴結清掃或采樣。患者疾病診斷標準為術后常規病理結果。
1.3 觀察指標
記錄圍手術期臨床指標,包括手術時間、術中出血量、淋巴結清掃組數、術后住院時間、引流管拔除時間、引流量、病理結果、術后并發癥、手術切除肺段。
1.4 統計學分析
研究數據采用SPSS 25.0軟件分析。符合正態分布的定量資料以均數±標準差(x±s)描述,總體差異采用F檢驗,采用Bonferroni法進行組間差異多重比較。不符合正態分布的定量資料以中位數(上下四分位數)[M(P25,P75)]描述,總體差異采用Kruskal Wallis 檢驗,采用Bonferroni 方法進行組間差異多重比較,差異有統計學意義的指標采用Mann Whitney U檢驗進行兩兩比較。分類資料以頻數及百分比描述,采用χ2檢驗或Fisher確切概率法比較總體差異。雙側檢驗水準α=0.05。
1.5 倫理審查
本研究經淮安市第二人民醫院倫理委員會審批通過,倫理審查批號:HEYLL2024044。
2 結果
2.1 患者一般資料
研究共納入168例患者,其中男73例、女95例,年齡25~81(61.61±10.55)歲。三組患者性別、年齡、吸煙史、結節大小等差異無統計學意義(P>0.05);見表1。
2.2 圍手術期資料
三組手術時間、拔管時間、引流量、出血量、術后住院時間總體差異有統計學意義(P<0.05)。三組術中淋巴結清掃組數(P=0.757)、術后病理結果(P=0.570)差異無統計學意義。三組術后切緣陰性,且滿足≥2 cm或超過結節直徑。三組術后并發癥分別為5例、4例、4例。AI組術后1例肺漏氣,檢查提示氣胸壓縮15%,術后予負壓吸引;1例因術后胸腔包裹積液,引流不暢需超聲引導下胸腔穿刺引流;2例因術中胸腔粘連較重,術后引流較多,住院時間延長;1例于術后第2天因哮喘急性發作而轉入呼吸重癥監護室。Mimics組1例術后漏氣導致皮下氣腫行負壓吸引;1例因術中胸腔粘連嚴重,術后肺漏氣行負壓吸引;1例因術前口服抗凝藥物史,術后胸腔引流顏色深且多,術后當晚血壓86/43 mm Hg(1 mm Hg=0.133 kPa),予以輸血2 U,血漿350 mL;1例術后反復咳嗽,需多種藥物止咳。對照組1例肺漏氣,術后胸部X線片提示少量氣胸,未特殊處理,后正常時間拔管出院;1例肺漏氣,需負壓吸引;1例術后胸部CT示雙肺滲出性改變、右肺局部實變,經呼吸功能訓練后復查CT肺復張良好;1例術后復查D-二聚體升高,肺動脈CT血管造影確診肺栓塞。三組術后并發癥差異無統計學意義(P>0.05);見表2~3。
3 討論
國家癌癥中心最新發布的全國癌癥統計數據[18]顯示,肺癌發病率和死亡率都位居癌癥之首。肺癌的治療方法多樣,包括手術、化療、放療、靶向治療、免疫治療等,手術是早期肺癌的首選治療手段。胸外科肺癌術式的發展最早可追溯到1933年,美國醫師埃瓦茨·格雷厄姆進行了第1例左全肺切除以根治肺癌[19]。隨后1941年,北京協和醫學院張紀正完成了國內首例全肺切除術。但全肺切除術手術風險大,對患者心肺功能影響較大,術后存在心律失常、縱膈移位、急性呼吸窘迫綜合征、肺動脈高壓及右心功能不全、全肺切除后綜合征等一系列并發癥[20]。全肺切除患者往往承受更高的圍手術期并發癥發生率和死亡率。因此,肺癌的手術發展方向一直向著盡可能切除原發灶及引流區淋巴結、盡可能保留肺功能的方向進行。肺段切除對肺功能的影響比肺葉及全肺小[21],JCOG0802/WJ0G4607L研究[22]為肺段切除術根治肺癌奠定了理論基礎,對于直徑≤2 cm,實性成分占比>0.5的結節,肺段切除5年總生存率優于肺葉切除,5年無復發生存率與肺葉切除無顯著差異。然而解剖性肺段切除對術者的解剖學基礎、閱片能力有較高要求,憑借術前CT進行手術路徑規劃對術者有極大挑戰。尤其是對于跨肺段的結節、氣管及血管復雜變異的肺葉,聯合亞段切除更依賴術前3D重建技術規劃手術路徑,確定切除范圍[23]。
對于遠離臟層胸膜的結節,肺表面通常無胸膜牽拉、凹陷征等表現。且磨玻璃結節實性成分少,術中僅憑器械滑動及手指觸摸,難以定位結節[24]。肺結節的定位方法多樣,有創定位如Hookwire、彈簧圈定位、亞甲藍標記、電磁導航支氣管鏡[25],存在疼痛、費用高、血氣胸、脫鉤、栓塞等弊端[2]。無創定位如肺3D重建,可以通過將二維的CT影像轉變為3D的肺部模型,通過放大縮小、旋轉平移等操作,可以更直觀地觀察血管、支氣管走行。通過術前觀察結節與周圍血管、氣管的毗鄰關系,術中實時查看,實現無創定位結節位置。同時也有助于外科醫師術前規劃手術路徑、保證切緣、降低血管損傷風險并提高手術安全性[26]。
AW、OSiriX等早期3D重建軟件因精度不足,已很少使用。Mimics軟件具有操作簡單、精度較高等優點,目前被多家醫院使用[27]。國產3D重建軟件DeepInsight由陳亮團隊開發,操作更為簡單且免費,目前也已在多家醫院使用,但對CT圖像質量要求較高[10]。AI技術近年來在各個領域異軍突起,AI技術在胸外科的應用經歷了肺結節識別[28]、良惡性判別[29]、預測輔助決策[30-32]、術前規劃[33]等過程。在肺3D重建方面,其具有速度快、操作簡單、精度高、智能化等特點[11]。
AI用于肺術前規劃時,其3D重建的準確性及安全性備受關注。Chen等對20例病例分別行推想AI 3D重建、Mimics人工3D重建,結果顯示,AI和Mimics分別以 85% 和 80%的準確率實現了對血管和支氣管的檢測(P=1.00)。AI 和Mimics的血管分類準確率分別為80%和95%(P=0.34)。AI與Mimics在解剖重建準確性方面差異無統計學意義[33]。Linkdoc AI團隊[34]發現,AI 3D重建系統的準確性及安全性均優于Mimics及無AI輔助。本研究結果表明,AI及Mimics 3D重建對胸腔鏡肺段切除均有指導意義,可使患者獲益,AI 3D重建在術前規劃方面不劣于Mimics 3D重建。
在重建時間方面,AI組完成3D重建約5~10 min,而Mimics組完成3D重建的時間約20~40 min。由于需要醫師完成重建中的動靜脈、段間平面識別等主要步驟,重建時間與CT圖像質量、醫師的解剖熟悉程度和工作狀態有較大關系。本研究中,AI在術前規劃方面不劣于Mimics。因此,采用AI完成3D重建能夠極大減輕醫師工作量,使其將更多的精力投入于術前手術路徑規劃及手術方案制定中。同時,AI 3D重建也使得術前3D重建+解剖性肺段切除更容易推廣到基層醫院。以往,肺3D重建需要熟悉解剖并掌握Mimics軟件操作的醫師完成,而AI僅需導入DICOM文件,即可自動完成重建工作。同時,AI 3D重建也縮短了培訓胸外科住院醫師的時間。由于重建時間及人工成本低,無論肺段還是肺葉手術術前幾乎都可以由AI完成3D重建,住院醫師通過術前3D重建3D圖像初步構思手術路徑,術中觀摩上級醫師手術操作,術后再次結合手術錄像及3D重建圖像學習解剖知識。雖然AI 3D重建在時間及人工成本上有極大優勢,但對于胸外科住院醫師來說,我們建議先行Mimics重建練習,使用半自動系統識別標記氣管、動靜脈、段間平面。并將人工重建圖像與AI重建圖像對比。通過人工重建過程,住院醫師可快速熟悉肺部血管走行及肺段結構分布。當熟練完成人工3D重建后,AI 3D重建將成為工作中的首選工具,因為醫師應該將更多的精力關注于手術本身而不是機械的重建工作。
目前,AI在手術中的應用有限,主要集中在術前規劃以提高手術安全性及準確性[35-36]。術中決策支持是未來AI在胸外科手術中的進一步運用。國外已有報道,研究者將3D圖像加載到科羅拉多州立大學開發的BananaVision 軟件中并顯示在頭戴式顯示器上[37],使外科醫師以沉浸的視角觀察解剖結構。但其只是改變了3D圖像呈現的載體,本質上還是處于術前模擬規劃階段,并未將虛擬現實技術與術中解剖實時結合。隨著技術發展,若胸腔鏡圖像與3D重建圖像自動匹配功能可以集成到推想軟件中,再結合虛擬現實視角,那么理論上胸外科醫師可以使用動態3D圖像與肺組織疊加層進行實時手術指導。3D重建對胸外科手術的意義將不再局限于術前規劃,虛擬手術模擬可以更加直觀有效地規劃手術路徑。其將重點參與手術過程,術中解剖的動靜脈將在虛擬現實視角中與3D圖像一一對應。同時3D圖像也可在手術中通過標記、指引、顯色等方式為術者提供手術路徑、結節無創定位等功能。術中3D導航或可以提高解剖切除的安全性及準確性[38-39]。如同目前磁導航技術一樣,其可將CT圖像與支氣管鏡相結合,通過生成虛擬的3D支氣管樹圖像,標記結節位置,提供通向結節的支氣管導航路徑,賦予支氣管鏡“GPS”功能,使得在錯綜復雜的氣管中精準引導至目標結節[40]。雖然AI在胸外科應用取得較好的效果,但對于AI在醫療領域的使用仍應該持有批判的態度。首先,AI軟件的使用應經歷嚴格的評估,應用于商業的AI軟件需取得國家藥品監督管理局醫療器械審批,應用于科研的AI軟件需取得患者知情同意,并符合醫學倫理。AI軟件的輸出結果極大程度上取決于算法以及數據的數量和質量,因此可能存在潛在的偏差。雖然AI軟件可以將醫師從重復機械勞動中解放,但是醫師必須充做好審查者的身份,以確保醫療質量。
綜上所述,術前采用AI 3D重建或Mimics人工3D重建進行手術規劃,可縮短手術時間、拔管時間、術后住院時間,減少術中出血量。AI 3D重建對手術指導及術后康復方面不劣于Mimics人工3D重建,可減輕臨床醫師工作量,值得推廣。AI在醫療領域的應用有廣闊前景,隨著技術進步及數據積累,未來AI在預防、診斷、治療、康復的醫療全流程中將發揮重要作用。同時,本研究也存在一定局限性。這是一個回顧性單中心研究,樣本量較小,缺乏遠期的隨訪數據及指標,需要多中心、前瞻性、大樣本的臨床試驗進一步驗證。
利益沖突:無。
作者貢獻:桑成鵬負責研究設計,撰寫論文;朱逸、王亞勤、貢力負責數據收集與整理;閔波、胡海波負責數據統計分析;唐志賢負責論文審閱與修改。