大動脈炎合并主動脈瓣病變患者行外科瓣膜置換術后預后不良,常面臨瓣周漏、瓣膜脫落和吻合口動脈瘤等并發癥風險。本文報道了一例通過經心尖途徑經導管主動脈瓣植入術成功治療大動脈炎合并主動脈瓣重度關閉不全的高危病例。患者術后6個月復查瓣膜功能良好,無并發癥發生。這為臨床治療此類高危患者提供了一種微創且可行的替代方案。
大動脈炎是一種慢性非特異性炎癥性疾病,主要累及主動脈及其主要分支和肺動脈,引起不同部位動脈狹窄、閉塞甚至動脈瘤。約2.2%~20%的患者因炎癥波及主動脈瓣,導致主動脈瓣狹窄或關閉不全。嚴重主動脈瓣反流可顯著影響患者的心功能和生活質量而需進行治療[1]。外科主動脈瓣置換術是治療大動脈炎并主動脈瓣反流的重要治療方法[2],但術后瓣膜脫落、瓣周漏和吻合口動脈瘤等并發癥發生率高達20%~30%[3-5]。近年來,經導管主動脈瓣植入術已成為高齡、中高危主動脈瓣疾病的主要手術方式,本文報道一例采用經心尖途徑經導管主動脈瓣植入術治療大動脈炎合并主動脈瓣關閉不全的高危患者。
臨床資料 患者,女,50歲,因“反復心悸、乏力8年”于2024年5月6日入住云南省阜外心血管病醫院,伴活動后胸悶、氣促病史,并偶爾出現雙下肢和顏面浮腫。既往曾在外院檢查診斷為甲狀腺功能亢進癥和甲亢性心肌病,經治療后甲亢好轉。于2020年9月明確診斷為多發性大動脈炎,并至風濕免疫科接受規范治療,長期服用甲氨蝶呤,炎性指標穩定,明確處于非活動期,但患者心悸、乏力癥狀反復發作,曾多次住院,心外科評估考慮患者合并右側頸動脈彌漫性重度狹窄,未實施外科手術治療。
入院查體:患者身高158 cm,體重72 kg,顏面輕度浮腫,心律不齊,心尖部可聞及舒張期嘆氣樣雜音,雙下肢無浮腫。心電圖檢查提示心房顫動,心臟彩色超聲顯示:左心房41 mm,左心室舒張末徑56 mm,左心室射血分數(left ventricular ejection fraction,LVEF)56%,主動脈瓣大量反流,二尖瓣和三尖瓣少中量反流,估測肺動脈收縮壓49 mm Hg(1 mm Hg=0.133 kPa)。頸動脈超聲顯示頭臂干、右側鎖骨下動脈起始段及右側頸總動脈和右側頸內外動脈起始段管壁彌漫性增厚,符合大動脈炎超聲改變;右側頸總動脈及頸內動脈重度狹窄,右側鎖骨下動脈起始段狹窄,右側椎動脈纖細,部分性竊血,左側椎動脈、頸動脈阻力指數增高。冠狀動脈及全主動脈CT血管造影顯示:冠狀動脈主要節段未見狹窄;升主動脈管壁增厚、散在鈣化,管腔增粗;主動脈弓、降主動脈及腹主動脈管壁增厚、散在鈣化,管腔粗細不均,降主動脈上段輕度狹窄,降主動脈遠段及腹主動脈管腔輕度擴張;頸動脈多發管壁環形增厚,管腔多發中重度狹窄及閉塞;左鎖骨下動脈、椎動脈開口以遠、右頸內動脈C1~C4段管腔迷漫閉塞,大動脈炎可能(圖1)。頭顱磁共振成像(magnetic resonance imaging,MRI)顯示雙側大腦半球散在缺血性腦白質改變。心臟MRI顯示左心房前后徑45 mm,左心室舒張末期橫徑59 mm,LVEF 47.9%;左心室各節段厚度大致正常,未見明確水腫心肌信號;主動脈瓣葉增厚,舒張期大量反流信號,二尖瓣少中量反流信號。血液炎癥指標:紅細胞沉降率14 mm/h,C反應蛋白5 mg/L,類風濕因子、免疫球蛋白、補體C3、補體C4均在正常范圍。
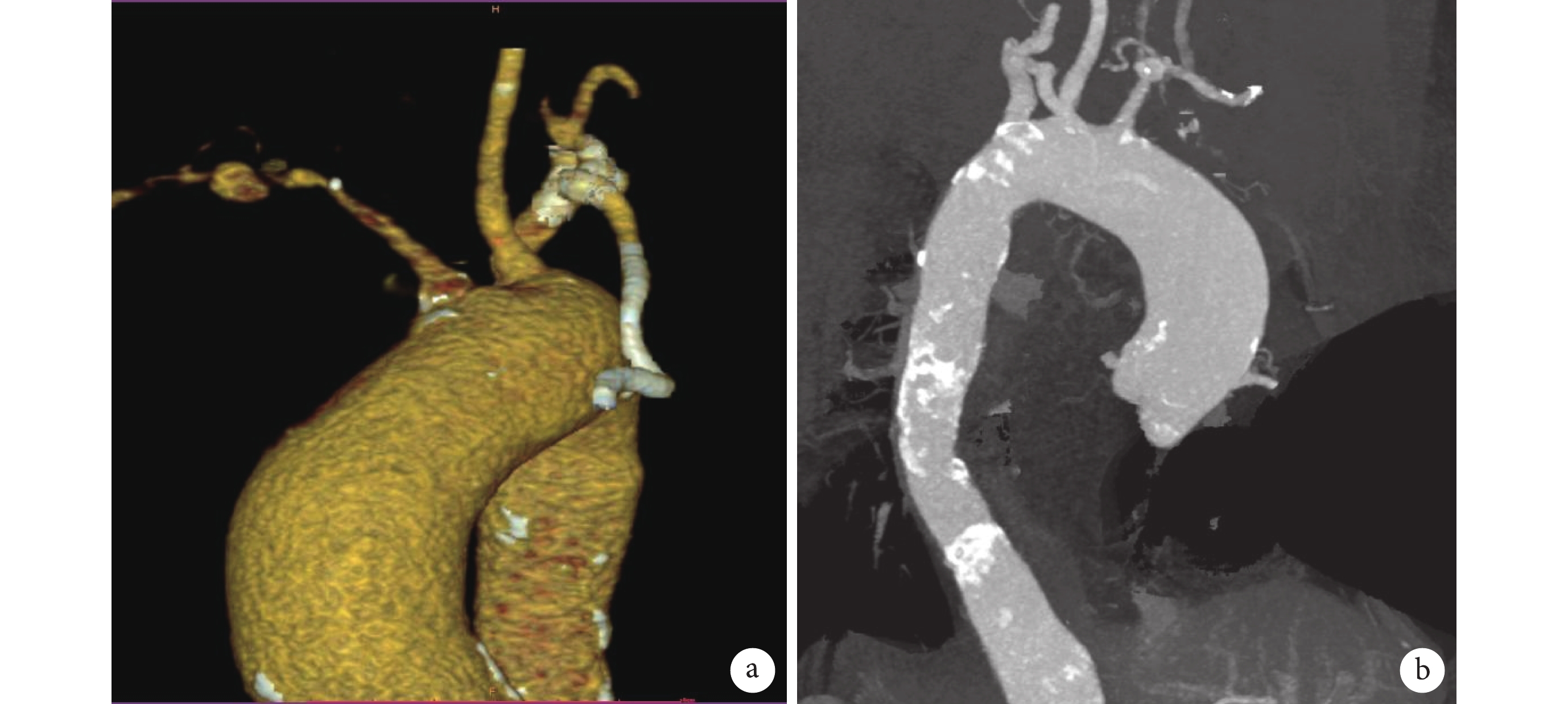
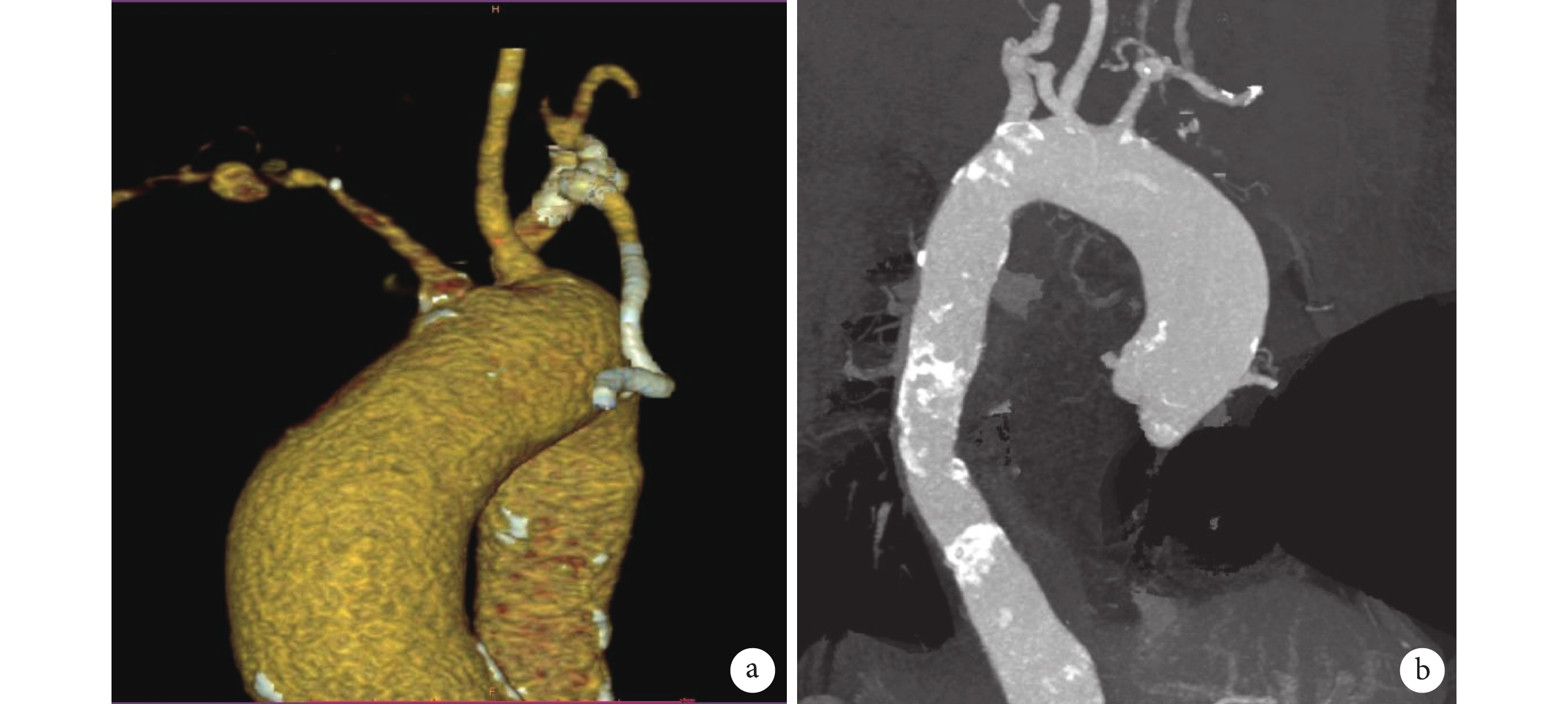 圖1
大動脈炎病變
圖1
大動脈炎病變
a:左鎖骨下動脈、椎動脈開口以遠段管腔迷漫閉塞;b:主動脈弓、降主動脈及腹主動脈管壁增厚、散在鈣化,管腔粗細不均,降主動脈上段輕度狹窄
采用3 mensio軟件評估主動脈瓣結構:瓣環面積470.5 mm2,平均瓣環徑24.5 mm,左心室流出道內徑25.3 mm,升主動脈內徑40 mm,左冠狀動脈開口高度10.2 mm,右冠狀動脈開口高度7.7 mm,左冠竇內徑33.3 mm,右冠竇內徑34.7 mm,無冠竇內徑31.7 mm。解剖結構適合經心尖途徑經導管主動脈瓣置換術,無明顯絕對手術禁忌證。
手術在雜交手術室采用全身麻醉氣管插管,經心尖小切口入路,食管超聲監測及數字減影血管造影引導下,成功植入27 mm杰成J-Valve經導管主動脈瓣膜系統(圖2),術中食管超聲提示瓣膜功能良好,主動脈瓣反流消失,術后轉監護室治療,無瓣膜移位、出血及房室傳導阻滯等并發癥,1周后康復出院,予阿司匹林腸溶片100 mg(1次/d)單抗血小板治療,術后繼續口服甲氨蝶呤維持治療大動脈炎。
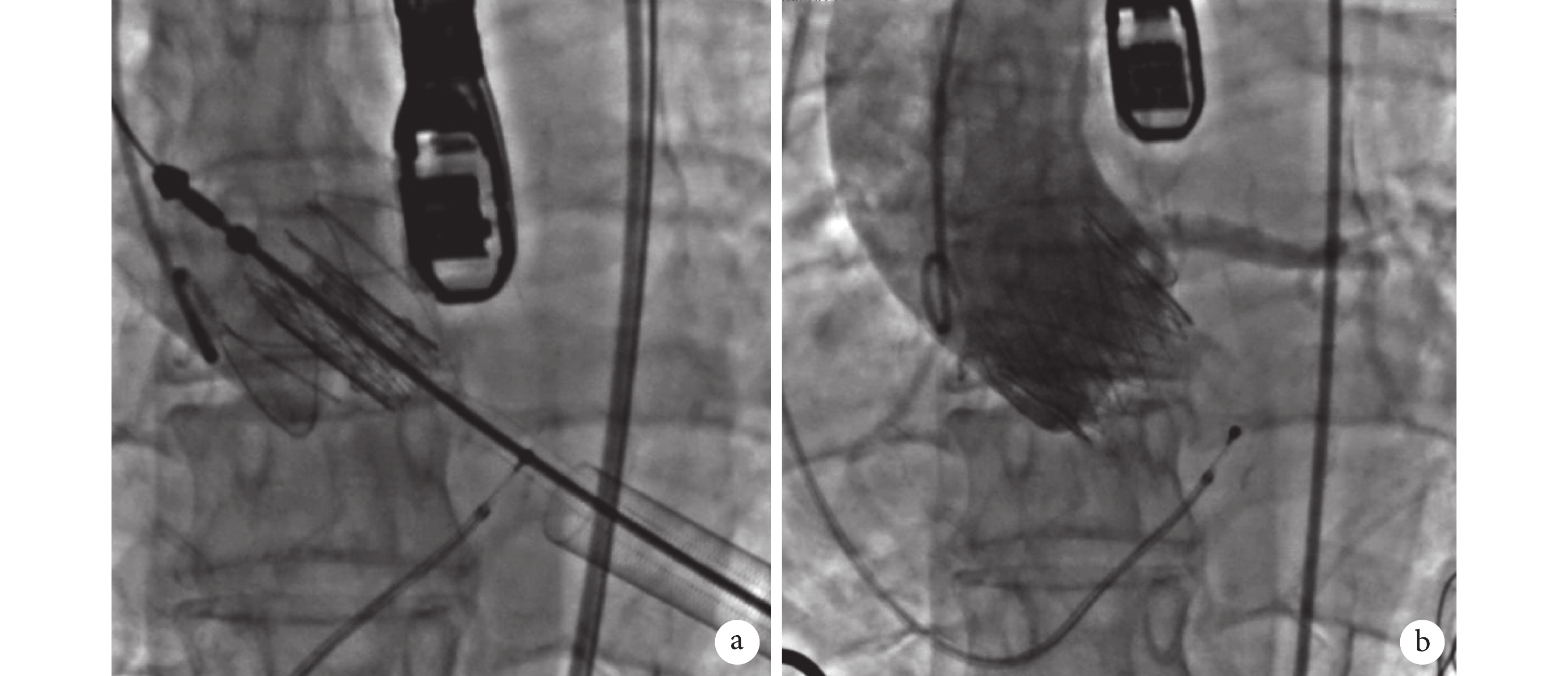
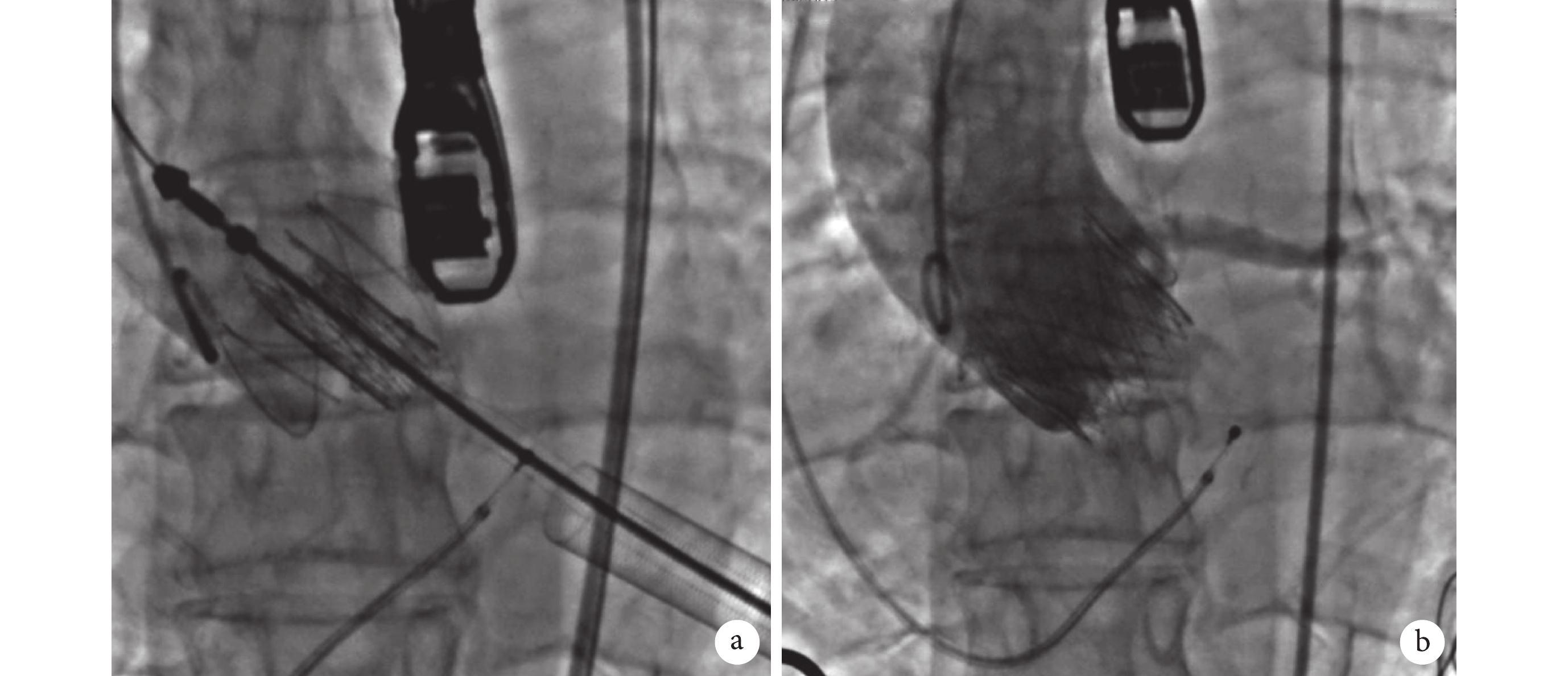 圖2
心尖入路植入27 mm杰成J-Valve經導管人工瓣膜系統
圖2
心尖入路植入27 mm杰成J-Valve經導管人工瓣膜系統
a:術中人工瓣膜定位;b:瓣膜釋放后造影示主動脈瓣反流消失
術后1周復查心臟彩色超聲顯示:左心房內徑39 mm,左心室舒張期末內徑55 mm,LVEF 49%,主動脈瓣人工瓣流速1.2 m/s,瓣周漏未見,二尖瓣和三尖瓣少量反流,估測肺動脈收縮壓49 mm Hg。術后6個月復查,患者自覺心悸、乏力癥狀明顯改善,心臟彩色超聲顯示:左心房內徑39 mm,左心室舒張期末內徑48 mm,LVEF 60%,主動脈瓣人工瓣流速2.0 m/s,瓣周漏未見,估測肺動脈收縮壓49 mm Hg(圖3)。
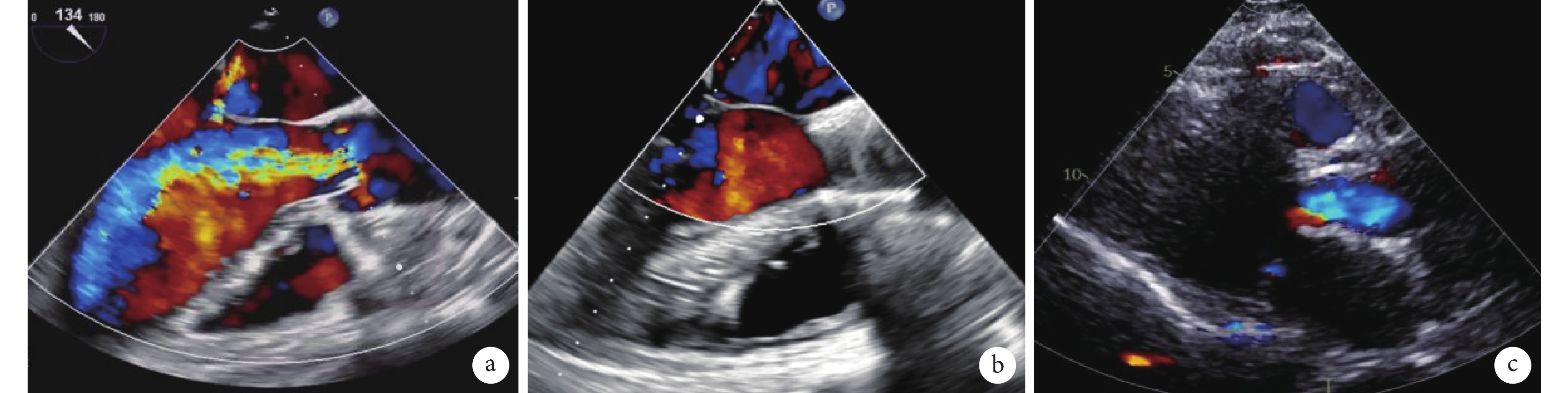
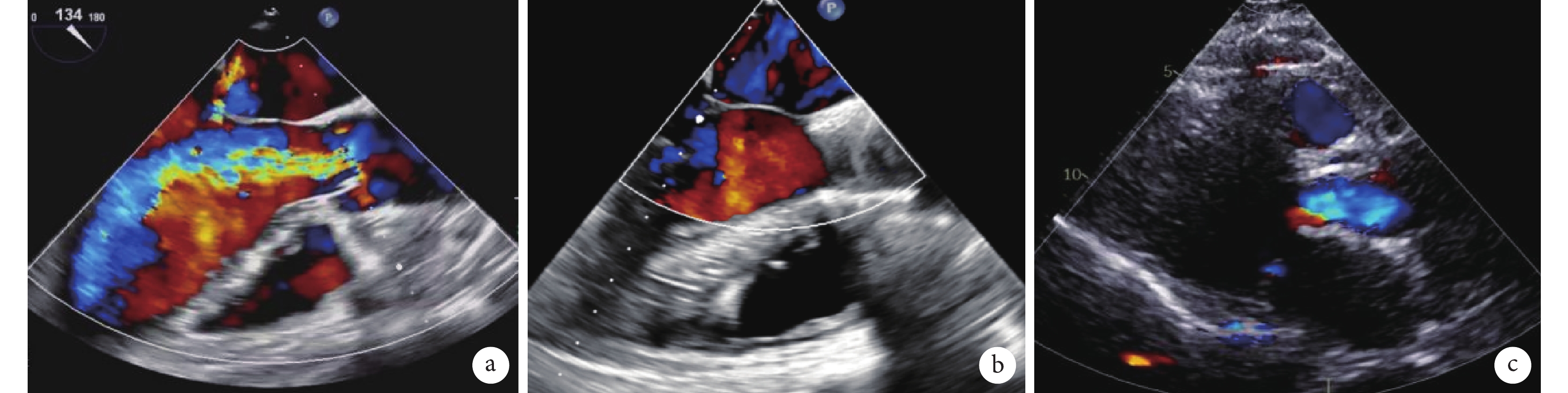 圖3
超聲檢查主動脈瓣反流情況
圖3
超聲檢查主動脈瓣反流情況
a:食管超聲示術前主動脈瓣大量反流;b:食管超聲示瓣膜植入后主動脈瓣反流消失;c:術后復查經胸超聲心動圖,胸骨旁長軸切面彩色多普勒血流示主動脈瓣功能良好
討論 大動脈炎合并主動脈瓣反流患者在保守治療下的遠期預后不佳,而外科瓣膜置換手術則可以改善患者預后。然而,外科術后瓣周漏和吻合口動脈瘤等并發癥發生率較高[6]。對于本例合并右側頸動脈和椎動脈重度狹窄的患者,神經系統并發癥也不可忽視。為避免上述嚴重且可能致命的并發癥,關鍵在于在主動脈瓣環或血管壁上不進行任何操作。J-Valve系統是一種創新設計的經心尖經導管心臟瓣膜,配備了3個定位鍵,可幫助精確定位人工瓣膜,并防止其向左心室流出道移位。此外,該系統將天然主動脈瓣夾在定位鍵和瓣架之間,無需在主動脈瓣環或血管壁上進行縫合,從而降低了手術相關的并發癥風險[7-8]。
目前,手術治療的預后被認為與非特異性炎癥反應密切相關,活動性炎癥可能增加手術并發癥的發生風險[4]。雖然經心尖主動脈瓣置換無需切開和縫合主動脈及瓣環,但由于人工瓣架與瓣環緊密貼合,而且術中有較大的心尖穿刺點,所以術前仍需進行詳細的病情評估。確保在手術前進行規范治療并有效控制大動脈炎的活動,可減少手術相關并發癥的發生[9]。因此,該患者在術前接受了規范的藥物治療以控制動脈炎,并達到臨床穩定狀態。復查結果顯示,C反應蛋白、血沉和炎癥因子均處于正常范圍內,進一步通過MRI檢查確認無活動性炎癥和心肌水腫。其次,術后仍需繼續進行規范的藥物治療,以控制非特異性炎癥反應,從而減少術后并發癥風險[4,10]。此外,術后管理應包括心血管專科和風濕免疫科的聯合隨訪、監測炎癥反應指標、評估手術效果和患者的恢復情況。根據患者的具體情況制定個體化的藥物治療方案,以實現最佳的治療效果。
本病例的治療結果提示,經導管主動脈瓣置換治療主動脈瓣反流合并大動脈炎可行且有效。該手術方式為治療此類患者提供了一種新的選擇。綜合來看,術前詳細評估和規范治療,術中精準操作,以及術后多學科聯合隨訪和個體化治療,是確保手術成功和改善患者預后的關鍵因素。
利益沖突:無。
作者貢獻:高建斌負責數據收集,論文撰寫;李健負責患者超聲檢查;楊于、馬米爾負責患者管理、隨訪;楊鎧瑞、羅薇負責數據收集,文獻檢索;朱達、王寧參與資料收集;潘湘斌負責手術;歐陽文斌負責手術,論文審閱與修改。
大動脈炎是一種慢性非特異性炎癥性疾病,主要累及主動脈及其主要分支和肺動脈,引起不同部位動脈狹窄、閉塞甚至動脈瘤。約2.2%~20%的患者因炎癥波及主動脈瓣,導致主動脈瓣狹窄或關閉不全。嚴重主動脈瓣反流可顯著影響患者的心功能和生活質量而需進行治療[1]。外科主動脈瓣置換術是治療大動脈炎并主動脈瓣反流的重要治療方法[2],但術后瓣膜脫落、瓣周漏和吻合口動脈瘤等并發癥發生率高達20%~30%[3-5]。近年來,經導管主動脈瓣植入術已成為高齡、中高危主動脈瓣疾病的主要手術方式,本文報道一例采用經心尖途徑經導管主動脈瓣植入術治療大動脈炎合并主動脈瓣關閉不全的高危患者。
臨床資料 患者,女,50歲,因“反復心悸、乏力8年”于2024年5月6日入住云南省阜外心血管病醫院,伴活動后胸悶、氣促病史,并偶爾出現雙下肢和顏面浮腫。既往曾在外院檢查診斷為甲狀腺功能亢進癥和甲亢性心肌病,經治療后甲亢好轉。于2020年9月明確診斷為多發性大動脈炎,并至風濕免疫科接受規范治療,長期服用甲氨蝶呤,炎性指標穩定,明確處于非活動期,但患者心悸、乏力癥狀反復發作,曾多次住院,心外科評估考慮患者合并右側頸動脈彌漫性重度狹窄,未實施外科手術治療。
入院查體:患者身高158 cm,體重72 kg,顏面輕度浮腫,心律不齊,心尖部可聞及舒張期嘆氣樣雜音,雙下肢無浮腫。心電圖檢查提示心房顫動,心臟彩色超聲顯示:左心房41 mm,左心室舒張末徑56 mm,左心室射血分數(left ventricular ejection fraction,LVEF)56%,主動脈瓣大量反流,二尖瓣和三尖瓣少中量反流,估測肺動脈收縮壓49 mm Hg(1 mm Hg=0.133 kPa)。頸動脈超聲顯示頭臂干、右側鎖骨下動脈起始段及右側頸總動脈和右側頸內外動脈起始段管壁彌漫性增厚,符合大動脈炎超聲改變;右側頸總動脈及頸內動脈重度狹窄,右側鎖骨下動脈起始段狹窄,右側椎動脈纖細,部分性竊血,左側椎動脈、頸動脈阻力指數增高。冠狀動脈及全主動脈CT血管造影顯示:冠狀動脈主要節段未見狹窄;升主動脈管壁增厚、散在鈣化,管腔增粗;主動脈弓、降主動脈及腹主動脈管壁增厚、散在鈣化,管腔粗細不均,降主動脈上段輕度狹窄,降主動脈遠段及腹主動脈管腔輕度擴張;頸動脈多發管壁環形增厚,管腔多發中重度狹窄及閉塞;左鎖骨下動脈、椎動脈開口以遠、右頸內動脈C1~C4段管腔迷漫閉塞,大動脈炎可能(圖1)。頭顱磁共振成像(magnetic resonance imaging,MRI)顯示雙側大腦半球散在缺血性腦白質改變。心臟MRI顯示左心房前后徑45 mm,左心室舒張末期橫徑59 mm,LVEF 47.9%;左心室各節段厚度大致正常,未見明確水腫心肌信號;主動脈瓣葉增厚,舒張期大量反流信號,二尖瓣少中量反流信號。血液炎癥指標:紅細胞沉降率14 mm/h,C反應蛋白5 mg/L,類風濕因子、免疫球蛋白、補體C3、補體C4均在正常范圍。
 圖1
大動脈炎病變
圖1
大動脈炎病變
a:左鎖骨下動脈、椎動脈開口以遠段管腔迷漫閉塞;b:主動脈弓、降主動脈及腹主動脈管壁增厚、散在鈣化,管腔粗細不均,降主動脈上段輕度狹窄
采用3 mensio軟件評估主動脈瓣結構:瓣環面積470.5 mm2,平均瓣環徑24.5 mm,左心室流出道內徑25.3 mm,升主動脈內徑40 mm,左冠狀動脈開口高度10.2 mm,右冠狀動脈開口高度7.7 mm,左冠竇內徑33.3 mm,右冠竇內徑34.7 mm,無冠竇內徑31.7 mm。解剖結構適合經心尖途徑經導管主動脈瓣置換術,無明顯絕對手術禁忌證。
手術在雜交手術室采用全身麻醉氣管插管,經心尖小切口入路,食管超聲監測及數字減影血管造影引導下,成功植入27 mm杰成J-Valve經導管主動脈瓣膜系統(圖2),術中食管超聲提示瓣膜功能良好,主動脈瓣反流消失,術后轉監護室治療,無瓣膜移位、出血及房室傳導阻滯等并發癥,1周后康復出院,予阿司匹林腸溶片100 mg(1次/d)單抗血小板治療,術后繼續口服甲氨蝶呤維持治療大動脈炎。
 圖2
心尖入路植入27 mm杰成J-Valve經導管人工瓣膜系統
圖2
心尖入路植入27 mm杰成J-Valve經導管人工瓣膜系統
a:術中人工瓣膜定位;b:瓣膜釋放后造影示主動脈瓣反流消失
術后1周復查心臟彩色超聲顯示:左心房內徑39 mm,左心室舒張期末內徑55 mm,LVEF 49%,主動脈瓣人工瓣流速1.2 m/s,瓣周漏未見,二尖瓣和三尖瓣少量反流,估測肺動脈收縮壓49 mm Hg。術后6個月復查,患者自覺心悸、乏力癥狀明顯改善,心臟彩色超聲顯示:左心房內徑39 mm,左心室舒張期末內徑48 mm,LVEF 60%,主動脈瓣人工瓣流速2.0 m/s,瓣周漏未見,估測肺動脈收縮壓49 mm Hg(圖3)。
 圖3
超聲檢查主動脈瓣反流情況
圖3
超聲檢查主動脈瓣反流情況
a:食管超聲示術前主動脈瓣大量反流;b:食管超聲示瓣膜植入后主動脈瓣反流消失;c:術后復查經胸超聲心動圖,胸骨旁長軸切面彩色多普勒血流示主動脈瓣功能良好
討論 大動脈炎合并主動脈瓣反流患者在保守治療下的遠期預后不佳,而外科瓣膜置換手術則可以改善患者預后。然而,外科術后瓣周漏和吻合口動脈瘤等并發癥發生率較高[6]。對于本例合并右側頸動脈和椎動脈重度狹窄的患者,神經系統并發癥也不可忽視。為避免上述嚴重且可能致命的并發癥,關鍵在于在主動脈瓣環或血管壁上不進行任何操作。J-Valve系統是一種創新設計的經心尖經導管心臟瓣膜,配備了3個定位鍵,可幫助精確定位人工瓣膜,并防止其向左心室流出道移位。此外,該系統將天然主動脈瓣夾在定位鍵和瓣架之間,無需在主動脈瓣環或血管壁上進行縫合,從而降低了手術相關的并發癥風險[7-8]。
目前,手術治療的預后被認為與非特異性炎癥反應密切相關,活動性炎癥可能增加手術并發癥的發生風險[4]。雖然經心尖主動脈瓣置換無需切開和縫合主動脈及瓣環,但由于人工瓣架與瓣環緊密貼合,而且術中有較大的心尖穿刺點,所以術前仍需進行詳細的病情評估。確保在手術前進行規范治療并有效控制大動脈炎的活動,可減少手術相關并發癥的發生[9]。因此,該患者在術前接受了規范的藥物治療以控制動脈炎,并達到臨床穩定狀態。復查結果顯示,C反應蛋白、血沉和炎癥因子均處于正常范圍內,進一步通過MRI檢查確認無活動性炎癥和心肌水腫。其次,術后仍需繼續進行規范的藥物治療,以控制非特異性炎癥反應,從而減少術后并發癥風險[4,10]。此外,術后管理應包括心血管專科和風濕免疫科的聯合隨訪、監測炎癥反應指標、評估手術效果和患者的恢復情況。根據患者的具體情況制定個體化的藥物治療方案,以實現最佳的治療效果。
本病例的治療結果提示,經導管主動脈瓣置換治療主動脈瓣反流合并大動脈炎可行且有效。該手術方式為治療此類患者提供了一種新的選擇。綜合來看,術前詳細評估和規范治療,術中精準操作,以及術后多學科聯合隨訪和個體化治療,是確保手術成功和改善患者預后的關鍵因素。
利益沖突:無。
作者貢獻:高建斌負責數據收集,論文撰寫;李健負責患者超聲檢查;楊于、馬米爾負責患者管理、隨訪;楊鎧瑞、羅薇負責數據收集,文獻檢索;朱達、王寧參與資料收集;潘湘斌負責手術;歐陽文斌負責手術,論文審閱與修改。