近年來,世界范圍內外周動脈和主動脈疾病發病率逐年上升,導致整體人群的心血管死亡率和發病率升高。既往,外周動脈和主動脈疾病相較冠狀動脈疾病往往容易漏診以及延誤治療。《2024歐洲心臟病學會外周動脈和主動脈疾病管理指南》首次將外周動脈和主動脈疾病合并在一起,整合并且更新了2017年外周動脈疾病和2014年主動脈疾病指南,旨在為全身動脈疾病管理提供標準化的建議,確保患者可以接受連貫、綜合的診斷和治療,從而改善預后。本文對該指南主要內容進行解讀,以期為我國現階段的外周動脈和主動脈疾病臨床診療工作提供參考和幫助。
在全球范圍內約有1.13億40歲以上人群受到外周動脈疾病(peripheral arterial disease,PAD)的影響。全球患病率約為1.52%,國內北京地區35歲以上人群發病率為3.84%[1],且隨著年齡的增長而逐漸增加(80~84歲人群患病率為14.91%),女性高于男性(18.03% vs. 10.56%)[2-3]。1990—2019年PAD患病率上升了72%,其中約有7 719萬人罹患與頸動脈狹窄相關的缺血性腦疾病,而包括動脈瘤和夾層在內的主動脈疾病在老年人群中患病率高達10%,約有17.2萬例與主動脈瘤相關的死亡事件發生[4]。鑒于PAD逐年增高的患病率和死亡風險,歐洲心臟病學會首次將外周動脈疾病和主動脈疾病指南聯合發布,強調兩者之間的密切關系,這一整合將確保患者接受整體且連貫的疾病管理,減少碎片化治療,改善整體預后。本文將參照指南[5]原文內容,對主要內容進行解讀。推薦等級為Ⅰ表示強推薦,Ⅱa表示中推薦,Ⅱb表示弱推薦,Ⅲ表示不推薦。A級證據表示數據來源于多個隨機臨床試驗或Meta分析,B級證據表示數據來源于單個隨機臨床試驗或大型非隨機研究,C級證據表示數據來源于專家共識、小型研究、回顧性研究。
1 外周動脈和主動脈疾病評估和生活方式干預
外周動脈和主動脈疾病(peripheral arterial and aortic diseases,PAAD)的診斷要充分結合患者的臨床癥狀、病史、家族史和詳細的體格檢查。所有患者在入院后均應該進行全身詳盡的評估,包括外周血管脈搏的觸診以及聽診。詳細的檢查不僅可以幫助診斷,還可以幫助了解預后。頸動脈有雜音的患者,心血管死亡的風險增加1倍,雙上肢壓差超過15 mm Hg(1 mmHg=0.133 kPa)則心血管死亡風險增加50%[5]。
踝肱指數(ankle-brachial index,ABI)在外周動脈的診斷中使用十分廣泛,靜息ABI對PAD診斷的敏感性為68%~84%,特異性為84%~99%。ABI≤0.90可以確診PAD,ABI>1.40則多考慮動脈硬化,此時應警惕相關心血管事件[6-7]。對于ABI>1.40的患者,如有條件建議進一步完善趾臂指數(toe-brachial index,TBI)[8]。推薦將超聲作為PAD篩查和診斷的首選影像檢查,計算機斷層血管造影(computed tomography angiography,CTA)可以進一步評估手術指征和方案。
主動脈疾病的評估應首選經胸心臟超聲(Ⅰ/B),同時推薦對年齡﹥65歲且既往有吸煙史的患者建議行腹主動脈瘤的超聲篩查[9]。股腘動脈瘤在腹主動脈瘤患者中發病率很高,所以對于已經診斷腹主動脈瘤的患者,應考慮超聲篩查股腘動脈瘤(Ⅱ/C)[10] 。
2 外周動脈疾病
2.1 下肢動脈疾病
下肢動脈粥樣硬化性外周血管疾病是一種具有多種臨床表現的慢性疾病,可能有癥狀或無癥狀,也可能與肢體傷口破潰相關,可以根據臨床表現對其進行分類(表1)。約有7%的患者在5年內從無癥狀進展到間歇性跛行,而5年內則有約1/5的患者從間歇性跛行進展為威脅肢體的缺血[11]。但無論是否有癥狀,所有患者均是嚴重不良心臟事件(major adverse cardiac event,MACE)和腦血管疾病的高危人群,其中有癥狀患者5年心血管死亡率可達13%[12]。
2.1.1 診斷
建議首先進行ABI的檢查,ABI>0.90但仍然懷疑PAD,則需要行影像學檢查或者測量運動后ABI,如果ABI下降>20%,也可診斷PAD[13]。同時指南建議將超聲作為PAD診斷和篩查的一線方法(Ⅰ/C),CTA和磁共振動脈成像(MRA)作為進一步檢查的常用手段(Ⅰ/C)。而對于存在威脅肢體的慢性缺血患者,還應完善數字減影血管造影(digital subtraction angiography,DSA)評估膝下血管病變,即使患者不適合進行血運重建,也應該進行DSA來評估血運情況,盡量減少截肢范圍[14]。
對于所有PAD患者,指南建議均應評估患者步行水平。可以采用WIFI量表來評估患者截肢的風險(表2)[15]。
2.1.2 治療
2.1.2.1 一般治療
指南推薦在對患者評估之后即開始監督式運動訓練(supervised exercise training,SET)[16-17]。訓練計劃應從低中強度開始,根據患者的耐受情況逐漸增加高強度運動。運動訓練可以一定程度改善步行距離,但是SET對于ABI的改善作用微乎其微。
盡管PAD患者的心血管風險很高,但一項評估抗血栓藥物對ABI≤0.95的無癥狀患者的試驗中沒有顯示出抗血栓治療對MACE或血運重建的影響[18]。另一項針對ABI≤0.99和糖尿病患者的試驗中也沒有顯示出阿司匹林對于MACE或截肢的任何影響[19]。所以對于無癥狀的PAD患者,不建議系統性接受抗血栓治療。但抗血栓治療可以改善有癥狀患者預后。阿司匹林聯合利伐沙班(2.5 mg,2 次/d)雙重抗栓治療比單獨抗血小板治療更為有效,可以減少MACE等事件的風險,但是會增加出血的風險[12, 20]。目前,指南建議對于有癥狀PAD患者使用阿司匹林或者氯吡格雷(Ⅰ/A),而對于缺血風險較高的無明顯出血風險患者則可以使用阿司匹林聯合利伐沙班進行治療(Ⅱa/A)。
2.1.2.2 血運重建治療
(1)主髂動脈病變 一項Meta分析評估了腔內手術和開放手術對于主髂病變(TASCⅡ C~D)的治療結果,腔內治療的短期并發癥和死亡率較低,但開放手術組具有更優的早期和中期一期通暢率,兩組患者的二期通暢率相當。指南建議無論是否植入支架,均可以考慮在髂外動脈進行球囊擴張,髂總動脈則可以考慮行一期支架植入術(Ⅱa/B)[21-23]。
(2)股腘動脈病變 對于需要進行血運重建的患者,無論病變復雜程度以及手術風險如何,均應首先嘗試腔內治療(Ⅱa/B)[24-25]。對于手術風險低的復雜病變患者,經血管中心討論后可以考慮行冠狀動脈旁路移植術,首選自體靜脈移植物(Ⅱa/C)[26]。
(3)膝下動脈病變 膝下病變多見于糖尿病和腎病患者,通常與股淺動脈病變相關[27],對于嚴重間歇性跛行患者,在實施股腘動脈血運重建的同時,可以考慮對膝下血管進行重建(Ⅱb/C)[28-29]。值得注意的是截至目前,藥物洗脫球囊和裸支架沒有顯示出優于普通球囊的治療效果[30]。
2.2 顱外頸動脈及椎動脈疾病
2.2.1 診斷
頸動脈超聲是篩查、診斷和監測頸動脈病變的首選影像學檢查(Ⅰ/C),而狹窄程度的評估建議采用北美癥狀性頸內動脈內膜剝脫試驗法(North American symptomatic carotid endarterectomy,NASCET)法(Ⅰ/B),即狹窄段直徑與頸內動脈遠端之比[15]。
2.2.2 治療
2.2.2.1 藥物治療
抗血栓治療在無癥狀頸動脈狹窄中的益處尚未得到證實。但是有癥狀患者的腦缺血事件風險較高,因此,建議有癥狀患者口服低劑量阿司匹林和氯吡格雷雙聯抗血小板治療至少3個月[31]。在接受內膜剝脫血運重建后可以停止口服氯吡格雷,接受腔內血運重建后則繼續雙聯抗血小板治療4周[32-33]。
2.2.2.2 血運重建
頸動脈內膜剝脫術(carotid endarterectomy,CEA)并不能減少有癥狀輕度狹窄(狹窄<50%)患者的卒中事件,但可以降低中度(50%~69%)和重度(70%~99%)狹窄患者的卒中風險[34-35]。研究[36-37]表明輕微卒中后1周內進行CEA較為安全,但是由于出血轉化的風險,卒中發作后48 h內行CEA的安全性目前仍有爭議。相較于頸動脈支架植入術(carotid artery stenting,CAS)來說,CEA在術后30 d內的卒中和死亡風險較低,且隨著年齡增大,CAS的相關風險也隨之增加,年齡>70歲患者,CEA優于CAS;而對于年齡>80歲患者,CAS卒中或死亡的風險則高4倍[38-39]。所以CEA仍然是有癥狀患者的首選手術方式,可以在患者出現癥狀的14 d內進行CEA手術(Ⅰ/B),而在并發癥<6%的血管中心,開放手術高風險的患者可以選擇CAS(Ⅱa/B)。
2.3 鎖骨下動脈疾病
鎖骨下動脈缺血通常無特殊癥狀,部分患者因上臂血壓差>10~15 mm Hg而進一步體檢得以確診[40]。上肢運動期間出現的眩暈、視覺障礙等都可能提示鎖骨下動脈狹窄,如果出現盜血綜合征則癥狀可能更加典型。對于有癥狀的鎖骨下動脈缺血患者,經血管中心充分討論后可以考慮進行血運重建(Ⅱa/B)[41]。如果患者需要同側乳內動脈搭橋、同側透析通路或者雙上肢均有重度狹窄或閉塞等情況則應考慮進行血運重建(Ⅱa/C)[42]。血運重建大多選擇腔內治療,但在合適的患者中,頸動脈-鎖骨下動脈轉位(5年通暢率96%)及頸動脈-鎖骨下動脈搭橋(5年通暢率97%)長期通暢率[43- 44]也良好。
2.4 腎動脈疾病
腎動脈狹窄約有90%以上由動脈粥樣硬化引起,大多會累及腎動脈起始部[45]。 由動脈粥樣硬化引起的腎動脈狹窄可使用低劑量阿司匹林治療(Ⅱb/C)。在充分的藥物治療后,重度狹窄且尚存殘余腎功能的高危患者應考慮血運重建(Ⅱa/B)[46],首選腔內治療,但在解剖結構復雜或血管內修復失敗的情況下,開放手術也可作為一種替代方法。
2.5 腸系膜動脈疾病
腸系膜動脈缺血可分為急性和慢性缺血。急性腸系膜缺血癥狀較為明顯,患者可有劇烈腹痛,同時合并嘔吐、腹瀉等表現。經CTA確診的急性缺血患者建議立即治療,首選腔內技術(Ⅰ/B);而對于慢性缺血患者,一般不建議進行血運重建治療,除非患者有明確的難以用其他原因解釋的包括餐后腹痛、體重減輕和腹瀉或便秘等腹部癥狀[47]。
3 主動脈疾病
3.1 主動脈瘤
當主動脈直徑大于平均直徑的兩個標準差時稱為主動脈擴張,而當主動脈直徑繼續增大至正常直徑的1.5倍時則定義為主動脈瘤。囊性動脈瘤大多與感染、主動脈穿透性潰瘍、創傷或者炎性疾病有關,而梭形動脈瘤則與主動脈退行性改變和結締組織病更相關,目前一般認為囊性動脈瘤更危險。當在任何部位發現動脈瘤之后均應該評估全身動脈(Ⅰ/C)。
3.1.1 胸主動脈瘤
胸主動脈瘤包括主動脈根部瘤、升主動脈瘤和主動脈弓部瘤。患者通常可無明確的自覺癥狀,多在篩查中偶然發現,部分患者可能會伴隨主動脈瓣相關的癥狀。瘤體的生長速度是非線性的,與病因、位置和主動脈基線直徑相關。當主動脈直徑達到57.5 mm時,年死亡率可高達10.8%[48]。
3.1.1.1 主動脈根部和升主動脈瘤的治療
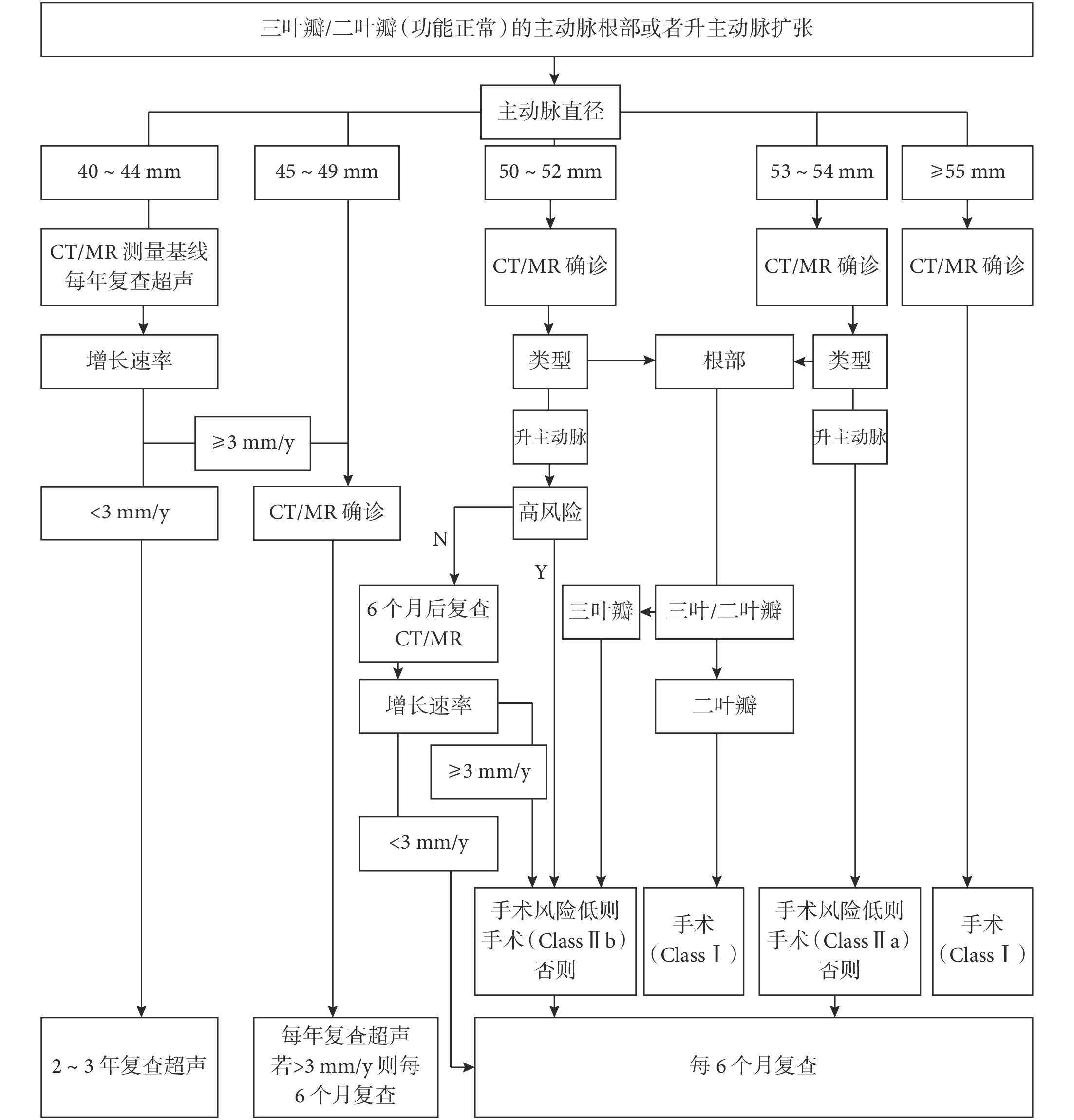
主動脈直徑是主動脈并發癥和死亡的主要決定因素,對于主動脈瓣膜功能正常的患者(圖1),建議在動脈瘤直徑≥55 mm時進行手術治療(Ⅰ/B),在經驗豐富的血管中心,擇期手術的死亡率可以控制在1%以下[49],在這些中心盡量考慮對患者實施保留主動脈瓣的主動脈根部置換術(Ⅰ/B)。
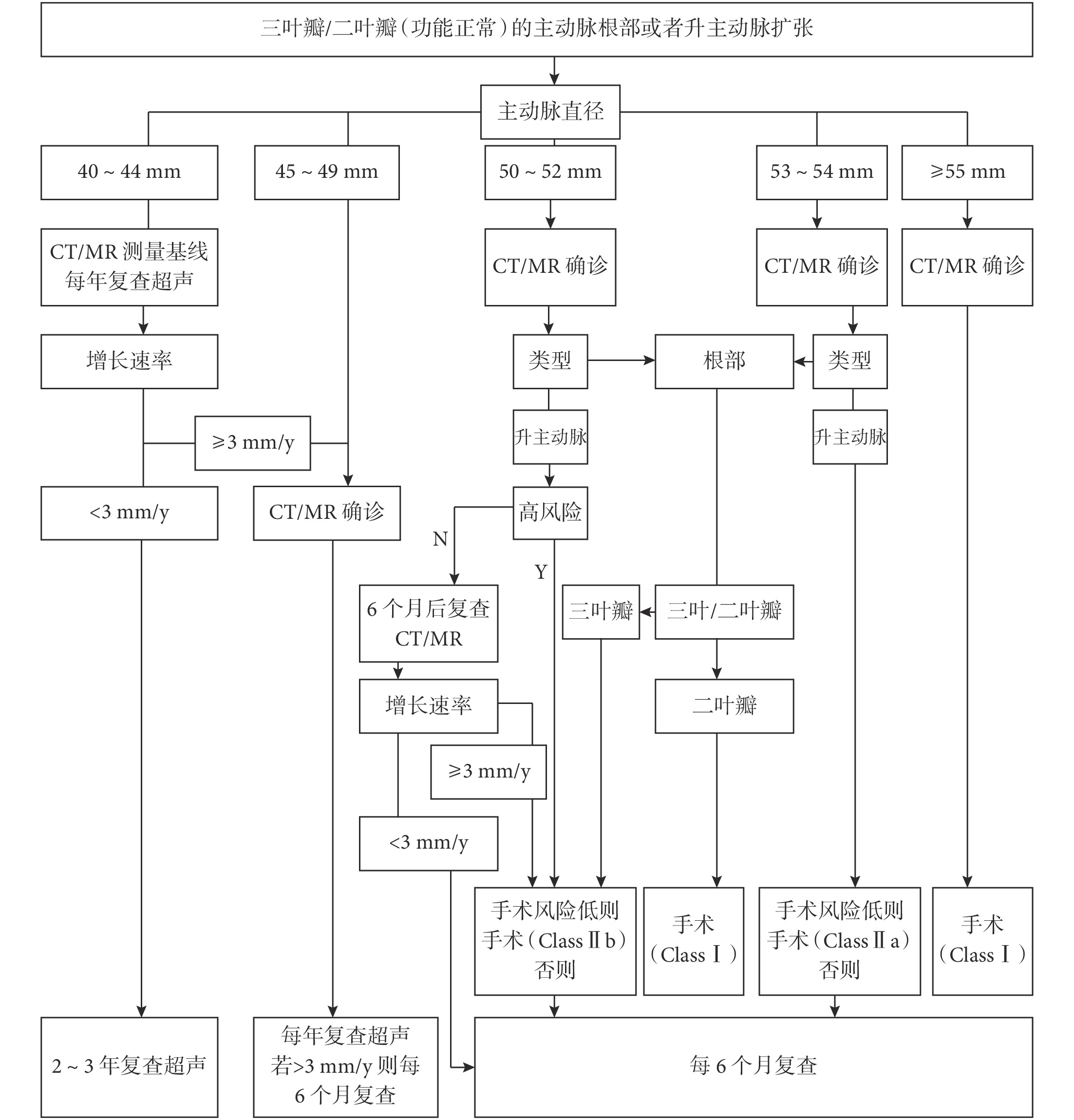 圖1
主動脈根部瘤或升主動脈瘤患者的隨訪策略[15]
圖1
主動脈根部瘤或升主動脈瘤患者的隨訪策略[15]
3.1.1.2 主動脈弓動脈瘤的治療
由于停循環和腦保護等風險,主動脈弓動脈瘤手術死亡率和卒中風險較主動脈根部手術高,所以在術前建議聯合神經科對顱內Willis環進行評估[50]。對于弓部直徑≥55 mm的低風險患者可以考慮行弓部置換(Ⅱa/B),而當病變累及遠端時,可以考慮術中行象鼻支架植入(Ⅱa/C)。對于存在手術指征的升主動脈瘤患者,如果近端弓部直徑>50 mm,則可以考慮同期進行半弓置換(Ⅱa/C)。
3.1.2 降主動脈和胸腹主動脈瘤
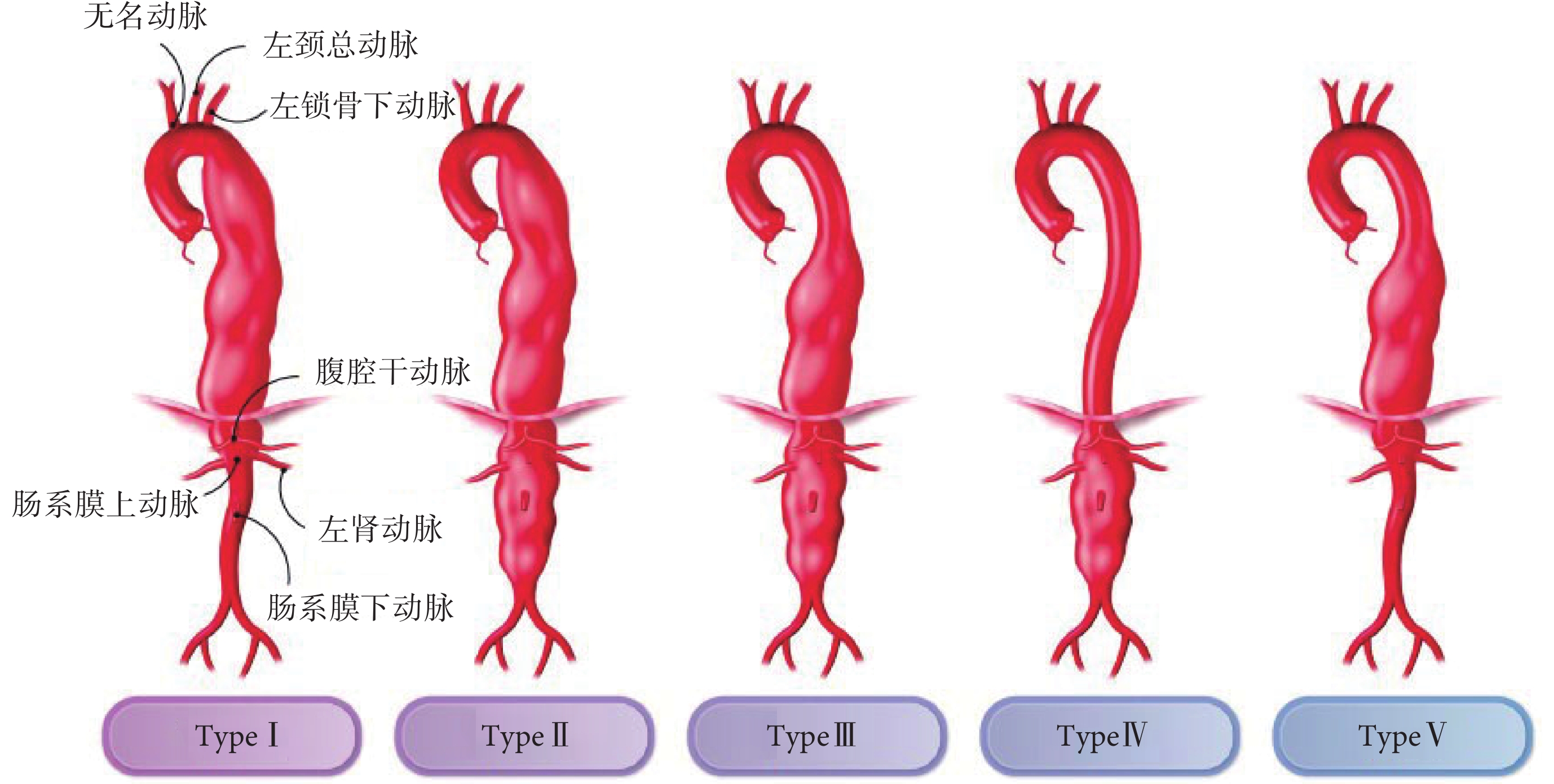
根據動脈瘤的累及范圍,降主動脈和胸腹主動脈瘤可以分為5型(圖2)[15],血管外科醫師可根據分型預測手術的難度,選擇合適的術式,制定手術計劃。胸腹主動脈瘤患者診斷的平均年齡為59~69歲,男性患者患病率是女性患者的2~4倍。胸腹主動脈瘤平均年增長1.9~3.4 mm,但當直徑超過50 mm時,增長速度則會顯著增加[51]。
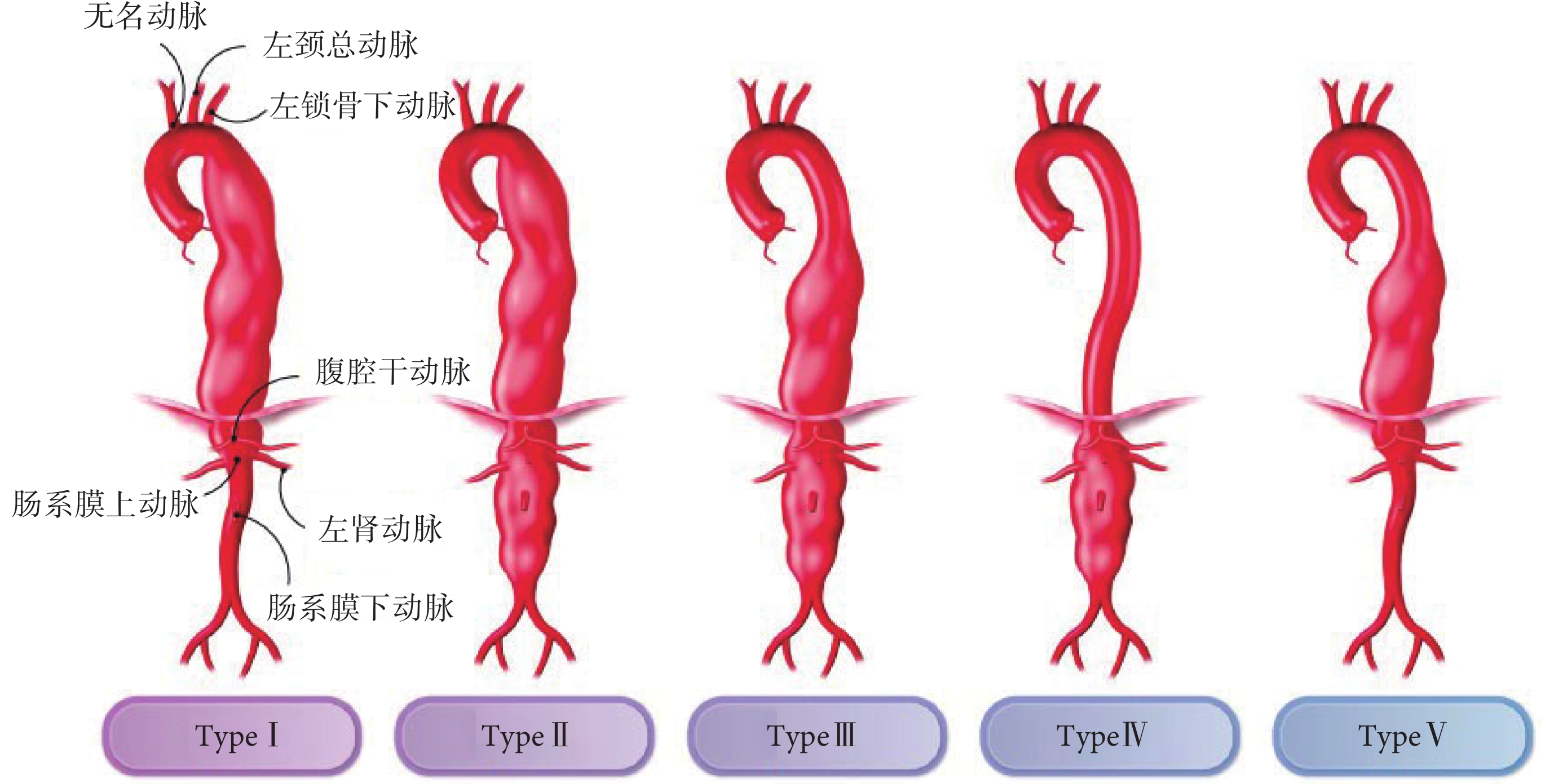 圖2
胸腹主動脈瘤分型[15]
圖2
胸腹主動脈瘤分型[15]
3.1.2.1 降主動脈瘤的治療
一般認為當直徑>60 mm時,降主動脈瘤的年破裂風險為10%,在降主動脈直徑≥55 mm時即有干預指征,直徑<55 mm時干預則獲益相對較小。對于需要手術干預的患者,腔內治療的優先級高于開放手術。開放手術僅限于年輕、健康、預期壽命長且無法行腔內修復的患者[52]。TEVAR術中盡可能對左鎖骨下動脈進行保留或者重建,從而盡可能減少脊髓缺血和腦血管相關事件。
3.1.2.2 胸腹主動脈瘤的治療
胸腹主動脈瘤的治療難度較大,對于中低風險患者,可考慮在動脈瘤直徑≥60 mm時進行手術治療。如果患者具有高風險特征或者手術風險較小時,則可以考慮在瘤體直徑≥55 mm時在有經驗的中心進行治療。開放手術難度高,腔內治療則是一種具有前景的替代方案。Meta分析顯示,接受腔內治療患者30 d死亡率顯著降低,2~3年隨訪的全因死亡率、動脈瘤相關死亡率與開放手術組差異無統計學意義,但其再干預率明顯增高,且移植物相關并發癥發生率較高[53-54]。
3.1.3 腹主動脈瘤
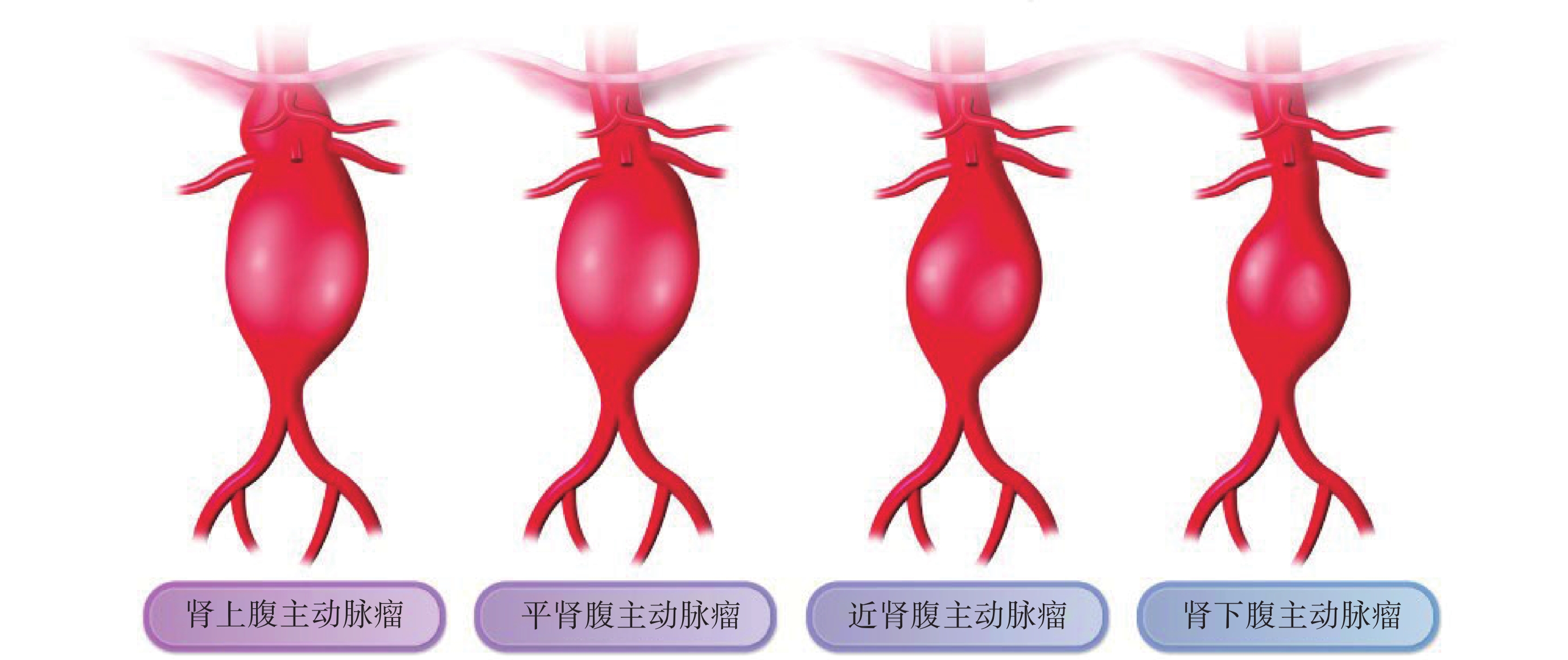
大多數腹主動脈瘤成梭形,通常根據其與腎動脈的關系進行分類(圖3),男性患者顯著多于女性患者,2/3的患者可沒有任何癥狀,出現癥狀時往往已經發生破裂,此時癥狀多表現為腹痛,還可能會出現休克表現[55]。
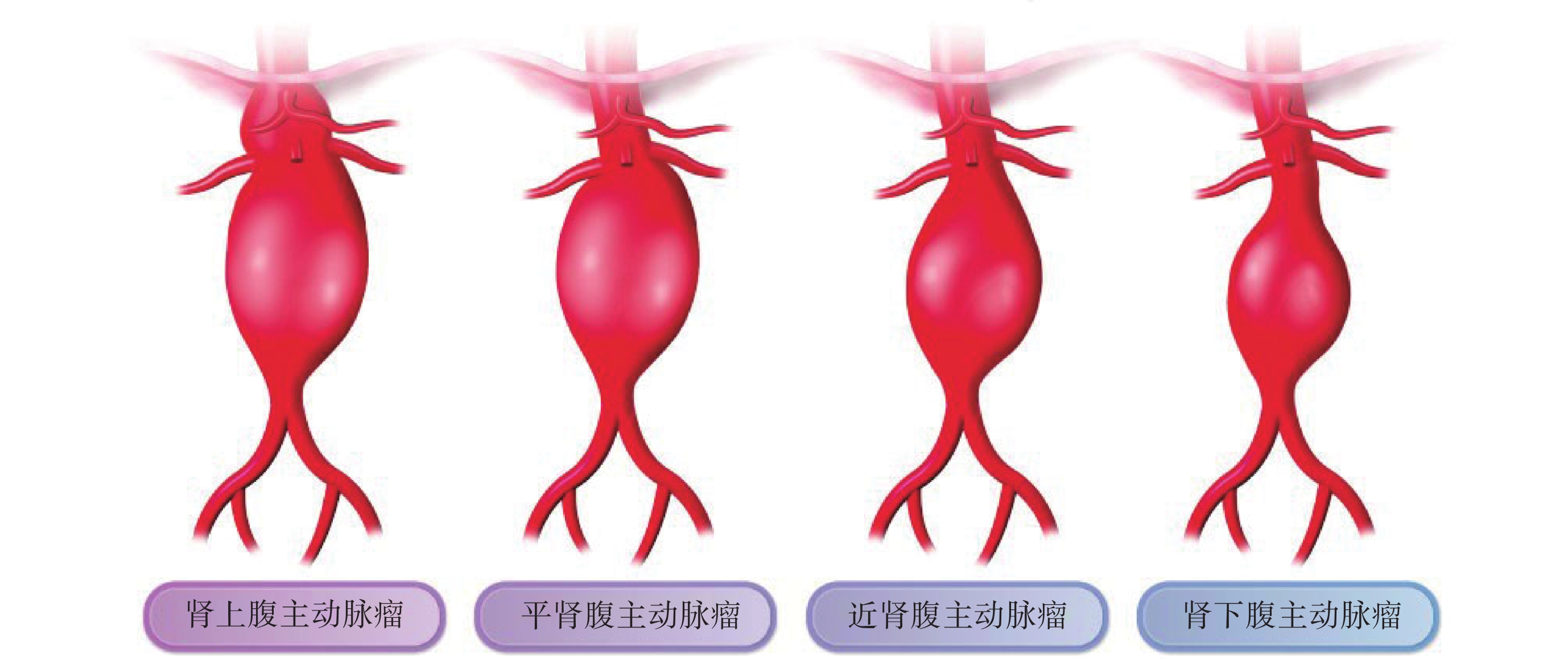 圖3
腹主動脈瘤分類[15]
圖3
腹主動脈瘤分類[15]
一般來說腹主動脈瘤的生長率約為每年3 mm,隨著直徑增大,破裂風險呈指數級上升,女性風險大于男性[56],對于半年內增長5 mm或者一年內增長10 mm以上的患者可以考慮提前進行手術干預。相對穩定腹主動脈瘤的手術指征仍為男性瘤體直徑≥55 mm,女性瘤體直徑≥50 mm,由于中西人群的整體體型以及主動脈基線直徑差異原因,國內對于腹主動脈瘤的干預指征進行了適當放寬[57]。腹主動脈瘤修復早期死亡的主要原因來自于冠狀動脈疾病,對于所有腹主動脈瘤患者術前均應評估冠脈病變[58]。但是對于心臟癥狀穩定的患者并不建議常規在術前對冠狀動脈進行血運重建,因為無論是否行冠脈血運重建都不會降低30 d心肌梗死發生率[59]。中低手術風險患者腹主動脈瘤修復的首選策略是開放手術,但是對于破裂的腹主動脈瘤,開放手術并發癥發生率高達48%[60],因此腔內治療可能更適合解剖合適的破裂腹主動脈瘤。除此之外,對于解剖條件合適的中低手術風險患者或者開放手術風險較高的患者,可以選擇腔內治療(Ⅱa)。腔內治療可以將圍術期死亡率降至1%,同時隨著介入器械的發展,再次手術的干預風險也在降低,但是EVAR術后的患者更容易出現晚期并發癥,所以需要進行終身監測[61]。
4 急性主動脈綜合征
急性主動脈綜合征是一組致命性的主動脈病變引起的,臨床上以突發劇烈胸痛為主要表現的臨床綜合征?,主要包括主動脈夾層、主動脈壁血腫、主動脈穿透性潰瘍、主動脈假性動脈瘤以及創傷性主動脈損傷。
早期診斷對于管理急性主動脈綜合征極為重要,對于疑似急性主動脈綜合征患者,建議完善全主動脈CT(Ⅰ/C),對于無法完善全主動脈CT的患者,建議經食管超聲評估以指導圍術期管理(Ⅰ/C)。對于確診急性主動脈綜合征患者,需要將收縮壓控制在120 mm Hg以下,心率控制在60次/分以下,通過降低主動脈壁的應力從而避免夾層進一步擴大。但是為了降低腦和脊髓的缺血風險,需要適當維持平均壓。
4.1 A型主動脈夾層
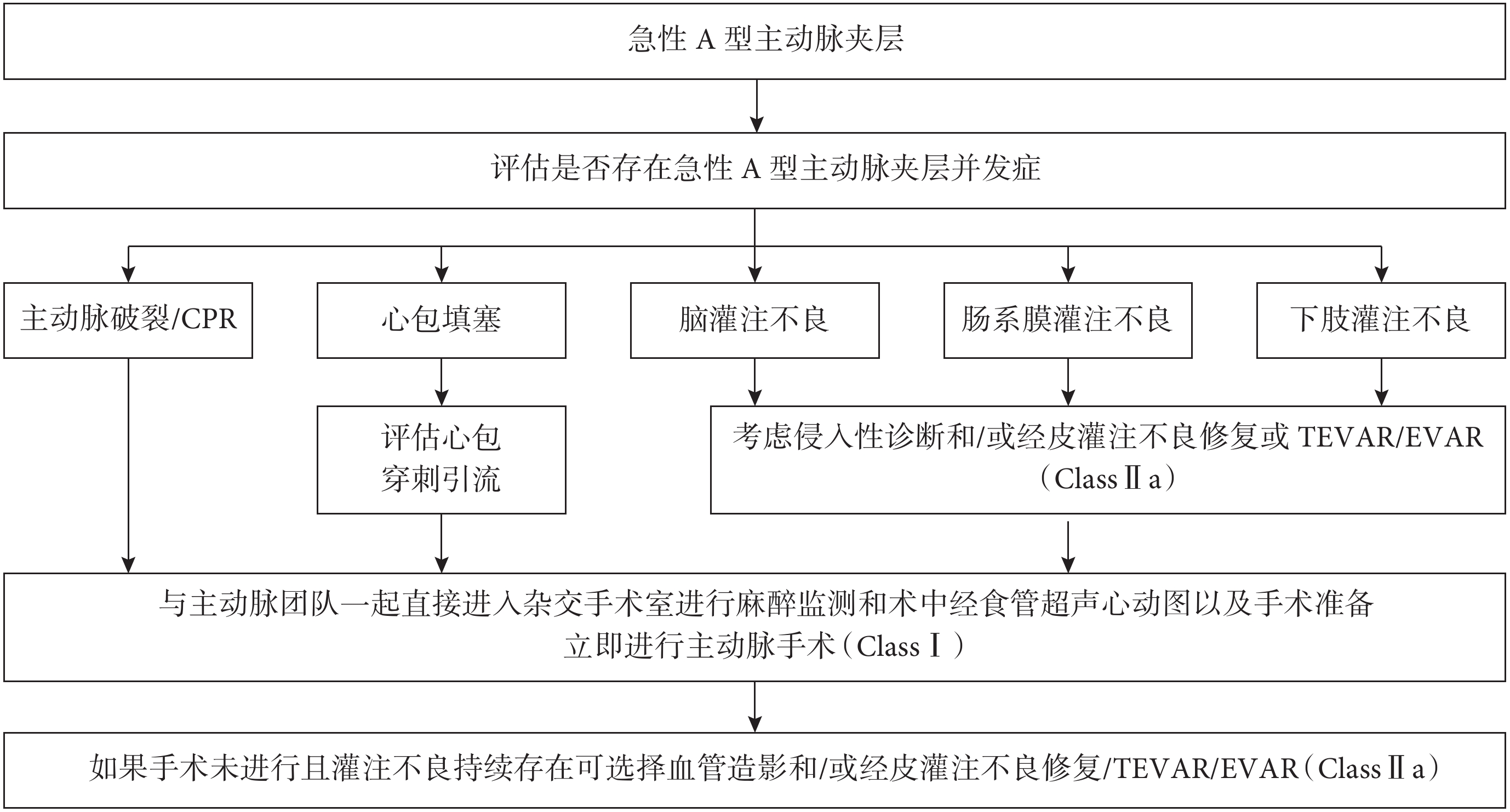
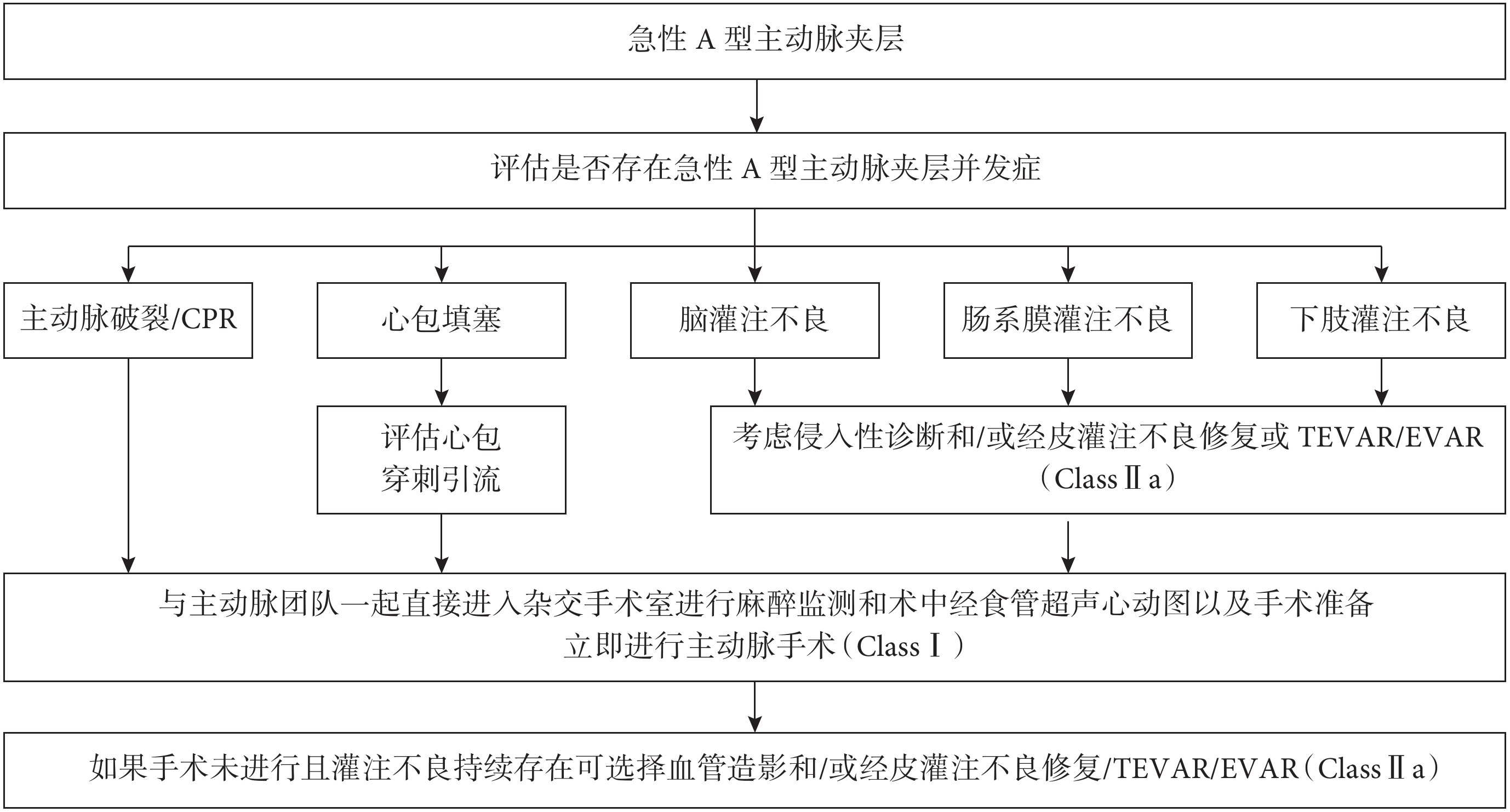
主動脈夾層是最常見的急性主動脈綜合征,占急性主動脈綜合征的80%~90%。根據我國2011年的健康保險資料,急性主動脈夾層的發病率約為2.8/10萬,其中男性患者占2/3以上[62]。A型主動脈夾層約占所有夾層的2/3左右,如果僅用藥物治療,最初48 h的死亡率極高,國內Sino-RAD顯示,單純藥物治療的死亡率為42.5%,所以目前的指南均建議對急性A型主動脈夾層進行手術修復。同時在長期隨訪中,手術干預也明顯優于藥物保守治療,但是心臟壓塞、冠狀動脈受累、內臟及下肢缺血等是術后早期死亡的主要預測因素,需要及時動態判斷并進行同步綜合干預(圖4)。
4.2 B型主動脈夾層
急性B型主動脈夾層中約有一半為非復雜型患者,優化標準藥物治療是目前公認的治療方法,2017 年主動脈夾層診斷與治療規范中國專家共識也指出,對于非復雜型 Stanford B 型夾層,不推薦在急性期早期進行胸主動脈腔內修復(thoracic endovascular aortic repair,TEVAR)治療,因其可能增加主動脈相關并發癥發生率。但對于復雜的急性B型主動脈夾層,開放手術曾經是唯一的選擇,目前腔內治療則成為了復雜急性B型主動脈夾層的一線治療手段,開放手術目前僅適用于解剖結構無法行腔內治療的患者[63]。但受限于近端血腫、夾層破口等因素,單純TEVAR有時難以滿足臨床治療需要,所以對于這類患者大多需要使用開窗技術或者分支支架。舒暢團隊報告了 2016—2017年234例TEVAR治療累及弓部分支動脈的主動脈病變的中期療效,總體手術成功率可達99.6%,取得了較好的臨床效果[64-65]。
B型主動脈夾層在癥狀出現3個月后轉為慢性夾層,慢性B型主動脈夾層手術指征包括灌注不良、快速擴張、破裂及主動脈直徑>50~55 mm[66-67]。TEVAR是解剖條件適宜的慢性B型主動脈夾層患者的首選治療方法。但是目前還沒有開放手術與TEVAR治療慢性TBAD 的隨機對照試驗。在最近的一項Meta分析[68]中,TEVAR與開放手術治療慢性B型主動脈夾層相比,TEVAR顯示出了更低的早期死亡率、卒中和呼吸并發癥發生率,兩者生存率差異無統計學意義。
4.3 主動脈壁內血腫及穿透性潰瘍
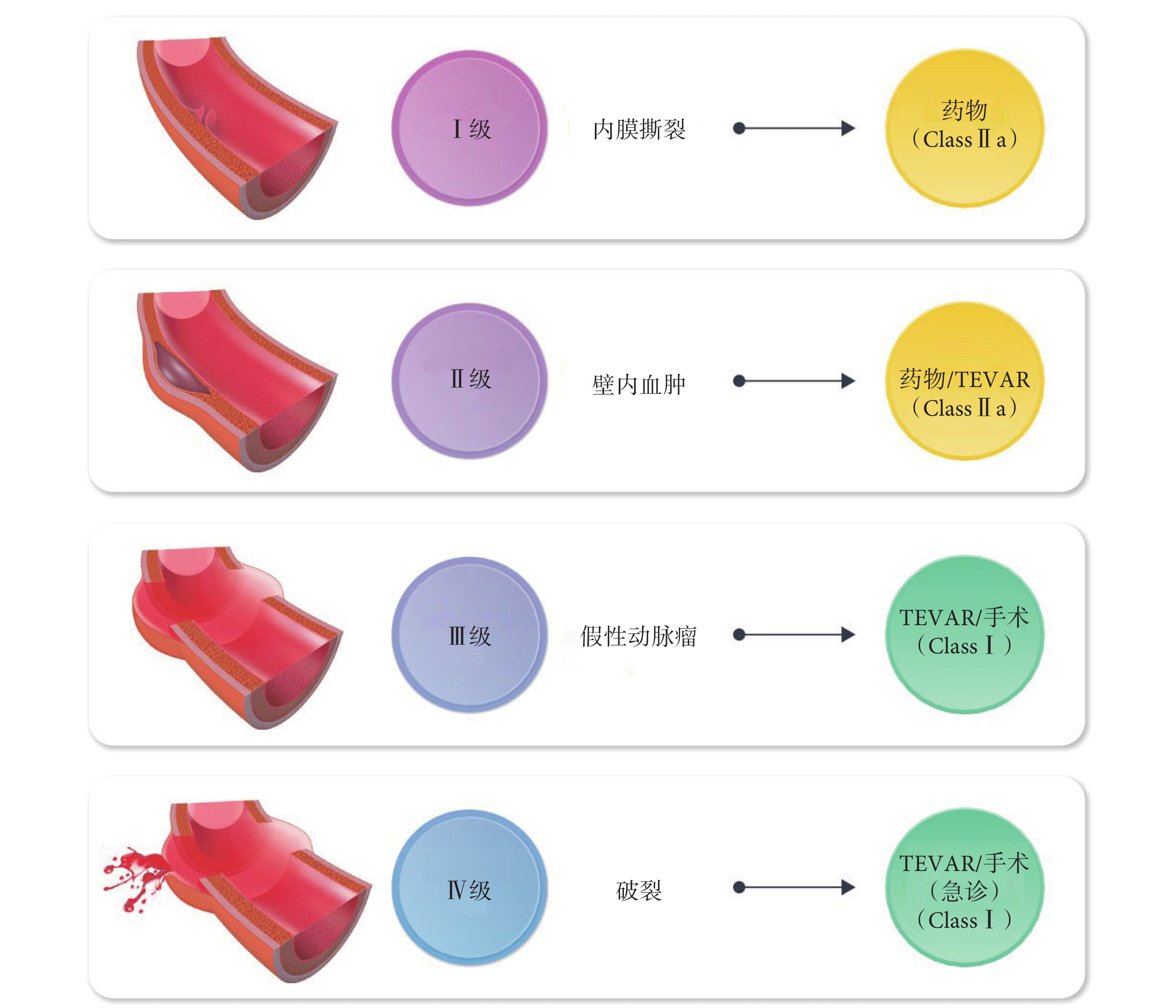
主動脈壁內血腫及穿透性潰瘍占主動脈急性綜合征的7%~32%。主動脈壁內血腫和穿透性潰瘍的整體干預措施類似于主動脈夾層,對于A型壁內血腫和潰瘍,建議盡早進行手術治療。無并發癥且無高危特征的B型壁內血腫(表3)和穿透性潰瘍建議進行標準的藥物治療,而對于有高危影像學特征(穿透性潰瘍最大深度≥10 mm;最大寬度≥13 mm;增長速度>5 mm/年;胸腔積液或囊性動脈瘤)或者合并并發癥的則首選TEVAR。
4.4 創傷性主動脈損傷
創傷性主動脈損傷通常是由巨大加速度引起的相對靜止主動脈段的損傷。根據主動脈壁的損傷程度可以分為4級,治療干預取決于全身臟器的合并損傷情況、多學科會診評估以及患者臨床狀態(圖5)[15]。
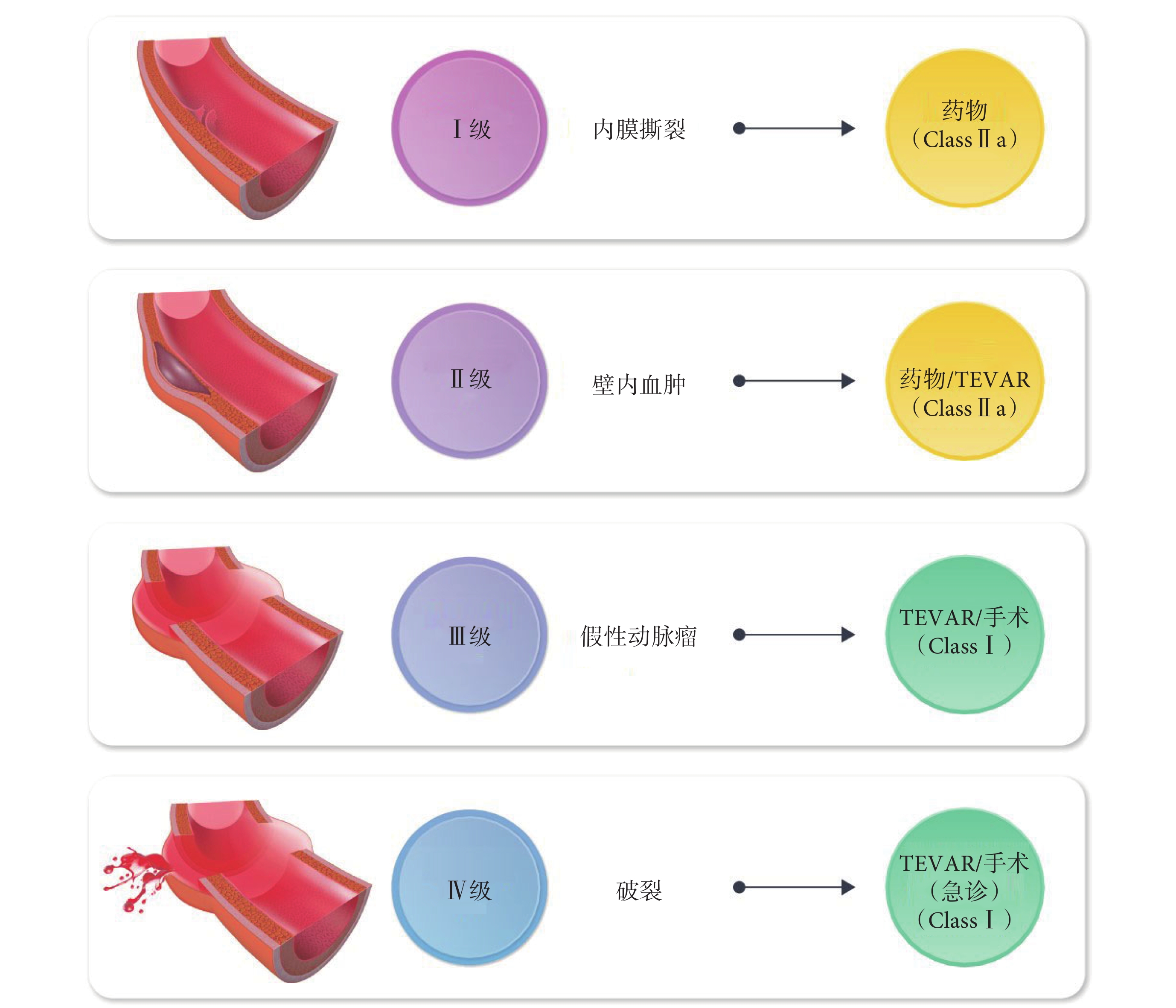 圖5
創傷型主動脈損傷的分級和治療[15]
圖5
創傷型主動脈損傷的分級和治療[15]
5 遺傳性和先天性主動脈疾病
遺傳性和先天性主動脈疾病主要包括Mafan、Loeys-Dietz和Ehlers-Danlos Ⅳ型綜合征等,共同的特征是基因突變導致血管壁病變,從而更容易發生動脈瘤和夾層。一般來說基因問題大多影響主動脈根部和升主動脈,而降主動脈及遠端病變,特別是腹主動脈瘤,則通常是由動脈硬化引起的。Mafan綜合征是最常見的遺傳性主動脈疾病,由致病性FBN-1基因突變引起,除了心血管系統外,可多器官受累。對于無明顯禁忌證患者,推薦使用最大耐受劑量的β受體阻滯劑或血管緊張素Ⅱ受體拮抗劑(angiotensinⅡ receptor antagonists,ARB)類藥物減緩主動脈的擴張速度(Ⅰ/A)。推薦對主動脈根部擴張至竇部≥50 mm的Mafan患者進行手術(Ⅰ/B),如有可能術中盡量保留主動脈瓣膜(Ⅰ/B)。所有遺傳性和先天性主動脈疾病在干預指征、手術方法以及遺傳咨詢等問題上均缺乏有力的證據,所以建議針對不同的患者采用多學科會診以及個體化的診療方案[69]。
6 總結
本次歐洲心臟病學會專家組在詳細總結既往相關研究和文獻數據后,對外周動脈和主動脈疾病管理的諸多方面提出了重要的指導和標準化建議。強調整體管理、共同決策和多學科協作,有望進一步改善PAAD患者的預后。隨著醫學證據及治療策略不斷發展,動脈疾病的管理將更加規范和高效。
利益沖突:無。
作者貢獻:湯開負責翻譯、文獻查閱以及論文撰寫;羅明堯負責總體設計及文章審閱和修改;舒暢負責文章修改及審閱。
在全球范圍內約有1.13億40歲以上人群受到外周動脈疾病(peripheral arterial disease,PAD)的影響。全球患病率約為1.52%,國內北京地區35歲以上人群發病率為3.84%[1],且隨著年齡的增長而逐漸增加(80~84歲人群患病率為14.91%),女性高于男性(18.03% vs. 10.56%)[2-3]。1990—2019年PAD患病率上升了72%,其中約有7 719萬人罹患與頸動脈狹窄相關的缺血性腦疾病,而包括動脈瘤和夾層在內的主動脈疾病在老年人群中患病率高達10%,約有17.2萬例與主動脈瘤相關的死亡事件發生[4]。鑒于PAD逐年增高的患病率和死亡風險,歐洲心臟病學會首次將外周動脈疾病和主動脈疾病指南聯合發布,強調兩者之間的密切關系,這一整合將確保患者接受整體且連貫的疾病管理,減少碎片化治療,改善整體預后。本文將參照指南[5]原文內容,對主要內容進行解讀。推薦等級為Ⅰ表示強推薦,Ⅱa表示中推薦,Ⅱb表示弱推薦,Ⅲ表示不推薦。A級證據表示數據來源于多個隨機臨床試驗或Meta分析,B級證據表示數據來源于單個隨機臨床試驗或大型非隨機研究,C級證據表示數據來源于專家共識、小型研究、回顧性研究。
1 外周動脈和主動脈疾病評估和生活方式干預
外周動脈和主動脈疾病(peripheral arterial and aortic diseases,PAAD)的診斷要充分結合患者的臨床癥狀、病史、家族史和詳細的體格檢查。所有患者在入院后均應該進行全身詳盡的評估,包括外周血管脈搏的觸診以及聽診。詳細的檢查不僅可以幫助診斷,還可以幫助了解預后。頸動脈有雜音的患者,心血管死亡的風險增加1倍,雙上肢壓差超過15 mm Hg(1 mmHg=0.133 kPa)則心血管死亡風險增加50%[5]。
踝肱指數(ankle-brachial index,ABI)在外周動脈的診斷中使用十分廣泛,靜息ABI對PAD診斷的敏感性為68%~84%,特異性為84%~99%。ABI≤0.90可以確診PAD,ABI>1.40則多考慮動脈硬化,此時應警惕相關心血管事件[6-7]。對于ABI>1.40的患者,如有條件建議進一步完善趾臂指數(toe-brachial index,TBI)[8]。推薦將超聲作為PAD篩查和診斷的首選影像檢查,計算機斷層血管造影(computed tomography angiography,CTA)可以進一步評估手術指征和方案。
主動脈疾病的評估應首選經胸心臟超聲(Ⅰ/B),同時推薦對年齡﹥65歲且既往有吸煙史的患者建議行腹主動脈瘤的超聲篩查[9]。股腘動脈瘤在腹主動脈瘤患者中發病率很高,所以對于已經診斷腹主動脈瘤的患者,應考慮超聲篩查股腘動脈瘤(Ⅱ/C)[10] 。
2 外周動脈疾病
2.1 下肢動脈疾病
下肢動脈粥樣硬化性外周血管疾病是一種具有多種臨床表現的慢性疾病,可能有癥狀或無癥狀,也可能與肢體傷口破潰相關,可以根據臨床表現對其進行分類(表1)。約有7%的患者在5年內從無癥狀進展到間歇性跛行,而5年內則有約1/5的患者從間歇性跛行進展為威脅肢體的缺血[11]。但無論是否有癥狀,所有患者均是嚴重不良心臟事件(major adverse cardiac event,MACE)和腦血管疾病的高危人群,其中有癥狀患者5年心血管死亡率可達13%[12]。
2.1.1 診斷
建議首先進行ABI的檢查,ABI>0.90但仍然懷疑PAD,則需要行影像學檢查或者測量運動后ABI,如果ABI下降>20%,也可診斷PAD[13]。同時指南建議將超聲作為PAD診斷和篩查的一線方法(Ⅰ/C),CTA和磁共振動脈成像(MRA)作為進一步檢查的常用手段(Ⅰ/C)。而對于存在威脅肢體的慢性缺血患者,還應完善數字減影血管造影(digital subtraction angiography,DSA)評估膝下血管病變,即使患者不適合進行血運重建,也應該進行DSA來評估血運情況,盡量減少截肢范圍[14]。
對于所有PAD患者,指南建議均應評估患者步行水平。可以采用WIFI量表來評估患者截肢的風險(表2)[15]。
2.1.2 治療
2.1.2.1 一般治療
指南推薦在對患者評估之后即開始監督式運動訓練(supervised exercise training,SET)[16-17]。訓練計劃應從低中強度開始,根據患者的耐受情況逐漸增加高強度運動。運動訓練可以一定程度改善步行距離,但是SET對于ABI的改善作用微乎其微。
盡管PAD患者的心血管風險很高,但一項評估抗血栓藥物對ABI≤0.95的無癥狀患者的試驗中沒有顯示出抗血栓治療對MACE或血運重建的影響[18]。另一項針對ABI≤0.99和糖尿病患者的試驗中也沒有顯示出阿司匹林對于MACE或截肢的任何影響[19]。所以對于無癥狀的PAD患者,不建議系統性接受抗血栓治療。但抗血栓治療可以改善有癥狀患者預后。阿司匹林聯合利伐沙班(2.5 mg,2 次/d)雙重抗栓治療比單獨抗血小板治療更為有效,可以減少MACE等事件的風險,但是會增加出血的風險[12, 20]。目前,指南建議對于有癥狀PAD患者使用阿司匹林或者氯吡格雷(Ⅰ/A),而對于缺血風險較高的無明顯出血風險患者則可以使用阿司匹林聯合利伐沙班進行治療(Ⅱa/A)。
2.1.2.2 血運重建治療
(1)主髂動脈病變 一項Meta分析評估了腔內手術和開放手術對于主髂病變(TASCⅡ C~D)的治療結果,腔內治療的短期并發癥和死亡率較低,但開放手術組具有更優的早期和中期一期通暢率,兩組患者的二期通暢率相當。指南建議無論是否植入支架,均可以考慮在髂外動脈進行球囊擴張,髂總動脈則可以考慮行一期支架植入術(Ⅱa/B)[21-23]。
(2)股腘動脈病變 對于需要進行血運重建的患者,無論病變復雜程度以及手術風險如何,均應首先嘗試腔內治療(Ⅱa/B)[24-25]。對于手術風險低的復雜病變患者,經血管中心討論后可以考慮行冠狀動脈旁路移植術,首選自體靜脈移植物(Ⅱa/C)[26]。
(3)膝下動脈病變 膝下病變多見于糖尿病和腎病患者,通常與股淺動脈病變相關[27],對于嚴重間歇性跛行患者,在實施股腘動脈血運重建的同時,可以考慮對膝下血管進行重建(Ⅱb/C)[28-29]。值得注意的是截至目前,藥物洗脫球囊和裸支架沒有顯示出優于普通球囊的治療效果[30]。
2.2 顱外頸動脈及椎動脈疾病
2.2.1 診斷
頸動脈超聲是篩查、診斷和監測頸動脈病變的首選影像學檢查(Ⅰ/C),而狹窄程度的評估建議采用北美癥狀性頸內動脈內膜剝脫試驗法(North American symptomatic carotid endarterectomy,NASCET)法(Ⅰ/B),即狹窄段直徑與頸內動脈遠端之比[15]。
2.2.2 治療
2.2.2.1 藥物治療
抗血栓治療在無癥狀頸動脈狹窄中的益處尚未得到證實。但是有癥狀患者的腦缺血事件風險較高,因此,建議有癥狀患者口服低劑量阿司匹林和氯吡格雷雙聯抗血小板治療至少3個月[31]。在接受內膜剝脫血運重建后可以停止口服氯吡格雷,接受腔內血運重建后則繼續雙聯抗血小板治療4周[32-33]。
2.2.2.2 血運重建
頸動脈內膜剝脫術(carotid endarterectomy,CEA)并不能減少有癥狀輕度狹窄(狹窄<50%)患者的卒中事件,但可以降低中度(50%~69%)和重度(70%~99%)狹窄患者的卒中風險[34-35]。研究[36-37]表明輕微卒中后1周內進行CEA較為安全,但是由于出血轉化的風險,卒中發作后48 h內行CEA的安全性目前仍有爭議。相較于頸動脈支架植入術(carotid artery stenting,CAS)來說,CEA在術后30 d內的卒中和死亡風險較低,且隨著年齡增大,CAS的相關風險也隨之增加,年齡>70歲患者,CEA優于CAS;而對于年齡>80歲患者,CAS卒中或死亡的風險則高4倍[38-39]。所以CEA仍然是有癥狀患者的首選手術方式,可以在患者出現癥狀的14 d內進行CEA手術(Ⅰ/B),而在并發癥<6%的血管中心,開放手術高風險的患者可以選擇CAS(Ⅱa/B)。
2.3 鎖骨下動脈疾病
鎖骨下動脈缺血通常無特殊癥狀,部分患者因上臂血壓差>10~15 mm Hg而進一步體檢得以確診[40]。上肢運動期間出現的眩暈、視覺障礙等都可能提示鎖骨下動脈狹窄,如果出現盜血綜合征則癥狀可能更加典型。對于有癥狀的鎖骨下動脈缺血患者,經血管中心充分討論后可以考慮進行血運重建(Ⅱa/B)[41]。如果患者需要同側乳內動脈搭橋、同側透析通路或者雙上肢均有重度狹窄或閉塞等情況則應考慮進行血運重建(Ⅱa/C)[42]。血運重建大多選擇腔內治療,但在合適的患者中,頸動脈-鎖骨下動脈轉位(5年通暢率96%)及頸動脈-鎖骨下動脈搭橋(5年通暢率97%)長期通暢率[43- 44]也良好。
2.4 腎動脈疾病
腎動脈狹窄約有90%以上由動脈粥樣硬化引起,大多會累及腎動脈起始部[45]。 由動脈粥樣硬化引起的腎動脈狹窄可使用低劑量阿司匹林治療(Ⅱb/C)。在充分的藥物治療后,重度狹窄且尚存殘余腎功能的高危患者應考慮血運重建(Ⅱa/B)[46],首選腔內治療,但在解剖結構復雜或血管內修復失敗的情況下,開放手術也可作為一種替代方法。
2.5 腸系膜動脈疾病
腸系膜動脈缺血可分為急性和慢性缺血。急性腸系膜缺血癥狀較為明顯,患者可有劇烈腹痛,同時合并嘔吐、腹瀉等表現。經CTA確診的急性缺血患者建議立即治療,首選腔內技術(Ⅰ/B);而對于慢性缺血患者,一般不建議進行血運重建治療,除非患者有明確的難以用其他原因解釋的包括餐后腹痛、體重減輕和腹瀉或便秘等腹部癥狀[47]。
3 主動脈疾病
3.1 主動脈瘤
當主動脈直徑大于平均直徑的兩個標準差時稱為主動脈擴張,而當主動脈直徑繼續增大至正常直徑的1.5倍時則定義為主動脈瘤。囊性動脈瘤大多與感染、主動脈穿透性潰瘍、創傷或者炎性疾病有關,而梭形動脈瘤則與主動脈退行性改變和結締組織病更相關,目前一般認為囊性動脈瘤更危險。當在任何部位發現動脈瘤之后均應該評估全身動脈(Ⅰ/C)。
3.1.1 胸主動脈瘤
胸主動脈瘤包括主動脈根部瘤、升主動脈瘤和主動脈弓部瘤。患者通常可無明確的自覺癥狀,多在篩查中偶然發現,部分患者可能會伴隨主動脈瓣相關的癥狀。瘤體的生長速度是非線性的,與病因、位置和主動脈基線直徑相關。當主動脈直徑達到57.5 mm時,年死亡率可高達10.8%[48]。
3.1.1.1 主動脈根部和升主動脈瘤的治療
主動脈直徑是主動脈并發癥和死亡的主要決定因素,對于主動脈瓣膜功能正常的患者(圖1),建議在動脈瘤直徑≥55 mm時進行手術治療(Ⅰ/B),在經驗豐富的血管中心,擇期手術的死亡率可以控制在1%以下[49],在這些中心盡量考慮對患者實施保留主動脈瓣的主動脈根部置換術(Ⅰ/B)。
 圖1
主動脈根部瘤或升主動脈瘤患者的隨訪策略[15]
圖1
主動脈根部瘤或升主動脈瘤患者的隨訪策略[15]
3.1.1.2 主動脈弓動脈瘤的治療
由于停循環和腦保護等風險,主動脈弓動脈瘤手術死亡率和卒中風險較主動脈根部手術高,所以在術前建議聯合神經科對顱內Willis環進行評估[50]。對于弓部直徑≥55 mm的低風險患者可以考慮行弓部置換(Ⅱa/B),而當病變累及遠端時,可以考慮術中行象鼻支架植入(Ⅱa/C)。對于存在手術指征的升主動脈瘤患者,如果近端弓部直徑>50 mm,則可以考慮同期進行半弓置換(Ⅱa/C)。
3.1.2 降主動脈和胸腹主動脈瘤
根據動脈瘤的累及范圍,降主動脈和胸腹主動脈瘤可以分為5型(圖2)[15],血管外科醫師可根據分型預測手術的難度,選擇合適的術式,制定手術計劃。胸腹主動脈瘤患者診斷的平均年齡為59~69歲,男性患者患病率是女性患者的2~4倍。胸腹主動脈瘤平均年增長1.9~3.4 mm,但當直徑超過50 mm時,增長速度則會顯著增加[51]。
 圖2
胸腹主動脈瘤分型[15]
圖2
胸腹主動脈瘤分型[15]
3.1.2.1 降主動脈瘤的治療
一般認為當直徑>60 mm時,降主動脈瘤的年破裂風險為10%,在降主動脈直徑≥55 mm時即有干預指征,直徑<55 mm時干預則獲益相對較小。對于需要手術干預的患者,腔內治療的優先級高于開放手術。開放手術僅限于年輕、健康、預期壽命長且無法行腔內修復的患者[52]。TEVAR術中盡可能對左鎖骨下動脈進行保留或者重建,從而盡可能減少脊髓缺血和腦血管相關事件。
3.1.2.2 胸腹主動脈瘤的治療
胸腹主動脈瘤的治療難度較大,對于中低風險患者,可考慮在動脈瘤直徑≥60 mm時進行手術治療。如果患者具有高風險特征或者手術風險較小時,則可以考慮在瘤體直徑≥55 mm時在有經驗的中心進行治療。開放手術難度高,腔內治療則是一種具有前景的替代方案。Meta分析顯示,接受腔內治療患者30 d死亡率顯著降低,2~3年隨訪的全因死亡率、動脈瘤相關死亡率與開放手術組差異無統計學意義,但其再干預率明顯增高,且移植物相關并發癥發生率較高[53-54]。
3.1.3 腹主動脈瘤
大多數腹主動脈瘤成梭形,通常根據其與腎動脈的關系進行分類(圖3),男性患者顯著多于女性患者,2/3的患者可沒有任何癥狀,出現癥狀時往往已經發生破裂,此時癥狀多表現為腹痛,還可能會出現休克表現[55]。
 圖3
腹主動脈瘤分類[15]
圖3
腹主動脈瘤分類[15]
一般來說腹主動脈瘤的生長率約為每年3 mm,隨著直徑增大,破裂風險呈指數級上升,女性風險大于男性[56],對于半年內增長5 mm或者一年內增長10 mm以上的患者可以考慮提前進行手術干預。相對穩定腹主動脈瘤的手術指征仍為男性瘤體直徑≥55 mm,女性瘤體直徑≥50 mm,由于中西人群的整體體型以及主動脈基線直徑差異原因,國內對于腹主動脈瘤的干預指征進行了適當放寬[57]。腹主動脈瘤修復早期死亡的主要原因來自于冠狀動脈疾病,對于所有腹主動脈瘤患者術前均應評估冠脈病變[58]。但是對于心臟癥狀穩定的患者并不建議常規在術前對冠狀動脈進行血運重建,因為無論是否行冠脈血運重建都不會降低30 d心肌梗死發生率[59]。中低手術風險患者腹主動脈瘤修復的首選策略是開放手術,但是對于破裂的腹主動脈瘤,開放手術并發癥發生率高達48%[60],因此腔內治療可能更適合解剖合適的破裂腹主動脈瘤。除此之外,對于解剖條件合適的中低手術風險患者或者開放手術風險較高的患者,可以選擇腔內治療(Ⅱa)。腔內治療可以將圍術期死亡率降至1%,同時隨著介入器械的發展,再次手術的干預風險也在降低,但是EVAR術后的患者更容易出現晚期并發癥,所以需要進行終身監測[61]。
4 急性主動脈綜合征
急性主動脈綜合征是一組致命性的主動脈病變引起的,臨床上以突發劇烈胸痛為主要表現的臨床綜合征?,主要包括主動脈夾層、主動脈壁血腫、主動脈穿透性潰瘍、主動脈假性動脈瘤以及創傷性主動脈損傷。
早期診斷對于管理急性主動脈綜合征極為重要,對于疑似急性主動脈綜合征患者,建議完善全主動脈CT(Ⅰ/C),對于無法完善全主動脈CT的患者,建議經食管超聲評估以指導圍術期管理(Ⅰ/C)。對于確診急性主動脈綜合征患者,需要將收縮壓控制在120 mm Hg以下,心率控制在60次/分以下,通過降低主動脈壁的應力從而避免夾層進一步擴大。但是為了降低腦和脊髓的缺血風險,需要適當維持平均壓。
4.1 A型主動脈夾層
主動脈夾層是最常見的急性主動脈綜合征,占急性主動脈綜合征的80%~90%。根據我國2011年的健康保險資料,急性主動脈夾層的發病率約為2.8/10萬,其中男性患者占2/3以上[62]。A型主動脈夾層約占所有夾層的2/3左右,如果僅用藥物治療,最初48 h的死亡率極高,國內Sino-RAD顯示,單純藥物治療的死亡率為42.5%,所以目前的指南均建議對急性A型主動脈夾層進行手術修復。同時在長期隨訪中,手術干預也明顯優于藥物保守治療,但是心臟壓塞、冠狀動脈受累、內臟及下肢缺血等是術后早期死亡的主要預測因素,需要及時動態判斷并進行同步綜合干預(圖4)。
4.2 B型主動脈夾層
急性B型主動脈夾層中約有一半為非復雜型患者,優化標準藥物治療是目前公認的治療方法,2017 年主動脈夾層診斷與治療規范中國專家共識也指出,對于非復雜型 Stanford B 型夾層,不推薦在急性期早期進行胸主動脈腔內修復(thoracic endovascular aortic repair,TEVAR)治療,因其可能增加主動脈相關并發癥發生率。但對于復雜的急性B型主動脈夾層,開放手術曾經是唯一的選擇,目前腔內治療則成為了復雜急性B型主動脈夾層的一線治療手段,開放手術目前僅適用于解剖結構無法行腔內治療的患者[63]。但受限于近端血腫、夾層破口等因素,單純TEVAR有時難以滿足臨床治療需要,所以對于這類患者大多需要使用開窗技術或者分支支架。舒暢團隊報告了 2016—2017年234例TEVAR治療累及弓部分支動脈的主動脈病變的中期療效,總體手術成功率可達99.6%,取得了較好的臨床效果[64-65]。
B型主動脈夾層在癥狀出現3個月后轉為慢性夾層,慢性B型主動脈夾層手術指征包括灌注不良、快速擴張、破裂及主動脈直徑>50~55 mm[66-67]。TEVAR是解剖條件適宜的慢性B型主動脈夾層患者的首選治療方法。但是目前還沒有開放手術與TEVAR治療慢性TBAD 的隨機對照試驗。在最近的一項Meta分析[68]中,TEVAR與開放手術治療慢性B型主動脈夾層相比,TEVAR顯示出了更低的早期死亡率、卒中和呼吸并發癥發生率,兩者生存率差異無統計學意義。
4.3 主動脈壁內血腫及穿透性潰瘍
主動脈壁內血腫及穿透性潰瘍占主動脈急性綜合征的7%~32%。主動脈壁內血腫和穿透性潰瘍的整體干預措施類似于主動脈夾層,對于A型壁內血腫和潰瘍,建議盡早進行手術治療。無并發癥且無高危特征的B型壁內血腫(表3)和穿透性潰瘍建議進行標準的藥物治療,而對于有高危影像學特征(穿透性潰瘍最大深度≥10 mm;最大寬度≥13 mm;增長速度>5 mm/年;胸腔積液或囊性動脈瘤)或者合并并發癥的則首選TEVAR。
4.4 創傷性主動脈損傷
創傷性主動脈損傷通常是由巨大加速度引起的相對靜止主動脈段的損傷。根據主動脈壁的損傷程度可以分為4級,治療干預取決于全身臟器的合并損傷情況、多學科會診評估以及患者臨床狀態(圖5)[15]。
 圖5
創傷型主動脈損傷的分級和治療[15]
圖5
創傷型主動脈損傷的分級和治療[15]
5 遺傳性和先天性主動脈疾病
遺傳性和先天性主動脈疾病主要包括Mafan、Loeys-Dietz和Ehlers-Danlos Ⅳ型綜合征等,共同的特征是基因突變導致血管壁病變,從而更容易發生動脈瘤和夾層。一般來說基因問題大多影響主動脈根部和升主動脈,而降主動脈及遠端病變,特別是腹主動脈瘤,則通常是由動脈硬化引起的。Mafan綜合征是最常見的遺傳性主動脈疾病,由致病性FBN-1基因突變引起,除了心血管系統外,可多器官受累。對于無明顯禁忌證患者,推薦使用最大耐受劑量的β受體阻滯劑或血管緊張素Ⅱ受體拮抗劑(angiotensinⅡ receptor antagonists,ARB)類藥物減緩主動脈的擴張速度(Ⅰ/A)。推薦對主動脈根部擴張至竇部≥50 mm的Mafan患者進行手術(Ⅰ/B),如有可能術中盡量保留主動脈瓣膜(Ⅰ/B)。所有遺傳性和先天性主動脈疾病在干預指征、手術方法以及遺傳咨詢等問題上均缺乏有力的證據,所以建議針對不同的患者采用多學科會診以及個體化的診療方案[69]。
6 總結
本次歐洲心臟病學會專家組在詳細總結既往相關研究和文獻數據后,對外周動脈和主動脈疾病管理的諸多方面提出了重要的指導和標準化建議。強調整體管理、共同決策和多學科協作,有望進一步改善PAAD患者的預后。隨著醫學證據及治療策略不斷發展,動脈疾病的管理將更加規范和高效。
利益沖突:無。
作者貢獻:湯開負責翻譯、文獻查閱以及論文撰寫;羅明堯負責總體設計及文章審閱和修改;舒暢負責文章修改及審閱。