引用本文: 郭曉蝶, 吳佳星, 官桂林, 左懷全. 雌激素受體不同表達狀態的人表皮生長因子受體2陰性乳腺癌患者的臨床病理特征及其預后分析. 中國普外基礎與臨床雜志, 2024, 31(1): 62-68. doi: 10.7507/1007-9424.202308067 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
2020–2021年度報告顯示乳腺癌全球新增發病226萬,已超越肺癌成為全球第一大癌,占總體癌癥發病率的11.7%[1]。雌激素受體(estrogen receptor,ER)表達是乳腺癌的預后因素之一,也是預測內分泌治療效果的重要生物標志物[2]。一項免疫組織化學染色研究[3]結果顯示,相較于ER陰性乳腺癌患者,在ER表達為1%~10%的患者中輔助內分泌治療可有潛在獲益。2020年美國臨床腫瘤學會/美國病理學家學會指南[4]建議,將ER陽性乳腺癌定義為ER表達陽性率≥1%,將ER表達陽性率在1%~10%之間的乳腺癌定義為ER低表達乳腺癌。然而隨著對ER低表達患者的進一步研究[5]表明,ER低表達乳腺癌患者的臨床病理特征與ER陰性患者相似,其內分泌治療獲益也并不明顯。基于目前研究結論的差異,本研究旨在收集初始行手術治療的人表皮生長因子受體2(human epidermal growth factor receptor 2,HER2)陰性乳腺癌患者的臨床病理資料,著重探討ER低表達乳腺癌患者的臨床病理特征和預后情況,有助于更好地了解 ER低表達HER2陰性乳腺癌患者的特征,從而為患者治療方案的制定提供參考。
1 對象與方法
1.1 研究對象及分組
回顧性收集2017年1月1日至2019年12月31日期間西南醫科大學附屬醫院乳腺外科收治的乳腺癌患者。納入標準:① 女性;② 術前未進行輔助治療或其他治療;③ 首次診斷的單側原發性乳腺癌且影像學檢查未提示遠處轉移;④ 在乳腺癌外科行手術治療且術后有完善的ER、孕激素受體(progesterone receptor,PR)及HER2免疫組織化學染色檢測結果且HER2表達結果為陰性;⑤ 病理分期為pT1–3N0–2M0。排除標準:① 未按治療規范完成術后輔助化學藥物治療(簡稱“化療”)、放射治療(簡稱“放療”)、內分泌治療;② 術前已發生遠處轉移的Ⅳ期乳腺癌;③ 合并其他部位惡性腫瘤的乳腺癌; ④ 雙側乳腺癌; ⑤ 炎性、妊娠期、哺乳期乳腺癌; ⑥ 無法獲得隨訪資料的患者。納入患者根據ER表達狀態分為ER陰性(ER表達陽性率<1%)組、ER低表達(ER表達陽性率1%~10%)組、ER表達陽性率>10%組3組。
1.2 資料收集
收集納入患者確診時的年齡、月經狀態、ER狀態、PR狀態、HER2狀態、腫瘤位置、病理類型、腫瘤T分期、腫瘤N分期、組織學分級、Ki-67表達、脈管癌栓、周圍神經侵犯、手術方式以及術后是否接受放療、化療、內分泌治療。其中ER、PR[4]及HER2[6-7]的判讀標準:ER、PR及HER2經過免疫組織化學染色后,其中ER、PR表達陽性率≥1%定義為ER、PR陽性,將ER表達陽性率為1%~10%定義為ER低表達;免疫組織化學染色HER2表達“3+”定義為陽性,表達為“1+”或“0”為陰性,若HER2表達為“2+”則進一步行熒光原位雜交技術檢測,若熒光原位雜交技術檢測基因拷貝數擴增則為HER2陽性,反之為HER2陰性。
1.3 隨訪
隨訪起始時間為患者的手術日期,截至2023年8月20日。觀察指標為總生存期(overall survival,OS)和無病生存期(disease-free survival,DFS)。OS指從手術開始至患者(因任何原因)死亡或末次隨訪的時間;DFS指從手術開始至首次出現乳腺癌復發轉移或復發轉移前(因任何原因)出現死亡的時間。采用電話或門診復查隨訪。所有患者每半年到1年到門診進行胸腹部及局部影像學(包括胸腹部平掃CT、胸部X線片、腹部超聲、乳腺超聲等),對影像學檢查可疑復發及轉移病例取活組織進行病理檢測確診。
1.4 統計學方法
采用 SPSS 26.0 統計學軟件及R 軟件(4.3.1)“TSHRC”“survival”包對數據進行分析。采用χ2檢驗、Fisher 確切概率法或多組等級資料的Kruskal-Wallis H 秩和檢驗比較 ER 不同表達狀態的HER2陰性乳腺癌患者的臨床病理特征及治療方式的差異;采用 Kaplan-Meier 法或Two-stage法繪制生存曲線并分別通過 log-rank 法檢驗或“TSHRC”包比較 ER 不同表達狀態的 HER2 陰性乳腺癌患者的 OS 和 DFS曲線;采用單因素和多因素Cox 比例風險回歸模型分析影響 ER 低表達 HER2 陰性乳腺癌患者復發轉移的風險因素。檢驗水準α=0.05。
2 結果
2.1 本研究納入患者的基本情況
2017年1月1日至2019年12月31日期間西南醫科大學附屬醫院乳腺外科收治的乳腺癌患者共1 770例有完整數據,按照納入及排除標準進行篩選后共納入610例符合納入標準的HER2陰性乳腺癌患者,年齡26~84歲、中位年齡50歲。所有患者術后均按規范輔以術后放療、化療或內分泌治療等。ER陰性組130例(21.3%),ER低表達組48例(7.9%),ER表達陽性率>10%組432例(70.8%)。
2.2 3組HER2陰性乳腺癌患者的臨床病理特征及治療特征比較結果
3組HER2陰性乳腺癌患者在年齡、月經狀態、腫瘤位置、病理類型、腫瘤T分期、腫瘤N分期、脈管癌栓、周圍神經侵犯以及手術方式方面比較差異未見有統計學意義(P>0.05,表1),但發現3組患者在組織學分級和Ki-67表達方面比較差異有統計學意義(P<0.001),采用Bonferroni法校正檢驗水準的事后兩兩比較發現,ER陰性組和ER低表達組較ER表達陽性率>10%組患者的組織學分級更晚(P<0.001、P=0.023)、Ki-67表達更高(P<0.001、P<0.001),而ER陰性組和ER低表達組之間在組織學分級和Ki-67表達方面比較差異無統計學意義(P=0.051、P=0.206)。3組患者在手術方式和術后是否放療方面比較差異無統計學意義(P>0.05),3組患者在是否行內分泌治療及化療方面比較差異有統計學意義(P<0.05),其中ER陰性組接受化療的比例高于ER表達陽性率>10%組(χ2=10.310,P=0.001),而ER低表達組分別與ER陰性組和ER表達陽性率>10%組在是否行化療方面比較差異均無統計學意義(Fisher確切概率法,P=1.000;χ2=3.585,P=0.058);ER低表達組接受內分泌治療的比例高于ER陰性組(χ2=36.333,P<0.001)而低于ER表達陽性率>10%組(χ2=246.996,P<0.001)。
2.3 ER不同表達狀態HER2陰性乳腺癌患者的預后情況
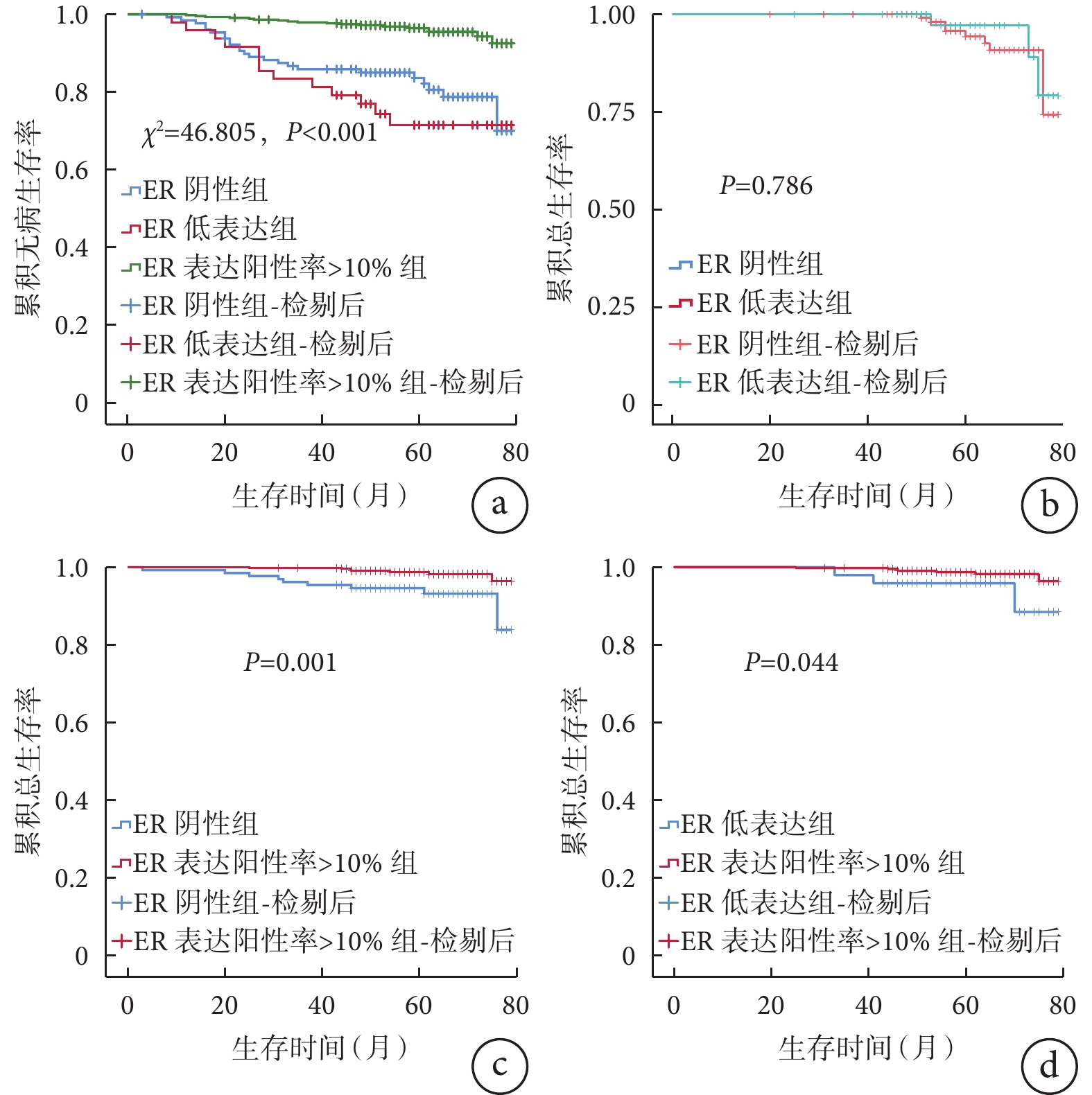
610例HER2陰性乳腺癌患者均獲得隨訪,隨訪時間3~79個月,中位隨訪時間61個月,隨訪期間死亡19例,復發轉移55例,累積總生存率為96.9%,累積無病生存率為91.0%。3組患者死亡和復發轉移情況見表2。3 組患者的無病生存曲線比較差異有統計學意義(χ2=46.805,P<0.001),見圖1a。總生存曲線(圖1b)和無病生存曲線在ER陰性組和 ER 低表達組之間比較差異均無統計學意義(Two-stage檢驗,P=0.786;χ2=1.141,P=0.286),而它們在ER 表達陽性率>10% 組明顯優于 ER 陰性組(χ2=10.137、P=0.001,圖1c;χ2=39.344、P<0.001)和 ER 低表達組(χ2=4.075、P=0.044,圖1d;χ2=31.911、P<0.001)。
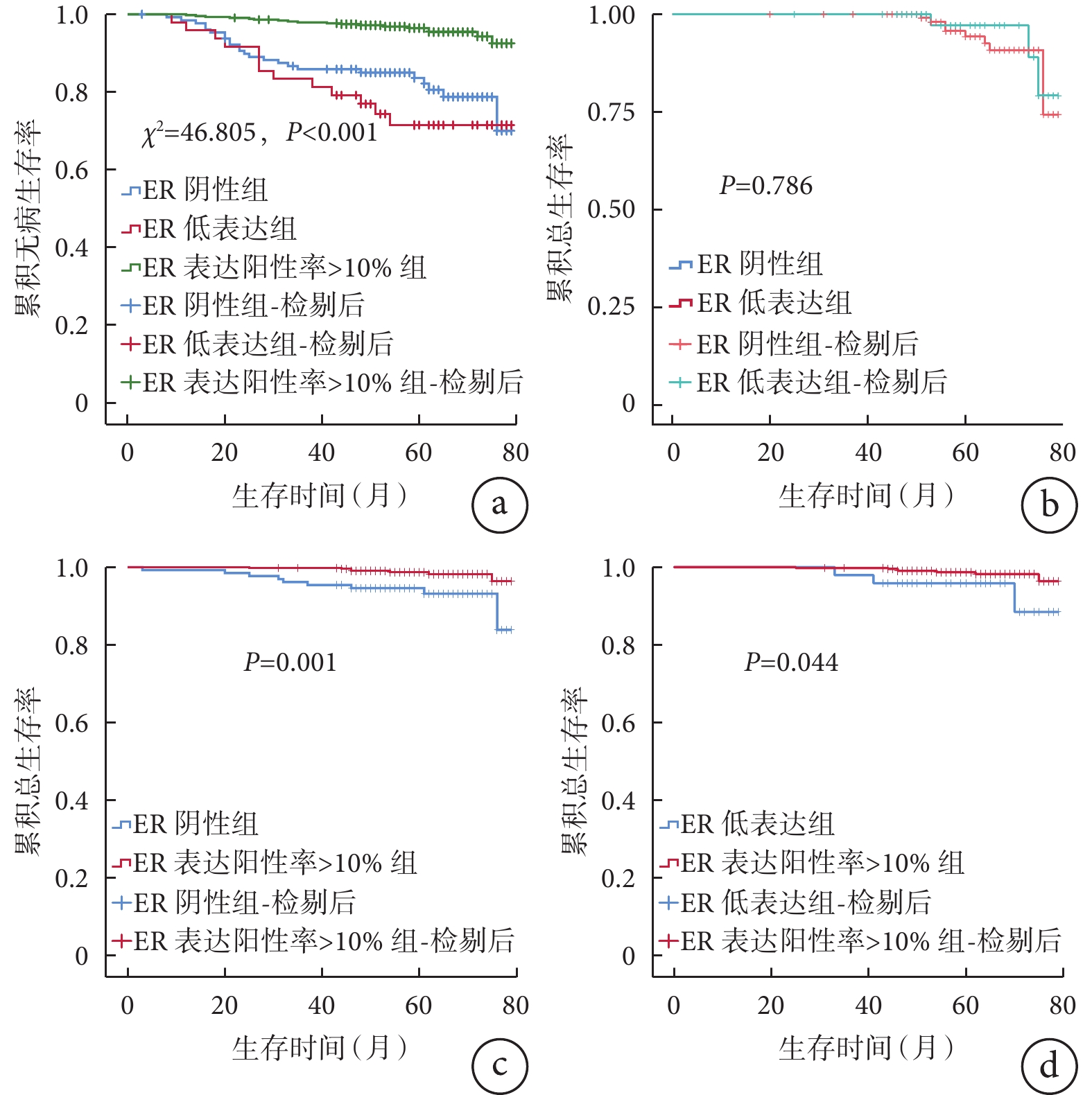 圖1
示ER陰性組、ER低表達組和ER表達陽性率>10%組的無病生存曲線(a)和總生存曲線(b~d)比較
圖1
示ER陰性組、ER低表達組和ER表達陽性率>10%組的無病生存曲線(a)和總生存曲線(b~d)比較
2.4 影響ER低表達HER2陰性乳腺癌患者復發轉移的風險因素分析結果
本研究中,由于ER低表達與ER陰性乳腺癌患者的臨床病理特征無明顯差異且預后也較差,而且本研究中由于死亡病例較少,故本次研究僅關注ER低表達HER2陰性乳腺癌患者的復發轉移情況。單因素分析結果發現,ER低表達HER2陰性乳腺癌患者的年齡、月經狀態、腫瘤部位、組織學分級、Ki-67表達狀態、是否有脈管癌栓及周圍神經侵犯、手術方式、化療、放療及內分泌治療情況與ER低表達HER2陰性乳腺癌患者的復發轉移無關(P>0.05,表3),而腫瘤N分期(P<0.001)及腫瘤T分期(P=0.023)與ER低表達HER2陰性乳腺癌患者復發轉移有關(P<0.05),進一步對此進行多因素Cox風險比例回歸分析發現,N1、N2相較于N0以及T3相較T1患者增大ER低表達HER2陰性乳腺癌患者復發轉移的風險(P<0.05,表4)。
3 討論
大部分研究[8-11]表明,大多數乳腺癌主要表現為ER強陽性或ER陰性,ER低表達(ER表達陽性率1%~10%)患者在乳腺癌中所占比例較小,約為2%~9%。2010年美國臨床腫瘤學會/美國病理學家學會將免疫組織化學檢測結果的ER陽性判讀標準從>10%下調至≥1%并推薦使用內分泌藥物治療[12]。但隨著更加深入的研究發現,對于ER表達陽性率1%~10%的低表達乳腺癌患者是否需行內分泌治療存在爭議。2020年美國臨床腫瘤學會/美國病理學家學會指南[4]建議將ER表達陽性率在1%~10%之間的乳腺癌定義為ER低表達乳腺癌,同時指出目前對于這類患者是否能從內分泌治療中獲益尚不明確,其生物學行為可能與ER表達陰性乳腺癌患者更為類似。
本研究結果顯示,ER低表達HER2陰性乳腺癌與ER陰性HER2陰性乳腺癌患者在年齡、月經狀態、腫瘤位置、手術方式及腫瘤N分期、Ki-67表達等臨床病理特征方面比較差異未見有統計學意義(P>0.05),并且二者的OS和DFS也相近,與ER表達陽性率>10%的HER2陰性乳腺癌患者相比,ER低表達組Ki-67高表達及組織學分級更晚且預后更差,提示了ER低表達HER2陰性乳腺癌與ER陰性HER2陰性乳腺癌患者在臨床病理特征及預后方面更接近。有研究[13-15]顯示,相比于ER表達陽性率>10%的乳腺癌,ER低表達與ER陰性或基底樣(ER、PR、HER2陰性)乳腺癌患者的臨床病理特征更為相似。Yoon等[16]將2 162例已行手術治療的早期乳腺癌患者分為ER陰性組(454例)、ER低表達(ER表達陽性率1%~10%)組(54例)及ER高表達(ER表達陽性率>10%)組(1 654例)3組,結果顯示,3組患者在性別、淋巴血管侵犯方面差異無統計學意義(P>0.05),而ER低表達組與ER高表達組在腫瘤大小、腫瘤T分期、組織學分級、Ki-67表達、PR狀態、HER2狀態、手術方式、是否接受放療、內分泌治療、化療方面比較差異有統計學意義(P<0.05),與ER陰性組患者相比,ER低表達組患者在年齡、腫瘤大小、組織學分級、Ki-67表達、是否接受內分泌治療、化療方面比較差異有統計學意義,就此而言,ER低表達和ER高表達乳腺癌之間的特征差異似乎較ER低表達和ER陰性乳腺癌之間的特征差異更明顯。
一項薈萃分析[17]顯示,內分泌治療對ER低表達患者獲益不佳,該薈萃分析共納入了6項研究[11, 18-22],共納入患者16 606例,結果顯示,ER表達陽性率1%~9%乳腺癌患者接受內分泌治療的預后與未接受內分泌治療的預后比較差異無統計學意義(P=0.68),與接受內分泌治療的ER陰性乳腺癌患者相似(P=0.15),結果提示,ER表達陽性率1%~9%乳腺癌患者未能從內分泌治療獲益或獲益較少。一項傾向性評分匹配分析研究[23]中共納入了634例ER弱陽性(ER表達陽性率1%~10%)早期乳腺癌患者,分為未接受內分泌治療(n=89)、2~3年內分泌治療(n=185)及5年內分泌治療(n=360)3組,在65個月的中位隨訪中,接受5年內分泌治療的患者較未接受內分泌治療的患者有更好的無病生存率(HR=0.57,P=0.04),而2~3年組和5年組患者的5年無病生存率比較差異無統計學意義(HR=0.82,P=0.43),多因素風險比例回歸模型分析提示,2~3年和5年內分泌治療患者的無病生存率差異依然無統計學意義(HR=0.74,P=0.30)。本研究中,由于ER低表達乳腺癌與ER陰性乳腺癌患者的臨床病理特征比較差異無統計學意義且ER陰性乳腺癌患者的預后也較差,而且由于隨訪過程中死亡病例較少,故本次研究僅關注ER低表達HER2陰性乳腺癌患者復發轉移的影響因素而并未進一步關注總生存的影響因素。本研究中ER低表達HER2陰性乳腺癌患者中有21例(43.8%)接受了內分泌治療,但未發現它與未接受內分泌治療患者在復發轉移率方面比較差異有統計學意義(χ2=2.335,P=0.127)。根據本研究結果及前面的相關文獻報道,ER低表達HER2陰性乳腺癌患者行內分泌治療獲益不明確,是否需行內分泌治療仍存在爭議,需要臨床醫生從多方面考量。
淋巴結轉移是乳腺癌最常見的轉移方式,也是較為公認的影響乳腺癌預后的危險因素之一[24]。有研究[25]表明,腫瘤大小與乳腺癌患者的復發相關。本研究也證實,腫瘤T分期晚(T3期)及有淋巴結轉移是影響ER低表達HER2陰性乳腺癌患者術后復發轉移的危險因素。
總之,從本研究結果提示,ER低表達HER2陰性乳腺癌患者臨床病理特征不同于ER表達陽性率>10%的HER2陰性乳腺癌患者,但與ER陰性HER2陰性乳腺癌患者的臨床病理特征更接近,有淋巴結轉移及腫瘤T分期晚是影響ER低表達HER2陰性乳腺癌患者復發轉移的風險因素,ER低表達HER2陰性乳腺癌患者內分泌治療獲益不明顯,對內分泌治療在ER低表達HER2陰性乳腺癌患者中的應用還需要進一步分析。但是對這些結論也需要客觀看待,作為回顧性研究有不足之處:本研究為單中心回顧性研究,普適性還需要驗證;缺乏隨機性,偏倚問題不可避免,且復發轉移事件數相對較少,可能會影響多因素分析結果;另外,本研究隨訪時間較短且僅對DFS、復發或轉移情況進行分析,未對患者死亡情況做進一步分析,今后需擴大樣本量、延長隨訪時間以及盡可能排除混雜因素來進一步在多中心進行論證。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:郭曉蝶負責收集和整理資料并撰寫論文;吳佳星和官桂林負責收集和分析數據以及在論文撰寫中提出修改意見;左懷全提出研究思路、審閱文章及提出修改意見。
倫理聲明:本研究通過了西南醫科大學附屬醫院倫理委員會審批(批文編號:KY2023306)。
2020–2021年度報告顯示乳腺癌全球新增發病226萬,已超越肺癌成為全球第一大癌,占總體癌癥發病率的11.7%[1]。雌激素受體(estrogen receptor,ER)表達是乳腺癌的預后因素之一,也是預測內分泌治療效果的重要生物標志物[2]。一項免疫組織化學染色研究[3]結果顯示,相較于ER陰性乳腺癌患者,在ER表達為1%~10%的患者中輔助內分泌治療可有潛在獲益。2020年美國臨床腫瘤學會/美國病理學家學會指南[4]建議,將ER陽性乳腺癌定義為ER表達陽性率≥1%,將ER表達陽性率在1%~10%之間的乳腺癌定義為ER低表達乳腺癌。然而隨著對ER低表達患者的進一步研究[5]表明,ER低表達乳腺癌患者的臨床病理特征與ER陰性患者相似,其內分泌治療獲益也并不明顯。基于目前研究結論的差異,本研究旨在收集初始行手術治療的人表皮生長因子受體2(human epidermal growth factor receptor 2,HER2)陰性乳腺癌患者的臨床病理資料,著重探討ER低表達乳腺癌患者的臨床病理特征和預后情況,有助于更好地了解 ER低表達HER2陰性乳腺癌患者的特征,從而為患者治療方案的制定提供參考。
1 對象與方法
1.1 研究對象及分組
回顧性收集2017年1月1日至2019年12月31日期間西南醫科大學附屬醫院乳腺外科收治的乳腺癌患者。納入標準:① 女性;② 術前未進行輔助治療或其他治療;③ 首次診斷的單側原發性乳腺癌且影像學檢查未提示遠處轉移;④ 在乳腺癌外科行手術治療且術后有完善的ER、孕激素受體(progesterone receptor,PR)及HER2免疫組織化學染色檢測結果且HER2表達結果為陰性;⑤ 病理分期為pT1–3N0–2M0。排除標準:① 未按治療規范完成術后輔助化學藥物治療(簡稱“化療”)、放射治療(簡稱“放療”)、內分泌治療;② 術前已發生遠處轉移的Ⅳ期乳腺癌;③ 合并其他部位惡性腫瘤的乳腺癌; ④ 雙側乳腺癌; ⑤ 炎性、妊娠期、哺乳期乳腺癌; ⑥ 無法獲得隨訪資料的患者。納入患者根據ER表達狀態分為ER陰性(ER表達陽性率<1%)組、ER低表達(ER表達陽性率1%~10%)組、ER表達陽性率>10%組3組。
1.2 資料收集
收集納入患者確診時的年齡、月經狀態、ER狀態、PR狀態、HER2狀態、腫瘤位置、病理類型、腫瘤T分期、腫瘤N分期、組織學分級、Ki-67表達、脈管癌栓、周圍神經侵犯、手術方式以及術后是否接受放療、化療、內分泌治療。其中ER、PR[4]及HER2[6-7]的判讀標準:ER、PR及HER2經過免疫組織化學染色后,其中ER、PR表達陽性率≥1%定義為ER、PR陽性,將ER表達陽性率為1%~10%定義為ER低表達;免疫組織化學染色HER2表達“3+”定義為陽性,表達為“1+”或“0”為陰性,若HER2表達為“2+”則進一步行熒光原位雜交技術檢測,若熒光原位雜交技術檢測基因拷貝數擴增則為HER2陽性,反之為HER2陰性。
1.3 隨訪
隨訪起始時間為患者的手術日期,截至2023年8月20日。觀察指標為總生存期(overall survival,OS)和無病生存期(disease-free survival,DFS)。OS指從手術開始至患者(因任何原因)死亡或末次隨訪的時間;DFS指從手術開始至首次出現乳腺癌復發轉移或復發轉移前(因任何原因)出現死亡的時間。采用電話或門診復查隨訪。所有患者每半年到1年到門診進行胸腹部及局部影像學(包括胸腹部平掃CT、胸部X線片、腹部超聲、乳腺超聲等),對影像學檢查可疑復發及轉移病例取活組織進行病理檢測確診。
1.4 統計學方法
采用 SPSS 26.0 統計學軟件及R 軟件(4.3.1)“TSHRC”“survival”包對數據進行分析。采用χ2檢驗、Fisher 確切概率法或多組等級資料的Kruskal-Wallis H 秩和檢驗比較 ER 不同表達狀態的HER2陰性乳腺癌患者的臨床病理特征及治療方式的差異;采用 Kaplan-Meier 法或Two-stage法繪制生存曲線并分別通過 log-rank 法檢驗或“TSHRC”包比較 ER 不同表達狀態的 HER2 陰性乳腺癌患者的 OS 和 DFS曲線;采用單因素和多因素Cox 比例風險回歸模型分析影響 ER 低表達 HER2 陰性乳腺癌患者復發轉移的風險因素。檢驗水準α=0.05。
2 結果
2.1 本研究納入患者的基本情況
2017年1月1日至2019年12月31日期間西南醫科大學附屬醫院乳腺外科收治的乳腺癌患者共1 770例有完整數據,按照納入及排除標準進行篩選后共納入610例符合納入標準的HER2陰性乳腺癌患者,年齡26~84歲、中位年齡50歲。所有患者術后均按規范輔以術后放療、化療或內分泌治療等。ER陰性組130例(21.3%),ER低表達組48例(7.9%),ER表達陽性率>10%組432例(70.8%)。
2.2 3組HER2陰性乳腺癌患者的臨床病理特征及治療特征比較結果
3組HER2陰性乳腺癌患者在年齡、月經狀態、腫瘤位置、病理類型、腫瘤T分期、腫瘤N分期、脈管癌栓、周圍神經侵犯以及手術方式方面比較差異未見有統計學意義(P>0.05,表1),但發現3組患者在組織學分級和Ki-67表達方面比較差異有統計學意義(P<0.001),采用Bonferroni法校正檢驗水準的事后兩兩比較發現,ER陰性組和ER低表達組較ER表達陽性率>10%組患者的組織學分級更晚(P<0.001、P=0.023)、Ki-67表達更高(P<0.001、P<0.001),而ER陰性組和ER低表達組之間在組織學分級和Ki-67表達方面比較差異無統計學意義(P=0.051、P=0.206)。3組患者在手術方式和術后是否放療方面比較差異無統計學意義(P>0.05),3組患者在是否行內分泌治療及化療方面比較差異有統計學意義(P<0.05),其中ER陰性組接受化療的比例高于ER表達陽性率>10%組(χ2=10.310,P=0.001),而ER低表達組分別與ER陰性組和ER表達陽性率>10%組在是否行化療方面比較差異均無統計學意義(Fisher確切概率法,P=1.000;χ2=3.585,P=0.058);ER低表達組接受內分泌治療的比例高于ER陰性組(χ2=36.333,P<0.001)而低于ER表達陽性率>10%組(χ2=246.996,P<0.001)。
2.3 ER不同表達狀態HER2陰性乳腺癌患者的預后情況
610例HER2陰性乳腺癌患者均獲得隨訪,隨訪時間3~79個月,中位隨訪時間61個月,隨訪期間死亡19例,復發轉移55例,累積總生存率為96.9%,累積無病生存率為91.0%。3組患者死亡和復發轉移情況見表2。3 組患者的無病生存曲線比較差異有統計學意義(χ2=46.805,P<0.001),見圖1a。總生存曲線(圖1b)和無病生存曲線在ER陰性組和 ER 低表達組之間比較差異均無統計學意義(Two-stage檢驗,P=0.786;χ2=1.141,P=0.286),而它們在ER 表達陽性率>10% 組明顯優于 ER 陰性組(χ2=10.137、P=0.001,圖1c;χ2=39.344、P<0.001)和 ER 低表達組(χ2=4.075、P=0.044,圖1d;χ2=31.911、P<0.001)。
 圖1
示ER陰性組、ER低表達組和ER表達陽性率>10%組的無病生存曲線(a)和總生存曲線(b~d)比較
圖1
示ER陰性組、ER低表達組和ER表達陽性率>10%組的無病生存曲線(a)和總生存曲線(b~d)比較
2.4 影響ER低表達HER2陰性乳腺癌患者復發轉移的風險因素分析結果
本研究中,由于ER低表達與ER陰性乳腺癌患者的臨床病理特征無明顯差異且預后也較差,而且本研究中由于死亡病例較少,故本次研究僅關注ER低表達HER2陰性乳腺癌患者的復發轉移情況。單因素分析結果發現,ER低表達HER2陰性乳腺癌患者的年齡、月經狀態、腫瘤部位、組織學分級、Ki-67表達狀態、是否有脈管癌栓及周圍神經侵犯、手術方式、化療、放療及內分泌治療情況與ER低表達HER2陰性乳腺癌患者的復發轉移無關(P>0.05,表3),而腫瘤N分期(P<0.001)及腫瘤T分期(P=0.023)與ER低表達HER2陰性乳腺癌患者復發轉移有關(P<0.05),進一步對此進行多因素Cox風險比例回歸分析發現,N1、N2相較于N0以及T3相較T1患者增大ER低表達HER2陰性乳腺癌患者復發轉移的風險(P<0.05,表4)。
3 討論
大部分研究[8-11]表明,大多數乳腺癌主要表現為ER強陽性或ER陰性,ER低表達(ER表達陽性率1%~10%)患者在乳腺癌中所占比例較小,約為2%~9%。2010年美國臨床腫瘤學會/美國病理學家學會將免疫組織化學檢測結果的ER陽性判讀標準從>10%下調至≥1%并推薦使用內分泌藥物治療[12]。但隨著更加深入的研究發現,對于ER表達陽性率1%~10%的低表達乳腺癌患者是否需行內分泌治療存在爭議。2020年美國臨床腫瘤學會/美國病理學家學會指南[4]建議將ER表達陽性率在1%~10%之間的乳腺癌定義為ER低表達乳腺癌,同時指出目前對于這類患者是否能從內分泌治療中獲益尚不明確,其生物學行為可能與ER表達陰性乳腺癌患者更為類似。
本研究結果顯示,ER低表達HER2陰性乳腺癌與ER陰性HER2陰性乳腺癌患者在年齡、月經狀態、腫瘤位置、手術方式及腫瘤N分期、Ki-67表達等臨床病理特征方面比較差異未見有統計學意義(P>0.05),并且二者的OS和DFS也相近,與ER表達陽性率>10%的HER2陰性乳腺癌患者相比,ER低表達組Ki-67高表達及組織學分級更晚且預后更差,提示了ER低表達HER2陰性乳腺癌與ER陰性HER2陰性乳腺癌患者在臨床病理特征及預后方面更接近。有研究[13-15]顯示,相比于ER表達陽性率>10%的乳腺癌,ER低表達與ER陰性或基底樣(ER、PR、HER2陰性)乳腺癌患者的臨床病理特征更為相似。Yoon等[16]將2 162例已行手術治療的早期乳腺癌患者分為ER陰性組(454例)、ER低表達(ER表達陽性率1%~10%)組(54例)及ER高表達(ER表達陽性率>10%)組(1 654例)3組,結果顯示,3組患者在性別、淋巴血管侵犯方面差異無統計學意義(P>0.05),而ER低表達組與ER高表達組在腫瘤大小、腫瘤T分期、組織學分級、Ki-67表達、PR狀態、HER2狀態、手術方式、是否接受放療、內分泌治療、化療方面比較差異有統計學意義(P<0.05),與ER陰性組患者相比,ER低表達組患者在年齡、腫瘤大小、組織學分級、Ki-67表達、是否接受內分泌治療、化療方面比較差異有統計學意義,就此而言,ER低表達和ER高表達乳腺癌之間的特征差異似乎較ER低表達和ER陰性乳腺癌之間的特征差異更明顯。
一項薈萃分析[17]顯示,內分泌治療對ER低表達患者獲益不佳,該薈萃分析共納入了6項研究[11, 18-22],共納入患者16 606例,結果顯示,ER表達陽性率1%~9%乳腺癌患者接受內分泌治療的預后與未接受內分泌治療的預后比較差異無統計學意義(P=0.68),與接受內分泌治療的ER陰性乳腺癌患者相似(P=0.15),結果提示,ER表達陽性率1%~9%乳腺癌患者未能從內分泌治療獲益或獲益較少。一項傾向性評分匹配分析研究[23]中共納入了634例ER弱陽性(ER表達陽性率1%~10%)早期乳腺癌患者,分為未接受內分泌治療(n=89)、2~3年內分泌治療(n=185)及5年內分泌治療(n=360)3組,在65個月的中位隨訪中,接受5年內分泌治療的患者較未接受內分泌治療的患者有更好的無病生存率(HR=0.57,P=0.04),而2~3年組和5年組患者的5年無病生存率比較差異無統計學意義(HR=0.82,P=0.43),多因素風險比例回歸模型分析提示,2~3年和5年內分泌治療患者的無病生存率差異依然無統計學意義(HR=0.74,P=0.30)。本研究中,由于ER低表達乳腺癌與ER陰性乳腺癌患者的臨床病理特征比較差異無統計學意義且ER陰性乳腺癌患者的預后也較差,而且由于隨訪過程中死亡病例較少,故本次研究僅關注ER低表達HER2陰性乳腺癌患者復發轉移的影響因素而并未進一步關注總生存的影響因素。本研究中ER低表達HER2陰性乳腺癌患者中有21例(43.8%)接受了內分泌治療,但未發現它與未接受內分泌治療患者在復發轉移率方面比較差異有統計學意義(χ2=2.335,P=0.127)。根據本研究結果及前面的相關文獻報道,ER低表達HER2陰性乳腺癌患者行內分泌治療獲益不明確,是否需行內分泌治療仍存在爭議,需要臨床醫生從多方面考量。
淋巴結轉移是乳腺癌最常見的轉移方式,也是較為公認的影響乳腺癌預后的危險因素之一[24]。有研究[25]表明,腫瘤大小與乳腺癌患者的復發相關。本研究也證實,腫瘤T分期晚(T3期)及有淋巴結轉移是影響ER低表達HER2陰性乳腺癌患者術后復發轉移的危險因素。
總之,從本研究結果提示,ER低表達HER2陰性乳腺癌患者臨床病理特征不同于ER表達陽性率>10%的HER2陰性乳腺癌患者,但與ER陰性HER2陰性乳腺癌患者的臨床病理特征更接近,有淋巴結轉移及腫瘤T分期晚是影響ER低表達HER2陰性乳腺癌患者復發轉移的風險因素,ER低表達HER2陰性乳腺癌患者內分泌治療獲益不明顯,對內分泌治療在ER低表達HER2陰性乳腺癌患者中的應用還需要進一步分析。但是對這些結論也需要客觀看待,作為回顧性研究有不足之處:本研究為單中心回顧性研究,普適性還需要驗證;缺乏隨機性,偏倚問題不可避免,且復發轉移事件數相對較少,可能會影響多因素分析結果;另外,本研究隨訪時間較短且僅對DFS、復發或轉移情況進行分析,未對患者死亡情況做進一步分析,今后需擴大樣本量、延長隨訪時間以及盡可能排除混雜因素來進一步在多中心進行論證。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:郭曉蝶負責收集和整理資料并撰寫論文;吳佳星和官桂林負責收集和分析數據以及在論文撰寫中提出修改意見;左懷全提出研究思路、審閱文章及提出修改意見。
倫理聲明:本研究通過了西南醫科大學附屬醫院倫理委員會審批(批文編號:KY2023306)。