結直腸癌(colorectal cancer,CRC)是世界范圍內發病率較高的惡性腫瘤,目前仍有增高趨勢,可能與飲食結構逐漸西方化有關。雖然近年來診療技術不斷提高,但仍有許多晚期患者因復發轉移而死亡[1]。因此,深入探討CRC發生發展機制,尋求針對CRC的預防、早期診斷和新的治療策略,對于降低CRC死亡率以及改善患者預后具有重要意義。碳水化合物作為細胞結構的主要成分參與調節人體多種生理和病理過程[2]。過量攝入碳水化合物與CRC的發生密切相關,調查發現每天飲用超過2份含糖飲料的Ⅲ期CRC患者復發率和病死率顯著增高[3]。2018年針對歐洲國家的研究[4]發現,精制糖的攝入量與男性群體的CRC發生存在低度正相關性,與女性群體存在中度正相關性。Science發表的研究[5]表明:敲除腫瘤抑制基因APC的小鼠經喂食高果糖玉米糖漿后,CRC腫瘤體積顯著增大、惡性程度更高。
鐵自噬是一種細胞調控鐵離子代謝的自噬類型,該過程由核受體輔助激活因子4(nuclear receptor coactivator 4,NCOA4)介導,結合鐵離子的鐵蛋白(ferritin)被NCOA4識別并結合后被轉運至溶酶體吞噬泡膜上形成自噬小體,然后被溶酶體降解并釋放出游離亞鐵離子[6-7]。研究[8]顯示,鐵自噬釋放出的游離亞鐵離子是鐵死亡發生的重要條件之一。鐵自噬在多種人類疾病的發病過程中發揮重要調控作用。近期研究[9]表明,高脂飲食通過抑制鐵死亡,誘導小鼠結腸炎以及炎性相關腸癌的發生發展。本研究中,筆者將通過實驗驗證高糖飲食激活的哺乳動物雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,mTOR)/晚期糖基化終末產物受體RAGE(receptor of advanced glycation end products,RAGE)信號通路通過抑制鐵自噬,發揮促進CRC侵襲轉移的作用。
1 材料與方法
1.1 研究對象
1.1.1 臨床病例
以多階段整群隨機抽取和自愿參與的形式招募2022年10月至2023年10月期間于哈爾濱醫科大學附屬第二醫院接受手術治療的CRC患者,本研究方案取得哈爾濱醫科大學倫理委員會的批準(KY2020-122),研究遵循赫爾辛基宣言所規定的道德標準,所有自愿者都被充分告知程序,所有參與研究的患者均簽署了哈爾濱醫科大學倫理委員會提供的知情同意書。最終有66例進入研究,網絡食物頻率問卷和填寫方式參見文獻[10]。術中收集上述CRC患者的腫瘤組織及其癌旁結直腸組織標本,貯存于–80 °C超低溫冰箱中保存備用。記錄上述患者的姓名、性別、年齡、就診時間、聯系電話等個人資料,記錄病理診斷中描述的腫瘤部位、大小、病理學分型,有無淋巴結轉移,TNM分期,并記錄癌胚抗原(carcinoembryonic antigen,CEA)和CA19-9水平。
1.1.2 CRC細胞
人結腸癌細胞系HT29以及HCT116常規培養于含10%胎牛血清的RPMI1640培養基中,培養基中均加入1%雙抗(青霉素、鏈霉素100 U/mL),置于37 °C、5% CO2培養箱中恒溫培養。48~72 h傳代。
1.1.3 實驗動物
SPF級3周齡雄性SD大鼠共16只,體質量約50 g/只,由哈爾濱獸醫研究所動物實驗中心提供,飼養于哈爾濱獸醫研究所動物實驗中心,3只/籠,實驗室環境溫度為(23±3)°C,相對濕度為(55±15)%,晝夜明暗交替時間為12 h/12 h,每3天更換墊料。本研究方案取得哈爾濱醫科大學倫理委員會的批準(KY2020-122)。
1.2 主要試劑和儀器
氧化偶氮甲烷(azoxymethane,AOM,
1.3 實驗方法
1.3.1 網絡食物頻率問卷
網絡食物頻率問卷包括我國南北方常食用的谷類及制品、薯類淀粉及其制品、豆類及其制品、蔬菜類食品、菌藻類、鮮果、堅果及種子類、家畜類及其食品、禽肉類及其食品、乳類及制品、蛋類及其食品、魚蝦蟹貝類、速食食品、糖及蜜餞類、飲料、調味品、其他,共17大類136種食物。調查中用各種標有食物重量的圖片和容器進行定量,幫助受調查者判斷攝入量。根據《中國食物成分表》計算能量和營養素攝入量;根據每月家庭總用油/鹽量÷30÷家中人數計算每天的人均用油/鹽量。在認真填寫完網絡食物頻率問卷后,每個被調查者將獲得1份詳細的膳食評估反饋,根據膳食評估反饋,將反饋結果為“蛋白質供能適宜,脂肪供能適宜,碳水化合物供能偏高”的CRC患者定義為高糖飲食組,將反饋結果為“蛋白質供能適宜,脂肪供能適宜,碳水化合物供能適宜”的CRC患者定義為正常飲食組[10]。
1.3.2 實驗動物分組
將大鼠隨機分為對照組和高糖飲食組,每組8只,大鼠經適應性飼養1周后,每周給予濃度為15 mg/kg的AOM腹腔注射,持續7周,每日觀察動物一般情況。對照組大鼠給予基礎飼料喂養,高糖飲食組給予80%基礎飼料+20%葡萄糖飼養。首次注射AOM后3個月,采用脫頸椎法處死大鼠,結直腸組織完整取材并以PBS緩沖液沖洗,所有實驗大鼠均可見結直腸腫瘤,AOM建模成功率為100%,記錄肉眼可見的結直腸腫瘤數目;將每個結直腸組織等分為2份,1份放于10%中性緩沖甲醛溶液固定并進行組織學檢查;另1份標本于–80 °C超低溫冰箱中保存用于實時熒光定量逆轉錄聚合酶鏈反應(real-time quantitative reverse transcription PCR,RT-qPCR)檢測[11]。
1.3.3 細胞的處理與分組
① 取活力良好的對數生長期HT29和HCT116細胞,以5×103個/孔接種于96孔板,待細胞融合至80%時,分別以含35、70、105、140 mmol/L葡萄糖的RPMI1640培養基培養。② 取活力良好的對數生長期HT29和HCT116細胞分為對照組、高糖培養組、靶向RAGE的siRNA轉染組(si-RAGE組)、靶向RAGE的siRNA轉染同時以高糖培養組(高糖+si-RAGE組)。③ 取活力良好的對數生長期HT29和HCT116細胞分為對照組、高糖培養組、鐵自噬激活劑處理組(雷帕霉素組)、鐵自噬激活劑處理同時以高糖培養組(高糖+雷帕霉素組)。④ 各組細胞處理:對照組為未經任何處理的HT29和HCT116細胞;高糖組以含105 mmol/L葡萄糖的RPMI1640培養基培養HT29和HCT116細胞48 h。si-RAGE組以RAGE siRNAs轉染HT29和HCT116細胞6 h,si-RAGE轉染CRC細胞操作按照說明書進行,轉染后6 h更換新鮮培養液繼續培養。雷帕霉素組為以10 nmol/L雷帕霉素處理HT29和HCT116細胞48 h。高糖+si-RAGE組以含105 mmol/L葡萄糖的RPMI1640培養基培養HT29和HCT116細胞48 h的同時以RAGE siRNAs轉染HT29和HCT116細胞6 h。高糖+雷帕霉素組以含105 mmol/L葡萄糖的RPMI1640培養基培養HT29和HCT116細胞48 h的同時以10 nmol/L雷帕霉素處理HT29和HCT116細胞48 h。每組均設6個復孔。
1.3.4 RT-qPCR
按Trizol試劑盒說明書操作提取標本的總RNA,按試劑盒說明書逆轉錄為cDNA。根據Genebank序列設計、合成目的基因引物,以PCR進行擴增,采用β-actin為內參,具體操作按試劑盒說明書進行。以2–??Ct表示每個目的基因的相對表達量,?Ct=CtmRNA–Ctβ-actin,實驗重復3次。RAGE上游引物為5’-GAATCCTCCCCAATGGTTCA-3’,下游引物為5’-GCCCGACACCGGAAAGT-3’;mTOR上游引物為5’-TCCGAGAGATGAGTCAAGAGG-3’,下游引物為5’-CACCTTCCACTCCTATGAGGC-3’;NCOA4上游引物為5’-TACCCAAAAGCAGACCTTGG-3’,下游引物為5’-CGCCTTCTCCTAGAGTTTTTCC-3’;ferritin上游引物為5’-CCCCCATTTGTGTGACTTCAT-3’,下游引物為5’-GCCCGAGGCTTAGCTTTCATT-3’;β-actin上游引物為5’-ATGTTGAGACCTTCAACACC-3’,下游引物為5’-AGGTAGTCAGTCAGGTCCCGGCC-3’。
1.3.5 蛋白免疫印跡(western blot)實驗
提取樣本總蛋白,聚丙烯酰胺凝膠電泳分離后采用半干法轉膜,10%脫脂牛奶封閉2 h,洗滌后加入目的蛋白的一抗(1∶500),4 °C過夜孵育,次日加入Alexa Fluor 680驢抗鼠IgG(H+L)或Alexa Fluor 680驢抗兔IgG(H+L)二抗(1∶5 000),37 °C孵育1 h。洗滌后采用Odyssey?近紅外成像系統檢測目的蛋白的相對表達水平。
1.3.6 細胞存活率的檢測
取對數生長期的HT29、HCT116細胞接種于96孔板中(3×103個/mL),以含10%血清的培養基培養24 h后將培養基更換為實驗組培養基繼續培養,24 h后每孔加入細胞計數試劑盒CCK-8工作液10 μL,培養2 h后,在570 nm處測定吸光度(A)值。實驗重復3次。細胞存活率(%)=實驗組A值/對照組A值×100%。
1.3.7 細胞毒性的檢測
取對數生長期的HT29、HCT116細胞以5×103個/孔均勻接種于96孔板,每組設6個復孔。每孔加入LDH釋放液10 μL,孵育1 h后以400 g離心5 min,取上清液,使用LDH檢測試劑盒按說明書加入LDH檢測液后,于450 nm波長處測定A值。LDH活性(%)=(樣本A值–無細胞的空白孔A值)–溶劑對照組平均A值/(陽性對照組平均A值–溶劑對照組平均A值)×100%。
1.3.8 透射電鏡觀察鐵自噬體的形成
收集HT29、HCT116細胞,加入預冷的戊二醛1 mL固定,洗滌后以1%四氧化鋨置于4 °C條件下固定2 h,依次置入30%、50%、70%、80%、90%和100%乙醇中脫水,吸凈脫水劑,以體積比1∶1加入3 mL純丙酮-EPON 812,室溫靜置30 min后,加入純包埋劑1 mL,固化。顯微鏡下修正包塊,制備超薄切片,使用醋酸雙氧鈾染色,沖洗晾干后于電鏡(Jeol,日本)下觀察記錄并拍照。
1.3.9 劃痕實驗
將生長狀態良好的HT29、HCT116細胞鋪入6孔板中,每組設6個復孔,待細胞融合度達80%后給予實驗處理,暴露24 h后垂直板底劃直線,PBS溶液清洗漂浮的細胞后立即拍照記錄;隨后將6孔板置于37 °C、5% CO2培養箱中恒溫培養,48 h后棄去培養上清,以PBS溶液清洗后拍照記錄。采用Image J軟件計算空白劃痕的面積,按照公式:(0 h的劃痕面積–48 h后的劃痕面積)/0 h的劃痕面積,計算HT29、HCT116細胞的劃痕與合度。
1.3.10 細胞遷移與侵襲實驗
取對數生長期的HT29、HCT116細胞以PBS溶液洗滌3次后,計數1×105個細胞重懸于100 μL無血清培養基,接種于上室,在下室加入600 μL含有10%胎牛血清的完全培養基。孵育24 h后取出小室,以95%的乙醇棉簽擦去上室的細胞,加入預冷的4%多聚甲醛固定。靜置15 min后,使用PBS溶液洗滌3次,每次5 min。烘干后,加入1%結晶紫染色10 min,PBS溶液洗滌3次。置于100倍顯微鏡下每張膜取5個隨機視野進行拍照,計數視野內穿過8 μm微孔的細胞數,取其均值制作統計圖,評估結腸癌細胞的遷移能力。
取4 °C預冷的不含血清的空培養基按1∶8比例稀釋Matrigel,每個小室鋪Matrigel 80 μL,取對數生長期的結腸癌細胞以PBS溶液洗滌3次后,計數1×105個細胞重懸于100 μL無血清培養基接種于上室,下室加入完全培養基,孵育24 h后用95%的乙醇棉簽擦去細胞,加入預冷的4%多聚甲醛置于搖床上緩慢搖勻15 min固定。將固定好的細胞烘干,使用1%結晶紫染色10 min,PBS溶液洗滌3次,置于100倍顯微鏡下取5個隨機視野進行拍照計數視野內穿過8 μm微孔的細胞數,取其均值制作統計圖,評估結腸癌細胞的侵襲能力。
1.3.11 蘇木素-伊紅(hematoxylin-eosin,HE)染色觀察組織形態學變化
收集組織標本以預冷的4%多聚甲醛在4 °C下固定2 h后進行低溫保護處理,置于30%蔗糖溶液中4 °C過夜。將固定好的組織進行液體石蠟包埋:依次置于50%、60%、70%、80%、90%濃度梯度乙醇中分別浸泡1.5 h,再于95%乙醇中浸泡1 h,然后置于100%乙醇Ⅰ及Ⅱ中分別浸泡10 min使組織脫水。置于二甲苯Ⅰ及Ⅱ中各浸泡10 min后,將組織浸于65 °C石蠟中1 h包埋成組織塊。包埋好后對蠟塊組織連續切片,切片厚度為6.0 μm,用涂有多聚賴氨酸的切片鋪片,防止標本脫落。預冷的丙酮浸泡10 min后70 °C烘干,行HE染色后,分別置于95%乙醇Ⅰ和Ⅱ中各2 min,無水乙醇Ⅰ和Ⅱ中各2 min,苯酚二甲苯溶液處理5 min后置于二甲苯溶液透明處理10 min;最后用中性樹膠封片,切片做好標記后置于光學顯微鏡下觀察組織形態學改變。
1.4 統計學方法
采用SPSS 22.0(IBM,美國)或GraphPad Prism 8.0(GraphPad Software,美國)統計軟件進行統計學分析。計量資料比較采用單因素方差分析,率的比較采用成組χ2檢驗。檢驗水準α=0.05。
2 結果
2.1 高糖飲食與CRC侵襲轉移及鐵自噬的相關性
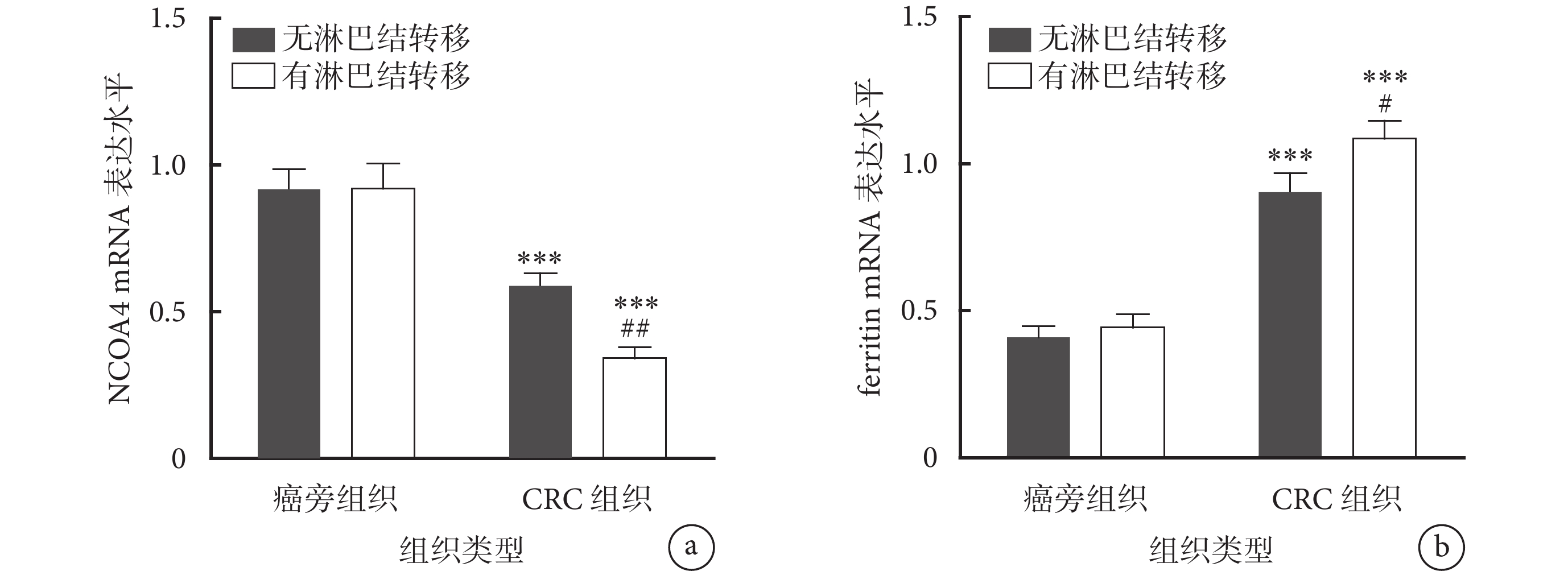
本研究共納入2022年10月至2023年10月期間于哈爾濱醫科大學附屬第二醫院普外科接受手術治療的66例CRC患者,根據調查問卷結果將其分為高糖飲食組和正常飲食組,2組患者的年齡、性別、腫瘤直徑、分化程度、CEA水平和CA19-9水平比較差異均無統計學意義(P>0.05)。然而,高糖飲食組伴有淋巴結轉移和Ⅲ/Ⅳ期患者的比例均高于正常飲食組(P=0.004、P=0.004),見表1。然后,本研究通過RT-qPCR方法檢測了鐵自噬標志物NCOA4和ferritin在CRC組織及其癌旁組織中的表達水平。如圖1a、1b所示,與癌旁組織(包括有、無淋巴結轉移)相比,NCOA4在無淋巴結轉移和有淋巴結轉移的CRC腫瘤組織中的表達水平下調(P<0.001),在伴有淋巴結轉移的CRC腫瘤組織中表達水平更低(P<0.01);而ferritin在無淋巴結轉移和有淋巴結轉移的CRC腫瘤組織中表達水平上調,在伴有淋巴結轉移的CRC腫瘤組織中表達水平更高(P<0.05)。根據NCOA4、ferritin在CRC腫瘤組織的中位相對表達量將其分為高、低表達,如表2所示,高糖飲食與CRC患者腫瘤組織中NCOA4的表達水平呈負相關(P=0.008),與ferritin表達水平呈正相關性(P<0.001)。
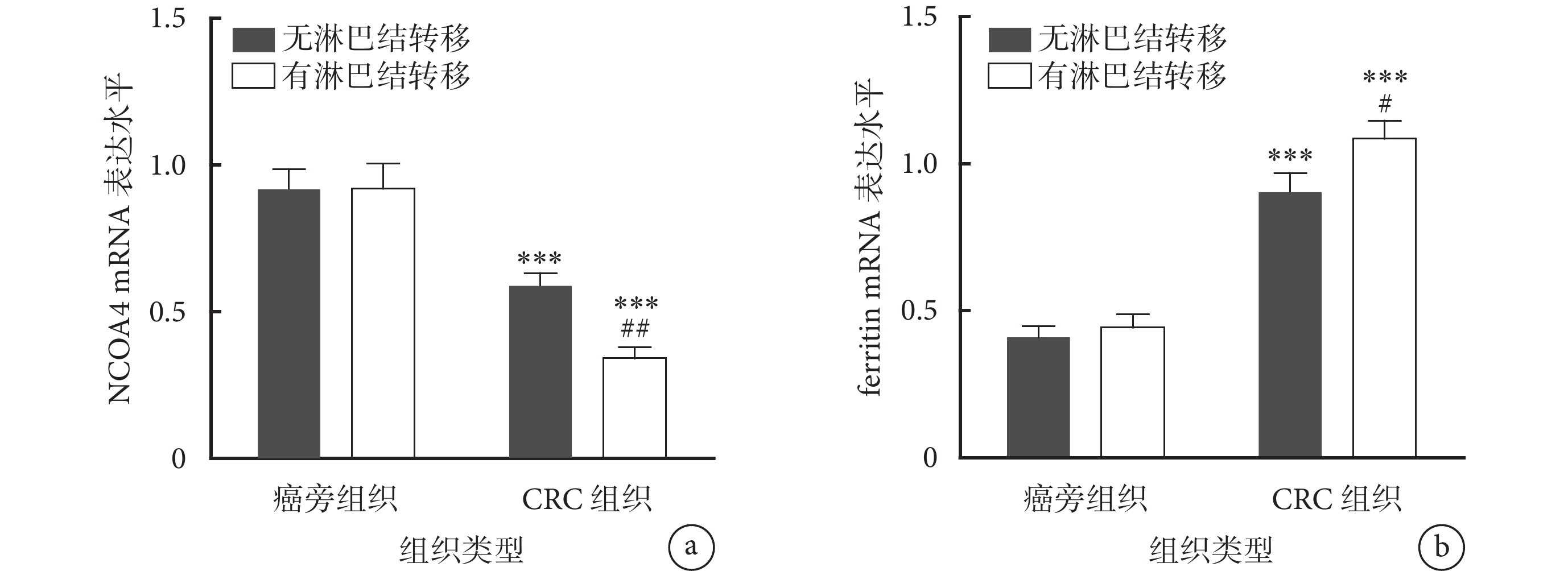 圖1
示CRC組織及其癌旁組織中NCOA4以及ferritin的表達水平比較
圖1
示CRC組織及其癌旁組織中NCOA4以及ferritin的表達水平比較
a:NCOA4在無淋巴結轉移和有淋巴結轉移的CRC組織中表達水平下調,在伴有淋巴結轉移的CRC組織中表達水平更低;b:ferritin在無淋巴結轉移和有淋巴結轉移的CRC組織中表達水平上調,在伴有淋巴結轉移的CRC腫瘤組織中表達水平更高。與癌旁組織(包括有、無淋巴結轉移)比較,
2.2 高濃度葡萄糖抑制鐵自噬并促進CRC細胞侵襲轉移
研究[12]表明高濃度葡萄糖具有抑制鐵自噬并促進多種人類惡性腫瘤細胞增殖分化的作用。為了分析高濃度葡萄糖對HT29和HCT116 CRC細胞鐵自噬的調節作用以及對細胞增殖分化的影響,本研究以不同濃度葡萄糖處理CRC細胞系,結果如圖2a所示:高濃度葡萄糖顯著促進CRC細胞的增殖分化,其效果隨葡萄糖濃度的增加(0、35、70、105、140 mmol/L)變得更加顯著。細胞毒性實驗分析結果如圖2b所示,當葡萄糖濃度達到140 mmol/L處理時,結腸癌細胞表現出顯著的細胞毒性作用。因此,后續實驗中采用105 mmol/L作為最適濃度。如圖2c所示,與對照組相比,高糖組HT29和HCT116細胞中自噬小體數量顯著減少;在圖2d~2g所示的western blot實驗中,高濃度葡萄糖處理顯著下調HT29和HCT116細胞的NCOA4表達,促進ferritin表達。在細胞劃痕(圖2h~2j)和侵襲小室實驗(圖2k~2n)中,本研究發現以高濃度葡萄糖培養HT29和HCT116細胞后顯著提高細胞的遷移侵襲能力:與對照組比較,高糖組HT29和HCT116的劃痕愈合度較低(P<0.05)、遷移和侵襲細胞數較高(P<0.05)。
 圖2
示高濃度葡萄糖抑制鐵自噬并促進CRC細胞侵襲轉移
圖2
示高濃度葡萄糖抑制鐵自噬并促進CRC細胞侵襲轉移
a:高濃度葡萄糖呈濃度依賴性促進CRC細胞的增殖分化;b:當葡萄糖濃度達到140 mmol/L時,結腸癌細胞表現出顯著的細胞毒性作用;c:高糖組HT29和HCT116細胞中自噬小體數量顯著減少,黑箭所指為自噬小體;d~g:HT29和HCT116細胞中,高濃度葡萄糖處理均下調NCOA4表達,促進ferritin表達;h~j:細胞劃痕實驗表明高濃度葡萄糖促進CRC細胞遷移(h、i:×10);k~n:細胞遷移與侵襲實驗證實高濃度葡萄糖促進CRC細胞的遷移侵襲(k、m:結晶紫染色 ×100);與對照組相比,*
2.3 mTOR/RAGE信號通路參與調控高濃度葡萄糖抑制鐵自噬,促進CRC細胞侵襲轉移
為了驗證高濃度葡萄糖通過調控mTOR/RAGE信號通路抑制鐵自噬、促進CRC細胞侵襲轉移過程,本研究以高濃度葡萄糖和RAGE特異性siRNAs處理HT29和HCT116細胞。如圖3a所示,與對照組相比,高糖組HT29和HCT116細胞的自噬小體顯著減少,si-RAGE組HT29和HCT116細胞內自噬小體顯著增多;與高糖組比較,高糖+si-RAGE組HT29和HCT116細胞中自噬小體顯著增多。如圖3b~3e所示,與對照組比較,高糖組HT29和HCT116細胞中RAGE、p-mTOR、ferritin表達上調(P<0.001),NCOA4表達下調(P<0.001);si-RAGE組RAGE、mTOR、ferritin表達下調(P<0.001),NCOA4表達上調(P<0.001)。與高糖組比較,高糖+si-RAGE組RAGE、p-mTOR、ferritin表達下調(P<0.001),NCOA4表達上調(P<0.001)。結果表明,高濃度葡萄糖下調CRC細胞NCOA4表達,促進p-mTOR、RAGE以及ferritin表達;si-RAGE處理后CRC細胞NCOA4表達上調,p-mTOR、RAGE以及ferritin表達下調;重要的是,在si-RAGE處理CRC細胞后,高濃度葡萄糖對CRC細胞NCOA4表達的抑制效果以及對p-mTOR、RAGE和ferritin表達的促進作用均顯著減弱。
 圖3
示高濃度葡萄糖激活mTOR/RAGE信號通路,抑制鐵自噬,促進CRC細胞侵襲轉移
圖3
示高濃度葡萄糖激活mTOR/RAGE信號通路,抑制鐵自噬,促進CRC細胞侵襲轉移
a:與對照組比較,高糖組HT29和HCT116細胞內自噬小體顯著減少,si-RAGE組細胞內自噬小體顯著增多,而與高糖組比較,高糖+si-RAGE組細胞內自噬小體數量增多(黑箭所指為自噬小體)。b~e:與對照組比較,高糖組HT29和HCT116細胞中NCOA4表達下調,p-mTOR、RAGE以及ferritin表達上調,si-RAGE組NCOA4表達上調,p-mTOR、RAGE以及ferritin表達下調;而與高糖組比較,高糖+si-RAGE組細胞中NCOA4表達上調,p-mTOR、RAGE和ferritin表達下調。f~g:細胞劃痕實驗表明與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較低,si-RAGE組較高;與高糖組比較,高糖+si-RAGE組的劃痕愈合度較高( ×10)。h~j:細胞遷移與侵襲實驗表明,與對照組比較,高糖組HT29和HCT116細胞的遷移侵襲數量高,si-RAGE組較低;與高糖組比較,高糖+si-RAGE組的遷移侵襲數量較低(結晶紫染色 ×100)。與對照組相比,*
在細胞劃痕(圖3f~3g)中,與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較低(P<0.05),si-RAGE組較高(P<0.05);與高糖組比較,高糖+si-RAGE組的劃痕愈合度較高(P<0.05)。在遷移侵襲小室實驗(圖3h~3j)中,與對照組比較,高糖組的遷移侵襲數量高(P<0.05),si-RAGE組較低(P<0.05);與高糖組比較,高糖+si-RAGE組的遷移侵襲數量較低(P<0.05)。表明高濃度葡萄糖顯著提高了CRC細胞的遷移侵襲能力,si-RAGE處理后CRC細胞遷移侵襲能力降低;在沉默CRC細胞RAGE表達后,高濃度葡萄糖對CRC細胞遷移和侵襲能力的促進作用均顯著減弱。上述實驗結果表明,mTOR/RAGE信號通路參與調控高濃度葡萄糖抑制鐵自噬,促進CRC細胞侵襲轉移。
2.4 高濃度葡萄糖調控的鐵自噬參與促進CRC細胞侵襲轉移
為了驗證高濃度葡萄糖調控的鐵自噬參與促進CRC細胞侵襲轉移過程,本研究以高濃度葡萄糖和鐵自噬激活劑雷帕霉素處理HT29和HCT116細胞。如圖4a所示,與對照組相比,高糖組HT29和HCT116細胞的自噬小體顯著減少,雷帕霉素組細胞內自噬小體顯著增多;與高糖組比較,高糖+雷帕霉素組細胞的自噬小體明顯增加,提示雷帕霉素削弱了高濃度葡萄糖對CRC細胞鐵自噬的抑制作用。圖4b~4e western blot實驗結果表明,與對照組比較,高糖組HT29和HCT116細胞中NCOA4表達下調(P<0.05),ferritin表達上調(P<0.05);雷帕霉素組NCOA4表達上調(P<0.05),ferritin表達下調(P<0.05);與高糖組比較,高糖+雷帕霉素組NCOA4表達上調(P<0.05),ferritin表達下調(P<0.05),提示在雷帕霉素處理CRC細胞后,高濃度葡萄糖對CRC細胞NCOA4表達的抑制效果以及對ferritin表達的促進作用均顯著減弱。
 圖4
示高濃度葡萄糖調控的鐵自噬促進CRC細胞侵襲轉移
圖4
示高濃度葡萄糖調控的鐵自噬促進CRC細胞侵襲轉移
a:與對照組比較,高糖組HT29和HCT116細胞內自噬小體顯著減少,雷帕霉素組細胞內自噬小體顯著增多,而與高糖組比較,高糖+雷帕霉素組細胞內自噬小體數量增多(黑箭所指為自噬小體)。b~e:與對照組比較,高糖組HT29和HCT116細胞中NCOA4表達下調、ferritin表達上調,雷帕霉素組NCOA4表達上調、ferritin表達下調;與高糖組比較,高糖+雷帕霉素組細胞中NCOA4表達上調,ferritin表達下調。f~g:細胞劃痕實驗表明與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較高,雷帕霉素組較低;與高糖組比較,高糖+雷帕霉素組的劃痕愈合度較低( ×10)。h~j:細胞遷移與侵襲實驗表明與對照組比較,高糖組HT29和HCT116細胞的遷移侵襲數量高,雷帕霉素組較低;與高糖組比較,高糖+雷帕霉素組的遷移侵襲數量較低(結晶紫染色 ×100)。與對照組比較,*
在細胞劃痕(圖4f~4g)中,與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較低(P<0.05),雷帕霉素組較高(P<0.05);與高糖組比較,高糖+雷帕霉素組的劃痕愈合度較高(P<0.05)。在遷移侵襲小室實驗(圖4h~4j)中,與對照組比較,高糖組的遷移侵襲數量高(P<0.05),雷帕霉素組較低(P<0.05);與高糖組比較,高糖+雷帕霉素組的遷移侵襲數量較低(P<0.05)。提示高濃度葡萄糖顯著提高了CRC細胞的遷移侵襲能力,雷帕霉素處理后CRC細胞遷移侵襲能力降低;在雷帕霉素處理CRC細胞后,高濃度葡萄糖對CRC細胞遷移和侵襲能力的促進作用均顯著減弱。以上實驗結果表明,高濃度葡萄糖環境下抑制的鐵自噬參與促進CRC細胞侵襲轉移。
2.5 高糖飲食通過mTOR/RAGE信號通路促進大鼠CRC發生發展
本研究采用AOM誘導的大鼠原位CRC模型進一步驗證高糖飲食通過mTOR/RAGE信號通路抑制鐵自噬,促進CRC發生發展過程。如圖5a所示,與對照組相比,高糖飲食組大鼠的結直腸腫瘤數量增多(P<0.05)。如圖5b和5c所示,對照組大鼠結直腸腫瘤組織可見典型的黏膜內癌,腫瘤呈現不規則腺體結構,可見典型的異型性細胞核;高糖飲食組大鼠腫瘤組織中黏膜內癌的分化程度顯著降低,腺體結構嚴重不規則,炎性細胞的浸潤情況較對照組明顯增加,細胞核異型性明顯增加。為進一步明確高糖飲食對大鼠CRC形成的促進機制,本研究通過RT-qPCR方法檢測2組大鼠結直腸組織中NCOA4、ferritin、RAGE以及mTOR的表達情況,如圖5d~5g所示:與對照組相比,高糖飲食組大鼠結直腸腫瘤組織中NCOA4表達水平降低(P<0.05),ferritin、RAGE以及mTOR表達水平增高(P<0.05)。以上實驗結果表明高糖飲食通過mTOR/RAGE信號通路抑制鐵自噬,促進實驗動物CRC發生發展。
 圖5
示高糖飲食激活mTOR/RAGE信號通路,促進大鼠CRC發生發展
圖5
示高糖飲食激活mTOR/RAGE信號通路,促進大鼠CRC發生發展
a:與對照組相比,高糖飲食組大鼠結直腸腫瘤數量增多。b、c:腫瘤組織HE染色示對照組大鼠(b)結直腸腫瘤組織可見典型的黏膜內癌,腫瘤呈現不規則腺體結構,可見典型的異型性細胞核;高糖飲食組大鼠(c)腫瘤組織中黏膜內癌的分化程度顯著降低,腺體結構嚴重不規則,炎性細胞的浸潤情況較對照組明顯增加,細胞核異型性明顯增加(HE ×400)。d~g:與對照組相比,高糖飲食組大鼠結直腸腫瘤組織中NCOA4表達水平降低(d),ferritin(e)、RAGE(f)以及mTOR(g)表達水平增高。與對照組相比,*
3 討論
碳水化合物是日常膳食的重要組成部分,作為細胞結構的主要成分和主要供能物質,可調節人體細胞活動、腸道菌群結構、表觀遺傳和內分泌代謝,由此調控人類惡性腫瘤的發生發展[13-14]。葡萄糖是人類日常膳食中最常見的單糖,Miles等[15]對包含22 720例男性的癌癥篩查樣本庫進行數據分析后發現,精制糖的攝入量與前列腺癌患病風險存在正相關性。另有研究表明過量精制糖的攝入可能增加非酒精性肝硬化相關肝癌的發生風險[16]。一項針對歐洲人群的流行病學研究[4]提示,精制糖的攝入量與男性群體的CRC發生存在低度正相關性,與女性群體存在中度正相關性。近期發表于Science的研究[5]表明:敲除APC基因的小鼠經長期喂食高果糖飲食后,CRC腫瘤體積顯著增大、惡性程度更高,提示長期過量精制糖的攝入可能是CRC發生發展的獨立危險因素。本研究通過分析收集的CRC患者臨床病例資料發現,日常生活中碳水化合物攝入量偏高的患者更容易出現淋巴結轉移和較晚的TNM分期,并且其腫瘤組織中鐵自噬水平相對較低。越來越多的研究表明,鐵自噬是細胞鐵死亡和自噬之間非常重要的對話方式,敲除鐵自噬關鍵蛋白NCOA4或自噬關鍵蛋白(autophagy-related gene,ATG),均會導致鐵自噬被抑制,進而抑制鐵死亡[17-18],這也是鐵自噬被用來發揮抑制腫瘤細胞增殖分化的理論基礎[19]。本實驗中,筆者在CRC原位動物模型和CRC細胞系中均證實了猜測,即高濃度葡萄糖具有抑制CRC細胞鐵自噬的作用,本研究發現以自噬激活劑雷帕霉素激活CRC細胞鐵自噬后,高濃度葡萄糖對CRC細胞遷移和侵襲能力的增強作用顯著減弱,這表明高濃度葡萄糖環境下抑制的鐵自噬參與促進了CRC細胞的侵襲轉移。然而,本研究也存在不足:雷帕霉素是細胞自噬的激活劑,并非鐵自噬的特異性激活劑,因此雷帕霉素激活了包括但不限于鐵自噬的全部自噬,在今后的研究中筆者將進一步采用特異性鐵自噬激活劑深入挖掘高濃度葡萄糖環境下抑制的鐵自噬對CRC細胞侵襲轉移的影響。
基于腫瘤細胞Warburg效應下的糖代謝特點,腫瘤細胞增殖速率與可利用碳水化合物的攝入量存在正相關性[20]。過量碳水化合物的攝入導致體內葡萄糖與蛋白質、脂質或核酸的自由氨基經過一系列復雜的非酶觸反應,形成大量晚期糖基化終末產物(advanced glycation end products,AGEs),其受體RAGE隨著AGEs的升高而積聚,二者相互作用具有促進腫瘤生長、滋養血管形成及腫瘤轉移的作用[21]。同時,AGEs/RAGE信號也是細胞自噬和鐵死亡程序的關鍵調控因子。有研究[22]報道楓樹糖漿通過抑制AGEs/RAGE信號激活抑制CRC細胞自噬,進而發揮抑制CRC細胞增殖分化的作用。有趣的是,高糖環境下AGEs/RAGE信號被異常激活,其介導的鐵死亡程序參與調控2型糖尿病的發生進展[23]。本研究結果表明,沉默CRC細胞RAGE表達后,CRC細胞鐵自噬被激活,細胞遷移侵襲能力降低;更重要的是,在沉默CRC細胞RAGE表達后,高濃度葡萄糖對CRC細胞鐵自噬的抑制作用被削弱,對CRC細胞遷移和侵襲能力的促進作用也隨之減弱。本動物實驗同樣表明,經高糖喂養的大鼠結直腸腫瘤數量明顯增多,黏膜內癌的分化程度更低,鐵自噬顯著被抑制,RAGE表達量異常增高。
鐵自噬是由NCOA4作為伴侶分子所介導的一種特異性自噬,NCOA4通過特異性地識別結合細胞內結合鐵離子的鐵蛋白,并將其轉運至溶酶體降解并釋放出游離鐵離子。鐵蛋白是細胞內鐵離子儲存的重要結構,由鐵蛋白重鏈(ferritin heavy chain)和輕鏈(ferritin light chain)亞基組成鐵蛋白復合體[24]。研究[25]表明,細胞鐵死亡過程中所依賴的鐵離子來自鐵自噬釋放的鐵離子,因此鐵死亡被認為屬于自噬依賴的細胞死亡過程。眾所周知,mTOR信號是調控自噬的關鍵分子,有研究[26]表明酚甲烷通過誘導腎小管上皮細胞鐵死亡導致腎損傷,這一過程需要mTOR/UNC51樣激酶1(UNC51-like kinase-1,ULK1)信號通路介導的鐵自噬參與。高糖通過激活單磷酸腺苷依賴蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)/mTOR信號通路誘導成骨細胞鐵自噬進而促進細胞鐵死亡,加重2型糖尿病患者的骨質疏松[27]。納米氧化鋅通過AMPK/mTOR信號通路調節鐵自噬促進血管內皮細胞鐵死亡[28]。本研究結果表明,高濃度葡萄糖導致mTOR信號磷酸化激活,抑制CRC細胞鐵自噬,增強CRC細胞的遷移和侵襲能力;在沉默CRC細胞RAGE表達后,高濃度葡萄糖對CRC細胞mTOR信號的激活效果、對鐵自噬的抑制作用以及對CRC細胞遷移和侵襲能力的促進作用均被削弱。本研究尚存在一些不足:本研究采用RT-qPCR方法檢測大鼠結直腸組織中NCOA4、ferritin、RAGE以及mTOR的mRNA表達情況,并未對上述基因蛋白表達情況進行檢測,在今后的研究中筆者將進一步對NCOA4、ferritin、RAGE以及mTOR在大鼠結直腸組織中的蛋白表達情況進行分析。
綜上所述,本研究結果證實高糖飲食促進CRC發生發展,CRC細胞長期暴露高糖環境下后鐵自噬被抑制,導致CRC細胞的遷移侵襲能力增強,其作用機制與mTOR/RAGE信號通路的異常激活及過度磷酸化密切相關。本研究揭示了長期高碳水化合物飲食促進CRC發展的潛在機制,豐富了國民對健康飲食降低CRC患病的認識,為通過改善飲食習慣從而尋求針對CRC的預防提供了理論依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:喬鵬飛完成實驗設計;熊梟、陳豪、李元亮、唐研共同進行實驗、收集數據并做統計分析;喬鵬飛、熊梟和張好剛共同完成論文寫作。
倫理聲明:本研究已通過哈爾濱醫科大學附屬第二醫院倫理委員會的倫理審核批準(批文編號:KY2020-122)。
結直腸癌(colorectal cancer,CRC)是世界范圍內發病率較高的惡性腫瘤,目前仍有增高趨勢,可能與飲食結構逐漸西方化有關。雖然近年來診療技術不斷提高,但仍有許多晚期患者因復發轉移而死亡[1]。因此,深入探討CRC發生發展機制,尋求針對CRC的預防、早期診斷和新的治療策略,對于降低CRC死亡率以及改善患者預后具有重要意義。碳水化合物作為細胞結構的主要成分參與調節人體多種生理和病理過程[2]。過量攝入碳水化合物與CRC的發生密切相關,調查發現每天飲用超過2份含糖飲料的Ⅲ期CRC患者復發率和病死率顯著增高[3]。2018年針對歐洲國家的研究[4]發現,精制糖的攝入量與男性群體的CRC發生存在低度正相關性,與女性群體存在中度正相關性。Science發表的研究[5]表明:敲除腫瘤抑制基因APC的小鼠經喂食高果糖玉米糖漿后,CRC腫瘤體積顯著增大、惡性程度更高。
鐵自噬是一種細胞調控鐵離子代謝的自噬類型,該過程由核受體輔助激活因子4(nuclear receptor coactivator 4,NCOA4)介導,結合鐵離子的鐵蛋白(ferritin)被NCOA4識別并結合后被轉運至溶酶體吞噬泡膜上形成自噬小體,然后被溶酶體降解并釋放出游離亞鐵離子[6-7]。研究[8]顯示,鐵自噬釋放出的游離亞鐵離子是鐵死亡發生的重要條件之一。鐵自噬在多種人類疾病的發病過程中發揮重要調控作用。近期研究[9]表明,高脂飲食通過抑制鐵死亡,誘導小鼠結腸炎以及炎性相關腸癌的發生發展。本研究中,筆者將通過實驗驗證高糖飲食激活的哺乳動物雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,mTOR)/晚期糖基化終末產物受體RAGE(receptor of advanced glycation end products,RAGE)信號通路通過抑制鐵自噬,發揮促進CRC侵襲轉移的作用。
1 材料與方法
1.1 研究對象
1.1.1 臨床病例
以多階段整群隨機抽取和自愿參與的形式招募2022年10月至2023年10月期間于哈爾濱醫科大學附屬第二醫院接受手術治療的CRC患者,本研究方案取得哈爾濱醫科大學倫理委員會的批準(KY2020-122),研究遵循赫爾辛基宣言所規定的道德標準,所有自愿者都被充分告知程序,所有參與研究的患者均簽署了哈爾濱醫科大學倫理委員會提供的知情同意書。最終有66例進入研究,網絡食物頻率問卷和填寫方式參見文獻[10]。術中收集上述CRC患者的腫瘤組織及其癌旁結直腸組織標本,貯存于–80 °C超低溫冰箱中保存備用。記錄上述患者的姓名、性別、年齡、就診時間、聯系電話等個人資料,記錄病理診斷中描述的腫瘤部位、大小、病理學分型,有無淋巴結轉移,TNM分期,并記錄癌胚抗原(carcinoembryonic antigen,CEA)和CA19-9水平。
1.1.2 CRC細胞
人結腸癌細胞系HT29以及HCT116常規培養于含10%胎牛血清的RPMI1640培養基中,培養基中均加入1%雙抗(青霉素、鏈霉素100 U/mL),置于37 °C、5% CO2培養箱中恒溫培養。48~72 h傳代。
1.1.3 實驗動物
SPF級3周齡雄性SD大鼠共16只,體質量約50 g/只,由哈爾濱獸醫研究所動物實驗中心提供,飼養于哈爾濱獸醫研究所動物實驗中心,3只/籠,實驗室環境溫度為(23±3)°C,相對濕度為(55±15)%,晝夜明暗交替時間為12 h/12 h,每3天更換墊料。本研究方案取得哈爾濱醫科大學倫理委員會的批準(KY2020-122)。
1.2 主要試劑和儀器
氧化偶氮甲烷(azoxymethane,AOM,
1.3 實驗方法
1.3.1 網絡食物頻率問卷
網絡食物頻率問卷包括我國南北方常食用的谷類及制品、薯類淀粉及其制品、豆類及其制品、蔬菜類食品、菌藻類、鮮果、堅果及種子類、家畜類及其食品、禽肉類及其食品、乳類及制品、蛋類及其食品、魚蝦蟹貝類、速食食品、糖及蜜餞類、飲料、調味品、其他,共17大類136種食物。調查中用各種標有食物重量的圖片和容器進行定量,幫助受調查者判斷攝入量。根據《中國食物成分表》計算能量和營養素攝入量;根據每月家庭總用油/鹽量÷30÷家中人數計算每天的人均用油/鹽量。在認真填寫完網絡食物頻率問卷后,每個被調查者將獲得1份詳細的膳食評估反饋,根據膳食評估反饋,將反饋結果為“蛋白質供能適宜,脂肪供能適宜,碳水化合物供能偏高”的CRC患者定義為高糖飲食組,將反饋結果為“蛋白質供能適宜,脂肪供能適宜,碳水化合物供能適宜”的CRC患者定義為正常飲食組[10]。
1.3.2 實驗動物分組
將大鼠隨機分為對照組和高糖飲食組,每組8只,大鼠經適應性飼養1周后,每周給予濃度為15 mg/kg的AOM腹腔注射,持續7周,每日觀察動物一般情況。對照組大鼠給予基礎飼料喂養,高糖飲食組給予80%基礎飼料+20%葡萄糖飼養。首次注射AOM后3個月,采用脫頸椎法處死大鼠,結直腸組織完整取材并以PBS緩沖液沖洗,所有實驗大鼠均可見結直腸腫瘤,AOM建模成功率為100%,記錄肉眼可見的結直腸腫瘤數目;將每個結直腸組織等分為2份,1份放于10%中性緩沖甲醛溶液固定并進行組織學檢查;另1份標本于–80 °C超低溫冰箱中保存用于實時熒光定量逆轉錄聚合酶鏈反應(real-time quantitative reverse transcription PCR,RT-qPCR)檢測[11]。
1.3.3 細胞的處理與分組
① 取活力良好的對數生長期HT29和HCT116細胞,以5×103個/孔接種于96孔板,待細胞融合至80%時,分別以含35、70、105、140 mmol/L葡萄糖的RPMI1640培養基培養。② 取活力良好的對數生長期HT29和HCT116細胞分為對照組、高糖培養組、靶向RAGE的siRNA轉染組(si-RAGE組)、靶向RAGE的siRNA轉染同時以高糖培養組(高糖+si-RAGE組)。③ 取活力良好的對數生長期HT29和HCT116細胞分為對照組、高糖培養組、鐵自噬激活劑處理組(雷帕霉素組)、鐵自噬激活劑處理同時以高糖培養組(高糖+雷帕霉素組)。④ 各組細胞處理:對照組為未經任何處理的HT29和HCT116細胞;高糖組以含105 mmol/L葡萄糖的RPMI1640培養基培養HT29和HCT116細胞48 h。si-RAGE組以RAGE siRNAs轉染HT29和HCT116細胞6 h,si-RAGE轉染CRC細胞操作按照說明書進行,轉染后6 h更換新鮮培養液繼續培養。雷帕霉素組為以10 nmol/L雷帕霉素處理HT29和HCT116細胞48 h。高糖+si-RAGE組以含105 mmol/L葡萄糖的RPMI1640培養基培養HT29和HCT116細胞48 h的同時以RAGE siRNAs轉染HT29和HCT116細胞6 h。高糖+雷帕霉素組以含105 mmol/L葡萄糖的RPMI1640培養基培養HT29和HCT116細胞48 h的同時以10 nmol/L雷帕霉素處理HT29和HCT116細胞48 h。每組均設6個復孔。
1.3.4 RT-qPCR
按Trizol試劑盒說明書操作提取標本的總RNA,按試劑盒說明書逆轉錄為cDNA。根據Genebank序列設計、合成目的基因引物,以PCR進行擴增,采用β-actin為內參,具體操作按試劑盒說明書進行。以2–??Ct表示每個目的基因的相對表達量,?Ct=CtmRNA–Ctβ-actin,實驗重復3次。RAGE上游引物為5’-GAATCCTCCCCAATGGTTCA-3’,下游引物為5’-GCCCGACACCGGAAAGT-3’;mTOR上游引物為5’-TCCGAGAGATGAGTCAAGAGG-3’,下游引物為5’-CACCTTCCACTCCTATGAGGC-3’;NCOA4上游引物為5’-TACCCAAAAGCAGACCTTGG-3’,下游引物為5’-CGCCTTCTCCTAGAGTTTTTCC-3’;ferritin上游引物為5’-CCCCCATTTGTGTGACTTCAT-3’,下游引物為5’-GCCCGAGGCTTAGCTTTCATT-3’;β-actin上游引物為5’-ATGTTGAGACCTTCAACACC-3’,下游引物為5’-AGGTAGTCAGTCAGGTCCCGGCC-3’。
1.3.5 蛋白免疫印跡(western blot)實驗
提取樣本總蛋白,聚丙烯酰胺凝膠電泳分離后采用半干法轉膜,10%脫脂牛奶封閉2 h,洗滌后加入目的蛋白的一抗(1∶500),4 °C過夜孵育,次日加入Alexa Fluor 680驢抗鼠IgG(H+L)或Alexa Fluor 680驢抗兔IgG(H+L)二抗(1∶5 000),37 °C孵育1 h。洗滌后采用Odyssey?近紅外成像系統檢測目的蛋白的相對表達水平。
1.3.6 細胞存活率的檢測
取對數生長期的HT29、HCT116細胞接種于96孔板中(3×103個/mL),以含10%血清的培養基培養24 h后將培養基更換為實驗組培養基繼續培養,24 h后每孔加入細胞計數試劑盒CCK-8工作液10 μL,培養2 h后,在570 nm處測定吸光度(A)值。實驗重復3次。細胞存活率(%)=實驗組A值/對照組A值×100%。
1.3.7 細胞毒性的檢測
取對數生長期的HT29、HCT116細胞以5×103個/孔均勻接種于96孔板,每組設6個復孔。每孔加入LDH釋放液10 μL,孵育1 h后以400 g離心5 min,取上清液,使用LDH檢測試劑盒按說明書加入LDH檢測液后,于450 nm波長處測定A值。LDH活性(%)=(樣本A值–無細胞的空白孔A值)–溶劑對照組平均A值/(陽性對照組平均A值–溶劑對照組平均A值)×100%。
1.3.8 透射電鏡觀察鐵自噬體的形成
收集HT29、HCT116細胞,加入預冷的戊二醛1 mL固定,洗滌后以1%四氧化鋨置于4 °C條件下固定2 h,依次置入30%、50%、70%、80%、90%和100%乙醇中脫水,吸凈脫水劑,以體積比1∶1加入3 mL純丙酮-EPON 812,室溫靜置30 min后,加入純包埋劑1 mL,固化。顯微鏡下修正包塊,制備超薄切片,使用醋酸雙氧鈾染色,沖洗晾干后于電鏡(Jeol,日本)下觀察記錄并拍照。
1.3.9 劃痕實驗
將生長狀態良好的HT29、HCT116細胞鋪入6孔板中,每組設6個復孔,待細胞融合度達80%后給予實驗處理,暴露24 h后垂直板底劃直線,PBS溶液清洗漂浮的細胞后立即拍照記錄;隨后將6孔板置于37 °C、5% CO2培養箱中恒溫培養,48 h后棄去培養上清,以PBS溶液清洗后拍照記錄。采用Image J軟件計算空白劃痕的面積,按照公式:(0 h的劃痕面積–48 h后的劃痕面積)/0 h的劃痕面積,計算HT29、HCT116細胞的劃痕與合度。
1.3.10 細胞遷移與侵襲實驗
取對數生長期的HT29、HCT116細胞以PBS溶液洗滌3次后,計數1×105個細胞重懸于100 μL無血清培養基,接種于上室,在下室加入600 μL含有10%胎牛血清的完全培養基。孵育24 h后取出小室,以95%的乙醇棉簽擦去上室的細胞,加入預冷的4%多聚甲醛固定。靜置15 min后,使用PBS溶液洗滌3次,每次5 min。烘干后,加入1%結晶紫染色10 min,PBS溶液洗滌3次。置于100倍顯微鏡下每張膜取5個隨機視野進行拍照,計數視野內穿過8 μm微孔的細胞數,取其均值制作統計圖,評估結腸癌細胞的遷移能力。
取4 °C預冷的不含血清的空培養基按1∶8比例稀釋Matrigel,每個小室鋪Matrigel 80 μL,取對數生長期的結腸癌細胞以PBS溶液洗滌3次后,計數1×105個細胞重懸于100 μL無血清培養基接種于上室,下室加入完全培養基,孵育24 h后用95%的乙醇棉簽擦去細胞,加入預冷的4%多聚甲醛置于搖床上緩慢搖勻15 min固定。將固定好的細胞烘干,使用1%結晶紫染色10 min,PBS溶液洗滌3次,置于100倍顯微鏡下取5個隨機視野進行拍照計數視野內穿過8 μm微孔的細胞數,取其均值制作統計圖,評估結腸癌細胞的侵襲能力。
1.3.11 蘇木素-伊紅(hematoxylin-eosin,HE)染色觀察組織形態學變化
收集組織標本以預冷的4%多聚甲醛在4 °C下固定2 h后進行低溫保護處理,置于30%蔗糖溶液中4 °C過夜。將固定好的組織進行液體石蠟包埋:依次置于50%、60%、70%、80%、90%濃度梯度乙醇中分別浸泡1.5 h,再于95%乙醇中浸泡1 h,然后置于100%乙醇Ⅰ及Ⅱ中分別浸泡10 min使組織脫水。置于二甲苯Ⅰ及Ⅱ中各浸泡10 min后,將組織浸于65 °C石蠟中1 h包埋成組織塊。包埋好后對蠟塊組織連續切片,切片厚度為6.0 μm,用涂有多聚賴氨酸的切片鋪片,防止標本脫落。預冷的丙酮浸泡10 min后70 °C烘干,行HE染色后,分別置于95%乙醇Ⅰ和Ⅱ中各2 min,無水乙醇Ⅰ和Ⅱ中各2 min,苯酚二甲苯溶液處理5 min后置于二甲苯溶液透明處理10 min;最后用中性樹膠封片,切片做好標記后置于光學顯微鏡下觀察組織形態學改變。
1.4 統計學方法
采用SPSS 22.0(IBM,美國)或GraphPad Prism 8.0(GraphPad Software,美國)統計軟件進行統計學分析。計量資料比較采用單因素方差分析,率的比較采用成組χ2檢驗。檢驗水準α=0.05。
2 結果
2.1 高糖飲食與CRC侵襲轉移及鐵自噬的相關性
本研究共納入2022年10月至2023年10月期間于哈爾濱醫科大學附屬第二醫院普外科接受手術治療的66例CRC患者,根據調查問卷結果將其分為高糖飲食組和正常飲食組,2組患者的年齡、性別、腫瘤直徑、分化程度、CEA水平和CA19-9水平比較差異均無統計學意義(P>0.05)。然而,高糖飲食組伴有淋巴結轉移和Ⅲ/Ⅳ期患者的比例均高于正常飲食組(P=0.004、P=0.004),見表1。然后,本研究通過RT-qPCR方法檢測了鐵自噬標志物NCOA4和ferritin在CRC組織及其癌旁組織中的表達水平。如圖1a、1b所示,與癌旁組織(包括有、無淋巴結轉移)相比,NCOA4在無淋巴結轉移和有淋巴結轉移的CRC腫瘤組織中的表達水平下調(P<0.001),在伴有淋巴結轉移的CRC腫瘤組織中表達水平更低(P<0.01);而ferritin在無淋巴結轉移和有淋巴結轉移的CRC腫瘤組織中表達水平上調,在伴有淋巴結轉移的CRC腫瘤組織中表達水平更高(P<0.05)。根據NCOA4、ferritin在CRC腫瘤組織的中位相對表達量將其分為高、低表達,如表2所示,高糖飲食與CRC患者腫瘤組織中NCOA4的表達水平呈負相關(P=0.008),與ferritin表達水平呈正相關性(P<0.001)。
 圖1
示CRC組織及其癌旁組織中NCOA4以及ferritin的表達水平比較
圖1
示CRC組織及其癌旁組織中NCOA4以及ferritin的表達水平比較
a:NCOA4在無淋巴結轉移和有淋巴結轉移的CRC組織中表達水平下調,在伴有淋巴結轉移的CRC組織中表達水平更低;b:ferritin在無淋巴結轉移和有淋巴結轉移的CRC組織中表達水平上調,在伴有淋巴結轉移的CRC腫瘤組織中表達水平更高。與癌旁組織(包括有、無淋巴結轉移)比較,
2.2 高濃度葡萄糖抑制鐵自噬并促進CRC細胞侵襲轉移
研究[12]表明高濃度葡萄糖具有抑制鐵自噬并促進多種人類惡性腫瘤細胞增殖分化的作用。為了分析高濃度葡萄糖對HT29和HCT116 CRC細胞鐵自噬的調節作用以及對細胞增殖分化的影響,本研究以不同濃度葡萄糖處理CRC細胞系,結果如圖2a所示:高濃度葡萄糖顯著促進CRC細胞的增殖分化,其效果隨葡萄糖濃度的增加(0、35、70、105、140 mmol/L)變得更加顯著。細胞毒性實驗分析結果如圖2b所示,當葡萄糖濃度達到140 mmol/L處理時,結腸癌細胞表現出顯著的細胞毒性作用。因此,后續實驗中采用105 mmol/L作為最適濃度。如圖2c所示,與對照組相比,高糖組HT29和HCT116細胞中自噬小體數量顯著減少;在圖2d~2g所示的western blot實驗中,高濃度葡萄糖處理顯著下調HT29和HCT116細胞的NCOA4表達,促進ferritin表達。在細胞劃痕(圖2h~2j)和侵襲小室實驗(圖2k~2n)中,本研究發現以高濃度葡萄糖培養HT29和HCT116細胞后顯著提高細胞的遷移侵襲能力:與對照組比較,高糖組HT29和HCT116的劃痕愈合度較低(P<0.05)、遷移和侵襲細胞數較高(P<0.05)。
 圖2
示高濃度葡萄糖抑制鐵自噬并促進CRC細胞侵襲轉移
圖2
示高濃度葡萄糖抑制鐵自噬并促進CRC細胞侵襲轉移
a:高濃度葡萄糖呈濃度依賴性促進CRC細胞的增殖分化;b:當葡萄糖濃度達到140 mmol/L時,結腸癌細胞表現出顯著的細胞毒性作用;c:高糖組HT29和HCT116細胞中自噬小體數量顯著減少,黑箭所指為自噬小體;d~g:HT29和HCT116細胞中,高濃度葡萄糖處理均下調NCOA4表達,促進ferritin表達;h~j:細胞劃痕實驗表明高濃度葡萄糖促進CRC細胞遷移(h、i:×10);k~n:細胞遷移與侵襲實驗證實高濃度葡萄糖促進CRC細胞的遷移侵襲(k、m:結晶紫染色 ×100);與對照組相比,*
2.3 mTOR/RAGE信號通路參與調控高濃度葡萄糖抑制鐵自噬,促進CRC細胞侵襲轉移
為了驗證高濃度葡萄糖通過調控mTOR/RAGE信號通路抑制鐵自噬、促進CRC細胞侵襲轉移過程,本研究以高濃度葡萄糖和RAGE特異性siRNAs處理HT29和HCT116細胞。如圖3a所示,與對照組相比,高糖組HT29和HCT116細胞的自噬小體顯著減少,si-RAGE組HT29和HCT116細胞內自噬小體顯著增多;與高糖組比較,高糖+si-RAGE組HT29和HCT116細胞中自噬小體顯著增多。如圖3b~3e所示,與對照組比較,高糖組HT29和HCT116細胞中RAGE、p-mTOR、ferritin表達上調(P<0.001),NCOA4表達下調(P<0.001);si-RAGE組RAGE、mTOR、ferritin表達下調(P<0.001),NCOA4表達上調(P<0.001)。與高糖組比較,高糖+si-RAGE組RAGE、p-mTOR、ferritin表達下調(P<0.001),NCOA4表達上調(P<0.001)。結果表明,高濃度葡萄糖下調CRC細胞NCOA4表達,促進p-mTOR、RAGE以及ferritin表達;si-RAGE處理后CRC細胞NCOA4表達上調,p-mTOR、RAGE以及ferritin表達下調;重要的是,在si-RAGE處理CRC細胞后,高濃度葡萄糖對CRC細胞NCOA4表達的抑制效果以及對p-mTOR、RAGE和ferritin表達的促進作用均顯著減弱。
 圖3
示高濃度葡萄糖激活mTOR/RAGE信號通路,抑制鐵自噬,促進CRC細胞侵襲轉移
圖3
示高濃度葡萄糖激活mTOR/RAGE信號通路,抑制鐵自噬,促進CRC細胞侵襲轉移
a:與對照組比較,高糖組HT29和HCT116細胞內自噬小體顯著減少,si-RAGE組細胞內自噬小體顯著增多,而與高糖組比較,高糖+si-RAGE組細胞內自噬小體數量增多(黑箭所指為自噬小體)。b~e:與對照組比較,高糖組HT29和HCT116細胞中NCOA4表達下調,p-mTOR、RAGE以及ferritin表達上調,si-RAGE組NCOA4表達上調,p-mTOR、RAGE以及ferritin表達下調;而與高糖組比較,高糖+si-RAGE組細胞中NCOA4表達上調,p-mTOR、RAGE和ferritin表達下調。f~g:細胞劃痕實驗表明與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較低,si-RAGE組較高;與高糖組比較,高糖+si-RAGE組的劃痕愈合度較高( ×10)。h~j:細胞遷移與侵襲實驗表明,與對照組比較,高糖組HT29和HCT116細胞的遷移侵襲數量高,si-RAGE組較低;與高糖組比較,高糖+si-RAGE組的遷移侵襲數量較低(結晶紫染色 ×100)。與對照組相比,*
在細胞劃痕(圖3f~3g)中,與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較低(P<0.05),si-RAGE組較高(P<0.05);與高糖組比較,高糖+si-RAGE組的劃痕愈合度較高(P<0.05)。在遷移侵襲小室實驗(圖3h~3j)中,與對照組比較,高糖組的遷移侵襲數量高(P<0.05),si-RAGE組較低(P<0.05);與高糖組比較,高糖+si-RAGE組的遷移侵襲數量較低(P<0.05)。表明高濃度葡萄糖顯著提高了CRC細胞的遷移侵襲能力,si-RAGE處理后CRC細胞遷移侵襲能力降低;在沉默CRC細胞RAGE表達后,高濃度葡萄糖對CRC細胞遷移和侵襲能力的促進作用均顯著減弱。上述實驗結果表明,mTOR/RAGE信號通路參與調控高濃度葡萄糖抑制鐵自噬,促進CRC細胞侵襲轉移。
2.4 高濃度葡萄糖調控的鐵自噬參與促進CRC細胞侵襲轉移
為了驗證高濃度葡萄糖調控的鐵自噬參與促進CRC細胞侵襲轉移過程,本研究以高濃度葡萄糖和鐵自噬激活劑雷帕霉素處理HT29和HCT116細胞。如圖4a所示,與對照組相比,高糖組HT29和HCT116細胞的自噬小體顯著減少,雷帕霉素組細胞內自噬小體顯著增多;與高糖組比較,高糖+雷帕霉素組細胞的自噬小體明顯增加,提示雷帕霉素削弱了高濃度葡萄糖對CRC細胞鐵自噬的抑制作用。圖4b~4e western blot實驗結果表明,與對照組比較,高糖組HT29和HCT116細胞中NCOA4表達下調(P<0.05),ferritin表達上調(P<0.05);雷帕霉素組NCOA4表達上調(P<0.05),ferritin表達下調(P<0.05);與高糖組比較,高糖+雷帕霉素組NCOA4表達上調(P<0.05),ferritin表達下調(P<0.05),提示在雷帕霉素處理CRC細胞后,高濃度葡萄糖對CRC細胞NCOA4表達的抑制效果以及對ferritin表達的促進作用均顯著減弱。
 圖4
示高濃度葡萄糖調控的鐵自噬促進CRC細胞侵襲轉移
圖4
示高濃度葡萄糖調控的鐵自噬促進CRC細胞侵襲轉移
a:與對照組比較,高糖組HT29和HCT116細胞內自噬小體顯著減少,雷帕霉素組細胞內自噬小體顯著增多,而與高糖組比較,高糖+雷帕霉素組細胞內自噬小體數量增多(黑箭所指為自噬小體)。b~e:與對照組比較,高糖組HT29和HCT116細胞中NCOA4表達下調、ferritin表達上調,雷帕霉素組NCOA4表達上調、ferritin表達下調;與高糖組比較,高糖+雷帕霉素組細胞中NCOA4表達上調,ferritin表達下調。f~g:細胞劃痕實驗表明與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較高,雷帕霉素組較低;與高糖組比較,高糖+雷帕霉素組的劃痕愈合度較低( ×10)。h~j:細胞遷移與侵襲實驗表明與對照組比較,高糖組HT29和HCT116細胞的遷移侵襲數量高,雷帕霉素組較低;與高糖組比較,高糖+雷帕霉素組的遷移侵襲數量較低(結晶紫染色 ×100)。與對照組比較,*
在細胞劃痕(圖4f~4g)中,與對照組比較,高糖組HT29和HCT116細胞的劃痕愈合度較低(P<0.05),雷帕霉素組較高(P<0.05);與高糖組比較,高糖+雷帕霉素組的劃痕愈合度較高(P<0.05)。在遷移侵襲小室實驗(圖4h~4j)中,與對照組比較,高糖組的遷移侵襲數量高(P<0.05),雷帕霉素組較低(P<0.05);與高糖組比較,高糖+雷帕霉素組的遷移侵襲數量較低(P<0.05)。提示高濃度葡萄糖顯著提高了CRC細胞的遷移侵襲能力,雷帕霉素處理后CRC細胞遷移侵襲能力降低;在雷帕霉素處理CRC細胞后,高濃度葡萄糖對CRC細胞遷移和侵襲能力的促進作用均顯著減弱。以上實驗結果表明,高濃度葡萄糖環境下抑制的鐵自噬參與促進CRC細胞侵襲轉移。
2.5 高糖飲食通過mTOR/RAGE信號通路促進大鼠CRC發生發展
本研究采用AOM誘導的大鼠原位CRC模型進一步驗證高糖飲食通過mTOR/RAGE信號通路抑制鐵自噬,促進CRC發生發展過程。如圖5a所示,與對照組相比,高糖飲食組大鼠的結直腸腫瘤數量增多(P<0.05)。如圖5b和5c所示,對照組大鼠結直腸腫瘤組織可見典型的黏膜內癌,腫瘤呈現不規則腺體結構,可見典型的異型性細胞核;高糖飲食組大鼠腫瘤組織中黏膜內癌的分化程度顯著降低,腺體結構嚴重不規則,炎性細胞的浸潤情況較對照組明顯增加,細胞核異型性明顯增加。為進一步明確高糖飲食對大鼠CRC形成的促進機制,本研究通過RT-qPCR方法檢測2組大鼠結直腸組織中NCOA4、ferritin、RAGE以及mTOR的表達情況,如圖5d~5g所示:與對照組相比,高糖飲食組大鼠結直腸腫瘤組織中NCOA4表達水平降低(P<0.05),ferritin、RAGE以及mTOR表達水平增高(P<0.05)。以上實驗結果表明高糖飲食通過mTOR/RAGE信號通路抑制鐵自噬,促進實驗動物CRC發生發展。
 圖5
示高糖飲食激活mTOR/RAGE信號通路,促進大鼠CRC發生發展
圖5
示高糖飲食激活mTOR/RAGE信號通路,促進大鼠CRC發生發展
a:與對照組相比,高糖飲食組大鼠結直腸腫瘤數量增多。b、c:腫瘤組織HE染色示對照組大鼠(b)結直腸腫瘤組織可見典型的黏膜內癌,腫瘤呈現不規則腺體結構,可見典型的異型性細胞核;高糖飲食組大鼠(c)腫瘤組織中黏膜內癌的分化程度顯著降低,腺體結構嚴重不規則,炎性細胞的浸潤情況較對照組明顯增加,細胞核異型性明顯增加(HE ×400)。d~g:與對照組相比,高糖飲食組大鼠結直腸腫瘤組織中NCOA4表達水平降低(d),ferritin(e)、RAGE(f)以及mTOR(g)表達水平增高。與對照組相比,*
3 討論
碳水化合物是日常膳食的重要組成部分,作為細胞結構的主要成分和主要供能物質,可調節人體細胞活動、腸道菌群結構、表觀遺傳和內分泌代謝,由此調控人類惡性腫瘤的發生發展[13-14]。葡萄糖是人類日常膳食中最常見的單糖,Miles等[15]對包含22 720例男性的癌癥篩查樣本庫進行數據分析后發現,精制糖的攝入量與前列腺癌患病風險存在正相關性。另有研究表明過量精制糖的攝入可能增加非酒精性肝硬化相關肝癌的發生風險[16]。一項針對歐洲人群的流行病學研究[4]提示,精制糖的攝入量與男性群體的CRC發生存在低度正相關性,與女性群體存在中度正相關性。近期發表于Science的研究[5]表明:敲除APC基因的小鼠經長期喂食高果糖飲食后,CRC腫瘤體積顯著增大、惡性程度更高,提示長期過量精制糖的攝入可能是CRC發生發展的獨立危險因素。本研究通過分析收集的CRC患者臨床病例資料發現,日常生活中碳水化合物攝入量偏高的患者更容易出現淋巴結轉移和較晚的TNM分期,并且其腫瘤組織中鐵自噬水平相對較低。越來越多的研究表明,鐵自噬是細胞鐵死亡和自噬之間非常重要的對話方式,敲除鐵自噬關鍵蛋白NCOA4或自噬關鍵蛋白(autophagy-related gene,ATG),均會導致鐵自噬被抑制,進而抑制鐵死亡[17-18],這也是鐵自噬被用來發揮抑制腫瘤細胞增殖分化的理論基礎[19]。本實驗中,筆者在CRC原位動物模型和CRC細胞系中均證實了猜測,即高濃度葡萄糖具有抑制CRC細胞鐵自噬的作用,本研究發現以自噬激活劑雷帕霉素激活CRC細胞鐵自噬后,高濃度葡萄糖對CRC細胞遷移和侵襲能力的增強作用顯著減弱,這表明高濃度葡萄糖環境下抑制的鐵自噬參與促進了CRC細胞的侵襲轉移。然而,本研究也存在不足:雷帕霉素是細胞自噬的激活劑,并非鐵自噬的特異性激活劑,因此雷帕霉素激活了包括但不限于鐵自噬的全部自噬,在今后的研究中筆者將進一步采用特異性鐵自噬激活劑深入挖掘高濃度葡萄糖環境下抑制的鐵自噬對CRC細胞侵襲轉移的影響。
基于腫瘤細胞Warburg效應下的糖代謝特點,腫瘤細胞增殖速率與可利用碳水化合物的攝入量存在正相關性[20]。過量碳水化合物的攝入導致體內葡萄糖與蛋白質、脂質或核酸的自由氨基經過一系列復雜的非酶觸反應,形成大量晚期糖基化終末產物(advanced glycation end products,AGEs),其受體RAGE隨著AGEs的升高而積聚,二者相互作用具有促進腫瘤生長、滋養血管形成及腫瘤轉移的作用[21]。同時,AGEs/RAGE信號也是細胞自噬和鐵死亡程序的關鍵調控因子。有研究[22]報道楓樹糖漿通過抑制AGEs/RAGE信號激活抑制CRC細胞自噬,進而發揮抑制CRC細胞增殖分化的作用。有趣的是,高糖環境下AGEs/RAGE信號被異常激活,其介導的鐵死亡程序參與調控2型糖尿病的發生進展[23]。本研究結果表明,沉默CRC細胞RAGE表達后,CRC細胞鐵自噬被激活,細胞遷移侵襲能力降低;更重要的是,在沉默CRC細胞RAGE表達后,高濃度葡萄糖對CRC細胞鐵自噬的抑制作用被削弱,對CRC細胞遷移和侵襲能力的促進作用也隨之減弱。本動物實驗同樣表明,經高糖喂養的大鼠結直腸腫瘤數量明顯增多,黏膜內癌的分化程度更低,鐵自噬顯著被抑制,RAGE表達量異常增高。
鐵自噬是由NCOA4作為伴侶分子所介導的一種特異性自噬,NCOA4通過特異性地識別結合細胞內結合鐵離子的鐵蛋白,并將其轉運至溶酶體降解并釋放出游離鐵離子。鐵蛋白是細胞內鐵離子儲存的重要結構,由鐵蛋白重鏈(ferritin heavy chain)和輕鏈(ferritin light chain)亞基組成鐵蛋白復合體[24]。研究[25]表明,細胞鐵死亡過程中所依賴的鐵離子來自鐵自噬釋放的鐵離子,因此鐵死亡被認為屬于自噬依賴的細胞死亡過程。眾所周知,mTOR信號是調控自噬的關鍵分子,有研究[26]表明酚甲烷通過誘導腎小管上皮細胞鐵死亡導致腎損傷,這一過程需要mTOR/UNC51樣激酶1(UNC51-like kinase-1,ULK1)信號通路介導的鐵自噬參與。高糖通過激活單磷酸腺苷依賴蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)/mTOR信號通路誘導成骨細胞鐵自噬進而促進細胞鐵死亡,加重2型糖尿病患者的骨質疏松[27]。納米氧化鋅通過AMPK/mTOR信號通路調節鐵自噬促進血管內皮細胞鐵死亡[28]。本研究結果表明,高濃度葡萄糖導致mTOR信號磷酸化激活,抑制CRC細胞鐵自噬,增強CRC細胞的遷移和侵襲能力;在沉默CRC細胞RAGE表達后,高濃度葡萄糖對CRC細胞mTOR信號的激活效果、對鐵自噬的抑制作用以及對CRC細胞遷移和侵襲能力的促進作用均被削弱。本研究尚存在一些不足:本研究采用RT-qPCR方法檢測大鼠結直腸組織中NCOA4、ferritin、RAGE以及mTOR的mRNA表達情況,并未對上述基因蛋白表達情況進行檢測,在今后的研究中筆者將進一步對NCOA4、ferritin、RAGE以及mTOR在大鼠結直腸組織中的蛋白表達情況進行分析。
綜上所述,本研究結果證實高糖飲食促進CRC發生發展,CRC細胞長期暴露高糖環境下后鐵自噬被抑制,導致CRC細胞的遷移侵襲能力增強,其作用機制與mTOR/RAGE信號通路的異常激活及過度磷酸化密切相關。本研究揭示了長期高碳水化合物飲食促進CRC發展的潛在機制,豐富了國民對健康飲食降低CRC患病的認識,為通過改善飲食習慣從而尋求針對CRC的預防提供了理論依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:喬鵬飛完成實驗設計;熊梟、陳豪、李元亮、唐研共同進行實驗、收集數據并做統計分析;喬鵬飛、熊梟和張好剛共同完成論文寫作。
倫理聲明:本研究已通過哈爾濱醫科大學附屬第二醫院倫理委員會的倫理審核批準(批文編號:KY2020-122)。