引用本文: 李虎, 韓悅, 茹翔翔, 李新喜, 張磊, 狄濤, 再英·葉爾寶, 田野. 2型糖尿病合并下肢動脈硬化閉塞癥的危險因素分析及其風險預測模型構建:病例對照研究. 中國普外基礎與臨床雜志, 2024, 31(10): 1251-1257. doi: 10.7507/1007-9424.202405074 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
下肢動脈硬化閉塞癥(arteriosclerosis obliterans,ASO)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者的嚴重血管并發癥之一,其主要特征是血管狹窄或閉塞[1]。高血糖水平可引起血管內皮細胞損傷和炎癥反應,進而導致血管內層的斑塊形成加速,使動脈壁硬化、狹窄或閉塞[2]。合并T2DM伴下肢ASO時的截肢率是不合并T2DM患者的10倍[3]。低三碘甲狀腺原氨酸與慢性腎衰竭、急性心肌梗死和外科敗血癥患者的死亡率密切相關[4];另有研究[5-9]發現,較低的游離三碘甲狀腺原氨酸(free triiodothyronine,FT3)/游離甲狀腺素(free thyroxine,FT4)比值與接受經皮冠狀動脈介入治療的冠狀動脈疾病患者、擴張型心肌病和結直腸癌患者以及住院的老年患者的死亡率相關。本研究分析了T2DM合并下肢ASO患者的血液、甲狀腺激素等相關指標,探討T2DM患者發生下肢ASO的風險因素并構建列線圖預測模型,為臨床早期干預提供參考。
1 資料與方法
1.1 患者的納入和排除標準
回顧性收集2017年1月至2022年12月期間于新疆醫科大學第一附屬醫院(簡稱“我院”)內分泌科及血管甲狀腺外科收治的T2DM合并ASO的患者作為觀察對象,以同期僅有T2DM的患者作為對照。T2DM的診斷標準參照 《中國老年2型糖尿病防治臨床指南(2022年版)》[10]中的診斷標準。ASO的診斷標準參照2016年發布《下肢動脈硬化閉塞癥診治指南》[1]。本研究的病例排除標準:① 1型糖尿病患者;② 合并惡性腫瘤或神經系統性疾病患者;③ 合并動脈炎、脈管炎、下肢動脈血栓等疾病患者;④ 溝通困難或精神障礙患者;⑤ 合并甲狀腺功能亢進、甲狀腺惡性腫瘤患者;⑥ 伴重度肝腎功能不全的患者;⑦ 臨床病理資料不全者。本研究經我院倫理委員會審核批準(批文編號:K202405-31),并得到患者和家屬的知情同意。
1.2 收集患者的臨床資料
1.2.1 人口學指標、既往史、合并癥等指標
患者的性別、年齡、身體質量指數、生活習慣(吸煙史、飲酒史)及合并癥(高血壓)。
1.2.2 血常規指標
白細胞(white blood cell,WBC)計數、中性粒細胞(neutrophil,Neut)計數、淋巴細胞(lymphocyte,Lym)計數、單核細胞(monocyte,MC)計數、血小板(platelet,PLT)計數。
1.2.3 炎癥相關指標
全身免疫炎癥指數(systemic immune-inflammation index,SII),其公式為“PLT計數×Neut計數/Lym計數”[11];系統炎癥反應指數(systemic inflammatory response index,SIRI),其公式為“Neut計數×MC計數/Lym計數”[12];全身免疫炎癥反應指數(systemic immune inflammatory response index,SIIRI),其公式為“Neut計數×MC計數×PLT計數/Lym計數”[13]。
1.2.4 脂類指標
總膽固醇(total cholesterol,TC)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)、甘油三酯(triglycerides,TG)、載脂蛋白A1(apolipoprotein A1,ApoA1)、載脂蛋白α(apolipoprotein α,Apoα)、載脂蛋白B(apolipoprotein B,ApoB)。
1.2.5 激素或甲狀腺相關指標
甲狀腺素(thyroid hormone,TH)、促甲狀腺激素(thyroid stimulating hormone,TSH)、游離三碘甲狀腺原氨酸(free triiodothyronine,FT3)、三碘甲狀腺原氨酸總量(total triiodothyronine,TT3)、游離甲狀腺素(free thyroxine,FT4)、FT3/FT4比值、抗甲狀腺球蛋白抗體(thyroglobulin antibodies,TGAb)、抗甲狀腺過氧化物酶抗體(thyroid peroxidase antibodies,TPOAb)。
1.2.6 止、凝血指標
凝血酶原時間(prothrombin time,PT)、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、血漿纖維蛋白原(fibrinogen,Fib)、纖維蛋白原降解產物(fibrinogen degradation products,FDP)、國際標準化比率(international normalized ratio,INR)、血漿D-二聚體(D-dimer,DD)。
1.2.7 腎功指標
血清胱抑素C(cystatin C,CysC)。
1.3 統計學方法
使用SPSS 27.0和R4.3.1軟件對數據進行統計學分析。服從正態分布的計量資料以均數±標準差(x±s)描述且2組間比較采用獨立樣本比較的t檢驗,不服從正態分布的計量資料以中位數(median,M)和上下四分位數(P25,P75)描述且2組間比較采用秩和檢驗;對計數資料采用頻數和百分率(%)描述且2組間比較采用成組卡方、連續性校正卡方或Fisher確切概率法檢驗。對2組間比較差異有統計意義(P<0.05)的指標及結合臨床上有意義的指標納入采用二元logistic回歸模型進行多因素分析,以篩選影響T2DM患者發生下肢ASO的可能危險因素。檢驗水準α=0.05。將篩選出的危險因素構建列線圖模型以預測T2DM患者發生下肢ASO的概率。采用受試者操作特征(receiver operating characteristic,ROC)曲線并計算曲線下面積值來評估模型的區分能力,同時采用校準曲線Hosmer-Lemeshow擬合優度檢驗評估列線圖模型的預測準確性,運用臨床決策分析曲線來評估列線圖模型的臨床實用性。
2 結果
2.1 2組患者的臨床資料
本研究中單純T2DM患者119例,T2DM合并下肢ASO患者114例,比較二者的臨床資料發現,與單純T2DM患者比較,T2DM合并ASO患者中有吸煙史患者占比更高(P<0.05),WBC、Neut、PLT、SIRI、SIIRI、Apoα、CysC、Fib、FDP、DD值更高(P<0.05),而Lym、SII、HDL-C、ApoA1、FT3、TT3、FT3/FT4值更低(P<0.05),而未發現二者的其他臨床資料比較差異有統計學意義(P>0.05)。見表1。
2.2 多因素分析影響T2DM患者發生下肢ASO的風險因素
將單純T2DM患者和T2DM合并下肢ASO患者比較差異有統計學意義的指標如有吸煙史、WBC、Neut、PLT、Lym、SII、SIRI、SIIRI、Apoα、ApoA1、CysC、Fib、FDP、DD、HDL-C、FT3、TT3、FT3/FT4比值納入進行多因素logistic回歸分析,結果顯示,有吸煙史增加T2DM患者發生下肢ASO的概率[OR(95%CI)=2.921(1.023,4.227),P=0.003],隨著SIRI值和Fib水平增高T2DM患者發生下肢ASO的概率增大 [OR(95%CI)=1.020(1.004,1.044),P=0.018;OR(95%CI)=2.641(1.810,4.327),P<0.001],隨著ApoA1、FT3水平增高T2DM患者發生下肢ASO的概率降低[OR(95%CI)=0.231(0.054,0.782),P=0.021;OR(95%CI)=0.503(0.352,0.809),P=0.002]。見表2。
2.3 構建預測T2DM患者發生下肢ASO風險的列線圖模型
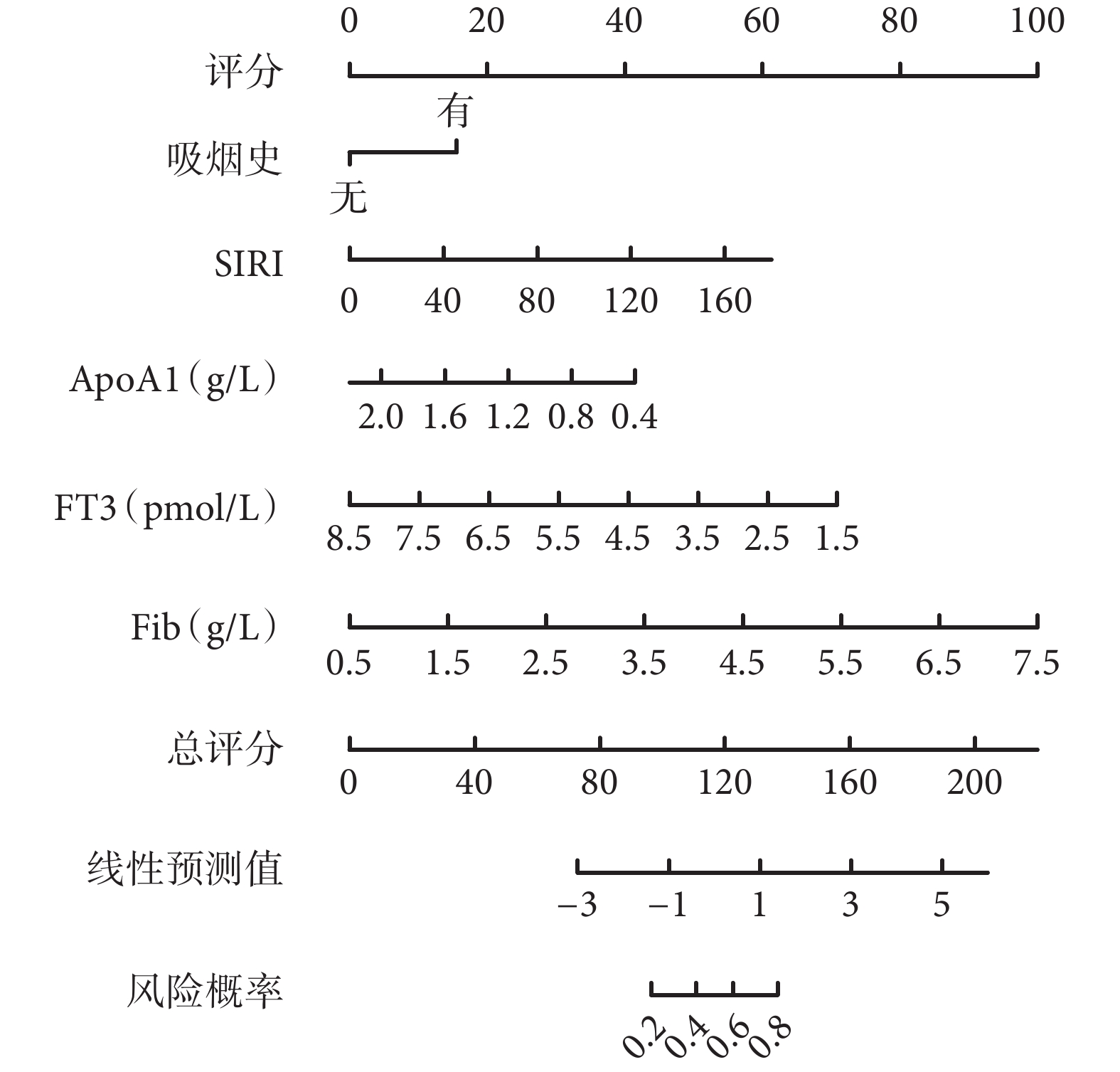
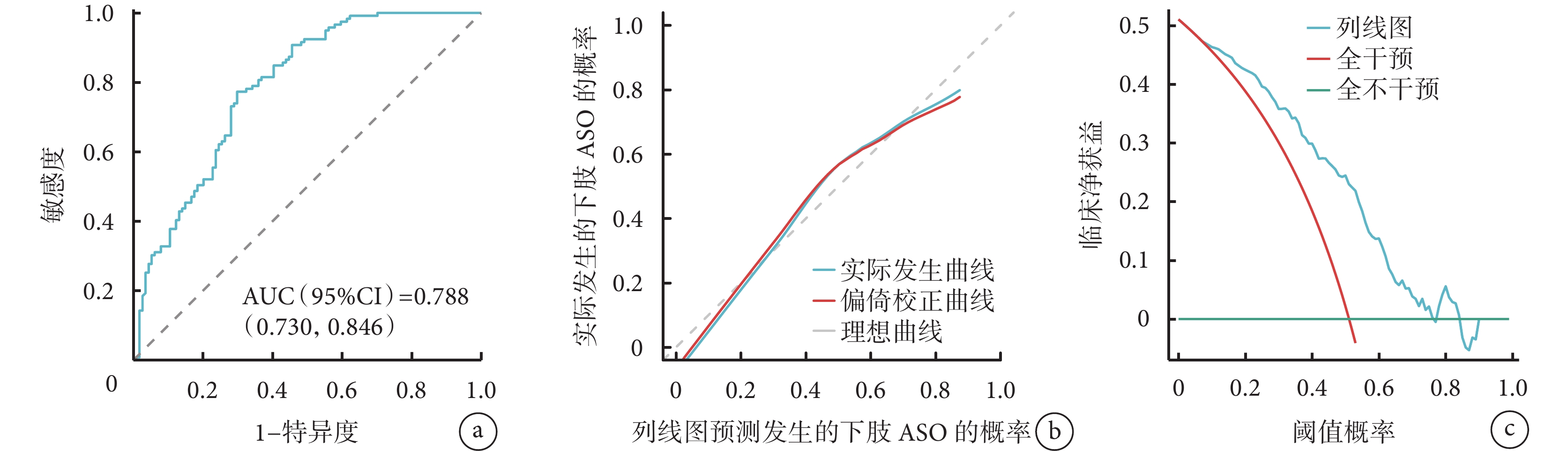
利用多因素logistic回歸分析篩選得到的風險因素生成了列線圖(圖1)并建立評分機制,結果表明,得分最高的風險因素為Fib(100分),其次為FT3(71分),第3是ApoA1(40分),第4是吸煙史(18分)。各因素得分之和為總分,可用于預測T2DM患者發生下肢ASO的概率,總分越高者對應的T2DM發生下肢ASO的概率越高,可根據得分對T2DM患者發生下肢ASO做出初步預測。列線圖模型的ROC曲線(圖2a)下面積為0.788 [95%CI(0.730,0.846)]。實際發生曲線靠近理想曲線(圖2b),調整后的校準曲線顯示與理想曲線沒有顯著偏差,表明置信水平良好(Hosmer-Lemeshow擬合優度檢驗,χ2=5.952,P=0.653)。臨床決策分析曲線評估列線圖預測模型的閾值概率在0.18~0.80范圍內對T2DM患者進行干預的臨床凈收益優于對所有患者不進行和進行干預(圖2c)。
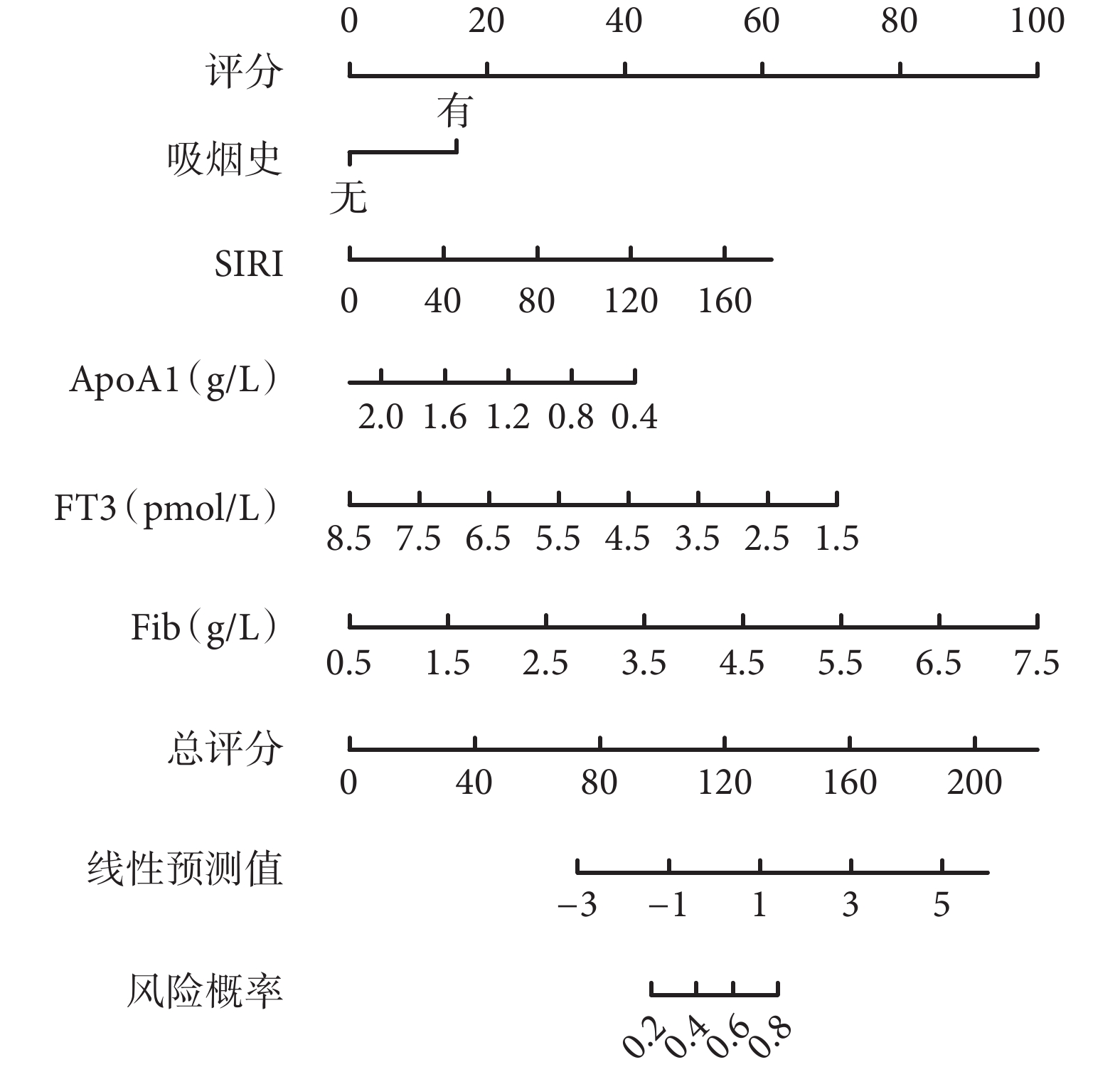 圖1
示T2DM患者發生下肢ASO的列線圖預測模型
圖1
示T2DM患者發生下肢ASO的列線圖預測模型
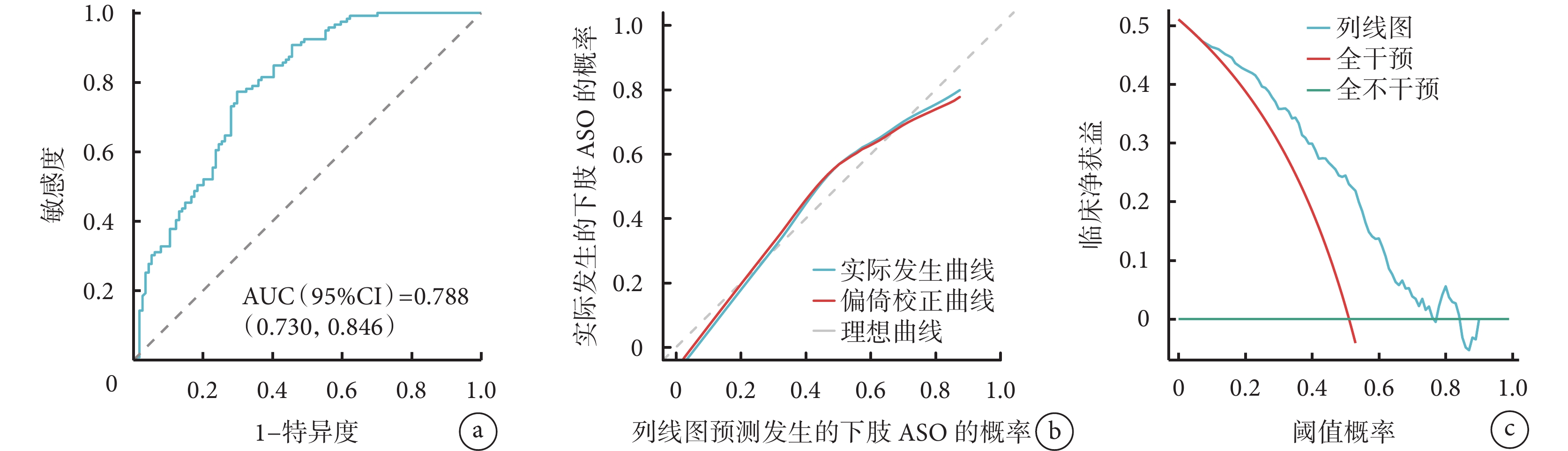 圖2
示列線圖預測模型的ROC曲線(a)、校準曲線(b)及臨床決策分析曲線(c)
圖2
示列線圖預測模型的ROC曲線(a)、校準曲線(b)及臨床決策分析曲線(c)
3 討論
目前,T2DM的發病率呈顯著上升趨勢[2],T2DM患者由于微血管并發癥的發生率顯著增加,導致缺血性血管生成反應受損,血脂異常伴隨的炎癥及動脈硬化進程加速,這些因素使得合并T2DM發生下肢ASO的患者相較于不合并T2DM發生下肢ASO患者面臨更高的腦血管事件、心血管疾病及全因死亡率的風險[14],因此對T2DM患者伴發下肢ASO進行探討是有必要的。本研究探討T2DM患者發生下肢ASO的風險因素并構建列線圖預測模型,最終篩選出吸煙、Fib、SIRI、ApoA1及FT3是T2DM患者發生下肢ASO的風險因素(P<0.05),下面將對這些因素結合文獻進行分析。
吸煙與下肢ASO有著密切聯系,吸煙會使外周血管缺血、急性心肌梗死、腦出血乃至死亡的風險上升[15-16];吸煙會抑制前列腺素的生成,造成動脈中PLT黏附,加速斑塊的形成[17-18]。長期吸煙可導致內皮細胞的損傷,刺激內皮細胞生長因子的釋放,進一步加重血管病變的進程[16]。本研究中發現的結果與文獻中報道基本相符,也發現吸煙是T2DM患者發生下肢ASO的危險因素(OR=2.921,P=0.003)。
甲狀腺功能障礙對血脂及其他心血管疾病具有顯著影響,它造成血管內皮功能障礙,進而分泌各種炎性細胞因子,促進動脈硬化斑塊的形成[19-20]。其中一種理論認為,顯性和亞臨床甲狀腺功能減退均可導致高水平LDL-C、凝血功能障礙和心肌功能障礙,進而增大患動脈硬化或血管疾病的可能[21-22]。本研究中發現,單純T2DM患者和T2DM合并ASO患者在FT3和ApoA1水平有明顯差異且二者的水平增高降低T2DM發生ASO的概率(OR=0.503,P=0.002;OR=0.231,P=0.021)。FT3水平下降可能導致血脂代謝紊亂,同時引起血管內皮細胞破壞,血管壁出現炎癥反應[23],使ASO的出現及進展更加迅速,增加ASO的發病風險。Apo運輸血脂到身體各組織,ApoA1通過清除組織脂質,在動脈粥樣硬化和心血管疾病的發生和調控中扮演著重要角色[24]。Edmunds等[25]研究發現,源自ApoA1的短肽序列RG54應用于糖尿病小鼠身上可有效降低小鼠動脈斑塊的形成。王冠等[26]研究發現,ApoA1/ApoB比值高是T2DM患者發生ASO的風險因素。在本研究中單純T2DM患者ApoA1高于T2DM合并ASO患者,基于多因素logistic回歸分析,ApoA1升高在T2DM患者具有避免發生ASO的作用,分析其原因,ApoA1下降導致脂質積累過多,促進血管內斑塊的形成,與其他學者的研究[25, 27]結果一致。
有多項研究[28-30]證實在炎癥反應、自身免疫等情況下均可激活Fib,使得動脈粥樣硬化的發生風險升高。Fib以多種方式參與其中,如誘導內皮功能紊亂、激活平滑肌細胞增殖和遷移、促進單核細胞或巨噬細胞在動脈粥樣病變中的黏附和浸潤,共同推動斑塊的形成。Rehman等[31]通過驗證糖化Fib作為新型生物標志物,提供了一種預測T2DM合并相關動脈粥樣硬化的方法。本研究中發現,Fib水平是T2DM患者發生下肢ASO的風險因素,Fib水平越高提示T2DM患者發生下肢ASO的風險越高,分析其原因可能與血液黏稠度增加及全身炎癥反應相關,從而使血管內皮損傷和動脈硬化加重,與國內外學者研究結果一致。
有文獻[32-34]報道,部分炎癥相關的血細胞參數與動脈粥樣硬化有關。比如,炎癥狀態已被證明會誘導單核細胞趨化蛋白-1的產生,將單核細胞招募到血管腔內,作為各種細胞因子和分子的來源,單核細胞會與PLT和內皮細胞相互作用,導致炎癥和促凝狀態的加劇。Neut可浸潤血管壁,分泌超氧自由基、細胞因子和多種蛋白水解酶,可引起內皮損傷,總體作用是促進動脈粥樣硬化的發展[33-34]。Lym在全身炎癥狀態下可調節Neut的作用,從而具有抗動脈粥樣硬化的作用[35]。在本研究中單因素分析時也發現,與單純T2DM患者相比,T2DM伴ASO患者的Neut和PLT水平更高,而Lym更低,多因素分析時并未發現它們是T2DM患者發生下肢ASO的風險因素;但是在通過計算這些指標與炎癥狀態有關的全血細胞參數SII、SIRI、SIIRI等衍生指標分析時發現,SIRI指標是T2DM患者發生ASO的風險因素,其值越高發生下肢ASO的概率越高,該指標中包含了反映炎癥狀態的Neut計數、MC計數及Lym計數指標,與前面文獻分析的機制比較相符。
總之,對于T2DM患者,需要密切關注其下肢發生ASO并發癥的風險,做到早診斷、早治療,盡可能地減少由下肢血管病變引起的嚴重后果,改善患者的生活質量和預后。結合本組資料分析結果,對于有吸煙史、SIRI值和Fib水平增高、ApoA1和FT3水平降低的T2DM患者需要密切關注其下肢發生ASO的風險;本研究還根據這幾個特征構建了列線圖預測模型,它對T2DM患者下肢發生ASO具有一定的區分度,但其價值還需要進一步探討,比如進一步積累病例避免數據偏倚,采用更加科學的方法學使研究結果更準確可靠,納入多中心的病例以及開展前瞻性的研究使研究結論更加具有普適性,以及納入更加全面的指標進行分析。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:李虎負責課題設計、統計分析及撰寫論文;韓悅、茹翔翔及再英·葉爾寶負責數據收集及李新喜和張磊負責數據核對;田野負責對文章指導、修改和審核;狄濤負責數據補充。
倫理聲明:本研究通過了新疆醫科大學第一附屬醫院倫理委員會審批(批文編號:K202405-31)。
下肢動脈硬化閉塞癥(arteriosclerosis obliterans,ASO)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者的嚴重血管并發癥之一,其主要特征是血管狹窄或閉塞[1]。高血糖水平可引起血管內皮細胞損傷和炎癥反應,進而導致血管內層的斑塊形成加速,使動脈壁硬化、狹窄或閉塞[2]。合并T2DM伴下肢ASO時的截肢率是不合并T2DM患者的10倍[3]。低三碘甲狀腺原氨酸與慢性腎衰竭、急性心肌梗死和外科敗血癥患者的死亡率密切相關[4];另有研究[5-9]發現,較低的游離三碘甲狀腺原氨酸(free triiodothyronine,FT3)/游離甲狀腺素(free thyroxine,FT4)比值與接受經皮冠狀動脈介入治療的冠狀動脈疾病患者、擴張型心肌病和結直腸癌患者以及住院的老年患者的死亡率相關。本研究分析了T2DM合并下肢ASO患者的血液、甲狀腺激素等相關指標,探討T2DM患者發生下肢ASO的風險因素并構建列線圖預測模型,為臨床早期干預提供參考。
1 資料與方法
1.1 患者的納入和排除標準
回顧性收集2017年1月至2022年12月期間于新疆醫科大學第一附屬醫院(簡稱“我院”)內分泌科及血管甲狀腺外科收治的T2DM合并ASO的患者作為觀察對象,以同期僅有T2DM的患者作為對照。T2DM的診斷標準參照 《中國老年2型糖尿病防治臨床指南(2022年版)》[10]中的診斷標準。ASO的診斷標準參照2016年發布《下肢動脈硬化閉塞癥診治指南》[1]。本研究的病例排除標準:① 1型糖尿病患者;② 合并惡性腫瘤或神經系統性疾病患者;③ 合并動脈炎、脈管炎、下肢動脈血栓等疾病患者;④ 溝通困難或精神障礙患者;⑤ 合并甲狀腺功能亢進、甲狀腺惡性腫瘤患者;⑥ 伴重度肝腎功能不全的患者;⑦ 臨床病理資料不全者。本研究經我院倫理委員會審核批準(批文編號:K202405-31),并得到患者和家屬的知情同意。
1.2 收集患者的臨床資料
1.2.1 人口學指標、既往史、合并癥等指標
患者的性別、年齡、身體質量指數、生活習慣(吸煙史、飲酒史)及合并癥(高血壓)。
1.2.2 血常規指標
白細胞(white blood cell,WBC)計數、中性粒細胞(neutrophil,Neut)計數、淋巴細胞(lymphocyte,Lym)計數、單核細胞(monocyte,MC)計數、血小板(platelet,PLT)計數。
1.2.3 炎癥相關指標
全身免疫炎癥指數(systemic immune-inflammation index,SII),其公式為“PLT計數×Neut計數/Lym計數”[11];系統炎癥反應指數(systemic inflammatory response index,SIRI),其公式為“Neut計數×MC計數/Lym計數”[12];全身免疫炎癥反應指數(systemic immune inflammatory response index,SIIRI),其公式為“Neut計數×MC計數×PLT計數/Lym計數”[13]。
1.2.4 脂類指標
總膽固醇(total cholesterol,TC)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)、甘油三酯(triglycerides,TG)、載脂蛋白A1(apolipoprotein A1,ApoA1)、載脂蛋白α(apolipoprotein α,Apoα)、載脂蛋白B(apolipoprotein B,ApoB)。
1.2.5 激素或甲狀腺相關指標
甲狀腺素(thyroid hormone,TH)、促甲狀腺激素(thyroid stimulating hormone,TSH)、游離三碘甲狀腺原氨酸(free triiodothyronine,FT3)、三碘甲狀腺原氨酸總量(total triiodothyronine,TT3)、游離甲狀腺素(free thyroxine,FT4)、FT3/FT4比值、抗甲狀腺球蛋白抗體(thyroglobulin antibodies,TGAb)、抗甲狀腺過氧化物酶抗體(thyroid peroxidase antibodies,TPOAb)。
1.2.6 止、凝血指標
凝血酶原時間(prothrombin time,PT)、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、血漿纖維蛋白原(fibrinogen,Fib)、纖維蛋白原降解產物(fibrinogen degradation products,FDP)、國際標準化比率(international normalized ratio,INR)、血漿D-二聚體(D-dimer,DD)。
1.2.7 腎功指標
血清胱抑素C(cystatin C,CysC)。
1.3 統計學方法
使用SPSS 27.0和R4.3.1軟件對數據進行統計學分析。服從正態分布的計量資料以均數±標準差(x±s)描述且2組間比較采用獨立樣本比較的t檢驗,不服從正態分布的計量資料以中位數(median,M)和上下四分位數(P25,P75)描述且2組間比較采用秩和檢驗;對計數資料采用頻數和百分率(%)描述且2組間比較采用成組卡方、連續性校正卡方或Fisher確切概率法檢驗。對2組間比較差異有統計意義(P<0.05)的指標及結合臨床上有意義的指標納入采用二元logistic回歸模型進行多因素分析,以篩選影響T2DM患者發生下肢ASO的可能危險因素。檢驗水準α=0.05。將篩選出的危險因素構建列線圖模型以預測T2DM患者發生下肢ASO的概率。采用受試者操作特征(receiver operating characteristic,ROC)曲線并計算曲線下面積值來評估模型的區分能力,同時采用校準曲線Hosmer-Lemeshow擬合優度檢驗評估列線圖模型的預測準確性,運用臨床決策分析曲線來評估列線圖模型的臨床實用性。
2 結果
2.1 2組患者的臨床資料
本研究中單純T2DM患者119例,T2DM合并下肢ASO患者114例,比較二者的臨床資料發現,與單純T2DM患者比較,T2DM合并ASO患者中有吸煙史患者占比更高(P<0.05),WBC、Neut、PLT、SIRI、SIIRI、Apoα、CysC、Fib、FDP、DD值更高(P<0.05),而Lym、SII、HDL-C、ApoA1、FT3、TT3、FT3/FT4值更低(P<0.05),而未發現二者的其他臨床資料比較差異有統計學意義(P>0.05)。見表1。
2.2 多因素分析影響T2DM患者發生下肢ASO的風險因素
將單純T2DM患者和T2DM合并下肢ASO患者比較差異有統計學意義的指標如有吸煙史、WBC、Neut、PLT、Lym、SII、SIRI、SIIRI、Apoα、ApoA1、CysC、Fib、FDP、DD、HDL-C、FT3、TT3、FT3/FT4比值納入進行多因素logistic回歸分析,結果顯示,有吸煙史增加T2DM患者發生下肢ASO的概率[OR(95%CI)=2.921(1.023,4.227),P=0.003],隨著SIRI值和Fib水平增高T2DM患者發生下肢ASO的概率增大 [OR(95%CI)=1.020(1.004,1.044),P=0.018;OR(95%CI)=2.641(1.810,4.327),P<0.001],隨著ApoA1、FT3水平增高T2DM患者發生下肢ASO的概率降低[OR(95%CI)=0.231(0.054,0.782),P=0.021;OR(95%CI)=0.503(0.352,0.809),P=0.002]。見表2。
2.3 構建預測T2DM患者發生下肢ASO風險的列線圖模型
利用多因素logistic回歸分析篩選得到的風險因素生成了列線圖(圖1)并建立評分機制,結果表明,得分最高的風險因素為Fib(100分),其次為FT3(71分),第3是ApoA1(40分),第4是吸煙史(18分)。各因素得分之和為總分,可用于預測T2DM患者發生下肢ASO的概率,總分越高者對應的T2DM發生下肢ASO的概率越高,可根據得分對T2DM患者發生下肢ASO做出初步預測。列線圖模型的ROC曲線(圖2a)下面積為0.788 [95%CI(0.730,0.846)]。實際發生曲線靠近理想曲線(圖2b),調整后的校準曲線顯示與理想曲線沒有顯著偏差,表明置信水平良好(Hosmer-Lemeshow擬合優度檢驗,χ2=5.952,P=0.653)。臨床決策分析曲線評估列線圖預測模型的閾值概率在0.18~0.80范圍內對T2DM患者進行干預的臨床凈收益優于對所有患者不進行和進行干預(圖2c)。
 圖1
示T2DM患者發生下肢ASO的列線圖預測模型
圖1
示T2DM患者發生下肢ASO的列線圖預測模型
 圖2
示列線圖預測模型的ROC曲線(a)、校準曲線(b)及臨床決策分析曲線(c)
圖2
示列線圖預測模型的ROC曲線(a)、校準曲線(b)及臨床決策分析曲線(c)
3 討論
目前,T2DM的發病率呈顯著上升趨勢[2],T2DM患者由于微血管并發癥的發生率顯著增加,導致缺血性血管生成反應受損,血脂異常伴隨的炎癥及動脈硬化進程加速,這些因素使得合并T2DM發生下肢ASO的患者相較于不合并T2DM發生下肢ASO患者面臨更高的腦血管事件、心血管疾病及全因死亡率的風險[14],因此對T2DM患者伴發下肢ASO進行探討是有必要的。本研究探討T2DM患者發生下肢ASO的風險因素并構建列線圖預測模型,最終篩選出吸煙、Fib、SIRI、ApoA1及FT3是T2DM患者發生下肢ASO的風險因素(P<0.05),下面將對這些因素結合文獻進行分析。
吸煙與下肢ASO有著密切聯系,吸煙會使外周血管缺血、急性心肌梗死、腦出血乃至死亡的風險上升[15-16];吸煙會抑制前列腺素的生成,造成動脈中PLT黏附,加速斑塊的形成[17-18]。長期吸煙可導致內皮細胞的損傷,刺激內皮細胞生長因子的釋放,進一步加重血管病變的進程[16]。本研究中發現的結果與文獻中報道基本相符,也發現吸煙是T2DM患者發生下肢ASO的危險因素(OR=2.921,P=0.003)。
甲狀腺功能障礙對血脂及其他心血管疾病具有顯著影響,它造成血管內皮功能障礙,進而分泌各種炎性細胞因子,促進動脈硬化斑塊的形成[19-20]。其中一種理論認為,顯性和亞臨床甲狀腺功能減退均可導致高水平LDL-C、凝血功能障礙和心肌功能障礙,進而增大患動脈硬化或血管疾病的可能[21-22]。本研究中發現,單純T2DM患者和T2DM合并ASO患者在FT3和ApoA1水平有明顯差異且二者的水平增高降低T2DM發生ASO的概率(OR=0.503,P=0.002;OR=0.231,P=0.021)。FT3水平下降可能導致血脂代謝紊亂,同時引起血管內皮細胞破壞,血管壁出現炎癥反應[23],使ASO的出現及進展更加迅速,增加ASO的發病風險。Apo運輸血脂到身體各組織,ApoA1通過清除組織脂質,在動脈粥樣硬化和心血管疾病的發生和調控中扮演著重要角色[24]。Edmunds等[25]研究發現,源自ApoA1的短肽序列RG54應用于糖尿病小鼠身上可有效降低小鼠動脈斑塊的形成。王冠等[26]研究發現,ApoA1/ApoB比值高是T2DM患者發生ASO的風險因素。在本研究中單純T2DM患者ApoA1高于T2DM合并ASO患者,基于多因素logistic回歸分析,ApoA1升高在T2DM患者具有避免發生ASO的作用,分析其原因,ApoA1下降導致脂質積累過多,促進血管內斑塊的形成,與其他學者的研究[25, 27]結果一致。
有多項研究[28-30]證實在炎癥反應、自身免疫等情況下均可激活Fib,使得動脈粥樣硬化的發生風險升高。Fib以多種方式參與其中,如誘導內皮功能紊亂、激活平滑肌細胞增殖和遷移、促進單核細胞或巨噬細胞在動脈粥樣病變中的黏附和浸潤,共同推動斑塊的形成。Rehman等[31]通過驗證糖化Fib作為新型生物標志物,提供了一種預測T2DM合并相關動脈粥樣硬化的方法。本研究中發現,Fib水平是T2DM患者發生下肢ASO的風險因素,Fib水平越高提示T2DM患者發生下肢ASO的風險越高,分析其原因可能與血液黏稠度增加及全身炎癥反應相關,從而使血管內皮損傷和動脈硬化加重,與國內外學者研究結果一致。
有文獻[32-34]報道,部分炎癥相關的血細胞參數與動脈粥樣硬化有關。比如,炎癥狀態已被證明會誘導單核細胞趨化蛋白-1的產生,將單核細胞招募到血管腔內,作為各種細胞因子和分子的來源,單核細胞會與PLT和內皮細胞相互作用,導致炎癥和促凝狀態的加劇。Neut可浸潤血管壁,分泌超氧自由基、細胞因子和多種蛋白水解酶,可引起內皮損傷,總體作用是促進動脈粥樣硬化的發展[33-34]。Lym在全身炎癥狀態下可調節Neut的作用,從而具有抗動脈粥樣硬化的作用[35]。在本研究中單因素分析時也發現,與單純T2DM患者相比,T2DM伴ASO患者的Neut和PLT水平更高,而Lym更低,多因素分析時并未發現它們是T2DM患者發生下肢ASO的風險因素;但是在通過計算這些指標與炎癥狀態有關的全血細胞參數SII、SIRI、SIIRI等衍生指標分析時發現,SIRI指標是T2DM患者發生ASO的風險因素,其值越高發生下肢ASO的概率越高,該指標中包含了反映炎癥狀態的Neut計數、MC計數及Lym計數指標,與前面文獻分析的機制比較相符。
總之,對于T2DM患者,需要密切關注其下肢發生ASO并發癥的風險,做到早診斷、早治療,盡可能地減少由下肢血管病變引起的嚴重后果,改善患者的生活質量和預后。結合本組資料分析結果,對于有吸煙史、SIRI值和Fib水平增高、ApoA1和FT3水平降低的T2DM患者需要密切關注其下肢發生ASO的風險;本研究還根據這幾個特征構建了列線圖預測模型,它對T2DM患者下肢發生ASO具有一定的區分度,但其價值還需要進一步探討,比如進一步積累病例避免數據偏倚,采用更加科學的方法學使研究結果更準確可靠,納入多中心的病例以及開展前瞻性的研究使研究結論更加具有普適性,以及納入更加全面的指標進行分析。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:李虎負責課題設計、統計分析及撰寫論文;韓悅、茹翔翔及再英·葉爾寶負責數據收集及李新喜和張磊負責數據核對;田野負責對文章指導、修改和審核;狄濤負責數據補充。
倫理聲明:本研究通過了新疆醫科大學第一附屬醫院倫理委員會審批(批文編號:K202405-31)。