原發于肝臟的淋巴瘤十分罕見,臨床報道病例較少,其臨床及影像學表現缺乏特異性,常易誤診。筆者展示了1例彌漫浸潤型原發性肝臟淋巴瘤患者的CT及MRI圖像,闡述了該疾病的影像學表現、相關病理生理機制及影像鑒別診斷,以加強臨床及影像醫師對該病的認識。
引用本文: 張奧翔, 趙又瑾, 陳衛霞, 盧春燕. 病例分析:1例彌漫浸潤型原發性肝臟淋巴瘤的影像學表現及鑒別診斷. 中國普外基礎與臨床雜志, 2024, 31(11): 1380-1384. doi: 10.7507/1007-9424.202408090 復制
原發性肝臟淋巴瘤(primary hepatic lymphoma,PHL)是指起源于肝內淋巴組織、無肝外浸潤的一類肝臟惡性腫瘤[1]。PHL占肝臟惡性腫瘤的0.1%,占結外非霍奇金淋巴瘤的0.4%[2]。PHL的臨床及影像學表現不典型,術前容易被誤診。根據腫瘤形態,PHL分為孤立結節型、多發結節型及彌漫浸潤型,其中孤立結節型相對多見[3]。筆者現報道1例經術后組織病理學檢查證實為彌漫浸潤型的PHL,該例患者的影像學表現相對于多數PHL更具有迷惑性,難以區分病灶與周圍正常肝實質。通過展示該病例的 CT 及 MRI 影像表現,分析其潛在的病理機制并進行相關鑒別診斷,以提高讀者對該病的認識及診斷意識。
1 患者基本信息
患者,男,51歲。因“皮膚和鞏膜黃染2年,腹痛及腹脹半個月,下肢水腫5 d”收入四川大學華西醫院(后文簡稱“我院”)。2年前患者無明顯誘因出現皮膚和鞏膜黃染,伴尿黃,未予以治療。患者于半個月前出現右上腹脹痛,無惡心、嘔吐、腹脹、嘔血、黑便等不適,于當地醫院對癥治療后癥狀無明顯好轉,遂轉入我院就診。查體:皮膚和鞏膜輕度黃染,肋下5 cm處可觸及肝臟,脾臟肋下未觸及,其余無特殊。血常規:淋巴細胞百分率(16.3%)低于正常值,單核細胞百分率(11.3%)高于正常值。肝腎功能:總膽紅素(131.9 μmol/L)、直接膽紅素(121.9 μmol/L)、丙氨酸轉氨酶(1 041 U/L)、天冬氨酸轉氨酶(1 331 U/L)、堿性磷酸酶(569 U/L)、谷氨酰轉肽酶(344 U/L)、乳酸脫氫酶(676 U/L)均高于正常值,總蛋白(55.2 g/L)及白蛋白(34.3 g/L)均低于正常值。血氨(54.6 μmol/L)高于正常值。乙型肝炎表面抗體(定量11.5 U/L)為陽性。腫瘤標志物檢查:甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)均陰性。免疫全套、自身免疫性肝病抗體、甲型肝炎抗體、戊型肝炎抗體均陰性。該患者入院后進一步行上腹部CT及MRI平掃及增強掃描。
2 影像學表現
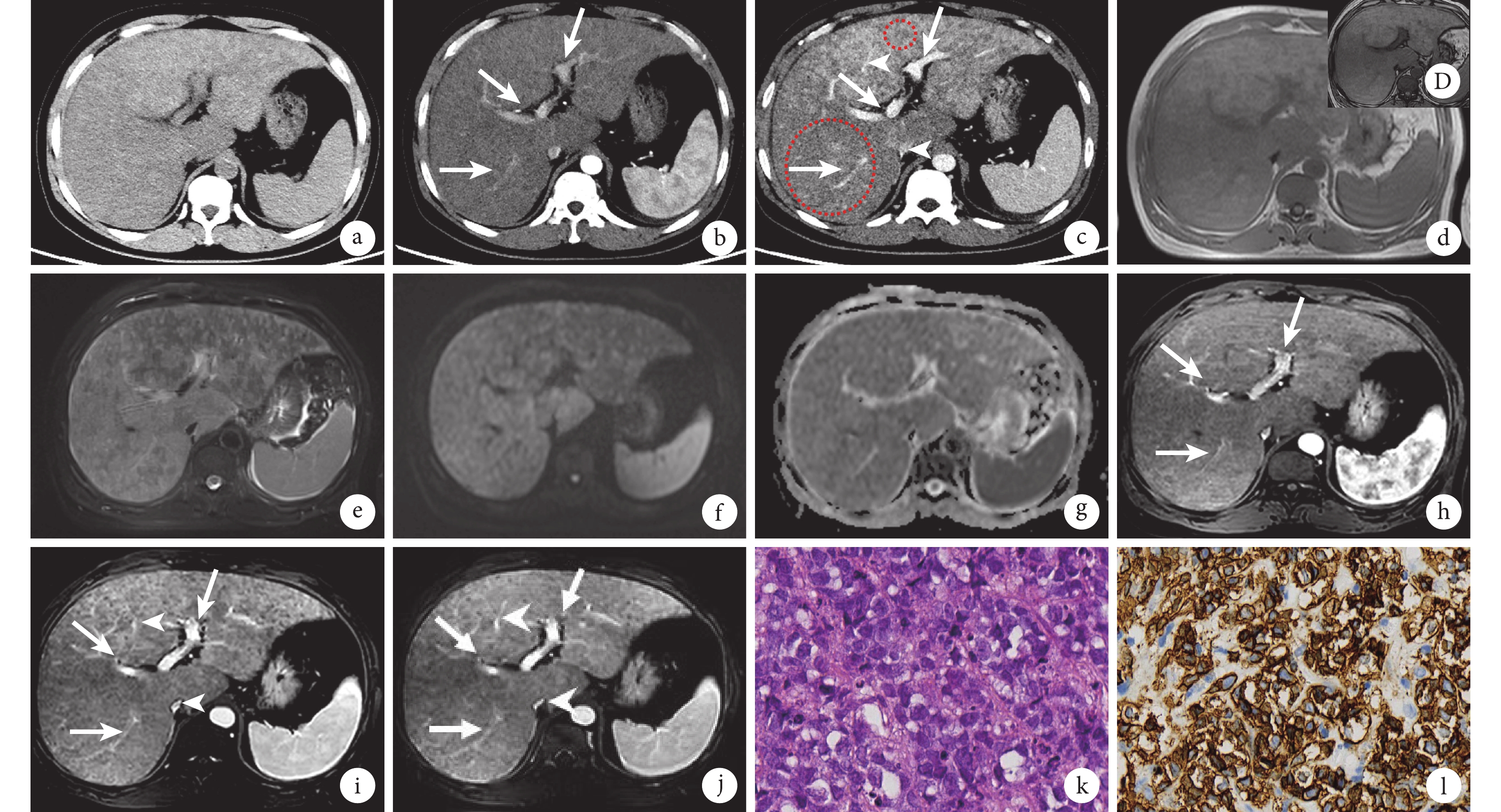
患者行上腹部CT檢查:平掃(圖1a)顯示肝臟彌漫增大,包膜光整,實質密度不均勻減低;增強掃描(圖1b、1c)動脈期或門靜脈期顯示肝實質強化不均勻,多發結節、斑片狀及大片狀稍低密度影,部分融合,以肝右后葉最為明顯,肝內門靜脈通暢,未見充盈缺損征象,下腔靜脈、肝靜脈及其屬支變細,未見閉塞。上腹部MRI檢查示病灶T1加權成像(weighted imaging,WI)呈等或稍低信號(圖1d),T2WI呈稍高信號(圖1e),T1WI反相位(圖1D)對比同相位(圖1d)圖像病灶信號未見明顯變化。病灶彌散加權成像(diffusion-weighted imaging,DWI)呈稍高信號(圖1f),表觀彌散系數(apparent diffusion coefficient,ADC)呈稍低信號(圖1g),提示病灶輕度彌散受限;病灶邊界不清。增強掃描動脈期顯示病灶未見明顯強化(圖1h),門靜脈期(圖1i)及延遲期(圖1j)病變呈進行性延遲強化,但強化程度均低于周圍肝實質,門靜脈未見增寬及充盈缺損征象(圖1h~1j),肝靜脈稍變細(圖1i、1j)。上述肝內彌漫病變,考慮腫瘤性病變?或血管源性病變?或其他?需結合臨床及其他檢查進一步明確診斷。
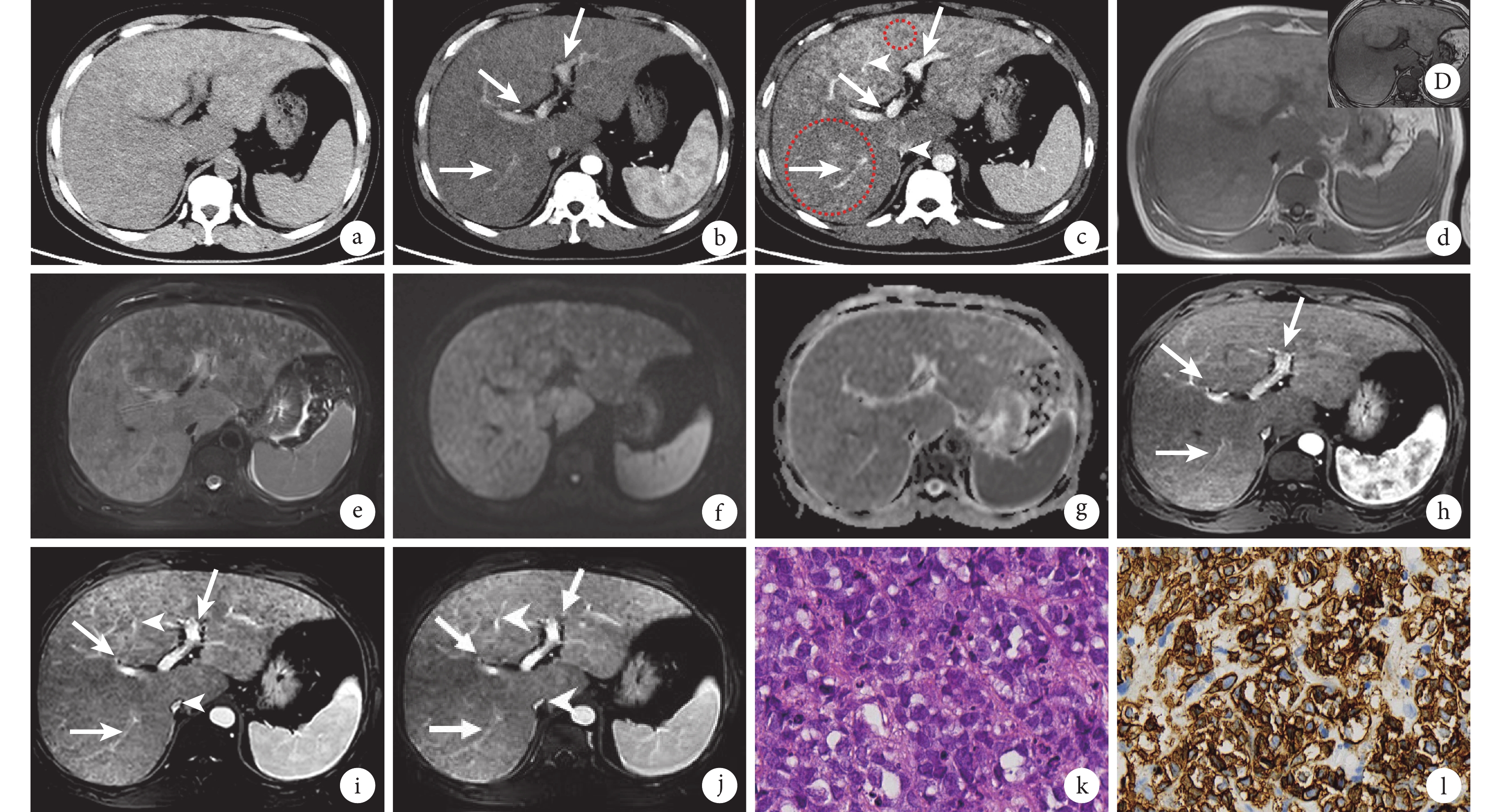 圖1
示上腹部CT平掃+增強掃描和上腹部MRI平掃+增強掃描以及組織學檢查結果
圖1
示上腹部CT平掃+增強掃描和上腹部MRI平掃+增強掃描以及組織學檢查結果
a:肝臟CT平掃顯示肝臟彌漫增大,包膜光整,實質密度不均勻減低;b、c:CT增強掃描顯示肝實質強化不均勻,多發結節、斑片狀及大片狀低密度影,部分融合(紅圈范圍內所示),以肝右后葉更明顯,肝內門靜脈通暢(白箭),下腔靜脈肝段及屬支變細(白箭頭);d~j:MRI T1WI平掃同相位圖像顯示病灶呈等或稍低信號(d)、壓脂T2WI呈稍高信號(e),T1WI反相位(D)病灶未見信號衰減,DWI呈稍高信號(f)、ADC呈稍低信號(g),增強掃描動脈期未見明顯強化(h,白箭),門靜脈期(i)及延遲期(j)病變呈進行性延遲強化,但強化程度低于周圍肝實質,門靜脈未見增寬、其內未見異常信號(白箭),肝靜脈稍變細(白箭頭);k:肝臟病灶穿刺標本組織病理學查見異型細胞,疑腫瘤(蘇木精-伊紅染色 ×40);l:淋巴瘤B細胞標志物CD-20染色陽性(免疫組織化學染色 ×40)
3 術后病理學檢查結果
入院后,患者行肝臟超聲穿刺活檢。術后病理學檢查結果:查見異型細胞(圖1k),免疫組織化學染色CD20(+,圖1l)、CD79a(+)、CD3(–)、CD10(+)、Bcl-6(+)、多發性骨髓瘤致癌蛋白-1(+)、Bcl-2(+,>90%)、C-myc(+,約50%)、CD30(–)、免疫球蛋白G4(–)、CD38 (灶+)、廣譜細胞角蛋白(–)、上皮膜抗原(–)、細胞角蛋白7(–)、S-100 (–)、CD56(–)、乙型肝炎表面抗原(–)、乙型肝炎核心抗原(–)、Ki-67(Mindbomb同源物1)(+,90%)。特殊染色:Foot及Masson染色示纖維組織增生,銅染色、鐵染色、PAS及D-PAS未見明顯異常。PCR+Genscan基因重排檢測示病灶內未查見免疫球蛋白重鏈基因和免疫球蛋白kappa基因克隆性擴增峰。綜上,考慮非霍奇金淋巴瘤,大B細胞淋巴瘤(侵襲性),多系生發中心B細胞源性(Hans分型)。
4 討論
4.1 PHL的臨床及病理特點
PHL病因不明確。目前認為可能與肝炎病毒感染、原發性膽汁性肝硬化等有關[4]。
4.1.1 臨床表現
PHL多見于中老年人,平均發病年齡為50歲,且以男性多見[5]。PHL臨床表現無特異性,多見上腹部不適,也可以表現為皮膚和鞏膜黃染、體質量下降、發熱、惡心等[6]。本例患者即以皮膚和鞏膜黃染、上腹部脹痛前來就診。
4.1.2 實驗室結果
PHL實驗室檢查常表現為乙型肝炎或丙型肝炎陽性,血清乳酸脫氫酶升高,但腫瘤相關抗原如AFP多呈陰性。有研究者[7-8]認為,乳酸脫氫酶升高可以作為PHL診斷的敏感指標,但特異性不高。目前關于乳酸脫氫酶升高與PHL發生的相關機制尚不明確。
4.1.3 組織病理學特點
非霍奇金淋巴瘤是PHL的主要組織學亞型,以彌漫性大B細胞型淋巴瘤為主,約占所有PHL的90%以上;其次為T細胞淋巴瘤,占5%~10%[9]。PHL可能起源于肝匯管區的淋巴組織,呈結節狀或彌漫性生長。當呈腫瘤結節狀生長時,淋巴瘤細胞破壞周圍肝板結構,受累區無匯管區結構殘留;當呈彌漫性生長時,腫瘤細胞通常沿肝竇狀間隙生長,肝實質結構得到保留[10-11]。
總之,PHL術前診斷困難,最終需依靠組織病理學及免疫組織化學檢查確診。
4.2 PHL的影像學表現及其相關病理基礎
根據PHL病變的大體形態,PHL的CT及MRI可表現為結節型和彌漫浸潤型。① 結節型又表現為孤立型和多發型,孤立型約占82.5%,表現為肝內單發大結節或腫塊型病灶;多發型約占15%,表現為肝內散在多發小結節病灶,單個病灶直徑通常<3 cm[2]。② 彌漫浸潤型,該型約占2.5%,表現為肝內彌漫浸潤性病灶,常無明確的結節和腫塊形成,較為罕見,預后較差[2]。
孤立和多發結節型PHL的CT和MRI表現:① CT平掃表現為單發或多發低密度結節或腫塊影,邊界清楚,大多數密度均勻,可能與PHL為單一細胞堆積有關,少數病灶內部可有出血、中央瘢痕,治療后可見鈣化[12-13]。② MRI上T1WI呈稍低信號,而T2WI信號多樣,與淋巴瘤引起的炎癥反應程度有關,但以稍高信號為主[13]。因腫塊內僅含少量小血管并伴有間質形成,所以動脈早期腫塊常輕度強化,門靜脈期和延遲期因腫瘤內間質成分多則呈漸進性強化[14]。此外,約16%的病變動脈期可見邊緣環形強化,可能與鄰近肝實質引起的血管炎癥有關[15-16]。MRI肝膽期病灶內因無肝細胞成分而呈低信號,部分病灶內因含中央瘢痕可有對比劑滯留,呈稍高信號[17-18]。
彌漫浸潤型PHL的CT和MRI表現:① CT表現為肝臟彌漫性腫大,其病理基礎為腫瘤廣泛浸潤肝竇及肝小血管,導致肝細胞廣泛腫脹壞死。腫瘤浸潤肝實質表現為大片狀低密度影,無明顯結節、腫塊形成[8]。此型患者病情進展迅速,極易并發爆發性肝功能衰竭[19]。② MRI病灶呈T1WI稍低信號,T2WI稍高信號,增強呈無或輕度強化,肝膽期病灶呈低信號[8]。由于淋巴瘤細胞體積小、核質比高、細胞填充度高及細胞外間隙小,水分子擴散明顯受限,故DWI呈高信號[14]。本例病灶并沒有表現出明顯的彌散受限征象,筆者推測可能與病灶呈彌漫性生長而無明顯結節或腫塊形成,導致細胞外間隙較結節型PHL更大有關。此外,增強掃描時無論哪種分型的PHL均可顯示“血管漂浮征”[8, 17],這歸因于淋巴瘤起源于肝臟間質,臟器內原有的大血管在病變早期可能殘留。
4.3 鑒別診斷
結合本病例,需與以下引起肝臟彌漫性病變的疾病進行鑒別診斷。
4.3.1 腫瘤性病變
① 彌漫型肝細胞癌。首先,該病通常有肝炎病毒感染史、肝硬化背景、AFP及異常凝血酶原升高,而PHL患者AFP正常、乳酸脫氫酶升高[20];其次,因彌漫型肝細胞癌具有高度侵襲性,門靜脈癌栓是其常見表現,而PHL時肝血管傾向于穿過肝臟病變,表現為“血管漂浮征”,無明顯血管狹窄或中斷及充盈缺損征象;此外,PHL在正電子發射CT上通常表現為強烈的氟脫氫葡萄糖高攝取,而大多數肝細胞癌通常無氟脫氫葡萄糖攝取[19]。② 彌漫型肝血管肉瘤,患者肝功能多出現異常,AFP、CEA、CA19-9基本正常;CT及MRI表現為肝臟多發結節或腫塊影,通常不侵犯門靜脈或肝靜脈,典型強化模式為動脈期病灶中心及周邊明顯結節或斑片狀強化,強化程度高于肝實質,并持續填充式強化,少數病例表現為增強各期無或輕度強化[21-22],PHL表現與此病類似,二者極易混淆,需要組織病理學檢查證實。③ 彌漫性肝轉移瘤,其CT及MRI典型表現為“牛眼征”,可見邊緣環形強化,且其強化程度較PHL明顯,同時患者多有原發腫瘤史,且常伴有腹腔及腹膜后間隙淋巴結轉移,可與PHL鑒別。
4.3.2 血管性病變
① 肝竇阻塞綜合征,它常有明確的藥物(如菊三七)服用史,盡管它和PHL在影像學上都表現為肝臟體積彌漫增大,但肝竇阻塞綜合征平掃及增強掃描可見沿肝靜脈及屬支分布的“地圖狀或爪形”斑片影[23],而PHL肝臟受累表現為門靜脈周圍的片狀影,結合病史、病灶分布及強化方式可進行鑒別。② 布-加綜合征,其急性期肝臟體積增大,慢性期可見肝硬化、多發再生結節;增強掃描呈特征性“中心扇樣強化”,即尾狀葉及中央部強化明顯,而外周肝實質強化減低,延遲期整個肝實質密度趨于一致[23]。與PHL相比,布-加綜合征患者主要為慢性肝病表現,伴肝靜脈和(或)下腔靜脈狹窄、閉塞。
4.3.3 炎性病變
① 急性病毒性肝炎,它常有肝炎病毒感染史,典型表現為肝臟腫大,門靜脈周圍暈環征,病灶多沿門靜脈周圍及肝包膜下分布,增強掃描動脈期呈斑片狀強化,門靜脈期及延遲期較均勻強化,與周圍肝實質強化趨于一致;當肝細胞大片壞死時,可見“反轉”強化[24],即壞死區門靜脈期強化程度高于周圍正常肝實質,推測與病變區炎細胞浸潤,細胞間隙增大,血管間隙間的擴散速率改變有關[25];而彌漫型PHL三期多呈無或輕度強化,均低于相對正常肝實質密度[8, 26]。此外,急性病毒性肝炎的病程相對可逆,肝臟灌注異常可恢復正常;而PHL在影像隨訪中常表現出病變持續進展,具有侵襲性特征[19]。② 粟粒型肝結核,與PHL類似,患者常表現出低熱、體質量減輕等全身癥狀,影像表現為全肝彌漫分布的結節,常伴肝腫大,但肝結核存在多發、不同密度或信號的病灶共存特征,增強掃描多呈邊緣環形強化;此外,約75%的肝結核患者胸部影像檢查顯示有肺結核[27]。③ 肝臟結節病,該病少見,肝臟多發結節常位于門靜脈及其周圍區域,CT平掃呈低密度,增強掃描病灶呈輕度強化,相對周圍肝實質呈稍低密度[28];病變活動期MRI上T1WI呈低信號,T2WI呈高信號,伴彌散受限,慢性期因病灶纖維化T2WI多呈低信號,增強掃描與CT類似,患者常有胸部結節病的表現[29]。
5 總結
本例PHL為中年男性,CT表現為肝臟腫大并肝內彌漫性病灶,肝血管無明顯破壞及侵犯征象,無肝炎、肝硬化及惡性腫瘤病史,腫瘤標志物陰性,術前明確診斷困難。筆者認為,對于無典型影像學表現的肝臟彌漫性病變,在診斷與鑒別診斷時,能想到PHL的診斷著實不易。因此,尚需積累PHL病例,進一步總結PHL的影像學特點,為今后術前明確診斷提供依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:張奧翔和趙又瑾查閱文獻、撰寫及修改論文;陳衛霞和盧春燕審閱及修改論文。
倫理聲明:本研究通過了四川大學華西醫院生物醫學倫理審查委員會的審批 [批文編號:2022 年審(1487)號]。
原發性肝臟淋巴瘤(primary hepatic lymphoma,PHL)是指起源于肝內淋巴組織、無肝外浸潤的一類肝臟惡性腫瘤[1]。PHL占肝臟惡性腫瘤的0.1%,占結外非霍奇金淋巴瘤的0.4%[2]。PHL的臨床及影像學表現不典型,術前容易被誤診。根據腫瘤形態,PHL分為孤立結節型、多發結節型及彌漫浸潤型,其中孤立結節型相對多見[3]。筆者現報道1例經術后組織病理學檢查證實為彌漫浸潤型的PHL,該例患者的影像學表現相對于多數PHL更具有迷惑性,難以區分病灶與周圍正常肝實質。通過展示該病例的 CT 及 MRI 影像表現,分析其潛在的病理機制并進行相關鑒別診斷,以提高讀者對該病的認識及診斷意識。
1 患者基本信息
患者,男,51歲。因“皮膚和鞏膜黃染2年,腹痛及腹脹半個月,下肢水腫5 d”收入四川大學華西醫院(后文簡稱“我院”)。2年前患者無明顯誘因出現皮膚和鞏膜黃染,伴尿黃,未予以治療。患者于半個月前出現右上腹脹痛,無惡心、嘔吐、腹脹、嘔血、黑便等不適,于當地醫院對癥治療后癥狀無明顯好轉,遂轉入我院就診。查體:皮膚和鞏膜輕度黃染,肋下5 cm處可觸及肝臟,脾臟肋下未觸及,其余無特殊。血常規:淋巴細胞百分率(16.3%)低于正常值,單核細胞百分率(11.3%)高于正常值。肝腎功能:總膽紅素(131.9 μmol/L)、直接膽紅素(121.9 μmol/L)、丙氨酸轉氨酶(1 041 U/L)、天冬氨酸轉氨酶(1 331 U/L)、堿性磷酸酶(569 U/L)、谷氨酰轉肽酶(344 U/L)、乳酸脫氫酶(676 U/L)均高于正常值,總蛋白(55.2 g/L)及白蛋白(34.3 g/L)均低于正常值。血氨(54.6 μmol/L)高于正常值。乙型肝炎表面抗體(定量11.5 U/L)為陽性。腫瘤標志物檢查:甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)均陰性。免疫全套、自身免疫性肝病抗體、甲型肝炎抗體、戊型肝炎抗體均陰性。該患者入院后進一步行上腹部CT及MRI平掃及增強掃描。
2 影像學表現
患者行上腹部CT檢查:平掃(圖1a)顯示肝臟彌漫增大,包膜光整,實質密度不均勻減低;增強掃描(圖1b、1c)動脈期或門靜脈期顯示肝實質強化不均勻,多發結節、斑片狀及大片狀稍低密度影,部分融合,以肝右后葉最為明顯,肝內門靜脈通暢,未見充盈缺損征象,下腔靜脈、肝靜脈及其屬支變細,未見閉塞。上腹部MRI檢查示病灶T1加權成像(weighted imaging,WI)呈等或稍低信號(圖1d),T2WI呈稍高信號(圖1e),T1WI反相位(圖1D)對比同相位(圖1d)圖像病灶信號未見明顯變化。病灶彌散加權成像(diffusion-weighted imaging,DWI)呈稍高信號(圖1f),表觀彌散系數(apparent diffusion coefficient,ADC)呈稍低信號(圖1g),提示病灶輕度彌散受限;病灶邊界不清。增強掃描動脈期顯示病灶未見明顯強化(圖1h),門靜脈期(圖1i)及延遲期(圖1j)病變呈進行性延遲強化,但強化程度均低于周圍肝實質,門靜脈未見增寬及充盈缺損征象(圖1h~1j),肝靜脈稍變細(圖1i、1j)。上述肝內彌漫病變,考慮腫瘤性病變?或血管源性病變?或其他?需結合臨床及其他檢查進一步明確診斷。
 圖1
示上腹部CT平掃+增強掃描和上腹部MRI平掃+增強掃描以及組織學檢查結果
圖1
示上腹部CT平掃+增強掃描和上腹部MRI平掃+增強掃描以及組織學檢查結果
a:肝臟CT平掃顯示肝臟彌漫增大,包膜光整,實質密度不均勻減低;b、c:CT增強掃描顯示肝實質強化不均勻,多發結節、斑片狀及大片狀低密度影,部分融合(紅圈范圍內所示),以肝右后葉更明顯,肝內門靜脈通暢(白箭),下腔靜脈肝段及屬支變細(白箭頭);d~j:MRI T1WI平掃同相位圖像顯示病灶呈等或稍低信號(d)、壓脂T2WI呈稍高信號(e),T1WI反相位(D)病灶未見信號衰減,DWI呈稍高信號(f)、ADC呈稍低信號(g),增強掃描動脈期未見明顯強化(h,白箭),門靜脈期(i)及延遲期(j)病變呈進行性延遲強化,但強化程度低于周圍肝實質,門靜脈未見增寬、其內未見異常信號(白箭),肝靜脈稍變細(白箭頭);k:肝臟病灶穿刺標本組織病理學查見異型細胞,疑腫瘤(蘇木精-伊紅染色 ×40);l:淋巴瘤B細胞標志物CD-20染色陽性(免疫組織化學染色 ×40)
3 術后病理學檢查結果
入院后,患者行肝臟超聲穿刺活檢。術后病理學檢查結果:查見異型細胞(圖1k),免疫組織化學染色CD20(+,圖1l)、CD79a(+)、CD3(–)、CD10(+)、Bcl-6(+)、多發性骨髓瘤致癌蛋白-1(+)、Bcl-2(+,>90%)、C-myc(+,約50%)、CD30(–)、免疫球蛋白G4(–)、CD38 (灶+)、廣譜細胞角蛋白(–)、上皮膜抗原(–)、細胞角蛋白7(–)、S-100 (–)、CD56(–)、乙型肝炎表面抗原(–)、乙型肝炎核心抗原(–)、Ki-67(Mindbomb同源物1)(+,90%)。特殊染色:Foot及Masson染色示纖維組織增生,銅染色、鐵染色、PAS及D-PAS未見明顯異常。PCR+Genscan基因重排檢測示病灶內未查見免疫球蛋白重鏈基因和免疫球蛋白kappa基因克隆性擴增峰。綜上,考慮非霍奇金淋巴瘤,大B細胞淋巴瘤(侵襲性),多系生發中心B細胞源性(Hans分型)。
4 討論
4.1 PHL的臨床及病理特點
PHL病因不明確。目前認為可能與肝炎病毒感染、原發性膽汁性肝硬化等有關[4]。
4.1.1 臨床表現
PHL多見于中老年人,平均發病年齡為50歲,且以男性多見[5]。PHL臨床表現無特異性,多見上腹部不適,也可以表現為皮膚和鞏膜黃染、體質量下降、發熱、惡心等[6]。本例患者即以皮膚和鞏膜黃染、上腹部脹痛前來就診。
4.1.2 實驗室結果
PHL實驗室檢查常表現為乙型肝炎或丙型肝炎陽性,血清乳酸脫氫酶升高,但腫瘤相關抗原如AFP多呈陰性。有研究者[7-8]認為,乳酸脫氫酶升高可以作為PHL診斷的敏感指標,但特異性不高。目前關于乳酸脫氫酶升高與PHL發生的相關機制尚不明確。
4.1.3 組織病理學特點
非霍奇金淋巴瘤是PHL的主要組織學亞型,以彌漫性大B細胞型淋巴瘤為主,約占所有PHL的90%以上;其次為T細胞淋巴瘤,占5%~10%[9]。PHL可能起源于肝匯管區的淋巴組織,呈結節狀或彌漫性生長。當呈腫瘤結節狀生長時,淋巴瘤細胞破壞周圍肝板結構,受累區無匯管區結構殘留;當呈彌漫性生長時,腫瘤細胞通常沿肝竇狀間隙生長,肝實質結構得到保留[10-11]。
總之,PHL術前診斷困難,最終需依靠組織病理學及免疫組織化學檢查確診。
4.2 PHL的影像學表現及其相關病理基礎
根據PHL病變的大體形態,PHL的CT及MRI可表現為結節型和彌漫浸潤型。① 結節型又表現為孤立型和多發型,孤立型約占82.5%,表現為肝內單發大結節或腫塊型病灶;多發型約占15%,表現為肝內散在多發小結節病灶,單個病灶直徑通常<3 cm[2]。② 彌漫浸潤型,該型約占2.5%,表現為肝內彌漫浸潤性病灶,常無明確的結節和腫塊形成,較為罕見,預后較差[2]。
孤立和多發結節型PHL的CT和MRI表現:① CT平掃表現為單發或多發低密度結節或腫塊影,邊界清楚,大多數密度均勻,可能與PHL為單一細胞堆積有關,少數病灶內部可有出血、中央瘢痕,治療后可見鈣化[12-13]。② MRI上T1WI呈稍低信號,而T2WI信號多樣,與淋巴瘤引起的炎癥反應程度有關,但以稍高信號為主[13]。因腫塊內僅含少量小血管并伴有間質形成,所以動脈早期腫塊常輕度強化,門靜脈期和延遲期因腫瘤內間質成分多則呈漸進性強化[14]。此外,約16%的病變動脈期可見邊緣環形強化,可能與鄰近肝實質引起的血管炎癥有關[15-16]。MRI肝膽期病灶內因無肝細胞成分而呈低信號,部分病灶內因含中央瘢痕可有對比劑滯留,呈稍高信號[17-18]。
彌漫浸潤型PHL的CT和MRI表現:① CT表現為肝臟彌漫性腫大,其病理基礎為腫瘤廣泛浸潤肝竇及肝小血管,導致肝細胞廣泛腫脹壞死。腫瘤浸潤肝實質表現為大片狀低密度影,無明顯結節、腫塊形成[8]。此型患者病情進展迅速,極易并發爆發性肝功能衰竭[19]。② MRI病灶呈T1WI稍低信號,T2WI稍高信號,增強呈無或輕度強化,肝膽期病灶呈低信號[8]。由于淋巴瘤細胞體積小、核質比高、細胞填充度高及細胞外間隙小,水分子擴散明顯受限,故DWI呈高信號[14]。本例病灶并沒有表現出明顯的彌散受限征象,筆者推測可能與病灶呈彌漫性生長而無明顯結節或腫塊形成,導致細胞外間隙較結節型PHL更大有關。此外,增強掃描時無論哪種分型的PHL均可顯示“血管漂浮征”[8, 17],這歸因于淋巴瘤起源于肝臟間質,臟器內原有的大血管在病變早期可能殘留。
4.3 鑒別診斷
結合本病例,需與以下引起肝臟彌漫性病變的疾病進行鑒別診斷。
4.3.1 腫瘤性病變
① 彌漫型肝細胞癌。首先,該病通常有肝炎病毒感染史、肝硬化背景、AFP及異常凝血酶原升高,而PHL患者AFP正常、乳酸脫氫酶升高[20];其次,因彌漫型肝細胞癌具有高度侵襲性,門靜脈癌栓是其常見表現,而PHL時肝血管傾向于穿過肝臟病變,表現為“血管漂浮征”,無明顯血管狹窄或中斷及充盈缺損征象;此外,PHL在正電子發射CT上通常表現為強烈的氟脫氫葡萄糖高攝取,而大多數肝細胞癌通常無氟脫氫葡萄糖攝取[19]。② 彌漫型肝血管肉瘤,患者肝功能多出現異常,AFP、CEA、CA19-9基本正常;CT及MRI表現為肝臟多發結節或腫塊影,通常不侵犯門靜脈或肝靜脈,典型強化模式為動脈期病灶中心及周邊明顯結節或斑片狀強化,強化程度高于肝實質,并持續填充式強化,少數病例表現為增強各期無或輕度強化[21-22],PHL表現與此病類似,二者極易混淆,需要組織病理學檢查證實。③ 彌漫性肝轉移瘤,其CT及MRI典型表現為“牛眼征”,可見邊緣環形強化,且其強化程度較PHL明顯,同時患者多有原發腫瘤史,且常伴有腹腔及腹膜后間隙淋巴結轉移,可與PHL鑒別。
4.3.2 血管性病變
① 肝竇阻塞綜合征,它常有明確的藥物(如菊三七)服用史,盡管它和PHL在影像學上都表現為肝臟體積彌漫增大,但肝竇阻塞綜合征平掃及增強掃描可見沿肝靜脈及屬支分布的“地圖狀或爪形”斑片影[23],而PHL肝臟受累表現為門靜脈周圍的片狀影,結合病史、病灶分布及強化方式可進行鑒別。② 布-加綜合征,其急性期肝臟體積增大,慢性期可見肝硬化、多發再生結節;增強掃描呈特征性“中心扇樣強化”,即尾狀葉及中央部強化明顯,而外周肝實質強化減低,延遲期整個肝實質密度趨于一致[23]。與PHL相比,布-加綜合征患者主要為慢性肝病表現,伴肝靜脈和(或)下腔靜脈狹窄、閉塞。
4.3.3 炎性病變
① 急性病毒性肝炎,它常有肝炎病毒感染史,典型表現為肝臟腫大,門靜脈周圍暈環征,病灶多沿門靜脈周圍及肝包膜下分布,增強掃描動脈期呈斑片狀強化,門靜脈期及延遲期較均勻強化,與周圍肝實質強化趨于一致;當肝細胞大片壞死時,可見“反轉”強化[24],即壞死區門靜脈期強化程度高于周圍正常肝實質,推測與病變區炎細胞浸潤,細胞間隙增大,血管間隙間的擴散速率改變有關[25];而彌漫型PHL三期多呈無或輕度強化,均低于相對正常肝實質密度[8, 26]。此外,急性病毒性肝炎的病程相對可逆,肝臟灌注異常可恢復正常;而PHL在影像隨訪中常表現出病變持續進展,具有侵襲性特征[19]。② 粟粒型肝結核,與PHL類似,患者常表現出低熱、體質量減輕等全身癥狀,影像表現為全肝彌漫分布的結節,常伴肝腫大,但肝結核存在多發、不同密度或信號的病灶共存特征,增強掃描多呈邊緣環形強化;此外,約75%的肝結核患者胸部影像檢查顯示有肺結核[27]。③ 肝臟結節病,該病少見,肝臟多發結節常位于門靜脈及其周圍區域,CT平掃呈低密度,增強掃描病灶呈輕度強化,相對周圍肝實質呈稍低密度[28];病變活動期MRI上T1WI呈低信號,T2WI呈高信號,伴彌散受限,慢性期因病灶纖維化T2WI多呈低信號,增強掃描與CT類似,患者常有胸部結節病的表現[29]。
5 總結
本例PHL為中年男性,CT表現為肝臟腫大并肝內彌漫性病灶,肝血管無明顯破壞及侵犯征象,無肝炎、肝硬化及惡性腫瘤病史,腫瘤標志物陰性,術前明確診斷困難。筆者認為,對于無典型影像學表現的肝臟彌漫性病變,在診斷與鑒別診斷時,能想到PHL的診斷著實不易。因此,尚需積累PHL病例,進一步總結PHL的影像學特點,為今后術前明確診斷提供依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:張奧翔和趙又瑾查閱文獻、撰寫及修改論文;陳衛霞和盧春燕審閱及修改論文。
倫理聲明:本研究通過了四川大學華西醫院生物醫學倫理審查委員會的審批 [批文編號:2022 年審(1487)號]。