引用本文: 王小勇, 馮敏, 唐小軍. 超抗原葡萄球菌腸毒素 B 對 Lewis 肺癌荷瘤小鼠抗腫瘤研究. 中國呼吸與危重監護雜志, 2022, 21(3): 195-199. doi: 10.7507/1671-6205.202112015 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
肺癌是發病率和死亡率最高的惡性腫瘤,目前治療效果仍令人不甚滿意[1-3]。免疫治療是近年來進展最大,也最令人期待的腫瘤治療方法。將免疫原性強的外源性抗原引入腫瘤宿主,刺激宿主產生強烈的免疫反應,達到抑制甚至消除腫瘤細胞,是腫瘤免疫治療的策略之一。葡萄球菌腸毒素 B(staphylococcus enterotoxin B,SEB)是來源于金黃色葡萄球菌的一種外源性腸毒素,具有超抗原的特性,具有強烈的激活免疫系統能力[4-5]。本研究合成了 SEB 基因的表達質粒,通過瘤內注射,觀察其對 Lewis 肺癌細胞在小鼠體內生長的抑制作用,并以此初步探索 SEB 作為外源性抗原基因的肺癌免疫基因治療的可行性。
1 材料與方法
1.1 材料
SEB 基因由 Invitrogen 公司合成,小鼠 Lewis 肺癌細胞來源于中科院細胞庫;C57 小鼠(無特定病原級)來源于四川大學[SCXK(川)2013-026]并飼養于西南醫科大學實驗動物中心[許可證號SYXK(川)2018-065],倫理批準文號:SWMU202110422;脂質體(lipofectamine2000)購自 Invitrogen 公司;酶聯免疫吸附試驗試劑盒購于康肽生物;SEB 抗體購于 Abcam 公司;Dulbecco 改良 Eagle 培養基及小牛血清購買于 Hyclone 公司。
1.2 方法
1.2.1 制備 SEB 基因表達質粒
(1)SEB 基因的合成及驗證。查詢 GeneBank 中 SEB 基因的 cDNA 序列,合成含 SEB的基因序列(由 Invitrogen 完成)。
(2)SEB 基因的擴增。設計擴增 SEB 基因的引物,上游引物:5'-AAGTATCTAGAGATGCCACCATGTACAACAGACTCTTCGTCAGCC-3',5’端含酶切位點XbaI(TCTAGA);下游引物:5'-GCCGAGGATCCTCACTTCTTCTTAGTTGTCAGGTATA-3’,5’端含酶切位點 BamHI(GGATCC),聚合酶鏈反應擴增獲取 SEB 基因,產物大小 801 bp。
(3)構建SEB表達質粒 PCDH-SEB-GFP。SEB 的聚合酶鏈反應擴增產物和載體質粒PCDH-CMV-GFP 用 XbaI、BamHI 進行雙酶切,然后作連接反應,轉化 DH5α 感受態細菌,質粒提取,獲取的重組質粒做酶切鑒定,重建成功的 SEB 表達質粒命名為 PCDH-SEB-GFP。
1.2.2 SEB 表達質粒 PCDH-SEB-GFP 轉染 Lewis 細胞并采用蛋白免疫印跡法檢測 SEB的表達
(1)將 PCDH-SEB-GFP 轉染 Lewis 肺癌細胞。在 6 孔培養板接種 Lewis 肺癌細胞,每孔細胞數目為 1.5×106 個,放入孵箱中培養至細胞匯合度達到 90% 左右。在 PCDH-SEB-GFP組中,將質粒 PCDH-SEB-GFP 4 μg加入 250 μL 無血清培養基組成溶液 A,將 16 μL 的脂質體加入到 50 μL 無血清培養基組成溶液 B,室溫放置 5 min 后,將溶液 A、B 混合室溫放置 20 min,加入到 6 孔板培養的 Lewis 肺癌細胞中,混合均勻,開始轉染實驗。PCDH-CMV-GFP 組采用相似方法將質粒 PCDH-CMV-GFP 轉染 Lewis 肺癌細胞。而 Lewis 肺癌細胞組為未被轉染的正常生長的 Lewis 肺癌細胞。轉染 24 h 后在熒光顯微鏡下觀察轉染效果。
(2)轉染細胞蛋白提取。轉染 Lewis 肺癌細胞 48 h 后,用 RIPA 裂解液提取細胞總蛋白。
(3)采用蛋白免疫印跡法檢測轉染細胞中 SEB 的表達。將步驟(2)獲得的蛋白質,用蛋白免疫印跡法檢測 SEB 的表達情況。過程簡述如下:蛋白樣品用 10% 的十二烷基硫酸鈉–聚丙烯酰胺凝膠電泳分離(濃縮膠電泳時電壓 60 V,50 min,分離膠電泳時電壓為 120 V,1 h),蛋白轉于聚偏氟乙烯膜(轉膜電壓100 V,1 h)。5% 脫脂牛奶封閉 1 h,一抗孵育(SEB兔多克隆抗體,1∶500),4 ℃ 過夜,漂洗膜 5 次(5 min/次)后再進行二抗孵育(羊抗兔,1∶3000),室溫孵育 2 h。經自動凝膠成像分析儀采集圖像。
1.2.3 Lewis 肺癌荷瘤小鼠模型構建
小鼠 18 只,雄性,4~6 周齡,體重 16~20 g。置于無特定病原體動物房中飼養,所需飼料、飲水經滅菌處理,采取自由進食及飲水,每天更換飲水、飼料及無菌墊料。取對數生長期的 Lewis 肺癌細胞,使用胰酶消化,檢測細胞活性在 90% 以上,使用磷酸鹽緩沖鹽溶液調整細胞濃度為 1.5×107 個/mL。在小鼠右側腋窩皮下接種 0.2 mL(3×106 個)細胞混懸液,當腫瘤體積達到約50 mm3 將小鼠隨機分為實驗組、陰性對照組和空白對照組,每組 6 只。
1.2.4 SEB 表達質粒 PCDH-SEB-GFP 治療試驗
將質粒與脂質體制備成轉染混合液,其中,質粒 20 μg,脂質體 20 μL。實驗組小鼠瘤內注射含質粒 PCDH-SEB-GFP 的混合液,陰性對照組瘤內注射等量的空載體質粒 PCDH-CMV-GFP 的混合液,空白對照組注射等體積磷酸鹽緩沖鹽溶液與脂質體制備的混合液,每 3 天注射1次,共進行 3 次注射,每 2 天計算腫瘤體積,繪制腫瘤生長曲線,腫瘤體積=(A×B2)×0.5,其中,A 為腫瘤長徑;B 為腫瘤短徑。
1.2.5 不良反應觀察
觀察實驗過程中小鼠有無嘔吐、行動障礙、腹瀉、死亡等。
1.2.6 病理檢查
治療試驗開始后第 8 天處死荷瘤小鼠,解剖并完整取出瘤體,稱量每只小鼠的瘤體質量。腫瘤組織用 4% 中性甲醛固定,石蠟包埋,切片,蘇木精–伊紅染色,觀察腫瘤組織壞死及炎癥細胞浸潤情況。免疫組織化學檢測腫瘤組織中 SEB 的表達,SEB 抗體稀釋液(1∶1000)50 μL,二抗(羊抗兔)稀釋液(1∶2000)50 μL。
1.2.7 酶聯免疫吸附試驗檢測各組小鼠血清炎癥因子 γ 干擾素和腫瘤壞死因子-α 水平
治療試驗第 8 天剝除小鼠眼球采血,獲得血清,4 ℃過夜后進行酶聯免疫吸附試驗,檢測各組小鼠血清 γ 干擾素(interferon gamma,IFN-γ)和腫瘤壞死因子-α(tumor necrosis factor alpha,TNF-α)水平。每孔加入 100 μL 待測溶液,孵育條件為 37 ℃、2 h,去除反應液后進行抗原洗脫和酶標抗體結合,孵育洗脫后,加入底物進行顯色反應,計算光密度值。
1.3 統計學方法
采用 SPSS 22 統計軟件。結果采用均數±標準差( ±s)表示,組間比較采用方差分析,P<0.05 為差異有統計學意義。
±s)表示,組間比較采用方差分析,P<0.05 為差異有統計學意義。
2 結果
2.1 重組質粒 PCDH-SEB-GFP 鑒定結果
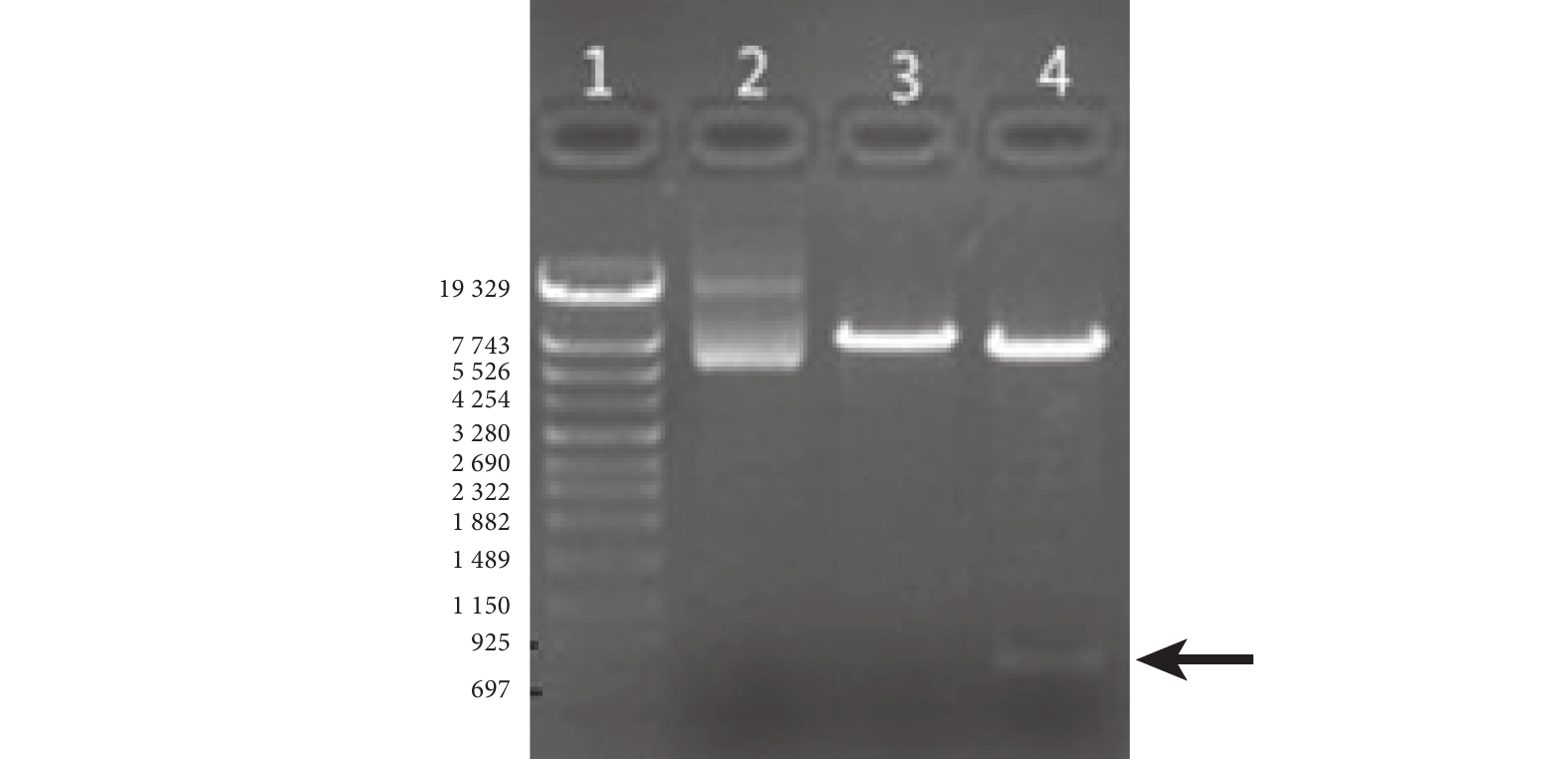
凝膠電泳實驗結果顯示,重組質粒 PCDH-SEB-GFP 經 XbaI、BamHI 雙酶切,在697~925 bp 間(黑色箭頭)有 DNA 條帶,該 DNA 條帶大小與目的基因大小相符(圖 1)。
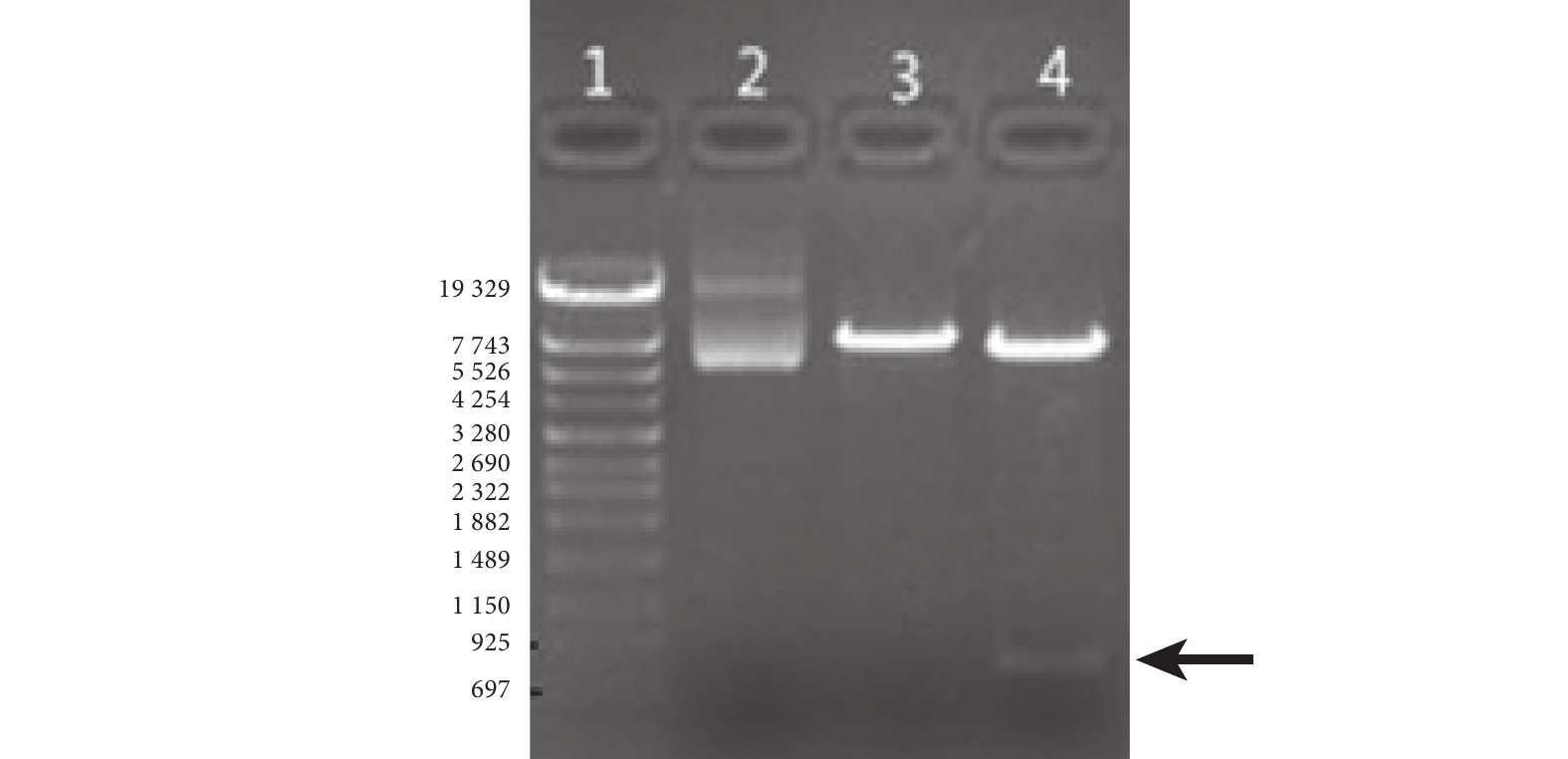 圖1
PCDH-SEB-GFP 質粒 XbaI、BamHI 雙酶切鑒定結果
圖1
PCDH-SEB-GFP 質粒 XbaI、BamHI 雙酶切鑒定結果
1:DNA Marker;2:未做酶切;3:單酶切;4:雙酶切。黑箭指示條帶的大小與目的基因大小相符。
2.2 熒光顯微鏡觀察轉染效果
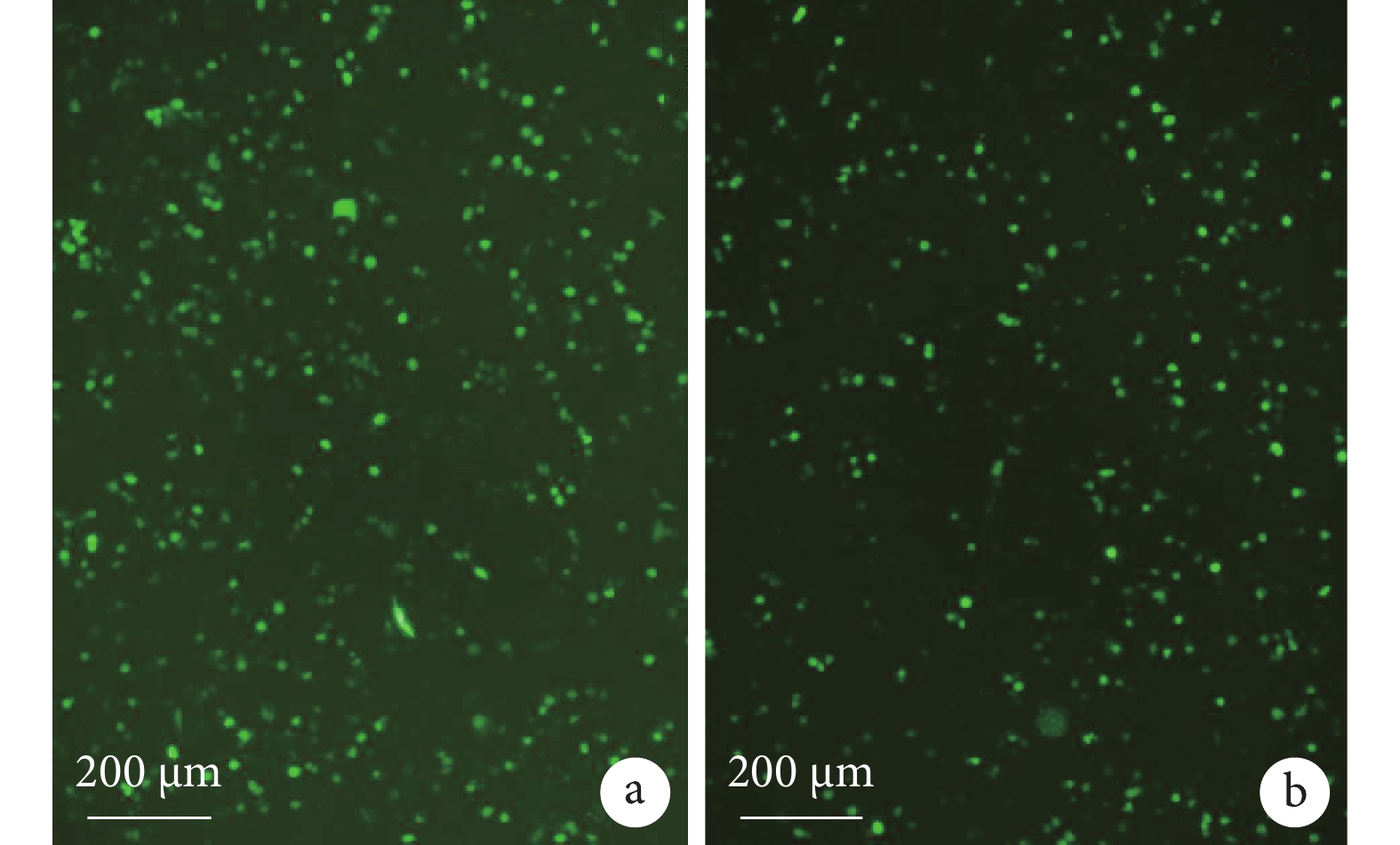
轉染實驗后在 PCDH-SEB-GFP 組和 PCDH-CMV-GFP 組中均能觀察到綠色熒光蛋白(green fluorescent protein,GFP)表達(圖 2)。
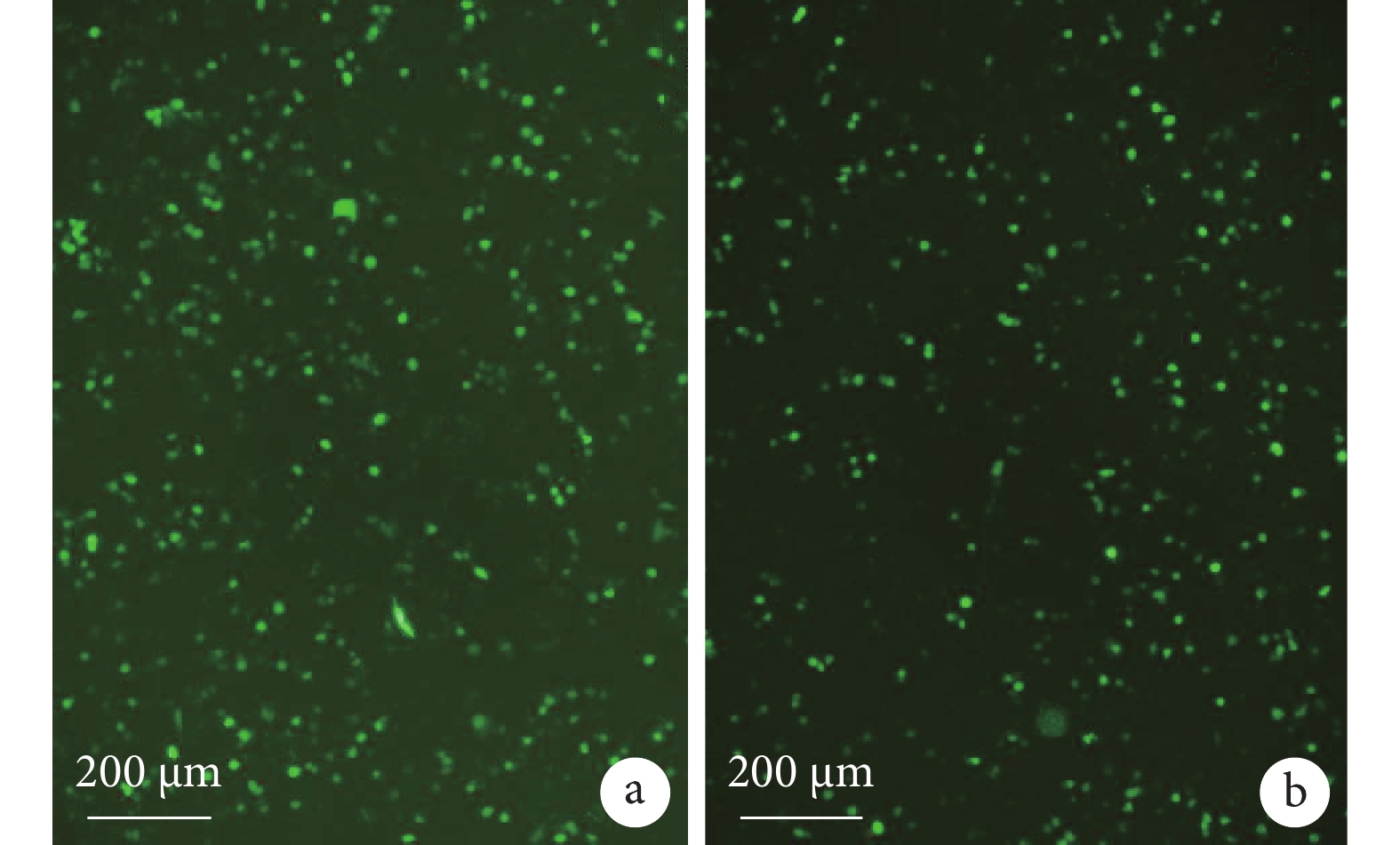 圖2
轉染實驗熒光檢測像(×100)
圖2
轉染實驗熒光檢測像(×100)
a. PCDH-SEB-GFP 組;b. PCDH-CMV-GFP 組。轉染實驗后在 PCDH-SEB-GFP 組和 PCDH-CMV-GFP 組中均能觀察到GFP表達。
2.3 蛋白免疫印跡法檢測結果
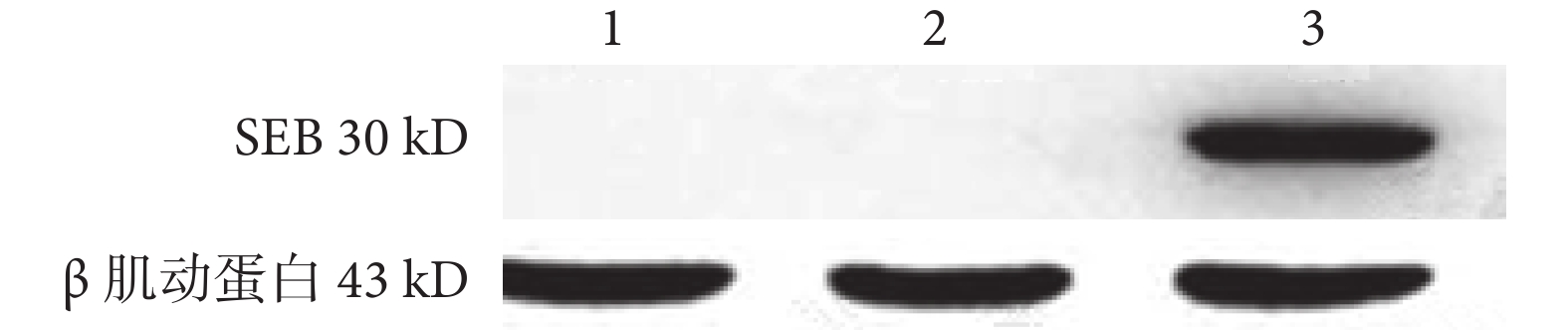
蛋白免疫印跡法檢測結果顯示,在 PCDH-SEB-GFP 組中用含有 SEB 基因的重組質粒PCDH-SEB-GFP 轉染 Lewis 肺癌細胞后能檢測到 SEB 蛋白表達,SEB 蛋白大小約 30 kD。而 Lewis 肺癌細胞組和 PCDH-CMV-GFP 組未檢測到 SEB 蛋白表達(圖 3)。
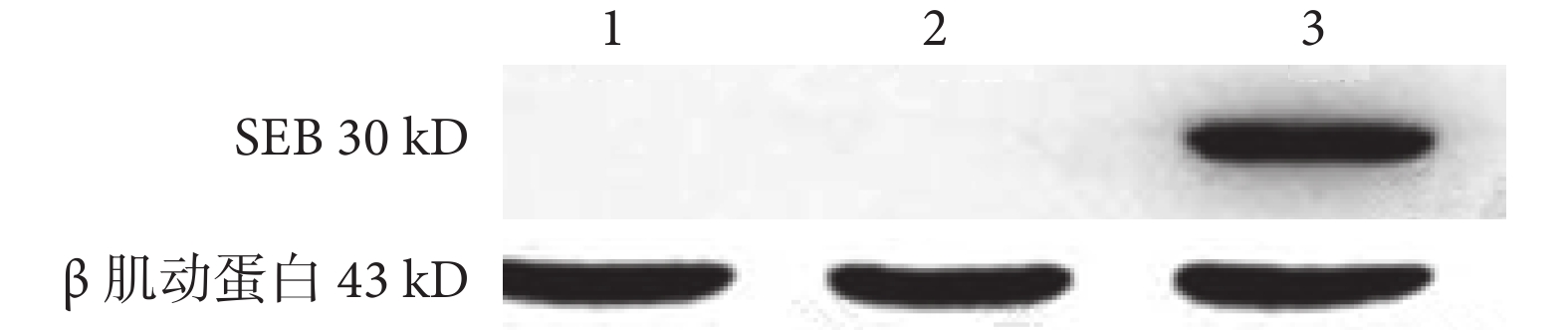 圖3
蛋白免疫印跡法檢測像
圖3
蛋白免疫印跡法檢測像
1. PCDH-CMV-GFP 組;2. Lewis 肺癌細胞組;3. PCDH-SEB-GFP 組。內參為 β 肌動蛋白,其大小為 43 kD。
2.4 腫瘤抑制實驗結果
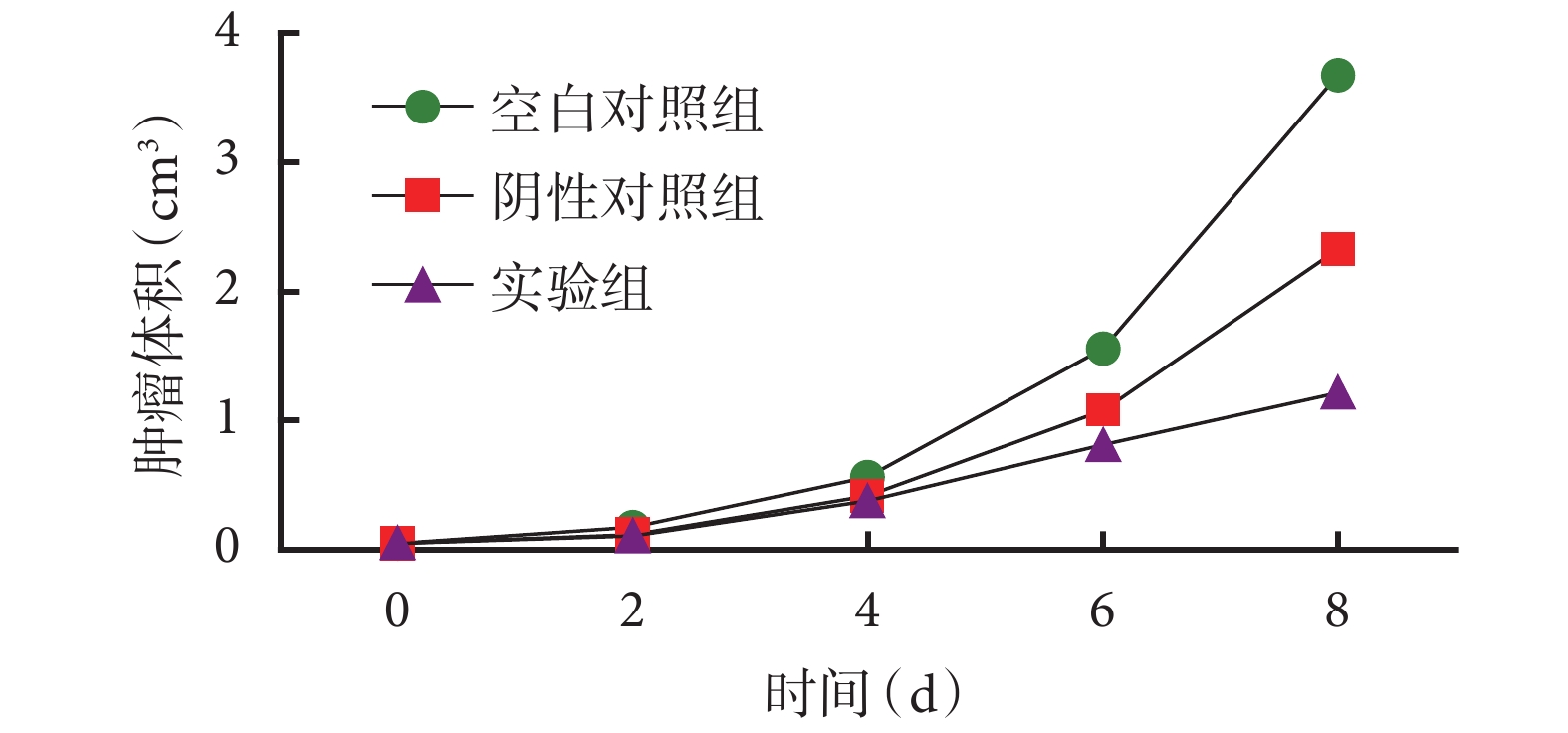
腫瘤抑制實驗開始后,實驗組、陰性對照組、空白對照組腫瘤體積呈逐漸增長趨勢,實驗組腫瘤體積增長最緩慢,空白對照組增長最迅速(圖 4)。處死小鼠后獲取腫瘤組織,三組平均瘤重分別為(1.02±0.47)、(2.24±0.87)、(3.32±1.04)g,各組間有顯著差異(P=0.001);兩兩比較:實驗組平均瘤重低于空白對照組(P=0.000)及陰性對照組(P=0.022);陰性對照組平均瘤重低于空白對照組(P=0.040)(圖 5)。
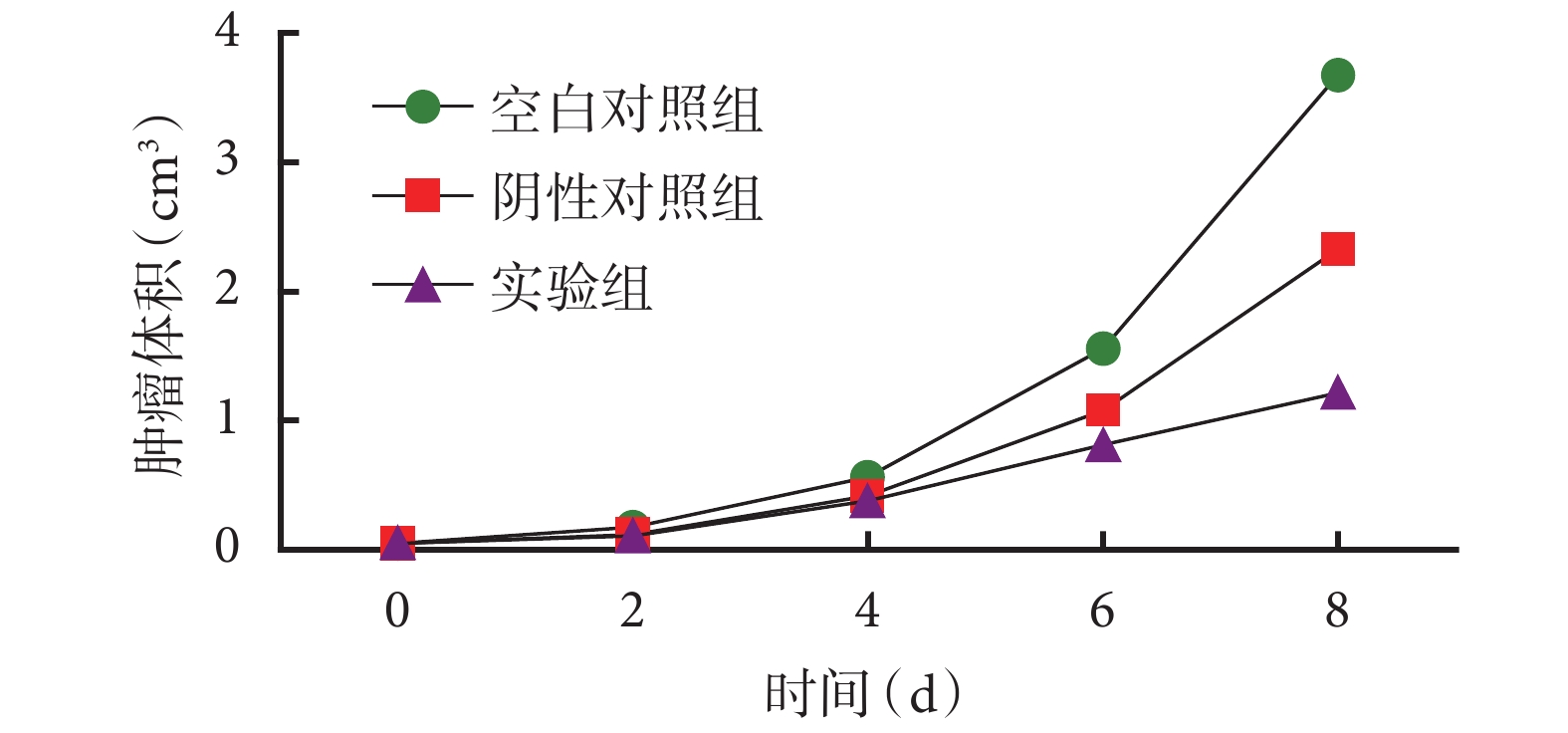 圖4
各組小鼠腫瘤生長曲線
圖4
各組小鼠腫瘤生長曲線
 圖5
獲取的各組小鼠腫瘤組織大體像
圖5
獲取的各組小鼠腫瘤組織大體像
a. 實驗組;b. 陰性對照組;c. 空白對照組。
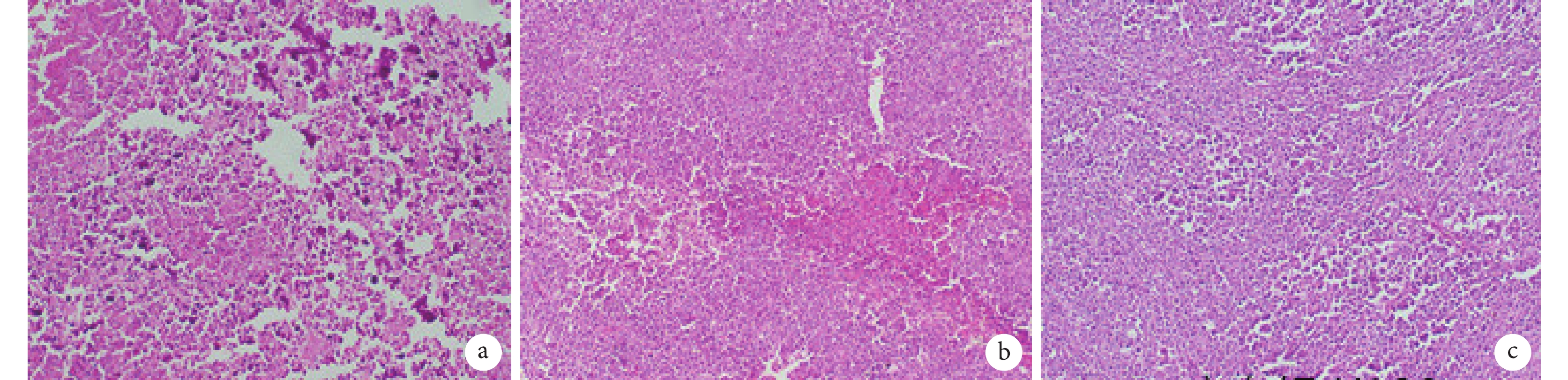
2.5 移植瘤病理檢查
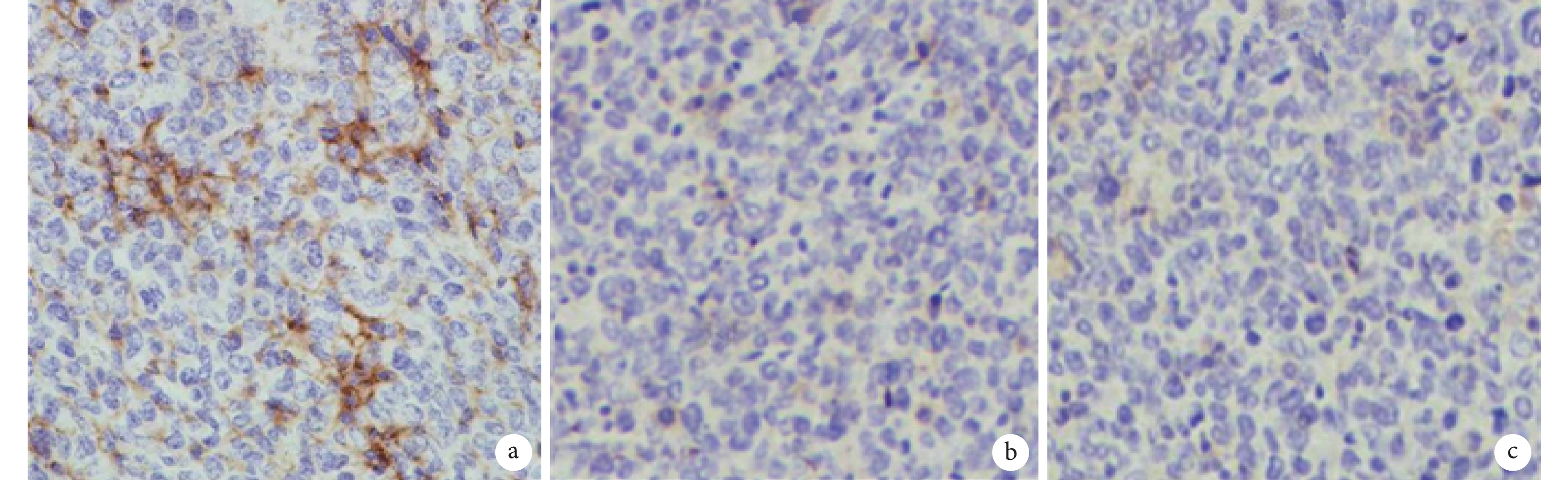
實驗組小鼠腫瘤見明顯出血、壞死,伴有炎癥細胞浸潤;陰性對照組程度明顯減輕;而空白對照組無上述改變(圖 6)。免疫組織化學檢測結果顯示,實驗組腫瘤組織中有 SEB 蛋白表達,而其余兩組無 SEB 蛋白表達(圖 7)。
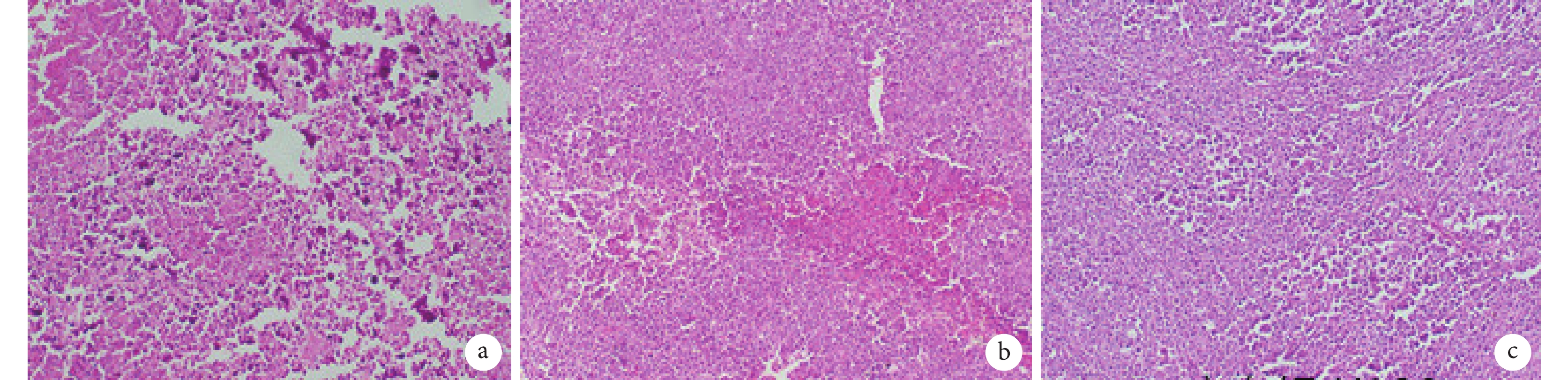 圖6
各組小鼠腫瘤病理檢查(蘇木精–伊紅×100)
圖6
各組小鼠腫瘤病理檢查(蘇木精–伊紅×100)
a. 實驗組;b. 陰性對照組;c. 空白對照組。實驗組小鼠移植瘤見明顯出血、壞死,伴有炎癥細胞浸潤;陰性對照組上述程度明顯減輕;而空白對照組無上述改變。
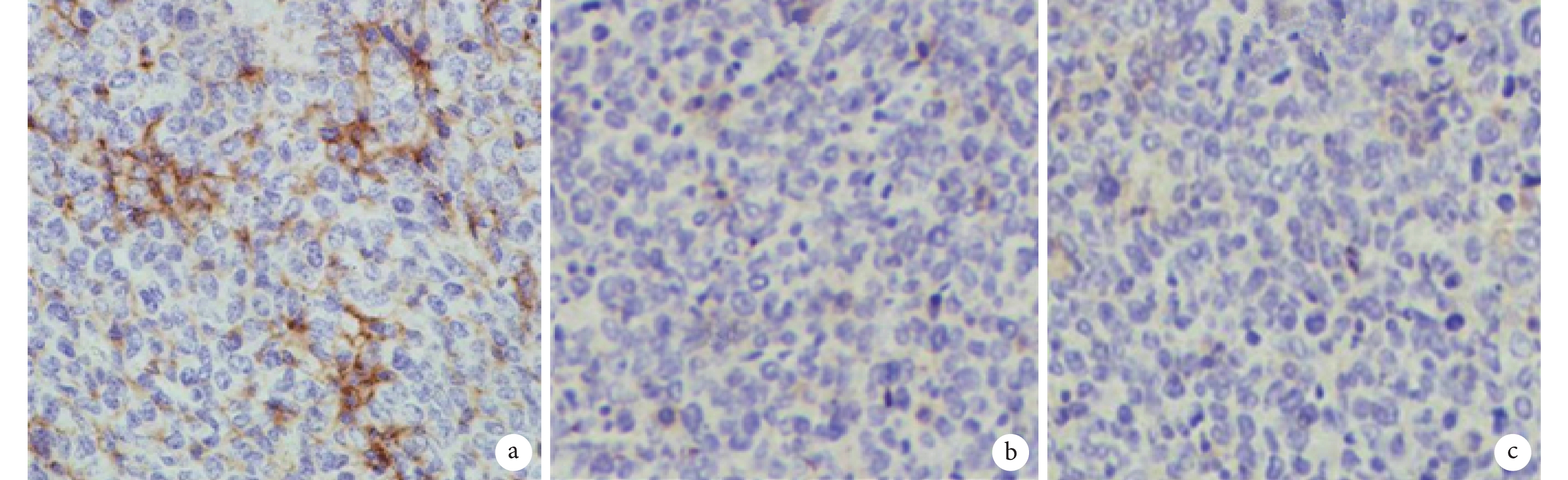 圖7
各組小鼠移植瘤病理檢查像(免疫組織化學×400)
圖7
各組小鼠移植瘤病理檢查像(免疫組織化學×400)
a. 實驗組;b. 陰性對照組;c. 空白對照組。實驗組小鼠移植瘤組織中有 SEB 蛋白表達,而其余兩組無 SEB 蛋白表達。
2.6 各組小鼠血清 TNF-α 和 IFN-γ 檢測
實驗組、陰性對照組、空白對照組血清 TNF-α 平均濃度分別為(157.0±97.1)、(141.7±69.3)、(92.6±43.2)pg/mL,差異無統計學意義(P=0.310);血清 IFN-γ 平均濃度分別為(207.5±71.2)、(206.8±21.3)、(191.5±52.1)pg/mL,差異無統計學意義(P=0.838)。
3 討論
引入外源抗原基因使其在腫瘤中表達,刺激宿主產生強烈的免疫應答,以獲得抗腫瘤作用,是腫瘤免疫治療的策略之一[6]。超抗原為細菌、病毒產生的一類外分泌抗原物質[5],微量劑量就能強烈刺激免疫細胞增殖,增強免疫能力。報道顯示超抗原能使體內多達 40% 的 T 淋巴細胞激活,大幅超過普通抗原的激活能力[7]。SEB 為金黃色葡萄球菌外分泌蛋白之一,具有超抗原屬性,通過直接呈遞抗原的形式與主要組織相容性復合體 Ⅱ 類分子和 T 淋巴細胞受體的特定 Vβ 區結合,進而導致 T 淋巴細胞的激活,產生免疫效應分子(如白細胞介素-2、TNF-α 和 IFN-γ)殺滅腫瘤細胞,同時也可以激活 T 淋巴細胞直接殺滅腫瘤細胞[8-10]。SEB 在抗腫瘤領域具有重要研究價值,研究中發現 SEB 對伴有惡性胸腔積液的晚期肺癌、卵巢癌具有抗腫瘤作用[11-12]。Ejtehadifar 等[13]發現 SEB 具有的超抗原特性能抑制多發性骨髓瘤腫瘤細胞的增殖和存活,具有抗腫瘤生長作用。本實驗發現實驗組中腫瘤體積及質量明顯小于其余兩組,說明 SEB 能起到抑制小鼠 Lewis 肺癌生長的作用。
在將 SEB 基因轉導入實驗動物體內的途徑有瘤體注射、體腔注射、靜脈注射等,本研究采用了瘤內注射的方法,主要是考慮到含有 SEB 基因的質粒為非腫瘤靶向性載體,如果采用靜脈或體腔注射,可能因藥物缺乏選擇性,出現抗腫瘤效果不佳,而加大劑量則可能導致嚴重的全身不良反應[14]。通過瘤內注射的方式可以使 SEB 表達及其誘導的免疫應答盡量局限于腫瘤局部,避免正常組織產生嚴重炎癥反應。SEB 基因作為原核生物基因可以在原核表達體系中表達,能否在真核細胞中表達是該實驗的關鍵所在[15]。朱大冕等[16]研究發現,構建含有超抗原SEA基因的真核表達載體,并將其轉染人肺腺癌后可以檢測到 SEA 蛋白的表達。我們的研究也進一步證實,在實驗組小鼠瘤體內注射含有 SEB 基因的質粒,通過免疫組織化學方式可在小鼠腫瘤組織中檢測到 SEB 的表達,說明該干預措施是可行和有效的,且實驗組中有 SEB 表達,而其他兩組無 SEB 表達。
本研究還發現,陰性對照組腫瘤體積及質量低于空白對照組,其可能的原因是陰性對照組小鼠瘤體內注射的質粒雖不含 SEB 基因,該載體含有 GFP 基因,相對小鼠而言,GFP 也是一種作為外源性蛋白,也具有一定的免疫原性,可以在腫瘤局部激活小鼠的免疫反應,從而產生抑瘤作用。實驗組腫瘤體積及質量小于陰性對照組可能是 SEB 和 GFP 相結合而呈現出更明顯的抑制腫瘤的作用。既往研究發現 GFP 可以通過主要組織相容性復合體介導的細胞毒性 T 細胞途徑發揮免疫作用,已證實其可刺激免疫反應產生 IFN-γ 等達到抗腫瘤作用[17-18]。該觀點與本文結論相符合。
通過瘤內注射的方式下,三組小鼠均未出現嚴重不良反應甚至死亡,尤其是實驗組小鼠未出現嚴重不良反應,說明 SEB 雖具有強烈的刺激免疫能力,但瘤內注射是比較安全的干預途徑。三組小鼠血清中細胞因子 IFN-γ、TNF-α 濃度沒有明顯的差異,分析原因可能是,通過瘤內注射的方式,免疫反應多局限于瘤體周圍,全身免疫反應較輕,因此產生的細胞因子濃度較低。Fooladi 等[19]的研究也證實了瘤體注射局部產生的 IFN-γ 和 T 淋巴細胞浸潤少于靜脈注射。本實驗也存在一定局限性,SEB 轉染腫瘤細胞是非特異性的,如果能通過靶向性方式使腫瘤細胞特異性表達 SEB,抗腫瘤反應可局限在腫瘤周圍,即起到抗腫瘤的目的,也盡量避免全身不良反應,為后續靶向性腫瘤免疫治療提供依據。
綜上,本研究發現在 Lewis 肺癌細胞荷瘤小鼠瘤體內注射 SEB 基因表達質粒可以使SEB 在腫瘤組織中表達,并能抑制 Lewis 肺癌荷瘤小鼠體內腫瘤生長,且沒有明顯的全身毒副作用。本研究結果為以 SEB 為外源性抗原基因的肺癌免疫基因治療的進一步研究奠定了一定基礎。
利益沖突:本研究不涉及任何利益沖突。
肺癌是發病率和死亡率最高的惡性腫瘤,目前治療效果仍令人不甚滿意[1-3]。免疫治療是近年來進展最大,也最令人期待的腫瘤治療方法。將免疫原性強的外源性抗原引入腫瘤宿主,刺激宿主產生強烈的免疫反應,達到抑制甚至消除腫瘤細胞,是腫瘤免疫治療的策略之一。葡萄球菌腸毒素 B(staphylococcus enterotoxin B,SEB)是來源于金黃色葡萄球菌的一種外源性腸毒素,具有超抗原的特性,具有強烈的激活免疫系統能力[4-5]。本研究合成了 SEB 基因的表達質粒,通過瘤內注射,觀察其對 Lewis 肺癌細胞在小鼠體內生長的抑制作用,并以此初步探索 SEB 作為外源性抗原基因的肺癌免疫基因治療的可行性。
1 材料與方法
1.1 材料
SEB 基因由 Invitrogen 公司合成,小鼠 Lewis 肺癌細胞來源于中科院細胞庫;C57 小鼠(無特定病原級)來源于四川大學[SCXK(川)2013-026]并飼養于西南醫科大學實驗動物中心[許可證號SYXK(川)2018-065],倫理批準文號:SWMU202110422;脂質體(lipofectamine2000)購自 Invitrogen 公司;酶聯免疫吸附試驗試劑盒購于康肽生物;SEB 抗體購于 Abcam 公司;Dulbecco 改良 Eagle 培養基及小牛血清購買于 Hyclone 公司。
1.2 方法
1.2.1 制備 SEB 基因表達質粒
(1)SEB 基因的合成及驗證。查詢 GeneBank 中 SEB 基因的 cDNA 序列,合成含 SEB的基因序列(由 Invitrogen 完成)。
(2)SEB 基因的擴增。設計擴增 SEB 基因的引物,上游引物:5'-AAGTATCTAGAGATGCCACCATGTACAACAGACTCTTCGTCAGCC-3',5’端含酶切位點XbaI(TCTAGA);下游引物:5'-GCCGAGGATCCTCACTTCTTCTTAGTTGTCAGGTATA-3’,5’端含酶切位點 BamHI(GGATCC),聚合酶鏈反應擴增獲取 SEB 基因,產物大小 801 bp。
(3)構建SEB表達質粒 PCDH-SEB-GFP。SEB 的聚合酶鏈反應擴增產物和載體質粒PCDH-CMV-GFP 用 XbaI、BamHI 進行雙酶切,然后作連接反應,轉化 DH5α 感受態細菌,質粒提取,獲取的重組質粒做酶切鑒定,重建成功的 SEB 表達質粒命名為 PCDH-SEB-GFP。
1.2.2 SEB 表達質粒 PCDH-SEB-GFP 轉染 Lewis 細胞并采用蛋白免疫印跡法檢測 SEB的表達
(1)將 PCDH-SEB-GFP 轉染 Lewis 肺癌細胞。在 6 孔培養板接種 Lewis 肺癌細胞,每孔細胞數目為 1.5×106 個,放入孵箱中培養至細胞匯合度達到 90% 左右。在 PCDH-SEB-GFP組中,將質粒 PCDH-SEB-GFP 4 μg加入 250 μL 無血清培養基組成溶液 A,將 16 μL 的脂質體加入到 50 μL 無血清培養基組成溶液 B,室溫放置 5 min 后,將溶液 A、B 混合室溫放置 20 min,加入到 6 孔板培養的 Lewis 肺癌細胞中,混合均勻,開始轉染實驗。PCDH-CMV-GFP 組采用相似方法將質粒 PCDH-CMV-GFP 轉染 Lewis 肺癌細胞。而 Lewis 肺癌細胞組為未被轉染的正常生長的 Lewis 肺癌細胞。轉染 24 h 后在熒光顯微鏡下觀察轉染效果。
(2)轉染細胞蛋白提取。轉染 Lewis 肺癌細胞 48 h 后,用 RIPA 裂解液提取細胞總蛋白。
(3)采用蛋白免疫印跡法檢測轉染細胞中 SEB 的表達。將步驟(2)獲得的蛋白質,用蛋白免疫印跡法檢測 SEB 的表達情況。過程簡述如下:蛋白樣品用 10% 的十二烷基硫酸鈉–聚丙烯酰胺凝膠電泳分離(濃縮膠電泳時電壓 60 V,50 min,分離膠電泳時電壓為 120 V,1 h),蛋白轉于聚偏氟乙烯膜(轉膜電壓100 V,1 h)。5% 脫脂牛奶封閉 1 h,一抗孵育(SEB兔多克隆抗體,1∶500),4 ℃ 過夜,漂洗膜 5 次(5 min/次)后再進行二抗孵育(羊抗兔,1∶3000),室溫孵育 2 h。經自動凝膠成像分析儀采集圖像。
1.2.3 Lewis 肺癌荷瘤小鼠模型構建
小鼠 18 只,雄性,4~6 周齡,體重 16~20 g。置于無特定病原體動物房中飼養,所需飼料、飲水經滅菌處理,采取自由進食及飲水,每天更換飲水、飼料及無菌墊料。取對數生長期的 Lewis 肺癌細胞,使用胰酶消化,檢測細胞活性在 90% 以上,使用磷酸鹽緩沖鹽溶液調整細胞濃度為 1.5×107 個/mL。在小鼠右側腋窩皮下接種 0.2 mL(3×106 個)細胞混懸液,當腫瘤體積達到約50 mm3 將小鼠隨機分為實驗組、陰性對照組和空白對照組,每組 6 只。
1.2.4 SEB 表達質粒 PCDH-SEB-GFP 治療試驗
將質粒與脂質體制備成轉染混合液,其中,質粒 20 μg,脂質體 20 μL。實驗組小鼠瘤內注射含質粒 PCDH-SEB-GFP 的混合液,陰性對照組瘤內注射等量的空載體質粒 PCDH-CMV-GFP 的混合液,空白對照組注射等體積磷酸鹽緩沖鹽溶液與脂質體制備的混合液,每 3 天注射1次,共進行 3 次注射,每 2 天計算腫瘤體積,繪制腫瘤生長曲線,腫瘤體積=(A×B2)×0.5,其中,A 為腫瘤長徑;B 為腫瘤短徑。
1.2.5 不良反應觀察
觀察實驗過程中小鼠有無嘔吐、行動障礙、腹瀉、死亡等。
1.2.6 病理檢查
治療試驗開始后第 8 天處死荷瘤小鼠,解剖并完整取出瘤體,稱量每只小鼠的瘤體質量。腫瘤組織用 4% 中性甲醛固定,石蠟包埋,切片,蘇木精–伊紅染色,觀察腫瘤組織壞死及炎癥細胞浸潤情況。免疫組織化學檢測腫瘤組織中 SEB 的表達,SEB 抗體稀釋液(1∶1000)50 μL,二抗(羊抗兔)稀釋液(1∶2000)50 μL。
1.2.7 酶聯免疫吸附試驗檢測各組小鼠血清炎癥因子 γ 干擾素和腫瘤壞死因子-α 水平
治療試驗第 8 天剝除小鼠眼球采血,獲得血清,4 ℃過夜后進行酶聯免疫吸附試驗,檢測各組小鼠血清 γ 干擾素(interferon gamma,IFN-γ)和腫瘤壞死因子-α(tumor necrosis factor alpha,TNF-α)水平。每孔加入 100 μL 待測溶液,孵育條件為 37 ℃、2 h,去除反應液后進行抗原洗脫和酶標抗體結合,孵育洗脫后,加入底物進行顯色反應,計算光密度值。
1.3 統計學方法
采用 SPSS 22 統計軟件。結果采用均數±標準差( ±s)表示,組間比較采用方差分析,P<0.05 為差異有統計學意義。
±s)表示,組間比較采用方差分析,P<0.05 為差異有統計學意義。
2 結果
2.1 重組質粒 PCDH-SEB-GFP 鑒定結果
凝膠電泳實驗結果顯示,重組質粒 PCDH-SEB-GFP 經 XbaI、BamHI 雙酶切,在697~925 bp 間(黑色箭頭)有 DNA 條帶,該 DNA 條帶大小與目的基因大小相符(圖 1)。
 圖1
PCDH-SEB-GFP 質粒 XbaI、BamHI 雙酶切鑒定結果
圖1
PCDH-SEB-GFP 質粒 XbaI、BamHI 雙酶切鑒定結果
1:DNA Marker;2:未做酶切;3:單酶切;4:雙酶切。黑箭指示條帶的大小與目的基因大小相符。
2.2 熒光顯微鏡觀察轉染效果
轉染實驗后在 PCDH-SEB-GFP 組和 PCDH-CMV-GFP 組中均能觀察到綠色熒光蛋白(green fluorescent protein,GFP)表達(圖 2)。
 圖2
轉染實驗熒光檢測像(×100)
圖2
轉染實驗熒光檢測像(×100)
a. PCDH-SEB-GFP 組;b. PCDH-CMV-GFP 組。轉染實驗后在 PCDH-SEB-GFP 組和 PCDH-CMV-GFP 組中均能觀察到GFP表達。
2.3 蛋白免疫印跡法檢測結果
蛋白免疫印跡法檢測結果顯示,在 PCDH-SEB-GFP 組中用含有 SEB 基因的重組質粒PCDH-SEB-GFP 轉染 Lewis 肺癌細胞后能檢測到 SEB 蛋白表達,SEB 蛋白大小約 30 kD。而 Lewis 肺癌細胞組和 PCDH-CMV-GFP 組未檢測到 SEB 蛋白表達(圖 3)。
 圖3
蛋白免疫印跡法檢測像
圖3
蛋白免疫印跡法檢測像
1. PCDH-CMV-GFP 組;2. Lewis 肺癌細胞組;3. PCDH-SEB-GFP 組。內參為 β 肌動蛋白,其大小為 43 kD。
2.4 腫瘤抑制實驗結果
腫瘤抑制實驗開始后,實驗組、陰性對照組、空白對照組腫瘤體積呈逐漸增長趨勢,實驗組腫瘤體積增長最緩慢,空白對照組增長最迅速(圖 4)。處死小鼠后獲取腫瘤組織,三組平均瘤重分別為(1.02±0.47)、(2.24±0.87)、(3.32±1.04)g,各組間有顯著差異(P=0.001);兩兩比較:實驗組平均瘤重低于空白對照組(P=0.000)及陰性對照組(P=0.022);陰性對照組平均瘤重低于空白對照組(P=0.040)(圖 5)。
 圖4
各組小鼠腫瘤生長曲線
圖4
各組小鼠腫瘤生長曲線
 圖5
獲取的各組小鼠腫瘤組織大體像
圖5
獲取的各組小鼠腫瘤組織大體像
a. 實驗組;b. 陰性對照組;c. 空白對照組。
2.5 移植瘤病理檢查
實驗組小鼠腫瘤見明顯出血、壞死,伴有炎癥細胞浸潤;陰性對照組程度明顯減輕;而空白對照組無上述改變(圖 6)。免疫組織化學檢測結果顯示,實驗組腫瘤組織中有 SEB 蛋白表達,而其余兩組無 SEB 蛋白表達(圖 7)。
 圖6
各組小鼠腫瘤病理檢查(蘇木精–伊紅×100)
圖6
各組小鼠腫瘤病理檢查(蘇木精–伊紅×100)
a. 實驗組;b. 陰性對照組;c. 空白對照組。實驗組小鼠移植瘤見明顯出血、壞死,伴有炎癥細胞浸潤;陰性對照組上述程度明顯減輕;而空白對照組無上述改變。
 圖7
各組小鼠移植瘤病理檢查像(免疫組織化學×400)
圖7
各組小鼠移植瘤病理檢查像(免疫組織化學×400)
a. 實驗組;b. 陰性對照組;c. 空白對照組。實驗組小鼠移植瘤組織中有 SEB 蛋白表達,而其余兩組無 SEB 蛋白表達。
2.6 各組小鼠血清 TNF-α 和 IFN-γ 檢測
實驗組、陰性對照組、空白對照組血清 TNF-α 平均濃度分別為(157.0±97.1)、(141.7±69.3)、(92.6±43.2)pg/mL,差異無統計學意義(P=0.310);血清 IFN-γ 平均濃度分別為(207.5±71.2)、(206.8±21.3)、(191.5±52.1)pg/mL,差異無統計學意義(P=0.838)。
3 討論
引入外源抗原基因使其在腫瘤中表達,刺激宿主產生強烈的免疫應答,以獲得抗腫瘤作用,是腫瘤免疫治療的策略之一[6]。超抗原為細菌、病毒產生的一類外分泌抗原物質[5],微量劑量就能強烈刺激免疫細胞增殖,增強免疫能力。報道顯示超抗原能使體內多達 40% 的 T 淋巴細胞激活,大幅超過普通抗原的激活能力[7]。SEB 為金黃色葡萄球菌外分泌蛋白之一,具有超抗原屬性,通過直接呈遞抗原的形式與主要組織相容性復合體 Ⅱ 類分子和 T 淋巴細胞受體的特定 Vβ 區結合,進而導致 T 淋巴細胞的激活,產生免疫效應分子(如白細胞介素-2、TNF-α 和 IFN-γ)殺滅腫瘤細胞,同時也可以激活 T 淋巴細胞直接殺滅腫瘤細胞[8-10]。SEB 在抗腫瘤領域具有重要研究價值,研究中發現 SEB 對伴有惡性胸腔積液的晚期肺癌、卵巢癌具有抗腫瘤作用[11-12]。Ejtehadifar 等[13]發現 SEB 具有的超抗原特性能抑制多發性骨髓瘤腫瘤細胞的增殖和存活,具有抗腫瘤生長作用。本實驗發現實驗組中腫瘤體積及質量明顯小于其余兩組,說明 SEB 能起到抑制小鼠 Lewis 肺癌生長的作用。
在將 SEB 基因轉導入實驗動物體內的途徑有瘤體注射、體腔注射、靜脈注射等,本研究采用了瘤內注射的方法,主要是考慮到含有 SEB 基因的質粒為非腫瘤靶向性載體,如果采用靜脈或體腔注射,可能因藥物缺乏選擇性,出現抗腫瘤效果不佳,而加大劑量則可能導致嚴重的全身不良反應[14]。通過瘤內注射的方式可以使 SEB 表達及其誘導的免疫應答盡量局限于腫瘤局部,避免正常組織產生嚴重炎癥反應。SEB 基因作為原核生物基因可以在原核表達體系中表達,能否在真核細胞中表達是該實驗的關鍵所在[15]。朱大冕等[16]研究發現,構建含有超抗原SEA基因的真核表達載體,并將其轉染人肺腺癌后可以檢測到 SEA 蛋白的表達。我們的研究也進一步證實,在實驗組小鼠瘤體內注射含有 SEB 基因的質粒,通過免疫組織化學方式可在小鼠腫瘤組織中檢測到 SEB 的表達,說明該干預措施是可行和有效的,且實驗組中有 SEB 表達,而其他兩組無 SEB 表達。
本研究還發現,陰性對照組腫瘤體積及質量低于空白對照組,其可能的原因是陰性對照組小鼠瘤體內注射的質粒雖不含 SEB 基因,該載體含有 GFP 基因,相對小鼠而言,GFP 也是一種作為外源性蛋白,也具有一定的免疫原性,可以在腫瘤局部激活小鼠的免疫反應,從而產生抑瘤作用。實驗組腫瘤體積及質量小于陰性對照組可能是 SEB 和 GFP 相結合而呈現出更明顯的抑制腫瘤的作用。既往研究發現 GFP 可以通過主要組織相容性復合體介導的細胞毒性 T 細胞途徑發揮免疫作用,已證實其可刺激免疫反應產生 IFN-γ 等達到抗腫瘤作用[17-18]。該觀點與本文結論相符合。
通過瘤內注射的方式下,三組小鼠均未出現嚴重不良反應甚至死亡,尤其是實驗組小鼠未出現嚴重不良反應,說明 SEB 雖具有強烈的刺激免疫能力,但瘤內注射是比較安全的干預途徑。三組小鼠血清中細胞因子 IFN-γ、TNF-α 濃度沒有明顯的差異,分析原因可能是,通過瘤內注射的方式,免疫反應多局限于瘤體周圍,全身免疫反應較輕,因此產生的細胞因子濃度較低。Fooladi 等[19]的研究也證實了瘤體注射局部產生的 IFN-γ 和 T 淋巴細胞浸潤少于靜脈注射。本實驗也存在一定局限性,SEB 轉染腫瘤細胞是非特異性的,如果能通過靶向性方式使腫瘤細胞特異性表達 SEB,抗腫瘤反應可局限在腫瘤周圍,即起到抗腫瘤的目的,也盡量避免全身不良反應,為后續靶向性腫瘤免疫治療提供依據。
綜上,本研究發現在 Lewis 肺癌細胞荷瘤小鼠瘤體內注射 SEB 基因表達質粒可以使SEB 在腫瘤組織中表達,并能抑制 Lewis 肺癌荷瘤小鼠體內腫瘤生長,且沒有明顯的全身毒副作用。本研究結果為以 SEB 為外源性抗原基因的肺癌免疫基因治療的進一步研究奠定了一定基礎。
利益沖突:本研究不涉及任何利益沖突。