血管生成素樣蛋白(ANGPTL)是一組分泌性糖蛋白,在體內表達廣泛,參與了機體糖代謝、脂代謝,干細胞生長、局部炎癥、血管滲漏、血管生成等多種病理生理過程。多種ANGPTL與糖尿病視網膜病變(DR)的發生和發展密切相關,尤其是ANGPTL4,已逐漸成為DR研究領域中的新熱點。ANGPTL參與糖代謝和脂代謝,促進血管通透性增加、病理性血管生成,參與眼內炎癥反應。ANGPTL是一種有潛力的分子靶點。其不僅可以作為生物標志物用于預測DR的發生和進展,也可以通過制作抗體藥物干預該分子,為DR的治療提供新的思路。
引用本文: 田野, 張國恒, 竇國睿. 血管生成素樣蛋白在糖尿病視網膜病變中作用與機制的研究進展. 中華眼底病雜志, 2024, 40(7): 569-574. doi: 10.3760/cma.j.cn511434-20240227-00085 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
糖尿病視網膜病變(DR)是糖尿病患者眼部最常見的微血管并發癥,也是全球范圍內患有糖尿病的工作年齡成年人與老年人視力損害和喪失的主要原因[1]。據統計,2020年,全球共有1.031 2億成年人患有DR;至2045年,預計患病人數將達1.6億[2]。DR的基本病變是微血管改變,此外炎癥和視網膜神經退行性病變也是DR早期視網膜損傷的重要病理變化[3]。隨著研究的不斷深入,目前研究認為DR是一個多因素疾病,多種關鍵分子及相關信號通路在DR的發生和發展中發揮作用。如血管內皮生長因子(VEGF)和血管生成素(Ang),已被證實在DR中具有促進內皮細胞(EC)增殖、血管生成、血管通透性改變的作用,而針對其單一或雙靶向藥物已在臨床中廣泛應用并取得了良好的效果。近年來,越來越多的研究發現Ang樣蛋白(ANGPTL)廣泛參與了糖代謝和脂代謝、炎癥、血管生成、腫瘤轉移、細胞凋亡、干細胞生長等多種病理生理過程[4],尤其是ANGPTL4,已逐漸成為DR研究領域中的新熱點。ANGPTL是近年來發現的一類分泌性糖蛋白。雖然與Ang在組成上具有一定同源性,也具有相似結構域,但在功能上與其又有明顯不同,原因之一是ANGPTL不結合酪氨酸激酶受體1、2。此外,ANGPTL各成員在體內分布廣泛,具有調控糖代謝和脂代謝、抗炎促炎、促血管生成、促血管滲漏、抗凋亡、調節干細胞活性等作用,對維持機體正常的生理功能具有重要作用。現就ANGPTL在DR中作用與機制的研究進展作一綜述,以期對DR的發病機制和臨床診斷和治療提供新的思路。
1 ANGPTL家族蛋白成員
ANGPTL是一個糖蛋白家族,共有8種家族成員,其中ANGPTL1-7都由N端卷曲螺旋結構域(CCD)和C端纖維蛋白原結構域(FLD)組成,ANGPTL8是ANGPTL家族的非典型成員,缺乏CCD和FLD[5]。ANGPTL在體內表達廣泛,是正常生理功能狀態維持中不可或缺的一部分,并廣泛參與了多種病理生理變化[4]。研究表明,ANGPTL與DR密切相關。其中,ANGPTL4增加眼內VEGF的表達水平,并可促進DR患者的眼部血管生成和炎癥。ANGPTL2、ANGPTL4、ANGPTL8在增生型DR(PDR)患者的玻璃體液中表達水平升高;血清中ANGPTL3的表達水平與DR嚴重程度呈正相關。這提示,ANGPTL可能在DR的發生和發展中發揮重要作用。
2 ANGPTL參與DR的發生和進展
對于ANGPTL4與DR的聯系,目前研究已較為深入且相對明確;而ANGPTL2、ANGPTL3、ANGPTL8分別與DR的發生發展存在不同程度的相關,但其機制尚不明確。
2.1 ANGPTL4與DR
既往研究結果顯示,PDR患者玻璃體及血清中ANGPTL4表達水平明顯升高,且ANGPTL4表達與VEGF表達水平呈正相關[6]。同時,該研究還發現PDR患者玻璃體和血清ANGPTL4水平也與血清三酰甘油(TG)呈顯著正相關,而和高密度脂蛋白膽固醇(HDL-C)呈顯著負相關。這表明ANGPTL4與PDR患者體內脂代謝紊亂和眼內病理改變有顯著相關性,提示ANGPTL4在PDR發生和進展中可能發揮重要作用。此外,多項研究表明DR患者房水中ANGPTL4表達水平升高,且ANGPTL4與DR患者病變嚴重程度呈正相關[7-9]。滕月等[10]通過液態流式芯片技術進一步證實DR患者房水中ANGPTL4表達水平升高,且PDR患者較非PDR(NPDR)患者升高更明顯,同時該研究發現ANGPTL4與白細胞介素(IL)-6、IL-8、單核細胞趨化蛋白-1以及VEGF家族、血小板源性生長因子家族呈正相關。然而也有研究報道,血清ANGPTL4表達水平對DR的發生和發展無顯著影響[11]。其原因可能是血清ANGPTL4的表達不穩定,受多種因素影響。因此,綜合多方面研究發現,ANGPTL4在DR的發生和發展中重要地位值得重點關注。
2.2 ANGPTL2與DR
ANGPTL2最早于2020年在DR患者的玻璃體中被發現,其不僅在PDR患者玻璃體中含量增加,且表達水平可能與PDR的進展相關[12]。Keles等[12]研究報道,活動性PDR患者玻璃體中ANGPTL2表達水平升高,且在不同并發癥的PDR患者中,ANGPTL2的表達水平在發生纖維血管牽拉性脫離的眼中顯著升高,表明ANGPTL2表達水平可能與PDR的進展有關。
2.3 ANGPTL3與DR
Yu等[11]研究報道1 192例2型糖尿病(T2DM)患者,采用酶聯免疫吸附試驗法測定血清ANGPTL3、ANGPTL4、C反應蛋白、血管黏附分子-1、細胞內黏附分子-1的表達水平。與正常對照者相比,T2DM患者血清中ANGPTL3表達水平升高,顯著增加了DR發生的風險。與NPDR患者相比,T2DM患者血清中ANGPTL3表達水平升高與PDR的發生風險增加相關,這提示ANGPTL3可能在DR的進展中扮演重要的角色。
2.4 ANGPTL8與DR
在一項橫斷面研究中,Wang等[13]通過比較伴有或不伴有DR的T2DM患者、正常對照者、治療前新診斷T2DM患者以及降糖治療中T2DM患者的血清ANGPTL8表達水平。研究發現,有降血糖治療的T2DM患者血清中ANGPTL8表達水平升高,此外,血清ANGPTL8表達水平升高與T2DM患者的DR的發生呈正相關。而在另一項橫斷面研究中,Fang等[14]通過比較T2DM與DR患者血清ANGPTL8表達水平,證明ANGPTL8是視網膜病變顯著且獨立相關的變量。最新的研究進一步證實了DR患者中血清ANPGTL8表達水平顯著升高[15]。此外,PDR患者玻璃體及血清中ANGPTL8、VEGF表達水平均高于特發性黃斑裂孔(IMH)患者,且兩者呈正相關[16]。研究報道,盡管DR患者較正常對照者的血清和房水ANGPTL8水平顯著升高,DR患者與糖尿病患者的血清和房水中ANGPTL8水平并不具有統計學差異[17],其原因可能是該研究的樣本量較小。綜上所述,ANGPTL8在DR患者的血清、玻璃體、房水中表達水平均增加,且與VEGF、DR的發生呈正相關,這提示其可能是DR發展中的一個潛在治療靶點。
3 ANGPTL在DR中的分子機制
DR的病理機制與糖脂代謝紊亂、血管通透性改變、血管生成、眼內炎癥密切相關。當前研究認為,高血糖高血脂是DR的危險因素,直接促進了DR的發生和發展[18]。DR的主要病理變化,則包括血管通透性增加、病理性血管生成、纖維化改變[18]。多種ANGPTL參與了DR的病理改變,但尚無研究證實ANGPTL參與了眼部纖維化病變。此外,眼內炎癥在DR中發揮關鍵作用并貫穿DR的全過程[19](圖1)。
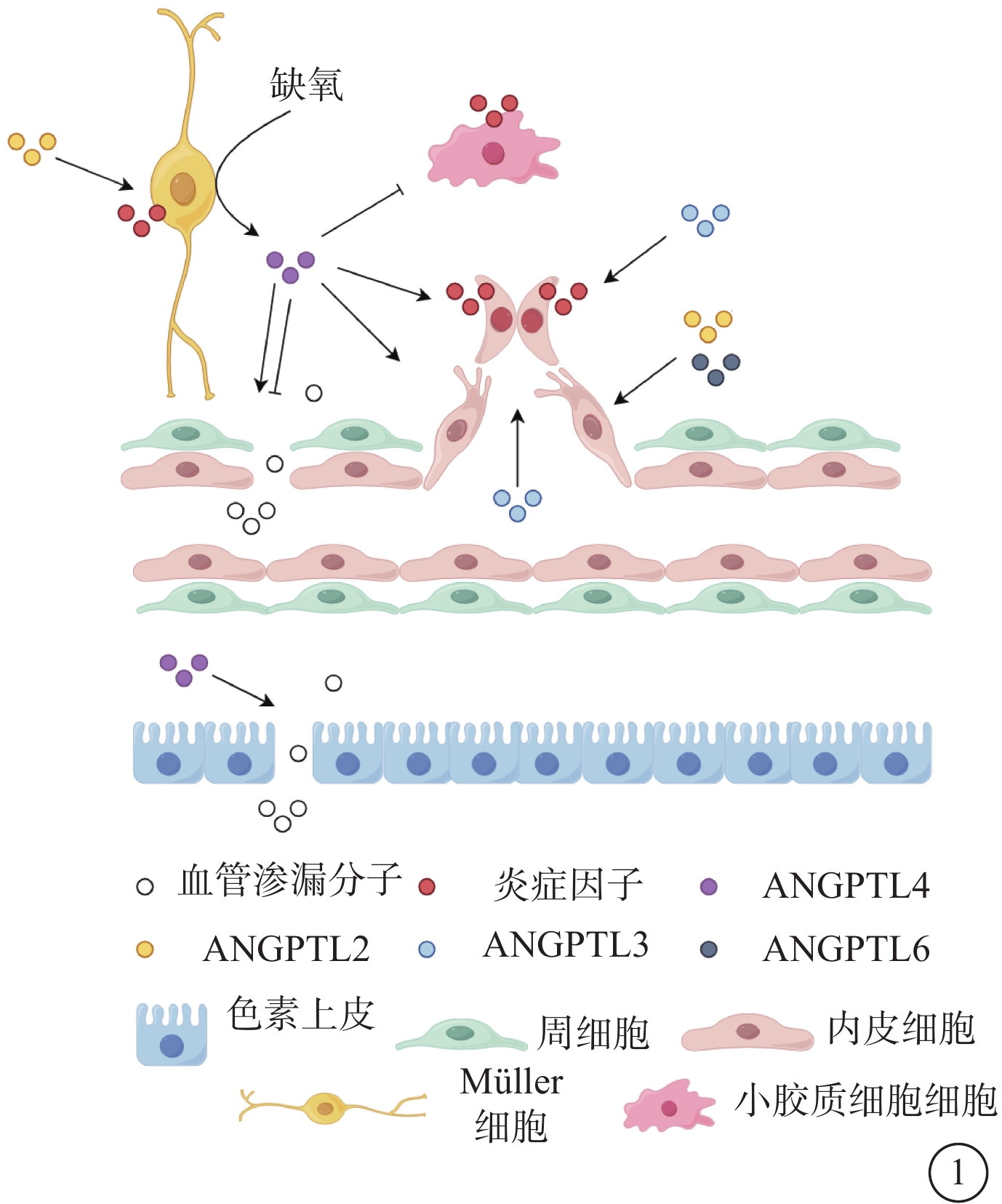
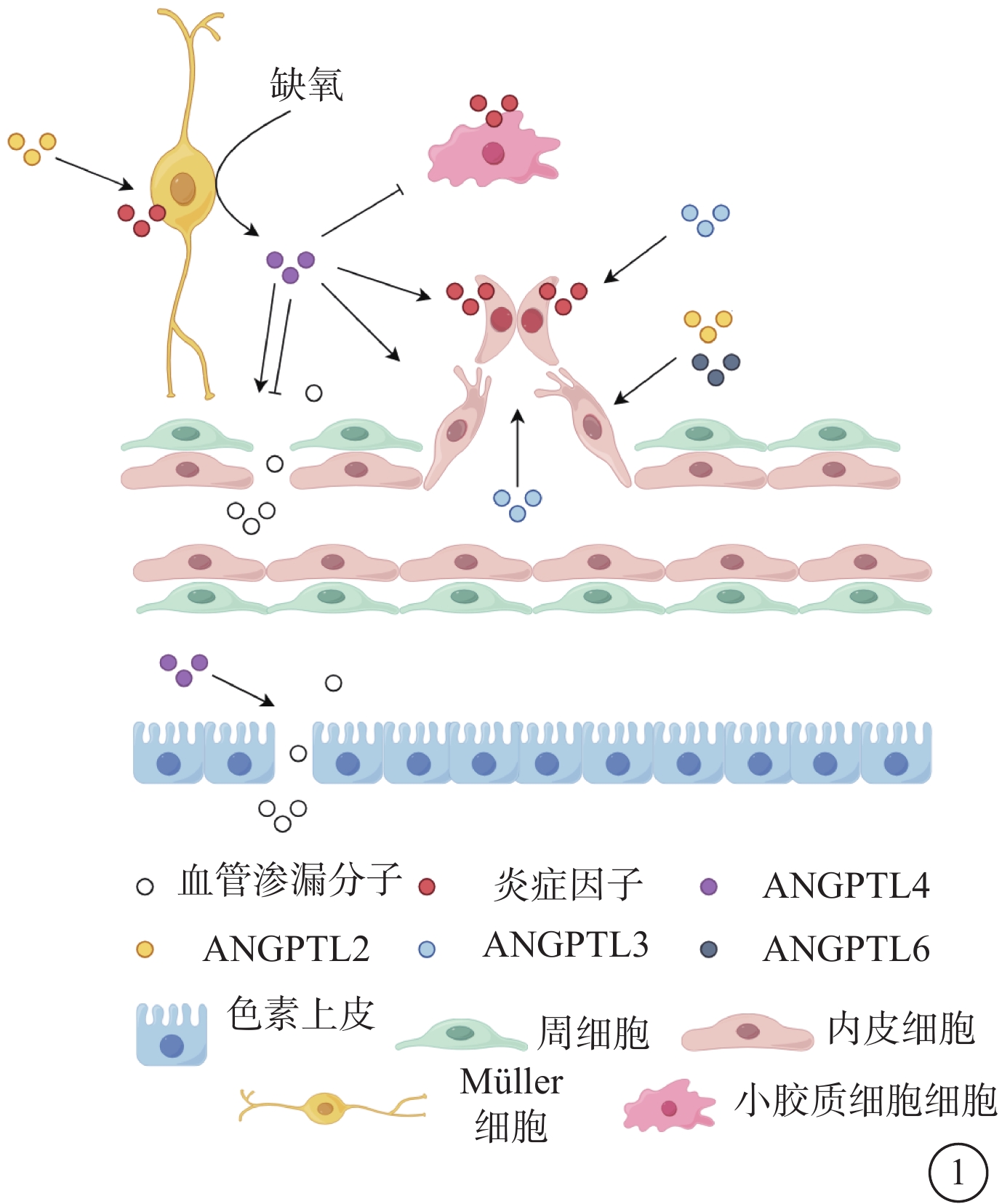 圖1
血管生成素樣蛋白在糖尿病視網膜病變中的作用示意圖
圖1
血管生成素樣蛋白在糖尿病視網膜病變中的作用示意圖
ANGPTl4對血管通透性的作用具有雙向作用。既可促使血管滲漏,又可保護血管通透性。ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL6促進血管生成。其中ANGPTL2、ANGPTL4、ANGPTL6在眼內表達升高,促進內皮細胞遷移誘導血管新生;ANGPTL3促進血漿內的內皮祖細胞分化以誘導新生血管形成。ANGPTL2、ANGPTL3、ANGPTL4促進視網膜炎癥的發生 ANGPTL:血管生成素樣蛋白
3.1 ANGPTL參與糖代謝和脂代謝
糖代謝方面,ANGPTL4可激活磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(Akt)通路來調節結直腸癌中葡萄糖轉運蛋白的表達,以促進葡萄糖的代謝[20],而ANPGTL8通過激活PI3K/Akt信號通路來抑制糖尿病小鼠肝臟糖異生,以降低血糖水平[21]。脂代謝方面,ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL8調控機體脂質代謝。ANGPTL2可結合CD146以激活環磷酸腺苷反應元件結合蛋白來上調CD146,從而發揮促脂肪形成的作用[22],ANGPTL3、ANGPTL4、ANGPTL8可單獨調節脂質代謝也可協同發揮作用。其中,ANGPTL3可抑制EC磷脂酶活性[23],ANGPTL4可觸發脂蛋白脂肪酶(LPL)的α/β-水解酶結構域的不可逆去折疊導致LPL失活[24]。ANGPTL3、ANGPTL4都具有CCD結構域,可抑制LPL功能[25]。ANGPTL8可與白色脂肪分泌的ANGPTL4結合導致其功能下降,而與血清中的ANGPTL3結合進一步增強其LPL抑制作用[26]。ANGPTL3、ANGPTL4、ANGPTL8都可通過特異性表位1抑制LPL功能[27-28]。綜上,ANGPTL4、8在糖代謝方面發揮作用,ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL8都參與了機體的脂質代謝,ANGPTL在機體糖脂代謝中的作用不可忽視。
3.2 ANGPTL促進血管通透性增加
多項研究結果顯示,ANGPTL4誘導了血管滲漏的發生。在EC中,ANGPTL4可通過整合素信號和細胞間血管內皮鈣黏蛋白和緊密連接蛋白5簇發生相互作用破壞血管連接完整性[29],同時,其還可以與EC上神經纖毛蛋白1(NRP1)和NRP2結合,導致Ras同源基因家族成員(Rho)A/Rho相關卷曲螺旋形成蛋白激酶信號通路的快速激活和EC之間連接的破壞[30]。此外,研究表明,ANGPTL4可通過上調VEGF表達水平增加EC通透性,且這種作用并不完全依賴于VEGF[31]。ANGPTL4可通過與EC整合素αvβ3結合競爭VEGFR2下游的酪氨酸激酶Src信號傳導來改善缺氧誘導的血管通透性增加[32],ANGPTL4還可減輕組胺誘導的血管滲漏[33],這說明ANGPTL4對血視網膜屏障還可能起到了保護作用。而在Müller細胞中,缺氧激活缺氧誘導因子-1a通路上調ANGPTL4以增強血管滲透[34];在視網膜色素上皮細胞中,ANGPTL4可通過激活轉錄激活因子3(STAT3)來減少色素上皮細胞中Claudin蛋白和帶狀閉合蛋白1從而促進血視網膜屏障通透性增加[35]。綜上,ANGPTL4對血管通透性的作用具有兩面性,其對血管通透性的具體作用機制可能跟所處的環境、結合的受體有關。
3.3 ANGPTL參與病理性血管生成
ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL6均參與血管生成。其中,ANGPTL4可通過激活視網膜EC表達VEGF或前纖維蛋白1(PROFLLIN-1)以促進眼部血管生成[31]。此外,在傷口上皮中,ANGPTL4可通過整合素/Janus激酶/STAT3介導的誘導型一氧化氮合酶表達上調,誘導一氧化氮生成,從而促進血管生成[36]。ANGPTL4可顯著誘導視網膜血管內限定膜破裂,促進視網膜血管向玻璃體內萌發[37]。
ANGPTL2、ANGPTL3、ANGPTL6也通過不同的機制參與血管生成。ANGPTL2可通過激活C-Jun氨基末端激酶(JNK)磷酸化進一步調節膜型基質金屬蛋白酶控制EC遷移和三維管腔形成[38]。ANGPTL3可通過與內皮祖細胞整合素ανβ3受體結合,促進Akt磷酸化,上調miR-126的表達,從而促進新血管的形成[39]。在糖尿病黃斑水腫患者的房水中,ANGPTL6表達水平升高,且與疾病嚴重程度呈正相關[8]。而ANGPTL6可激活細胞外調節蛋白激酶(ERK)1/2-內皮型一氧化氮合酶-一氧化氮通路以誘導血管生成[40]。外泌體中的ANGPTL6,除ERK1/2通路外,還可以通過JNK和絲裂原相關蛋白激酶p38途徑促進血管生成[41],這提示ANGPTL6可能參與了眼部血管生成。
3.4 ANGPTL參與眼內炎癥反應
ANGPTL4通過激活PROFLLIN-1信號通路上調IL-1β、IL-6水平,從而促進炎癥反應[31]。然而,也有研究發現ANGPTL4可以抑制小膠質細胞活化同時抑制脂肪酸合成酶配體/脂肪酸合成酶通路減輕細胞凋亡和炎癥[42],這提示ANGPTL4在眼部炎癥病變中的作用可能存在兩面性。
在小鼠角膜炎模型中,ANGPTL2表達水平上調,ANGPTL2誘導了巨噬細胞浸潤和IL-1β過表達,加劇了角膜炎癥改變[43];而在小鼠葡萄膜炎模型中,ANGPTL2通過激活核轉錄因子(NF)-κB信號通路促進了內毒素誘導的視網膜炎癥[44];在脂多糖誘導眼內炎的小鼠模型中,ANGPTL2通過PirB受體激活視網膜Müller細胞參與眼內炎癥[45];而在脈絡膜新生血管的模型中,ANGPTL2可通過與整合素α4β2結合,激活了巨噬細胞中NF-κB和ERK通路,促進多種炎癥因子表達和巨噬細胞募集,巨噬細胞會進一步促進ANGPTL2表達[46]。綜上,ANGPTL2與眼部炎癥性改變聯系密切。
ANGPTL3可直接促進眼部炎癥的發生。有研究發現,向小鼠玻璃體內注射ANGPTL3可導致ANGPTL3與視網膜EC整合素ανβ3結合,產生促炎促凋亡的作用,這一作用可以被過氧化物酶體增殖物激活受體α(PPAR-α)激動劑非諾貝特阻斷[47],這提示ANGPTL3可通過抑制PPAR-α通路促進眼部炎癥。
4 ANGPTL作為生物標志物的研究及靶向調控ANGPTL的藥物研發和臨床試驗
現有研究證明,ANGPTL3、ANGPTL4、ANGPTL8是DR的候選生物標志物。其中,ANGPTL4在PDR患者玻璃體和血清中表達水平明顯高于IMH患者,并且PDR患者的玻璃體及血清中ANGPTL4與VEGF水平有顯著相關性,這提示ANGPTL4可能作為治療PDR的新靶點[6]。另一方面,研究發現,血清中ANGPTL3的表達水平與T2DM患者的DR分期呈正相關,ANGPTL3可能作為T2DM患者DR進展的潛在生物標志物[11]。此外,ANGPTL8表達水平在PDR患者中的血清和玻璃體中顯著升高[16],血清ANGPTL8表達水平與DR顯著相關[14],ANGPTL8也可能成為DR的診斷依據。
目前主要研發了針對ANGPTL3的三種藥物,單克隆抗體依維蘇單抗和反義寡核苷酸Vupanorsen、RNA干擾藥物ARO-ANG3。其中依維蘇單抗已經上市,用于純合子家族性高膽固醇血癥的輔助治療。研究表明,依維蘇單抗和Vupanorsen對ANGPTL3的藥理抑制可復制ANGPTL3功能缺失載體的表型[48-49]。在正常對照者和家族性高膽固醇患者中,依維蘇單抗靶向循環ANGPTL3,能有效降低低密度脂蛋白膽固醇(LDL-C)、HDL-C和TG。重要的是,依維蘇單抗在LDL受體(LDLR)缺乏人群中的療效支持了其降低LDL-C的作用與完整LDLR無關[48, 50]。然而,頻繁的靜脈注射抗體可能給患者帶來不便,并可能影響治療的依從性。此外,由于臨床同期發現丙氨酸轉氨酶和肝脂肪變性的增加,Vupanorsen的開發已經停止[49, 51]。ARO-ANG3是一種靶向ANGPTL3的RNA干擾療法,目前處于Ⅱ期臨床試驗階段。最新的一項臨床試驗證明,ANGPTL3信使RNA的小干擾RNA治療預期較好。患者的耐受性良好,可以有效降低動脈粥樣硬化脂蛋白、TG和脂蛋白濃度。ARO-ANG3也能降低LDL-C表達水平[52]。ARO-ANG3可以解決廣泛性動脈粥樣硬化二級預防的主要空白,對于管理高危人群,如混合性血脂異常和家族性高膽固醇血癥尤其有價值[51]。然而,以ANGPTL為靶點的靶向藥物在DR中的研發尚未見報道。未來,需要在DR中進一步研究ANGPTL3、ANGPTL4、ANGPTL8作為生物標志物的可行性,而ANGPTL3的靶向藥物在控制血脂異常的同時,是否有利于改善DR的疾病進展,以及ANGPTL4作為DR治療中新的靶向藥物的潛在可能。
5 小結與展望
ANGPTL在機體內表達廣泛,發揮著維持糖脂代謝穩態、調控干細胞活性、參與血管生成、調節炎性反應、調節血管滲漏等多種作用。其中,糖脂代謝穩態、炎性反應、血管滲漏和血管生成是DR的重要病理機制。ANGPTL4已被證明參與了DR的進展過程,而多種ANGPTL在血清或玻璃體中表達水平與DR的發生和發展呈正相關。基于ANGPTL的生理病理調控機制及其與DR存在的相關性,ANGPTL是一種有潛力的分子靶點,不僅可以作為生物標志物用于預測DR的發生和進展,也可以通過制作抗體藥物干預該分子,為DR的治療提供新的思路。
糖尿病視網膜病變(DR)是糖尿病患者眼部最常見的微血管并發癥,也是全球范圍內患有糖尿病的工作年齡成年人與老年人視力損害和喪失的主要原因[1]。據統計,2020年,全球共有1.031 2億成年人患有DR;至2045年,預計患病人數將達1.6億[2]。DR的基本病變是微血管改變,此外炎癥和視網膜神經退行性病變也是DR早期視網膜損傷的重要病理變化[3]。隨著研究的不斷深入,目前研究認為DR是一個多因素疾病,多種關鍵分子及相關信號通路在DR的發生和發展中發揮作用。如血管內皮生長因子(VEGF)和血管生成素(Ang),已被證實在DR中具有促進內皮細胞(EC)增殖、血管生成、血管通透性改變的作用,而針對其單一或雙靶向藥物已在臨床中廣泛應用并取得了良好的效果。近年來,越來越多的研究發現Ang樣蛋白(ANGPTL)廣泛參與了糖代謝和脂代謝、炎癥、血管生成、腫瘤轉移、細胞凋亡、干細胞生長等多種病理生理過程[4],尤其是ANGPTL4,已逐漸成為DR研究領域中的新熱點。ANGPTL是近年來發現的一類分泌性糖蛋白。雖然與Ang在組成上具有一定同源性,也具有相似結構域,但在功能上與其又有明顯不同,原因之一是ANGPTL不結合酪氨酸激酶受體1、2。此外,ANGPTL各成員在體內分布廣泛,具有調控糖代謝和脂代謝、抗炎促炎、促血管生成、促血管滲漏、抗凋亡、調節干細胞活性等作用,對維持機體正常的生理功能具有重要作用。現就ANGPTL在DR中作用與機制的研究進展作一綜述,以期對DR的發病機制和臨床診斷和治療提供新的思路。
1 ANGPTL家族蛋白成員
ANGPTL是一個糖蛋白家族,共有8種家族成員,其中ANGPTL1-7都由N端卷曲螺旋結構域(CCD)和C端纖維蛋白原結構域(FLD)組成,ANGPTL8是ANGPTL家族的非典型成員,缺乏CCD和FLD[5]。ANGPTL在體內表達廣泛,是正常生理功能狀態維持中不可或缺的一部分,并廣泛參與了多種病理生理變化[4]。研究表明,ANGPTL與DR密切相關。其中,ANGPTL4增加眼內VEGF的表達水平,并可促進DR患者的眼部血管生成和炎癥。ANGPTL2、ANGPTL4、ANGPTL8在增生型DR(PDR)患者的玻璃體液中表達水平升高;血清中ANGPTL3的表達水平與DR嚴重程度呈正相關。這提示,ANGPTL可能在DR的發生和發展中發揮重要作用。
2 ANGPTL參與DR的發生和進展
對于ANGPTL4與DR的聯系,目前研究已較為深入且相對明確;而ANGPTL2、ANGPTL3、ANGPTL8分別與DR的發生發展存在不同程度的相關,但其機制尚不明確。
2.1 ANGPTL4與DR
既往研究結果顯示,PDR患者玻璃體及血清中ANGPTL4表達水平明顯升高,且ANGPTL4表達與VEGF表達水平呈正相關[6]。同時,該研究還發現PDR患者玻璃體和血清ANGPTL4水平也與血清三酰甘油(TG)呈顯著正相關,而和高密度脂蛋白膽固醇(HDL-C)呈顯著負相關。這表明ANGPTL4與PDR患者體內脂代謝紊亂和眼內病理改變有顯著相關性,提示ANGPTL4在PDR發生和進展中可能發揮重要作用。此外,多項研究表明DR患者房水中ANGPTL4表達水平升高,且ANGPTL4與DR患者病變嚴重程度呈正相關[7-9]。滕月等[10]通過液態流式芯片技術進一步證實DR患者房水中ANGPTL4表達水平升高,且PDR患者較非PDR(NPDR)患者升高更明顯,同時該研究發現ANGPTL4與白細胞介素(IL)-6、IL-8、單核細胞趨化蛋白-1以及VEGF家族、血小板源性生長因子家族呈正相關。然而也有研究報道,血清ANGPTL4表達水平對DR的發生和發展無顯著影響[11]。其原因可能是血清ANGPTL4的表達不穩定,受多種因素影響。因此,綜合多方面研究發現,ANGPTL4在DR的發生和發展中重要地位值得重點關注。
2.2 ANGPTL2與DR
ANGPTL2最早于2020年在DR患者的玻璃體中被發現,其不僅在PDR患者玻璃體中含量增加,且表達水平可能與PDR的進展相關[12]。Keles等[12]研究報道,活動性PDR患者玻璃體中ANGPTL2表達水平升高,且在不同并發癥的PDR患者中,ANGPTL2的表達水平在發生纖維血管牽拉性脫離的眼中顯著升高,表明ANGPTL2表達水平可能與PDR的進展有關。
2.3 ANGPTL3與DR
Yu等[11]研究報道1 192例2型糖尿病(T2DM)患者,采用酶聯免疫吸附試驗法測定血清ANGPTL3、ANGPTL4、C反應蛋白、血管黏附分子-1、細胞內黏附分子-1的表達水平。與正常對照者相比,T2DM患者血清中ANGPTL3表達水平升高,顯著增加了DR發生的風險。與NPDR患者相比,T2DM患者血清中ANGPTL3表達水平升高與PDR的發生風險增加相關,這提示ANGPTL3可能在DR的進展中扮演重要的角色。
2.4 ANGPTL8與DR
在一項橫斷面研究中,Wang等[13]通過比較伴有或不伴有DR的T2DM患者、正常對照者、治療前新診斷T2DM患者以及降糖治療中T2DM患者的血清ANGPTL8表達水平。研究發現,有降血糖治療的T2DM患者血清中ANGPTL8表達水平升高,此外,血清ANGPTL8表達水平升高與T2DM患者的DR的發生呈正相關。而在另一項橫斷面研究中,Fang等[14]通過比較T2DM與DR患者血清ANGPTL8表達水平,證明ANGPTL8是視網膜病變顯著且獨立相關的變量。最新的研究進一步證實了DR患者中血清ANPGTL8表達水平顯著升高[15]。此外,PDR患者玻璃體及血清中ANGPTL8、VEGF表達水平均高于特發性黃斑裂孔(IMH)患者,且兩者呈正相關[16]。研究報道,盡管DR患者較正常對照者的血清和房水ANGPTL8水平顯著升高,DR患者與糖尿病患者的血清和房水中ANGPTL8水平并不具有統計學差異[17],其原因可能是該研究的樣本量較小。綜上所述,ANGPTL8在DR患者的血清、玻璃體、房水中表達水平均增加,且與VEGF、DR的發生呈正相關,這提示其可能是DR發展中的一個潛在治療靶點。
3 ANGPTL在DR中的分子機制
DR的病理機制與糖脂代謝紊亂、血管通透性改變、血管生成、眼內炎癥密切相關。當前研究認為,高血糖高血脂是DR的危險因素,直接促進了DR的發生和發展[18]。DR的主要病理變化,則包括血管通透性增加、病理性血管生成、纖維化改變[18]。多種ANGPTL參與了DR的病理改變,但尚無研究證實ANGPTL參與了眼部纖維化病變。此外,眼內炎癥在DR中發揮關鍵作用并貫穿DR的全過程[19](圖1)。
 圖1
血管生成素樣蛋白在糖尿病視網膜病變中的作用示意圖
圖1
血管生成素樣蛋白在糖尿病視網膜病變中的作用示意圖
ANGPTl4對血管通透性的作用具有雙向作用。既可促使血管滲漏,又可保護血管通透性。ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL6促進血管生成。其中ANGPTL2、ANGPTL4、ANGPTL6在眼內表達升高,促進內皮細胞遷移誘導血管新生;ANGPTL3促進血漿內的內皮祖細胞分化以誘導新生血管形成。ANGPTL2、ANGPTL3、ANGPTL4促進視網膜炎癥的發生 ANGPTL:血管生成素樣蛋白
3.1 ANGPTL參與糖代謝和脂代謝
糖代謝方面,ANGPTL4可激活磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(Akt)通路來調節結直腸癌中葡萄糖轉運蛋白的表達,以促進葡萄糖的代謝[20],而ANPGTL8通過激活PI3K/Akt信號通路來抑制糖尿病小鼠肝臟糖異生,以降低血糖水平[21]。脂代謝方面,ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL8調控機體脂質代謝。ANGPTL2可結合CD146以激活環磷酸腺苷反應元件結合蛋白來上調CD146,從而發揮促脂肪形成的作用[22],ANGPTL3、ANGPTL4、ANGPTL8可單獨調節脂質代謝也可協同發揮作用。其中,ANGPTL3可抑制EC磷脂酶活性[23],ANGPTL4可觸發脂蛋白脂肪酶(LPL)的α/β-水解酶結構域的不可逆去折疊導致LPL失活[24]。ANGPTL3、ANGPTL4都具有CCD結構域,可抑制LPL功能[25]。ANGPTL8可與白色脂肪分泌的ANGPTL4結合導致其功能下降,而與血清中的ANGPTL3結合進一步增強其LPL抑制作用[26]。ANGPTL3、ANGPTL4、ANGPTL8都可通過特異性表位1抑制LPL功能[27-28]。綜上,ANGPTL4、8在糖代謝方面發揮作用,ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL8都參與了機體的脂質代謝,ANGPTL在機體糖脂代謝中的作用不可忽視。
3.2 ANGPTL促進血管通透性增加
多項研究結果顯示,ANGPTL4誘導了血管滲漏的發生。在EC中,ANGPTL4可通過整合素信號和細胞間血管內皮鈣黏蛋白和緊密連接蛋白5簇發生相互作用破壞血管連接完整性[29],同時,其還可以與EC上神經纖毛蛋白1(NRP1)和NRP2結合,導致Ras同源基因家族成員(Rho)A/Rho相關卷曲螺旋形成蛋白激酶信號通路的快速激活和EC之間連接的破壞[30]。此外,研究表明,ANGPTL4可通過上調VEGF表達水平增加EC通透性,且這種作用并不完全依賴于VEGF[31]。ANGPTL4可通過與EC整合素αvβ3結合競爭VEGFR2下游的酪氨酸激酶Src信號傳導來改善缺氧誘導的血管通透性增加[32],ANGPTL4還可減輕組胺誘導的血管滲漏[33],這說明ANGPTL4對血視網膜屏障還可能起到了保護作用。而在Müller細胞中,缺氧激活缺氧誘導因子-1a通路上調ANGPTL4以增強血管滲透[34];在視網膜色素上皮細胞中,ANGPTL4可通過激活轉錄激活因子3(STAT3)來減少色素上皮細胞中Claudin蛋白和帶狀閉合蛋白1從而促進血視網膜屏障通透性增加[35]。綜上,ANGPTL4對血管通透性的作用具有兩面性,其對血管通透性的具體作用機制可能跟所處的環境、結合的受體有關。
3.3 ANGPTL參與病理性血管生成
ANGPTL2、ANGPTL3、ANGPTL4、ANGPTL6均參與血管生成。其中,ANGPTL4可通過激活視網膜EC表達VEGF或前纖維蛋白1(PROFLLIN-1)以促進眼部血管生成[31]。此外,在傷口上皮中,ANGPTL4可通過整合素/Janus激酶/STAT3介導的誘導型一氧化氮合酶表達上調,誘導一氧化氮生成,從而促進血管生成[36]。ANGPTL4可顯著誘導視網膜血管內限定膜破裂,促進視網膜血管向玻璃體內萌發[37]。
ANGPTL2、ANGPTL3、ANGPTL6也通過不同的機制參與血管生成。ANGPTL2可通過激活C-Jun氨基末端激酶(JNK)磷酸化進一步調節膜型基質金屬蛋白酶控制EC遷移和三維管腔形成[38]。ANGPTL3可通過與內皮祖細胞整合素ανβ3受體結合,促進Akt磷酸化,上調miR-126的表達,從而促進新血管的形成[39]。在糖尿病黃斑水腫患者的房水中,ANGPTL6表達水平升高,且與疾病嚴重程度呈正相關[8]。而ANGPTL6可激活細胞外調節蛋白激酶(ERK)1/2-內皮型一氧化氮合酶-一氧化氮通路以誘導血管生成[40]。外泌體中的ANGPTL6,除ERK1/2通路外,還可以通過JNK和絲裂原相關蛋白激酶p38途徑促進血管生成[41],這提示ANGPTL6可能參與了眼部血管生成。
3.4 ANGPTL參與眼內炎癥反應
ANGPTL4通過激活PROFLLIN-1信號通路上調IL-1β、IL-6水平,從而促進炎癥反應[31]。然而,也有研究發現ANGPTL4可以抑制小膠質細胞活化同時抑制脂肪酸合成酶配體/脂肪酸合成酶通路減輕細胞凋亡和炎癥[42],這提示ANGPTL4在眼部炎癥病變中的作用可能存在兩面性。
在小鼠角膜炎模型中,ANGPTL2表達水平上調,ANGPTL2誘導了巨噬細胞浸潤和IL-1β過表達,加劇了角膜炎癥改變[43];而在小鼠葡萄膜炎模型中,ANGPTL2通過激活核轉錄因子(NF)-κB信號通路促進了內毒素誘導的視網膜炎癥[44];在脂多糖誘導眼內炎的小鼠模型中,ANGPTL2通過PirB受體激活視網膜Müller細胞參與眼內炎癥[45];而在脈絡膜新生血管的模型中,ANGPTL2可通過與整合素α4β2結合,激活了巨噬細胞中NF-κB和ERK通路,促進多種炎癥因子表達和巨噬細胞募集,巨噬細胞會進一步促進ANGPTL2表達[46]。綜上,ANGPTL2與眼部炎癥性改變聯系密切。
ANGPTL3可直接促進眼部炎癥的發生。有研究發現,向小鼠玻璃體內注射ANGPTL3可導致ANGPTL3與視網膜EC整合素ανβ3結合,產生促炎促凋亡的作用,這一作用可以被過氧化物酶體增殖物激活受體α(PPAR-α)激動劑非諾貝特阻斷[47],這提示ANGPTL3可通過抑制PPAR-α通路促進眼部炎癥。
4 ANGPTL作為生物標志物的研究及靶向調控ANGPTL的藥物研發和臨床試驗
現有研究證明,ANGPTL3、ANGPTL4、ANGPTL8是DR的候選生物標志物。其中,ANGPTL4在PDR患者玻璃體和血清中表達水平明顯高于IMH患者,并且PDR患者的玻璃體及血清中ANGPTL4與VEGF水平有顯著相關性,這提示ANGPTL4可能作為治療PDR的新靶點[6]。另一方面,研究發現,血清中ANGPTL3的表達水平與T2DM患者的DR分期呈正相關,ANGPTL3可能作為T2DM患者DR進展的潛在生物標志物[11]。此外,ANGPTL8表達水平在PDR患者中的血清和玻璃體中顯著升高[16],血清ANGPTL8表達水平與DR顯著相關[14],ANGPTL8也可能成為DR的診斷依據。
目前主要研發了針對ANGPTL3的三種藥物,單克隆抗體依維蘇單抗和反義寡核苷酸Vupanorsen、RNA干擾藥物ARO-ANG3。其中依維蘇單抗已經上市,用于純合子家族性高膽固醇血癥的輔助治療。研究表明,依維蘇單抗和Vupanorsen對ANGPTL3的藥理抑制可復制ANGPTL3功能缺失載體的表型[48-49]。在正常對照者和家族性高膽固醇患者中,依維蘇單抗靶向循環ANGPTL3,能有效降低低密度脂蛋白膽固醇(LDL-C)、HDL-C和TG。重要的是,依維蘇單抗在LDL受體(LDLR)缺乏人群中的療效支持了其降低LDL-C的作用與完整LDLR無關[48, 50]。然而,頻繁的靜脈注射抗體可能給患者帶來不便,并可能影響治療的依從性。此外,由于臨床同期發現丙氨酸轉氨酶和肝脂肪變性的增加,Vupanorsen的開發已經停止[49, 51]。ARO-ANG3是一種靶向ANGPTL3的RNA干擾療法,目前處于Ⅱ期臨床試驗階段。最新的一項臨床試驗證明,ANGPTL3信使RNA的小干擾RNA治療預期較好。患者的耐受性良好,可以有效降低動脈粥樣硬化脂蛋白、TG和脂蛋白濃度。ARO-ANG3也能降低LDL-C表達水平[52]。ARO-ANG3可以解決廣泛性動脈粥樣硬化二級預防的主要空白,對于管理高危人群,如混合性血脂異常和家族性高膽固醇血癥尤其有價值[51]。然而,以ANGPTL為靶點的靶向藥物在DR中的研發尚未見報道。未來,需要在DR中進一步研究ANGPTL3、ANGPTL4、ANGPTL8作為生物標志物的可行性,而ANGPTL3的靶向藥物在控制血脂異常的同時,是否有利于改善DR的疾病進展,以及ANGPTL4作為DR治療中新的靶向藥物的潛在可能。
5 小結與展望
ANGPTL在機體內表達廣泛,發揮著維持糖脂代謝穩態、調控干細胞活性、參與血管生成、調節炎性反應、調節血管滲漏等多種作用。其中,糖脂代謝穩態、炎性反應、血管滲漏和血管生成是DR的重要病理機制。ANGPTL4已被證明參與了DR的進展過程,而多種ANGPTL在血清或玻璃體中表達水平與DR的發生和發展呈正相關。基于ANGPTL的生理病理調控機制及其與DR存在的相關性,ANGPTL是一種有潛力的分子靶點,不僅可以作為生物標志物用于預測DR的發生和進展,也可以通過制作抗體藥物干預該分子,為DR的治療提供新的思路。