引用本文: 李建華, 吳銳邦, 劉錚, 黃勇, 豐干鈞, 張利, 劉立岷, 宋躍明. 局部注射負載姜黃素的介孔二氧化硅納米粒延緩大鼠尾椎間盤退變的研究. 華西醫學, 2024, 39(4): 604-612. doi: 10.7507/1002-0179.202312144 復制
腰痛是椎間盤退變引發的常見癥狀之一,在不同程度上影響人們的正常工作與生活,其不僅帶來相應的疾病與經濟負擔,也帶來不小的家庭和心理負擔[1-2]。椎間盤組織會隨年齡的增長逐漸發生自然老化,引發退變相關的癥狀與疾病[3-4]。目前研究認為,椎間盤組織退變的發生與椎間盤組織營養供給不足及代謝失衡、細胞外基質(extracellular matrix, ECM)成分的改變以及細胞的衰老、凋亡等病理生理過程及生物化學變化相關[5]。炎癥反應促進組織代謝平衡向分解代謝傾斜,最終引發椎間盤組織的退行性改變[6]。目前針對椎間盤退變的治療主要包括手術治療和保守治療兩種方式[7]。手術治療可以緩解壓迫和疼痛等癥狀,去除病因,但難免對局部造成損傷,引發手術相關并發癥;保守治療借助康復理療等方式來緩解癥狀,但常難以起到理想的療效[8]。因此,目前的治療缺少有效的方式來延緩或逆轉椎間盤退變的生物學過程[9]。近年來,介孔二氧化硅納米粒(mesoporous silica nanoparticles, MSN)作為一種無機材料,因其良好的生物相容性、理化穩定性以及表面可修飾性,且制備較為簡易可控,常被用作藥物載體來遞送藥物[10]。姜黃素是從姜黃科植物中提取出的一種姜黃色素類物質,其結構上是由 2 個鄰甲氧基化的酚以及 1 個 β-二酮組成,屬于多酚類物質[11]。借助 MSN 搭載姜黃素藥物,理論上可以增加其溶出率及穩定性,提高姜黃素的生物利用度[12]。根據目前的研究進展和已有的研究結果,我們采用負載姜黃素的 MSN 復合體(curcumin-loaded MSN, Cur@MSN)對大鼠退變椎間盤進行干預,期望在一定程度上延緩椎間盤的退變過程,為椎間盤退變的治療提供新策略。
1 材料與方法
1.1 實驗動物
雄性 SD 大鼠 20 只,8 周齡,體重 200~250 g,于四川大學動物實驗中心進行飼養,一切飼養及動物實驗操作均按四川大學動物實驗倫理委員會批準的倫理方案(批件號:20231116002)進行。
1.2 試劑與儀器
1.2.1 主要試劑
姜黃素、無水乙醇、二甲基亞砜、十六烷基三甲基溴化銨、原硅酸四乙酯、乙酸乙酯、硝酸銨(上海阿拉丁試劑有限公司);最低必需培養基(minimum essential medium-α, MEM-α)、胎牛血清、雙抗混合液、胰蛋白酶(美國 Gibco 公司);細胞計數試劑盒(cell counting kit-8, CCK-8)(上海碧云天有限公司);蘇木精-伊紅(hematoxylin-eosin, HE)染色試劑盒、番紅 O/固綠(safranine O-fast green, SO)染色試劑盒、Masson 染色試劑盒、甲醛組織固定液、乙二胺四乙酸二鉀脫鈣液(北京索萊寶生物公司);兔抗大鼠Ⅱ型膠原(collagen type Ⅱ, Col-Ⅱ)抗體、兔抗大鼠基質金屬蛋白酶-13(matrix metallopeptidase-13, MMP-13)抗體、兔抗大鼠腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)抗體(美國 Abcam 公司)。
1.2.2 主要儀器
Gemini 300 掃描電鏡(德國 Zeiss 公司);Nicolet6700 傅里葉紅外吸收光譜檢測(美國 ThermoFisher 公司);STA449F3 差示掃描量熱分析(德國 NETZSCH 公司)。
1.3 實驗方法
1.3.1 MSN 的制備
MSN 通過之前研究報道的方法[13]合成。簡單來說,首先將 380 mg 十六烷基三甲基溴化銨、142 mg 三氟乙酸鈉以及 60 μL 三乙醇胺溶于 25 mL 去離子水中,在 80℃攪拌 1 h,然后加入 4 mL 硅酸四乙酯并繼續在 80℃攪拌 1 h 后離心,得到的白色粉末冷凍干燥后放入馬弗爐中,在 550℃下退火 5 h 去除模版劑,得到實驗所需 MSN。
1.3.2 Cur@MSN 的制備
將 300 μg 姜黃素粉末完全溶解于 10 mL 無水乙醇中,并加入已制備的 MSN 納米粒 30 mg,置于磁力攪拌器上攪拌過夜。離心 2 次去除未負載的姜黃素即得到 Cur@MSN 納米粒復合體。
1.3.3 材料表征
通過掃描電鏡觀察 MSN 及 Cur@MSN 的外觀及形態大小,使用激光粒度分析儀分析并比較材料的粒徑分布及 Zeta 電位。取 MSN 及 Cur@MSN 納米粒,進行傅里葉紅外吸收光譜檢測,設定掃描范圍為 500~4000 cm-1,收集數據并繪制紅外吸收圖譜;取 MSN 及 Cur@MSN 納米粒進行差示掃描量熱分析,設定加熱溫度范圍為 40~250℃,加熱速率為 10℃/min,記錄數據并繪制量熱分析圖譜。
1.3.4 Cur@MSN 的釋藥、包封率及載藥率的測定
將適量 Cur@MSN 加入生理鹽水中,分別于不同時間點取樣離心,取上清液,采用紫外分光光度計在 425 nm 處測定上清液的吸光度值,通過已制備姜黃素標準曲線進行計算,得到姜黃素濃度,并通過溶液體積計算溶出的姜黃素質量,繪制 Cur@MSN 在不同時間點的釋藥曲線。包封率及載藥率計算公式為:包封率=(所得復合體質量?初始 MSN 質量)/初始姜黃素質量×100%,載藥率=(所得復合體質量?初始 MSN 質量)/所得復合體質量×100%。
1.3.5 髓核細胞的分離培養
參考既往文獻并適當改良后,對大鼠髓核細胞進行分離培養[14]。取 2 只 4~6 周齡大鼠,異氟烷過量麻醉處死后,在無菌條件下取尾椎髓核組織,剪碎后置于磷酸鹽緩沖液(phosphate buffer saline,PBS)中以 1000 r/min、有效離心半徑 10 cm 離心 5 min,棄上清液,于 37℃條件下加 5 mL 胰蛋白酶作用并震蕩 3~5 min,再以 1000 r/min、有效離心半徑 10 cm 離心 5 min,棄上清液,使用 MEM-α 完全培養基重懸后 75 目濾網過濾,得到髓核原代細胞懸液。原代細胞置于 37℃細胞培養箱中培養,首次于 48 h 后更換培養基,后每 72 小時更換培養基,待細胞鋪滿達 80% 時傳代。傳代 2 次后得到實驗所需髓核細胞(P2)。
1.3.6 細胞增殖實驗
基于 CCK-8 實驗結果、復合體載藥率和相關文獻報道,我們選擇了 1 μmol/L 姜黃素[15]以及 200 μg/mL Cur@MSN 作為后續實驗的濃度[16-17]。首先評估不同濃度姜黃素在體外對大鼠髓核細胞的毒性。96 孔板中加入髓核細胞 MEM-α 完全培養基懸液 100 μL,待細胞貼壁后,更換為不同濃度(0、1、10、20、40、60、80、100 μmol/L)的姜黃素培養基溶液 100 μL,其中姜黃素預先以二甲基亞砜溶解后少量緩慢加入 MEM-α 完全培養基中振蕩溶解,二甲基亞砜終濃度控制為小于 0.05%。共培養 1 d 后,用 CCK-8 試劑盒檢測各濃度細胞增殖情況。其次分別在正常環境和炎癥環境下,將姜黃素和 Cur@MSN 分別與髓核細胞共培養 1、3 或 5 d,以檢測二者的細胞相容性以及對炎癥環境下細胞增殖的干預情況。將姜黃素和 Cur@MSN 分別置于 96 孔板孔底,每孔中加入 100 μL 細胞懸液;同時設置一組無材料干預的平行對照組。細胞貼壁后,炎癥環境各組另加入 10 μg/mL 的脂多糖模擬炎癥環境。兩種環境均各自與無材料干預的細胞作比較。干預完成后,采用 CCK-8 試劑盒測定髓核細胞的增殖情況。
1.3.7 動物體內實驗
通過針刺大鼠尾椎間盤建立椎間盤退變動物模型,以評價 Cur@MSN 的體內作用,該動物模型可模擬椎間盤退變的生理過程。 將 12 只雄性 SD 大鼠采用隨機抽簽法分為 4 組:正常組、退變組、姜黃素組及 Cur@MSN 組,每組 3 只,其中正常組不進行任何操作,退變組僅建立模型,其余 2 組在造模后即進行相應的姜黃素及 Cur@MSN 材料試劑的干預。根據文獻報道,采用針刺法建立大鼠尾椎間盤退變模型[18-19]。使用異氟烷氣體麻醉滿意后對尾椎局部進行消毒,觸診選取尾椎第 7~8 和8~9 節段(Co7-8,Co8-9)椎間盤,使用 18G 針頭沿選定椎間隙中心經皮垂直穿刺至髓核區域,旋轉 360° 并維持 30 s 后拔出。穿刺前預先測量該節段大鼠尾直徑,計算半徑確定進針深度(約 5 mm),并在針頭相應位置作好標記,進針時結合穿刺落空感來評估穿刺深度。對試劑干預組的大鼠完成穿刺造模后,立即使用微量注射器分別向相應節段椎間盤內注射 20 μL 相應試劑。為減少給藥引起的二次損傷,藥物通過椎間隙中的同一針道注射。 術后將動物轉回飼養間觀察。
1.3.8 影像學及大體病理評估
術后 4 周,對大鼠尾椎進行組織取材、顯微 CT(Micro-CT)掃描和 MRI 分析,以監測椎間盤的退化或再生。所有大鼠予過量異氟烷麻醉處死,截取相應節段尾椎,剝皮后固定于 4% 甲醛固定液中,以便進行后續各項評估。首先使用 Micro-CT 進行 CT 掃描及局部的骨三維重建,測量椎間盤高度及相鄰椎體高度,計算椎間盤高度指數(disc height index, DHI),并將退變組、姜黃素組及 Cur@MSN 組的 DHI 與正常組 DHI 作比獲得 DHI 百分比(DHI%),評估椎間盤高度的改變[20]。使用 MRI 技術對離體尾椎進行矢狀面 T2 相掃描,對圖像進行椎間盤 Pfirrmann 分級的評估[21],觀察比較椎間盤退變的程度。組織固定約 1 周后加入乙二胺四乙酸脫鈣溶液中進行脫鈣,5~6 周后沿縱軸剖開,置于解剖顯微鏡下拍攝相應節段椎間盤組織的矢狀面,觀察退變情況。
1.3.9 組織學評估
將上述脫鈣的椎間盤組織包埋于石蠟中切片,進行 HE 染色、SO 染色以及 Masson 染色。通過 HE 染色確定椎間盤的結構變化,通過 SO 染色確定椎間盤內髓核的成分,通過 Masson 染色確定膠原重塑和比例。同時,根據文獻報道的方法評估椎間盤的退行性改變,該分級系統將 1、2 或 3 的等級分配給 4 個參數:纖維環、纖維環和髓核之間的邊界、髓核的細胞結構和髓核的基質,通過將每個參數的等級相加,得到一個總分,較高的總分級表明更嚴重的變性[22]。
1.3.10 免疫組織化學(組化)分析
通過免疫組化染色分析 Col-Ⅱ、MMP-13 和 TNF-α 在組織中的表達。將以上石蠟組織切片進行烘烤、脫蠟及抗原修復后,使用 3% 過氧化氫溶液處理,后分別加入兔抗大鼠 Col-Ⅱ抗體、兔抗大鼠 MMP-13 抗體及兔抗大鼠 TNF-α 抗體(均以 1∶100 比例稀釋)低溫過夜孵育,PBS 清洗 3 遍,滴加辣根過氧化物酶偶聯的抗兔二抗常溫孵育 1 h 后使用 PBS 清洗,以二氨基聯苯胺顯色劑顯色,PBS 清洗 3 遍,加入蘇木精復染,清水清洗后予脫水、封片,掃描得到免疫組化染色圖像,使用 ImageJ 軟件分析陽性著色細胞數量及染色強度。
1.4 統計學方法
通過 SPSS 22.0 軟件進行統計分析。實驗數據均服從正態分布,以均數±標準差表示,每個實驗至少重復 5 次。多組之間采用單因素方差分析進行比較,兩兩比較采用 Tukey 檢驗,雙側檢驗水準 α=0.05。采用 Graphpad Prism 9.0 軟件繪制統計圖。
2 結果
2.1 材料表征結果
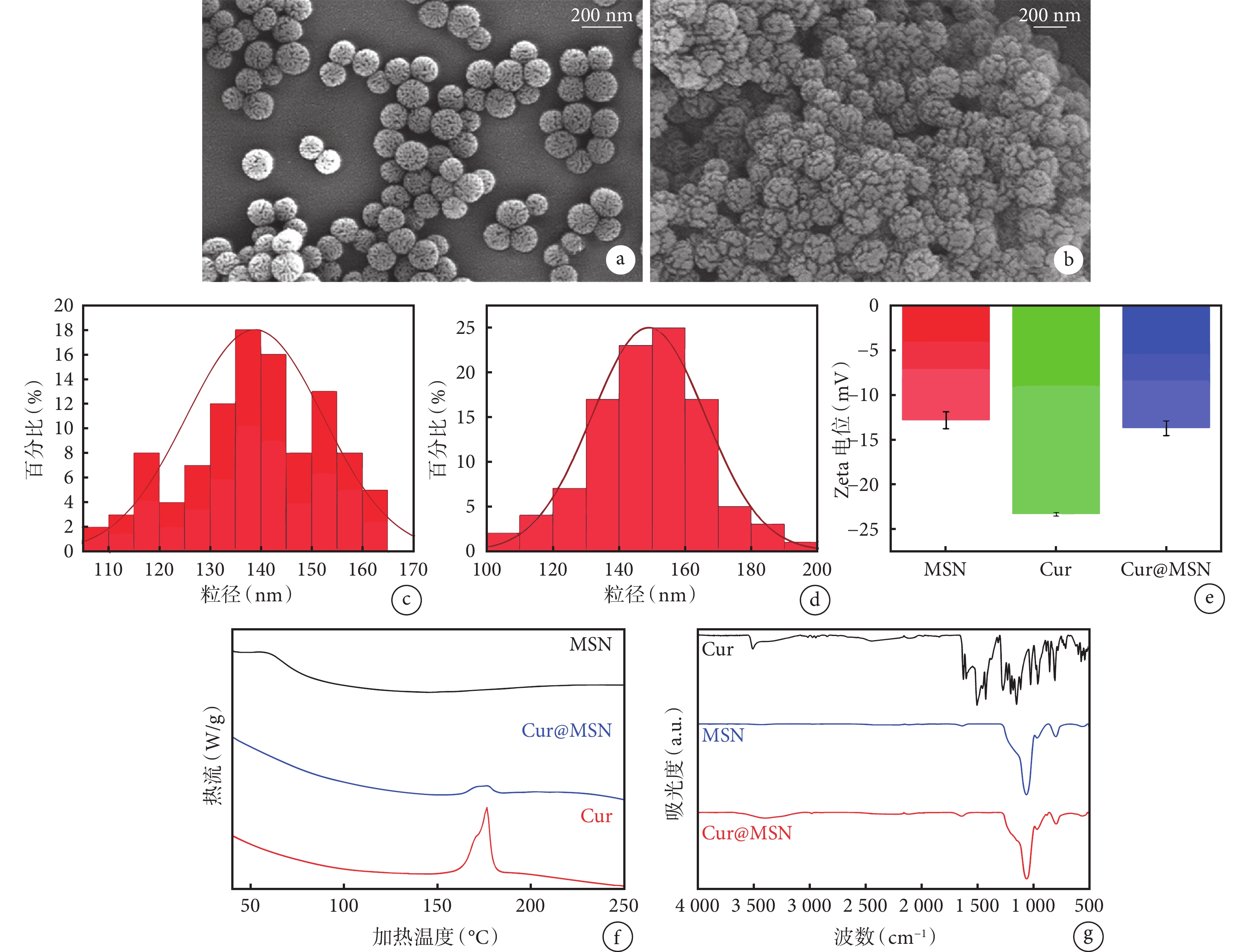
掃描電鏡下(圖1a、1b)可見 MSN 及 Cur@MSN 納米粒呈圓球形,分散性良好,粒徑分布均勻,表面呈花狀結構,瓣葉間可見許多溝回狀孔隙;其中 Cur@MSN 納米粒表面的瓣葉更為飽滿寬厚,瓣葉間隙相對較少,且窄而淺,未見明顯姜黃素晶體顆粒,說明姜黃素晶體已較好地分散并吸附于 MSN 瓣葉表面及其間隙中。粒徑分析結果(圖1c、1d)顯示 MSN 粒徑大小主要集中在 120~160 nm,平均粒徑為 142.2 nm;而 Cur@MSN 粒徑大小主要分布于 130~170 nm,平均粒徑為 153.3 nm。Zeta 電位分析(圖1e)測得 MSN、姜黃素、Cur@MSN 的平均 Zeta 電位分別為 ?12.5、?22.5、?13.5 mV,Cur@MSN 介于前兩者之間,表明姜黃素已吸附于 MSN 納米粒中。
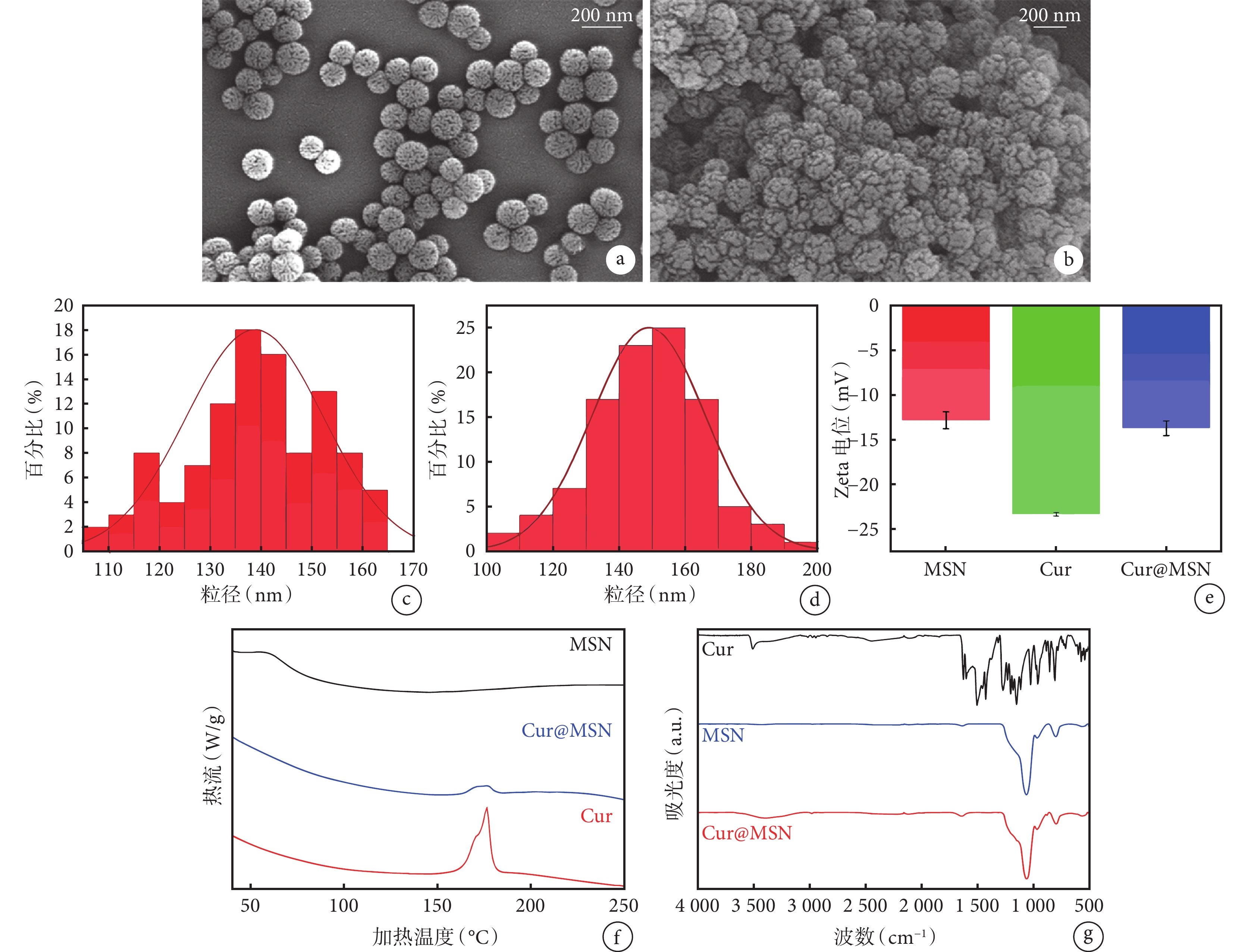 圖1
姜黃素及納米粒的材料表征分析
圖1
姜黃素及納米粒的材料表征分析
a、b. 分別為 MSN 和 Cur@MSN 的掃描電鏡照片,兩種納米顆粒大小均一,形態規則;c、d. 粒徑直方圖分析,MSN 和 Cur@MSN 平均粒徑分別為(142.2±25.8)、(153.3±43.6) nm;e. MSN、姜黃素、Cur@MSN 的 Zeta 電位分析;f. 差示掃描量熱分析;g. 傅里葉紅外吸收光譜檢測。MSN:介孔二氧化硅納米粒;Cur:姜黃素;Cur@MSN:負載姜黃素的 MSN 復合體
從差示掃描量熱分析圖譜(圖1f)可見,姜黃素在 175℃處出現一個強吸熱峰,對應其晶體熔點;MSN 未見明顯吸熱峰;Cur@MSN 在 160~180℃范圍內出現一個在溫度上與姜黃素的熔點相對應的較低而寬的吸熱峰,表明姜黃素已經較好地分散于 MSN 的孔隙中。
傅里葉紅外吸收光譜檢測圖譜(圖1g)顯示,姜黃素與 MSN 的特征吸收峰均清晰可見。姜黃素圖譜中羥基 O-H 伸縮振動所對應的 3516 cm?1 處吸收峰,苯環及雙鍵碳的 C-H 伸縮振動所對應 3100~2800 cm?1 范圍內吸收峰,上述不飽和碳的 C-H 面外彎曲振動所對應 892 cm?1 處吸收峰,以及 MSN 圖譜中 Si-O-Si 非對稱伸縮振動所對應 1056 cm?1 處吸收峰,Si-OH 彎曲振動所對應 996 cm?1 處吸收峰,Si-O 對稱伸縮振動所對應 808 cm?1 處吸收峰,在 Cur@MSN 圖譜中均可見與之對應的吸收峰,且無明顯遷移,其中 3650~3100 cm?1 范圍內的伸縮振動變寬,表明姜黃素與 MSN 分子間已形成多分子締合氫鍵,說明姜黃素已較好地負載于 MSN 中,且二者間未形成新的化學鍵,主要以氫鍵和范德華力相結合。
2.2 Cur@MSN 的包封率、載藥率及釋藥曲線
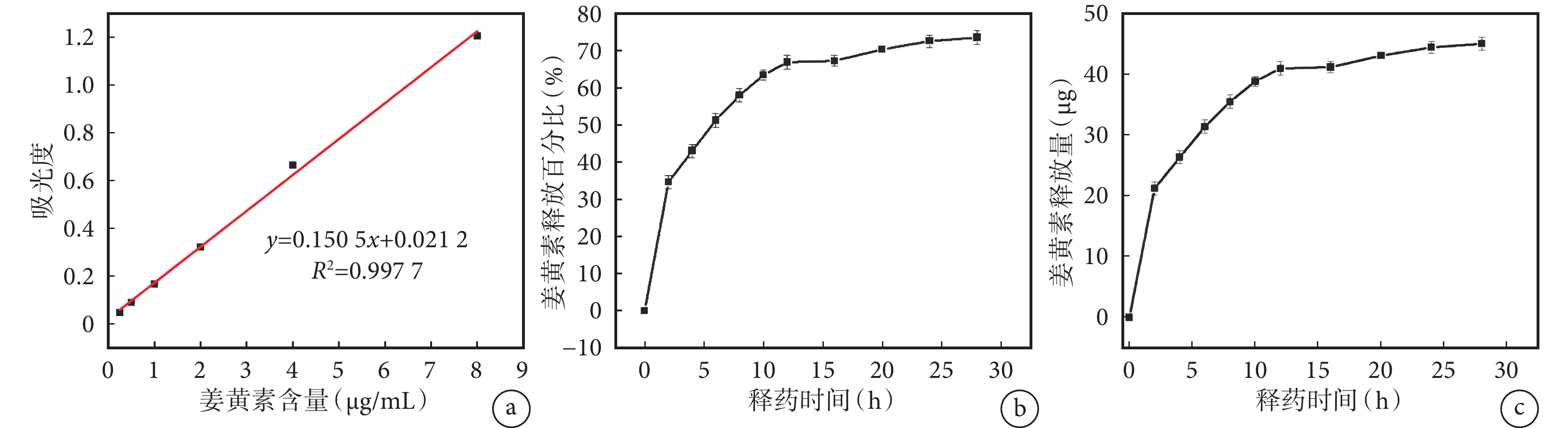
Cur@MSN 的包封率為 20.4%,載藥率為 0.2%。經體外藥物釋放實驗觀察(圖2)發現,Cur@MSN 在最初的 12 h 內藥物釋放速度相對較快,釋放出的藥物約占總藥物量的 60%。隨后,藥物釋放速度逐漸減緩,并逐漸趨于穩定,形成了一個相對穩定的釋放濃度。到 28 h 時,已釋放的姜黃素總量達到了 70%。
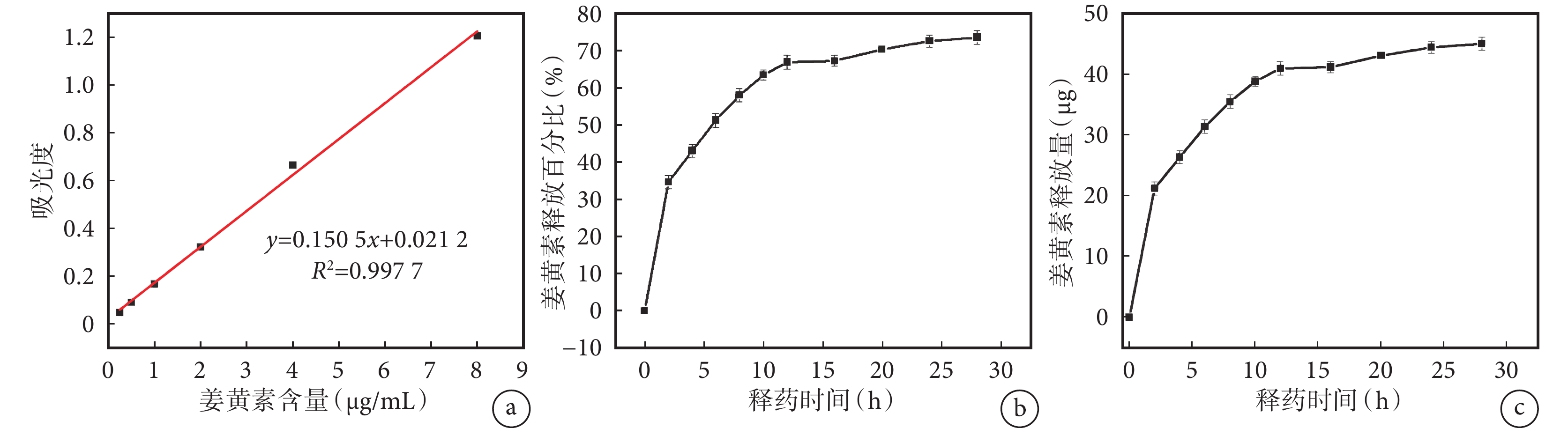 圖2
姜黃素的標準曲線及 Cur@MSN 的釋藥曲線
圖2
姜黃素的標準曲線及 Cur@MSN 的釋藥曲線
a. 姜黃素標準曲線;b、c. Cur@MSN 的姜黃素釋放百分比及釋放量曲線。Cur@MSN:負載姜黃素的介孔二氧化硅納米粒復合體
2.3 體外細胞實驗結果
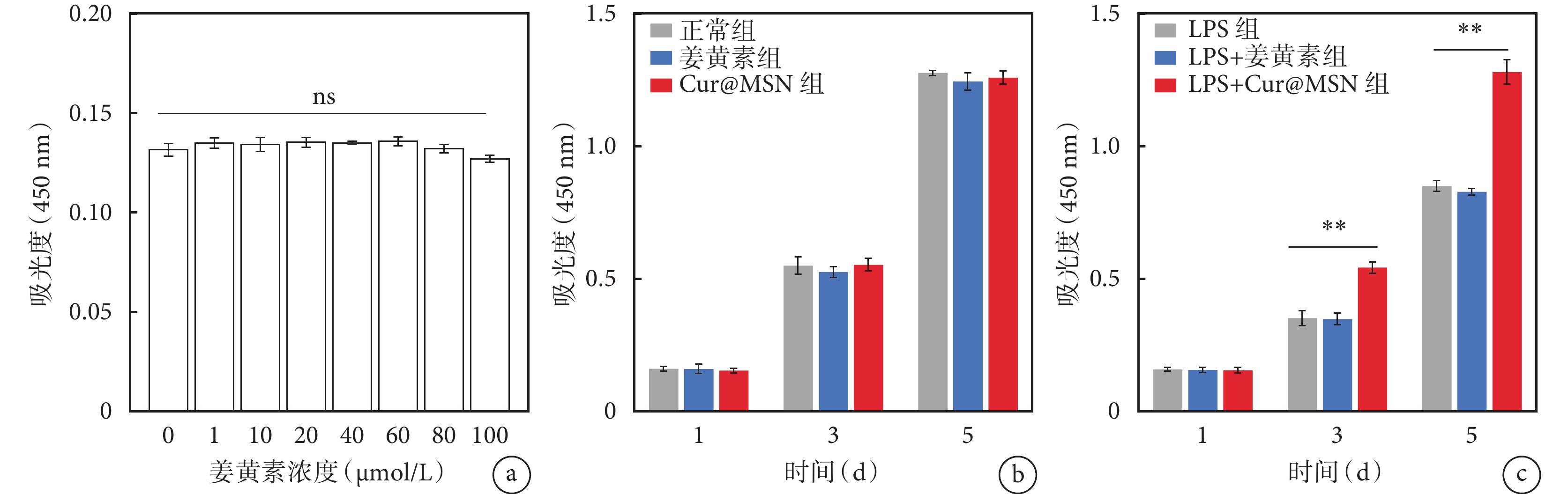
姜黃素的不同終濃度間髓核細胞增殖吸光度值差異無統計學意義(P>0.05),見圖3a。在正常環境條件下,隨共培養時間的增加,3 組的髓核細胞表現為持續增殖,細胞增殖吸光度值持續升高,同時各組之間的差異無統計學意義(P>0.05),見圖3b。然而在脂多糖所誘導炎癥環境中,共培養 3 d 和 5 d 的 Cur@MSN 組細胞增殖吸光度值均明顯高于對照組和姜黃素組(P<0.01),見圖3c。
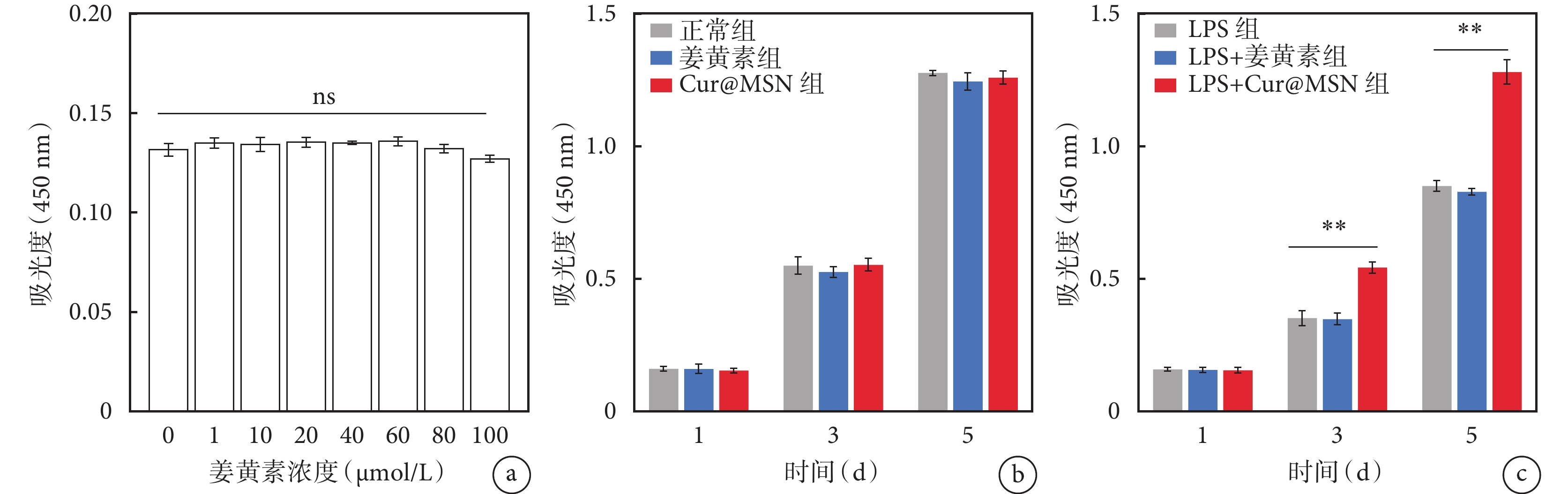 圖3
不同環境下髓核細胞增殖情況
圖3
不同環境下髓核細胞增殖情況
a. CCK-8 實驗,不同濃度姜黃素溶液與髓核細胞共培養 1 d 后的 450 nm 吸光度;b. 正常環境,3 組細胞增殖吸光度值比較差異無統計學意義;c. 脂多糖誘導下 3 組細胞增殖吸光度值比較,3 d 和 5 d 的 Cur@MSN 組細胞增殖能力和其余兩組比較差異具有統計學意義。ns 表示
2.4 影像學評估及大體病理結果
Micro-CT 及其三維重建圖像顯示,手術后針刺椎間盤明顯退化,表明椎間盤退變大鼠模型的成功構建。從各組間 DHI% 的對比中可以看出,在術后 4 周時,相比退變組和姜黃素組,Cur@MSN 組椎間盤高度的丟失量更少,最為接近正常組的椎間盤高度。MRI 圖像顯示,正常組椎間盤結構清晰,含水量豐富。相比之下,退變組的椎間盤邊界模糊,含水量低,其余 2 組的椎間盤退變程度介于二者之間。Pfirrmann 分級結果顯示,術后 4 周時正常組的椎間盤含水量在所有組中最高;與正常組相比,Cur@MSN 組的椎間盤含水量較之降低最小,其含水量顯著高于退變組。這一結果表明,Cur@MSN 對維持退變椎間盤的含水量有積極作用,可以改善局部微環境,進而促進椎間盤退變的修復。不同組椎間盤的大體形態顯示,術后 4 周,正常組椎間盤的大體結構和高度基本正常,退變組和姜黃素組髓核幾乎完全消失,而 Cur@MSN 組大部分髓核組織保留較好。各組影像學評估和大體病理結果詳見圖4。
 圖4
各組影像學評估及大體病理結果
圖4
各組影像學評估及大體病理結果
Cur@MSN:負載姜黃素的介孔二氧化硅納米粒復合體;椎間盤高度指數百分比和 Pfirrmann 分級均為術后 4 周時的數據;*表示
2.5 組織學及免疫組化評價結果
組織學切片染色圖中可見,正常組椎間盤表現正常,顯微結構髓核完整,輪廓分明;退變組與姜黃素組髓核缺失,椎間盤紊亂;Cur@MSN 組髓核更完整,椎間盤局部顯微結構接近正常組。根據先前的研究確定所有椎間盤的組織學分級,結果顯示,Cur@MSN 組的組織學評分與正常組最接近,而退變組和姜黃素組的組織學評分則顯著升高。為了探討 Cur@MSN 的治療機制,采用免疫組織化學染色技術檢測 COL-Ⅱ、MMP-13 和 TNF-α 的表達水平,在正常組和 Cur@MSN 組中,髓核區域顯示出 MMP-13、TNF-α 著色的相對缺乏和 COL-Ⅱ著色的顯著增強;相反,退變組表現出 MMP-13、TNF-α 染色的免疫反應性增強和 COL-Ⅱ的染色減少。對 COL-Ⅱ染色的定量分析顯示,正常組和 Cur@MSN 組的 COL-Ⅱ相對表達量顯著高于其他 2 組。對 MMP-13 染色的定量分析顯示,與正常組和 Cur@MSN 組相比,退變組的 MMP-13 相對表達量較之顯著升高,而姜黃素組升高不明顯。而對 TNF-α 染色的定量分析顯示,與正常組和 Cur@MSN 組相比,退變組和姜黃素組的 TNF-α 相對表達量均有升高。見圖5。
 圖5
各組的組織學及免疫組化病理結果
圖5
各組的組織學及免疫組化病理結果
Cur@MSN:負載姜黃素的介孔二氧化硅納米粒復合體;HE:蘇木精-伊紅;SO:番紅 O/固綠;COL-Ⅱ:Ⅱ型膠原;MMP-13:基質金屬蛋白酶-13;TNF-α:腫瘤壞死因子-α。ns 表示
3 討論
姜黃素是從姜黃中提取的一種天然多酚,具有廣泛的藥理作用。與用于體內促進抗炎或者再生的細胞因子相比,姜黃素具有低獲取成本、易于滲透的優勢,但受到了水溶性差和生物半衰期短的限制[23]。為了克服這些局限性,研究人員提出了諸如化學修飾、脂質體包封和納米載體遞送等策略[24]。本研究選擇了 MSN 作為載體,成功實現了對姜黃素的有效負載和緩慢釋放。在注射 Cur@MSN 后,姜黃素被逐漸釋放出來,藥物釋放曲線驗證了這一過程,這種釋放行為對于藥物遞送和持續釋放具有重要意義。在最初的 12 h 內,藥物釋放較快可以使藥物迅速達到治療濃度,迅速發揮作用。然后,隨著時間的推移,釋放速度的減緩可以使藥物持續釋放,維持治療濃度的穩定,從而實現長效治療的效果。體外藥物釋放曲線的特點表明該載藥系統對姜黃素的釋放具有可控性和穩定性,這對于藥物治療的精準調控具有重要意義。這些結果使得 MSN 成為一種潛力巨大的藥物載體,可用于制備高效、安全、可控釋放的藥物輸送系統。過去的研究中,Bai 等[25]曾對比腹腔注射與局部注射藥物對大鼠尾退變椎間盤的療效,發現腹腔注射組的全身不良反應顯著增強。本研究選擇了使用微量注射器微創注射到退變局部,避免了全身性的不良反應,同時也使藥物在椎間盤組織內形成了有效的治療濃度,明確了靶點,提高了姜黃素的生物利用率。另外,直接植入生物材料可能引發局部炎癥和免疫反應。本研究通過 CCK-8 實驗研究發現,Cur@MSN 在與大鼠髓核細胞的共培養中呈現出良好的生物相容性和一定的抗炎作用,這些結果揭示了在不同環境下的姜黃素和 Cur@MSN 對髓核細胞增殖的影響。在正常環境下,姜黃素和 Cur@MSN 對細胞增殖沒有顯著性影響,而在炎癥環境下,Cur@MSN 可以減輕細胞受炎癥抑制的程度。此外,Cur@MSN 的應用在炎癥環境中有助于提高細胞增殖的能力,這可能是由于 MSN 提供了持續的姜黃素釋放,從而在一定程度上對抗了炎癥引起的細胞抑制作用。這些結果為姜黃素在炎癥相關疾病中的應用提供了重要的理論依據。本研究在使用大鼠尾椎穿刺退變模型進一步評估 Cur@MSN 的治療效果時,發現注射 Cur@MSN 4 周后,DHI%、Pfirrmann 分級均明顯優于退變組及單純的姜黃素干預組。同時,注射 Cur@MSN 4 周后,組織學評分以及免疫組化結果與影像學評估結果基本一致,進一步驗證了 Cur@MSN 對椎間盤退變所具有的延緩、抑制和修復的作用,也初步驗證了其抑制炎癥以及減少 ECM 分解的治療機制。Ma 等[26]的研究表明,姜黃素可以下調 TNF-α 的表達,進而抑制核因子 κB 通路的激活。而已有大量研究報道,這一通路的激活與椎間盤組織 ECM 的分解密切相關,進而加速椎間盤退變的進程[27]。Hu 等[28]報道了姜黃素在椎間盤退變的治療中所起的另一作用,即姜黃素可以上調腦源性神經營養因子的轉錄水平。這一發現有助于完善姜黃素的作用機制,可以作為后續研究的方向。此外在本研究中,與未經處理的退變組相比,姜黃素組第 4 周時在 MRI、組織學評分以及部分免疫組化分析上的表現均更好,這說明單純姜黃素的干預在短時間內仍然可以起到一定延緩退變的治療效果,但缺乏載體的遞送和緩釋,導致其難以實現較為理想的療效。
本研究尚有不足之處:① Cur@MSN 的具體治療作用機制尚未被充分解析,姜黃素的具體生物學效應仍需進一步研究;② 所采用的動物模型在建立及治療期間耗時較長,且考慮到大鼠正處于生長發育階段,其生理狀態與成年人類的疾病模型之間的對應關系尚不明確;③ 由于鼠尾椎間盤并非承重結構,無法完全再現人類椎間盤所承受的力學壓力;④ 本研究未能包含對動物疼痛感知和運動功能障礙的行為學評估,這是方法學上的一個缺陷;⑤ 因種屬的不同,Cur@MSN 對人退變椎間盤的治療作用尚待進一步研究。
綜上所述,Cur@MSN 具備延緩大鼠椎間盤退變進程的潛力,并在退變椎間盤的修復與治療方面展現出積極效果。在此過程中,姜黃素發揮了關鍵作用,其抗炎特性有助于減緩椎間盤退變速度。同時,MSN 的加入優化了姜黃素的釋放,增強了其生物活性,從而提高了治療效果。Cur@MSN 的設計不僅為椎間盤退變的臨床治療提供了新的視角,而且在組織工程和再生醫學領域中,也展現了其廣泛的應用潛力。通過這種新策略,Cur@MSN 能夠在細胞水平上促進受損組織的修復,同時在分子層面上調節病理狀態,為未來的治療方法開辟了新的道路。此外,Cur@MSN 在提高椎間盤細胞的存活率和功能性方面也顯示出了顯著效果,這為椎間盤退變的治療帶來了新的希望。隨著進一步的研究和開發,Cur@MSN 有望成為一種有效的治療選項,為患者提供更好的生活質量和健康狀況。
利益沖突:所有作者聲明不存在利益沖突。
腰痛是椎間盤退變引發的常見癥狀之一,在不同程度上影響人們的正常工作與生活,其不僅帶來相應的疾病與經濟負擔,也帶來不小的家庭和心理負擔[1-2]。椎間盤組織會隨年齡的增長逐漸發生自然老化,引發退變相關的癥狀與疾病[3-4]。目前研究認為,椎間盤組織退變的發生與椎間盤組織營養供給不足及代謝失衡、細胞外基質(extracellular matrix, ECM)成分的改變以及細胞的衰老、凋亡等病理生理過程及生物化學變化相關[5]。炎癥反應促進組織代謝平衡向分解代謝傾斜,最終引發椎間盤組織的退行性改變[6]。目前針對椎間盤退變的治療主要包括手術治療和保守治療兩種方式[7]。手術治療可以緩解壓迫和疼痛等癥狀,去除病因,但難免對局部造成損傷,引發手術相關并發癥;保守治療借助康復理療等方式來緩解癥狀,但常難以起到理想的療效[8]。因此,目前的治療缺少有效的方式來延緩或逆轉椎間盤退變的生物學過程[9]。近年來,介孔二氧化硅納米粒(mesoporous silica nanoparticles, MSN)作為一種無機材料,因其良好的生物相容性、理化穩定性以及表面可修飾性,且制備較為簡易可控,常被用作藥物載體來遞送藥物[10]。姜黃素是從姜黃科植物中提取出的一種姜黃色素類物質,其結構上是由 2 個鄰甲氧基化的酚以及 1 個 β-二酮組成,屬于多酚類物質[11]。借助 MSN 搭載姜黃素藥物,理論上可以增加其溶出率及穩定性,提高姜黃素的生物利用度[12]。根據目前的研究進展和已有的研究結果,我們采用負載姜黃素的 MSN 復合體(curcumin-loaded MSN, Cur@MSN)對大鼠退變椎間盤進行干預,期望在一定程度上延緩椎間盤的退變過程,為椎間盤退變的治療提供新策略。
1 材料與方法
1.1 實驗動物
雄性 SD 大鼠 20 只,8 周齡,體重 200~250 g,于四川大學動物實驗中心進行飼養,一切飼養及動物實驗操作均按四川大學動物實驗倫理委員會批準的倫理方案(批件號:20231116002)進行。
1.2 試劑與儀器
1.2.1 主要試劑
姜黃素、無水乙醇、二甲基亞砜、十六烷基三甲基溴化銨、原硅酸四乙酯、乙酸乙酯、硝酸銨(上海阿拉丁試劑有限公司);最低必需培養基(minimum essential medium-α, MEM-α)、胎牛血清、雙抗混合液、胰蛋白酶(美國 Gibco 公司);細胞計數試劑盒(cell counting kit-8, CCK-8)(上海碧云天有限公司);蘇木精-伊紅(hematoxylin-eosin, HE)染色試劑盒、番紅 O/固綠(safranine O-fast green, SO)染色試劑盒、Masson 染色試劑盒、甲醛組織固定液、乙二胺四乙酸二鉀脫鈣液(北京索萊寶生物公司);兔抗大鼠Ⅱ型膠原(collagen type Ⅱ, Col-Ⅱ)抗體、兔抗大鼠基質金屬蛋白酶-13(matrix metallopeptidase-13, MMP-13)抗體、兔抗大鼠腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)抗體(美國 Abcam 公司)。
1.2.2 主要儀器
Gemini 300 掃描電鏡(德國 Zeiss 公司);Nicolet6700 傅里葉紅外吸收光譜檢測(美國 ThermoFisher 公司);STA449F3 差示掃描量熱分析(德國 NETZSCH 公司)。
1.3 實驗方法
1.3.1 MSN 的制備
MSN 通過之前研究報道的方法[13]合成。簡單來說,首先將 380 mg 十六烷基三甲基溴化銨、142 mg 三氟乙酸鈉以及 60 μL 三乙醇胺溶于 25 mL 去離子水中,在 80℃攪拌 1 h,然后加入 4 mL 硅酸四乙酯并繼續在 80℃攪拌 1 h 后離心,得到的白色粉末冷凍干燥后放入馬弗爐中,在 550℃下退火 5 h 去除模版劑,得到實驗所需 MSN。
1.3.2 Cur@MSN 的制備
將 300 μg 姜黃素粉末完全溶解于 10 mL 無水乙醇中,并加入已制備的 MSN 納米粒 30 mg,置于磁力攪拌器上攪拌過夜。離心 2 次去除未負載的姜黃素即得到 Cur@MSN 納米粒復合體。
1.3.3 材料表征
通過掃描電鏡觀察 MSN 及 Cur@MSN 的外觀及形態大小,使用激光粒度分析儀分析并比較材料的粒徑分布及 Zeta 電位。取 MSN 及 Cur@MSN 納米粒,進行傅里葉紅外吸收光譜檢測,設定掃描范圍為 500~4000 cm-1,收集數據并繪制紅外吸收圖譜;取 MSN 及 Cur@MSN 納米粒進行差示掃描量熱分析,設定加熱溫度范圍為 40~250℃,加熱速率為 10℃/min,記錄數據并繪制量熱分析圖譜。
1.3.4 Cur@MSN 的釋藥、包封率及載藥率的測定
將適量 Cur@MSN 加入生理鹽水中,分別于不同時間點取樣離心,取上清液,采用紫外分光光度計在 425 nm 處測定上清液的吸光度值,通過已制備姜黃素標準曲線進行計算,得到姜黃素濃度,并通過溶液體積計算溶出的姜黃素質量,繪制 Cur@MSN 在不同時間點的釋藥曲線。包封率及載藥率計算公式為:包封率=(所得復合體質量?初始 MSN 質量)/初始姜黃素質量×100%,載藥率=(所得復合體質量?初始 MSN 質量)/所得復合體質量×100%。
1.3.5 髓核細胞的分離培養
參考既往文獻并適當改良后,對大鼠髓核細胞進行分離培養[14]。取 2 只 4~6 周齡大鼠,異氟烷過量麻醉處死后,在無菌條件下取尾椎髓核組織,剪碎后置于磷酸鹽緩沖液(phosphate buffer saline,PBS)中以 1000 r/min、有效離心半徑 10 cm 離心 5 min,棄上清液,于 37℃條件下加 5 mL 胰蛋白酶作用并震蕩 3~5 min,再以 1000 r/min、有效離心半徑 10 cm 離心 5 min,棄上清液,使用 MEM-α 完全培養基重懸后 75 目濾網過濾,得到髓核原代細胞懸液。原代細胞置于 37℃細胞培養箱中培養,首次于 48 h 后更換培養基,后每 72 小時更換培養基,待細胞鋪滿達 80% 時傳代。傳代 2 次后得到實驗所需髓核細胞(P2)。
1.3.6 細胞增殖實驗
基于 CCK-8 實驗結果、復合體載藥率和相關文獻報道,我們選擇了 1 μmol/L 姜黃素[15]以及 200 μg/mL Cur@MSN 作為后續實驗的濃度[16-17]。首先評估不同濃度姜黃素在體外對大鼠髓核細胞的毒性。96 孔板中加入髓核細胞 MEM-α 完全培養基懸液 100 μL,待細胞貼壁后,更換為不同濃度(0、1、10、20、40、60、80、100 μmol/L)的姜黃素培養基溶液 100 μL,其中姜黃素預先以二甲基亞砜溶解后少量緩慢加入 MEM-α 完全培養基中振蕩溶解,二甲基亞砜終濃度控制為小于 0.05%。共培養 1 d 后,用 CCK-8 試劑盒檢測各濃度細胞增殖情況。其次分別在正常環境和炎癥環境下,將姜黃素和 Cur@MSN 分別與髓核細胞共培養 1、3 或 5 d,以檢測二者的細胞相容性以及對炎癥環境下細胞增殖的干預情況。將姜黃素和 Cur@MSN 分別置于 96 孔板孔底,每孔中加入 100 μL 細胞懸液;同時設置一組無材料干預的平行對照組。細胞貼壁后,炎癥環境各組另加入 10 μg/mL 的脂多糖模擬炎癥環境。兩種環境均各自與無材料干預的細胞作比較。干預完成后,采用 CCK-8 試劑盒測定髓核細胞的增殖情況。
1.3.7 動物體內實驗
通過針刺大鼠尾椎間盤建立椎間盤退變動物模型,以評價 Cur@MSN 的體內作用,該動物模型可模擬椎間盤退變的生理過程。 將 12 只雄性 SD 大鼠采用隨機抽簽法分為 4 組:正常組、退變組、姜黃素組及 Cur@MSN 組,每組 3 只,其中正常組不進行任何操作,退變組僅建立模型,其余 2 組在造模后即進行相應的姜黃素及 Cur@MSN 材料試劑的干預。根據文獻報道,采用針刺法建立大鼠尾椎間盤退變模型[18-19]。使用異氟烷氣體麻醉滿意后對尾椎局部進行消毒,觸診選取尾椎第 7~8 和8~9 節段(Co7-8,Co8-9)椎間盤,使用 18G 針頭沿選定椎間隙中心經皮垂直穿刺至髓核區域,旋轉 360° 并維持 30 s 后拔出。穿刺前預先測量該節段大鼠尾直徑,計算半徑確定進針深度(約 5 mm),并在針頭相應位置作好標記,進針時結合穿刺落空感來評估穿刺深度。對試劑干預組的大鼠完成穿刺造模后,立即使用微量注射器分別向相應節段椎間盤內注射 20 μL 相應試劑。為減少給藥引起的二次損傷,藥物通過椎間隙中的同一針道注射。 術后將動物轉回飼養間觀察。
1.3.8 影像學及大體病理評估
術后 4 周,對大鼠尾椎進行組織取材、顯微 CT(Micro-CT)掃描和 MRI 分析,以監測椎間盤的退化或再生。所有大鼠予過量異氟烷麻醉處死,截取相應節段尾椎,剝皮后固定于 4% 甲醛固定液中,以便進行后續各項評估。首先使用 Micro-CT 進行 CT 掃描及局部的骨三維重建,測量椎間盤高度及相鄰椎體高度,計算椎間盤高度指數(disc height index, DHI),并將退變組、姜黃素組及 Cur@MSN 組的 DHI 與正常組 DHI 作比獲得 DHI 百分比(DHI%),評估椎間盤高度的改變[20]。使用 MRI 技術對離體尾椎進行矢狀面 T2 相掃描,對圖像進行椎間盤 Pfirrmann 分級的評估[21],觀察比較椎間盤退變的程度。組織固定約 1 周后加入乙二胺四乙酸脫鈣溶液中進行脫鈣,5~6 周后沿縱軸剖開,置于解剖顯微鏡下拍攝相應節段椎間盤組織的矢狀面,觀察退變情況。
1.3.9 組織學評估
將上述脫鈣的椎間盤組織包埋于石蠟中切片,進行 HE 染色、SO 染色以及 Masson 染色。通過 HE 染色確定椎間盤的結構變化,通過 SO 染色確定椎間盤內髓核的成分,通過 Masson 染色確定膠原重塑和比例。同時,根據文獻報道的方法評估椎間盤的退行性改變,該分級系統將 1、2 或 3 的等級分配給 4 個參數:纖維環、纖維環和髓核之間的邊界、髓核的細胞結構和髓核的基質,通過將每個參數的等級相加,得到一個總分,較高的總分級表明更嚴重的變性[22]。
1.3.10 免疫組織化學(組化)分析
通過免疫組化染色分析 Col-Ⅱ、MMP-13 和 TNF-α 在組織中的表達。將以上石蠟組織切片進行烘烤、脫蠟及抗原修復后,使用 3% 過氧化氫溶液處理,后分別加入兔抗大鼠 Col-Ⅱ抗體、兔抗大鼠 MMP-13 抗體及兔抗大鼠 TNF-α 抗體(均以 1∶100 比例稀釋)低溫過夜孵育,PBS 清洗 3 遍,滴加辣根過氧化物酶偶聯的抗兔二抗常溫孵育 1 h 后使用 PBS 清洗,以二氨基聯苯胺顯色劑顯色,PBS 清洗 3 遍,加入蘇木精復染,清水清洗后予脫水、封片,掃描得到免疫組化染色圖像,使用 ImageJ 軟件分析陽性著色細胞數量及染色強度。
1.4 統計學方法
通過 SPSS 22.0 軟件進行統計分析。實驗數據均服從正態分布,以均數±標準差表示,每個實驗至少重復 5 次。多組之間采用單因素方差分析進行比較,兩兩比較采用 Tukey 檢驗,雙側檢驗水準 α=0.05。采用 Graphpad Prism 9.0 軟件繪制統計圖。
2 結果
2.1 材料表征結果
掃描電鏡下(圖1a、1b)可見 MSN 及 Cur@MSN 納米粒呈圓球形,分散性良好,粒徑分布均勻,表面呈花狀結構,瓣葉間可見許多溝回狀孔隙;其中 Cur@MSN 納米粒表面的瓣葉更為飽滿寬厚,瓣葉間隙相對較少,且窄而淺,未見明顯姜黃素晶體顆粒,說明姜黃素晶體已較好地分散并吸附于 MSN 瓣葉表面及其間隙中。粒徑分析結果(圖1c、1d)顯示 MSN 粒徑大小主要集中在 120~160 nm,平均粒徑為 142.2 nm;而 Cur@MSN 粒徑大小主要分布于 130~170 nm,平均粒徑為 153.3 nm。Zeta 電位分析(圖1e)測得 MSN、姜黃素、Cur@MSN 的平均 Zeta 電位分別為 ?12.5、?22.5、?13.5 mV,Cur@MSN 介于前兩者之間,表明姜黃素已吸附于 MSN 納米粒中。
 圖1
姜黃素及納米粒的材料表征分析
圖1
姜黃素及納米粒的材料表征分析
a、b. 分別為 MSN 和 Cur@MSN 的掃描電鏡照片,兩種納米顆粒大小均一,形態規則;c、d. 粒徑直方圖分析,MSN 和 Cur@MSN 平均粒徑分別為(142.2±25.8)、(153.3±43.6) nm;e. MSN、姜黃素、Cur@MSN 的 Zeta 電位分析;f. 差示掃描量熱分析;g. 傅里葉紅外吸收光譜檢測。MSN:介孔二氧化硅納米粒;Cur:姜黃素;Cur@MSN:負載姜黃素的 MSN 復合體
從差示掃描量熱分析圖譜(圖1f)可見,姜黃素在 175℃處出現一個強吸熱峰,對應其晶體熔點;MSN 未見明顯吸熱峰;Cur@MSN 在 160~180℃范圍內出現一個在溫度上與姜黃素的熔點相對應的較低而寬的吸熱峰,表明姜黃素已經較好地分散于 MSN 的孔隙中。
傅里葉紅外吸收光譜檢測圖譜(圖1g)顯示,姜黃素與 MSN 的特征吸收峰均清晰可見。姜黃素圖譜中羥基 O-H 伸縮振動所對應的 3516 cm?1 處吸收峰,苯環及雙鍵碳的 C-H 伸縮振動所對應 3100~2800 cm?1 范圍內吸收峰,上述不飽和碳的 C-H 面外彎曲振動所對應 892 cm?1 處吸收峰,以及 MSN 圖譜中 Si-O-Si 非對稱伸縮振動所對應 1056 cm?1 處吸收峰,Si-OH 彎曲振動所對應 996 cm?1 處吸收峰,Si-O 對稱伸縮振動所對應 808 cm?1 處吸收峰,在 Cur@MSN 圖譜中均可見與之對應的吸收峰,且無明顯遷移,其中 3650~3100 cm?1 范圍內的伸縮振動變寬,表明姜黃素與 MSN 分子間已形成多分子締合氫鍵,說明姜黃素已較好地負載于 MSN 中,且二者間未形成新的化學鍵,主要以氫鍵和范德華力相結合。
2.2 Cur@MSN 的包封率、載藥率及釋藥曲線
Cur@MSN 的包封率為 20.4%,載藥率為 0.2%。經體外藥物釋放實驗觀察(圖2)發現,Cur@MSN 在最初的 12 h 內藥物釋放速度相對較快,釋放出的藥物約占總藥物量的 60%。隨后,藥物釋放速度逐漸減緩,并逐漸趨于穩定,形成了一個相對穩定的釋放濃度。到 28 h 時,已釋放的姜黃素總量達到了 70%。
 圖2
姜黃素的標準曲線及 Cur@MSN 的釋藥曲線
圖2
姜黃素的標準曲線及 Cur@MSN 的釋藥曲線
a. 姜黃素標準曲線;b、c. Cur@MSN 的姜黃素釋放百分比及釋放量曲線。Cur@MSN:負載姜黃素的介孔二氧化硅納米粒復合體
2.3 體外細胞實驗結果
姜黃素的不同終濃度間髓核細胞增殖吸光度值差異無統計學意義(P>0.05),見圖3a。在正常環境條件下,隨共培養時間的增加,3 組的髓核細胞表現為持續增殖,細胞增殖吸光度值持續升高,同時各組之間的差異無統計學意義(P>0.05),見圖3b。然而在脂多糖所誘導炎癥環境中,共培養 3 d 和 5 d 的 Cur@MSN 組細胞增殖吸光度值均明顯高于對照組和姜黃素組(P<0.01),見圖3c。
 圖3
不同環境下髓核細胞增殖情況
圖3
不同環境下髓核細胞增殖情況
a. CCK-8 實驗,不同濃度姜黃素溶液與髓核細胞共培養 1 d 后的 450 nm 吸光度;b. 正常環境,3 組細胞增殖吸光度值比較差異無統計學意義;c. 脂多糖誘導下 3 組細胞增殖吸光度值比較,3 d 和 5 d 的 Cur@MSN 組細胞增殖能力和其余兩組比較差異具有統計學意義。ns 表示
2.4 影像學評估及大體病理結果
Micro-CT 及其三維重建圖像顯示,手術后針刺椎間盤明顯退化,表明椎間盤退變大鼠模型的成功構建。從各組間 DHI% 的對比中可以看出,在術后 4 周時,相比退變組和姜黃素組,Cur@MSN 組椎間盤高度的丟失量更少,最為接近正常組的椎間盤高度。MRI 圖像顯示,正常組椎間盤結構清晰,含水量豐富。相比之下,退變組的椎間盤邊界模糊,含水量低,其余 2 組的椎間盤退變程度介于二者之間。Pfirrmann 分級結果顯示,術后 4 周時正常組的椎間盤含水量在所有組中最高;與正常組相比,Cur@MSN 組的椎間盤含水量較之降低最小,其含水量顯著高于退變組。這一結果表明,Cur@MSN 對維持退變椎間盤的含水量有積極作用,可以改善局部微環境,進而促進椎間盤退變的修復。不同組椎間盤的大體形態顯示,術后 4 周,正常組椎間盤的大體結構和高度基本正常,退變組和姜黃素組髓核幾乎完全消失,而 Cur@MSN 組大部分髓核組織保留較好。各組影像學評估和大體病理結果詳見圖4。
 圖4
各組影像學評估及大體病理結果
圖4
各組影像學評估及大體病理結果
Cur@MSN:負載姜黃素的介孔二氧化硅納米粒復合體;椎間盤高度指數百分比和 Pfirrmann 分級均為術后 4 周時的數據;*表示
2.5 組織學及免疫組化評價結果
組織學切片染色圖中可見,正常組椎間盤表現正常,顯微結構髓核完整,輪廓分明;退變組與姜黃素組髓核缺失,椎間盤紊亂;Cur@MSN 組髓核更完整,椎間盤局部顯微結構接近正常組。根據先前的研究確定所有椎間盤的組織學分級,結果顯示,Cur@MSN 組的組織學評分與正常組最接近,而退變組和姜黃素組的組織學評分則顯著升高。為了探討 Cur@MSN 的治療機制,采用免疫組織化學染色技術檢測 COL-Ⅱ、MMP-13 和 TNF-α 的表達水平,在正常組和 Cur@MSN 組中,髓核區域顯示出 MMP-13、TNF-α 著色的相對缺乏和 COL-Ⅱ著色的顯著增強;相反,退變組表現出 MMP-13、TNF-α 染色的免疫反應性增強和 COL-Ⅱ的染色減少。對 COL-Ⅱ染色的定量分析顯示,正常組和 Cur@MSN 組的 COL-Ⅱ相對表達量顯著高于其他 2 組。對 MMP-13 染色的定量分析顯示,與正常組和 Cur@MSN 組相比,退變組的 MMP-13 相對表達量較之顯著升高,而姜黃素組升高不明顯。而對 TNF-α 染色的定量分析顯示,與正常組和 Cur@MSN 組相比,退變組和姜黃素組的 TNF-α 相對表達量均有升高。見圖5。
 圖5
各組的組織學及免疫組化病理結果
圖5
各組的組織學及免疫組化病理結果
Cur@MSN:負載姜黃素的介孔二氧化硅納米粒復合體;HE:蘇木精-伊紅;SO:番紅 O/固綠;COL-Ⅱ:Ⅱ型膠原;MMP-13:基質金屬蛋白酶-13;TNF-α:腫瘤壞死因子-α。ns 表示
3 討論
姜黃素是從姜黃中提取的一種天然多酚,具有廣泛的藥理作用。與用于體內促進抗炎或者再生的細胞因子相比,姜黃素具有低獲取成本、易于滲透的優勢,但受到了水溶性差和生物半衰期短的限制[23]。為了克服這些局限性,研究人員提出了諸如化學修飾、脂質體包封和納米載體遞送等策略[24]。本研究選擇了 MSN 作為載體,成功實現了對姜黃素的有效負載和緩慢釋放。在注射 Cur@MSN 后,姜黃素被逐漸釋放出來,藥物釋放曲線驗證了這一過程,這種釋放行為對于藥物遞送和持續釋放具有重要意義。在最初的 12 h 內,藥物釋放較快可以使藥物迅速達到治療濃度,迅速發揮作用。然后,隨著時間的推移,釋放速度的減緩可以使藥物持續釋放,維持治療濃度的穩定,從而實現長效治療的效果。體外藥物釋放曲線的特點表明該載藥系統對姜黃素的釋放具有可控性和穩定性,這對于藥物治療的精準調控具有重要意義。這些結果使得 MSN 成為一種潛力巨大的藥物載體,可用于制備高效、安全、可控釋放的藥物輸送系統。過去的研究中,Bai 等[25]曾對比腹腔注射與局部注射藥物對大鼠尾退變椎間盤的療效,發現腹腔注射組的全身不良反應顯著增強。本研究選擇了使用微量注射器微創注射到退變局部,避免了全身性的不良反應,同時也使藥物在椎間盤組織內形成了有效的治療濃度,明確了靶點,提高了姜黃素的生物利用率。另外,直接植入生物材料可能引發局部炎癥和免疫反應。本研究通過 CCK-8 實驗研究發現,Cur@MSN 在與大鼠髓核細胞的共培養中呈現出良好的生物相容性和一定的抗炎作用,這些結果揭示了在不同環境下的姜黃素和 Cur@MSN 對髓核細胞增殖的影響。在正常環境下,姜黃素和 Cur@MSN 對細胞增殖沒有顯著性影響,而在炎癥環境下,Cur@MSN 可以減輕細胞受炎癥抑制的程度。此外,Cur@MSN 的應用在炎癥環境中有助于提高細胞增殖的能力,這可能是由于 MSN 提供了持續的姜黃素釋放,從而在一定程度上對抗了炎癥引起的細胞抑制作用。這些結果為姜黃素在炎癥相關疾病中的應用提供了重要的理論依據。本研究在使用大鼠尾椎穿刺退變模型進一步評估 Cur@MSN 的治療效果時,發現注射 Cur@MSN 4 周后,DHI%、Pfirrmann 分級均明顯優于退變組及單純的姜黃素干預組。同時,注射 Cur@MSN 4 周后,組織學評分以及免疫組化結果與影像學評估結果基本一致,進一步驗證了 Cur@MSN 對椎間盤退變所具有的延緩、抑制和修復的作用,也初步驗證了其抑制炎癥以及減少 ECM 分解的治療機制。Ma 等[26]的研究表明,姜黃素可以下調 TNF-α 的表達,進而抑制核因子 κB 通路的激活。而已有大量研究報道,這一通路的激活與椎間盤組織 ECM 的分解密切相關,進而加速椎間盤退變的進程[27]。Hu 等[28]報道了姜黃素在椎間盤退變的治療中所起的另一作用,即姜黃素可以上調腦源性神經營養因子的轉錄水平。這一發現有助于完善姜黃素的作用機制,可以作為后續研究的方向。此外在本研究中,與未經處理的退變組相比,姜黃素組第 4 周時在 MRI、組織學評分以及部分免疫組化分析上的表現均更好,這說明單純姜黃素的干預在短時間內仍然可以起到一定延緩退變的治療效果,但缺乏載體的遞送和緩釋,導致其難以實現較為理想的療效。
本研究尚有不足之處:① Cur@MSN 的具體治療作用機制尚未被充分解析,姜黃素的具體生物學效應仍需進一步研究;② 所采用的動物模型在建立及治療期間耗時較長,且考慮到大鼠正處于生長發育階段,其生理狀態與成年人類的疾病模型之間的對應關系尚不明確;③ 由于鼠尾椎間盤并非承重結構,無法完全再現人類椎間盤所承受的力學壓力;④ 本研究未能包含對動物疼痛感知和運動功能障礙的行為學評估,這是方法學上的一個缺陷;⑤ 因種屬的不同,Cur@MSN 對人退變椎間盤的治療作用尚待進一步研究。
綜上所述,Cur@MSN 具備延緩大鼠椎間盤退變進程的潛力,并在退變椎間盤的修復與治療方面展現出積極效果。在此過程中,姜黃素發揮了關鍵作用,其抗炎特性有助于減緩椎間盤退變速度。同時,MSN 的加入優化了姜黃素的釋放,增強了其生物活性,從而提高了治療效果。Cur@MSN 的設計不僅為椎間盤退變的臨床治療提供了新的視角,而且在組織工程和再生醫學領域中,也展現了其廣泛的應用潛力。通過這種新策略,Cur@MSN 能夠在細胞水平上促進受損組織的修復,同時在分子層面上調節病理狀態,為未來的治療方法開辟了新的道路。此外,Cur@MSN 在提高椎間盤細胞的存活率和功能性方面也顯示出了顯著效果,這為椎間盤退變的治療帶來了新的希望。隨著進一步的研究和開發,Cur@MSN 有望成為一種有效的治療選項,為患者提供更好的生活質量和健康狀況。
利益沖突:所有作者聲明不存在利益沖突。