引用本文: 永佳蕙, 陶靜, 麗霞, 王凱陽, 楊毅寧. CYP2C19 基因多態性與心力衰竭患病及預后的相關性研究. 華西醫學, 2024, 39(9): 1398-1405. doi: 10.7507/1002-0179.202404197 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
心力衰竭(心衰)是一種嚴重的心臟疾病,其特征是心臟無法有效地泵血以滿足身體的需求,導致血液循環受阻和器官灌注不足。心衰是目前所有心血管領域里治療難度最大、預后最差的疾病。根據最新數據,我國心衰患者人數達 1 370 萬,35 歲及以上居民的患病率為 1.3%,住院患者的病死率高達 2.8%~4.1%[1-2]。近年來,遺傳因素在心血管疾病中的作用及其作為治療靶點的潛力引起了廣泛關注。CYP2C19 是 CYP 基因超家族中的重要亞型之一,定位于 10 號染色體,在體內編碼細胞色素 P450(CYP450)酶系[3],后者在維持心血管系統的穩態方面發揮著重要作用。它可催化幾種內源性分子的形成和/或代謝,如膽固醇、性激素和花生四烯酸等,已知這幾種代謝產物對心血管功能具有重要意義[4]。研究發現,CYP2C19 基因多態性可導致 CYP450 酶活性的改變,從而影響相關疾病的發生和發展。其中,CYP2C19*3(rs12769205 位點突變)是一個關鍵的多態性位點,它通過破壞內含子 2 中的分支位點,導致 CYP2C19 功能蛋白的異常表達[5]。
作為一種有效的研究方法,基因組關聯分析(genome association study, GAS)通過識別與特定性狀相關的基因組變異位點,有助于深入理解人類疾病和動植物遺傳的機制,并可利用單核苷酸多態性(single nucleotide polymorphism, SNP)作為標記,探索基因組與表型之間的關聯[6]。目前,國內外眾多學者利用 GAS 揭示了靜脈血栓栓塞[7]、心房顫動[8]等多個心血管疾病背后的遺傳變異位點,并證實了其致病作用。而心衰患病的遺傳病因仍有待探索。因此,本研究利用 GAS 方法深入分析了 CYP2C19 基因多態性與心衰患者的患病風險及預后之間的關系,旨在揭示 CYP2C19 基因多態性在心衰發生和發展中的作用機制,為心衰的預防和治療提供新的分子靶點。
1 對象與方法
1.1 研究對象
選取 2021 年 6 月—2022 年 12 月于新疆維吾爾自治區人民醫院心血管內科病房住院并行基因組學檢測的 1 368 例患者作為研究對象。所有研究對象均自愿入組并簽署知情同意書,并通過我院倫理委員會審批(KY2023081801)。
1.2 研究方法
1.2.1 分組
根據定義將研究對象分為缺血性心衰組和非心衰組。其中,“缺血性心衰”指:① 存在基礎的缺血性心臟疾病(如高血壓、冠心病);② 有心衰的臨床表現,如呼吸困難、乏力、體液潴留(水腫)、肺部濕性啰音等;③ 至少具有一項或一項以上心血管異常的客觀指標,如左心室射血分數(left ventricular ejection, LVEF)、腦鈉肽(brain natriuretic peptide, BNP)水平、心肌肌鈣蛋白(cardiac troponin, cTn)T、cTnI、X 線胸片和/或超聲心動圖結果等;④ 既往病例記錄確診心衰且病因明確;⑤ 并非由于嚴重感染、惡性腫瘤以及明確肝、腎原發疾病所致的心衰;⑥ 非肺栓塞引起的右心衰竭;⑦ 非糖尿病心肌病引起的心衰。“非心衰”是指無上述心衰臨床表現、無心衰病史。
剔除標準:主要為二分類性狀關聯分析的剔除標準。使用 PLINK 軟件,選取“缺血性心衰”與“非心衰”作為表型對個體與基因型數據進行質量控制,通過缺失質控將個體及 SNP 缺失>2%的值予以剔除,通過次等位基因頻率(minor allele frequency, MAF)質控將 MAP<0.05 的 SNP 予以剔除,通過 Hardy-Weinberg 平衡質控以及雜合度質控,將雜合度在 3 倍標準差以外的個體予以剔除。
1.2.2 觀察指標
收集患者的基本信息[性別,年齡,體質量指數(body mass index, BMI),是否合并高血壓、冠心病與糖尿病]和相關心功能指標[BNP、cTnI、乳酸脫氫酶(lactate dehydrogenase, LDH)、肌紅蛋白(myoglobin, Mb)、肌酸激酶(creatine kinase, CK)與肌酸激酶同工酶(creatine kinase - muscle and brain isoenzyme, CK-MB)]。其中,“高血壓”指原發性高血壓,定義為:在未使用降壓藥的情況下,非同日 3 次測量診室血壓,收縮壓≥140 mm Hg(1 mm Hg=0.133 kPa)和/或舒張壓≥90 mm Hg[9]。“冠心病”指診斷為慢性冠脈疾病與急性冠狀動脈綜合征的患者[10]。“糖尿病”指 2 型糖尿病,定義為:空腹血糖≥7.0 mmol/L 和/或糖負荷后 2 h 血糖≥11.1 mmol/L[11]。BMI 由體重與身高的平方相除得到。
1.2.3 基因分型
禁食>12 h 后采集受試者的外周靜脈血。將血液樣品抽入 5 mL 乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)管中,并以 4 000×g 離心 5 min(離心半徑 0.224 cm)以分離血漿成分。使用標準苯酚-氯仿法從外周血白細胞中提取基因組 DNA[12]。DNA 樣品在使用前儲存在?80°C 下,使用時將 DNA 稀釋至 50 ng/μL 的濃度。使用 Applied Biosystems 公司提供的 TaqMan? SNP 基因分型測定試劑進行基因分型,使用的引物和探針根據 ABI 網站上的信息選擇。使用 Applied Biosystems 7900HT 標準實時 PCR 系統進行熱循環。使用序列檢測系統(sequenced detection systems, SDS)自動化控制器軟件(v2.4)讀取平板信息。使用 2.5 μL TaqMan Universa Master Mix、0.15 μL 探針和 1.85 ddH2O 在含有 1 μL DNA 的 6 μL 最終反應體系中進行聚合酶鏈反應(polymerase chain reaction, PCR)擴增。使用 SDS 自動化控制器軟件 v2.4(ABI)讀取所有 96 孔板信息。
本研究對涉及心血管疾病用藥的 31 個關鍵藥物代謝酶基因及其 62 個 SNP 位點進行了檢測分析。這些基因包括:ABCB1、ABCC9、ACE、ACY3、ADD1、ADRB1、AGT、AGTR1、APOE、BDKRB2、CACNA1C、CES1、CYP2C19、CYP2C9、CYP2D6、CYP3A4、CYP3A5、CYP4F2、GNB3、GP1BA、ITGB3、KCNJ1、LTC4S、MTHFR、NEDD4L、PEAR1、PTGER3、PTGS1、SLCO1B1、VKORC1 和 ABCG2。每個基因都包含特定的 SNP 位點,如 CYP2C19 基因包含 rs12248560、rs12769205、rs28399504、rs3758581、rs4986893 和 rs72552267 共 6 個位點。每一個 SNP 位點包括 3 種基因型,如 CYP2C19 rs12769205 位點包含 AG、GG 與 AA 3 種基因型,與 2 種等位基因類型,如 CYP2C19 rs12769205 位點包含等位基因 A 與等位基因 G 兩種等位基因。等位基因類型是指在某個特定基因位點上,由于遺傳變異導致的不同堿基序列組成的基因變體;而基因型是指個體在特定基因位點上攜帶的一對等位基因的組合。
1.2.4 二分類性狀關聯分析
觀察比較缺血性心衰組和非心衰組患者的遺傳數據,包括 SNP 標識、染色體編碼、基因坐標、參考等位基因及基因型。個體的表型以因變量的形式表示,其中 1 代表缺血性心衰,0 代表非心衰。將遺傳變異(如 SNP)作為自變量輸入邏輯回歸模型,并在模型中納入年齡、性別等潛在混雜因素。通過計算每個 SNP 的比值比(odds ratio, OR)及其 95%置信區間(confidence interval, CI),評估這些遺傳變異與缺血性心衰患病風險的關聯強度。
1.2.5 隨訪
于缺血性心衰組患者出院后 6 個月完成 1 次有效隨訪,以探究基因多態性與心衰預后的相關性。由 2 位心血管內科的專職醫師及護士完成隨訪工作,隨訪的方式為電話隨訪或者門診隨訪。隨訪的內容包括復查的相關檢查結果、藥物依從性以及是否發生各類不良事件。研究的終點事件定義為主要不良心血管事件(major adverse cardiovascular events, MACE)的發生,MACE 定義為:非計劃性靶血管血運重建、非致死性心肌梗死、因心絞痛或心衰的非計劃性再入院、非致死性卒中及心源性死亡[13]。有效隨訪定義為患者接受電話隨訪或門診隨訪,并且其預后情況被完整記錄。
1.3 數據篩選
將數據導入 SPSS 26.0 統計軟件,將缺失值≥20%的數據剔除,缺失值<20%的數據保留,對缺失值按照多重插補進行數據補全處理。
1.4 質量控制
實驗操作由專業實驗人員完成。臨床測量數據予以雙人錄入,避免錯漏。數據錄入完畢后交由第三人進行統計分析。
1.5 統計學方法
采用 SPSS 26.0 統計軟件進行數據分析。符合正態分布的計量資料以均數±標準差表示,組件比較采用 t 檢驗;非正態分布的連續型變量以中位數(下四分位數,上四分位數)表示,組間比較采用 Mann-Whitney U 檢驗。計數資料采用頻數和百分比表示,組間比較采用χ2 檢驗或 Fisher 確切概率法。采用 PLINK 軟件、Gitbash 軟件進行數據質量控制與二分類性狀關聯分析,計算χ2 值與 OR 值;采用 Benjamini-Hochberg 方法進行 FDR 檢驗。Graphpad Prism 用于繪制柱形圖。采用多因素 logistic 回歸方法分析得出心衰患病的獨立危險因素,計算 OR 值及其 95%CI,擬合優度采用 Hosmer-Lemeshow 檢驗。采用逐步回歸方法來識別并排除可能導致多重共線性的變量。雙側檢驗水準α=0.05。
2 結果
2.1 兩組患者基線臨床特征比較
共納入患者 1 368 例,經二分類性狀關聯分析剔除 16 例,最終納入 1 352 例。其中,缺血性心衰組 169 例,非心衰組 1 183 例。兩組患者的基本信息比較見表1。可見,缺血性心衰組較非心衰組的年齡較大,合并高血壓、冠心病、糖尿病的比例增加,BNP、CK-MB 和 LDH 水平增高(P<0.05)。
2.2 兩組患者遺傳變量二分類性狀關聯分析結果
二分類性狀關聯分析結果見表2。可見,CYP2C19 rs12769205 位點為顯著性位點并與缺血性心衰的患病具有相關性。在 rs12769205 位點,患者攜帶等位基因為G的患病風險低于等位基因A(OR=0.733,P=0.023)。
2.3 兩組患者等位基因與疾病的相關性分析
rs12769205 位點的 G 等位基因在缺血性心衰組中的出現頻率為 22.78%(77/338),而在非心衰組中為 28.70%(679/2 366),兩組比較差異有統計學意義(χ2=5.141,P=0.024)。
為觀察影響 CYP2C19 rs12769205 位點不同等位基因攜帶者患心衰的影響因素,將患者的基本信息進行變量賦值(表3),多因素 logistic 回歸分析結果(表4)顯示,患者的等位基因類型、年齡、BMI 和冠心病是心衰的獨立影響因素。
2.4 缺血性心衰患者等位基因與臨床指標相關性分析
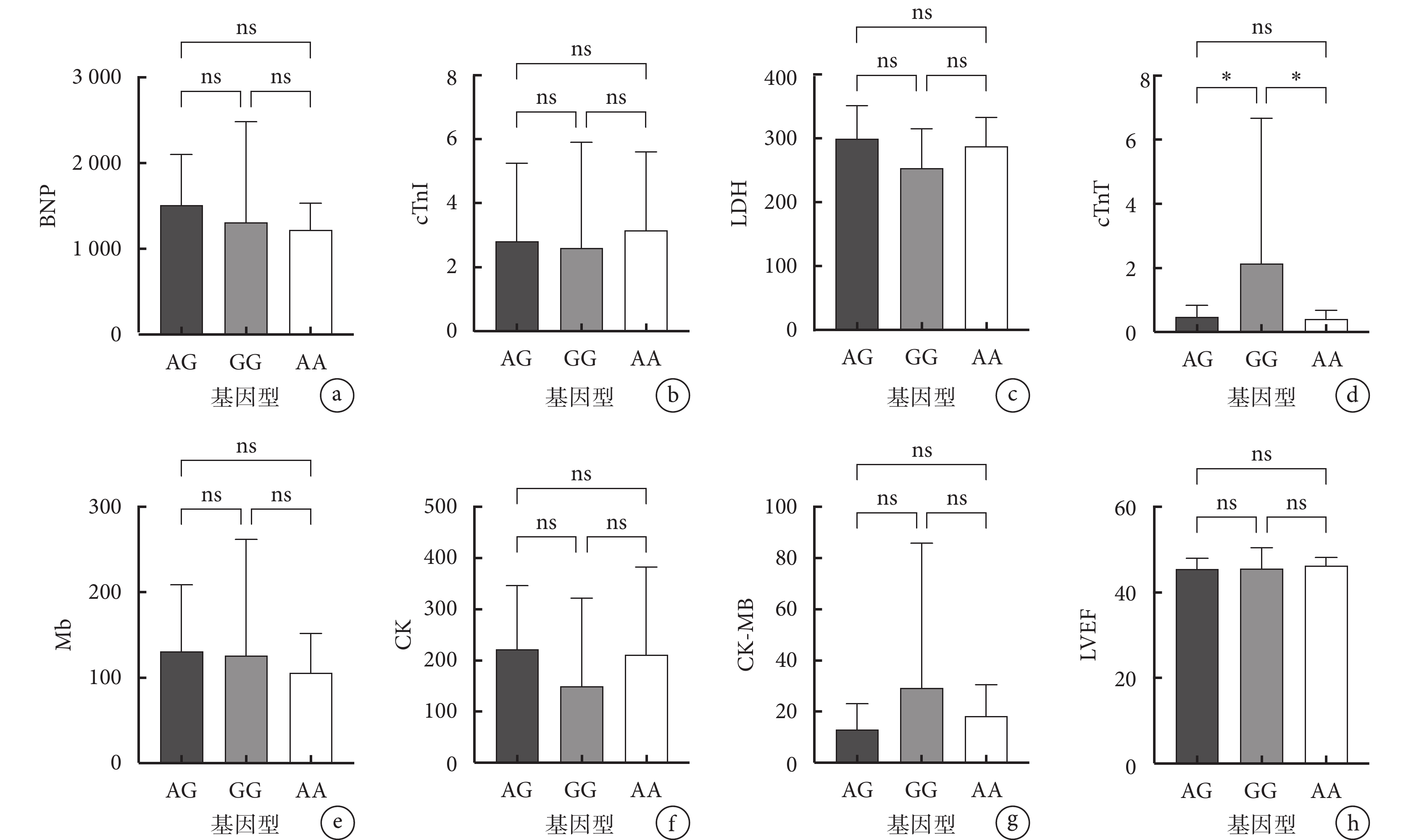
對缺血性心衰患者的等位基因與臨床指標(BNP、cTnI、LDH、cTnT、Mb、CK、CK-MB 與 LVEF)的相關性進行分析結果(圖1)顯示,在 rs12769205 多態性位點,患者等位基因攜帶數量與心功能指標水平具有相關性,2 個突變等位基因(GG)攜帶者 cTnT 水平高于 1 個突變等位基因(AG)攜帶者(P=0.044),亦高于野生型等位基因(AA)攜帶者(P=0.028)。
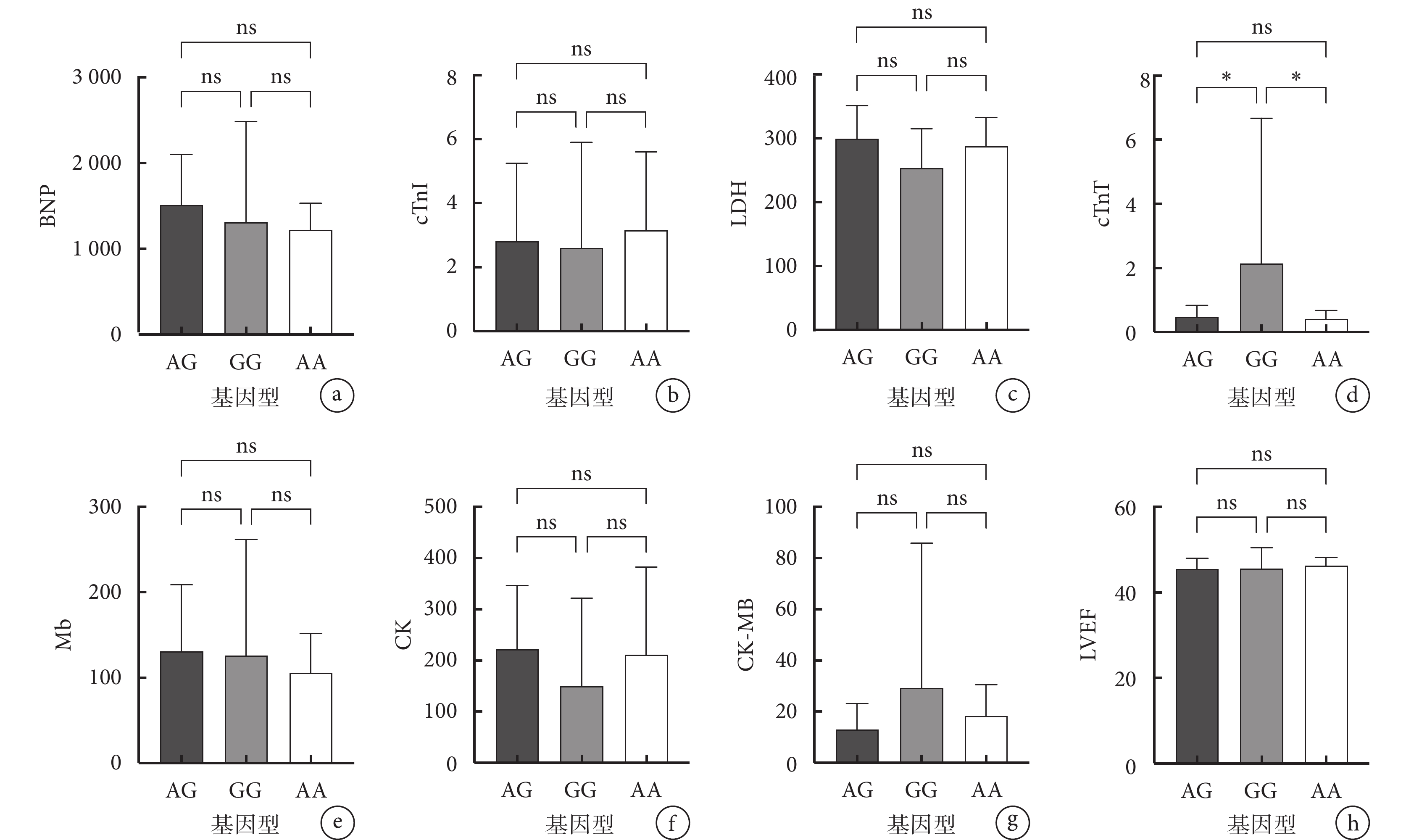 圖1
心衰患者的 rs12769205 位點等位基因攜帶情況與各臨床指標的相關性
圖1
心衰患者的 rs12769205 位點等位基因攜帶情況與各臨床指標的相關性
a. BNP 與等位基因攜帶情況的相關性;b. cTnI 與等位基因攜帶情況的相關性;c. LDH 與等位基因攜帶情況的相關性;d. cTnT 與等位基因攜帶情況的相關性;e. Mb 與等位基因攜帶情況的相關性;f. CK 與等位基因攜帶情況的相關性;g. CK-MB 與等位基因攜帶情況的相關性;h. LVEF 與等位基因攜帶情況的相關性。*
2.5 隨訪結局
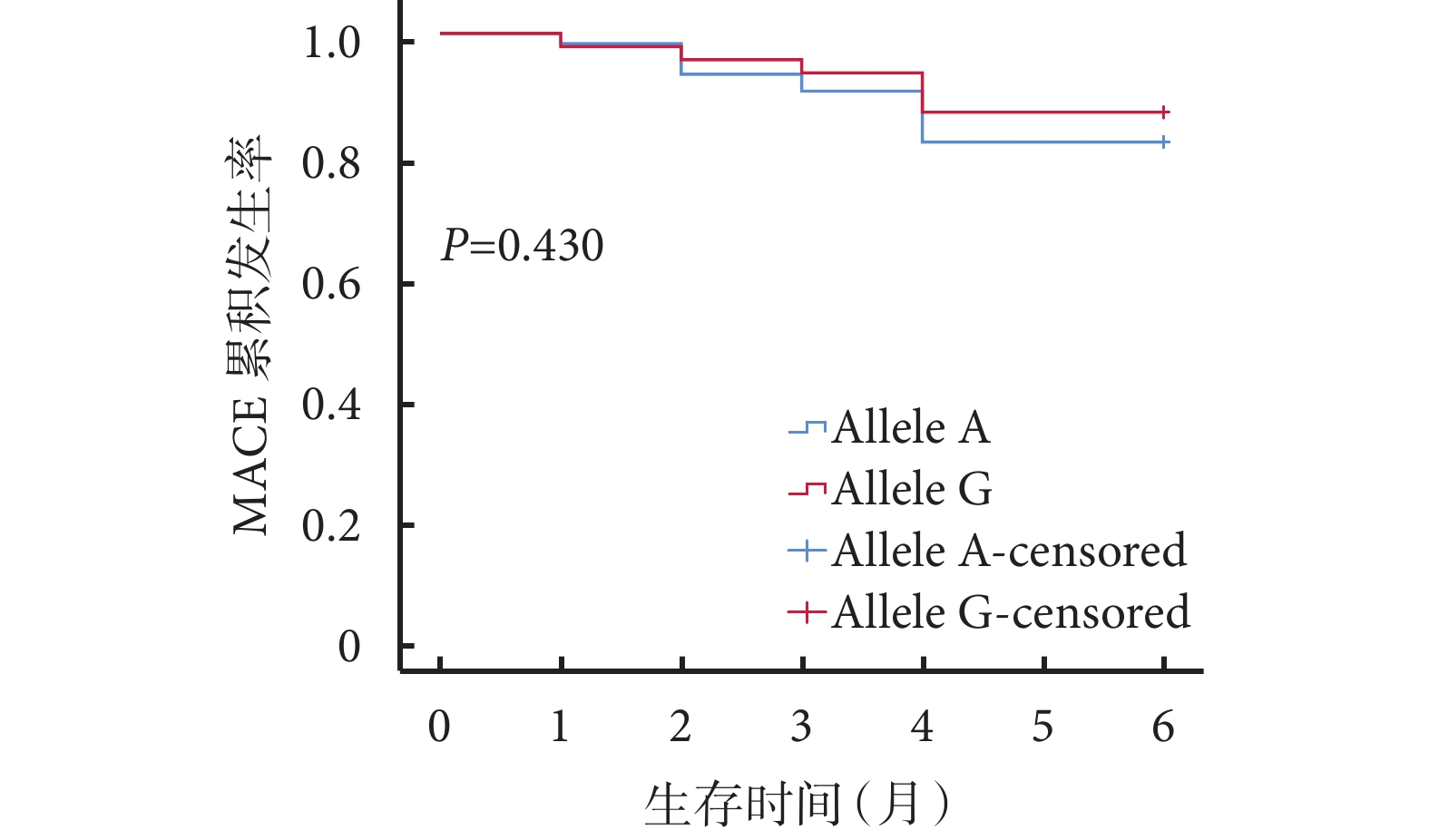
共對 169 例缺血性心衰患者在出院 6 個月后進行了隨訪,其中有效隨訪 112 例,余 57 例因聯系方式錯誤或拒絕回答而被定義為失訪。平均隨訪時間 1.63(1.00,4.00)個月。在攜帶 rs12769205 位點等位基因 A 與等位基因 G 的受試者中,分別有 84.21%(32/38)和 15.79%(6/38)發生 MACE,但 2 種等位基因類型在發生與未發生 MACE 組中的分布未顯示出統計學差異(χ2=0.632,P=0.427)。依據 rs12769205 位點等位基因類型分組,繪制隨訪期內 MACE 累積發生率的 Kaplan-Meier 生存曲線,結果顯示:攜帶 2 種等位基因的患者隨訪期內累積心血管不良事件發生率比較,差異無統計學意義(P=0.430),見圖2。
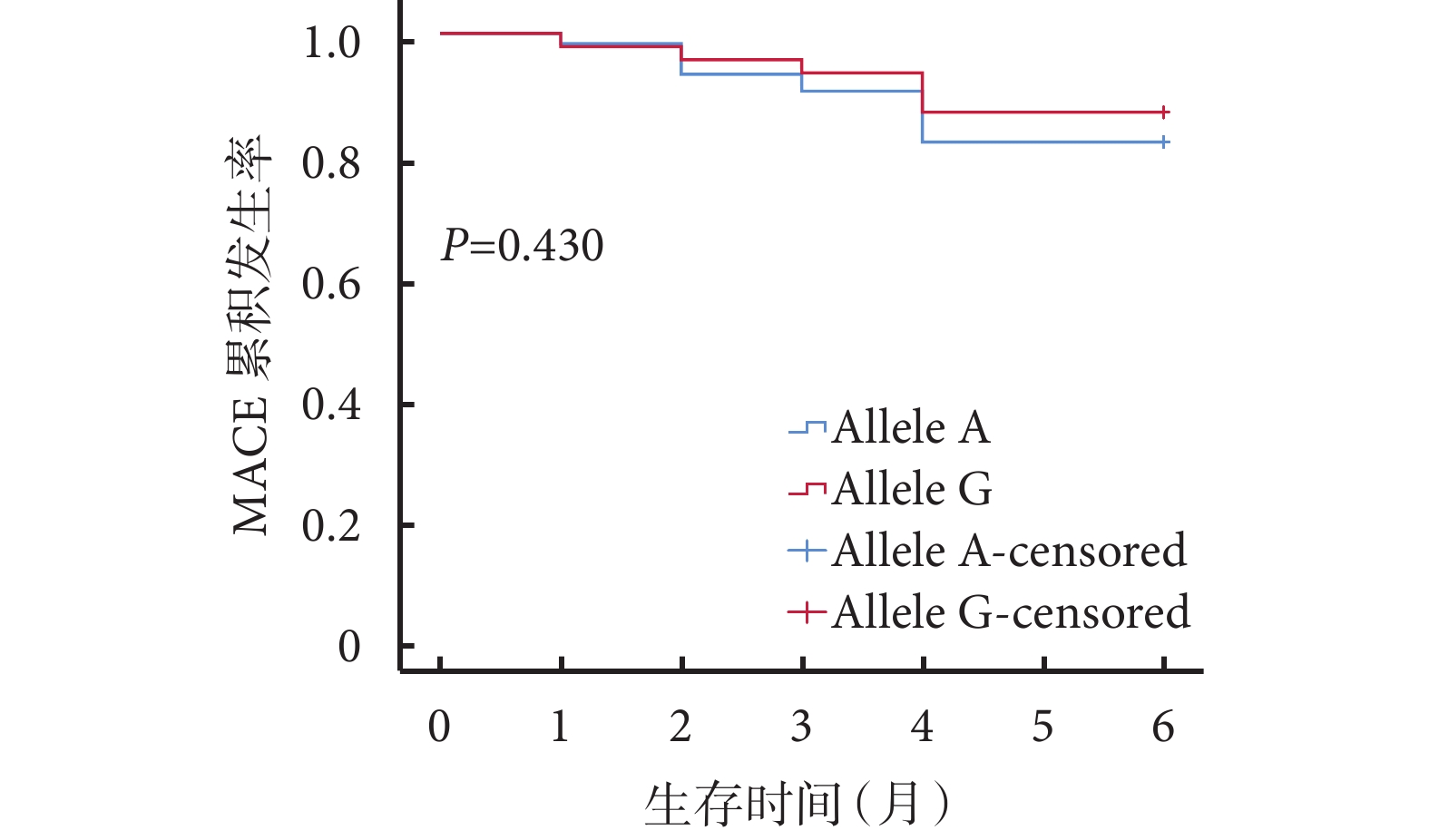 圖2
依據 rs12769205 位點等位基因類型分組繪制的 MACE 累計發生率的 Kaplan-Meier 曲線
圖2
依據 rs12769205 位點等位基因類型分組繪制的 MACE 累計發生率的 Kaplan-Meier 曲線
MACE:主要不良心血管事件;Allele:等位基因;censored:檢剔后
3 討論
近年,GAS 作為確定疾病相關基因、易感區域或疾病的標志物,從而探究復雜疾病遺傳機制的方法得到迅速發展,已發現系列心血管疾病相關基因和變異位點。本研究前期采集了心血管疾病患者的外周血樣本用于藥物基因組學檢測,但在分析數據的過程中,利用基因組分析的方法(二分類性狀關聯分析),發現 CYP2C19 編碼的 CYP450 酶系這一藥物代謝酶與心衰患病具有相關性。既往研究多集中于探討 CYP450 酶系作為藥物代謝酶的關鍵作用,卻很少關注 CYP450 酶系及其代謝產物在心血管疾病發生發展中的重要作用。CYP450 酶系在體內主要參與花生四烯酸的代謝,作為花生四烯酸在體內的主要代謝酶之一,CYP 酶將花生四烯酸分別經 CYP 環氧合酶和 CYP 羥化酶代謝為活性產物環氧二十碳三烯酸(epoxyeicosatrienoic acids, EET)和無活性產物羥基二十碳四烯酸(hydroxyeicosatetraenoic acids, HETE)[14-15]。研究發現,花生四烯酸、EET、HETE等均在心血管疾病的發生發展中具有重要意義[5, 16-17]。因此,本研究以此為開頭,近一步探討了 CYP2C19 rs12769205 多態性位點與心衰患病的相關性。本研究結果顯示,CYP2C19 rs12769205 多態性位點與缺血性心衰的患病具有相關性,且心衰組患者多攜帶野生型等位基因且等位基因類型為心衰患病的獨立影響因素。此外,在 rs12769205 多態性位點,患者突變等位基因的攜帶數量與心功能指標 cTnT 水平相關。但對心衰患者的隨訪結果顯示,暫未發現 rs12769205 位點的等位基因類型與患者不良預后具有相關性。
本研究通過比較 rs12769205 多態性位點的等位基因在缺血性心衰和非心衰患者間的分布發現,相比非心衰組,缺血性心衰組患者 rs12769205 位點的 G 等位基因出現的頻率減低,這表明缺血性心衰組患者多攜帶野生型等位基因,結合二分類性狀分析結果,可考慮此突變位點為保護性突變,這與既往研究結果相符。有研究對 CYP2C19 多態性位點基因突變的意義進行了探討,結果發現 CYP2C19 非功能等位基因在人類進化過程中被積極選擇并顯示出顯著的生存優勢[18]。此外,野生型等位基因代表 CYP2C19 所編碼酶系處于相對正常或高活性狀態,這將導致下游代謝產物 EET 與 DHET 的產生增加[15, 18]。有研究對心衰患者外周血內 EET 含量進行測定后發現,心衰患者體內 EET 含量增加,但 EET 的進一步代謝酶 sEH 的活性亦增高,這導致無活性代謝產物 DHET 的含量增加,且 EET/DHET 比值減低,從而導致 EET 這一微血管舒張劑未能在心血管系統中發揮有益作用[19-21]。
此外,本研究利用多因素 logistic 回歸分析發現,年齡、冠心病、等位基因類型及 BMI 是心衰的獨立影響因素(P<0.05)。有研究指出,冠心病、高血壓已成為心衰的最主要病因。冠狀動脈疾病導致缺血性心肌損害,而心衰始于心肌損傷,隨著病變的進展出現心肌病理性重塑,進而出現左心室擴大和/或肥大。起初,以腎素-血管緊張素系統、抗利尿激素激活和交感神經興奮為主的代償機制尚能維持心臟正常輸出,但這些神經體液機制最終將導致直接細胞毒性,致使心泵衰竭[22]。流行病學調查顯示,隨著年齡增長,心衰患病率迅速增加,70 歲以上人群患病率上升至 10%以上[23]。研究發現,衰老動物模型出現心室重塑、舒張功能障礙、間質纖維化的表現[24],這提示年齡可能是心功能不全的獨立影響因素。此外,BMI 也是心衰的獨立危險因素。一項對弗雷明漢心臟研究參與者的分析顯示,超重和肥胖患者相比 BMI 正常者,心衰風險分別增加 34%和 104%[25]。研究指出,血液動力學超負荷、神經激素激活和氧化應激引起的心室重塑可能是肥胖與慢性心衰相關的機制[26]。
cTn 是心肌收縮中起調控作用的蛋白,包括 cTnT、cTnI 和 cTnC。當心肌受損時,心肌細胞胞膜的完整性遭到破壞,游離和結合部分的 cTnT 相繼釋放入血,導致 cTnT 的血液濃度升高。研究指出,發生心衰時,心臟壓力和容量負荷增加,由紡錘體組成的心肌纖維束被動拉長、易位和溶解,導致心肌細胞膜損傷,進而出現肌鈣蛋白水平的升高[27]。研究指出,在應激、缺血、缺氧等病理條件下,細胞膜磷脂可釋放大量的花生四烯酸,從而導致多種有害后果,包括異常的興奮-收縮耦合、細胞凋亡等,從而出現心臟功能障礙,甚至心衰的發生,表現為肌鈣蛋白、肌酸激酶同工酶、乳酸脫氫酶的升高等[28]。而低劑量氯化釓則可消除過量的花生四烯酸的毒性作用,改善心肌活性[29]。本研究發現心衰患者的 CYP2C19 rs12769205 位點突變基因攜帶數與 cTnT 呈相關性,可推測,心衰患者體內 rs12769205 位點的等位基因突變導致 CYP450 酶活性的減低,這可能導致花生四烯酸的代謝困難,進而出現病變發展過程中心肌酶升高的表現。此外,亦不排除隊列中合并急性冠狀動脈綜合征的患者出現心肌損傷導致的心肌酶升高表現。
目前,基因組測序結果除了用于心血管疾病的患病風險預測外,還可用于對疾病預后的評估[30]。如多基因風險評分在冠狀動脈病變等疾病的預后評估(如心血管不良事件的發生率)中顯示出良好效果[31]。而本研究旨在探討 CYP2C19 多態性位點與心衰患病的相關性,因此,本研究暫時只對心衰組患者進行了隨訪,以評估患者攜帶的等位基因類型與心衰患者出現 MACE 的相關性;研究結果顯示,暫未發現 CYP2C19 rs12769205 位點的等位基因類型與心衰患者出現 MACE 具有相關性。因此,可考慮缺血性心衰組納入研究的患者例數較少且其中完成隨訪的患者例數亦較少,這可能是暫未發現有意義的研究結果的原因之一。
本研究存在一些局限性。一方面,本研究的研究例數較少,僅局限于同一家醫院。未來的研究應包括來自其他地區、更大樣本量的研究,以進一步驗證 CYP2C19 基因多態性與心衰患病的相關性。另一方面,本研究雖然通過隨訪評估了 CYP2C19 基因多態性與心衰預后的相關性,但隨訪率較低,接下來有待繼續補充隨訪或延長隨訪時間,以探究遺傳因素在心衰患者心血管不良預后中發揮的作用。此外,本研究尚未能從基因功能層面進行研究,并進一步闡述基因多態性影響心衰發生、發展的機制,這是該研究的另一處局限。對于心衰這一多數嚴重心血管疾病的最終“戰場”,除遺傳因素外,共病、用藥、環境等多個因素都在疾病進展中起到重要作用,而遺傳因素解釋能力有限,需要結合多層面、多組學研究以深入探討心衰發病與預后的影響因素。
綜上,CYP2C19 基因多態性與缺血性心衰的患病具有相關性,其中 rs12769205 位點基因突變是心衰患病的獨立影響因素,但該位點等位基因類型與患者的預后無相關性。
作者貢獻:永佳蕙:研究設計、數據收集與整理、數據分析、論文撰寫;陶靜,麗霞:數據收集、數據處理;王凱陽:數據分析;楊毅寧:研究指導、論文修改
志謝:感謝新疆維吾爾自治區科技廳及新疆維吾爾自治區人民醫院對本研究的資金支持。
利益沖突:所有作者聲明不存在利益沖突。
心力衰竭(心衰)是一種嚴重的心臟疾病,其特征是心臟無法有效地泵血以滿足身體的需求,導致血液循環受阻和器官灌注不足。心衰是目前所有心血管領域里治療難度最大、預后最差的疾病。根據最新數據,我國心衰患者人數達 1 370 萬,35 歲及以上居民的患病率為 1.3%,住院患者的病死率高達 2.8%~4.1%[1-2]。近年來,遺傳因素在心血管疾病中的作用及其作為治療靶點的潛力引起了廣泛關注。CYP2C19 是 CYP 基因超家族中的重要亞型之一,定位于 10 號染色體,在體內編碼細胞色素 P450(CYP450)酶系[3],后者在維持心血管系統的穩態方面發揮著重要作用。它可催化幾種內源性分子的形成和/或代謝,如膽固醇、性激素和花生四烯酸等,已知這幾種代謝產物對心血管功能具有重要意義[4]。研究發現,CYP2C19 基因多態性可導致 CYP450 酶活性的改變,從而影響相關疾病的發生和發展。其中,CYP2C19*3(rs12769205 位點突變)是一個關鍵的多態性位點,它通過破壞內含子 2 中的分支位點,導致 CYP2C19 功能蛋白的異常表達[5]。
作為一種有效的研究方法,基因組關聯分析(genome association study, GAS)通過識別與特定性狀相關的基因組變異位點,有助于深入理解人類疾病和動植物遺傳的機制,并可利用單核苷酸多態性(single nucleotide polymorphism, SNP)作為標記,探索基因組與表型之間的關聯[6]。目前,國內外眾多學者利用 GAS 揭示了靜脈血栓栓塞[7]、心房顫動[8]等多個心血管疾病背后的遺傳變異位點,并證實了其致病作用。而心衰患病的遺傳病因仍有待探索。因此,本研究利用 GAS 方法深入分析了 CYP2C19 基因多態性與心衰患者的患病風險及預后之間的關系,旨在揭示 CYP2C19 基因多態性在心衰發生和發展中的作用機制,為心衰的預防和治療提供新的分子靶點。
1 對象與方法
1.1 研究對象
選取 2021 年 6 月—2022 年 12 月于新疆維吾爾自治區人民醫院心血管內科病房住院并行基因組學檢測的 1 368 例患者作為研究對象。所有研究對象均自愿入組并簽署知情同意書,并通過我院倫理委員會審批(KY2023081801)。
1.2 研究方法
1.2.1 分組
根據定義將研究對象分為缺血性心衰組和非心衰組。其中,“缺血性心衰”指:① 存在基礎的缺血性心臟疾病(如高血壓、冠心病);② 有心衰的臨床表現,如呼吸困難、乏力、體液潴留(水腫)、肺部濕性啰音等;③ 至少具有一項或一項以上心血管異常的客觀指標,如左心室射血分數(left ventricular ejection, LVEF)、腦鈉肽(brain natriuretic peptide, BNP)水平、心肌肌鈣蛋白(cardiac troponin, cTn)T、cTnI、X 線胸片和/或超聲心動圖結果等;④ 既往病例記錄確診心衰且病因明確;⑤ 并非由于嚴重感染、惡性腫瘤以及明確肝、腎原發疾病所致的心衰;⑥ 非肺栓塞引起的右心衰竭;⑦ 非糖尿病心肌病引起的心衰。“非心衰”是指無上述心衰臨床表現、無心衰病史。
剔除標準:主要為二分類性狀關聯分析的剔除標準。使用 PLINK 軟件,選取“缺血性心衰”與“非心衰”作為表型對個體與基因型數據進行質量控制,通過缺失質控將個體及 SNP 缺失>2%的值予以剔除,通過次等位基因頻率(minor allele frequency, MAF)質控將 MAP<0.05 的 SNP 予以剔除,通過 Hardy-Weinberg 平衡質控以及雜合度質控,將雜合度在 3 倍標準差以外的個體予以剔除。
1.2.2 觀察指標
收集患者的基本信息[性別,年齡,體質量指數(body mass index, BMI),是否合并高血壓、冠心病與糖尿病]和相關心功能指標[BNP、cTnI、乳酸脫氫酶(lactate dehydrogenase, LDH)、肌紅蛋白(myoglobin, Mb)、肌酸激酶(creatine kinase, CK)與肌酸激酶同工酶(creatine kinase - muscle and brain isoenzyme, CK-MB)]。其中,“高血壓”指原發性高血壓,定義為:在未使用降壓藥的情況下,非同日 3 次測量診室血壓,收縮壓≥140 mm Hg(1 mm Hg=0.133 kPa)和/或舒張壓≥90 mm Hg[9]。“冠心病”指診斷為慢性冠脈疾病與急性冠狀動脈綜合征的患者[10]。“糖尿病”指 2 型糖尿病,定義為:空腹血糖≥7.0 mmol/L 和/或糖負荷后 2 h 血糖≥11.1 mmol/L[11]。BMI 由體重與身高的平方相除得到。
1.2.3 基因分型
禁食>12 h 后采集受試者的外周靜脈血。將血液樣品抽入 5 mL 乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)管中,并以 4 000×g 離心 5 min(離心半徑 0.224 cm)以分離血漿成分。使用標準苯酚-氯仿法從外周血白細胞中提取基因組 DNA[12]。DNA 樣品在使用前儲存在?80°C 下,使用時將 DNA 稀釋至 50 ng/μL 的濃度。使用 Applied Biosystems 公司提供的 TaqMan? SNP 基因分型測定試劑進行基因分型,使用的引物和探針根據 ABI 網站上的信息選擇。使用 Applied Biosystems 7900HT 標準實時 PCR 系統進行熱循環。使用序列檢測系統(sequenced detection systems, SDS)自動化控制器軟件(v2.4)讀取平板信息。使用 2.5 μL TaqMan Universa Master Mix、0.15 μL 探針和 1.85 ddH2O 在含有 1 μL DNA 的 6 μL 最終反應體系中進行聚合酶鏈反應(polymerase chain reaction, PCR)擴增。使用 SDS 自動化控制器軟件 v2.4(ABI)讀取所有 96 孔板信息。
本研究對涉及心血管疾病用藥的 31 個關鍵藥物代謝酶基因及其 62 個 SNP 位點進行了檢測分析。這些基因包括:ABCB1、ABCC9、ACE、ACY3、ADD1、ADRB1、AGT、AGTR1、APOE、BDKRB2、CACNA1C、CES1、CYP2C19、CYP2C9、CYP2D6、CYP3A4、CYP3A5、CYP4F2、GNB3、GP1BA、ITGB3、KCNJ1、LTC4S、MTHFR、NEDD4L、PEAR1、PTGER3、PTGS1、SLCO1B1、VKORC1 和 ABCG2。每個基因都包含特定的 SNP 位點,如 CYP2C19 基因包含 rs12248560、rs12769205、rs28399504、rs3758581、rs4986893 和 rs72552267 共 6 個位點。每一個 SNP 位點包括 3 種基因型,如 CYP2C19 rs12769205 位點包含 AG、GG 與 AA 3 種基因型,與 2 種等位基因類型,如 CYP2C19 rs12769205 位點包含等位基因 A 與等位基因 G 兩種等位基因。等位基因類型是指在某個特定基因位點上,由于遺傳變異導致的不同堿基序列組成的基因變體;而基因型是指個體在特定基因位點上攜帶的一對等位基因的組合。
1.2.4 二分類性狀關聯分析
觀察比較缺血性心衰組和非心衰組患者的遺傳數據,包括 SNP 標識、染色體編碼、基因坐標、參考等位基因及基因型。個體的表型以因變量的形式表示,其中 1 代表缺血性心衰,0 代表非心衰。將遺傳變異(如 SNP)作為自變量輸入邏輯回歸模型,并在模型中納入年齡、性別等潛在混雜因素。通過計算每個 SNP 的比值比(odds ratio, OR)及其 95%置信區間(confidence interval, CI),評估這些遺傳變異與缺血性心衰患病風險的關聯強度。
1.2.5 隨訪
于缺血性心衰組患者出院后 6 個月完成 1 次有效隨訪,以探究基因多態性與心衰預后的相關性。由 2 位心血管內科的專職醫師及護士完成隨訪工作,隨訪的方式為電話隨訪或者門診隨訪。隨訪的內容包括復查的相關檢查結果、藥物依從性以及是否發生各類不良事件。研究的終點事件定義為主要不良心血管事件(major adverse cardiovascular events, MACE)的發生,MACE 定義為:非計劃性靶血管血運重建、非致死性心肌梗死、因心絞痛或心衰的非計劃性再入院、非致死性卒中及心源性死亡[13]。有效隨訪定義為患者接受電話隨訪或門診隨訪,并且其預后情況被完整記錄。
1.3 數據篩選
將數據導入 SPSS 26.0 統計軟件,將缺失值≥20%的數據剔除,缺失值<20%的數據保留,對缺失值按照多重插補進行數據補全處理。
1.4 質量控制
實驗操作由專業實驗人員完成。臨床測量數據予以雙人錄入,避免錯漏。數據錄入完畢后交由第三人進行統計分析。
1.5 統計學方法
采用 SPSS 26.0 統計軟件進行數據分析。符合正態分布的計量資料以均數±標準差表示,組件比較采用 t 檢驗;非正態分布的連續型變量以中位數(下四分位數,上四分位數)表示,組間比較采用 Mann-Whitney U 檢驗。計數資料采用頻數和百分比表示,組間比較采用χ2 檢驗或 Fisher 確切概率法。采用 PLINK 軟件、Gitbash 軟件進行數據質量控制與二分類性狀關聯分析,計算χ2 值與 OR 值;采用 Benjamini-Hochberg 方法進行 FDR 檢驗。Graphpad Prism 用于繪制柱形圖。采用多因素 logistic 回歸方法分析得出心衰患病的獨立危險因素,計算 OR 值及其 95%CI,擬合優度采用 Hosmer-Lemeshow 檢驗。采用逐步回歸方法來識別并排除可能導致多重共線性的變量。雙側檢驗水準α=0.05。
2 結果
2.1 兩組患者基線臨床特征比較
共納入患者 1 368 例,經二分類性狀關聯分析剔除 16 例,最終納入 1 352 例。其中,缺血性心衰組 169 例,非心衰組 1 183 例。兩組患者的基本信息比較見表1。可見,缺血性心衰組較非心衰組的年齡較大,合并高血壓、冠心病、糖尿病的比例增加,BNP、CK-MB 和 LDH 水平增高(P<0.05)。
2.2 兩組患者遺傳變量二分類性狀關聯分析結果
二分類性狀關聯分析結果見表2。可見,CYP2C19 rs12769205 位點為顯著性位點并與缺血性心衰的患病具有相關性。在 rs12769205 位點,患者攜帶等位基因為G的患病風險低于等位基因A(OR=0.733,P=0.023)。
2.3 兩組患者等位基因與疾病的相關性分析
rs12769205 位點的 G 等位基因在缺血性心衰組中的出現頻率為 22.78%(77/338),而在非心衰組中為 28.70%(679/2 366),兩組比較差異有統計學意義(χ2=5.141,P=0.024)。
為觀察影響 CYP2C19 rs12769205 位點不同等位基因攜帶者患心衰的影響因素,將患者的基本信息進行變量賦值(表3),多因素 logistic 回歸分析結果(表4)顯示,患者的等位基因類型、年齡、BMI 和冠心病是心衰的獨立影響因素。
2.4 缺血性心衰患者等位基因與臨床指標相關性分析
對缺血性心衰患者的等位基因與臨床指標(BNP、cTnI、LDH、cTnT、Mb、CK、CK-MB 與 LVEF)的相關性進行分析結果(圖1)顯示,在 rs12769205 多態性位點,患者等位基因攜帶數量與心功能指標水平具有相關性,2 個突變等位基因(GG)攜帶者 cTnT 水平高于 1 個突變等位基因(AG)攜帶者(P=0.044),亦高于野生型等位基因(AA)攜帶者(P=0.028)。
 圖1
心衰患者的 rs12769205 位點等位基因攜帶情況與各臨床指標的相關性
圖1
心衰患者的 rs12769205 位點等位基因攜帶情況與各臨床指標的相關性
a. BNP 與等位基因攜帶情況的相關性;b. cTnI 與等位基因攜帶情況的相關性;c. LDH 與等位基因攜帶情況的相關性;d. cTnT 與等位基因攜帶情況的相關性;e. Mb 與等位基因攜帶情況的相關性;f. CK 與等位基因攜帶情況的相關性;g. CK-MB 與等位基因攜帶情況的相關性;h. LVEF 與等位基因攜帶情況的相關性。*
2.5 隨訪結局
共對 169 例缺血性心衰患者在出院 6 個月后進行了隨訪,其中有效隨訪 112 例,余 57 例因聯系方式錯誤或拒絕回答而被定義為失訪。平均隨訪時間 1.63(1.00,4.00)個月。在攜帶 rs12769205 位點等位基因 A 與等位基因 G 的受試者中,分別有 84.21%(32/38)和 15.79%(6/38)發生 MACE,但 2 種等位基因類型在發生與未發生 MACE 組中的分布未顯示出統計學差異(χ2=0.632,P=0.427)。依據 rs12769205 位點等位基因類型分組,繪制隨訪期內 MACE 累積發生率的 Kaplan-Meier 生存曲線,結果顯示:攜帶 2 種等位基因的患者隨訪期內累積心血管不良事件發生率比較,差異無統計學意義(P=0.430),見圖2。
 圖2
依據 rs12769205 位點等位基因類型分組繪制的 MACE 累計發生率的 Kaplan-Meier 曲線
圖2
依據 rs12769205 位點等位基因類型分組繪制的 MACE 累計發生率的 Kaplan-Meier 曲線
MACE:主要不良心血管事件;Allele:等位基因;censored:檢剔后
3 討論
近年,GAS 作為確定疾病相關基因、易感區域或疾病的標志物,從而探究復雜疾病遺傳機制的方法得到迅速發展,已發現系列心血管疾病相關基因和變異位點。本研究前期采集了心血管疾病患者的外周血樣本用于藥物基因組學檢測,但在分析數據的過程中,利用基因組分析的方法(二分類性狀關聯分析),發現 CYP2C19 編碼的 CYP450 酶系這一藥物代謝酶與心衰患病具有相關性。既往研究多集中于探討 CYP450 酶系作為藥物代謝酶的關鍵作用,卻很少關注 CYP450 酶系及其代謝產物在心血管疾病發生發展中的重要作用。CYP450 酶系在體內主要參與花生四烯酸的代謝,作為花生四烯酸在體內的主要代謝酶之一,CYP 酶將花生四烯酸分別經 CYP 環氧合酶和 CYP 羥化酶代謝為活性產物環氧二十碳三烯酸(epoxyeicosatrienoic acids, EET)和無活性產物羥基二十碳四烯酸(hydroxyeicosatetraenoic acids, HETE)[14-15]。研究發現,花生四烯酸、EET、HETE等均在心血管疾病的發生發展中具有重要意義[5, 16-17]。因此,本研究以此為開頭,近一步探討了 CYP2C19 rs12769205 多態性位點與心衰患病的相關性。本研究結果顯示,CYP2C19 rs12769205 多態性位點與缺血性心衰的患病具有相關性,且心衰組患者多攜帶野生型等位基因且等位基因類型為心衰患病的獨立影響因素。此外,在 rs12769205 多態性位點,患者突變等位基因的攜帶數量與心功能指標 cTnT 水平相關。但對心衰患者的隨訪結果顯示,暫未發現 rs12769205 位點的等位基因類型與患者不良預后具有相關性。
本研究通過比較 rs12769205 多態性位點的等位基因在缺血性心衰和非心衰患者間的分布發現,相比非心衰組,缺血性心衰組患者 rs12769205 位點的 G 等位基因出現的頻率減低,這表明缺血性心衰組患者多攜帶野生型等位基因,結合二分類性狀分析結果,可考慮此突變位點為保護性突變,這與既往研究結果相符。有研究對 CYP2C19 多態性位點基因突變的意義進行了探討,結果發現 CYP2C19 非功能等位基因在人類進化過程中被積極選擇并顯示出顯著的生存優勢[18]。此外,野生型等位基因代表 CYP2C19 所編碼酶系處于相對正常或高活性狀態,這將導致下游代謝產物 EET 與 DHET 的產生增加[15, 18]。有研究對心衰患者外周血內 EET 含量進行測定后發現,心衰患者體內 EET 含量增加,但 EET 的進一步代謝酶 sEH 的活性亦增高,這導致無活性代謝產物 DHET 的含量增加,且 EET/DHET 比值減低,從而導致 EET 這一微血管舒張劑未能在心血管系統中發揮有益作用[19-21]。
此外,本研究利用多因素 logistic 回歸分析發現,年齡、冠心病、等位基因類型及 BMI 是心衰的獨立影響因素(P<0.05)。有研究指出,冠心病、高血壓已成為心衰的最主要病因。冠狀動脈疾病導致缺血性心肌損害,而心衰始于心肌損傷,隨著病變的進展出現心肌病理性重塑,進而出現左心室擴大和/或肥大。起初,以腎素-血管緊張素系統、抗利尿激素激活和交感神經興奮為主的代償機制尚能維持心臟正常輸出,但這些神經體液機制最終將導致直接細胞毒性,致使心泵衰竭[22]。流行病學調查顯示,隨著年齡增長,心衰患病率迅速增加,70 歲以上人群患病率上升至 10%以上[23]。研究發現,衰老動物模型出現心室重塑、舒張功能障礙、間質纖維化的表現[24],這提示年齡可能是心功能不全的獨立影響因素。此外,BMI 也是心衰的獨立危險因素。一項對弗雷明漢心臟研究參與者的分析顯示,超重和肥胖患者相比 BMI 正常者,心衰風險分別增加 34%和 104%[25]。研究指出,血液動力學超負荷、神經激素激活和氧化應激引起的心室重塑可能是肥胖與慢性心衰相關的機制[26]。
cTn 是心肌收縮中起調控作用的蛋白,包括 cTnT、cTnI 和 cTnC。當心肌受損時,心肌細胞胞膜的完整性遭到破壞,游離和結合部分的 cTnT 相繼釋放入血,導致 cTnT 的血液濃度升高。研究指出,發生心衰時,心臟壓力和容量負荷增加,由紡錘體組成的心肌纖維束被動拉長、易位和溶解,導致心肌細胞膜損傷,進而出現肌鈣蛋白水平的升高[27]。研究指出,在應激、缺血、缺氧等病理條件下,細胞膜磷脂可釋放大量的花生四烯酸,從而導致多種有害后果,包括異常的興奮-收縮耦合、細胞凋亡等,從而出現心臟功能障礙,甚至心衰的發生,表現為肌鈣蛋白、肌酸激酶同工酶、乳酸脫氫酶的升高等[28]。而低劑量氯化釓則可消除過量的花生四烯酸的毒性作用,改善心肌活性[29]。本研究發現心衰患者的 CYP2C19 rs12769205 位點突變基因攜帶數與 cTnT 呈相關性,可推測,心衰患者體內 rs12769205 位點的等位基因突變導致 CYP450 酶活性的減低,這可能導致花生四烯酸的代謝困難,進而出現病變發展過程中心肌酶升高的表現。此外,亦不排除隊列中合并急性冠狀動脈綜合征的患者出現心肌損傷導致的心肌酶升高表現。
目前,基因組測序結果除了用于心血管疾病的患病風險預測外,還可用于對疾病預后的評估[30]。如多基因風險評分在冠狀動脈病變等疾病的預后評估(如心血管不良事件的發生率)中顯示出良好效果[31]。而本研究旨在探討 CYP2C19 多態性位點與心衰患病的相關性,因此,本研究暫時只對心衰組患者進行了隨訪,以評估患者攜帶的等位基因類型與心衰患者出現 MACE 的相關性;研究結果顯示,暫未發現 CYP2C19 rs12769205 位點的等位基因類型與心衰患者出現 MACE 具有相關性。因此,可考慮缺血性心衰組納入研究的患者例數較少且其中完成隨訪的患者例數亦較少,這可能是暫未發現有意義的研究結果的原因之一。
本研究存在一些局限性。一方面,本研究的研究例數較少,僅局限于同一家醫院。未來的研究應包括來自其他地區、更大樣本量的研究,以進一步驗證 CYP2C19 基因多態性與心衰患病的相關性。另一方面,本研究雖然通過隨訪評估了 CYP2C19 基因多態性與心衰預后的相關性,但隨訪率較低,接下來有待繼續補充隨訪或延長隨訪時間,以探究遺傳因素在心衰患者心血管不良預后中發揮的作用。此外,本研究尚未能從基因功能層面進行研究,并進一步闡述基因多態性影響心衰發生、發展的機制,這是該研究的另一處局限。對于心衰這一多數嚴重心血管疾病的最終“戰場”,除遺傳因素外,共病、用藥、環境等多個因素都在疾病進展中起到重要作用,而遺傳因素解釋能力有限,需要結合多層面、多組學研究以深入探討心衰發病與預后的影響因素。
綜上,CYP2C19 基因多態性與缺血性心衰的患病具有相關性,其中 rs12769205 位點基因突變是心衰患病的獨立影響因素,但該位點等位基因類型與患者的預后無相關性。
作者貢獻:永佳蕙:研究設計、數據收集與整理、數據分析、論文撰寫;陶靜,麗霞:數據收集、數據處理;王凱陽:數據分析;楊毅寧:研究指導、論文修改
志謝:感謝新疆維吾爾自治區科技廳及新疆維吾爾自治區人民醫院對本研究的資金支持。
利益沖突:所有作者聲明不存在利益沖突。