引用本文: 孫瑞龍, 李云飛, 田永正, 樊博. 新型多功能骨水泥治療骨腫瘤的研究進展. 中國修復重建外科雜志, 2023, 37(11): 1444-1450. doi: 10.7507/1002-1892.202308019 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
原發性骨腫瘤是臨床中常見的惡性腫瘤,在兒童中發病率高、預后差,具有局部破壞性和高度轉移性特點[1]。同時骨骼也是惡性腫瘤常見轉移部位[2],骨腫瘤或惡性腫瘤骨轉移常造成骨缺損,植入優良的填充材料修復骨缺損、重建骨力學性能至關重要。骨水泥有著優良的生物相容性、易塑性和固化能力,廣泛應用于臨床[3]。骨水泥在發生聚合時產生的高溫對腫瘤痛覺神經末梢可起到永久性消融作用,極大緩解了骨腫瘤所致疼痛[4]。然而,傳統骨水泥缺乏抗骨腫瘤的功能,無法有效抑制骨腫瘤的原位復發和遠處轉移。過去十余年,越來越多學者開始關注骨水泥改性,通過載藥、摻雜具有磁熱或光熱性能的粒子等方式賦予其抗腫瘤功能,構建新型多功能骨水泥,使其在填補缺損、修復和重建骨組織同時達到協同抗腫瘤的效果。現對近年新型多功能骨水泥治療骨腫瘤的研究進展綜述如下,以期為抗腫瘤骨水泥的進一步研究和臨床應用提供幫助。
1 傳統骨水泥
目前臨床常用骨水泥有聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥和磷酸鈣骨水泥(calcium phosphate cement,CPC)兩大類。
PMMA骨水泥是由甲基丙烯酸甲酯單體在室溫下聚合產生的骨黏固劑,具有價格低廉、質量輕、機械強度高、易于成型等優點,早在20世紀40年代就已應用于顱骨和其他骨修復領域[5]。值得注意的是,PMMA骨水泥作為一種生物惰性材料,不能與缺損的骨組織形成較好骨整合。此外,其存在的單體細胞毒性也限制了在骨腫瘤臨床治療中的應用[6]。
CPC主要是由磷酸鈣鹽形成的骨黏固劑,與人體骨組織成分相近,具有良好的生物相容性和一定可降解性,能與骨組織界面形成有機整合。但是,CPC存在機械強度低和成骨性能差的缺陷,容易在骨質中崩解,限制了在骨缺損修復中的臨床應用[7]。
傳統的CPC和PMMA骨水泥都缺乏有效抗腫瘤功能。所以,在改善傳統骨水泥固有缺陷的同時,通過改性賦予其抗腫瘤性能以構建多功能抗腫瘤骨水泥,對于骨腫瘤的治療有極大臨床意義。
2 新型多功能骨水泥
新型多功能骨水泥包括具有光熱療、磁熱療、放化療和術后抗菌功能的骨水泥,我們從抗腫瘤、藥物控釋、細胞毒性等方面進行了探討。
2.1 磁熱療抗腫瘤骨水泥
熱療包括磁熱療法和光熱療法,通過熱能誘導腫瘤細胞凋亡[8]。Fe3O4納米粒子(nanoparticles,NPs)及其改性后的鐵基復合物常被作為磁性介質導入骨水泥,制備的磁性骨水泥在外加交變磁場(alternating magnetic field,AMF)作用下產生熱量作用于腫瘤細胞[9]。1998年,Takegami等[10]就將Fe3O4粉末摻入骨水泥并植入兔脛骨中,維持骨水泥溫度在50~60℃范圍內1 h,發現該骨水泥對周圍的骨骼和肌肉有較好熱傳導作用,在此期間骨骼與肌肉界面之間的溫度升高至43~45℃。不同于PMMA骨水泥自身聚合產生的熱量,多功能磁熱骨水泥的熱量可以通過調節外加磁場控制,為定期、可控的熱療抗腫瘤策略提供了新思路。
然而,單一的Fe3O4 NPs在抗腫瘤應用中存在轉熱效率差的問題。學者們通過對其改性,以優化磁熱轉換效率。Yan等[11]將Fe3O4/氧化石墨烯(graphene oxide,Go)摻雜至α磷酸三鈣(α- tertiary calcium phosphate,α-TCP)/硫酸鈣雙相骨水泥中。結果表明,10%Fe3O4/Go摻雜的骨水泥最穩定,具有優異的磁熱性能;加熱24~72 h后,人骨肉瘤143B細胞大部分呈萎縮形態,而BMSCs保持了良好的形態和存活率,實現了有效抗腫瘤和促進骨再生的作用。
此外,皮質或髓內浸潤狀的骨破壞是惡性骨腫瘤較為常見的臨床表現。近來,Ren等[12]合成了Zn0.3Fe2.7O4 NPs,并制備了含1wt% Zn0.3Fe2.7O4的磁性PMMA骨水泥,結果表明,磁性PMMA骨水泥不但表現出了良好的生物相容性和力學支撐性能;并且當大鼠脛骨腫瘤模型經磁性PMMA骨水泥+AMF處理后,脛骨骨髓區域的骨皮質破壞少、腫瘤細胞出現壞死。Yu等[13]進一步將Zn和Co與Fe3O4 NPs共摻雜合成了Zn0.3Co0.08Fe2.62O4@SiO2 NPs,它的單位損耗功率在430 kHz、27 kA/m的AMF下達到2 428 W/g;在808 nm和2.5 W/cm2的近紅外光(near infrared light,NIR)激光輻照下達到了12 296 W/g;在AMF和NIR激光輻照雙模式下,達到了前所未有的14 724 W/g。合成的新型NPs在AMF和NIR下加熱的效率同時提高,減少了高熱治療所需光熱劑(photothermal agents,PTAs)的劑量和大量摻入PTAs可能帶來的不良反應。
2.2 光熱療抗腫瘤骨水泥
光熱療是一種受到磁熱療的啟示發展而來的抗腫瘤新興療法。相比于正常細胞,腫瘤細胞對熱量更加敏感[14]。近十年來,光熱療法因抗腫瘤作用強、空間定位準確等優點被廣泛應用于抗骨腫瘤研究。研究證明,將摻雜PTAs的光熱骨水泥植入或注射至術后骨缺損部位,在NIR照射下,腫瘤局部溫度迅速上升至42℃以上,可選擇性殺傷原位腫瘤細胞,而對正常組織和細胞傷害很少[15]。
此外,由于T淋巴細胞浸潤不足和抗原低表達,腫瘤細胞常出現免疫應答不足,手術切除后的癌癥復發仍然是治療失敗的重要原因[16]。原位腫瘤死亡后釋放的腫瘤相關抗原和腫瘤特異性抗原作為“藥物”, “喚醒”了宿主固有和適應性免疫,從而緩解了腫瘤細胞的免疫應答不足,抑制了術后局部腫瘤復發和潛在的轉移性擴散[17]。Chen等[18]將含有抗CD47抗體的碳酸鈣NPs包裹在纖維蛋白凝膠中。一方面,嵌入凝膠的NPs通過清除H+ 調控腫瘤微環境,從而促進抗腫瘤免疫應答;另一方面,抗CD47抗體增加了巨噬細胞對癌細胞的吞噬作用,促進了抗原呈遞,啟動了T細胞介導的免疫反應。Wen等[19]研制的碲化銅(copper telluride,Cu2-xTe)NPs將巨噬細胞的TNF-α和IL-6分泌量分別增加了14.4倍和1.6倍,同時免疫抑制細胞因子IL-10水平下調45.3%;并且經NIR預處理的Cu2-xTe NPs將約34.3%巨噬細胞極化至M1表型,而M2表型僅占10.7%。CuTe NPs激活了免疫系統,有效地對抗了腫瘤轉移和復發。
Xu等[20]用硅酸三鈣和Go納米片制備了硅酸三鈣/Go光熱骨水泥,通過調節NIR的功率及Go含量來調節骨水泥溫度,實現了對骨腫瘤長期穩定、可調控的光熱治療。實驗結果表明,硅酸三鈣/Go光熱骨水泥在抑制小鼠皮下腫瘤生長的同時,還可促進ALP的生物活性和MC3T3-E1細胞增殖,促進了骨缺損處新骨形成。近來,Qu等[21]在CPC中引入了含Co金屬有機框架結合四(4-羧苯基)卟啉 [tetrakis(4-carboxyphenyl)porphyrin,TCPP],制備了改性的光熱多功能骨水泥(Co-TCPP/CPC)。Co-TCPP/CPC有著良好的光熱性能,在NIR照射5 min后,由1wt% Co-TCPP與CPC復合而成的1%Co-TCPP/CPC溫度已上升至71℃。在體外實驗中,1%Co-TCPP/CPC結合NIR處理的MG-63細胞存活率僅為3%;在體內實驗中,1%Co-TCPP/CPC組小鼠在處理后14 d內腫瘤體積逐漸縮小。雖然目前文獻報道生物玻璃、介孔二氧化硅、羥基磷灰石(hydroxyapatite,HA)等都可以搭載PTAs[22],但可塑性高、經濟實用的骨水泥仍然是PTAs重要的功能載體。
有趣的是,部分PTAs除了光熱效應之外,還具有類似于生物酶的活性。例如,碳基[23]、鐵基[24]、銅基[25]的NPs還具有過氧化物酶樣活性。在腫瘤細胞中,活性氧(reactive oxygen species,ROS)的高含量決定了腫瘤細胞始終處于氧化應激狀態。腫瘤細胞對ROS的敏感性遠高于正常細胞,加速ROS的產生以誘導腫瘤細胞凋亡是行之有效的方法[26]。具有過氧化物酶樣活性的NPs通過芬頓反應催化H2O2分解,產生具有細胞毒性的ROS,誘導了處于氧化應激狀態下的腫瘤細胞凋亡,但不傷害正常組織和細胞。此外,Zhou等[27]發現銅基的NPs還具有谷胱甘肽氧化酶樣活性,它能促進腫瘤細胞大量消耗谷胱甘肽,降低了腫瘤細胞對抗氧化應激的能力,加強了ROS誘導腫瘤細胞的凋亡(圖1)。Yao等[28]的研究進一步發現,Fe3O4 NPs的過氧化物酶樣活性隨著溫度不斷升高(5~85℃)而增強,在光熱抗腫瘤的同時進一步增強了NPs內在的酶活性。
 圖1
光熱骨水泥抗腫瘤模式
圖1
光熱骨水泥抗腫瘤模式
將NPs(PTAs)和傳統骨水泥結合制備的光熱骨水泥注入小鼠腫瘤部位,在NIR照射下,局部溫度升高協同NPs內在的酶活性消融了腫瘤細胞
Figure1. Anti-tumor pattern of photothermal bone cementThe photothermal bone cement prepared by combining NPs (PTAs) and traditional bone cement was injected into the tumor site of mice, upon irradiation with NIR, the local temperature increase cooperated with the intrinsic enzymatic activity of the NPs to ablate the tumor cells
2.3 化療抗腫瘤骨水泥
藥物彌散分布在骨水泥中,可起到體內藥物緩釋效果,增強了骨水泥局部藥物濃度,減輕了全身化療帶來的不良反應[29]。Liang等[30]開發了含有阿霉素(adriamycin,DOX)和Fe3O4的多功能骨水泥(DOX/Fe3O4@PMMA)。經過DOX/Fe3O4@PMMA+AMF處理后,癌細胞的相對存活率迅速下降至30.6%;并通過調節AMF的大小改變了產生的熱能,達到了對DOX的控制釋放,在消融骨腫瘤的同時滿足了減少化療不良反應的需求(圖2)。同樣,考慮到骨水泥中長期化療藥物對骨愈合的不利影響,Cyphert等[31]基于PMMA骨水泥和不溶性γ-環糊精(γ-cyclodextrin,γ-CD)聚合物的微粒設計了一種可釋放DOX的輔助化療平臺。研究結果表明,在100 d內含有15wt% γ-CD微粒的復合材料對DOX的釋放率達到了100%,而在同一時期內從PMMA骨水泥中游離釋放的DOX只有6%。該復合材料在抗骨腫瘤的同時,避免了PMMA復合物中長期殘留的化療藥物對骨愈合產生不利影響。通過摻雜其他元素或協同光熱、磁熱療法等,達到對骨水泥中化療藥物更為精確的控釋,對提升化療效果和減少毒副作用都將有所裨益。此外,DOX可引發腫瘤細胞的免疫原性死亡,觸發機體產生抗腫瘤免疫應答,從而進一步促進殘留腫瘤細胞的殺滅。在最新研究中,Wang等[32]開發了一種含有DOX的脂質體,研究結果表明源于腫瘤細胞的DNA通過激活樹突狀細胞的cGAS-STING通路促進了Ⅰ型干擾素的分泌,增強抗腫瘤T細胞免疫應答并產生強大的抗腫瘤效應。
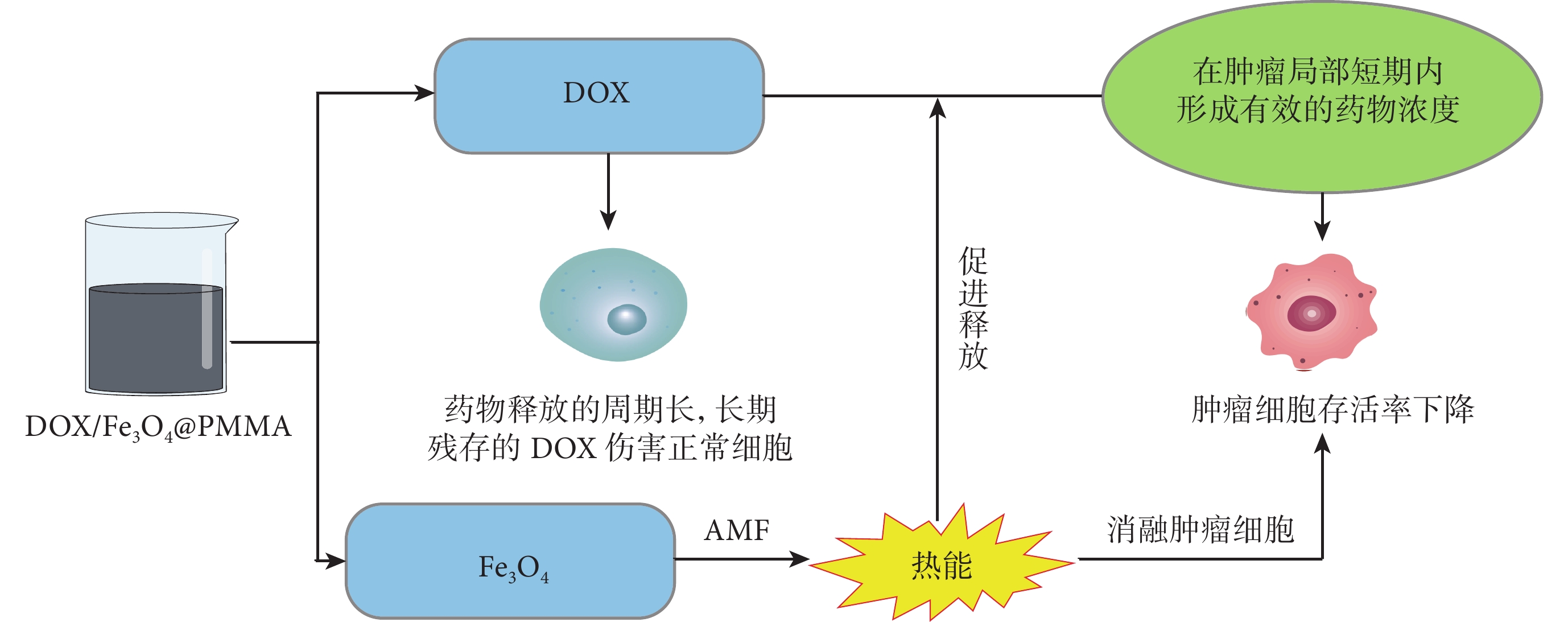
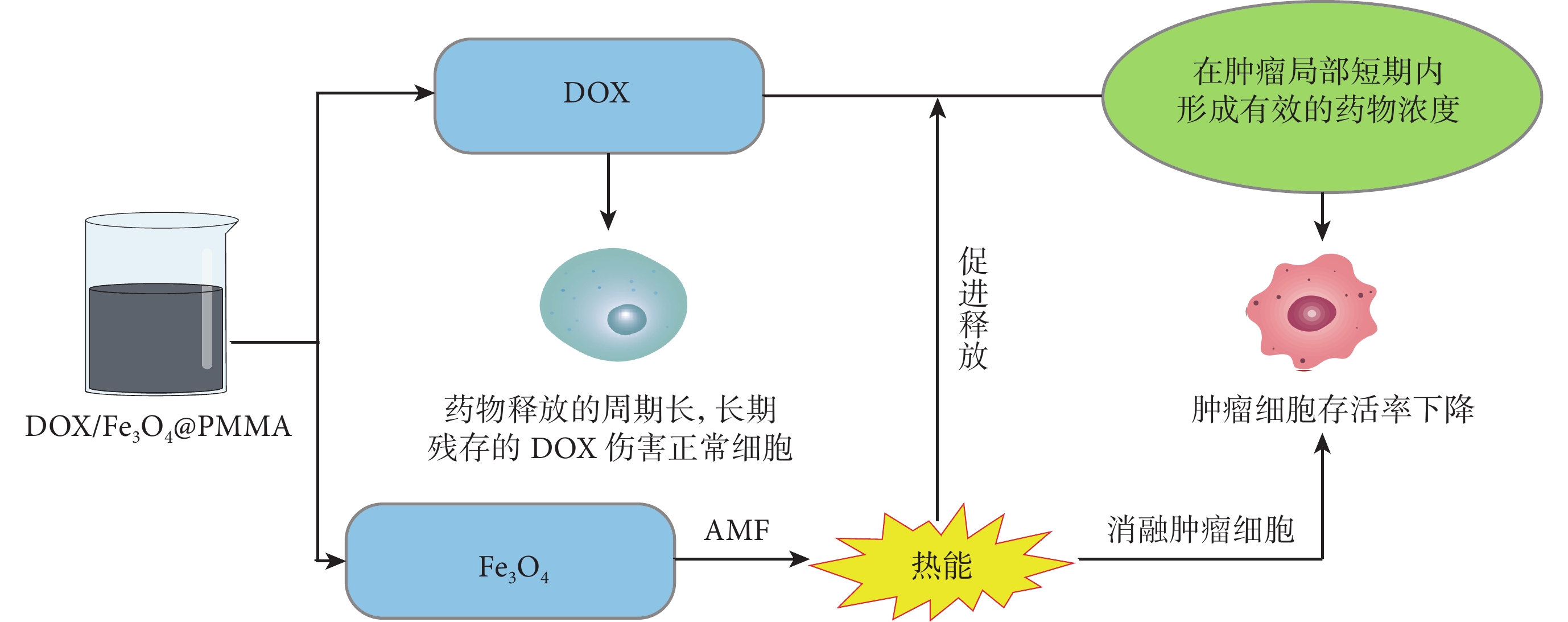 圖2
DOX/Fe3O4@PMMA平臺對DOX的控釋
圖2
DOX/Fe3O4@PMMA平臺對DOX的控釋
Fe3O4在磁場中產生的熱能誘導腫瘤細胞凋亡,同時促進了骨水泥中DOX釋放,加速了局部藥物濃度增加,減輕了藥物殘留對正常組織細胞的毒性作用
Figure2. Controlled release of DOX by DOX/Fe3O4@PMMA platformThe thermal energy generated by Fe3O4 in the magnetic field induced apoptosis of tumor cells and promoted the release of DOX from bone cement, the local drug concentration was accelerated and the toxic effects of drug residues on normal tissues and cells were mitigated
另一方面,在治療過程中,骨水泥和化療藥物的毒性往往會使正常細胞活力受到影響,導致人體正常組織修復、愈合受影響[33-34]。為減少該影響,學者們研制了一些可降低細胞毒性的新型多功能骨水泥。Liao等[35]的研究制備了納米HA/海藻酸鈉/殼聚糖骨水泥,與傳統骨水泥相比,該骨水泥顯著促進了細胞增殖,表現出了更好的生物相容性。此外,Bi等[36]制備了負載DOX的HA/海藻酸鈉/殼聚糖復合微球,在降低細胞毒性基礎上,表現出了良好的pH敏感藥物控釋能力。Phakatkar等[37]將二維磷酸鎂納米片和HA納米纖維作為填充物摻入PMMA骨水泥,浸泡實驗表明,兩種添加劑均能提高骨水泥的生物活性。作為對照組的PMMA骨水泥細胞相容性最低,而PMMA-磷酸鎂與10wt%磷酸鎂納米片細胞相容性最高,這可能與釋放的鎂離子有助于鈣離子通道調節和DNA的穩定有關[38]。
2.4 術后抗菌骨水泥
目前,對于骨腫瘤常采取局部手術切除聯合藥物化療的治療手段。由于惡性腫瘤患者常因營養不良、免疫抑制劑的使用,更容易發生細菌感染[39]。在注重骨水泥的抗腫瘤和成骨作用外,開發具有廣譜持久抗菌能力的骨水泥尤為重要。Mukai等[40]用萬古霉素(vancomycin,VCM)分別浸漬CPC與PMMA骨水泥,植入大鼠體內24周,發現CPC/VCM釋放VCM的時間更持久,并且藥物釋放量比PMMA/VCM多了1.4~26.1倍,取得了良好的抗菌效果。近來,Morinaga等[41]進一步評估了不同碘含量(2.5%、5%和20%)的CPC中碘的釋放及其抗菌性能,結果表明,5%碘含量的CPC在1周后比其他碘含量的CPC保留了更多碘,起到了一定緩釋作用,表現出長達8周的抗菌作用。Tantavisut等[42]將殼聚糖和殼聚糖寡糖(chitosan,ChO)摻入含抗生素的骨水泥中,研究其對VCM和慶大霉素釋放的影響。實驗結果表明,10%ChO摻雜的抗生素骨水泥具有最高藥物釋放率,這種現象可能源于ChO的優異水溶性,當ChO離開骨水泥標本時產生了孔隙,這些孔隙將骨水泥基質暴露于周圍介質中,從而增加了抗生素洗脫。
此外,相比于抗菌藥物,摻雜具有抗菌性能的粒子具有更加長期有效的作用[43]。Li等[44]通過將β-TCP粉末與濃度分別為0、1%、3%、5%的銅摻雜,制備了透鈣磷石骨水泥(brushite bone cement,BrC)、BrC-1Cu、BrC-3Cu、BrC-5Cu。在抗菌實驗中,BrC-1Cu、BrC-3Cu、BrC-5Cu對大腸桿菌的抑菌直徑分別為8、14、18 mm,對金黃色葡萄球菌的抑菌直徑分別為6、13、16 mm,對銅綠假單胞菌的抑菌直徑分別為14、17、22 mm。隨著銅含量增加,抗菌范圍也逐漸增大,并且隨之增加了復合物的抗壓強度。最新研究中,Zhou等[27]研發了具有強大抗菌能力的CuTe納米簇,結果表明,CuTe NPs處理的小鼠細菌數量大幅下降,存活率提升至90%;該研究還揭示了CuTe NPs的作用機制與銅基NPs的過氧化物酶樣及谷胱甘肽氧化酶樣活性的協同作用有關。然而,目前骨腫瘤術后常采用抗生素預防感染,抗菌骨水泥的研究更多關注的是感染性骨缺損愈合,對于植入骨水泥在骨腫瘤術后的抗菌性能研究較少。
2.5 放療抗腫瘤骨水泥
脊椎轉移是許多癌癥的常見表現,經皮椎體成形術和手術前后輔助放療是常規治療手段[45],將放射性核素引入骨水泥并注入體內,用于骨腫瘤的治療。相比于全身傳統放療方式,放療抗腫瘤骨水泥減小了全身放療的毒副作用,更為有效且簡便。Kaneko等[46]將32P引入PMMA骨水泥,把合成的放射性骨水泥注射入尸體標本,研究發現該復合骨水泥的放射有效范圍可達到周圍4 mm,在腫瘤累及的骨骼局部呈高劑量,同時對附近脊髓和神經等輻射敏感組織的劑量最小。近年,Keyak等[47]將32P骨水泥植入綿羊體內,并構建模型來估計人體椎骨中32P的劑量分布,對32P骨水泥治療的安全性進行評估。結果顯示,4 mCi/mL輻射量的32P骨水泥若要安全植入椎體、避免損傷神經,其表面距綿羊脊髓至少4 mm、距人類脊髓至少5 mm。植入32P骨水泥的綿羊并未出現神經系統或其他不良反應,在其血液、尿液和糞便中均未檢測到32P。然而關于放射性核素骨水泥長期療效及安全性,尚缺乏相關文獻報道。
3 總結與展望
為了應對骨腫瘤產生的骨缺損和復發等問題,學者們進行了新型多功能骨水泥的研究。通過調節骨水泥的組成或摻入其他粒子構建抗腫瘤骨水泥,在細胞毒性、藥物控釋、機械性能等方面都有一定改善。見表1。
目前研制的光療、放化療及術后抗菌骨水泥,對于骨腫瘤的治療和術后恢復已取得了切實有效的結果,但仍存在巨大挑戰。對于抗骨腫瘤多功能骨水泥的研究應注意以下幾點:① 對于較深的骨腫瘤(如盆骨),光熱療骨水泥和磁熱療骨水泥生熱能力仍難以達到有效治療效果,雖然光熱療骨水泥目前關于NIR第二窗口的研究在一定程度上增強了其應用范圍,但也十分有限。如何優化使其具有更深、更廣的應用范圍,值得探討。② 對于某些兼具磁熱轉換、光熱轉換、酶催化活性的NPs,具有顯著的抗腫瘤及抗菌作用,基于這些NPs協同化療藥物構建新型多功能抗腫瘤骨水泥有著重要研究價值。③ 在當前研究中,搭載抗菌藥物和化療藥物的骨水泥在一定程度上緩解了“突釋”效應,并嘗試加入ChO、γ-CD等粒子或通過pH調節藥物釋放,但仍無法達到精準控釋,并且不能選擇性地作用于細胞,仍會導致副作用的產生。④ 關于放療骨水泥中放射性核素長期輻照的安全性評估和對骨水泥基質的影響,也有待更深入研究。⑤ 聚焦新型多功能骨水泥對骨腫瘤患者個體化的治療,基于患者要求與實際需求制定個體化治療方案以達到最佳治療效果,將是未來抗腫瘤骨水泥研制的方向。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點及報道
作者貢獻聲明 孫瑞龍:綜述構思及設計,文獻收集,文章撰寫;李云飛:文章內容修改;田永正:文章內容修改;樊博:對文章的知識性內容作批評性審閱并提出重要參考意見
原發性骨腫瘤是臨床中常見的惡性腫瘤,在兒童中發病率高、預后差,具有局部破壞性和高度轉移性特點[1]。同時骨骼也是惡性腫瘤常見轉移部位[2],骨腫瘤或惡性腫瘤骨轉移常造成骨缺損,植入優良的填充材料修復骨缺損、重建骨力學性能至關重要。骨水泥有著優良的生物相容性、易塑性和固化能力,廣泛應用于臨床[3]。骨水泥在發生聚合時產生的高溫對腫瘤痛覺神經末梢可起到永久性消融作用,極大緩解了骨腫瘤所致疼痛[4]。然而,傳統骨水泥缺乏抗骨腫瘤的功能,無法有效抑制骨腫瘤的原位復發和遠處轉移。過去十余年,越來越多學者開始關注骨水泥改性,通過載藥、摻雜具有磁熱或光熱性能的粒子等方式賦予其抗腫瘤功能,構建新型多功能骨水泥,使其在填補缺損、修復和重建骨組織同時達到協同抗腫瘤的效果。現對近年新型多功能骨水泥治療骨腫瘤的研究進展綜述如下,以期為抗腫瘤骨水泥的進一步研究和臨床應用提供幫助。
1 傳統骨水泥
目前臨床常用骨水泥有聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥和磷酸鈣骨水泥(calcium phosphate cement,CPC)兩大類。
PMMA骨水泥是由甲基丙烯酸甲酯單體在室溫下聚合產生的骨黏固劑,具有價格低廉、質量輕、機械強度高、易于成型等優點,早在20世紀40年代就已應用于顱骨和其他骨修復領域[5]。值得注意的是,PMMA骨水泥作為一種生物惰性材料,不能與缺損的骨組織形成較好骨整合。此外,其存在的單體細胞毒性也限制了在骨腫瘤臨床治療中的應用[6]。
CPC主要是由磷酸鈣鹽形成的骨黏固劑,與人體骨組織成分相近,具有良好的生物相容性和一定可降解性,能與骨組織界面形成有機整合。但是,CPC存在機械強度低和成骨性能差的缺陷,容易在骨質中崩解,限制了在骨缺損修復中的臨床應用[7]。
傳統的CPC和PMMA骨水泥都缺乏有效抗腫瘤功能。所以,在改善傳統骨水泥固有缺陷的同時,通過改性賦予其抗腫瘤性能以構建多功能抗腫瘤骨水泥,對于骨腫瘤的治療有極大臨床意義。
2 新型多功能骨水泥
新型多功能骨水泥包括具有光熱療、磁熱療、放化療和術后抗菌功能的骨水泥,我們從抗腫瘤、藥物控釋、細胞毒性等方面進行了探討。
2.1 磁熱療抗腫瘤骨水泥
熱療包括磁熱療法和光熱療法,通過熱能誘導腫瘤細胞凋亡[8]。Fe3O4納米粒子(nanoparticles,NPs)及其改性后的鐵基復合物常被作為磁性介質導入骨水泥,制備的磁性骨水泥在外加交變磁場(alternating magnetic field,AMF)作用下產生熱量作用于腫瘤細胞[9]。1998年,Takegami等[10]就將Fe3O4粉末摻入骨水泥并植入兔脛骨中,維持骨水泥溫度在50~60℃范圍內1 h,發現該骨水泥對周圍的骨骼和肌肉有較好熱傳導作用,在此期間骨骼與肌肉界面之間的溫度升高至43~45℃。不同于PMMA骨水泥自身聚合產生的熱量,多功能磁熱骨水泥的熱量可以通過調節外加磁場控制,為定期、可控的熱療抗腫瘤策略提供了新思路。
然而,單一的Fe3O4 NPs在抗腫瘤應用中存在轉熱效率差的問題。學者們通過對其改性,以優化磁熱轉換效率。Yan等[11]將Fe3O4/氧化石墨烯(graphene oxide,Go)摻雜至α磷酸三鈣(α- tertiary calcium phosphate,α-TCP)/硫酸鈣雙相骨水泥中。結果表明,10%Fe3O4/Go摻雜的骨水泥最穩定,具有優異的磁熱性能;加熱24~72 h后,人骨肉瘤143B細胞大部分呈萎縮形態,而BMSCs保持了良好的形態和存活率,實現了有效抗腫瘤和促進骨再生的作用。
此外,皮質或髓內浸潤狀的骨破壞是惡性骨腫瘤較為常見的臨床表現。近來,Ren等[12]合成了Zn0.3Fe2.7O4 NPs,并制備了含1wt% Zn0.3Fe2.7O4的磁性PMMA骨水泥,結果表明,磁性PMMA骨水泥不但表現出了良好的生物相容性和力學支撐性能;并且當大鼠脛骨腫瘤模型經磁性PMMA骨水泥+AMF處理后,脛骨骨髓區域的骨皮質破壞少、腫瘤細胞出現壞死。Yu等[13]進一步將Zn和Co與Fe3O4 NPs共摻雜合成了Zn0.3Co0.08Fe2.62O4@SiO2 NPs,它的單位損耗功率在430 kHz、27 kA/m的AMF下達到2 428 W/g;在808 nm和2.5 W/cm2的近紅外光(near infrared light,NIR)激光輻照下達到了12 296 W/g;在AMF和NIR激光輻照雙模式下,達到了前所未有的14 724 W/g。合成的新型NPs在AMF和NIR下加熱的效率同時提高,減少了高熱治療所需光熱劑(photothermal agents,PTAs)的劑量和大量摻入PTAs可能帶來的不良反應。
2.2 光熱療抗腫瘤骨水泥
光熱療是一種受到磁熱療的啟示發展而來的抗腫瘤新興療法。相比于正常細胞,腫瘤細胞對熱量更加敏感[14]。近十年來,光熱療法因抗腫瘤作用強、空間定位準確等優點被廣泛應用于抗骨腫瘤研究。研究證明,將摻雜PTAs的光熱骨水泥植入或注射至術后骨缺損部位,在NIR照射下,腫瘤局部溫度迅速上升至42℃以上,可選擇性殺傷原位腫瘤細胞,而對正常組織和細胞傷害很少[15]。
此外,由于T淋巴細胞浸潤不足和抗原低表達,腫瘤細胞常出現免疫應答不足,手術切除后的癌癥復發仍然是治療失敗的重要原因[16]。原位腫瘤死亡后釋放的腫瘤相關抗原和腫瘤特異性抗原作為“藥物”, “喚醒”了宿主固有和適應性免疫,從而緩解了腫瘤細胞的免疫應答不足,抑制了術后局部腫瘤復發和潛在的轉移性擴散[17]。Chen等[18]將含有抗CD47抗體的碳酸鈣NPs包裹在纖維蛋白凝膠中。一方面,嵌入凝膠的NPs通過清除H+ 調控腫瘤微環境,從而促進抗腫瘤免疫應答;另一方面,抗CD47抗體增加了巨噬細胞對癌細胞的吞噬作用,促進了抗原呈遞,啟動了T細胞介導的免疫反應。Wen等[19]研制的碲化銅(copper telluride,Cu2-xTe)NPs將巨噬細胞的TNF-α和IL-6分泌量分別增加了14.4倍和1.6倍,同時免疫抑制細胞因子IL-10水平下調45.3%;并且經NIR預處理的Cu2-xTe NPs將約34.3%巨噬細胞極化至M1表型,而M2表型僅占10.7%。CuTe NPs激活了免疫系統,有效地對抗了腫瘤轉移和復發。
Xu等[20]用硅酸三鈣和Go納米片制備了硅酸三鈣/Go光熱骨水泥,通過調節NIR的功率及Go含量來調節骨水泥溫度,實現了對骨腫瘤長期穩定、可調控的光熱治療。實驗結果表明,硅酸三鈣/Go光熱骨水泥在抑制小鼠皮下腫瘤生長的同時,還可促進ALP的生物活性和MC3T3-E1細胞增殖,促進了骨缺損處新骨形成。近來,Qu等[21]在CPC中引入了含Co金屬有機框架結合四(4-羧苯基)卟啉 [tetrakis(4-carboxyphenyl)porphyrin,TCPP],制備了改性的光熱多功能骨水泥(Co-TCPP/CPC)。Co-TCPP/CPC有著良好的光熱性能,在NIR照射5 min后,由1wt% Co-TCPP與CPC復合而成的1%Co-TCPP/CPC溫度已上升至71℃。在體外實驗中,1%Co-TCPP/CPC結合NIR處理的MG-63細胞存活率僅為3%;在體內實驗中,1%Co-TCPP/CPC組小鼠在處理后14 d內腫瘤體積逐漸縮小。雖然目前文獻報道生物玻璃、介孔二氧化硅、羥基磷灰石(hydroxyapatite,HA)等都可以搭載PTAs[22],但可塑性高、經濟實用的骨水泥仍然是PTAs重要的功能載體。
有趣的是,部分PTAs除了光熱效應之外,還具有類似于生物酶的活性。例如,碳基[23]、鐵基[24]、銅基[25]的NPs還具有過氧化物酶樣活性。在腫瘤細胞中,活性氧(reactive oxygen species,ROS)的高含量決定了腫瘤細胞始終處于氧化應激狀態。腫瘤細胞對ROS的敏感性遠高于正常細胞,加速ROS的產生以誘導腫瘤細胞凋亡是行之有效的方法[26]。具有過氧化物酶樣活性的NPs通過芬頓反應催化H2O2分解,產生具有細胞毒性的ROS,誘導了處于氧化應激狀態下的腫瘤細胞凋亡,但不傷害正常組織和細胞。此外,Zhou等[27]發現銅基的NPs還具有谷胱甘肽氧化酶樣活性,它能促進腫瘤細胞大量消耗谷胱甘肽,降低了腫瘤細胞對抗氧化應激的能力,加強了ROS誘導腫瘤細胞的凋亡(圖1)。Yao等[28]的研究進一步發現,Fe3O4 NPs的過氧化物酶樣活性隨著溫度不斷升高(5~85℃)而增強,在光熱抗腫瘤的同時進一步增強了NPs內在的酶活性。
 圖1
光熱骨水泥抗腫瘤模式
圖1
光熱骨水泥抗腫瘤模式
將NPs(PTAs)和傳統骨水泥結合制備的光熱骨水泥注入小鼠腫瘤部位,在NIR照射下,局部溫度升高協同NPs內在的酶活性消融了腫瘤細胞
Figure1. Anti-tumor pattern of photothermal bone cementThe photothermal bone cement prepared by combining NPs (PTAs) and traditional bone cement was injected into the tumor site of mice, upon irradiation with NIR, the local temperature increase cooperated with the intrinsic enzymatic activity of the NPs to ablate the tumor cells
2.3 化療抗腫瘤骨水泥
藥物彌散分布在骨水泥中,可起到體內藥物緩釋效果,增強了骨水泥局部藥物濃度,減輕了全身化療帶來的不良反應[29]。Liang等[30]開發了含有阿霉素(adriamycin,DOX)和Fe3O4的多功能骨水泥(DOX/Fe3O4@PMMA)。經過DOX/Fe3O4@PMMA+AMF處理后,癌細胞的相對存活率迅速下降至30.6%;并通過調節AMF的大小改變了產生的熱能,達到了對DOX的控制釋放,在消融骨腫瘤的同時滿足了減少化療不良反應的需求(圖2)。同樣,考慮到骨水泥中長期化療藥物對骨愈合的不利影響,Cyphert等[31]基于PMMA骨水泥和不溶性γ-環糊精(γ-cyclodextrin,γ-CD)聚合物的微粒設計了一種可釋放DOX的輔助化療平臺。研究結果表明,在100 d內含有15wt% γ-CD微粒的復合材料對DOX的釋放率達到了100%,而在同一時期內從PMMA骨水泥中游離釋放的DOX只有6%。該復合材料在抗骨腫瘤的同時,避免了PMMA復合物中長期殘留的化療藥物對骨愈合產生不利影響。通過摻雜其他元素或協同光熱、磁熱療法等,達到對骨水泥中化療藥物更為精確的控釋,對提升化療效果和減少毒副作用都將有所裨益。此外,DOX可引發腫瘤細胞的免疫原性死亡,觸發機體產生抗腫瘤免疫應答,從而進一步促進殘留腫瘤細胞的殺滅。在最新研究中,Wang等[32]開發了一種含有DOX的脂質體,研究結果表明源于腫瘤細胞的DNA通過激活樹突狀細胞的cGAS-STING通路促進了Ⅰ型干擾素的分泌,增強抗腫瘤T細胞免疫應答并產生強大的抗腫瘤效應。
 圖2
DOX/Fe3O4@PMMA平臺對DOX的控釋
圖2
DOX/Fe3O4@PMMA平臺對DOX的控釋
Fe3O4在磁場中產生的熱能誘導腫瘤細胞凋亡,同時促進了骨水泥中DOX釋放,加速了局部藥物濃度增加,減輕了藥物殘留對正常組織細胞的毒性作用
Figure2. Controlled release of DOX by DOX/Fe3O4@PMMA platformThe thermal energy generated by Fe3O4 in the magnetic field induced apoptosis of tumor cells and promoted the release of DOX from bone cement, the local drug concentration was accelerated and the toxic effects of drug residues on normal tissues and cells were mitigated
另一方面,在治療過程中,骨水泥和化療藥物的毒性往往會使正常細胞活力受到影響,導致人體正常組織修復、愈合受影響[33-34]。為減少該影響,學者們研制了一些可降低細胞毒性的新型多功能骨水泥。Liao等[35]的研究制備了納米HA/海藻酸鈉/殼聚糖骨水泥,與傳統骨水泥相比,該骨水泥顯著促進了細胞增殖,表現出了更好的生物相容性。此外,Bi等[36]制備了負載DOX的HA/海藻酸鈉/殼聚糖復合微球,在降低細胞毒性基礎上,表現出了良好的pH敏感藥物控釋能力。Phakatkar等[37]將二維磷酸鎂納米片和HA納米纖維作為填充物摻入PMMA骨水泥,浸泡實驗表明,兩種添加劑均能提高骨水泥的生物活性。作為對照組的PMMA骨水泥細胞相容性最低,而PMMA-磷酸鎂與10wt%磷酸鎂納米片細胞相容性最高,這可能與釋放的鎂離子有助于鈣離子通道調節和DNA的穩定有關[38]。
2.4 術后抗菌骨水泥
目前,對于骨腫瘤常采取局部手術切除聯合藥物化療的治療手段。由于惡性腫瘤患者常因營養不良、免疫抑制劑的使用,更容易發生細菌感染[39]。在注重骨水泥的抗腫瘤和成骨作用外,開發具有廣譜持久抗菌能力的骨水泥尤為重要。Mukai等[40]用萬古霉素(vancomycin,VCM)分別浸漬CPC與PMMA骨水泥,植入大鼠體內24周,發現CPC/VCM釋放VCM的時間更持久,并且藥物釋放量比PMMA/VCM多了1.4~26.1倍,取得了良好的抗菌效果。近來,Morinaga等[41]進一步評估了不同碘含量(2.5%、5%和20%)的CPC中碘的釋放及其抗菌性能,結果表明,5%碘含量的CPC在1周后比其他碘含量的CPC保留了更多碘,起到了一定緩釋作用,表現出長達8周的抗菌作用。Tantavisut等[42]將殼聚糖和殼聚糖寡糖(chitosan,ChO)摻入含抗生素的骨水泥中,研究其對VCM和慶大霉素釋放的影響。實驗結果表明,10%ChO摻雜的抗生素骨水泥具有最高藥物釋放率,這種現象可能源于ChO的優異水溶性,當ChO離開骨水泥標本時產生了孔隙,這些孔隙將骨水泥基質暴露于周圍介質中,從而增加了抗生素洗脫。
此外,相比于抗菌藥物,摻雜具有抗菌性能的粒子具有更加長期有效的作用[43]。Li等[44]通過將β-TCP粉末與濃度分別為0、1%、3%、5%的銅摻雜,制備了透鈣磷石骨水泥(brushite bone cement,BrC)、BrC-1Cu、BrC-3Cu、BrC-5Cu。在抗菌實驗中,BrC-1Cu、BrC-3Cu、BrC-5Cu對大腸桿菌的抑菌直徑分別為8、14、18 mm,對金黃色葡萄球菌的抑菌直徑分別為6、13、16 mm,對銅綠假單胞菌的抑菌直徑分別為14、17、22 mm。隨著銅含量增加,抗菌范圍也逐漸增大,并且隨之增加了復合物的抗壓強度。最新研究中,Zhou等[27]研發了具有強大抗菌能力的CuTe納米簇,結果表明,CuTe NPs處理的小鼠細菌數量大幅下降,存活率提升至90%;該研究還揭示了CuTe NPs的作用機制與銅基NPs的過氧化物酶樣及谷胱甘肽氧化酶樣活性的協同作用有關。然而,目前骨腫瘤術后常采用抗生素預防感染,抗菌骨水泥的研究更多關注的是感染性骨缺損愈合,對于植入骨水泥在骨腫瘤術后的抗菌性能研究較少。
2.5 放療抗腫瘤骨水泥
脊椎轉移是許多癌癥的常見表現,經皮椎體成形術和手術前后輔助放療是常規治療手段[45],將放射性核素引入骨水泥并注入體內,用于骨腫瘤的治療。相比于全身傳統放療方式,放療抗腫瘤骨水泥減小了全身放療的毒副作用,更為有效且簡便。Kaneko等[46]將32P引入PMMA骨水泥,把合成的放射性骨水泥注射入尸體標本,研究發現該復合骨水泥的放射有效范圍可達到周圍4 mm,在腫瘤累及的骨骼局部呈高劑量,同時對附近脊髓和神經等輻射敏感組織的劑量最小。近年,Keyak等[47]將32P骨水泥植入綿羊體內,并構建模型來估計人體椎骨中32P的劑量分布,對32P骨水泥治療的安全性進行評估。結果顯示,4 mCi/mL輻射量的32P骨水泥若要安全植入椎體、避免損傷神經,其表面距綿羊脊髓至少4 mm、距人類脊髓至少5 mm。植入32P骨水泥的綿羊并未出現神經系統或其他不良反應,在其血液、尿液和糞便中均未檢測到32P。然而關于放射性核素骨水泥長期療效及安全性,尚缺乏相關文獻報道。
3 總結與展望
為了應對骨腫瘤產生的骨缺損和復發等問題,學者們進行了新型多功能骨水泥的研究。通過調節骨水泥的組成或摻入其他粒子構建抗腫瘤骨水泥,在細胞毒性、藥物控釋、機械性能等方面都有一定改善。見表1。
目前研制的光療、放化療及術后抗菌骨水泥,對于骨腫瘤的治療和術后恢復已取得了切實有效的結果,但仍存在巨大挑戰。對于抗骨腫瘤多功能骨水泥的研究應注意以下幾點:① 對于較深的骨腫瘤(如盆骨),光熱療骨水泥和磁熱療骨水泥生熱能力仍難以達到有效治療效果,雖然光熱療骨水泥目前關于NIR第二窗口的研究在一定程度上增強了其應用范圍,但也十分有限。如何優化使其具有更深、更廣的應用范圍,值得探討。② 對于某些兼具磁熱轉換、光熱轉換、酶催化活性的NPs,具有顯著的抗腫瘤及抗菌作用,基于這些NPs協同化療藥物構建新型多功能抗腫瘤骨水泥有著重要研究價值。③ 在當前研究中,搭載抗菌藥物和化療藥物的骨水泥在一定程度上緩解了“突釋”效應,并嘗試加入ChO、γ-CD等粒子或通過pH調節藥物釋放,但仍無法達到精準控釋,并且不能選擇性地作用于細胞,仍會導致副作用的產生。④ 關于放療骨水泥中放射性核素長期輻照的安全性評估和對骨水泥基質的影響,也有待更深入研究。⑤ 聚焦新型多功能骨水泥對骨腫瘤患者個體化的治療,基于患者要求與實際需求制定個體化治療方案以達到最佳治療效果,將是未來抗腫瘤骨水泥研制的方向。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點及報道
作者貢獻聲明 孫瑞龍:綜述構思及設計,文獻收集,文章撰寫;李云飛:文章內容修改;田永正:文章內容修改;樊博:對文章的知識性內容作批評性審閱并提出重要參考意見