肺癌居中國惡性腫瘤發病之首,骨轉移是肺癌常見轉移部位之一。隨著影像學和核醫學技術不斷進步,骨轉移早診水平均有所提高。針對肺癌骨轉移全身系統治療(化療、靶向治療、免疫治療)以及骨改良藥已有更多循證依據和進展。多學科(腫瘤內科、外科、放療、介入、核素、心理康復等)指導下的綜合治療模式已經日趨成熟。鑒于此,中國醫藥教育協會肺癌醫學教育委員會、北京醫學獎勵基金會肺癌青年專家委員會、中國老年保健協會肺癌專業委員會在 《肺癌骨轉移診療專家共識(2019版)》的基礎上,制定了《中國肺癌骨轉移臨床診療指南(2024版)》,旨在提升我國肺癌骨轉移的綜合治療水平。
引用本文: 支修益, 王潔, 劉倫旭, 趙軍, 中國醫藥教育協會肺癌醫學教育委員會,北京醫學獎勵基金會肺癌醫學青年專家委員會, 中國老年保健協會肺癌專業委員會. 中國肺癌骨轉移臨床診療指南(2024版). 中國胸心血管外科臨床雜志, 2024, 31(5): 643-654. doi: 10.7507/1007-4848.202402042 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌是骨轉移最常見的實體瘤類型[1]。數據[1]表明,肺癌患者出現骨轉移的平均時間為 9 個月,約 2/3 在肺癌診斷時即已發生,即同時骨轉移(synchronous bone metastasis,SBM)。近期我國一項大型回顧性流行病學調查研究[2]發現,肺癌患者中有17.42%出現SBM,中位生存期為11.53個月,1年、2年和5年的總體生存率分別為51%、17%和8%。因此,在肺癌確診的同時,應密切留意肺癌骨轉移,推薦對肺癌高危骨轉移人群進行常規篩查。
骨轉移不僅影響患者日常生活,還會發生骨痛、病理性骨折、脊髓和神經壓迫、鈣鹽和磷酸鹽平衡紊亂等骨相關事件(skeletal related events,SREs)。20%~30%的晚期肺癌骨轉移患者在診斷時即已發生SREs[3]; 也有數據[1]表明,肺癌患者骨轉移的SREs發生率高達 53.4%,如不積極治療,中位生存時間僅為10個月。因此,肺癌患者應在積極治療原發病的同時,規范使用骨改良藥物,以積極應對SREs的發生發展。
此外,肺癌骨轉移不僅是SREs的防治,也需要多學科全身治療與局部治療相結合,在強化骨轉移癥狀控制的同時綜合考量患者心理因素,強調腫瘤患者身心并重的整體治療。
1 指南制定方法
中國醫藥教育協會肺癌醫學教育委員會、北京醫學獎勵基金會肺癌醫學青年專家委員會、中國老年保健協會肺癌專業委員會于2023年 4月正式成立《中國肺癌骨轉移臨床診療指南(2024版)》工作組,在《肺癌骨轉移診療專家共識(2019 版)》[4]基礎上修訂并升級為指南,歷經10個月討論,確定了章節構架、循證更新,再經過反復論證、統稿、審校,最終成稿。本指南采用GRADE方法評價證據質量、GRADE推薦作為推薦強度分級標準[5],針對肺癌骨轉移多學科診療模式(multi-disciplinary treatment,MDT)提出12條推薦意見,以期規范日益發展的骨改良治療,提升肺癌骨轉移綜合防治水平。
2 病理與發病機制
肺癌骨轉移的特征是破骨細胞活化導致的骨破壞,病理上以溶骨性病變居多。一旦骨骼中出現腫瘤細胞,則腫瘤細胞、成骨細胞及破骨細胞之間的相互作用會形成惡性循環,使骨轉換增加,從而導致溶骨性破壞并促進惡性腫瘤細胞生存。活化的成骨細胞可刺激核因子-κB受體活化因子配體(receptor activator for nuclear factor-κB ligand,RANKL),RANKL與核因子-κB受體活化因子受體(receptor activator for nuclear factor-κB,RANK)相互作用激活破骨細胞,激活的破骨細胞隨后使骨再吸收,導致骨溶解,同時釋放生長因子誘導腫瘤細胞持續生長。可見,RANKL/RANK是介導肺癌骨破壞的關鍵通路[6]。此外,RANKL可能作為趨化因子,與表達RANK的腫瘤細胞直接作用,促使腫瘤細胞向骨組織歸巢[6-7]。
3 診斷
肺癌骨轉移檢測對準確分期和指導治療至關重要。目前公認的骨轉移診斷標準為臨床確診肺癌,骨活檢陽性或有明確的骨轉移影像診斷。影像學檢查用于確定骨轉移部位,以及評估受累部位是否存在病理性骨折和/或脊髓壓迫(或是存在的可能性);必要時還可用于引導活檢。
推薦1:對于確診肺癌患者且有骨轉移高危因素,初篩應首選放射性核素骨顯像(bone scintigraphy,BS),特別是有骨轉移的高危人群(如骨痛、高鈣血癥、高堿性磷酸酶、脊髓壓迫癥狀等)(1A)。
推薦2:對于初篩BS陽性的肺癌患者,有必要行CT、磁共振成像(MRI)、正電子發射計算機斷層顯像/計算機斷層顯像(positron emission computed tomography/computer tomography,PET/CT)或骨活檢進一步評估轉移病灶,進一步明確診斷(2A)。
推薦3:肺癌如僅出現孤立性骨破壞病灶,應積極行病灶骨活檢;如確診肺癌,伴全身多發骨破壞,則不必進行骨活檢(1A)。
3.1 診斷方法
3.1.1 放射性核素骨顯像
BS通常被稱為骨掃描,原理是利用示蹤劑(一般為99mTc-MDP)在成骨細胞活性增加的部位蓄積的特性,反映骨代謝變化,進而提示肺癌骨轉移的早期存在。臨床研究[8]表明,BS檢測骨轉移兼具敏感性(79%~86%)和特異性(81%~88%),全身成像不易漏診。因此,推薦其作為肺癌骨轉移的優選初篩檢測,特別是有骨轉移的高危人群(如骨痛、高鈣血癥、高堿性磷酸酶、脊髓壓迫癥狀等)。
但BS無法檢測骨髓受累情況,且非轉移性骨病變可出現假陽性[9]。故BS需要聯合其他影像手段,才能進一步提高診斷準確性。此外,在骨轉移治療后隨訪中,應注意不要將修復性成骨細胞活動造成的閃爍現象(flare phenomenon)誤診為疾病進展,故BS不常規推薦用于評價療效。
3.1.2 PET/CT和PET/MRI
PET/CT 具有更高的空間分辨率,不僅反映全身骨骼受累情況,還可識別更小的病灶。
PET/CT診斷骨轉移的特異性顯著高于BS[10];18 F-氟脫氧葡萄糖(18F-FDG) PET/CT對于溶骨性及骨髓的轉移最敏感,而18F標記氟化鈉(18F-NaF) PET/CT對于成骨性轉移最敏感,但炎癥或創傷后修復等可能導致假陽性[4]。18F-FDG PET/CT和18F-NaF PET/CT對于肺癌骨轉移的療效評價準確率較高。但考慮到價格和可及性,一般不推薦常規PET/CT作為肺癌骨轉移的初始篩查手段,除非懷疑肺癌有除骨骼以外的多發轉移。
PET/MRI作為目前最高端的融合影像設備,集成了MRI高軟組織分辨率、多參數、多序列、低輻射和PET功能代謝的優勢,可以提高閱片者對骨轉移的診斷信心,特別是針對早期骨髓浸潤和PET攝取較低的骨病變。但PET/MRI對于骨硬化病變特異性較低,且價格高昂,不適合臨床常規應用。
3.1.3 X線
X線檢查由于空間分辨率高、操作簡單、費用低廉、輻射較小、有一定特異性[11],臨床上常用于骨痛患者的初步影像學檢查。骨病灶在X線攝影上可能表現為低骨密度或無骨密度區(骨溶解),骨小梁結構破壞或缺失,或者硬化性病變或邊緣。骨質破壞必須達到一定程度(骨密度降低30%~75%),才能在X線片上出現明顯病變,因此X線平片相比BS和PET/CT,對早期骨轉移瘤的診斷往往特異性較高但敏感性較低[12],比BS顯示的骨轉移灶晚3~6個月。當骨髓內轉移未累及皮質時,易被高密度皮質掩蓋而漏診;對于早期溶骨性骨質破壞者,當患者伴發骨質疏松癥或其他低密度骨質疾病時,X線檢查不易鑒別,故不推薦X線作為骨轉移的早期篩查手段。
3.1.4 CT
與X線相比,CT可更好地顯示骨的細節,實現骨皮質的高分辨率顯像,對骨質破壞及其周圍軟組織腫塊的識別更精準。CT的敏感性與BS接近,一項Meta分析[13]調查了各種影像學方法對診斷多種惡性腫瘤骨轉移的作用,就檢測單個病灶而言,CT的敏感性和特異性分別為77%和83%,而骨掃描分別為75%和94%。因此,推薦對于BS檢查陽性而X線平片陰性患者進行CT檢查明確診斷;由于CT在骨破壞尚未達到X線片能夠檢出的程度之前就能檢測到骨髓中的溶骨性和成骨性轉移,故當懷疑轉移瘤位于脊髓時,也推薦行脊柱CT觀察椎體穩定性。
CT影像也有助于制定放療或手術方案。當需要了解骨轉移瘤與周圍神經、血管結構的關系時可考慮使用增強CT[4]。對于部分成骨性轉移的鑒別,有文獻[14-15]報道使用能譜CT檢查有一定意義。但對于骨皮質的早期轉移、骨轉移骨髓質的浸潤,尤其是在伴有骨質疏松的情況下,CT診斷的敏感性相對較低[16]。
3.1.5 MRI
MRI是唯一可以直接顯示骨髓腔及其組成結構的成像方法,是檢測骨髓病變最敏感的技術[17]。骨轉移早期,在成骨細胞或破骨細胞活化而發生骨質變化之前,MRI即可對髓內的早期轉移敏感性較高,是診斷和鑒別診斷骨髓轉移的首選影像學方法。MRI檢查轉移灶的敏感性高于CT,可更準確地確定腫瘤范圍,并且對脊柱轉移患者尤為有用,可評估髓內和脊柱外病變范圍。MRI的準確性高于CT或BS,診斷骨轉移的準確性與FDG-PET/CT相當[13]。因此,當BS和X線無法確診,特別是對懷疑髓內及脊髓受累的患者,推薦行MRI[4]檢查。
3.1.6 治療監測的影像學評價
骨轉移的治療監測中,X線、CT、BS及MRI等均是重要的影像學檢查手段。目前尚無統一的療效評價標準,RECIST 1.1療效評價有一定局限性,可以參照MD Anderson標準[18]來評價骨轉移;見表1。當成骨性轉移診斷、評價困難時,可用MRI[19]或PET/CT[20]輔助。
3.1.7 骨活檢
確診肺癌骨轉移的金標準是骨活組織的病理檢查。如僅出現孤立性骨破壞病灶,無論有無肺癌均應積極行病灶骨活檢;如確診肺癌,伴全身多發骨破壞,則骨活檢為非必須操作[4]。
穿刺活檢是一種很好的獲取足夠組織的方法,足以明確是否存在轉移性病變。CT引導下細針抽吸活檢操作簡單且結果準確,在極少數情況下可能需要開放活檢[4]。通常情況下,穿刺活檢不會引起病理性骨折的發生。穿刺活檢取材要求及活檢標本的處理方法詳見《肺癌骨轉移診療專家共識(2019版)》[4]。
3.2 診斷流程
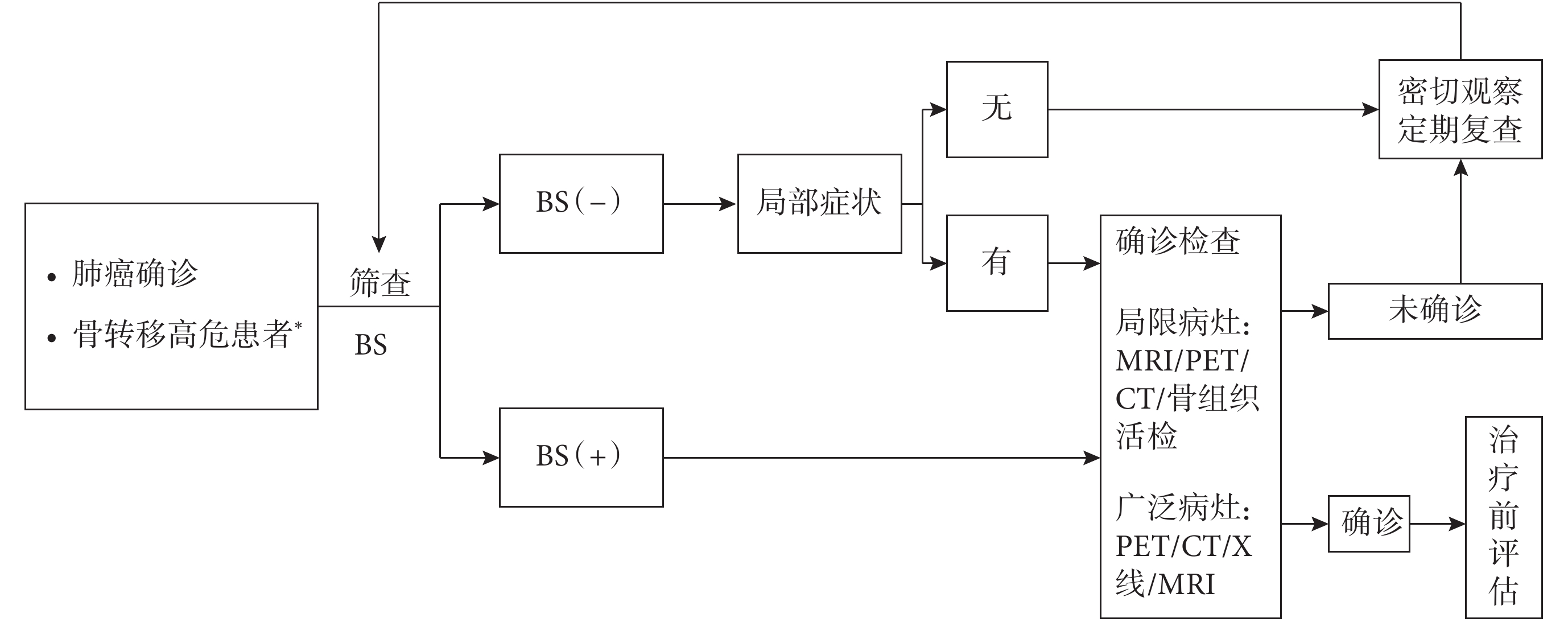
當肺癌患者合并骨轉移高危因素時,應及時進行BS篩查,如BS陽性,則有必要行MRI、PET/CT 或骨活檢進一步評估轉移病灶,進一步明確診斷。診斷流程見圖1。
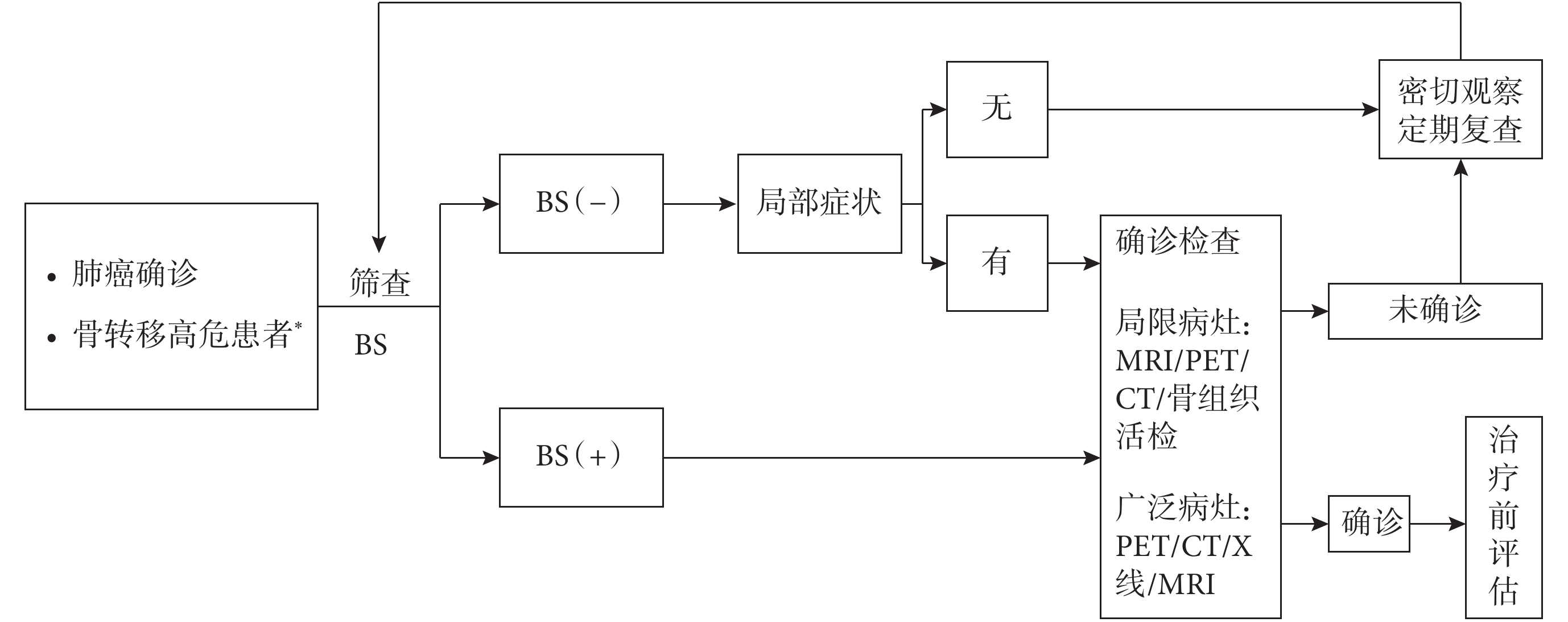 圖1
肺癌骨轉移的診斷流程
圖1
肺癌骨轉移的診斷流程
BS:核素骨顯像;PET/CT:正電子發射計算機斷層顯像;MRI:磁共振成像;*高危患者指骨痛、高鈣血癥、高堿性磷酸酶、脊髓壓迫癥狀等
4 治療
肺癌骨轉移的防治目標為癥狀緩解、預防或延緩SREs、最終延長生存期并提高生活質量;必要時還應進行心理干預。
肺癌骨轉移的治療推薦遵循MDT制定個體化方案。推薦以肺癌的全身治療為主,同時聯合雙膦酸鹽和RANKL抑制劑等骨改良藥物,預防和延緩SREs;對癥止痛治療可緩解癥狀,改善生活質量;此外,包括手術和放療在內的局部治療可以更好地控制骨轉移相關癥狀。
推薦4:對確診肺癌骨轉移患者,推薦MDT,個體化制定綜合治療方案(1A)。
推薦5:對確診肺癌骨轉移患者,如無禁忌證,均推薦應用骨改良藥物治療(1A),但不推薦常規使用骨改良藥物作為預防性治療(2B)。
推薦6:如無禁忌,推薦雙膦酸鹽或RANKL抑制劑降低肺癌骨轉移患者的SREs風險(1A)。
推薦7:正在接受雙膦酸鹽治療的患者,如出現二次SREs不建議立即停用雙膦酸鹽(1B),也可以考慮換用RANKL抑制劑或另外一種雙膦酸鹽(2B)。
推薦8:在接受骨改良藥物前后,均應常規檢查口腔,以降低頜骨壞死(osteonecrosis of the jaw,ONJ)風險(1B)。
推薦9:對于多發性骨轉移患者,應優先考慮全身系統治療和及早、持續、有效地進行階梯鎮痛(1C)。
推薦10:對經全身治療后仍無法改善的頑固性骨痛、病理性骨折和脊髓壓迫的患者,局部體外放射治療,特別是立體定向放射治療(SBRT)應作為首選治療(1B)。
推薦11:對于全身治療有效、但局部或孤立性骨轉移病灶、有脊柱受累的患者,可在外科充分評估的情況下進行外科干預(2B)。
推薦12:對于肺癌溶骨性骨轉移病灶,可使用消融聯合骨成形術(骨水泥)的介入治療,控制轉移病灶的同時恢復骨結構的穩定性(2B)。
4.1 骨改良藥物
肺癌骨轉移確診后應立即進行骨改良藥物治療。骨改良藥物也被稱為“破骨細胞抑制劑”,臨床常用的骨改良藥物為雙膦酸鹽類和RANKL抑制劑。
4.1.1 雙膦酸鹽
在肺癌骨轉移患者中,雙膦酸鹽常與抗腫瘤治療聯合使用,是骨改良的基礎用藥之一。雙膦酸鹽通過抑制破骨細胞活性而減少骨質吸收和增加礦化,阻止腫瘤轉移引起的溶骨型病變、減少骨吸收、減輕骨痛及由骨轉移所致的高鈣血癥及其他SREs[21-22]。目前,雙膦酸鹽類藥物已經發展至第三代,以唑來膦酸、伊班膦酸鈉和因卡膦酸二鈉為代表;相比前兩代,除減輕癥狀、延緩SREs獲益外,還可顯著降低高鈣血癥風險、提升骨密度、改善骨代謝。伊班膦酸負荷劑量可快速緩解骨轉移患者的疼痛[4,23-24]。因卡膦酸相比其他第三代雙膦酸鹽,發熱、腎毒性及下頜骨壞死等不良反應發生率更低[25]。各類雙膦酸鹽藥物的用法用量詳見《肺癌骨轉移診療專家共識(2019版)》[4]。
4.1.2 RANKL抑制劑
在惡性腫瘤骨轉移的過程中,RANK/RANKL是關鍵通路,因而針對骨轉移的治療,靶向RANKL是一個很好的選擇。
4.1.2.1 地舒單抗
地舒單抗是RANKL抑制劑的代表藥物,靶向抑制破骨細胞的分化、活化,打破癌癥骨轉移的惡性循環過程[26]。雖然目前沒有地舒單抗與雙膦酸鹽在肺癌骨轉移人群中的頭對頭比較研究,但在其他腫瘤骨轉移研究中,地舒單抗相比雙膦酸鹽可延長首次出現SREs的時間,顯著降低首次SREs發生風險,顯著延緩病理性骨折、骨手術和/或骨放療及脊髓壓迫,延緩惡性高鈣血癥發生時間,部分研究[24,27-30]顯示可延長生存時間,生存質量也更有優勢[31]。地舒單抗目前已經獲批在中國上市,用于預防實體瘤骨轉移和多發性骨髓瘤引起的SREs,推薦的使用方法為皮下給藥,每4周1次,每次120 mg。
4.1.2.2 其他RANKL抑制劑
納魯索拜單抗是我國原研的全球首個全人源IgG4 RANKL抑制劑,是國家1類生物制劑,已在肺癌骨轉移患者中完成Ⅰ期及Ⅰb期臨床試驗。在骨巨細胞瘤關鍵Ⅱ期上市研究中,納魯索拜單抗的起效率和骨痛緩解率超過80%,安全性可以接受[32]。
4.1.3 骨改良藥物使用療程及停藥指征
雖然骨改良藥物可在短時間內改善骨痛癥狀[33],但對于SREs則需要超過6個月的治療時間[34]。系統評價[35]發現,骨改良治療超過2年,SREs風險降低,但ONJ 等不良反應的累積風險增加。因此骨改良藥物不宜短期治療,ASCO多發性骨髓瘤指南[36]認為,對于寡轉移性疾病控制良好的患者在2年后中斷雙膦酸鹽治療可行,但其最佳使用時間目前尚無定論[27-38]。從臨床經驗的角度,如患者可耐受且治療符合患者和醫生共同治療目標時,可酌情選擇長期治療。
出現嚴重不良反應或醫生認為繼續用藥無法從治療中獲益是骨改良藥物的停藥指征。但如果雙膦酸鹽治療期間骨痛加重或出現SREs時,應繼續用藥以降低二次SREs風險[5],也可以考慮換用地舒單抗或另外一種雙膦酸鹽,但仍需后續研究進一步明確。
4.1.4 不良反應及用藥注意事項
雙膦酸鹽和地舒單抗都可引起ONJ、低鈣血癥和其他電解質異常以及非典型骨折等并發癥。雙膦酸鹽獨有的并發癥包括腎功能不全、急性期反應、眼毒性、肌肉骨骼疼痛和心房顫動等;地舒單抗常見的不良反應為肌肉、骨骼疼痛,偶見蜂窩織感染等病例報道,ONJ和非典型性股骨骨折相對罕見[23]。
4.1.4.1 頜骨壞死
骨改良藥物的使用是ONJ發生的危險因素之一,于2002年首次描述。ONJ的特征表現為骨暴露和壞死,其可在數周、數月甚至數年內無癥狀;直至周圍軟組織發炎時病變出現相關癥狀,包括長時間的頜部疼痛、牙齒松動、骨膨大、牙齦腫脹、發紅和潰瘍。有些表現可能自發出現,也可能在既往牙科手術部位出現。ONJ繼發感染后,還可能發生口內或口外瘺。ONJ主要發生機制尚不明確,但可能與嚴重且長期的骨吸收抑制伴骨重塑過度抑制以及感染有關[39]。
一項納入4.2萬例腫瘤患者的系統評價[40]指出,使用骨改良藥物后發生ONJ的發生率為2.08%,地舒單抗的ONJ發生率略高于雙膦酸鹽(3% vs. 1.6%)。但也有研究[41]指出,更短的給藥間隔也會增加雙膦酸鹽發生ONJ風險(5周 vs. ≥5周)。地舒單抗治療第1年ONJ發生率為1.1%,第2年為3.7%,隨后每年為4.6%。因此,在開始進行骨改良藥物治療之前,推薦進行口腔檢查,治療期間應定期進行口腔檢查,并給以適當的預防性牙科護理。患者在治療期間應避免進行侵入性的牙科手術,如果必須進行可考慮暫停骨改良藥物治療。如出現ONJ,對于大部分患者建議最開始采用保守治療(抗菌含漱劑、有臨床指征時使用抗生素、有效保持口腔衛生,以及有限的清創),而不是積極的手術切除;關于ONJ患者是否停用骨改良藥物,請參考4.1.3。
4.1.4.2 腎毒性
腎功能不全是雙膦酸鹽的常見不良反應之一,早期無明顯癥狀,表現為蛋白尿或管型尿,少數可發展至急性腎衰竭[4]。但骨改良藥物導致腎功能不全的數據多見于多發性骨髓瘤研究,肺癌骨轉移人群鮮有報道。對于年齡>65歲、合并糖尿病、服用非甾體抗炎藥(NSAIDs)或正在進行含順鉑化療的患者應當警惕腎功能不全甚至急性腎損傷的發生[4]。據文獻[42]報道,一般腎功能不全中位發生時間為4.7~5.4個月,當血清肌酐清除率<60 mL/min時,出現急性腎功能不全風險顯著升高。對于腎功能不全患者使用雙膦酸鹽需調整劑量(表2)。因卡膦酸給藥后在腎臟沉積量更少,且易被快速清除,與唑來膦酸相比,可一定程度降低腎毒性風險。RANKL抑制劑(地舒單抗)分子量大于腎小球濾過閾值,幾乎不經腎臟消除。因此,既不需要也不推薦對既存腎損傷患者監測腎功能和調整劑量。
4.1.4.3 低鈣血癥
不同骨改良藥物的低鈣血癥發生率有差異,如唑來膦酸發生率為5%~10%,伊班膦酸為1%~10%,地舒單抗為18%。雖然輕度和/或慢性低鈣血癥幾乎沒有癥狀,但重度或急性低鈣血癥會引發抽搐、支氣管痙攣等急癥,甚至危及生命。因此在給予地舒單抗前,有必要常規監測低鈣血癥并將其糾正,甚至預防性補鈣。有證據表明,骨改良藥物服用期間補鈣(含維生素D),可顯著降低低鈣血癥風險[43]。因此,除非有高鈣血癥等禁忌證,推薦使用骨改良藥物的患者額外補充1 000 mg鈣及800~1 200 IU維生素D。
4.2 全身治療
由于絕大多數肺癌骨轉移患者為肺癌晚期,常多發骨轉移灶,為了延長總生存期,同時維持生存質量,晚期非小細胞肺癌(NSCLC)一般需要序貫系統治療和輔助性鎮痛治療,并優先于外科和放療等局部治療[44]。在肺癌的系統性治療中,傳統化療依舊重要,但基于生物標志物的個體化治療和免疫檢查點抑制劑等新策略正逐漸受到重視,并探索出多種聯合治療方案。然而,由于骨轉移的復雜生物學特性和評估困難,并沒有特殊的內科治療藥物能特異性改善骨轉移的療效,減輕SREs的發生,更多的是需要MDT。
4.2.1 化療
無論是小細胞肺癌還是NSCLC骨轉移,均強調綜合治療策略的重要性。傳統化療長期以來一直是標準治療,選擇化療方案時應考慮患者的全身狀況和腫瘤的生物學特性。鉑類藥物為基礎的雙聯方案是此類患者一線化療的主要選擇,可根據患者耐受性和疾病特點調整。
4.2.2 免疫治療
基于生物標志物的個性化療法和免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)為治療提供了新方向,但骨轉移通常不會被列入亞組分析。NSCLC患者在發生骨轉移時,對ICIs的治療反應表現出明顯的復雜性。部分研究[45-46]顯示預后惡化,而有些研究[47-49]發現骨轉移對生存影響不明顯。這種差異可能源于骨的免疫微環境[45,47-49]和骨轉移的生物學差異[50]。但如果ICIs與RANKL抑制劑(地舒單抗)聯合應用時,相比ICIs單藥,抑制晚期NSCLC患者骨轉移的進展效果更優,延長總生存期。
為提升骨轉移相關NSCLC患者療效,綜合運用化療聯合其他治療比如抗血管生成療法、ICIs和骨改良藥物成為趨勢[51]。但骨轉移的獨特性,如特定微環境、評估挑戰以及生物學異質性和PD-L1的動態表達,使治療過程復雜化,目前仍然難以給出前瞻性、個體化的方案。
4.2.3 靶向治療
骨轉移在NSCLC中與多器官轉移、頻繁的復發性突變及復雜基因異常相關。既往文獻[4]報道表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)對骨轉移表現出治療潛力,例如TKIs可以通過調節骨髓基質細胞(BMSC)降低破骨細胞的分化,從而延緩腫瘤骨轉移病灶的骨破壞,進而減少SREs,延長首次SREs時間;但出現骨轉移仍是不良預后的獨立危險因素。現行治療傾向于整合靶向治療、雙膦酸鹽及骨吸收抑制劑來優化治療[4]。
4.2.4 抗血管生成治療
在NSCLC骨轉移的抗血管生成治療研究中,有研究[4]揭示貝伐單抗對NSCLC骨轉移的特異性療效,貝伐單抗組患者的骨轉移反應率和疾病控制率顯著提高。對比先前關于唑來膦酸的研究,含貝伐單抗的化療方案可能對骨轉移反應率更高。
4.3 鎮痛治療
由于骨受累是癌癥相關性疼痛的主要原因之一,也是晚期惡性腫瘤患者出現重度疼痛的主要原因[52]。肺癌骨轉移疼痛的處理應優先采用病因治療、藥物和非藥物協同鎮痛的原則,及早按階梯、個體化給藥,同時預防和控制藥物不良反應。病因治療是指針對肺癌的抗腫瘤治療,非藥物治療包括放療、手術和介入治療等局部治療[53-54]。對于局限性骨痛,可考慮局部放療、神經阻滯術、椎體成形術或經皮消融術等。當骨轉移疼痛局限于一處或少數幾處時,也可以使用外照射的方法[4],具體可參見4.4.1。本小節主要介紹肺癌骨轉移疼痛的藥物治療。
4.3.1 疼痛評估
對于肺癌骨轉移合并疼痛的患者,充分進行疼痛評估是鎮痛治療的前提。癌痛評估應遵循四大原則:常規、量化、全面、動態[55]。常規評估中需特別注意鑒別是否有因病理性骨折或脊髓壓迫等引起的爆發痛。量化評估有數字分級法、主訴疼痛程度分級法、面部表情評估量表法和簡明疼痛評估量表等。
4.3.2 藥物鎮痛
4.3.2.1 非甾體類抗炎藥和對乙酰氨基酚
輕度疼痛優選此類藥物,常見的有阿司匹林、布洛芬和塞來昔布等。對乙酰氨基酚最大用量不宜超過4 g/d。對于局部關節疼痛可外用NSAIDs,如1%雙氯芬酸鈉凝膠,每日4次;或1.3%雙氯芬酸貼劑,1~2片/d。
4.3.2.2 阿片類藥物
阿片類藥物是肺癌骨轉移患者中至重度疼痛的一線鎮痛用藥。阿片類藥物劑量換算及不良反應處理詳見《肺癌骨轉移診療專家共識(2019版)》[4]。這些藥物可預防骨相關事件并提高生存質量。在疼痛得到有效緩解后,應考慮逐步減少或完全終止阿片類藥物的使用。建議采用逐漸減量法,即每日按10%~25%的比例遞減藥物劑量,直至達到日劑量相當于30 mg口服嗎啡的藥量。此劑量水平維持2 d后,方可考慮停止阿片類藥物治療。
4.3.2.3 輔助鎮痛藥
若患者對阿片類藥物的反應欠佳,則考慮聯合輔助鎮痛藥物。骨改良藥物、糖皮質激素(如強的松、地塞米松)、局部麻醉藥(如利多卡因)、抗驚厥類藥物(如加巴噴丁、普瑞巴林)、鎮痛性抗抑郁藥(如度洛西汀、米那普侖)、骨靶向放射性核素藥物[如鍶-89(89Sr) ]等均屬于此類。
骨改良藥物可改善腫瘤骨組織的酸性微環境、遏制骨溶解,并減少鎮痛藥的使用量[56]。因此,如肺癌骨轉移的患者伴有強烈骨痛,我們推薦使用骨改良藥物聯合阿片類藥物。糖皮質激素可能對阿片類藥物難治性骨痛患者有用,特別是神經壓迫的患者。骨靶向放射性核素可用于難治性多灶性骨痛患者,詳見4.4.3。
4.4 放射治療
4.4.1 外照射
外照射是治療單純性骨轉移的標準治療,可使50%~80%的患者疼痛緩解,多達1/3的患者實現疼痛完全緩解。外照射前因進行評估體能狀態評分,并明確骨轉移灶的部位。對于單純骨轉移,美國放射腫瘤學會(ASTRO)和歐洲腫瘤內科學會(ESMO)[57]認為,單次8 Gy方案和分割方案的疼痛緩解效果相同,且可能更方便、性價比更高,即便有的患者需要再次外照射治療。外照射適應證、劑量及分割方式見《肺癌骨轉移診療專家共識(2019版)》[4]。
4.4.2 立體定向放射治療
近年來,SBRT逐漸在臨床普及,相比外照射提高了患者的局部控制率, SBRT對小體積骨寡轉移患者優勢更為明顯,可顯著緩解骨轉移引起的疼痛癥狀[4],尤其是有椎骨轉移。但SBRT也可能會增加椎骨壓縮骨折的風險。因此,SBRT應主要用于期望壽命較長(>6個月),在標準療程外照射后仍有骨痛或骨痛復發,并需要再次照射的患者。
4.4.3 骨靶向放射性核素
骨靶向放射性核素是放射性親骨性分子,目前已獲批用于緩解成骨性骨轉移患者的疼痛。一般來講,骨靶向放射性核素治療更適用于經外照射和/或其他形式治療后仍有疼痛或疼痛復發的多灶性骨痛患者,而不是作為初始治療。
89Sr是常用的放射性核素,能夠發射β粒子,可有效緩解疼痛,緩解率為40%~95%。關于89Sr的適應證、用法用量和禁忌證等見《肺癌骨轉移診療專家共識(2019版)》[4]。此外,鐳-223(233Ra)是一種新型的經靜脈注射的骨靶向放射性同位素,可發射α粒子;目前在前列腺腫瘤骨轉移研究中,總生存情況和首次出現癥狀性SREs的時間均得到改善。但在肺癌骨轉移人群中的療效仍待觀察。
4.5 外科治療
4.5.1 外科治療目的
外科治療主要目的在于緩解疼痛、減輕或避免運動系統功能受損或脊髓受壓引起的一系列并發癥、預防或治療病理性骨折方法、提高生活質量從而間接延長患者生存期,與此同時,通過對手術獲得的骨轉移病灶進行組織學診斷,也可指導后續治療[58]。
4.5.2 外科治療適應證
骨轉移的手術治療通常僅用于有完全性病理性骨折或病理性骨折傾向的病變,并且手術干預應符合治療目標。對于嚴格選擇的晚期癌癥患者,即骨病變是原發部位以外唯一轉移灶的患者,整塊切除轉移灶可使局部腫瘤控制最佳,持久緩解疼痛,并可能延長患者生存期。脊柱轉移導致機械性不穩定時,可考慮手術干預;但除單純性脊柱或胸骨受累的特定患者外,很少進行骨轉移灶的根治性切除。
4.5.3 外科治療的時機選擇
當(1)確診肺癌骨轉移;(2)保守治療后,骨破壞和/或疼痛癥狀仍持續加重;(3)已經出現病理性骨折;(4)保守治療后,運動系統功能仍無法恢復;(5)出現神經壓迫癥狀;(6)脊柱出現不穩定表現,容易發生截癱風險;(7)骨轉移病灶對放、化療均不敏感時,建議采取外科治療干預[59-61]。
4.5.4 不同轉移部位的外科治療
4.5.4.1 長骨轉移
病理性骨折是肺癌長骨轉移瘤最嚴重的并發癥,影響患者的日常活動和生活質量,可導致患者死亡等嚴重SREs。難以忍受的疼痛和病理性骨折是手術的明確指征[62]。長骨以病灶位置不同區分,骨端病灶可選擇行瘤段切除、假體重建;骨干病灶可考慮骨水泥填充內固定或節段假體重建。不同部位長骨轉移瘤的手術方式應進行個體化選擇[63]。若其他治療方式仍無法控制骨破壞,患者存在頑固性疼痛,主要血管、神經受累,廣泛軟組織侵犯,為提高生存質量可采用截肢手術[10]。
4.5.4.2 脊柱轉移
肺癌脊柱轉移瘤手術以姑息性手術為主,手術旨在對脊髓和神經根減壓以及重建脊柱穩定,從而減輕癥狀,提高生活質量,主要分為減壓手術和減瘤手術,具體包括椎板切除減壓術、經瘤椎體切除術、分離手術以及微創經皮椎體成形術等[64-65]。但應避免單純后路椎板減壓術,防止加重脊柱不穩定。
4.5.4.3 骨盆轉移
肺癌骨盆轉移瘤以姑息性治療為主,手術主要目的為最大可能切除腫瘤,減輕疼痛,恢復行走能力,提高生活質量。手術方式多選擇去除腫瘤轉移灶后用甲基丙烯酸甲酯(PMMA,又稱骨水泥)成形。對于尚未累及髖臼的病變,可以選擇植入物或骨水泥強化應力傳導區;累及髖臼者,則可以考慮行全髖關節置換術;對于病變位于恥骨、坐骨等非應力傳導區的病變,可行單純切除術。
4.6 介入治療
癥狀性肺癌骨轉移瘤患者在接受外照射、外科、藥物鎮痛治療后或治療的同時,仍會有部分患者疼痛并未緩解或緩解不充分;或患者的期望壽命有限不適宜外科等其他綜合治療,骨轉移瘤的局部介入治療可有效控制這類患者的局部癥狀,成為系統治療的有力補充。各類介入治療的適應證和禁忌證等見《肺癌骨轉移診療專家共識(2019版)》[4]。
4.6.1 消融治療
臨床上常用的消融治療包括射頻消融、微波消融、冷凍消融以及聚焦超聲。消融治療無外科手術指證的骨轉移瘤安全、有效,可顯著緩解疼痛、預防SREsR的發生,并可持久控制局部腫瘤[66-68]。消融常用于治療肺癌已經進展的骨轉移患者;拒絕放療或者放療后仍有疼痛的患者。在美國國家綜合癌癥網絡(NCCN)癌痛指南中,局部消融現已成為無骨科急癥時轉移性骨痛的推薦治療。此外,姑息性治療中也可使用骨轉移瘤消融治療代替手術,以保留承重骨的功能或防止其發生病理性骨折。
4.6.2 經皮骨成形術
既往,經皮骨水泥成形術僅用于不適合開放手術的患者,但隨著影像學引導下的微創技術的興起,拓寬了經皮骨水泥成形術的應用范圍,常與局部消融治療聯合,作為外科手術的替代方案之一[69] ,適用于各種溶骨性骨原發腫瘤或骨轉移瘤[4]。消融治療使病灶局部凝固性壞死,后續對消融區域進行骨水泥填充,加強了轉移骨(特別是承重骨如椎體)的穩定性和支撐力。經皮骨水泥成形術降低了髖臼周圍骨盆和股骨近端的骨轉移灶的處理難度;在控制疼痛的同時,恢復轉移骨的完整性,是預防SREs的有效方法[70-71]。
4.6.3 近距離治療
近距離放療是將放射源置于需治療區域內部或附近。發出的輻射通常僅在相對較短的距離內有活性,其優點在于可對腫瘤予以大劑量照射,同時減少周圍正常組織的照射劑量。近距離治療可用于緩解常規治療失敗或抵抗后的骨轉移疼痛,可改善疼痛癥狀,腫瘤局部控制良好[72],因其為微創操作,并發癥可控,在臨床中可與骨水泥治療協同應用。我國用于肺癌骨轉移的放射源一般為碘-125。需要注意的是,近距離治療需要侵入性操作,因此必須權衡治療益處與可能產生的并發癥。
4.7 心理支持治療
肺癌患者抑郁患病率是所有惡性腫瘤中發病率最高的[4],因此,有效的心理支持對于肺癌骨轉移綜合干預也是必要的。心理支持主要為心理-社會干預,包括認知-行為學、家庭支持以及CALM(managing cancer and living meaningfully)治療,這些已被證實是緩解痛苦、改善生活質量的有效措施之一。如患者合并焦慮抑郁障礙,可聯合精神藥物治療,特別是重度焦慮抑郁障礙患者。
利益沖突:無。
《中國肺癌骨轉移臨床診療指南(2024版)》編寫委員會名單
主編:支修益(首都醫科大學宣武醫院),王潔(中國醫學科學院腫瘤醫院) ,劉倫旭(四川大學華西醫院)
執筆:趙軍(北京大學腫瘤醫院)
成員(按姓氏漢語拼音排序) 曹寶山(北京大學第三醫院),陳麥林(北京大學腫瘤醫院),丁凱(天津醫科大學總醫院),段建春(中國醫學科學院腫瘤醫院/中國醫學科學院腫瘤醫院山西醫院),龔敬(復旦大學腫瘤醫院),郭銳(北京大學腫瘤醫院),胡牧(首都醫科大學附屬北京友誼醫院),胡攀攀(北京大學第三醫院),李東(北京京西腫瘤醫院),李琳(北京醫院腫瘤內科),李囡(北京大學腫瘤醫院),李曉燕(首都醫科大學附屬北京天壇醫院),劉玉良(北京大學腫瘤醫院),柳晨(北京大學腫瘤醫院),牛曉輝(北京積水潭醫院),潘峰(北京大學人民醫院),石安輝(北京大學腫瘤醫院),孫昆昆(北京大學人民醫院),唐麗麗(北京大學腫瘤醫院),唐威(中國醫學科學院腫瘤醫院),萬蕊(中國醫學科學院腫瘤醫院),王靜靜(北京大學腫瘤醫院),王娟(北京大學首鋼醫院),韋峰(北京大學第三醫院),徐蔚然(首都醫科大學附屬北京天壇醫院),易福梅(北京大學第三醫院),張建新(中國醫學科學院腫瘤醫院山西醫院/山西省腫瘤醫院醫學),周舒暢(華中科技大學同濟醫學院附屬同濟醫院),周永[ 新疆醫科大學第三臨床醫學院(附屬腫瘤醫院)],朱翔(北京大學醫學部/北京大學第三醫院)
成員參與專家(按姓氏漢語拼音排序)
陳軍(天津醫科大學總醫院),姜格寧(同濟大學附屬上海肺科醫院),馬少華(北京大學腫瘤醫院),王長利(天津市腫瘤醫院),楊躍(北京大學腫瘤醫院),張蘭軍(中山大學腫瘤防治中心)
肺癌是骨轉移最常見的實體瘤類型[1]。數據[1]表明,肺癌患者出現骨轉移的平均時間為 9 個月,約 2/3 在肺癌診斷時即已發生,即同時骨轉移(synchronous bone metastasis,SBM)。近期我國一項大型回顧性流行病學調查研究[2]發現,肺癌患者中有17.42%出現SBM,中位生存期為11.53個月,1年、2年和5年的總體生存率分別為51%、17%和8%。因此,在肺癌確診的同時,應密切留意肺癌骨轉移,推薦對肺癌高危骨轉移人群進行常規篩查。
骨轉移不僅影響患者日常生活,還會發生骨痛、病理性骨折、脊髓和神經壓迫、鈣鹽和磷酸鹽平衡紊亂等骨相關事件(skeletal related events,SREs)。20%~30%的晚期肺癌骨轉移患者在診斷時即已發生SREs[3]; 也有數據[1]表明,肺癌患者骨轉移的SREs發生率高達 53.4%,如不積極治療,中位生存時間僅為10個月。因此,肺癌患者應在積極治療原發病的同時,規范使用骨改良藥物,以積極應對SREs的發生發展。
此外,肺癌骨轉移不僅是SREs的防治,也需要多學科全身治療與局部治療相結合,在強化骨轉移癥狀控制的同時綜合考量患者心理因素,強調腫瘤患者身心并重的整體治療。
1 指南制定方法
中國醫藥教育協會肺癌醫學教育委員會、北京醫學獎勵基金會肺癌醫學青年專家委員會、中國老年保健協會肺癌專業委員會于2023年 4月正式成立《中國肺癌骨轉移臨床診療指南(2024版)》工作組,在《肺癌骨轉移診療專家共識(2019 版)》[4]基礎上修訂并升級為指南,歷經10個月討論,確定了章節構架、循證更新,再經過反復論證、統稿、審校,最終成稿。本指南采用GRADE方法評價證據質量、GRADE推薦作為推薦強度分級標準[5],針對肺癌骨轉移多學科診療模式(multi-disciplinary treatment,MDT)提出12條推薦意見,以期規范日益發展的骨改良治療,提升肺癌骨轉移綜合防治水平。
2 病理與發病機制
肺癌骨轉移的特征是破骨細胞活化導致的骨破壞,病理上以溶骨性病變居多。一旦骨骼中出現腫瘤細胞,則腫瘤細胞、成骨細胞及破骨細胞之間的相互作用會形成惡性循環,使骨轉換增加,從而導致溶骨性破壞并促進惡性腫瘤細胞生存。活化的成骨細胞可刺激核因子-κB受體活化因子配體(receptor activator for nuclear factor-κB ligand,RANKL),RANKL與核因子-κB受體活化因子受體(receptor activator for nuclear factor-κB,RANK)相互作用激活破骨細胞,激活的破骨細胞隨后使骨再吸收,導致骨溶解,同時釋放生長因子誘導腫瘤細胞持續生長。可見,RANKL/RANK是介導肺癌骨破壞的關鍵通路[6]。此外,RANKL可能作為趨化因子,與表達RANK的腫瘤細胞直接作用,促使腫瘤細胞向骨組織歸巢[6-7]。
3 診斷
肺癌骨轉移檢測對準確分期和指導治療至關重要。目前公認的骨轉移診斷標準為臨床確診肺癌,骨活檢陽性或有明確的骨轉移影像診斷。影像學檢查用于確定骨轉移部位,以及評估受累部位是否存在病理性骨折和/或脊髓壓迫(或是存在的可能性);必要時還可用于引導活檢。
推薦1:對于確診肺癌患者且有骨轉移高危因素,初篩應首選放射性核素骨顯像(bone scintigraphy,BS),特別是有骨轉移的高危人群(如骨痛、高鈣血癥、高堿性磷酸酶、脊髓壓迫癥狀等)(1A)。
推薦2:對于初篩BS陽性的肺癌患者,有必要行CT、磁共振成像(MRI)、正電子發射計算機斷層顯像/計算機斷層顯像(positron emission computed tomography/computer tomography,PET/CT)或骨活檢進一步評估轉移病灶,進一步明確診斷(2A)。
推薦3:肺癌如僅出現孤立性骨破壞病灶,應積極行病灶骨活檢;如確診肺癌,伴全身多發骨破壞,則不必進行骨活檢(1A)。
3.1 診斷方法
3.1.1 放射性核素骨顯像
BS通常被稱為骨掃描,原理是利用示蹤劑(一般為99mTc-MDP)在成骨細胞活性增加的部位蓄積的特性,反映骨代謝變化,進而提示肺癌骨轉移的早期存在。臨床研究[8]表明,BS檢測骨轉移兼具敏感性(79%~86%)和特異性(81%~88%),全身成像不易漏診。因此,推薦其作為肺癌骨轉移的優選初篩檢測,特別是有骨轉移的高危人群(如骨痛、高鈣血癥、高堿性磷酸酶、脊髓壓迫癥狀等)。
但BS無法檢測骨髓受累情況,且非轉移性骨病變可出現假陽性[9]。故BS需要聯合其他影像手段,才能進一步提高診斷準確性。此外,在骨轉移治療后隨訪中,應注意不要將修復性成骨細胞活動造成的閃爍現象(flare phenomenon)誤診為疾病進展,故BS不常規推薦用于評價療效。
3.1.2 PET/CT和PET/MRI
PET/CT 具有更高的空間分辨率,不僅反映全身骨骼受累情況,還可識別更小的病灶。
PET/CT診斷骨轉移的特異性顯著高于BS[10];18 F-氟脫氧葡萄糖(18F-FDG) PET/CT對于溶骨性及骨髓的轉移最敏感,而18F標記氟化鈉(18F-NaF) PET/CT對于成骨性轉移最敏感,但炎癥或創傷后修復等可能導致假陽性[4]。18F-FDG PET/CT和18F-NaF PET/CT對于肺癌骨轉移的療效評價準確率較高。但考慮到價格和可及性,一般不推薦常規PET/CT作為肺癌骨轉移的初始篩查手段,除非懷疑肺癌有除骨骼以外的多發轉移。
PET/MRI作為目前最高端的融合影像設備,集成了MRI高軟組織分辨率、多參數、多序列、低輻射和PET功能代謝的優勢,可以提高閱片者對骨轉移的診斷信心,特別是針對早期骨髓浸潤和PET攝取較低的骨病變。但PET/MRI對于骨硬化病變特異性較低,且價格高昂,不適合臨床常規應用。
3.1.3 X線
X線檢查由于空間分辨率高、操作簡單、費用低廉、輻射較小、有一定特異性[11],臨床上常用于骨痛患者的初步影像學檢查。骨病灶在X線攝影上可能表現為低骨密度或無骨密度區(骨溶解),骨小梁結構破壞或缺失,或者硬化性病變或邊緣。骨質破壞必須達到一定程度(骨密度降低30%~75%),才能在X線片上出現明顯病變,因此X線平片相比BS和PET/CT,對早期骨轉移瘤的診斷往往特異性較高但敏感性較低[12],比BS顯示的骨轉移灶晚3~6個月。當骨髓內轉移未累及皮質時,易被高密度皮質掩蓋而漏診;對于早期溶骨性骨質破壞者,當患者伴發骨質疏松癥或其他低密度骨質疾病時,X線檢查不易鑒別,故不推薦X線作為骨轉移的早期篩查手段。
3.1.4 CT
與X線相比,CT可更好地顯示骨的細節,實現骨皮質的高分辨率顯像,對骨質破壞及其周圍軟組織腫塊的識別更精準。CT的敏感性與BS接近,一項Meta分析[13]調查了各種影像學方法對診斷多種惡性腫瘤骨轉移的作用,就檢測單個病灶而言,CT的敏感性和特異性分別為77%和83%,而骨掃描分別為75%和94%。因此,推薦對于BS檢查陽性而X線平片陰性患者進行CT檢查明確診斷;由于CT在骨破壞尚未達到X線片能夠檢出的程度之前就能檢測到骨髓中的溶骨性和成骨性轉移,故當懷疑轉移瘤位于脊髓時,也推薦行脊柱CT觀察椎體穩定性。
CT影像也有助于制定放療或手術方案。當需要了解骨轉移瘤與周圍神經、血管結構的關系時可考慮使用增強CT[4]。對于部分成骨性轉移的鑒別,有文獻[14-15]報道使用能譜CT檢查有一定意義。但對于骨皮質的早期轉移、骨轉移骨髓質的浸潤,尤其是在伴有骨質疏松的情況下,CT診斷的敏感性相對較低[16]。
3.1.5 MRI
MRI是唯一可以直接顯示骨髓腔及其組成結構的成像方法,是檢測骨髓病變最敏感的技術[17]。骨轉移早期,在成骨細胞或破骨細胞活化而發生骨質變化之前,MRI即可對髓內的早期轉移敏感性較高,是診斷和鑒別診斷骨髓轉移的首選影像學方法。MRI檢查轉移灶的敏感性高于CT,可更準確地確定腫瘤范圍,并且對脊柱轉移患者尤為有用,可評估髓內和脊柱外病變范圍。MRI的準確性高于CT或BS,診斷骨轉移的準確性與FDG-PET/CT相當[13]。因此,當BS和X線無法確診,特別是對懷疑髓內及脊髓受累的患者,推薦行MRI[4]檢查。
3.1.6 治療監測的影像學評價
骨轉移的治療監測中,X線、CT、BS及MRI等均是重要的影像學檢查手段。目前尚無統一的療效評價標準,RECIST 1.1療效評價有一定局限性,可以參照MD Anderson標準[18]來評價骨轉移;見表1。當成骨性轉移診斷、評價困難時,可用MRI[19]或PET/CT[20]輔助。
3.1.7 骨活檢
確診肺癌骨轉移的金標準是骨活組織的病理檢查。如僅出現孤立性骨破壞病灶,無論有無肺癌均應積極行病灶骨活檢;如確診肺癌,伴全身多發骨破壞,則骨活檢為非必須操作[4]。
穿刺活檢是一種很好的獲取足夠組織的方法,足以明確是否存在轉移性病變。CT引導下細針抽吸活檢操作簡單且結果準確,在極少數情況下可能需要開放活檢[4]。通常情況下,穿刺活檢不會引起病理性骨折的發生。穿刺活檢取材要求及活檢標本的處理方法詳見《肺癌骨轉移診療專家共識(2019版)》[4]。
3.2 診斷流程
當肺癌患者合并骨轉移高危因素時,應及時進行BS篩查,如BS陽性,則有必要行MRI、PET/CT 或骨活檢進一步評估轉移病灶,進一步明確診斷。診斷流程見圖1。
 圖1
肺癌骨轉移的診斷流程
圖1
肺癌骨轉移的診斷流程
BS:核素骨顯像;PET/CT:正電子發射計算機斷層顯像;MRI:磁共振成像;*高危患者指骨痛、高鈣血癥、高堿性磷酸酶、脊髓壓迫癥狀等
4 治療
肺癌骨轉移的防治目標為癥狀緩解、預防或延緩SREs、最終延長生存期并提高生活質量;必要時還應進行心理干預。
肺癌骨轉移的治療推薦遵循MDT制定個體化方案。推薦以肺癌的全身治療為主,同時聯合雙膦酸鹽和RANKL抑制劑等骨改良藥物,預防和延緩SREs;對癥止痛治療可緩解癥狀,改善生活質量;此外,包括手術和放療在內的局部治療可以更好地控制骨轉移相關癥狀。
推薦4:對確診肺癌骨轉移患者,推薦MDT,個體化制定綜合治療方案(1A)。
推薦5:對確診肺癌骨轉移患者,如無禁忌證,均推薦應用骨改良藥物治療(1A),但不推薦常規使用骨改良藥物作為預防性治療(2B)。
推薦6:如無禁忌,推薦雙膦酸鹽或RANKL抑制劑降低肺癌骨轉移患者的SREs風險(1A)。
推薦7:正在接受雙膦酸鹽治療的患者,如出現二次SREs不建議立即停用雙膦酸鹽(1B),也可以考慮換用RANKL抑制劑或另外一種雙膦酸鹽(2B)。
推薦8:在接受骨改良藥物前后,均應常規檢查口腔,以降低頜骨壞死(osteonecrosis of the jaw,ONJ)風險(1B)。
推薦9:對于多發性骨轉移患者,應優先考慮全身系統治療和及早、持續、有效地進行階梯鎮痛(1C)。
推薦10:對經全身治療后仍無法改善的頑固性骨痛、病理性骨折和脊髓壓迫的患者,局部體外放射治療,特別是立體定向放射治療(SBRT)應作為首選治療(1B)。
推薦11:對于全身治療有效、但局部或孤立性骨轉移病灶、有脊柱受累的患者,可在外科充分評估的情況下進行外科干預(2B)。
推薦12:對于肺癌溶骨性骨轉移病灶,可使用消融聯合骨成形術(骨水泥)的介入治療,控制轉移病灶的同時恢復骨結構的穩定性(2B)。
4.1 骨改良藥物
肺癌骨轉移確診后應立即進行骨改良藥物治療。骨改良藥物也被稱為“破骨細胞抑制劑”,臨床常用的骨改良藥物為雙膦酸鹽類和RANKL抑制劑。
4.1.1 雙膦酸鹽
在肺癌骨轉移患者中,雙膦酸鹽常與抗腫瘤治療聯合使用,是骨改良的基礎用藥之一。雙膦酸鹽通過抑制破骨細胞活性而減少骨質吸收和增加礦化,阻止腫瘤轉移引起的溶骨型病變、減少骨吸收、減輕骨痛及由骨轉移所致的高鈣血癥及其他SREs[21-22]。目前,雙膦酸鹽類藥物已經發展至第三代,以唑來膦酸、伊班膦酸鈉和因卡膦酸二鈉為代表;相比前兩代,除減輕癥狀、延緩SREs獲益外,還可顯著降低高鈣血癥風險、提升骨密度、改善骨代謝。伊班膦酸負荷劑量可快速緩解骨轉移患者的疼痛[4,23-24]。因卡膦酸相比其他第三代雙膦酸鹽,發熱、腎毒性及下頜骨壞死等不良反應發生率更低[25]。各類雙膦酸鹽藥物的用法用量詳見《肺癌骨轉移診療專家共識(2019版)》[4]。
4.1.2 RANKL抑制劑
在惡性腫瘤骨轉移的過程中,RANK/RANKL是關鍵通路,因而針對骨轉移的治療,靶向RANKL是一個很好的選擇。
4.1.2.1 地舒單抗
地舒單抗是RANKL抑制劑的代表藥物,靶向抑制破骨細胞的分化、活化,打破癌癥骨轉移的惡性循環過程[26]。雖然目前沒有地舒單抗與雙膦酸鹽在肺癌骨轉移人群中的頭對頭比較研究,但在其他腫瘤骨轉移研究中,地舒單抗相比雙膦酸鹽可延長首次出現SREs的時間,顯著降低首次SREs發生風險,顯著延緩病理性骨折、骨手術和/或骨放療及脊髓壓迫,延緩惡性高鈣血癥發生時間,部分研究[24,27-30]顯示可延長生存時間,生存質量也更有優勢[31]。地舒單抗目前已經獲批在中國上市,用于預防實體瘤骨轉移和多發性骨髓瘤引起的SREs,推薦的使用方法為皮下給藥,每4周1次,每次120 mg。
4.1.2.2 其他RANKL抑制劑
納魯索拜單抗是我國原研的全球首個全人源IgG4 RANKL抑制劑,是國家1類生物制劑,已在肺癌骨轉移患者中完成Ⅰ期及Ⅰb期臨床試驗。在骨巨細胞瘤關鍵Ⅱ期上市研究中,納魯索拜單抗的起效率和骨痛緩解率超過80%,安全性可以接受[32]。
4.1.3 骨改良藥物使用療程及停藥指征
雖然骨改良藥物可在短時間內改善骨痛癥狀[33],但對于SREs則需要超過6個月的治療時間[34]。系統評價[35]發現,骨改良治療超過2年,SREs風險降低,但ONJ 等不良反應的累積風險增加。因此骨改良藥物不宜短期治療,ASCO多發性骨髓瘤指南[36]認為,對于寡轉移性疾病控制良好的患者在2年后中斷雙膦酸鹽治療可行,但其最佳使用時間目前尚無定論[27-38]。從臨床經驗的角度,如患者可耐受且治療符合患者和醫生共同治療目標時,可酌情選擇長期治療。
出現嚴重不良反應或醫生認為繼續用藥無法從治療中獲益是骨改良藥物的停藥指征。但如果雙膦酸鹽治療期間骨痛加重或出現SREs時,應繼續用藥以降低二次SREs風險[5],也可以考慮換用地舒單抗或另外一種雙膦酸鹽,但仍需后續研究進一步明確。
4.1.4 不良反應及用藥注意事項
雙膦酸鹽和地舒單抗都可引起ONJ、低鈣血癥和其他電解質異常以及非典型骨折等并發癥。雙膦酸鹽獨有的并發癥包括腎功能不全、急性期反應、眼毒性、肌肉骨骼疼痛和心房顫動等;地舒單抗常見的不良反應為肌肉、骨骼疼痛,偶見蜂窩織感染等病例報道,ONJ和非典型性股骨骨折相對罕見[23]。
4.1.4.1 頜骨壞死
骨改良藥物的使用是ONJ發生的危險因素之一,于2002年首次描述。ONJ的特征表現為骨暴露和壞死,其可在數周、數月甚至數年內無癥狀;直至周圍軟組織發炎時病變出現相關癥狀,包括長時間的頜部疼痛、牙齒松動、骨膨大、牙齦腫脹、發紅和潰瘍。有些表現可能自發出現,也可能在既往牙科手術部位出現。ONJ繼發感染后,還可能發生口內或口外瘺。ONJ主要發生機制尚不明確,但可能與嚴重且長期的骨吸收抑制伴骨重塑過度抑制以及感染有關[39]。
一項納入4.2萬例腫瘤患者的系統評價[40]指出,使用骨改良藥物后發生ONJ的發生率為2.08%,地舒單抗的ONJ發生率略高于雙膦酸鹽(3% vs. 1.6%)。但也有研究[41]指出,更短的給藥間隔也會增加雙膦酸鹽發生ONJ風險(5周 vs. ≥5周)。地舒單抗治療第1年ONJ發生率為1.1%,第2年為3.7%,隨后每年為4.6%。因此,在開始進行骨改良藥物治療之前,推薦進行口腔檢查,治療期間應定期進行口腔檢查,并給以適當的預防性牙科護理。患者在治療期間應避免進行侵入性的牙科手術,如果必須進行可考慮暫停骨改良藥物治療。如出現ONJ,對于大部分患者建議最開始采用保守治療(抗菌含漱劑、有臨床指征時使用抗生素、有效保持口腔衛生,以及有限的清創),而不是積極的手術切除;關于ONJ患者是否停用骨改良藥物,請參考4.1.3。
4.1.4.2 腎毒性
腎功能不全是雙膦酸鹽的常見不良反應之一,早期無明顯癥狀,表現為蛋白尿或管型尿,少數可發展至急性腎衰竭[4]。但骨改良藥物導致腎功能不全的數據多見于多發性骨髓瘤研究,肺癌骨轉移人群鮮有報道。對于年齡>65歲、合并糖尿病、服用非甾體抗炎藥(NSAIDs)或正在進行含順鉑化療的患者應當警惕腎功能不全甚至急性腎損傷的發生[4]。據文獻[42]報道,一般腎功能不全中位發生時間為4.7~5.4個月,當血清肌酐清除率<60 mL/min時,出現急性腎功能不全風險顯著升高。對于腎功能不全患者使用雙膦酸鹽需調整劑量(表2)。因卡膦酸給藥后在腎臟沉積量更少,且易被快速清除,與唑來膦酸相比,可一定程度降低腎毒性風險。RANKL抑制劑(地舒單抗)分子量大于腎小球濾過閾值,幾乎不經腎臟消除。因此,既不需要也不推薦對既存腎損傷患者監測腎功能和調整劑量。
4.1.4.3 低鈣血癥
不同骨改良藥物的低鈣血癥發生率有差異,如唑來膦酸發生率為5%~10%,伊班膦酸為1%~10%,地舒單抗為18%。雖然輕度和/或慢性低鈣血癥幾乎沒有癥狀,但重度或急性低鈣血癥會引發抽搐、支氣管痙攣等急癥,甚至危及生命。因此在給予地舒單抗前,有必要常規監測低鈣血癥并將其糾正,甚至預防性補鈣。有證據表明,骨改良藥物服用期間補鈣(含維生素D),可顯著降低低鈣血癥風險[43]。因此,除非有高鈣血癥等禁忌證,推薦使用骨改良藥物的患者額外補充1 000 mg鈣及800~1 200 IU維生素D。
4.2 全身治療
由于絕大多數肺癌骨轉移患者為肺癌晚期,常多發骨轉移灶,為了延長總生存期,同時維持生存質量,晚期非小細胞肺癌(NSCLC)一般需要序貫系統治療和輔助性鎮痛治療,并優先于外科和放療等局部治療[44]。在肺癌的系統性治療中,傳統化療依舊重要,但基于生物標志物的個體化治療和免疫檢查點抑制劑等新策略正逐漸受到重視,并探索出多種聯合治療方案。然而,由于骨轉移的復雜生物學特性和評估困難,并沒有特殊的內科治療藥物能特異性改善骨轉移的療效,減輕SREs的發生,更多的是需要MDT。
4.2.1 化療
無論是小細胞肺癌還是NSCLC骨轉移,均強調綜合治療策略的重要性。傳統化療長期以來一直是標準治療,選擇化療方案時應考慮患者的全身狀況和腫瘤的生物學特性。鉑類藥物為基礎的雙聯方案是此類患者一線化療的主要選擇,可根據患者耐受性和疾病特點調整。
4.2.2 免疫治療
基于生物標志物的個性化療法和免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)為治療提供了新方向,但骨轉移通常不會被列入亞組分析。NSCLC患者在發生骨轉移時,對ICIs的治療反應表現出明顯的復雜性。部分研究[45-46]顯示預后惡化,而有些研究[47-49]發現骨轉移對生存影響不明顯。這種差異可能源于骨的免疫微環境[45,47-49]和骨轉移的生物學差異[50]。但如果ICIs與RANKL抑制劑(地舒單抗)聯合應用時,相比ICIs單藥,抑制晚期NSCLC患者骨轉移的進展效果更優,延長總生存期。
為提升骨轉移相關NSCLC患者療效,綜合運用化療聯合其他治療比如抗血管生成療法、ICIs和骨改良藥物成為趨勢[51]。但骨轉移的獨特性,如特定微環境、評估挑戰以及生物學異質性和PD-L1的動態表達,使治療過程復雜化,目前仍然難以給出前瞻性、個體化的方案。
4.2.3 靶向治療
骨轉移在NSCLC中與多器官轉移、頻繁的復發性突變及復雜基因異常相關。既往文獻[4]報道表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)對骨轉移表現出治療潛力,例如TKIs可以通過調節骨髓基質細胞(BMSC)降低破骨細胞的分化,從而延緩腫瘤骨轉移病灶的骨破壞,進而減少SREs,延長首次SREs時間;但出現骨轉移仍是不良預后的獨立危險因素。現行治療傾向于整合靶向治療、雙膦酸鹽及骨吸收抑制劑來優化治療[4]。
4.2.4 抗血管生成治療
在NSCLC骨轉移的抗血管生成治療研究中,有研究[4]揭示貝伐單抗對NSCLC骨轉移的特異性療效,貝伐單抗組患者的骨轉移反應率和疾病控制率顯著提高。對比先前關于唑來膦酸的研究,含貝伐單抗的化療方案可能對骨轉移反應率更高。
4.3 鎮痛治療
由于骨受累是癌癥相關性疼痛的主要原因之一,也是晚期惡性腫瘤患者出現重度疼痛的主要原因[52]。肺癌骨轉移疼痛的處理應優先采用病因治療、藥物和非藥物協同鎮痛的原則,及早按階梯、個體化給藥,同時預防和控制藥物不良反應。病因治療是指針對肺癌的抗腫瘤治療,非藥物治療包括放療、手術和介入治療等局部治療[53-54]。對于局限性骨痛,可考慮局部放療、神經阻滯術、椎體成形術或經皮消融術等。當骨轉移疼痛局限于一處或少數幾處時,也可以使用外照射的方法[4],具體可參見4.4.1。本小節主要介紹肺癌骨轉移疼痛的藥物治療。
4.3.1 疼痛評估
對于肺癌骨轉移合并疼痛的患者,充分進行疼痛評估是鎮痛治療的前提。癌痛評估應遵循四大原則:常規、量化、全面、動態[55]。常規評估中需特別注意鑒別是否有因病理性骨折或脊髓壓迫等引起的爆發痛。量化評估有數字分級法、主訴疼痛程度分級法、面部表情評估量表法和簡明疼痛評估量表等。
4.3.2 藥物鎮痛
4.3.2.1 非甾體類抗炎藥和對乙酰氨基酚
輕度疼痛優選此類藥物,常見的有阿司匹林、布洛芬和塞來昔布等。對乙酰氨基酚最大用量不宜超過4 g/d。對于局部關節疼痛可外用NSAIDs,如1%雙氯芬酸鈉凝膠,每日4次;或1.3%雙氯芬酸貼劑,1~2片/d。
4.3.2.2 阿片類藥物
阿片類藥物是肺癌骨轉移患者中至重度疼痛的一線鎮痛用藥。阿片類藥物劑量換算及不良反應處理詳見《肺癌骨轉移診療專家共識(2019版)》[4]。這些藥物可預防骨相關事件并提高生存質量。在疼痛得到有效緩解后,應考慮逐步減少或完全終止阿片類藥物的使用。建議采用逐漸減量法,即每日按10%~25%的比例遞減藥物劑量,直至達到日劑量相當于30 mg口服嗎啡的藥量。此劑量水平維持2 d后,方可考慮停止阿片類藥物治療。
4.3.2.3 輔助鎮痛藥
若患者對阿片類藥物的反應欠佳,則考慮聯合輔助鎮痛藥物。骨改良藥物、糖皮質激素(如強的松、地塞米松)、局部麻醉藥(如利多卡因)、抗驚厥類藥物(如加巴噴丁、普瑞巴林)、鎮痛性抗抑郁藥(如度洛西汀、米那普侖)、骨靶向放射性核素藥物[如鍶-89(89Sr) ]等均屬于此類。
骨改良藥物可改善腫瘤骨組織的酸性微環境、遏制骨溶解,并減少鎮痛藥的使用量[56]。因此,如肺癌骨轉移的患者伴有強烈骨痛,我們推薦使用骨改良藥物聯合阿片類藥物。糖皮質激素可能對阿片類藥物難治性骨痛患者有用,特別是神經壓迫的患者。骨靶向放射性核素可用于難治性多灶性骨痛患者,詳見4.4.3。
4.4 放射治療
4.4.1 外照射
外照射是治療單純性骨轉移的標準治療,可使50%~80%的患者疼痛緩解,多達1/3的患者實現疼痛完全緩解。外照射前因進行評估體能狀態評分,并明確骨轉移灶的部位。對于單純骨轉移,美國放射腫瘤學會(ASTRO)和歐洲腫瘤內科學會(ESMO)[57]認為,單次8 Gy方案和分割方案的疼痛緩解效果相同,且可能更方便、性價比更高,即便有的患者需要再次外照射治療。外照射適應證、劑量及分割方式見《肺癌骨轉移診療專家共識(2019版)》[4]。
4.4.2 立體定向放射治療
近年來,SBRT逐漸在臨床普及,相比外照射提高了患者的局部控制率, SBRT對小體積骨寡轉移患者優勢更為明顯,可顯著緩解骨轉移引起的疼痛癥狀[4],尤其是有椎骨轉移。但SBRT也可能會增加椎骨壓縮骨折的風險。因此,SBRT應主要用于期望壽命較長(>6個月),在標準療程外照射后仍有骨痛或骨痛復發,并需要再次照射的患者。
4.4.3 骨靶向放射性核素
骨靶向放射性核素是放射性親骨性分子,目前已獲批用于緩解成骨性骨轉移患者的疼痛。一般來講,骨靶向放射性核素治療更適用于經外照射和/或其他形式治療后仍有疼痛或疼痛復發的多灶性骨痛患者,而不是作為初始治療。
89Sr是常用的放射性核素,能夠發射β粒子,可有效緩解疼痛,緩解率為40%~95%。關于89Sr的適應證、用法用量和禁忌證等見《肺癌骨轉移診療專家共識(2019版)》[4]。此外,鐳-223(233Ra)是一種新型的經靜脈注射的骨靶向放射性同位素,可發射α粒子;目前在前列腺腫瘤骨轉移研究中,總生存情況和首次出現癥狀性SREs的時間均得到改善。但在肺癌骨轉移人群中的療效仍待觀察。
4.5 外科治療
4.5.1 外科治療目的
外科治療主要目的在于緩解疼痛、減輕或避免運動系統功能受損或脊髓受壓引起的一系列并發癥、預防或治療病理性骨折方法、提高生活質量從而間接延長患者生存期,與此同時,通過對手術獲得的骨轉移病灶進行組織學診斷,也可指導后續治療[58]。
4.5.2 外科治療適應證
骨轉移的手術治療通常僅用于有完全性病理性骨折或病理性骨折傾向的病變,并且手術干預應符合治療目標。對于嚴格選擇的晚期癌癥患者,即骨病變是原發部位以外唯一轉移灶的患者,整塊切除轉移灶可使局部腫瘤控制最佳,持久緩解疼痛,并可能延長患者生存期。脊柱轉移導致機械性不穩定時,可考慮手術干預;但除單純性脊柱或胸骨受累的特定患者外,很少進行骨轉移灶的根治性切除。
4.5.3 外科治療的時機選擇
當(1)確診肺癌骨轉移;(2)保守治療后,骨破壞和/或疼痛癥狀仍持續加重;(3)已經出現病理性骨折;(4)保守治療后,運動系統功能仍無法恢復;(5)出現神經壓迫癥狀;(6)脊柱出現不穩定表現,容易發生截癱風險;(7)骨轉移病灶對放、化療均不敏感時,建議采取外科治療干預[59-61]。
4.5.4 不同轉移部位的外科治療
4.5.4.1 長骨轉移
病理性骨折是肺癌長骨轉移瘤最嚴重的并發癥,影響患者的日常活動和生活質量,可導致患者死亡等嚴重SREs。難以忍受的疼痛和病理性骨折是手術的明確指征[62]。長骨以病灶位置不同區分,骨端病灶可選擇行瘤段切除、假體重建;骨干病灶可考慮骨水泥填充內固定或節段假體重建。不同部位長骨轉移瘤的手術方式應進行個體化選擇[63]。若其他治療方式仍無法控制骨破壞,患者存在頑固性疼痛,主要血管、神經受累,廣泛軟組織侵犯,為提高生存質量可采用截肢手術[10]。
4.5.4.2 脊柱轉移
肺癌脊柱轉移瘤手術以姑息性手術為主,手術旨在對脊髓和神經根減壓以及重建脊柱穩定,從而減輕癥狀,提高生活質量,主要分為減壓手術和減瘤手術,具體包括椎板切除減壓術、經瘤椎體切除術、分離手術以及微創經皮椎體成形術等[64-65]。但應避免單純后路椎板減壓術,防止加重脊柱不穩定。
4.5.4.3 骨盆轉移
肺癌骨盆轉移瘤以姑息性治療為主,手術主要目的為最大可能切除腫瘤,減輕疼痛,恢復行走能力,提高生活質量。手術方式多選擇去除腫瘤轉移灶后用甲基丙烯酸甲酯(PMMA,又稱骨水泥)成形。對于尚未累及髖臼的病變,可以選擇植入物或骨水泥強化應力傳導區;累及髖臼者,則可以考慮行全髖關節置換術;對于病變位于恥骨、坐骨等非應力傳導區的病變,可行單純切除術。
4.6 介入治療
癥狀性肺癌骨轉移瘤患者在接受外照射、外科、藥物鎮痛治療后或治療的同時,仍會有部分患者疼痛并未緩解或緩解不充分;或患者的期望壽命有限不適宜外科等其他綜合治療,骨轉移瘤的局部介入治療可有效控制這類患者的局部癥狀,成為系統治療的有力補充。各類介入治療的適應證和禁忌證等見《肺癌骨轉移診療專家共識(2019版)》[4]。
4.6.1 消融治療
臨床上常用的消融治療包括射頻消融、微波消融、冷凍消融以及聚焦超聲。消融治療無外科手術指證的骨轉移瘤安全、有效,可顯著緩解疼痛、預防SREsR的發生,并可持久控制局部腫瘤[66-68]。消融常用于治療肺癌已經進展的骨轉移患者;拒絕放療或者放療后仍有疼痛的患者。在美國國家綜合癌癥網絡(NCCN)癌痛指南中,局部消融現已成為無骨科急癥時轉移性骨痛的推薦治療。此外,姑息性治療中也可使用骨轉移瘤消融治療代替手術,以保留承重骨的功能或防止其發生病理性骨折。
4.6.2 經皮骨成形術
既往,經皮骨水泥成形術僅用于不適合開放手術的患者,但隨著影像學引導下的微創技術的興起,拓寬了經皮骨水泥成形術的應用范圍,常與局部消融治療聯合,作為外科手術的替代方案之一[69] ,適用于各種溶骨性骨原發腫瘤或骨轉移瘤[4]。消融治療使病灶局部凝固性壞死,后續對消融區域進行骨水泥填充,加強了轉移骨(特別是承重骨如椎體)的穩定性和支撐力。經皮骨水泥成形術降低了髖臼周圍骨盆和股骨近端的骨轉移灶的處理難度;在控制疼痛的同時,恢復轉移骨的完整性,是預防SREs的有效方法[70-71]。
4.6.3 近距離治療
近距離放療是將放射源置于需治療區域內部或附近。發出的輻射通常僅在相對較短的距離內有活性,其優點在于可對腫瘤予以大劑量照射,同時減少周圍正常組織的照射劑量。近距離治療可用于緩解常規治療失敗或抵抗后的骨轉移疼痛,可改善疼痛癥狀,腫瘤局部控制良好[72],因其為微創操作,并發癥可控,在臨床中可與骨水泥治療協同應用。我國用于肺癌骨轉移的放射源一般為碘-125。需要注意的是,近距離治療需要侵入性操作,因此必須權衡治療益處與可能產生的并發癥。
4.7 心理支持治療
肺癌患者抑郁患病率是所有惡性腫瘤中發病率最高的[4],因此,有效的心理支持對于肺癌骨轉移綜合干預也是必要的。心理支持主要為心理-社會干預,包括認知-行為學、家庭支持以及CALM(managing cancer and living meaningfully)治療,這些已被證實是緩解痛苦、改善生活質量的有效措施之一。如患者合并焦慮抑郁障礙,可聯合精神藥物治療,特別是重度焦慮抑郁障礙患者。
利益沖突:無。
《中國肺癌骨轉移臨床診療指南(2024版)》編寫委員會名單
主編:支修益(首都醫科大學宣武醫院),王潔(中國醫學科學院腫瘤醫院) ,劉倫旭(四川大學華西醫院)
執筆:趙軍(北京大學腫瘤醫院)
成員(按姓氏漢語拼音排序) 曹寶山(北京大學第三醫院),陳麥林(北京大學腫瘤醫院),丁凱(天津醫科大學總醫院),段建春(中國醫學科學院腫瘤醫院/中國醫學科學院腫瘤醫院山西醫院),龔敬(復旦大學腫瘤醫院),郭銳(北京大學腫瘤醫院),胡牧(首都醫科大學附屬北京友誼醫院),胡攀攀(北京大學第三醫院),李東(北京京西腫瘤醫院),李琳(北京醫院腫瘤內科),李囡(北京大學腫瘤醫院),李曉燕(首都醫科大學附屬北京天壇醫院),劉玉良(北京大學腫瘤醫院),柳晨(北京大學腫瘤醫院),牛曉輝(北京積水潭醫院),潘峰(北京大學人民醫院),石安輝(北京大學腫瘤醫院),孫昆昆(北京大學人民醫院),唐麗麗(北京大學腫瘤醫院),唐威(中國醫學科學院腫瘤醫院),萬蕊(中國醫學科學院腫瘤醫院),王靜靜(北京大學腫瘤醫院),王娟(北京大學首鋼醫院),韋峰(北京大學第三醫院),徐蔚然(首都醫科大學附屬北京天壇醫院),易福梅(北京大學第三醫院),張建新(中國醫學科學院腫瘤醫院山西醫院/山西省腫瘤醫院醫學),周舒暢(華中科技大學同濟醫學院附屬同濟醫院),周永[ 新疆醫科大學第三臨床醫學院(附屬腫瘤醫院)],朱翔(北京大學醫學部/北京大學第三醫院)
成員參與專家(按姓氏漢語拼音排序)
陳軍(天津醫科大學總醫院),姜格寧(同濟大學附屬上海肺科醫院),馬少華(北京大學腫瘤醫院),王長利(天津市腫瘤醫院),楊躍(北京大學腫瘤醫院),張蘭軍(中山大學腫瘤防治中心)