本文采用德爾菲法更新了《中國經導管主動脈瓣置換術臨床路徑專家共識(2021版)》,通過檢索近4年PubMed、中國知網及萬方數據庫經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)臨床路徑相關的證據,在TAVR團隊的構成與臨床評估、圍術期影像學評估、手術過程、患者圍術期及遠期管理4個方向提出了35個核心觀點。具體更新點包括:細化TAVR團隊的職責與構成,明確臨床評估的步驟與內容;強調CT在圍術期影像學評估中的核心地位,并介紹了人工智能、數值仿真及3D打印等新技術的應用;優化TAVR手術流程,包括麻醉選擇、入路建立、瓣膜選擇及釋放等關鍵環節;提出針對特殊類型患者(如急診TAVR、簡化TAVR、單純主動脈瓣反流、合并冠狀動脈粥樣硬化性心臟病及心房顫動等)的管理策略。此外,共識還強調了術后隨訪和康復的重要性,并提供了詳細的抗血栓及康復指導。本共識的更新將進一步推動我國TAVR技術的規范發展,提升臨床治療效果。
引用本文: 中國醫師協會心血管內科醫師分會結構性心臟病學組, 亞太結構性心臟病俱樂部. 中國經導管主動脈瓣置換術臨床路徑專家共識(2024版). 中國胸心血管外科臨床雜志, 2024, 31(12): 1713-1727. doi: 10.7507/1007-4848.202410009 復制
近3年來,經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)領域在循證證據、應用經驗、指南更新、器械研發、術式改良等方面陸續取得重要進展。為進一步契合最新證據經驗,推進我國TAVR治療技術規范、安全、穩步發展,我們檢索最新文獻,依據德爾菲方法,更新了2018和2021版TAVR臨床路徑專家共識[1-2]。方法參考2021版共識[2]。
1 TAVR團隊的構成與臨床評估
1.1 TAVR團隊的構成
核心觀點1:TAVR團隊是一個由多學科組成的綜合管理團隊,負責術前評估、手術策略制定、手術實施及術后全病程管理。
一個完整的TAVR團隊包括心血管內科醫師、影像評估醫師、心臟瓣膜病介入醫師、心血管外科手術醫師、重癥監護室醫師、麻醉科醫師、導管室技術人員、護理及康復管理人員等[3-4]。TAVR團隊需要完成患者術前評估、制定手術策略并評估其可行性、實施TAVR并進行圍術期管理以及術后全病程管理。
1.2 臨床評估
核心觀點2:臨床評估是以患者主動脈瓣疾病干預指征為核心的臨床綜合評估,其重點包括TAVR的適應證、手術方式選擇及禁忌證三大步驟。內容包括主動脈瓣疾病癥狀及嚴重程度評估、臨床基線數據的采集、心血管相關合并癥的評估、非心血管相關合并癥的評估、老年綜合評估、神經系統功能評估和無效性評估。
瓣膜置換的適應證和預期獲益主要通過評估患者超聲心動圖及臨床癥狀,確定主動脈瓣疾病的嚴重程度及風險分期,從而確認干預時機及獲益[2,5]。在手術方式選擇方面,外科風險評分不再是衡量主動脈瓣疾病治療方式的獨立指標,而是綜合考慮患者臨床情況、解剖特點、手術意愿以及預期壽命等因素,由心臟綜合管理團隊決策。禁忌證評估方面則需要根據患者臨床資料的全面采集了解有無急性心肌梗死、流出道梗阻、左心血栓形成或解剖不適合TAVR的情況,同時還需進行無效性評估,考量術后預期壽命及生活質量改善的可能[2,6-9]。
1.3 TAVR的適應證和禁忌證
核心觀點3:近年來TAVR指南更新的重點是適應證的拓展和干預方式的轉變,強調干預方式選擇依賴于臨床評估團隊和根據患者個體化的臨床和解剖特點共同決策[2]。
1.3.1 TAVR的絕對適應證
主動脈根部及入路解剖結構符合TAVR(特別是經股動脈TAVR)要求且預期壽命>1年。
(1)年齡≥70歲,有下列情況之一:
① 重度主動脈瓣狹窄(aortic stenosis,AS)患者有AS導致的如下臨床癥狀:運動性呼吸困難、心力衰竭、心絞痛、暈厥、既往或運動試驗時暈厥先兆。
② 運動試驗可以誘發癥狀或血壓下降的無癥狀重度AS患者。
③ 無癥狀的重度AS,左心室射血分數(left ventricular ejection fraction,LVEF)<55%(無其他誘因導致的左心室收縮功能不全)。
④ 無癥狀的重度AS,LVEF>55%,運動試驗結果正常,干預風險低且具備以下條件之一:極重度AS[平均壓差≥60 mm Hg(1 mm Hg=0.133 kPa)或最大峰值流速>5 m/s];重度瓣膜鈣化(經CT評估)且最大峰值流速進展≥0.3 m/(s·a);經重復檢測確認無其他誘因的B型利鈉肽顯著升高(大于經性別、年齡校正的正常值的3倍)。
(2)年齡<70歲的重度AS患者,存在外科手術禁忌或高危,或存在其他危險因素,如胸部放射治療后、肝功能衰竭、主動脈彌漫性嚴重鈣化、極度虛弱等[2]。
(3)外科主動脈生物瓣膜毀損。
1.3.2 TAVR的相對適應證
(1)年齡60~69歲的患者,滿足1.3.1 TAVR的絕對適應證(1)中的條件之一,經過臨床團隊綜合評估認為更適合行TAVR手術。
(2)二葉式重度AS患者滿足上述條件之一,可在有經驗的中心(年手術量≥50例)或術者(年手術量≥25例)中開展。
(3)有癥狀的重度單純主動脈瓣反流(pure aortic regurgitation,PAR)患者,外科手術禁忌或高危,預期治療后能夠臨床獲益,解剖特點經過充分評估適合TAVR,可在有經驗的中心(年手術量≥50例)或術者(年手術量≥25例)中開展[10]。
(4)無癥狀的重度PAR患者,外科手術禁忌或高危,預期治療后能臨床獲益,解剖特點經過充分評估適合TAVR,需滿足下述條件之一:左心室舒張末期內徑>70 mm;左心室收縮末期內徑>50 mm;左心室收縮末期內徑指數>25 mm/m2;LVEF≤55%,可在有經驗的中心(年手術量≥50例)或術者(年手術量≥25例)中開展。
1.3.3 TAVR的禁忌證
TAVR的禁忌證參考2021版共識[2]。
2 TAVR圍術期影像學評估
核心觀點4:TAVR圍術期影像學評估中術前評估最為關鍵。CT是評估主動脈根部及入路解剖結構和鈣化的最重要手段,特定情況下超聲心動圖、心臟磁共振成像(cardiac magnetic resonance,CMR)、造影等檢查方式可以達到協同或替代評估作用。人工智能分析、數值仿真及三維(three dimension,3D)打印等新技術未來可能成為TAVR圍術期評估的重要補充(表1)。
2.1 CT評估
核心觀點5:CT在TAVR術前評估、術中指導以及術后隨訪中處于核心地位,是術前人工瓣膜及入路選擇的影像“金標準”[2],推薦心電門控全時相CT血管造影(CT angiography,CTA)掃描作為主動脈根部解剖評估的重要手段。
TAVR術前CT檢查圖像采集需評估患者心臟腎臟功能以及相關用藥,盡量采用64排及以上CT掃描設備。檢查應包括3個方面內容:(1)心電門控非增強CT掃描;(2)心電門控全時相CTA掃描;(3)大范圍非心電門控螺旋CTA掃描,掃描范圍及重建參數需特別關注(表2)。對比劑注射流率及總量的確定需綜合考慮選用的對比劑濃度、管電壓、設備掃描速度、患者靜脈血管條件、患者體重、心腎功能狀態等因素。TAVR術前CTA檢查需立刻評價圖像質量及掃描完整度,如圖像質量或完整度不足以滿足TAVR術前規劃的相關評估要求,則需要進行二次檢查或補充掃描[11]。
術前測量評估:需要有經驗的影像核心實驗室對CT圖像通過專業軟件進行分析,主要觀察主動脈根部和入路的形態學特征,其中主要包括瓣葉分型、鈣化情況、主動脈瓣環上下相關解剖徑線、冠狀動脈開口、左心室、入路血管管壁鈣化程度、管腔狹窄程度及走行迂曲程度、合并嚴重的主動脈病變(動脈瘤、夾層及閉塞等)等指標[12-13]。
核心觀點6:術者需要熟練掌握CT影像評估方法并對結果進行充分解讀及個體化分析,可根據圖像結果識別解剖難度、評估風險并制定正確的手術策略[2]。
術中、術后CT評估:通過CT可對導絲跨瓣及最佳釋放角度進行預測,以減少術中X線的輻射劑量及對比劑的使用并精確指導釋放深度及位置,對于解剖結構復雜及單純反流患者選擇合理的投照角度尤為重要[2]。術后通過主動脈根部CT可判斷TAVR瓣膜置換位置及深度、瓣架膨脹程度及圓度,對功能區嚴重膨脹不良或橢圓率較高的患者可考慮再次進行經導管球囊擴張成形術治療。同時術后CT可觀察聯合部錯位程度及冠狀動脈開口是否受到人工瓣膜縫制區或外裙邊遮擋,評估冠狀動脈通路通暢性及再介入可行性[14]。通過舒張期及四維(four dimension,4D)CT動態觀察瓣葉,可了解有無異常瓣葉增厚或血栓形成來評價器械遠期效果或制訂抗凝抗栓策略。目前高分辨率4D CT是診斷TAVR瓣膜血栓形成的金標準,主要影像學特征是不同程度的低衰減瓣葉增厚征和瓣葉運動減弱[2]。
核心觀點7:建議TAVR術后半年內常規行全時相CT掃描,評價瓣膜置換效果、位置、冠狀動脈再介入可行性及血栓情況,制定合理抗栓方案。
2.2 超聲心動圖評估
核心觀點8:超聲心動圖主要評價主動脈瓣病變的嚴重程度、其他瓣膜和心臟功能及圍術期并發癥,是圍術期影像評價的重要手段。
術前評估、術中監測及術后隨訪的方法及要點參考2021版共識[2]。
基于目前TAVR適應證向外科低危患者拓展,人工生物瓣膜耐久性成為術后評價的重要指標。瓣膜學術聯盟-3標準[15]所提出的生物瓣膜功能障礙分為結構性瓣膜退化、非結構性瓣膜功能障礙、臨床瓣膜血栓形成或心內膜炎。其中結構性瓣膜退化被定義為人工瓣膜發生的內在性永久性變化,包括磨損、瓣葉破損、瓣葉連枷、瓣葉纖維化和/或鈣化、支架斷裂或變形;非結構性瓣膜功能障礙被定義為人工瓣膜本身以外的任何因素導致的瓣膜功能障礙。
核心觀點9:生物瓣膜功能障礙嚴重程度的主要衡量指標為跨瓣壓差絕對值升高、跨瓣壓差較前進展、有效瓣口面積減少以及多普勒速度指數減少等(表3),作為術后超聲心動圖隨訪評價瓣膜耐久性的重要指標,需特別關注。
2.3 人工智能分析、數值仿真及3D打印技術
核心觀點10:人工智能及3D打印等影像學新技術應用于TAVR患者影像學分析,可輔助提升評估的精準性和效率、縮短術者的學習曲線,有望進一步降低手術并發癥風險,成為TAVR術前評估的重要手段[16]。
基于人工智能的TAVR術前評估:通過導入高質量CTA影像至分析系統,自動完成主動脈根部多目標精細分割與3D重建,自動識別瓣葉分型、竇底及冠狀動脈開口,精確定位關鍵解剖結構并測量,同時動態評估鈣化斑塊,輔助術者精準規劃手術方案,提升手術成功率。
基于人工智能TAVR術后評估:通過對瓣膜支架的高精度分割、去偽影操作和逐層的全自動形態學指標定量評估,能夠精準評價支架膨脹程度和效果,為復盤手術過程、優化手術策略、改進器械設計提供重要參考依據。
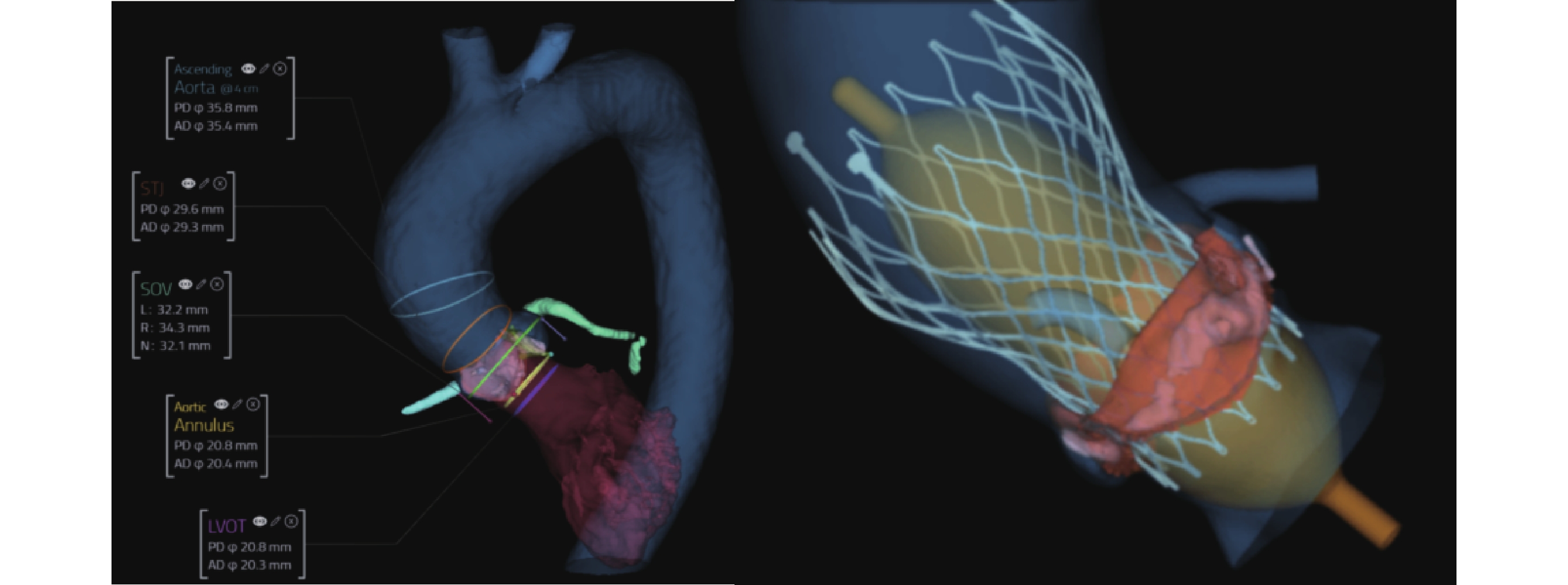
TAVR手術數值模擬仿真及3D打印技術:TAVR數值模擬仿真可以根據患者解剖特點,通過計算機數值模擬不同尺寸和類型支架的置入效果,選擇最優瓣膜型號和釋放位置,分析并發癥風險(圖1)。3D打印技術通過CT構建3D模型進行仿真與體外模擬,優化手術策略與效果[17-18]。利用3D打印具有內部傳感器的主動脈根部模型模擬TAVR,可以映射出施加在主動脈根部關鍵區域的壓力,判斷介入瓣膜錨定的穩定性、傳導阻滯風險等問題[19]。同時,3D打印模型還可通過4D MR技術識別并量化TAVR術后瓣周漏,助力瓣周漏檢測與量化[20]。而水凝膠瓣膜與熔融電鑄技術制造的高度可調且空間異質性的纖維管狀支架是目前3D生物打印的前沿方向[21-22]。
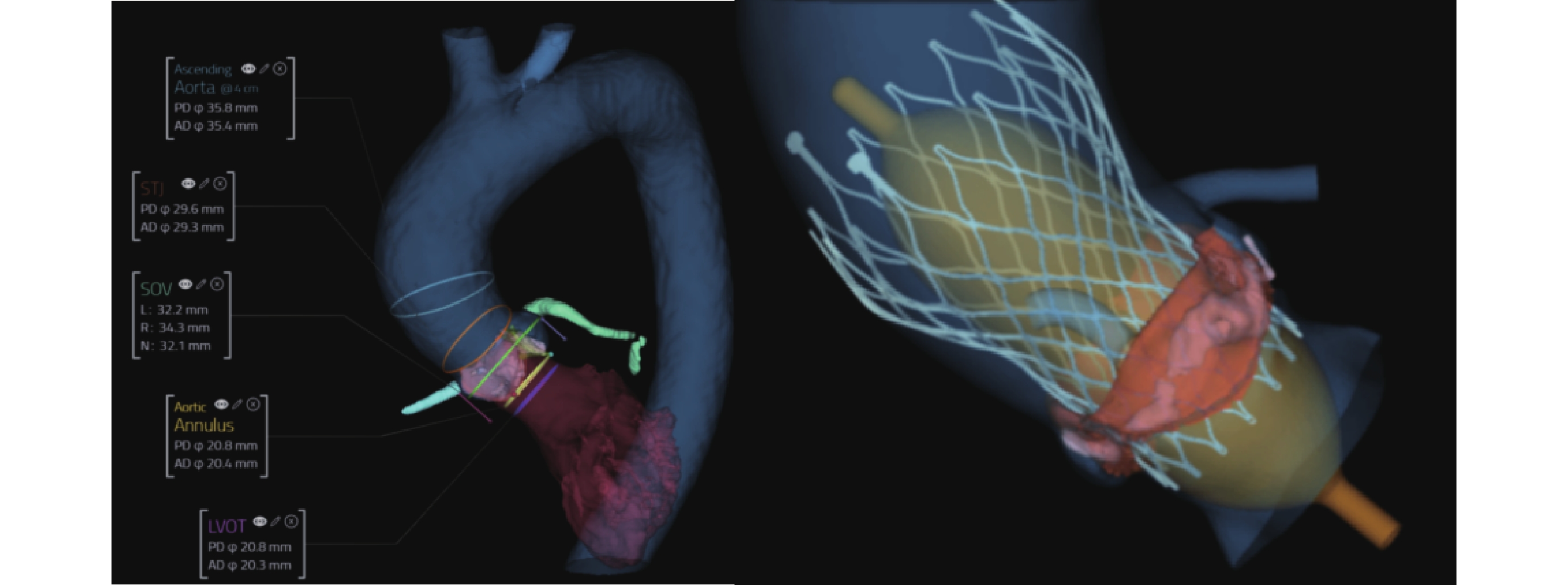 圖1
人工智能分析主動脈根部及經導管主動脈瓣置換術數值模擬仿真效果
圖1
人工智能分析主動脈根部及經導管主動脈瓣置換術數值模擬仿真效果
Ascending Aorta:升主動脈;STJ:竇管交界;SOV:瓦氏竇;LVOT:左心室流出道;PD:周長衍生直徑;AD:面積衍生直徑;Aortic Annulus:主動脈瓣環;L:左冠竇;R:右冠竇;N:無冠竇
2.4 CMR評估
核心觀點11:在TAVR術前評估中,CMR可在特定條件下作為CT的合理替代方案。
CMR可精確測量主動脈根部的尺寸和形態,幫助確定解剖適應證并制定手術策略及器械選擇,同時無創地評估從主動脈根部到外周血管的解剖結構,幫助選擇最佳導管路徑,減少術中并發癥。其避免對比劑和輻射、對心功能和心肌纖維化疤痕組織評估能力強等特點具有一定優勢和臨床應用價值[23]。
3 TAVR的手術過程
3.1 場地及器械準備
核心觀點12:完整的多學科團隊和完善的雜交手術室是TAVR手術的最好保障,但隨著技術的發展和熟練程度的增加,各中心根據醫院條件、團隊配備情況在保障手術安全順利的情況下,因地制宜地在導管室采用簡化TAVR是可以推薦的。需根據術前評估方案及患者個體化需求充分準備好手術器械。
3.2 麻醉準備與選擇
核心觀點13:充分的麻醉術前準備非常必要,應根據患者狀況采用不同的麻醉方式。
麻醉方式包括:局部麻醉、鎮靜或監護麻醉、全身麻醉。患者本身、術者和麻醉醫師、TAVR入路是決定TAVR麻醉方式選擇的主要因素,其中入路是最主要的因素[24-27]。經股動脈入路TAVR建議優選鎮靜或監護麻醉方式,對于特殊入路、危重患者及各中心早期開展階段可選擇全身麻醉。
3.3 入路選擇和建立
核心觀點14:股動脈入路是TAVR最主要的入路,90%以上患者可以選擇股動脈入路。對于股動脈,如無鈣化,一般置入鞘管外面積可以超過血管面積20%~30%。在我國,頸動脈、鎖骨下動脈(腋動脈)途徑已成為僅次于股動脈途徑的常用外周血管入路。
經股動脈入路的方法參考2021版共識[2]。其他入路建議需有血管外科或心臟外科支持,并且在經驗較為豐富且具備完善心臟團隊的TAVR中心來完成,具體入路也需要依據器械特點、患者解剖情況,由心臟團隊討論后決定[28-29]。近期,國內開始嘗試All in one技術,應用單支血管入路完成經股動脈TAVR治療[30-32]。
3.4 瓣膜選擇
核心觀點15:進行瓣膜選擇時應結合術前CT綜合評估結果,如瓣膜分型、瓣膜鈣化分布、冠狀動脈堵塞風險、永久起搏器植入可能性、瓣環破裂風險、生物瓣膜不匹配等,并根據患者血管入路情況和人工瓣膜特性,做到個體化選擇,必要時結合術中球囊擴張的結果[2]。
目前中國大陸共有8款經股動脈入路的TAVR瓣膜、1款經心尖入路的TAVR瓣膜上市,包括球囊擴張式瓣膜、自膨脹式瓣膜兩大類,其中已有4款升級為可回收系統。數款針對PAR的經股動脈途徑瓣膜已經完成臨床試驗,即將應用于臨床。
3.5 腦保護裝置的使用
核心觀點16:TAVR術前完善腦血管和神經系統功能評估,對于高危栓塞風險患者,與神經內外科及血管外科專家共同制定治療策略,并推薦使用腦保護裝置。
TAVR術后高危栓塞風險包括既往腦卒中史、高齡、新發心房顫動、冠狀動脈粥樣硬化性心臟病(冠心病)史、外周血管病史、術中反復球囊擴張、心臟瓣膜移位、高流速高壓差等因素[15]。現有研究表明TAVR期間應用腦保護裝置安全性高,但其臨床結果仍需更多研究證實。
3.6 瓣膜置換前的準備
核心觀點17:瓣膜置換前應基于臨床和影像評估結果合理制定手術方案。包括臨時起搏電極植入、跨瓣角度的選擇以及跨瓣導絲的操作、瓣膜釋放角度的判定、球囊預擴張方案、瓣膜類型及型號選擇和可能出現的并發癥以及處理預案。
臨時起搏電極植入:TAVR術中的臨時快速起搏用于球囊擴張或瓣膜釋放過程中減弱心臟搏動幅度以減少球囊或瓣膜移位[2]。左心室導絲起搏技術的應用逐漸增加[33],但對于高風險患者仍建議傳統起搏方式,必要時TAVR術后留置臨時起搏電極24~48 h[34]。經頸靜脈或鎖骨下靜脈置入心室主動電極,不僅可以滿足術中起搏需要,必要時還可以橋接到過渡性永久起搏器技術以延長觀察時間、有利于患者早期活動[35]。
跨瓣角度的選擇以及跨瓣導絲的操作:術前通過CT可幫助選擇最合適的跨瓣角度及優先透視角度。跨瓣的核心步驟是逐步有序地調整導管軸向及高度,操作導絲頭端跨過瓣口,及時更換不同指引導管進行嘗試[2]。對于跨瓣困難的患者,也可采用經房間隔和經心尖穿刺后順行跨瓣后抓捕導絲建立軌道。
瓣膜釋放角度的選擇:術前通過多排CT對器械釋放角度進行預測,結合術中主動脈根部造影,確定瓣膜最佳釋放角度,常用方法包括右竇中心位、左右竇重疊位(Cusp-overlap)及雙S曲線技術[2]。若存在特殊結構關注點或風險,例如存在冠狀動脈堵塞風險時可選擇冠狀動脈切線位造影觀察。對于二葉式主動脈瓣患者,最理想角度通常為平行于交界區連線的方向(雙竇展開位),無論采取何種方法,均需要打齊瓣環平面。
球囊預擴張:術前應根據CT評估瓣環及瓣上結構徑線和患者心功能及臨床狀態來選擇合適的球囊型號,同時應考慮是否有球囊擴張時觀察球囊腰部及根部造影反流量、評估冠狀動脈閉塞風險的需要進行型號調整。對于瓣葉重度鈣化、瓣葉交界粘連、二葉式主動脈瓣的AS患者,建議球囊預擴張,但盡量避免多次球囊預擴張。球囊擴張前充分考慮可能發生的風險,準備好應對措施。
3.7 瓣膜的輸送、定位及釋放
核心觀點18:瓣膜輸送時,應特別關注跨越主動脈弓和主動脈瓣這兩個位置的過程。不同瓣葉結構類型和瓣膜型號對起始定位的高度要求有所不同,應從術前CT分析中確定TAVR瓣膜的錨定區和封堵區[2],決定起始位置及優選釋放位置。
瓣膜輸送的操作要點見2021版共識[2]。二葉式主動脈瓣大多數需要高位釋放,其瓣膜的錨定區多數是瓣上結構;而對于三葉式主動脈瓣,多數的錨定區在瓣環到流出道之間,一般選擇標準位釋放。瓣膜釋放過程中可能需要應用快速起搏,根據瓣膜類型以及釋放策略不同,起搏頻率常規120~220次/min[2]。
3.8 瓣膜置換后的評估
核心觀點19:術后應觀察血流動力學情況,通過超聲心動圖和主動脈根部造影評估瓣膜的位置及反流情況,同時觀察二尖瓣、左心室功能以及術中并發癥[2]。
TAVR術后瓣膜反流的評估:TAVR術后的瓣膜反流根據其位置分為中心型反流以及瓣周漏。瓣周漏與嚴重鈣化、瓣環偏心、瓣膜尺寸過小、瓣膜置入過深等原因相關。
瓣周漏的評估應該建立綜合評估體系:
(1)造影評估:根據左心室內對比劑相對密度評估反流程度,初篩反流,粗估反流總量,但不能評估反流數目、位置、方向。根據Selles分級標準,分為4個等級:Ⅰ級:無反流;Ⅱ級:輕度反流:造影劑進入左心室流出道及中部,經過1次心搏即可排除;Ⅲ級:中度反流:造影劑進入整個左心室,1次心搏不能完全清除,經過數次心搏后顯影變淡;Ⅳ級:重度反流:整個左心室及主動脈均勻顯影,1次心搏后仍保持。
(2)Sinning和Hasan主動脈瓣反流指數(aortic regurgitation index,ARI)作為評估指標:ARI=(主動脈舒張壓?左心室舒張末期壓力)/主動脈收縮壓×100,或ARI=(主動脈舒張壓?左心室舒張末期壓力)/心率×80。ARI與反流程度呈負相關,ARI<25患者術后1年病死率是ARI>25患者的2.9倍,故ARI閾值定為25,作為判斷瓣周漏是否需要采取進一步治療的評估依據。
(3)超聲心動圖多普勒評估:TAVR術后超聲心動圖評估時需要盡可能將患者血流動力學控制在較穩定的范圍內,新發快速心律失常可影響瓣周漏判斷,必要時可使用藥物干預。計算彩色多普勒反流束的內徑與左心室流出道的比值、胸骨旁短軸切面測量的弧狀反流長度與瓣環長度的比值(無:無彩色反流;輕度:10%以下;中度:10%~30%,重度:>30%)、主動脈舒張期反向血流頻譜。
3.9 TAVR術中常見并發癥的處理
核心觀點20:常見并發癥包括循環崩潰、瓣周漏、瓣膜移位、冠狀動脈閉塞、心肌梗死、腦卒中、血管并發癥、傳導阻滯,需特別關注。
TAVR術中常見并發癥包括[15]:
(1)循環崩潰:循環崩潰常見原因包括術中新發急性主動脈瓣反流、術前心功能低下、冠狀動脈阻塞、難以耐受高頻起搏、瓣環破裂、心臟壓塞、自殺左心室、血管并發癥、急性二尖瓣反流等。術前評估需要甄別循環崩潰的高危患者,采取相應預防和處理措施。
(2)瓣周漏:新一代瓣膜的瓣周漏顯著減少。對于中度以上瓣周漏,需要立即進行糾正,瓣周漏的處理應基于對其病因的正確判斷,如膨脹不良,則應該考慮球囊后擴張;如果瓣膜釋放位置不佳,則應該考慮瓣中瓣;如果由于嚴重鈣化導致瓣膜不能完全貼壁,則應該考慮瓣周漏封堵。
(3)瓣膜移位:瓣膜移位可能導致緊急開胸或再次置入瓣膜。術前影像學評估瓣環及環上結構非常重要,對已發生移位的瓣膜,可嘗試使用抓捕器調整位置。某些病例瓣膜置換后突發臨床癥狀加重或血流動力學惡化需考慮遲發瓣膜移位的發生。
(4)冠狀動脈閉塞及心肌梗死:在術前評估時應特別注意冠狀動脈開口高度、竇部容積、瓣葉增厚及鈣化情況以及人工瓣膜與冠狀動脈開口的關系,術中球囊預擴張同時行主動脈根部造影有助于觀察冠狀動脈灌注情況。預判冠狀動脈閉塞高風險則建議預先冠狀動脈保護,可預埋延長導管、球囊或支架保護冠狀動脈。BASILICA技術可通過撕裂瓣葉來預防冠狀動脈開口阻塞[2]。
(5)腦卒中:腦卒中的預防措施包括充分的術前評估、減少術中操作次數和采用腦保護裝置(表4)。腦保護裝置已被證實安全,其臨床療效需更多循證醫學證據支持。
(6)血管并發癥:血管入路并發癥發生率較高,有時甚至可致命。對可能出現血管并發癥的患者,應積極準備應急處理措施,包括外周血管球囊、覆膜支架等,必要時及時外科切開處理。
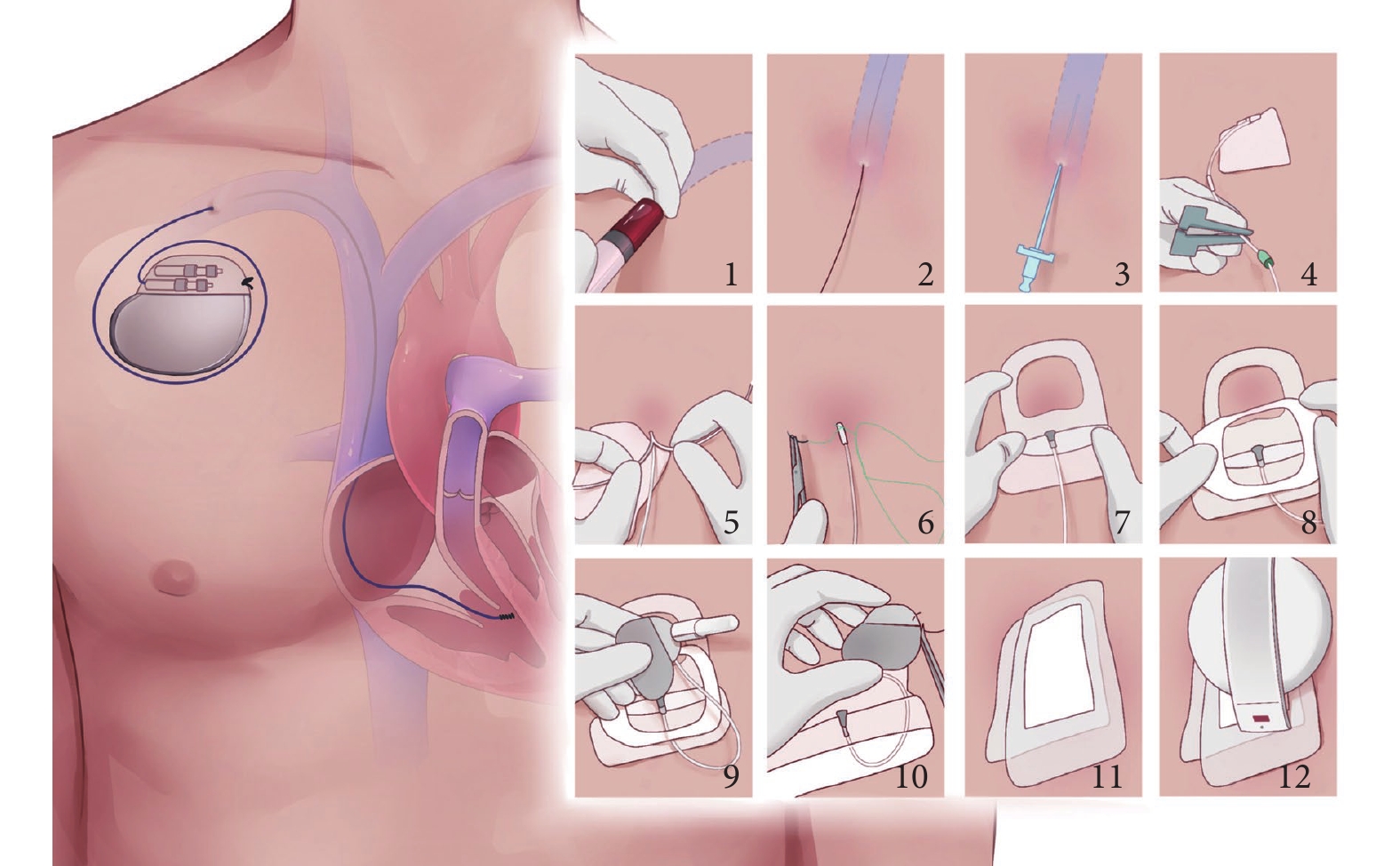
(7)傳導阻滯:TAVR術后傳導阻滯主要與瓣膜架體或導管與傳導系統之間的直接機械相互作用導致的局部炎癥、水腫或缺血相關。術后發生傳導阻滯后植入永久起搏器時機存在較大差異。起搏方式的選擇建議盡量生理起搏。左心室功能降低的患者中,預期右心室起搏要求高(>40%)可考慮心臟再同步化治療。過渡性永久起搏器技術可以降低TAVR術后永久起搏器植入率,降低成本,早期康復,改善患者生活質量(圖2)[35]。
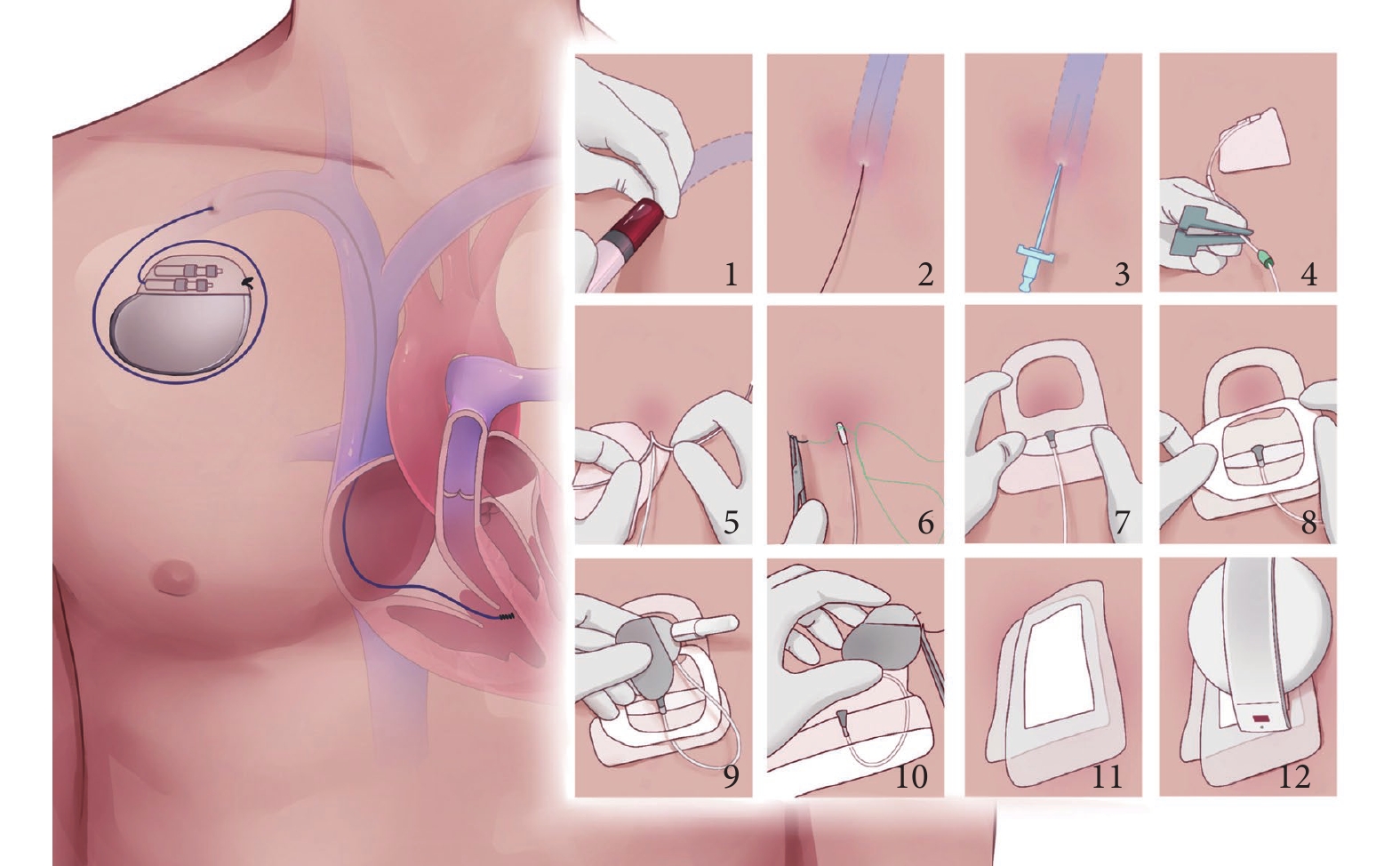 圖2
過渡性永久起搏器技術
圖2
過渡性永久起搏器技術
1:穿刺鎖骨下靜脈或腋靜脈;2:保留穿刺導絲;3:置入7F或8F可撕開鞘管;4:植入心室主動電極至右心室間隔部;5:撕開鞘管;6:用縫線將電極固定在皮膚表面;7~8:無菌敷料覆蓋電極;9:電極尾端連接起搏器脈沖發生器;10:用縫線將起搏器脈沖發生器固定在皮膚表面;11:無菌敷料覆蓋脈沖發生器;12:通過程控儀調整起搏器參數
核心觀點21:其他并發癥包括:(1)心包積液及心臟壓塞;(2)左心室左心房漏;(3)主動脈瓣環撕裂;(4)主動脈夾層、撕裂;(5)二尖瓣功能損傷;(6)感染性心內膜炎;(7)瓣膜血栓;(8)急性腎功能損傷;(9)出血[2]。
3.10 急診TAVR
核心觀點22:對藥物治療反應性差的難治性癥狀性重度AS患者,伴或不伴有血流動力學不穩定,需要最短時間內完成的緊急經導管主動脈瓣球囊擴張或TAVR,定義為急診主動脈瓣球囊擴張術/TAVR。
核心觀點23:急診主動脈瓣球囊擴張術/TAVR適應證包括:(1)心源性休克;(2)合并有持續性室性心動過速或發生心室顫動;(3)藥物難以改善需要器械循環輔助裝置的不穩定性心絞痛或慢性心力衰竭;(4)在TAVR 評估及手術階段出現血流動力學崩潰接受心肺復蘇的患者[2]。
核心觀點24:如果決定使用機械循環輔助裝置,建議在TAVR術前預防性植入,優選體外膜氧合裝置,如不具備條件,可選擇主動脈內球囊反搏裝置。
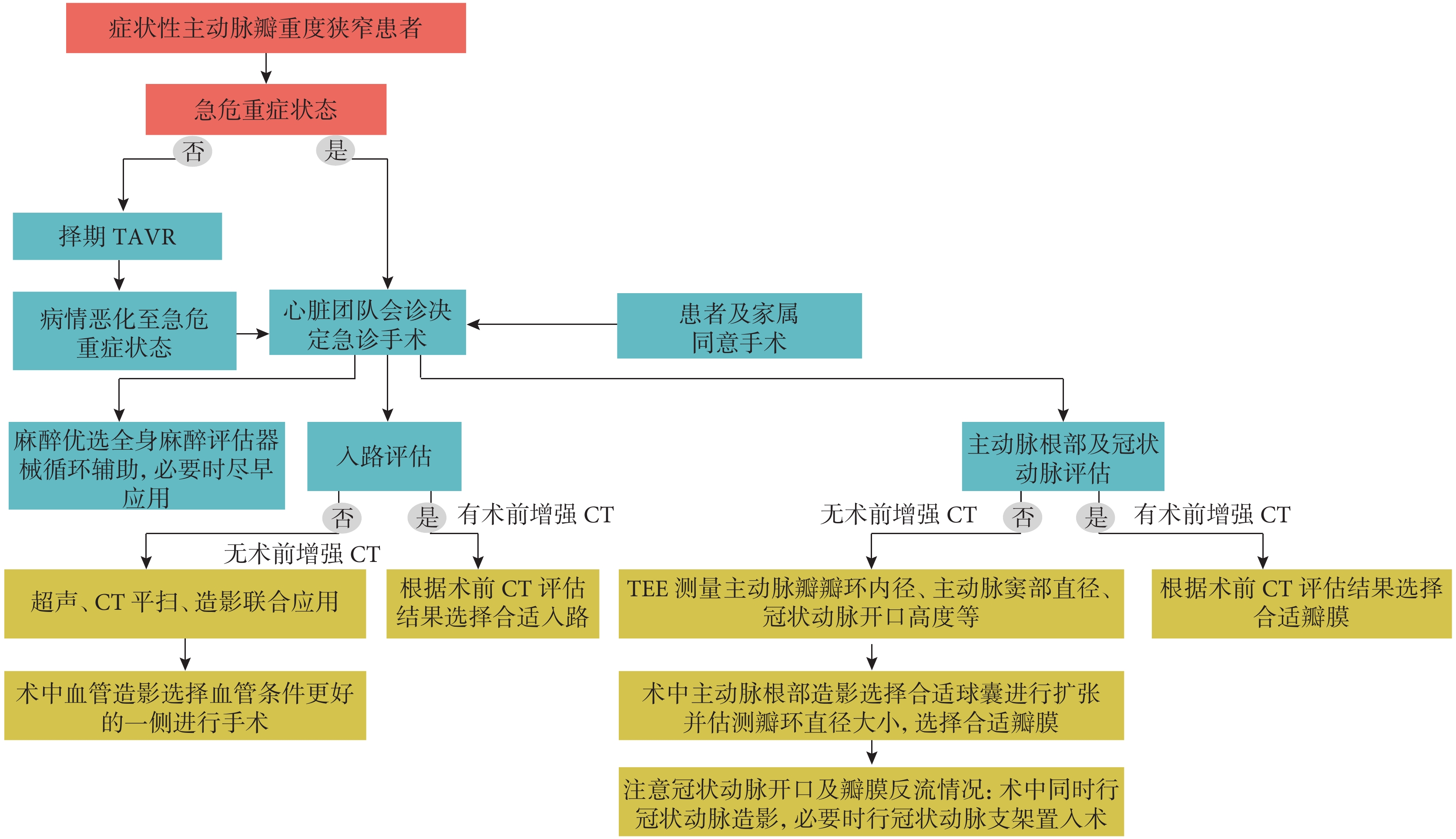
核心觀點25:因病情嚴重無法完善增強CT時,平掃CT、術中3D經食管超聲心動圖(transesophageal echocardiography,TEE)及血管造影的聯合應用對于入路及根部評價有一定作用。
根據目前國內外經驗做出以下建議:(1)首選全身麻醉,根據血管超聲及術中造影結果,優選經股動脈入路;(2)應用TEE評估主動脈根部結構;(3)根據CT和超聲心動圖評估結果選擇預擴張球囊型號,術中預擴張時應特別關注冠狀動脈灌注以及反流量情況,必要時可選擇小球囊序貫擴張,避免大量反流所致循環不穩定;(4)根據術中根部造影和球囊擴張造影選擇人工瓣膜型號;(5)術后建議患者在監護病房進行過渡治療[36-38](圖3)。
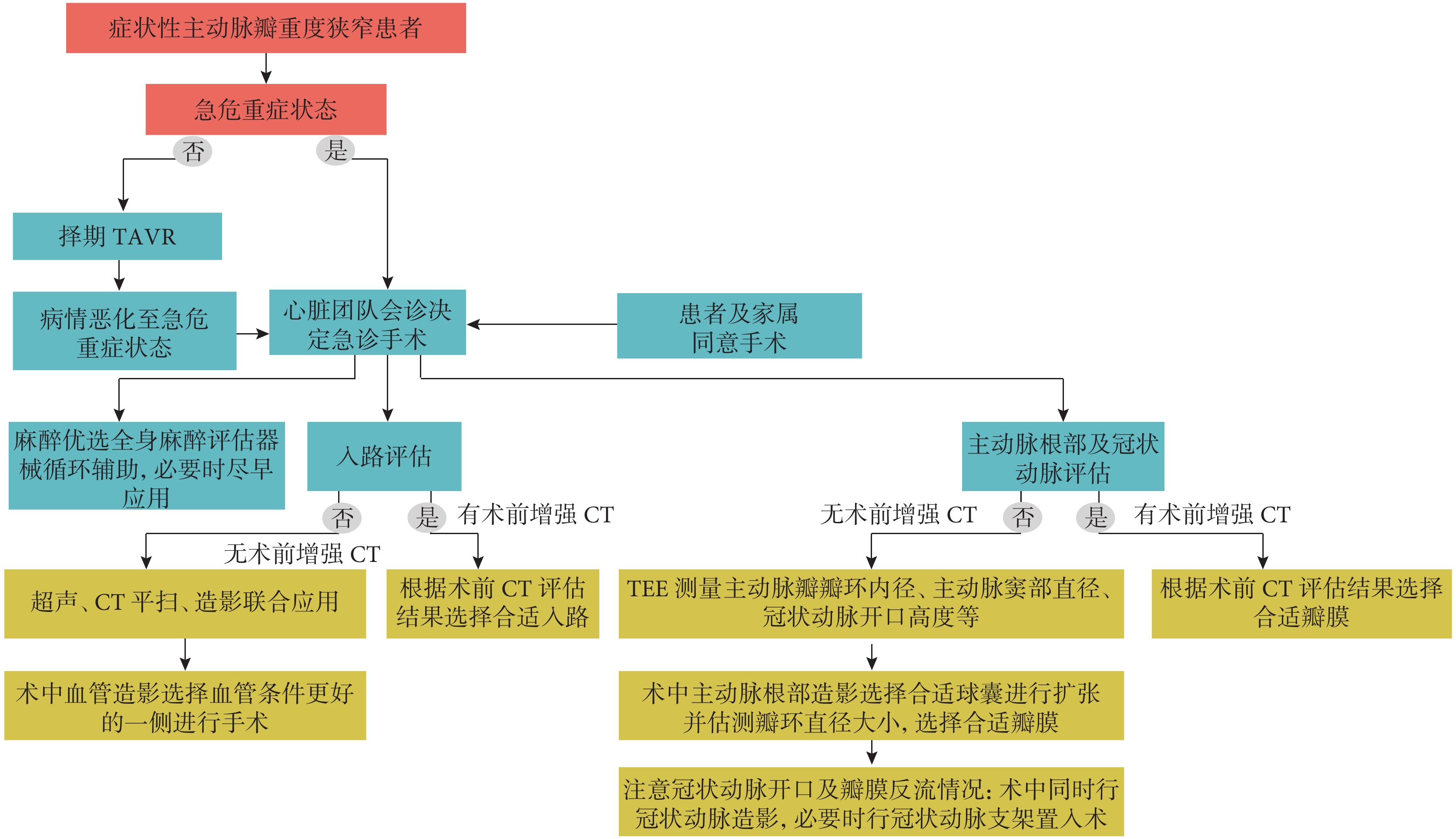 圖3
急診TAVR流程
圖3
急診TAVR流程
TAVR:經導管主動脈瓣置換術;TEE:經食管超聲心動圖
3.11 簡化TAVR
核心觀點26:簡化TAVR的安全性和有效性不遜于傳統TAVR,能夠促進患者早期恢復,縮短住院時間,降低醫療費用。各中心可因地制宜,制定適合本中心的簡化手術方案(表5)。
必須對能夠從簡化手術中獲益的患者進行嚴格篩選,以確保其安全性。簡化TAVR傾向于選擇血管解剖條件合適的低危患者,應遵從個體化原則,篩選標準包括:(1)具備合適的血管入路;(2)冠狀動脈阻塞風險較低;(3)無慢性疼痛;(4)TTE聲窗條件好;(5)可緊急插管;(6)可以平臥。不適宜行簡化TAVR的標準包括:(1)入路血管條件較差;(2)冠狀動脈阻塞風險較高;(3)瓣環破裂風險較高;(4)患者焦慮、術中不能配合;(5)瓣膜大小不確定;(6)患者無法平臥;(7)TTE聲窗差。目前,國內大多數中心采用的簡化TAVR方法包括在導管室進行局部麻醉、穿刺股動脈為主入路、橈動脈作為副入路或All in one技術、左心室導絲起搏、直接瓣膜置入術、減少有創監測和通路、術中采用TTE、鼓勵早期活動、早期出院等[39-42]。
3.12 PAR的TAVR
核心觀點27:我國目前尚無確切主動脈瓣反流患病率的流行病學數據,但現有證據顯示其流行病學規律不同于西方,我國的主動脈瓣反流可能更常見[10]。
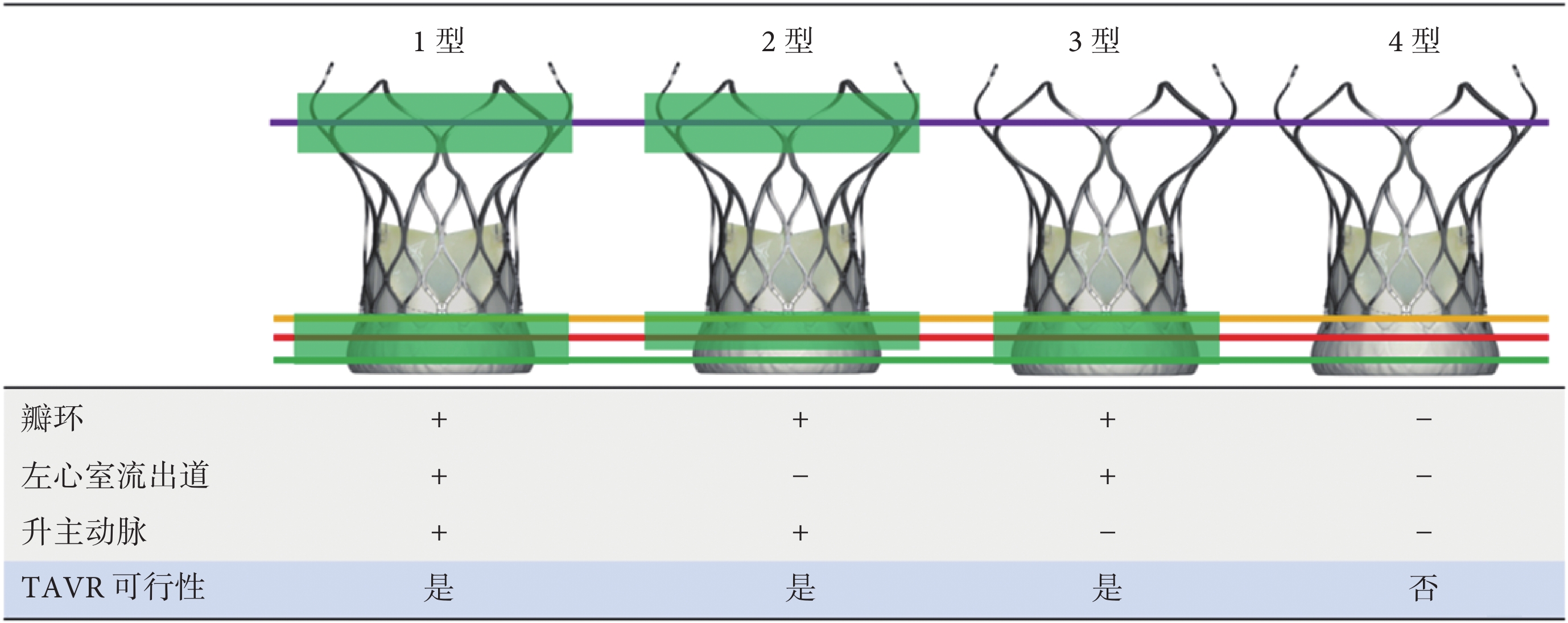
核心觀點28:CT雙錨定多平面測量方案和解剖分型對PAR的TAVR有指導意義。建議人工瓣膜在錨定平面的直徑(周長)超尺寸比率應在10%以上。
目前我國僅有經心尖入路的J-Valve人工主動脈瓣膜被批準用于主動脈瓣反流的TAVR治療,但是多款經股動脈瓣膜已經完成臨床試驗,即將上市。對PAR患者行經股動脈TAVR,超適應證應用時推薦使用可回收的自膨脹式瓣膜,建議術前采用CTA評估患者的解剖,根據CTA分析結果判斷患者是否適合手術,并選擇合適的瓣膜型號[10]。CT雙錨定多平面測量方案和解剖分型對TAVR有指導意義:1型:瓣環、左心室流出道、升主動脈均能錨定;2型:左心室流出道不能錨定,瓣環、升主動脈可錨定;3型:瓣環、左心室流出道可錨定,升主動脈不能錨定;4型:瓣環、左心室流出道、升主動脈均不能錨定(圖4)。術中應以高速心室起搏輔助,快速釋放瓣膜到可回收位置,然后根據情況選擇回收或完全釋放[10,43]。
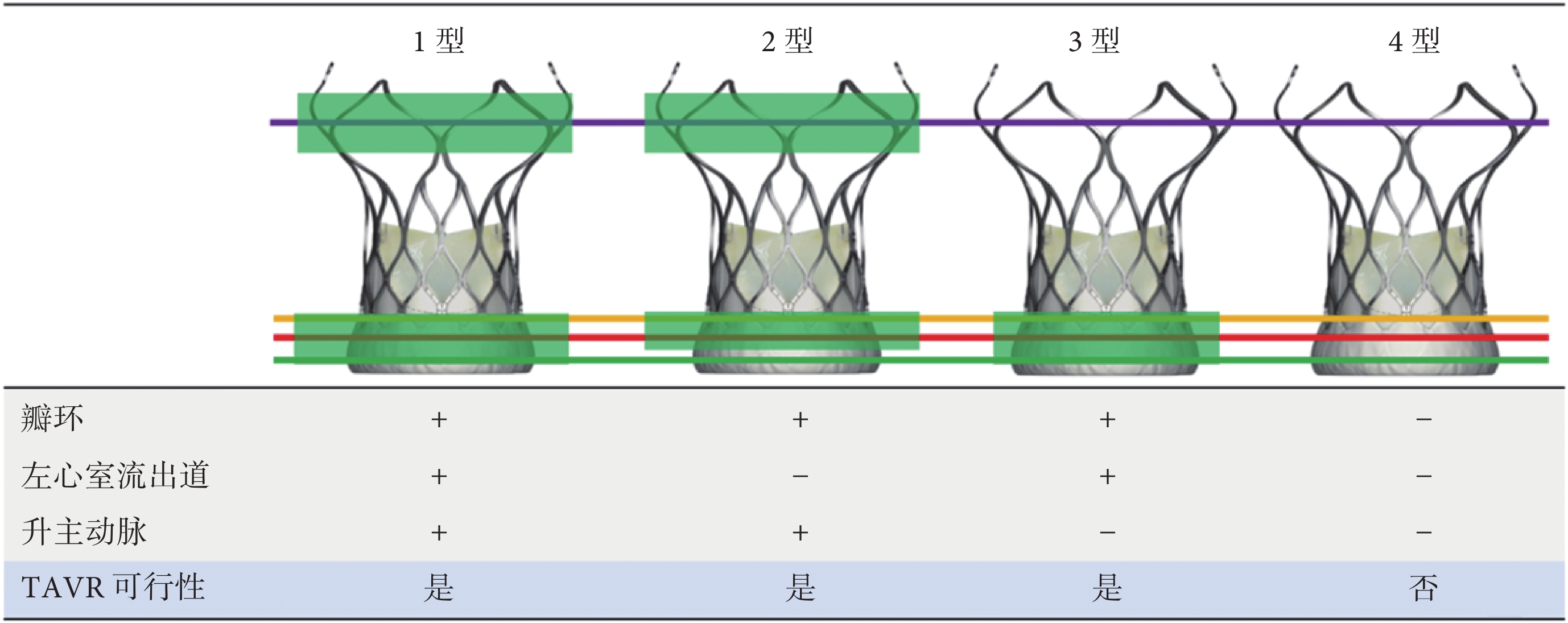 圖4
CT雙錨定多平面測量方案和解剖分型
圖4
CT雙錨定多平面測量方案和解剖分型
TAVR:經導管主動脈瓣置換術;+:能錨定;?:不能錨定
3.13 TAVR合并冠心病的血運重建策略
核心觀點29:重度AS合并冠心病發病率為30%~50%,但是目前關于冠心病是否影響TAVR患者預后的臨床研究結果并不完全一致,而且這些冠心病患者是否均需要血運重建仍存在爭議。
核心觀點30:一站式TAVR+經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)應在有經驗的中心開展,早期應選擇簡單組合進行處理,建議進行預先跨瓣置入豬尾導管。對于合并左主干病變、多個靶病變、需要旋磨以及二葉式主動脈瓣的復雜TAVR+PCI一站式治療的患者,應特別注意基礎心功能及腎功能,避免多個難點進行組合導致手術難度過大、時間過長、對比劑用量過多從而增加風險(表6)。手術過程中對于冠狀動脈病變復雜及基礎心功能狀態不佳患者,應充分評估其麻醉方式及是否需要左心輔助裝置[2,44-48]。
TAVR術前均應進行冠狀動脈影像學評估。國外指南建議冠狀動脈造影仍是大多數TAVR患者進行冠心病評估的主要手段;但冠狀動脈CTA作為TAVR術前冠狀動脈評估的主要初篩手段是可行的,若冠狀動脈CTA提示病變嚴重,則進一步行冠狀動脈造影檢查。嚴重AS患者的冠狀動脈生理學評估的臨床價值需要更多數據支持。指南建議TAVR患者合并冠狀動脈近端狹窄>70%時可采用PCI方式進行干預。PCI相對于TAVR的時間安排應基于患者臨床表現、解剖特征和冠狀動脈病變的復雜性。目前TAVR后進行PCI因冠狀動脈入路難度增加不作為常規推薦。
3.14 AS伴心房顫動的TAVR與左心耳封堵治療(left atrial appendage closure,LAAC)
核心觀點31:LAAC是TAVR合并心房顫動患者重要的腦卒中二級預防手段,對于出血高危患者或術后無法堅持長期抗凝患者可考慮行同期手術。
核心觀點32:盤式封堵器患者可口服氯吡格雷75 mg 1次/d+阿司匹林100 mg 1次/d,半年后改為口服阿司匹林100 mg 1次/d;塞式封堵器患者可口服抗凝+阿司匹林100 mg 1次/d,45 d,45 d后阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d至術后6個月,6個月后阿司匹林100 mg 1次/d持續服用。若患者不能耐受高強度抗栓治療,抗栓方案可根據患者耐受程度降級。術后第45天、6個月時通過TEE或CTA觀察封堵器是否完全封閉左心耳、有無器械表面血栓[49-52]。
TAVR+LAAC的最適人群為心房顫動伴腦卒中高危患者,不能耐受長期抗凝治療或在規范抗凝治療中仍反復發生心源性腦卒中患者。LAAC在TAVR術后進行,推薦TEE/心腔內超聲心動圖(intracardiac echocardiography,ICE)指引下完成LAAC,確保手術安全性和封堵的有效性。患者具備TAVR+LAAC指征,但由于各種原因并未接受LAAC治療(包括經濟原因、個人意愿、患者身體狀況等),TAVR術后因服用抗凝藥導致出血事件發生,或再發心源性腦卒中,除外瓣膜血栓因素后,可考慮再次行LAAC治療。術后抗栓方案尚存在部分爭議,可根據患者腦卒中和出血風險進行個體化策略制定。
3.15 主動脈瓣生物瓣損毀的瓣中瓣技術
核心觀點33:生物瓣損毀是我們即將面對的重要問題,包括在外科毀損瓣中行TAVR治療(TAVR-in-SAVR)及在TAVR毀損瓣中行TAVR治療(TAVR-in-TAVR)的瓣中瓣技術是解決生物瓣毀損的重要方式。
在首次瓣膜置換時即應考慮全生命周期中再次瓣膜置換面臨的問題,冠狀動脈風險和冠狀動脈通路風險以及瓣膜-患者不匹配是要考慮的最重要問題。TAVR-in-SAVR的關鍵步驟參考2021版共識[2]。冠狀動脈閉塞高風險是TAVR-in-SAVR待解決的問題,瓣葉切割技術對原外科瓣膜的瓣葉進行切割,減少冠狀動脈閉塞風險發生。
行TAVR-in-TAVR(Redo-TAVR)時需要特別關注的內容包括:(1)根據首次置入瓣膜類型與型號,評估冠狀動脈風險并選擇第二枚置入瓣膜的類型和尺寸、確定置入瓣膜的位置;(2)充分的CT分析,包括首次置入前后CT影像;(3)Redo-TAVR時,竇隔離是重要的冠狀動脈閉塞風險因素,瓣葉切割技術、Chimney支架技術在Redo-TAVR中效果并不確切且操作困難[53-55]。瓣膜的幾何形狀、瓣架的長度、釋放位置均可以影響新裙邊的高度,應根據患者的個體情況制定相應的手術策略(圖5)。
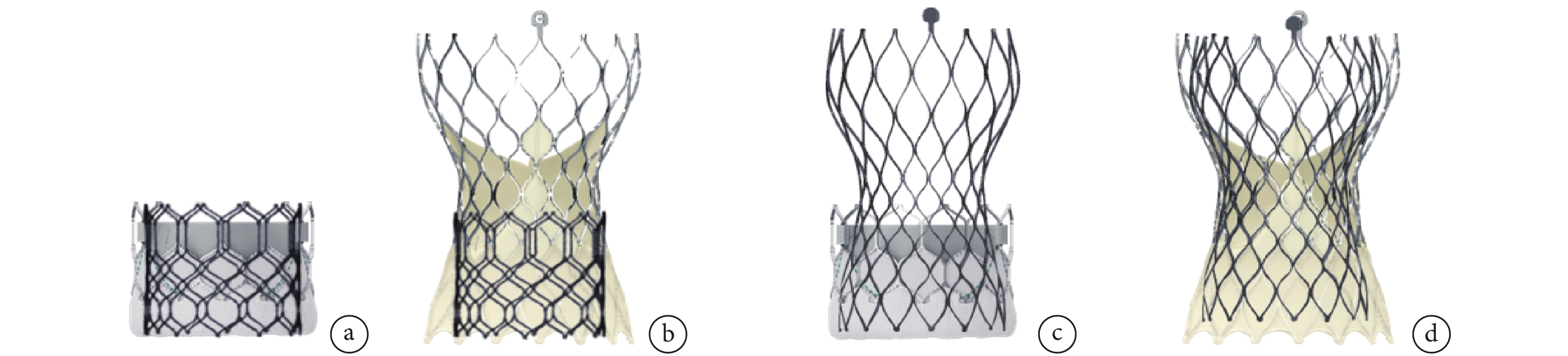 圖5
Redo-TAVR的手術策略規劃
圖5
Redo-TAVR的手術策略規劃
a:短瓣架置入短瓣架;b:短瓣架置入長瓣架;c:長瓣架置入短瓣架;d:長瓣架置入長瓣架;Redo-TAVR:再次經導管主動脈瓣置換術
4 TAVR 患者圍術期及遠期管理
4.1 TAVR患者圍術期管理及隨訪康復策略
核心觀點34:TAVR患者病情復雜、并發癥病情變化快,圍術期管理尤為重要。
核心觀點35:術后隨訪和康復對TAVR患者術后遠期預后和生活質量具有重要作用。
在術后應根據麻醉方式及入路情況,酌情于重癥監護室進行過渡或于普通病房進行治療,需進行精細的循環容量管理,疼痛管理,呼吸系統、神經系統及消化系統的綜合管理[2]。容量管理建議根據患者性別、年齡、體重、疾病特點、術前全身狀況和血循環容量狀態等指標,采取個體化補液方案[56]。TAVR圍術期腦卒中的發病機制復雜多樣,涉及瓣膜置入過程中的機械損傷、血流動力學改變、血栓形成等多個環節,需要遵循標準化流程評估和管理。其他監測重點包括心律變化(起搏器評估)、呼吸道感染、穿刺點出血、急性腎損傷、譫妄、心臟結構并發癥及瓣周反流等[2](詳見本文“3 TAVR的手術過程”)。
術后抗栓方面:對于有抗凝適應證者(如心房顫動、血栓栓塞等),建議長期應用口服抗凝藥物,對于合并急性冠狀動脈綜合征和近期PCI患者可酌情加用單種抗血小板藥物;對于無抗凝適應證者,建議直接單種抗血小板藥物長期治療,如患者為高栓塞風險、急性冠狀動脈綜合征或近期PCI的予以適當時長的雙聯抗血小板治療[5,57-58];對于明確出現臨床瓣膜血栓證據患者,應調整為維生素K拮抗劑口服。目前基于術后抗栓方案的國內相關研究TAORTA研究[59]、CREATE研究(ChiCTR2400087454)、SCOPE研究(ChiCTR2400087453)等均在進行,旨在進一步探索抗栓優化方案。
TAVR后康復包括圍術期康復、門診康復和居家康復[60]。術后康復策略參考2021版共識[2]。若出現心血管系統疾病或其他系統疾病的癥狀,應隨時增加隨訪內容和頻率。
4.2 特殊類型患者隨訪要點
特殊類型的TAVR術后患者需要增加個體化的隨訪項目,明確各種特殊患者的隨訪重點。對于二葉式主動脈瓣患者:應著重主動脈內徑(尤其是升主動脈內徑)CT評估,監測二葉式主動脈瓣患者升主動脈內徑的擴張程度及速度,必要時行CMR進一步評估管壁應力及渦流位置等,警惕嚴重大血管并發癥。對于升主動脈內徑較大(>4.5 cm)、增長速度較快或具有家族遺傳史患者、瓷化主動脈或主動脈嚴重動脈粥樣硬化患者以及TAVR同期行冠狀動脈支架置入患者的隨訪策略見2021版共識[2]。
5 結語
隨著TAVR適應證的拓寬、手術器械的多樣化、操作流程的優化,TAVR在我國必將有更廣泛的應用。通過十余年的不懈探索,在TAVR領域,中國數據和方案已經開始在國際舞臺綻放并具有越來越大的影響力。希望本臨床路徑的更新可以更好地助力我國TAVR技術發展,繼續開拓中國TAVR特色創新之路,造福更多瓣膜性心臟病患者。
利益沖突:無。
院士專家顧問組(按姓氏漢語拼音排序):高潤霖(中國醫學科學院阜外醫院),葛均波(復旦大學附屬中山醫院),韓雅玲(中國人民解放軍北部戰區總醫院),王建安(浙江大學醫學院附屬第二醫院)
核心專家組成員(按姓氏漢語拼音排序):安貴鵬(山東大學齊魯醫院),白明(蘭州大學第一醫院),白元(海軍軍醫大學第一附屬醫院),卜軍(上海交通大學醫學院附屬仁濟醫院),陳暉(首都醫科大學附屬北京友誼醫院),陳靜(武漢大學人民醫院),陳良龍(福建醫科大學附屬協和醫院),陳茂(四川大學華西醫院),陳紹良(南京市第一醫院),陳生龍(北京大學人民醫院),陳韻岱(中國人民解放軍總醫院),程翔(華中科技大學同濟醫學院附屬協和醫院),董念國(華中科技大學同濟醫學院附屬協和醫院),范瑞新(廣東省人民醫院),方軍(福建醫科大學附屬協和醫院),方臻飛(中南大學湘雅二醫院),馮沅(四川大學華西醫院),傅國勝(浙江大學醫學院附屬邵逸夫醫院),龔韌(南昌大學第二附屬醫院),谷興華(山東大學齊魯醫院),郭亮(中國醫科大學附屬第一醫院),郭然(大連醫科大學附屬第一醫院),郭曉剛(浙江大學醫學院附屬第一醫院),郭延松(福建省立醫院),郭應強(四川大學華西醫院),韓克(西安交通大學第一附屬醫院),何奔(上海交通大學醫學院附屬胸科醫院),何泉(重慶醫科大學附屬第一醫院),何怡華(首都醫科大學附屬北京安貞醫院),洪浪(江西省心血管病醫院),黃暉(寧夏醫科大學總醫院),霍曉川(首都醫科大學附屬北京安貞醫院),季福綏(北京醫院),賈紹斌(寧夏醫科大學總醫院),江磊(青島大學附屬醫院),姜楠(天津市胸科醫院),姜小飛(珠海市人民醫院),姜正明(首都醫科大學附屬北京安貞醫院),晉軍(陸軍軍醫大學第二附屬醫院),孔祥清(江蘇省人民醫院),來永強(首都醫科大學附屬北京安貞醫院),李傳寶(山東大學齊魯醫院),李飛(空軍軍醫大學第一附屬醫院),李捷(廣東省人民醫院),李偉棟(浙江大學醫學院附屬第一醫院),李怡(中山大學附屬第一醫院),李妍(空軍軍醫大學第二附屬醫院),李永在(中國臺北振興醫院),林逸賢(香港嘉諾撒醫院亞洲心臟中心),劉斌(吉林大學第二醫院),劉長福(中國人民解放軍總醫院),劉健(北京大學人民醫院),劉杰(南寧市第一人民醫院),劉巍(北京積水潭醫院),劉先寶(浙江大學醫學院附屬第二醫院),劉新民(首都醫科大學附屬北京安貞醫院),劉洋(空軍軍醫大學第一附屬醫院),陸方林(海軍軍醫大學第一附屬醫院),羅建方(廣東省人民醫院 ),呂濱(中國醫學科學院阜外醫院),馬根山(東南大學附屬中大醫院),馬為(北京大學第一醫院),馬翔(新疆醫科大學第一附屬醫院),馬玉良(北京大學人民醫院),聶如瓊(中山大學孫逸仙紀念醫院),牛冠男(中國醫學科學院阜外醫院),潘文志(復旦大學附屬中山醫院),潘欣(上海交通大學醫學院附屬胸科醫院),裴漢軍(內蒙古科技大學包頭醫學院第一附屬醫院),彭小平(南昌大學第一附屬醫院),彭勇(四川大學華西醫院),喬帆(海軍軍醫大學第一附屬醫院),曲鵬(大連醫科大學附屬第二醫院),尚小珂(華中科技大學同濟醫學院附屬協和醫院),宋光遠(首都醫科大學附屬北京安貞醫院),宋思賢(中國臺北榮民總醫院),蘇晞(武漢亞心總醫院),孫英賢(中國醫科大學附屬第一醫院),譚冠昶(中國澳門鏡湖醫院),唐熠達(北京大學第三醫院),陶凌(空軍軍醫大學第一附屬醫院),王斌(廈門大學附屬心血管病醫院),王墨揚(中國醫學科學院阜外醫院),王晟(首都醫科大學附屬北京安貞醫院),王焱(廈門大學附屬心血管病醫院),王宇彬(首都醫科大學宣武醫院),吳延慶(南昌大學第二附屬醫院),吳永健(中國醫學科學院阜外醫院),修建成(南方醫科大學南方醫院),徐凱(中國人民解放軍北部戰區總醫院),徐磊(首都醫科大學附屬北京安貞醫院),徐吉喆(蘭州大學第一醫院),薛亞軍(清華大學附屬北京清華長庚醫院),楊劍(空軍軍醫大學第一附屬醫院),楊杰孚(北京醫院),楊毅寧(新疆醫科大學第一附屬醫院),楊躍進(中國醫學科學院阜外醫院),殷偉賢(中國臺北振興醫院),于波(哈爾濱醫科大學附屬第二醫院),俞飛成(浙江大學醫學院附屬邵逸夫醫院),袁義強(河南省胸科醫院),袁祖貽(西安交通大學第一附屬醫院),曾和松(華中科技大學同濟醫學院附屬同濟醫院),張純(首都醫科大學附屬北京安貞醫院),張春鵬(吉林大學第二醫院),張東會(哈爾濱醫科大學附屬第二醫院),張海波(首都醫科大學附屬北京安貞醫院),張慧平(北京醫院),張俊杰(南京市第一醫院),張龍巖(武漢亞心總醫院),張力(上海交通大學醫學院附屬新華醫院),張瑞巖(上海交通大學醫學院附屬瑞金醫院),張申偉(鄭州市第七人民醫院),張曉春(復旦大學附屬中山醫院),張志輝(陸軍軍醫大學第一附屬醫院),鐘禹成(華中科技大學同濟醫學院附屬協和醫院),鐘煒(梅州市人民醫院),周浩(溫州醫科大學附屬第一醫院),周達新(復旦大學附屬中山醫院),周勝華(中南大學湘雅二醫院),周玉杰(首都醫科大學附屬北京安貞醫院),朱政斌(上海交通大學醫學院附屬瑞金醫院),莊曉東(中山大學附屬第一醫院)
審核組成員(按姓氏漢語拼音排序):白元(海軍軍醫大學第一附屬醫院),方軍(福建醫科大學附屬協和醫院),韓克(西安交通大學第一附屬醫院),李飛(空軍軍醫大學第一附屬醫院),李捷(廣東省人民醫院),李妍(空軍軍醫大學第二附屬醫院),劉長福(中國人民解放軍總醫院),馬為(北京大學第一醫院),彭小平(南昌大學第一附屬醫院),尚小珂(華中科技大學同濟醫學院附屬協和醫院),王斌(廈門大學附屬心血管病醫院),王建德 (中國醫學科學院阜外醫院),徐凱(中國人民解放軍北部戰區總醫院),張海波(首都醫科大學附屬北京安貞醫院)
主要執筆專家(按姓氏漢語拼音排序):劉新民(首都醫科大學附屬北京安貞醫院),王墨揚(中國醫學科學院阜外醫院)
寫作組成員(按姓氏漢語拼音排序):陳陽(北京大學人民醫院),杜潤(上海交通大學醫學院附屬瑞金醫院),胡祥銘(中國醫學科學院阜外醫院),姜正明(首都醫科大學附屬北京安貞醫院),科雨彤(首都醫科大學附屬北京安貞醫院),李蘭蘭(空軍軍醫大學第一附屬醫院),林多茂(首都醫科大學附屬北京安貞醫院),劉然(首都醫科大學附屬北京安貞醫院),劉先寶(浙江大學醫學院附屬第二醫院),劉新民(首都醫科大學附屬北京安貞醫院),牛冠男(中國醫學科學院阜外醫院),潘文志(復旦大學附屬中山醫院),宋光遠(首都醫科大學附屬北京安貞醫院),王力涵(浙江大學醫學院附屬第二醫院),王墨揚(中國醫學科學院阜外醫院),王瑞(首都醫科大學附屬北京安貞醫院),王宇彬(首都醫科大學宣武醫院),席子惟(首都醫科大學附屬北京安貞醫院),修建成(南方醫科大學南方醫院),姚晶(首都醫科大學附屬北京安貞醫院),葉蘊青(中國醫學科學院阜外醫院),苑飛(首都醫科大學附屬北京安貞醫院),張倩(中國醫學科學院阜外醫院),趙晟(中國醫學科學院阜外醫院),周政(中國醫學科學院阜外醫院),朱政斌(上海交通大學醫學院附屬瑞金醫院)
近3年來,經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)領域在循證證據、應用經驗、指南更新、器械研發、術式改良等方面陸續取得重要進展。為進一步契合最新證據經驗,推進我國TAVR治療技術規范、安全、穩步發展,我們檢索最新文獻,依據德爾菲方法,更新了2018和2021版TAVR臨床路徑專家共識[1-2]。方法參考2021版共識[2]。
1 TAVR團隊的構成與臨床評估
1.1 TAVR團隊的構成
核心觀點1:TAVR團隊是一個由多學科組成的綜合管理團隊,負責術前評估、手術策略制定、手術實施及術后全病程管理。
一個完整的TAVR團隊包括心血管內科醫師、影像評估醫師、心臟瓣膜病介入醫師、心血管外科手術醫師、重癥監護室醫師、麻醉科醫師、導管室技術人員、護理及康復管理人員等[3-4]。TAVR團隊需要完成患者術前評估、制定手術策略并評估其可行性、實施TAVR并進行圍術期管理以及術后全病程管理。
1.2 臨床評估
核心觀點2:臨床評估是以患者主動脈瓣疾病干預指征為核心的臨床綜合評估,其重點包括TAVR的適應證、手術方式選擇及禁忌證三大步驟。內容包括主動脈瓣疾病癥狀及嚴重程度評估、臨床基線數據的采集、心血管相關合并癥的評估、非心血管相關合并癥的評估、老年綜合評估、神經系統功能評估和無效性評估。
瓣膜置換的適應證和預期獲益主要通過評估患者超聲心動圖及臨床癥狀,確定主動脈瓣疾病的嚴重程度及風險分期,從而確認干預時機及獲益[2,5]。在手術方式選擇方面,外科風險評分不再是衡量主動脈瓣疾病治療方式的獨立指標,而是綜合考慮患者臨床情況、解剖特點、手術意愿以及預期壽命等因素,由心臟綜合管理團隊決策。禁忌證評估方面則需要根據患者臨床資料的全面采集了解有無急性心肌梗死、流出道梗阻、左心血栓形成或解剖不適合TAVR的情況,同時還需進行無效性評估,考量術后預期壽命及生活質量改善的可能[2,6-9]。
1.3 TAVR的適應證和禁忌證
核心觀點3:近年來TAVR指南更新的重點是適應證的拓展和干預方式的轉變,強調干預方式選擇依賴于臨床評估團隊和根據患者個體化的臨床和解剖特點共同決策[2]。
1.3.1 TAVR的絕對適應證
主動脈根部及入路解剖結構符合TAVR(特別是經股動脈TAVR)要求且預期壽命>1年。
(1)年齡≥70歲,有下列情況之一:
① 重度主動脈瓣狹窄(aortic stenosis,AS)患者有AS導致的如下臨床癥狀:運動性呼吸困難、心力衰竭、心絞痛、暈厥、既往或運動試驗時暈厥先兆。
② 運動試驗可以誘發癥狀或血壓下降的無癥狀重度AS患者。
③ 無癥狀的重度AS,左心室射血分數(left ventricular ejection fraction,LVEF)<55%(無其他誘因導致的左心室收縮功能不全)。
④ 無癥狀的重度AS,LVEF>55%,運動試驗結果正常,干預風險低且具備以下條件之一:極重度AS[平均壓差≥60 mm Hg(1 mm Hg=0.133 kPa)或最大峰值流速>5 m/s];重度瓣膜鈣化(經CT評估)且最大峰值流速進展≥0.3 m/(s·a);經重復檢測確認無其他誘因的B型利鈉肽顯著升高(大于經性別、年齡校正的正常值的3倍)。
(2)年齡<70歲的重度AS患者,存在外科手術禁忌或高危,或存在其他危險因素,如胸部放射治療后、肝功能衰竭、主動脈彌漫性嚴重鈣化、極度虛弱等[2]。
(3)外科主動脈生物瓣膜毀損。
1.3.2 TAVR的相對適應證
(1)年齡60~69歲的患者,滿足1.3.1 TAVR的絕對適應證(1)中的條件之一,經過臨床團隊綜合評估認為更適合行TAVR手術。
(2)二葉式重度AS患者滿足上述條件之一,可在有經驗的中心(年手術量≥50例)或術者(年手術量≥25例)中開展。
(3)有癥狀的重度單純主動脈瓣反流(pure aortic regurgitation,PAR)患者,外科手術禁忌或高危,預期治療后能夠臨床獲益,解剖特點經過充分評估適合TAVR,可在有經驗的中心(年手術量≥50例)或術者(年手術量≥25例)中開展[10]。
(4)無癥狀的重度PAR患者,外科手術禁忌或高危,預期治療后能臨床獲益,解剖特點經過充分評估適合TAVR,需滿足下述條件之一:左心室舒張末期內徑>70 mm;左心室收縮末期內徑>50 mm;左心室收縮末期內徑指數>25 mm/m2;LVEF≤55%,可在有經驗的中心(年手術量≥50例)或術者(年手術量≥25例)中開展。
1.3.3 TAVR的禁忌證
TAVR的禁忌證參考2021版共識[2]。
2 TAVR圍術期影像學評估
核心觀點4:TAVR圍術期影像學評估中術前評估最為關鍵。CT是評估主動脈根部及入路解剖結構和鈣化的最重要手段,特定情況下超聲心動圖、心臟磁共振成像(cardiac magnetic resonance,CMR)、造影等檢查方式可以達到協同或替代評估作用。人工智能分析、數值仿真及三維(three dimension,3D)打印等新技術未來可能成為TAVR圍術期評估的重要補充(表1)。
2.1 CT評估
核心觀點5:CT在TAVR術前評估、術中指導以及術后隨訪中處于核心地位,是術前人工瓣膜及入路選擇的影像“金標準”[2],推薦心電門控全時相CT血管造影(CT angiography,CTA)掃描作為主動脈根部解剖評估的重要手段。
TAVR術前CT檢查圖像采集需評估患者心臟腎臟功能以及相關用藥,盡量采用64排及以上CT掃描設備。檢查應包括3個方面內容:(1)心電門控非增強CT掃描;(2)心電門控全時相CTA掃描;(3)大范圍非心電門控螺旋CTA掃描,掃描范圍及重建參數需特別關注(表2)。對比劑注射流率及總量的確定需綜合考慮選用的對比劑濃度、管電壓、設備掃描速度、患者靜脈血管條件、患者體重、心腎功能狀態等因素。TAVR術前CTA檢查需立刻評價圖像質量及掃描完整度,如圖像質量或完整度不足以滿足TAVR術前規劃的相關評估要求,則需要進行二次檢查或補充掃描[11]。
術前測量評估:需要有經驗的影像核心實驗室對CT圖像通過專業軟件進行分析,主要觀察主動脈根部和入路的形態學特征,其中主要包括瓣葉分型、鈣化情況、主動脈瓣環上下相關解剖徑線、冠狀動脈開口、左心室、入路血管管壁鈣化程度、管腔狹窄程度及走行迂曲程度、合并嚴重的主動脈病變(動脈瘤、夾層及閉塞等)等指標[12-13]。
核心觀點6:術者需要熟練掌握CT影像評估方法并對結果進行充分解讀及個體化分析,可根據圖像結果識別解剖難度、評估風險并制定正確的手術策略[2]。
術中、術后CT評估:通過CT可對導絲跨瓣及最佳釋放角度進行預測,以減少術中X線的輻射劑量及對比劑的使用并精確指導釋放深度及位置,對于解剖結構復雜及單純反流患者選擇合理的投照角度尤為重要[2]。術后通過主動脈根部CT可判斷TAVR瓣膜置換位置及深度、瓣架膨脹程度及圓度,對功能區嚴重膨脹不良或橢圓率較高的患者可考慮再次進行經導管球囊擴張成形術治療。同時術后CT可觀察聯合部錯位程度及冠狀動脈開口是否受到人工瓣膜縫制區或外裙邊遮擋,評估冠狀動脈通路通暢性及再介入可行性[14]。通過舒張期及四維(four dimension,4D)CT動態觀察瓣葉,可了解有無異常瓣葉增厚或血栓形成來評價器械遠期效果或制訂抗凝抗栓策略。目前高分辨率4D CT是診斷TAVR瓣膜血栓形成的金標準,主要影像學特征是不同程度的低衰減瓣葉增厚征和瓣葉運動減弱[2]。
核心觀點7:建議TAVR術后半年內常規行全時相CT掃描,評價瓣膜置換效果、位置、冠狀動脈再介入可行性及血栓情況,制定合理抗栓方案。
2.2 超聲心動圖評估
核心觀點8:超聲心動圖主要評價主動脈瓣病變的嚴重程度、其他瓣膜和心臟功能及圍術期并發癥,是圍術期影像評價的重要手段。
術前評估、術中監測及術后隨訪的方法及要點參考2021版共識[2]。
基于目前TAVR適應證向外科低危患者拓展,人工生物瓣膜耐久性成為術后評價的重要指標。瓣膜學術聯盟-3標準[15]所提出的生物瓣膜功能障礙分為結構性瓣膜退化、非結構性瓣膜功能障礙、臨床瓣膜血栓形成或心內膜炎。其中結構性瓣膜退化被定義為人工瓣膜發生的內在性永久性變化,包括磨損、瓣葉破損、瓣葉連枷、瓣葉纖維化和/或鈣化、支架斷裂或變形;非結構性瓣膜功能障礙被定義為人工瓣膜本身以外的任何因素導致的瓣膜功能障礙。
核心觀點9:生物瓣膜功能障礙嚴重程度的主要衡量指標為跨瓣壓差絕對值升高、跨瓣壓差較前進展、有效瓣口面積減少以及多普勒速度指數減少等(表3),作為術后超聲心動圖隨訪評價瓣膜耐久性的重要指標,需特別關注。
2.3 人工智能分析、數值仿真及3D打印技術
核心觀點10:人工智能及3D打印等影像學新技術應用于TAVR患者影像學分析,可輔助提升評估的精準性和效率、縮短術者的學習曲線,有望進一步降低手術并發癥風險,成為TAVR術前評估的重要手段[16]。
基于人工智能的TAVR術前評估:通過導入高質量CTA影像至分析系統,自動完成主動脈根部多目標精細分割與3D重建,自動識別瓣葉分型、竇底及冠狀動脈開口,精確定位關鍵解剖結構并測量,同時動態評估鈣化斑塊,輔助術者精準規劃手術方案,提升手術成功率。
基于人工智能TAVR術后評估:通過對瓣膜支架的高精度分割、去偽影操作和逐層的全自動形態學指標定量評估,能夠精準評價支架膨脹程度和效果,為復盤手術過程、優化手術策略、改進器械設計提供重要參考依據。
TAVR手術數值模擬仿真及3D打印技術:TAVR數值模擬仿真可以根據患者解剖特點,通過計算機數值模擬不同尺寸和類型支架的置入效果,選擇最優瓣膜型號和釋放位置,分析并發癥風險(圖1)。3D打印技術通過CT構建3D模型進行仿真與體外模擬,優化手術策略與效果[17-18]。利用3D打印具有內部傳感器的主動脈根部模型模擬TAVR,可以映射出施加在主動脈根部關鍵區域的壓力,判斷介入瓣膜錨定的穩定性、傳導阻滯風險等問題[19]。同時,3D打印模型還可通過4D MR技術識別并量化TAVR術后瓣周漏,助力瓣周漏檢測與量化[20]。而水凝膠瓣膜與熔融電鑄技術制造的高度可調且空間異質性的纖維管狀支架是目前3D生物打印的前沿方向[21-22]。
 圖1
人工智能分析主動脈根部及經導管主動脈瓣置換術數值模擬仿真效果
圖1
人工智能分析主動脈根部及經導管主動脈瓣置換術數值模擬仿真效果
Ascending Aorta:升主動脈;STJ:竇管交界;SOV:瓦氏竇;LVOT:左心室流出道;PD:周長衍生直徑;AD:面積衍生直徑;Aortic Annulus:主動脈瓣環;L:左冠竇;R:右冠竇;N:無冠竇
2.4 CMR評估
核心觀點11:在TAVR術前評估中,CMR可在特定條件下作為CT的合理替代方案。
CMR可精確測量主動脈根部的尺寸和形態,幫助確定解剖適應證并制定手術策略及器械選擇,同時無創地評估從主動脈根部到外周血管的解剖結構,幫助選擇最佳導管路徑,減少術中并發癥。其避免對比劑和輻射、對心功能和心肌纖維化疤痕組織評估能力強等特點具有一定優勢和臨床應用價值[23]。
3 TAVR的手術過程
3.1 場地及器械準備
核心觀點12:完整的多學科團隊和完善的雜交手術室是TAVR手術的最好保障,但隨著技術的發展和熟練程度的增加,各中心根據醫院條件、團隊配備情況在保障手術安全順利的情況下,因地制宜地在導管室采用簡化TAVR是可以推薦的。需根據術前評估方案及患者個體化需求充分準備好手術器械。
3.2 麻醉準備與選擇
核心觀點13:充分的麻醉術前準備非常必要,應根據患者狀況采用不同的麻醉方式。
麻醉方式包括:局部麻醉、鎮靜或監護麻醉、全身麻醉。患者本身、術者和麻醉醫師、TAVR入路是決定TAVR麻醉方式選擇的主要因素,其中入路是最主要的因素[24-27]。經股動脈入路TAVR建議優選鎮靜或監護麻醉方式,對于特殊入路、危重患者及各中心早期開展階段可選擇全身麻醉。
3.3 入路選擇和建立
核心觀點14:股動脈入路是TAVR最主要的入路,90%以上患者可以選擇股動脈入路。對于股動脈,如無鈣化,一般置入鞘管外面積可以超過血管面積20%~30%。在我國,頸動脈、鎖骨下動脈(腋動脈)途徑已成為僅次于股動脈途徑的常用外周血管入路。
經股動脈入路的方法參考2021版共識[2]。其他入路建議需有血管外科或心臟外科支持,并且在經驗較為豐富且具備完善心臟團隊的TAVR中心來完成,具體入路也需要依據器械特點、患者解剖情況,由心臟團隊討論后決定[28-29]。近期,國內開始嘗試All in one技術,應用單支血管入路完成經股動脈TAVR治療[30-32]。
3.4 瓣膜選擇
核心觀點15:進行瓣膜選擇時應結合術前CT綜合評估結果,如瓣膜分型、瓣膜鈣化分布、冠狀動脈堵塞風險、永久起搏器植入可能性、瓣環破裂風險、生物瓣膜不匹配等,并根據患者血管入路情況和人工瓣膜特性,做到個體化選擇,必要時結合術中球囊擴張的結果[2]。
目前中國大陸共有8款經股動脈入路的TAVR瓣膜、1款經心尖入路的TAVR瓣膜上市,包括球囊擴張式瓣膜、自膨脹式瓣膜兩大類,其中已有4款升級為可回收系統。數款針對PAR的經股動脈途徑瓣膜已經完成臨床試驗,即將應用于臨床。
3.5 腦保護裝置的使用
核心觀點16:TAVR術前完善腦血管和神經系統功能評估,對于高危栓塞風險患者,與神經內外科及血管外科專家共同制定治療策略,并推薦使用腦保護裝置。
TAVR術后高危栓塞風險包括既往腦卒中史、高齡、新發心房顫動、冠狀動脈粥樣硬化性心臟病(冠心病)史、外周血管病史、術中反復球囊擴張、心臟瓣膜移位、高流速高壓差等因素[15]。現有研究表明TAVR期間應用腦保護裝置安全性高,但其臨床結果仍需更多研究證實。
3.6 瓣膜置換前的準備
核心觀點17:瓣膜置換前應基于臨床和影像評估結果合理制定手術方案。包括臨時起搏電極植入、跨瓣角度的選擇以及跨瓣導絲的操作、瓣膜釋放角度的判定、球囊預擴張方案、瓣膜類型及型號選擇和可能出現的并發癥以及處理預案。
臨時起搏電極植入:TAVR術中的臨時快速起搏用于球囊擴張或瓣膜釋放過程中減弱心臟搏動幅度以減少球囊或瓣膜移位[2]。左心室導絲起搏技術的應用逐漸增加[33],但對于高風險患者仍建議傳統起搏方式,必要時TAVR術后留置臨時起搏電極24~48 h[34]。經頸靜脈或鎖骨下靜脈置入心室主動電極,不僅可以滿足術中起搏需要,必要時還可以橋接到過渡性永久起搏器技術以延長觀察時間、有利于患者早期活動[35]。
跨瓣角度的選擇以及跨瓣導絲的操作:術前通過CT可幫助選擇最合適的跨瓣角度及優先透視角度。跨瓣的核心步驟是逐步有序地調整導管軸向及高度,操作導絲頭端跨過瓣口,及時更換不同指引導管進行嘗試[2]。對于跨瓣困難的患者,也可采用經房間隔和經心尖穿刺后順行跨瓣后抓捕導絲建立軌道。
瓣膜釋放角度的選擇:術前通過多排CT對器械釋放角度進行預測,結合術中主動脈根部造影,確定瓣膜最佳釋放角度,常用方法包括右竇中心位、左右竇重疊位(Cusp-overlap)及雙S曲線技術[2]。若存在特殊結構關注點或風險,例如存在冠狀動脈堵塞風險時可選擇冠狀動脈切線位造影觀察。對于二葉式主動脈瓣患者,最理想角度通常為平行于交界區連線的方向(雙竇展開位),無論采取何種方法,均需要打齊瓣環平面。
球囊預擴張:術前應根據CT評估瓣環及瓣上結構徑線和患者心功能及臨床狀態來選擇合適的球囊型號,同時應考慮是否有球囊擴張時觀察球囊腰部及根部造影反流量、評估冠狀動脈閉塞風險的需要進行型號調整。對于瓣葉重度鈣化、瓣葉交界粘連、二葉式主動脈瓣的AS患者,建議球囊預擴張,但盡量避免多次球囊預擴張。球囊擴張前充分考慮可能發生的風險,準備好應對措施。
3.7 瓣膜的輸送、定位及釋放
核心觀點18:瓣膜輸送時,應特別關注跨越主動脈弓和主動脈瓣這兩個位置的過程。不同瓣葉結構類型和瓣膜型號對起始定位的高度要求有所不同,應從術前CT分析中確定TAVR瓣膜的錨定區和封堵區[2],決定起始位置及優選釋放位置。
瓣膜輸送的操作要點見2021版共識[2]。二葉式主動脈瓣大多數需要高位釋放,其瓣膜的錨定區多數是瓣上結構;而對于三葉式主動脈瓣,多數的錨定區在瓣環到流出道之間,一般選擇標準位釋放。瓣膜釋放過程中可能需要應用快速起搏,根據瓣膜類型以及釋放策略不同,起搏頻率常規120~220次/min[2]。
3.8 瓣膜置換后的評估
核心觀點19:術后應觀察血流動力學情況,通過超聲心動圖和主動脈根部造影評估瓣膜的位置及反流情況,同時觀察二尖瓣、左心室功能以及術中并發癥[2]。
TAVR術后瓣膜反流的評估:TAVR術后的瓣膜反流根據其位置分為中心型反流以及瓣周漏。瓣周漏與嚴重鈣化、瓣環偏心、瓣膜尺寸過小、瓣膜置入過深等原因相關。
瓣周漏的評估應該建立綜合評估體系:
(1)造影評估:根據左心室內對比劑相對密度評估反流程度,初篩反流,粗估反流總量,但不能評估反流數目、位置、方向。根據Selles分級標準,分為4個等級:Ⅰ級:無反流;Ⅱ級:輕度反流:造影劑進入左心室流出道及中部,經過1次心搏即可排除;Ⅲ級:中度反流:造影劑進入整個左心室,1次心搏不能完全清除,經過數次心搏后顯影變淡;Ⅳ級:重度反流:整個左心室及主動脈均勻顯影,1次心搏后仍保持。
(2)Sinning和Hasan主動脈瓣反流指數(aortic regurgitation index,ARI)作為評估指標:ARI=(主動脈舒張壓?左心室舒張末期壓力)/主動脈收縮壓×100,或ARI=(主動脈舒張壓?左心室舒張末期壓力)/心率×80。ARI與反流程度呈負相關,ARI<25患者術后1年病死率是ARI>25患者的2.9倍,故ARI閾值定為25,作為判斷瓣周漏是否需要采取進一步治療的評估依據。
(3)超聲心動圖多普勒評估:TAVR術后超聲心動圖評估時需要盡可能將患者血流動力學控制在較穩定的范圍內,新發快速心律失常可影響瓣周漏判斷,必要時可使用藥物干預。計算彩色多普勒反流束的內徑與左心室流出道的比值、胸骨旁短軸切面測量的弧狀反流長度與瓣環長度的比值(無:無彩色反流;輕度:10%以下;中度:10%~30%,重度:>30%)、主動脈舒張期反向血流頻譜。
3.9 TAVR術中常見并發癥的處理
核心觀點20:常見并發癥包括循環崩潰、瓣周漏、瓣膜移位、冠狀動脈閉塞、心肌梗死、腦卒中、血管并發癥、傳導阻滯,需特別關注。
TAVR術中常見并發癥包括[15]:
(1)循環崩潰:循環崩潰常見原因包括術中新發急性主動脈瓣反流、術前心功能低下、冠狀動脈阻塞、難以耐受高頻起搏、瓣環破裂、心臟壓塞、自殺左心室、血管并發癥、急性二尖瓣反流等。術前評估需要甄別循環崩潰的高危患者,采取相應預防和處理措施。
(2)瓣周漏:新一代瓣膜的瓣周漏顯著減少。對于中度以上瓣周漏,需要立即進行糾正,瓣周漏的處理應基于對其病因的正確判斷,如膨脹不良,則應該考慮球囊后擴張;如果瓣膜釋放位置不佳,則應該考慮瓣中瓣;如果由于嚴重鈣化導致瓣膜不能完全貼壁,則應該考慮瓣周漏封堵。
(3)瓣膜移位:瓣膜移位可能導致緊急開胸或再次置入瓣膜。術前影像學評估瓣環及環上結構非常重要,對已發生移位的瓣膜,可嘗試使用抓捕器調整位置。某些病例瓣膜置換后突發臨床癥狀加重或血流動力學惡化需考慮遲發瓣膜移位的發生。
(4)冠狀動脈閉塞及心肌梗死:在術前評估時應特別注意冠狀動脈開口高度、竇部容積、瓣葉增厚及鈣化情況以及人工瓣膜與冠狀動脈開口的關系,術中球囊預擴張同時行主動脈根部造影有助于觀察冠狀動脈灌注情況。預判冠狀動脈閉塞高風險則建議預先冠狀動脈保護,可預埋延長導管、球囊或支架保護冠狀動脈。BASILICA技術可通過撕裂瓣葉來預防冠狀動脈開口阻塞[2]。
(5)腦卒中:腦卒中的預防措施包括充分的術前評估、減少術中操作次數和采用腦保護裝置(表4)。腦保護裝置已被證實安全,其臨床療效需更多循證醫學證據支持。
(6)血管并發癥:血管入路并發癥發生率較高,有時甚至可致命。對可能出現血管并發癥的患者,應積極準備應急處理措施,包括外周血管球囊、覆膜支架等,必要時及時外科切開處理。
(7)傳導阻滯:TAVR術后傳導阻滯主要與瓣膜架體或導管與傳導系統之間的直接機械相互作用導致的局部炎癥、水腫或缺血相關。術后發生傳導阻滯后植入永久起搏器時機存在較大差異。起搏方式的選擇建議盡量生理起搏。左心室功能降低的患者中,預期右心室起搏要求高(>40%)可考慮心臟再同步化治療。過渡性永久起搏器技術可以降低TAVR術后永久起搏器植入率,降低成本,早期康復,改善患者生活質量(圖2)[35]。
 圖2
過渡性永久起搏器技術
圖2
過渡性永久起搏器技術
1:穿刺鎖骨下靜脈或腋靜脈;2:保留穿刺導絲;3:置入7F或8F可撕開鞘管;4:植入心室主動電極至右心室間隔部;5:撕開鞘管;6:用縫線將電極固定在皮膚表面;7~8:無菌敷料覆蓋電極;9:電極尾端連接起搏器脈沖發生器;10:用縫線將起搏器脈沖發生器固定在皮膚表面;11:無菌敷料覆蓋脈沖發生器;12:通過程控儀調整起搏器參數
核心觀點21:其他并發癥包括:(1)心包積液及心臟壓塞;(2)左心室左心房漏;(3)主動脈瓣環撕裂;(4)主動脈夾層、撕裂;(5)二尖瓣功能損傷;(6)感染性心內膜炎;(7)瓣膜血栓;(8)急性腎功能損傷;(9)出血[2]。
3.10 急診TAVR
核心觀點22:對藥物治療反應性差的難治性癥狀性重度AS患者,伴或不伴有血流動力學不穩定,需要最短時間內完成的緊急經導管主動脈瓣球囊擴張或TAVR,定義為急診主動脈瓣球囊擴張術/TAVR。
核心觀點23:急診主動脈瓣球囊擴張術/TAVR適應證包括:(1)心源性休克;(2)合并有持續性室性心動過速或發生心室顫動;(3)藥物難以改善需要器械循環輔助裝置的不穩定性心絞痛或慢性心力衰竭;(4)在TAVR 評估及手術階段出現血流動力學崩潰接受心肺復蘇的患者[2]。
核心觀點24:如果決定使用機械循環輔助裝置,建議在TAVR術前預防性植入,優選體外膜氧合裝置,如不具備條件,可選擇主動脈內球囊反搏裝置。
核心觀點25:因病情嚴重無法完善增強CT時,平掃CT、術中3D經食管超聲心動圖(transesophageal echocardiography,TEE)及血管造影的聯合應用對于入路及根部評價有一定作用。
根據目前國內外經驗做出以下建議:(1)首選全身麻醉,根據血管超聲及術中造影結果,優選經股動脈入路;(2)應用TEE評估主動脈根部結構;(3)根據CT和超聲心動圖評估結果選擇預擴張球囊型號,術中預擴張時應特別關注冠狀動脈灌注以及反流量情況,必要時可選擇小球囊序貫擴張,避免大量反流所致循環不穩定;(4)根據術中根部造影和球囊擴張造影選擇人工瓣膜型號;(5)術后建議患者在監護病房進行過渡治療[36-38](圖3)。
 圖3
急診TAVR流程
圖3
急診TAVR流程
TAVR:經導管主動脈瓣置換術;TEE:經食管超聲心動圖
3.11 簡化TAVR
核心觀點26:簡化TAVR的安全性和有效性不遜于傳統TAVR,能夠促進患者早期恢復,縮短住院時間,降低醫療費用。各中心可因地制宜,制定適合本中心的簡化手術方案(表5)。
必須對能夠從簡化手術中獲益的患者進行嚴格篩選,以確保其安全性。簡化TAVR傾向于選擇血管解剖條件合適的低危患者,應遵從個體化原則,篩選標準包括:(1)具備合適的血管入路;(2)冠狀動脈阻塞風險較低;(3)無慢性疼痛;(4)TTE聲窗條件好;(5)可緊急插管;(6)可以平臥。不適宜行簡化TAVR的標準包括:(1)入路血管條件較差;(2)冠狀動脈阻塞風險較高;(3)瓣環破裂風險較高;(4)患者焦慮、術中不能配合;(5)瓣膜大小不確定;(6)患者無法平臥;(7)TTE聲窗差。目前,國內大多數中心采用的簡化TAVR方法包括在導管室進行局部麻醉、穿刺股動脈為主入路、橈動脈作為副入路或All in one技術、左心室導絲起搏、直接瓣膜置入術、減少有創監測和通路、術中采用TTE、鼓勵早期活動、早期出院等[39-42]。
3.12 PAR的TAVR
核心觀點27:我國目前尚無確切主動脈瓣反流患病率的流行病學數據,但現有證據顯示其流行病學規律不同于西方,我國的主動脈瓣反流可能更常見[10]。
核心觀點28:CT雙錨定多平面測量方案和解剖分型對PAR的TAVR有指導意義。建議人工瓣膜在錨定平面的直徑(周長)超尺寸比率應在10%以上。
目前我國僅有經心尖入路的J-Valve人工主動脈瓣膜被批準用于主動脈瓣反流的TAVR治療,但是多款經股動脈瓣膜已經完成臨床試驗,即將上市。對PAR患者行經股動脈TAVR,超適應證應用時推薦使用可回收的自膨脹式瓣膜,建議術前采用CTA評估患者的解剖,根據CTA分析結果判斷患者是否適合手術,并選擇合適的瓣膜型號[10]。CT雙錨定多平面測量方案和解剖分型對TAVR有指導意義:1型:瓣環、左心室流出道、升主動脈均能錨定;2型:左心室流出道不能錨定,瓣環、升主動脈可錨定;3型:瓣環、左心室流出道可錨定,升主動脈不能錨定;4型:瓣環、左心室流出道、升主動脈均不能錨定(圖4)。術中應以高速心室起搏輔助,快速釋放瓣膜到可回收位置,然后根據情況選擇回收或完全釋放[10,43]。
 圖4
CT雙錨定多平面測量方案和解剖分型
圖4
CT雙錨定多平面測量方案和解剖分型
TAVR:經導管主動脈瓣置換術;+:能錨定;?:不能錨定
3.13 TAVR合并冠心病的血運重建策略
核心觀點29:重度AS合并冠心病發病率為30%~50%,但是目前關于冠心病是否影響TAVR患者預后的臨床研究結果并不完全一致,而且這些冠心病患者是否均需要血運重建仍存在爭議。
核心觀點30:一站式TAVR+經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)應在有經驗的中心開展,早期應選擇簡單組合進行處理,建議進行預先跨瓣置入豬尾導管。對于合并左主干病變、多個靶病變、需要旋磨以及二葉式主動脈瓣的復雜TAVR+PCI一站式治療的患者,應特別注意基礎心功能及腎功能,避免多個難點進行組合導致手術難度過大、時間過長、對比劑用量過多從而增加風險(表6)。手術過程中對于冠狀動脈病變復雜及基礎心功能狀態不佳患者,應充分評估其麻醉方式及是否需要左心輔助裝置[2,44-48]。
TAVR術前均應進行冠狀動脈影像學評估。國外指南建議冠狀動脈造影仍是大多數TAVR患者進行冠心病評估的主要手段;但冠狀動脈CTA作為TAVR術前冠狀動脈評估的主要初篩手段是可行的,若冠狀動脈CTA提示病變嚴重,則進一步行冠狀動脈造影檢查。嚴重AS患者的冠狀動脈生理學評估的臨床價值需要更多數據支持。指南建議TAVR患者合并冠狀動脈近端狹窄>70%時可采用PCI方式進行干預。PCI相對于TAVR的時間安排應基于患者臨床表現、解剖特征和冠狀動脈病變的復雜性。目前TAVR后進行PCI因冠狀動脈入路難度增加不作為常規推薦。
3.14 AS伴心房顫動的TAVR與左心耳封堵治療(left atrial appendage closure,LAAC)
核心觀點31:LAAC是TAVR合并心房顫動患者重要的腦卒中二級預防手段,對于出血高危患者或術后無法堅持長期抗凝患者可考慮行同期手術。
核心觀點32:盤式封堵器患者可口服氯吡格雷75 mg 1次/d+阿司匹林100 mg 1次/d,半年后改為口服阿司匹林100 mg 1次/d;塞式封堵器患者可口服抗凝+阿司匹林100 mg 1次/d,45 d,45 d后阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d至術后6個月,6個月后阿司匹林100 mg 1次/d持續服用。若患者不能耐受高強度抗栓治療,抗栓方案可根據患者耐受程度降級。術后第45天、6個月時通過TEE或CTA觀察封堵器是否完全封閉左心耳、有無器械表面血栓[49-52]。
TAVR+LAAC的最適人群為心房顫動伴腦卒中高危患者,不能耐受長期抗凝治療或在規范抗凝治療中仍反復發生心源性腦卒中患者。LAAC在TAVR術后進行,推薦TEE/心腔內超聲心動圖(intracardiac echocardiography,ICE)指引下完成LAAC,確保手術安全性和封堵的有效性。患者具備TAVR+LAAC指征,但由于各種原因并未接受LAAC治療(包括經濟原因、個人意愿、患者身體狀況等),TAVR術后因服用抗凝藥導致出血事件發生,或再發心源性腦卒中,除外瓣膜血栓因素后,可考慮再次行LAAC治療。術后抗栓方案尚存在部分爭議,可根據患者腦卒中和出血風險進行個體化策略制定。
3.15 主動脈瓣生物瓣損毀的瓣中瓣技術
核心觀點33:生物瓣損毀是我們即將面對的重要問題,包括在外科毀損瓣中行TAVR治療(TAVR-in-SAVR)及在TAVR毀損瓣中行TAVR治療(TAVR-in-TAVR)的瓣中瓣技術是解決生物瓣毀損的重要方式。
在首次瓣膜置換時即應考慮全生命周期中再次瓣膜置換面臨的問題,冠狀動脈風險和冠狀動脈通路風險以及瓣膜-患者不匹配是要考慮的最重要問題。TAVR-in-SAVR的關鍵步驟參考2021版共識[2]。冠狀動脈閉塞高風險是TAVR-in-SAVR待解決的問題,瓣葉切割技術對原外科瓣膜的瓣葉進行切割,減少冠狀動脈閉塞風險發生。
行TAVR-in-TAVR(Redo-TAVR)時需要特別關注的內容包括:(1)根據首次置入瓣膜類型與型號,評估冠狀動脈風險并選擇第二枚置入瓣膜的類型和尺寸、確定置入瓣膜的位置;(2)充分的CT分析,包括首次置入前后CT影像;(3)Redo-TAVR時,竇隔離是重要的冠狀動脈閉塞風險因素,瓣葉切割技術、Chimney支架技術在Redo-TAVR中效果并不確切且操作困難[53-55]。瓣膜的幾何形狀、瓣架的長度、釋放位置均可以影響新裙邊的高度,應根據患者的個體情況制定相應的手術策略(圖5)。
 圖5
Redo-TAVR的手術策略規劃
圖5
Redo-TAVR的手術策略規劃
a:短瓣架置入短瓣架;b:短瓣架置入長瓣架;c:長瓣架置入短瓣架;d:長瓣架置入長瓣架;Redo-TAVR:再次經導管主動脈瓣置換術
4 TAVR 患者圍術期及遠期管理
4.1 TAVR患者圍術期管理及隨訪康復策略
核心觀點34:TAVR患者病情復雜、并發癥病情變化快,圍術期管理尤為重要。
核心觀點35:術后隨訪和康復對TAVR患者術后遠期預后和生活質量具有重要作用。
在術后應根據麻醉方式及入路情況,酌情于重癥監護室進行過渡或于普通病房進行治療,需進行精細的循環容量管理,疼痛管理,呼吸系統、神經系統及消化系統的綜合管理[2]。容量管理建議根據患者性別、年齡、體重、疾病特點、術前全身狀況和血循環容量狀態等指標,采取個體化補液方案[56]。TAVR圍術期腦卒中的發病機制復雜多樣,涉及瓣膜置入過程中的機械損傷、血流動力學改變、血栓形成等多個環節,需要遵循標準化流程評估和管理。其他監測重點包括心律變化(起搏器評估)、呼吸道感染、穿刺點出血、急性腎損傷、譫妄、心臟結構并發癥及瓣周反流等[2](詳見本文“3 TAVR的手術過程”)。
術后抗栓方面:對于有抗凝適應證者(如心房顫動、血栓栓塞等),建議長期應用口服抗凝藥物,對于合并急性冠狀動脈綜合征和近期PCI患者可酌情加用單種抗血小板藥物;對于無抗凝適應證者,建議直接單種抗血小板藥物長期治療,如患者為高栓塞風險、急性冠狀動脈綜合征或近期PCI的予以適當時長的雙聯抗血小板治療[5,57-58];對于明確出現臨床瓣膜血栓證據患者,應調整為維生素K拮抗劑口服。目前基于術后抗栓方案的國內相關研究TAORTA研究[59]、CREATE研究(ChiCTR2400087454)、SCOPE研究(ChiCTR2400087453)等均在進行,旨在進一步探索抗栓優化方案。
TAVR后康復包括圍術期康復、門診康復和居家康復[60]。術后康復策略參考2021版共識[2]。若出現心血管系統疾病或其他系統疾病的癥狀,應隨時增加隨訪內容和頻率。
4.2 特殊類型患者隨訪要點
特殊類型的TAVR術后患者需要增加個體化的隨訪項目,明確各種特殊患者的隨訪重點。對于二葉式主動脈瓣患者:應著重主動脈內徑(尤其是升主動脈內徑)CT評估,監測二葉式主動脈瓣患者升主動脈內徑的擴張程度及速度,必要時行CMR進一步評估管壁應力及渦流位置等,警惕嚴重大血管并發癥。對于升主動脈內徑較大(>4.5 cm)、增長速度較快或具有家族遺傳史患者、瓷化主動脈或主動脈嚴重動脈粥樣硬化患者以及TAVR同期行冠狀動脈支架置入患者的隨訪策略見2021版共識[2]。
5 結語
隨著TAVR適應證的拓寬、手術器械的多樣化、操作流程的優化,TAVR在我國必將有更廣泛的應用。通過十余年的不懈探索,在TAVR領域,中國數據和方案已經開始在國際舞臺綻放并具有越來越大的影響力。希望本臨床路徑的更新可以更好地助力我國TAVR技術發展,繼續開拓中國TAVR特色創新之路,造福更多瓣膜性心臟病患者。
利益沖突:無。
院士專家顧問組(按姓氏漢語拼音排序):高潤霖(中國醫學科學院阜外醫院),葛均波(復旦大學附屬中山醫院),韓雅玲(中國人民解放軍北部戰區總醫院),王建安(浙江大學醫學院附屬第二醫院)
核心專家組成員(按姓氏漢語拼音排序):安貴鵬(山東大學齊魯醫院),白明(蘭州大學第一醫院),白元(海軍軍醫大學第一附屬醫院),卜軍(上海交通大學醫學院附屬仁濟醫院),陳暉(首都醫科大學附屬北京友誼醫院),陳靜(武漢大學人民醫院),陳良龍(福建醫科大學附屬協和醫院),陳茂(四川大學華西醫院),陳紹良(南京市第一醫院),陳生龍(北京大學人民醫院),陳韻岱(中國人民解放軍總醫院),程翔(華中科技大學同濟醫學院附屬協和醫院),董念國(華中科技大學同濟醫學院附屬協和醫院),范瑞新(廣東省人民醫院),方軍(福建醫科大學附屬協和醫院),方臻飛(中南大學湘雅二醫院),馮沅(四川大學華西醫院),傅國勝(浙江大學醫學院附屬邵逸夫醫院),龔韌(南昌大學第二附屬醫院),谷興華(山東大學齊魯醫院),郭亮(中國醫科大學附屬第一醫院),郭然(大連醫科大學附屬第一醫院),郭曉剛(浙江大學醫學院附屬第一醫院),郭延松(福建省立醫院),郭應強(四川大學華西醫院),韓克(西安交通大學第一附屬醫院),何奔(上海交通大學醫學院附屬胸科醫院),何泉(重慶醫科大學附屬第一醫院),何怡華(首都醫科大學附屬北京安貞醫院),洪浪(江西省心血管病醫院),黃暉(寧夏醫科大學總醫院),霍曉川(首都醫科大學附屬北京安貞醫院),季福綏(北京醫院),賈紹斌(寧夏醫科大學總醫院),江磊(青島大學附屬醫院),姜楠(天津市胸科醫院),姜小飛(珠海市人民醫院),姜正明(首都醫科大學附屬北京安貞醫院),晉軍(陸軍軍醫大學第二附屬醫院),孔祥清(江蘇省人民醫院),來永強(首都醫科大學附屬北京安貞醫院),李傳寶(山東大學齊魯醫院),李飛(空軍軍醫大學第一附屬醫院),李捷(廣東省人民醫院),李偉棟(浙江大學醫學院附屬第一醫院),李怡(中山大學附屬第一醫院),李妍(空軍軍醫大學第二附屬醫院),李永在(中國臺北振興醫院),林逸賢(香港嘉諾撒醫院亞洲心臟中心),劉斌(吉林大學第二醫院),劉長福(中國人民解放軍總醫院),劉健(北京大學人民醫院),劉杰(南寧市第一人民醫院),劉巍(北京積水潭醫院),劉先寶(浙江大學醫學院附屬第二醫院),劉新民(首都醫科大學附屬北京安貞醫院),劉洋(空軍軍醫大學第一附屬醫院),陸方林(海軍軍醫大學第一附屬醫院),羅建方(廣東省人民醫院 ),呂濱(中國醫學科學院阜外醫院),馬根山(東南大學附屬中大醫院),馬為(北京大學第一醫院),馬翔(新疆醫科大學第一附屬醫院),馬玉良(北京大學人民醫院),聶如瓊(中山大學孫逸仙紀念醫院),牛冠男(中國醫學科學院阜外醫院),潘文志(復旦大學附屬中山醫院),潘欣(上海交通大學醫學院附屬胸科醫院),裴漢軍(內蒙古科技大學包頭醫學院第一附屬醫院),彭小平(南昌大學第一附屬醫院),彭勇(四川大學華西醫院),喬帆(海軍軍醫大學第一附屬醫院),曲鵬(大連醫科大學附屬第二醫院),尚小珂(華中科技大學同濟醫學院附屬協和醫院),宋光遠(首都醫科大學附屬北京安貞醫院),宋思賢(中國臺北榮民總醫院),蘇晞(武漢亞心總醫院),孫英賢(中國醫科大學附屬第一醫院),譚冠昶(中國澳門鏡湖醫院),唐熠達(北京大學第三醫院),陶凌(空軍軍醫大學第一附屬醫院),王斌(廈門大學附屬心血管病醫院),王墨揚(中國醫學科學院阜外醫院),王晟(首都醫科大學附屬北京安貞醫院),王焱(廈門大學附屬心血管病醫院),王宇彬(首都醫科大學宣武醫院),吳延慶(南昌大學第二附屬醫院),吳永健(中國醫學科學院阜外醫院),修建成(南方醫科大學南方醫院),徐凱(中國人民解放軍北部戰區總醫院),徐磊(首都醫科大學附屬北京安貞醫院),徐吉喆(蘭州大學第一醫院),薛亞軍(清華大學附屬北京清華長庚醫院),楊劍(空軍軍醫大學第一附屬醫院),楊杰孚(北京醫院),楊毅寧(新疆醫科大學第一附屬醫院),楊躍進(中國醫學科學院阜外醫院),殷偉賢(中國臺北振興醫院),于波(哈爾濱醫科大學附屬第二醫院),俞飛成(浙江大學醫學院附屬邵逸夫醫院),袁義強(河南省胸科醫院),袁祖貽(西安交通大學第一附屬醫院),曾和松(華中科技大學同濟醫學院附屬同濟醫院),張純(首都醫科大學附屬北京安貞醫院),張春鵬(吉林大學第二醫院),張東會(哈爾濱醫科大學附屬第二醫院),張海波(首都醫科大學附屬北京安貞醫院),張慧平(北京醫院),張俊杰(南京市第一醫院),張龍巖(武漢亞心總醫院),張力(上海交通大學醫學院附屬新華醫院),張瑞巖(上海交通大學醫學院附屬瑞金醫院),張申偉(鄭州市第七人民醫院),張曉春(復旦大學附屬中山醫院),張志輝(陸軍軍醫大學第一附屬醫院),鐘禹成(華中科技大學同濟醫學院附屬協和醫院),鐘煒(梅州市人民醫院),周浩(溫州醫科大學附屬第一醫院),周達新(復旦大學附屬中山醫院),周勝華(中南大學湘雅二醫院),周玉杰(首都醫科大學附屬北京安貞醫院),朱政斌(上海交通大學醫學院附屬瑞金醫院),莊曉東(中山大學附屬第一醫院)
審核組成員(按姓氏漢語拼音排序):白元(海軍軍醫大學第一附屬醫院),方軍(福建醫科大學附屬協和醫院),韓克(西安交通大學第一附屬醫院),李飛(空軍軍醫大學第一附屬醫院),李捷(廣東省人民醫院),李妍(空軍軍醫大學第二附屬醫院),劉長福(中國人民解放軍總醫院),馬為(北京大學第一醫院),彭小平(南昌大學第一附屬醫院),尚小珂(華中科技大學同濟醫學院附屬協和醫院),王斌(廈門大學附屬心血管病醫院),王建德 (中國醫學科學院阜外醫院),徐凱(中國人民解放軍北部戰區總醫院),張海波(首都醫科大學附屬北京安貞醫院)
主要執筆專家(按姓氏漢語拼音排序):劉新民(首都醫科大學附屬北京安貞醫院),王墨揚(中國醫學科學院阜外醫院)
寫作組成員(按姓氏漢語拼音排序):陳陽(北京大學人民醫院),杜潤(上海交通大學醫學院附屬瑞金醫院),胡祥銘(中國醫學科學院阜外醫院),姜正明(首都醫科大學附屬北京安貞醫院),科雨彤(首都醫科大學附屬北京安貞醫院),李蘭蘭(空軍軍醫大學第一附屬醫院),林多茂(首都醫科大學附屬北京安貞醫院),劉然(首都醫科大學附屬北京安貞醫院),劉先寶(浙江大學醫學院附屬第二醫院),劉新民(首都醫科大學附屬北京安貞醫院),牛冠男(中國醫學科學院阜外醫院),潘文志(復旦大學附屬中山醫院),宋光遠(首都醫科大學附屬北京安貞醫院),王力涵(浙江大學醫學院附屬第二醫院),王墨揚(中國醫學科學院阜外醫院),王瑞(首都醫科大學附屬北京安貞醫院),王宇彬(首都醫科大學宣武醫院),席子惟(首都醫科大學附屬北京安貞醫院),修建成(南方醫科大學南方醫院),姚晶(首都醫科大學附屬北京安貞醫院),葉蘊青(中國醫學科學院阜外醫院),苑飛(首都醫科大學附屬北京安貞醫院),張倩(中國醫學科學院阜外醫院),趙晟(中國醫學科學院阜外醫院),周政(中國醫學科學院阜外醫院),朱政斌(上海交通大學醫學院附屬瑞金醫院)