引用本文: 邢洪銘, 黃建花, 游欣雨, 廖玉波, 張宇. 二步肝切除治療晚期肝泡型棘球蚴病的 安全性和療效. 中國普外基礎與臨床雜志, 2024, 31(10): 1202-1209. doi: 10.7507/1007-9424.202407101 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
棘球蚴病,又稱“包蟲病”,它主要侵犯肝臟,肝棘球蚴病約占棘球蚴病70%[1],其中肝泡型棘球蚴病(hepatic alveolar echinococcosis,HAE)的危害相較于肝囊型棘球蚴病更為嚴重,其中未經有效治療的HAE患者10年病死率超過90%[2-6]。由于肝棘球蚴病患者大多生活在偏遠貧困的山區或牧區,“早發現、早診斷、早治療”的三早原則往往難以實現,因此大部分患者就診時已是晚期,同時高昂的治療費用讓大多數患者無力負擔。幸運的是,手術技術的不斷進步以及我國中央財政補助政策的實施,讓這些地區的肝棘球蚴病患者有了根治的希望。但是這些患者由于就診時多數處于晚期,若直接行根治性肝切除術后往往會出現剩余肝體積(future liver remnant,FLR)不足。基于筆者團隊[7-8]的經驗,當患者的FLR/標準肝體積(standard liver volume,SLV)<30%時行復雜的肝病灶切除手術,譬如行離體肝切除聯合自體肝移植術(ex vivo liver resection and autotransplantation,ELRA)或半離體肝切除術往往難以實現。需注意的是,FLR/SLV比值根據患者肝功能、有無黃疸、是否合并慢性肝炎等因素有所不同。FLR/SLV不足所引起的術后小肝綜合征會導致患者面臨發生肝切除術后肝衰竭的風險,由此,在進行根治性肝切除術前進行保留側肝臟增生(以下簡稱“增肝”)治療顯得尤為重要。本研究團隊對此類初始不宜一期行根治性肝切除術的晚期HAE患者的治療方法進行了探索,即一期采用門靜脈栓塞術(portal vein embolization,PVE)、肝靜脈剝奪術(liver venous deprivation,LVD)或肝臟分隔聯合門靜脈結扎的二步肝切除術(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)來增肝,以增大FLR;然后再二期行復雜肝切除手術如ELRA或半離體肝切除術等方式治療,對其可行性、安全性及預后情況進行回顧性分析并總結。
1 對象與方法
1.1 研究對象
回顧性收集四川省人民醫院2016年12月至2022年12月期間對預計行肝切除術后FLR不足且采用二步肝切除治療的晚期HAE患者的臨床病理資料,所有患者均經術后病理檢查結果證實為HAE。
1.2 一期行PVE、LVD或ALPPS后二期行復雜肝切除的適應證和禁忌證
適應證:① 術前影像學評估FLR不足的病例,肝功能正常者FLR/SLV<35%,慢性肝臟疾病患者FLR/SLV<40%;② 經多學科協作團隊討論后認為行一期肝切除手術難度大、預計肝切除術后肝衰竭發生風險高。禁忌證:① 肝囊型棘球蚴病;② 同時合并嚴重的器官功能不全不能耐受手術患者;③ 同時合并其他惡性腫瘤患者。
1.3 手術方法
1.3.1 PVE后的二期肝切除手術
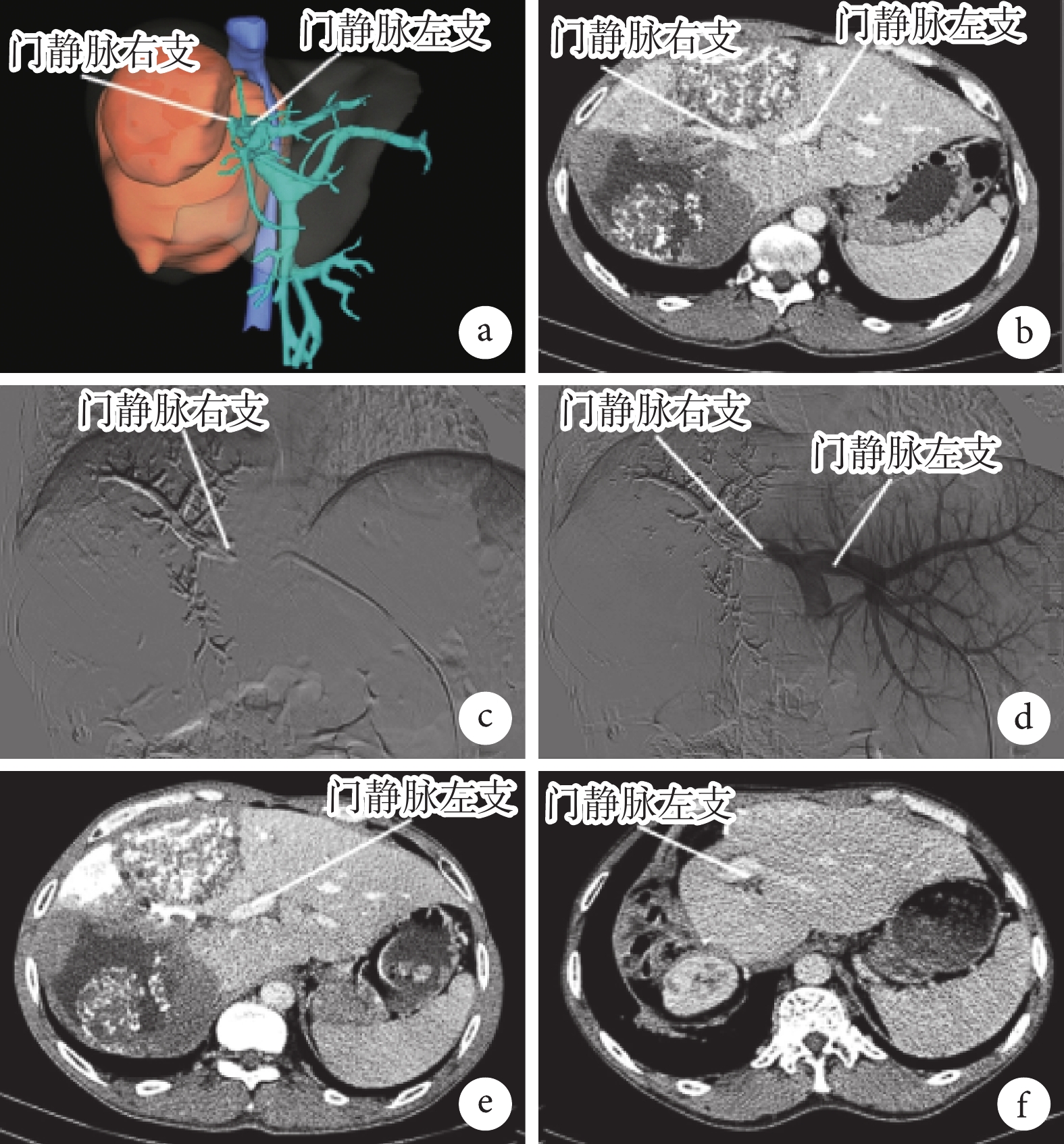
① 一期行PVE。術前行肝臟CT三維重建(圖1a)。PVE前行肝臟增強CT檢查顯示門靜脈左、右支情況(圖1b)。采用經皮經肝穿刺門靜脈插管治療。在數字減影血管造影(digital subtraction angiography,DSA)下經劍突穿刺門靜脈健側分支,選擇性插管至門靜脈主干并造影,明確門靜脈分支及主干;經導絲引導造影管進入門靜脈患側支內,利用微導管注射栓塞劑或可控彈簧圈以栓塞門靜脈患側支(圖1c);再次造影見患側肝內門靜脈血流完全阻斷,健側肝內門靜脈分支通暢(圖1d)。② 二期“在體優先”自體肝移植理念下的復雜肝切除手術。二期術前增強CT檢查評估手術可行性(圖1e)。貫徹“在體優先”理念,游離肝臟,明確棘球蚴病灶位置、大小及侵犯程度后,采取常規肝切除方式,優先在體劈裂肝臟,當劈裂至重要血管受侵犯處時根據血管受侵情況合理選擇手術方式:第一種情況,半肝離體即可完成病灶及受侵脈管的切除及重建;第二種情況,評估無法實現前一種手術方式,則行全肝離體,在體內建立臨時的下腔靜脈及門靜脈轉流通道,同時在體外對病肝進行病灶切除并重建流入和流出道,最后將完整切除病灶后的殘肝移植回體內。二期肝切除手術后第12個月時行增強CT示病灶完整切除未見復發,殘肝生長及血供良好(圖1f)。
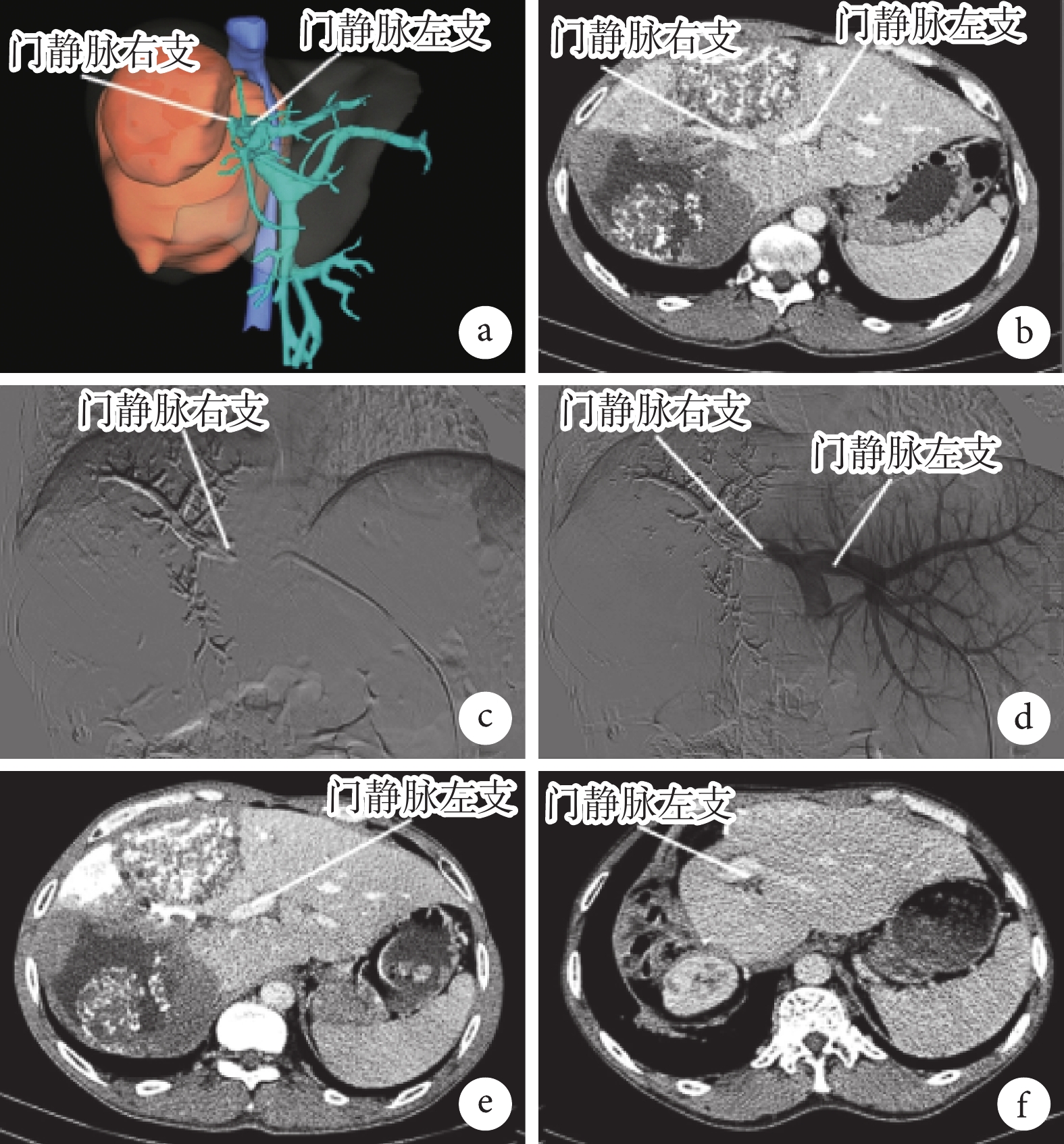 圖1
示PVE一期及二期手術的影像學檢查結果
圖1
示PVE一期及二期手術的影像學檢查結果
a:PVE術前CT三維重建圖像;b:PVE前增強CT見門靜脈左、右支情況;c:DSA下見術中栓塞門靜脈右支情況;d:DSA下見PVE術畢門靜脈右支閉塞、門靜脈左支通暢;e:二期肝切除術前1周時行增強CT示門靜脈右支栓塞,左肝體積增大;f:二期肝切除手術后第12個月時的增強CT示病灶完整切除未見復發,殘肝生長及血供良好
1.3.2 LVD后的二期肝切除手術
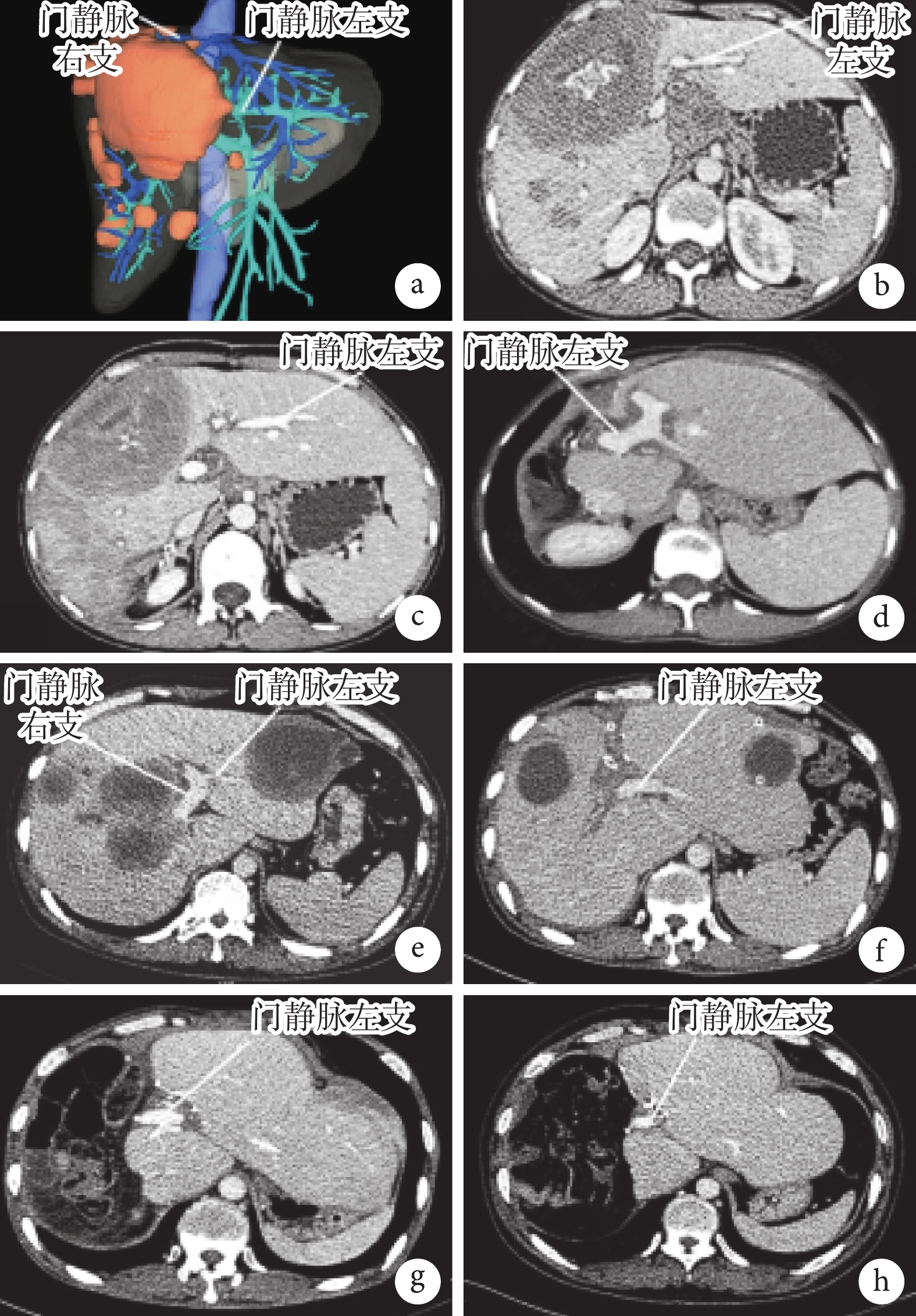
① 一期行LVD。術前行CT三維重建(圖2a)和肝臟增強CT(圖2b)檢查顯示病灶侵犯右葉和左內葉,估計患者FLR不足。通過手術結扎患側門靜脈和肝靜脈及多條粗短肝靜脈。② 二期肝切除手術。LVD術后第2個月時即二期肝切除術前行增強CT檢查評估患者FLR增長情況(圖2c)。游離肝臟,明確棘球蚴病灶位置、大小及侵犯程度后,經評估采取常規肝切除方式,成功實現病灶根治性切除。 二期肝切除術后第9個月時的CT圖像示病灶完整切除未見復發,殘肝生長及血供良好(圖2d)。
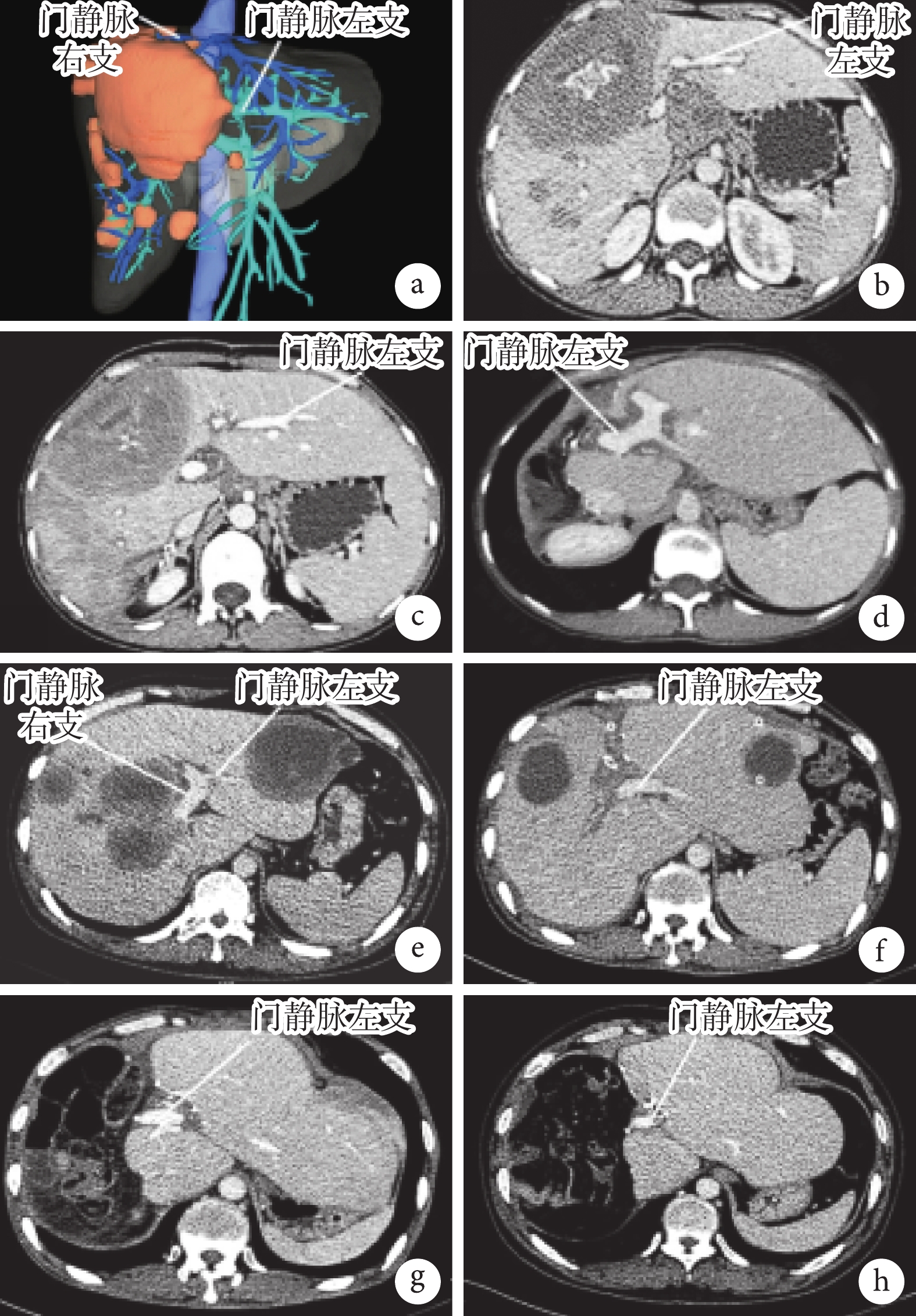 圖2
示LVD或ALPPS一期及二期手術的影像學結果
圖2
示LVD或ALPPS一期及二期手術的影像學結果
a:LVD術前CT三維重建圖像示病灶侵犯右半肝及左內葉;b:LVD術前CT平掃見門靜脈左、右支情況;c:LVD術后第2個月時CT圖像示門靜脈右支閉塞、左半肝增大;d:二期肝切除術后第9個月時的CT圖像示病灶完整切除,未見復發,殘肝生長及血供良好;e:ALPPS術前CT圖像示左、右半肝多發包蟲病灶;f:ALPPS術后第4個月時CT圖像示門靜脈右支結扎,中肝及左肝外葉部分病灶已切除,同時左半肝增大;g:二期肝切除手術后第1個月時CT圖像示病灶完整切除,殘肝血供良好;h:二期肝切除術后第12個月時CT圖像示未見復發,殘肝生長及血供良好
1.3.3 ALPPS后的二期肝切除手術
① 一期行ALPPS手術。術前行肝臟CT檢查顯示門靜脈左、右支情況(圖2e)。術中充分游離肝臟,解剖出門靜脈左、右支及Glisson系統并予以標記,自擬保留肝葉或肝段平面劈裂肝實質,必要時切除擬保留肝臟上的邊緣棘球蚴病灶,或非保留側且已被病灶侵蝕的肝葉或肝段直接切除,部分侵犯肝臟鄰近肝組織者可選擇一并切除,但需要注意,要使切緣距離病灶至少0.5 cm;結扎離斷擬二期切除患側肝臟對應的門靜脈分支;然后肝臟斷面徹底止血。需注意:肝臟劈裂過程中,需仔細結扎細小膽管分支及血管分支,避免術后膽汁漏或出血,必要時懸吊標記患側肝臟肝靜脈主干。② 二期“在體優先”的自體肝移植技術理念下的手術。ALPPS術后第4個月時即二期復雜肝切除手術前第4個月時CT檢查評估手術可行性(圖2f)。術中探查剩余肝臟增生情況,沿一期手術劈裂處使用超聲刀聯合電刀行肝臟常規切除;若有肝內外管道嚴重侵犯時,必要時完整顯露肝后下腔靜脈、第一、二肝門且分別預置阻斷帶,游離肝臟,明確棘球蚴病灶位置、大小及侵犯程度后,采取常規肝切除方式,優先在體劈裂肝臟,當劈裂至重要血管受侵犯處時根據血管受侵情況合理選擇手術方式:第一種情況,可直接在開腹或腹腔鏡下完成病灶切除術;第二種情況,病灶侵犯嚴重,評估無法實現前一種手術方式,通過半離體肝切除術完成病灶及受侵脈管的切除及重建。二期根治性切除術后行增強CT復查示病灶完整切除未見復發,殘肝增生及血供良好(圖2g和圖2h)。
1.4 觀察指標
① 一期手術觀察指標:PVE或LVD前后肝功能相關指標變化情況及術后FLR增長情況,術后并發癥(Clavien-Dindo分級,后文并發癥分級均指此分級)發生情況,手術間隔時間;ALPPS一期手術肝臟劈裂方式、門靜脈結扎選擇、病灶切除、手術時間、手術輸血情況、術后并發癥,ALPPS前后肝功能相關指標變化情況、術后FLR增長情況及手術間隔時間。② PVE、LVD或ALPPS二期肝切除手術后觀察指標包括:手術方式、手術時間、術中出血、術中術后輸血情況,術后并發癥及處理方式。
1.5 術后隨訪
所有患者通過電話或門診就診隨訪,隨訪截至2024年2月1日。隨訪內容包括患者術后一般情況,術后規律服用阿苯達唑情況,進行血管置換的患者長期規律口服抗凝藥物情況,定期進行實驗室及影像學檢查。
1.6 統計學方法
采用SPSS 27.0軟件對數據進行統計學分析。計量資料若滿足正態分布以均數±標準差(x±s)進行統計描述,偏態分布以中位數(median,M)和上下四分位數(P25,P75)進行統計描述;計數資料用頻數和百分率(%)描述。本研究中的計量資料比較均為同一對象治療前后的對比,故采用配對樣本比較的t檢驗或Wilcoxon符號秩檢驗。檢驗水準α=0.05。
2 結果
2.1 納入患者的基本資料
本研究共分析了11例晚期HAE患者,其術前基本資料見表1。男6例、女5例,年齡26~59歲,有4例患者有乙型肝炎(簡稱“乙肝”)病史,病灶最大直徑4.3~13.7 cm,一期有2例行PVE、2例行LVD、7例行ALPPS。11例患者均為藏族,均有長期疫區居住史,患者術前均無黃疸,術前Child-Pugh分級均為A級,除病例9外,其余10患者均為多發腫囊。
2.2 PVE后的二期肝切除術后結果
病例1及病例2行PVE栓塞門靜脈右支主干,PVE術后肝功能指標較術前水平變化不明顯,見表2。2例PVE術后患者均未發生嚴重并發癥。PVE后FLR增生滿足二期根治肝切除手術標準,病例1和病例2分別于一期PVE后第150和300天時行二期ELRA手術及半離體肝切除術,二期手術時間分別為560和450 min、術中出血量分別為700和600 mL,病例2術中輸注懸浮紅細胞3 U,二期手術后分別發生Ⅱ級和Ⅰ級并發癥,均不需要干預。
2.3 LVD后的二期肝切除術后結果
病例3及病例4行LVD手術結扎門靜脈右支主干、肝右靜脈及多條粗短肝靜脈,LVD后肝功能指標較術前水平變化不明顯,見表2。一期手術后2例患者均未發生嚴重并發癥。病例3及病例4在行LVD后FLR增生滿足二期根治切除手術標準,分別于術后第52天和第62天均直接行二期肝切除術,手術時間分別為330和300 min、術中出血量分別為400和300 mL,病例3術中輸注懸浮紅細胞3 U,二期手術后僅發生Ⅰ級并發癥,不需要干預。
2.4 ALPPS后的二期“在體優先”術后結果
2.4.1 ALPPS 一期術中及術后情況
7例患者均成功行ALPPS一期手術,術中處理情況見表3。病例5、7及10行中肝棘球蚴病灶完整切除(其中病例5還一并切除了部分受侵膈肌及心包)后,左右半肝已呈部分劈裂狀態,均結扎門靜脈左支(其中病例7僅S6段保留完整的入肝及出肝管道系統,結扎門靜脈左支及右前支,增加S6段的門靜脈供血);病例6、8及11行左肝切除(其中病例6和11是左半肝切除,病例11還聯合了右后葉棘球蚴病灶和部分膈肌切除,病例8是左外葉棘球蚴病灶聯合中肝部分邊緣病灶切除)后,病例8和11的左右半肝已呈部分劈裂狀態、病例6沿右肝后葉棘球蚴病灶邊緣劈裂右前葉及右后葉,病例8和11結扎門靜脈右支、病例6結扎門靜脈左支。ALPPS一期手術前后肝功能指標變化不明顯,見表4。7例患者經ALPPS一期手術后FLR增生效果滿意(表4),均滿足二期根治性切除的FLR/SLV標準。
2.4.2 二期術中及術后情況
7例行一期ALPPS患者增肝手術和二期肝切除手術的間隔時間[M(P25,P75)]為130(120,240)d。1例(病例7)通過半離體肝切除術完成病灶根治性切除,其余6例患者直接通過肝切除術完成病灶切除。二期肝切除手術時間 [M(P25,P75)]為360(250,420) min;術中出血量 [M(P25,P75)]為600(200,3 000)mL;術中及術后輸入紅細胞 [M(P25,P75)]為6.0(0.0,15.0)U,輸入新鮮冰凍血漿 [M(P25,P75)]為450(0,
2.5 隨訪結果
11例患者均獲得隨訪,隨訪時間 [M(P25,P75)]為36(15,75)個月。所有患者均堅持按療程服用阿苯達唑;有1例行ALPPS患者在術后第3年時復發再次行手術切除,其余10例患者實現了無病灶生存。
3 討論
由于肝棘球蚴病就診時已是晚期,若直接行根治性肝切除手術后往往會出現FLR不足,患者易發生肝切除術后肝衰竭,從而導致患者預后不佳。因此,術前進行增肝治療顯得尤為重要,其方法較多,本研究將重點討論PVE、LVD和ALPPS這3種增肝手術方式。
3.1 PVE
采用PVE增肝手術是通過介入實現對患側門靜脈栓塞,從而引起患側肝臟萎縮,讓更多的血液流向健側,促進增肝,此方法可用于那些預計肝切除術后FLR不足的患者。然而不足的是,由于PVE術后FLR增長一般需4~6周,此期間疾病可能進展,有文獻[9-11]報道,約25%的肝癌患者因此期間疾病進展而無法進行二期根治性手術。然而,與肝癌相比,HAE生長緩慢[12-13],因此在晚期HAE治療中采用PVE進行增肝治療是合理的。但對于肝硬化伴腹水、門靜脈高壓伴食管胃底靜脈曲張中度以上的高齡患者,應該謹慎選擇PVE[14]。近年有研究者[15]提出,對于肝功能Child-Pugh分級A級,肝功能正常者其FLR/SLV<40%或肝功能受損者(10%≤吲哚菁綠15 min滯留率≤20%)者其FLR/SLV<50%,并且保留側肝臟無腫瘤、無遠處轉移的患者,可先行PVE增肝,若保留側肝葉內膽管由于腫瘤壓迫引起梗阻性黃疸,可行經皮經肝膽管引流術或內支架減黃后再行PVE增肝。在本研究中,有2例(病例1和2)HAE患者采用了PVE增肝,分別在PVE后第150和300天時FLR/SLV分別為37.85%、49.66%和33.94%、58.37%,均達到肝切除標準,隨后分別采用ELRA及半離體肝切除術實現了病灶的根治性切除,術后不良反應少,預后較好。但二期手術方式較為復雜,需要進一步更多的臨床數據來確認療效。
3.2 LVD
2016年有研究者[16]報道1例由于肝右靜脈和門靜脈右支的早期血栓完全形成后,發現其右肝發生萎縮而左肝卻明顯肥大,但肝功能逐漸改善直至完全恢復。據此,有研究者[17]提出了一種用于誘發肝體積增長的LVD方式,即聯合應用PVE和肝靜脈栓塞,發現該方法能使肝臟快速增長,未發現嚴重不良反應發生且對肝功能影響不大;而且有研究者[18]發現,與行 ALPPS患者相比,采用LVD患者二期術后Ⅲ級以上并發癥發生率(13.2%比20.5%)及90 d內病死率(1.7%比6.8%)更低。可見,LVD的增生速度快于PVE,但稍慢于ALPPS,而LVD安全性可能優于ALPPS[17-19]。然而將LVD用于治療HAE的相關報道還較少。在本研究中病例3系首次報道用于治療HAE[20],因此將LVD用于治療HAE仍處于探索階段,需要更大樣本量的研究來進一步證實其安全性及有效性。
3.3 ALPPS
ALPPS作為分期肝切除的一種特殊術式,也可作為PVE無效的補救性術式[21-22]。該術式最早由de Santiba?es等[23]于2012年應用于肝臟巨大腫瘤的分期切除,他們將這一術式命名為“聯合肝臟離斷和門靜脈結扎二步肝切除術”。ALPPS一期手術通過劈裂肝實質,離斷左右肝之間的靜脈交通支,然后結扎離斷擬二期切除肝臟對應的門靜脈分支,使血液更多流向了保留側肝臟,從而實現肝體積短時間內的迅速增長,以達到二期手術完整切除腫瘤并避免肝切除術后肝衰竭發生。不同于PVE,ALPPS同時離斷了潛在的交通支,促使保留側肝臟在更短時間內實現增長,縮短兩次手術的時間間隔[24],并且可一并切除部分病灶。但仍有患者由于多已處于腫瘤較晚期,腫瘤增長較快,使部分腫瘤患者因為手術間隙發生保留側腫瘤轉移而無法行二期根治切除。相對于肝臟其他惡性腫瘤而言,HAE進展緩慢,兩次分期手術間隔不會明顯進展,故理論上相較于肝臟其他惡性腫瘤而言,ALPPS術更適合于終末期HAE的手術治療。Akbulut等[25]于2018年將ALPPS 應用于終末期HAE患者的右半肝切除,為HAE患者的根治性切除開辟了新路徑。在本研究中,ALPPS一期手術與二期肝切除手術間隔時間 [M(P25,P75)]為130(120,240) d, FLR增加明顯,FLR/SLV由術前的(29.39±2.17)%增大至(50.19±2.98)%,隨后二期肝切除手術中1例行半離體肝切除術,其余患者直接行復雜肝切除術完成對病灶的根治性切除。由于HAE具有不規則侵襲性生長的特點,傳統的ALPPS手術在一期手術中難以保留完整的肝葉。然而,此類患者通常尚保留有完整的功能肝段,且具備比硬化肝臟更活躍的增生能力。Schadde等[26]報道,將保留單個肝段的ALPPS手術應用于結直腸癌肝轉移患者,患者良好的預后證明該手術方式依然是有效安全的。基于此,筆者團隊也通過應用僅保留S6段的變異ALPPS聯合下腔靜脈重建,成功治療本次研究中的病例7患者,取得較好效果。因此,針對FLR不足的HAE患者,根據患者功能肝段的具體情況選擇ALPPS及其變異術式,是一種有效的治療方式[27]。但與傳統分期肝切除術相比,ALPPS術有更多的并發癥和更高的死亡率[13],通過ALPPS 促使肝臟增生的肝細胞相較于PVE,其密度更大,細胞更小,并且肝組織中的竇狀隙更易出現狹窄,胞內脂褐素顆粒及細胞器也比PVE少,這提示ALPPS誘導增生的肝細胞較為幼稚,進而誤判FLR,這是導致術后肝衰竭發生率高的原因之一[28],同時相較于PVE,ALPPS帶來的更大的手術創傷使得肝臟發生不同程度的水腫,影響對FLR的判斷,進而影響ALPPS術后的預后。有學者[29]用 ALPPS一期術后的動態生長速率來描述標準化FLR每日增長率,認為當動態生長速率≥6%/d時,肝切除術后肝衰竭的發生風險顯著降低。在對ALPPS領域的不斷探索中,衍生出眾多改良術式以應對其不良預后,如在腹腔鏡下進行兩期ALPPS 手術。總而來說,ALPPS手術操作復雜、創傷大、并發癥發生率高, 所以實施ALPPS術前仍需慎重考慮和評估[13]。
4 結論
將PVE、LVD和ALPPS 用于FLR不足的晚期HAE患者增肝效果明顯,有效預防了術后小肝綜合征的發生,降低了肝切除術后肝衰竭發生的風險,為原本無法根治性切除的晚期HAE患者帶來了新的生機。但3種術式各有利弊:① PVE需要更長的時間等待FLR的增長(本組資料中2例分別達5個月及10個月),這期間疾病可能發生進展,但是PVE創傷小,可通過介入方式完成,安全性更高,術后均未發生需要干預的Ⅲ級及以上并發癥。② ALPPS可使FLR增生更快,兩期手術時間間隔中位時間低于5個月,但是ALPPS所誘導的增生肝臟更加幼稚以及手術創傷所致的肝臟水腫容易導致在二期術前對FLR進行錯誤的估計;有文獻[17-19, 30]報道,相比于PVE,ALPPS二期術后并發癥發生率和病死率更高。本組7例ALPPS術中發生了1例Ⅲb級并發癥。③ LVD的FLR/SLV增生速度快于PVE,兩期手術間隔時間更短(在2個月之內),其安全性可能優于ALPPS手術,術后均未發生需要干預的Ⅲ級及以上并發癥,但LVD在治療HAE領域仍需繼續探究。在進行二步肝切除一期手術方式選擇時,有研究者[15]建議應根據患者的FLR/SLV進行個體化選擇:當FLR/SLV<30%,ALPPS可能更加適合;若FLR/SLV為30%~40%時,應當優先考慮行PVE。因此,晚期HAE患者術前應充分評估與個體化處理,最大限度地降低術后并發癥及肝功能衰竭發生幾率[31]。在本研究中,由于納入樣本量較少,且二期手術難度均較大,數據可能存在偏倚。因此,需要進一步的前瞻性研究來為臨床治療的選擇提供更加具有普適性的建議。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:邢洪銘和黃建花負責文獻總結、起草并撰寫文章;游欣雨和廖玉波負責文獻查詢與整理;張宇修訂論文格式、文章結構及文章重要論點,給予指導性意見并對最終文稿內容進行審閱。
倫理聲明:該研究已通過了四川省醫學科學院?四川省人民醫院醫學倫理委員會的審批,批文編號:倫審(研)2016年第24號。
棘球蚴病,又稱“包蟲病”,它主要侵犯肝臟,肝棘球蚴病約占棘球蚴病70%[1],其中肝泡型棘球蚴病(hepatic alveolar echinococcosis,HAE)的危害相較于肝囊型棘球蚴病更為嚴重,其中未經有效治療的HAE患者10年病死率超過90%[2-6]。由于肝棘球蚴病患者大多生活在偏遠貧困的山區或牧區,“早發現、早診斷、早治療”的三早原則往往難以實現,因此大部分患者就診時已是晚期,同時高昂的治療費用讓大多數患者無力負擔。幸運的是,手術技術的不斷進步以及我國中央財政補助政策的實施,讓這些地區的肝棘球蚴病患者有了根治的希望。但是這些患者由于就診時多數處于晚期,若直接行根治性肝切除術后往往會出現剩余肝體積(future liver remnant,FLR)不足。基于筆者團隊[7-8]的經驗,當患者的FLR/標準肝體積(standard liver volume,SLV)<30%時行復雜的肝病灶切除手術,譬如行離體肝切除聯合自體肝移植術(ex vivo liver resection and autotransplantation,ELRA)或半離體肝切除術往往難以實現。需注意的是,FLR/SLV比值根據患者肝功能、有無黃疸、是否合并慢性肝炎等因素有所不同。FLR/SLV不足所引起的術后小肝綜合征會導致患者面臨發生肝切除術后肝衰竭的風險,由此,在進行根治性肝切除術前進行保留側肝臟增生(以下簡稱“增肝”)治療顯得尤為重要。本研究團隊對此類初始不宜一期行根治性肝切除術的晚期HAE患者的治療方法進行了探索,即一期采用門靜脈栓塞術(portal vein embolization,PVE)、肝靜脈剝奪術(liver venous deprivation,LVD)或肝臟分隔聯合門靜脈結扎的二步肝切除術(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)來增肝,以增大FLR;然后再二期行復雜肝切除手術如ELRA或半離體肝切除術等方式治療,對其可行性、安全性及預后情況進行回顧性分析并總結。
1 對象與方法
1.1 研究對象
回顧性收集四川省人民醫院2016年12月至2022年12月期間對預計行肝切除術后FLR不足且采用二步肝切除治療的晚期HAE患者的臨床病理資料,所有患者均經術后病理檢查結果證實為HAE。
1.2 一期行PVE、LVD或ALPPS后二期行復雜肝切除的適應證和禁忌證
適應證:① 術前影像學評估FLR不足的病例,肝功能正常者FLR/SLV<35%,慢性肝臟疾病患者FLR/SLV<40%;② 經多學科協作團隊討論后認為行一期肝切除手術難度大、預計肝切除術后肝衰竭發生風險高。禁忌證:① 肝囊型棘球蚴病;② 同時合并嚴重的器官功能不全不能耐受手術患者;③ 同時合并其他惡性腫瘤患者。
1.3 手術方法
1.3.1 PVE后的二期肝切除手術
① 一期行PVE。術前行肝臟CT三維重建(圖1a)。PVE前行肝臟增強CT檢查顯示門靜脈左、右支情況(圖1b)。采用經皮經肝穿刺門靜脈插管治療。在數字減影血管造影(digital subtraction angiography,DSA)下經劍突穿刺門靜脈健側分支,選擇性插管至門靜脈主干并造影,明確門靜脈分支及主干;經導絲引導造影管進入門靜脈患側支內,利用微導管注射栓塞劑或可控彈簧圈以栓塞門靜脈患側支(圖1c);再次造影見患側肝內門靜脈血流完全阻斷,健側肝內門靜脈分支通暢(圖1d)。② 二期“在體優先”自體肝移植理念下的復雜肝切除手術。二期術前增強CT檢查評估手術可行性(圖1e)。貫徹“在體優先”理念,游離肝臟,明確棘球蚴病灶位置、大小及侵犯程度后,采取常規肝切除方式,優先在體劈裂肝臟,當劈裂至重要血管受侵犯處時根據血管受侵情況合理選擇手術方式:第一種情況,半肝離體即可完成病灶及受侵脈管的切除及重建;第二種情況,評估無法實現前一種手術方式,則行全肝離體,在體內建立臨時的下腔靜脈及門靜脈轉流通道,同時在體外對病肝進行病灶切除并重建流入和流出道,最后將完整切除病灶后的殘肝移植回體內。二期肝切除手術后第12個月時行增強CT示病灶完整切除未見復發,殘肝生長及血供良好(圖1f)。
 圖1
示PVE一期及二期手術的影像學檢查結果
圖1
示PVE一期及二期手術的影像學檢查結果
a:PVE術前CT三維重建圖像;b:PVE前增強CT見門靜脈左、右支情況;c:DSA下見術中栓塞門靜脈右支情況;d:DSA下見PVE術畢門靜脈右支閉塞、門靜脈左支通暢;e:二期肝切除術前1周時行增強CT示門靜脈右支栓塞,左肝體積增大;f:二期肝切除手術后第12個月時的增強CT示病灶完整切除未見復發,殘肝生長及血供良好
1.3.2 LVD后的二期肝切除手術
① 一期行LVD。術前行CT三維重建(圖2a)和肝臟增強CT(圖2b)檢查顯示病灶侵犯右葉和左內葉,估計患者FLR不足。通過手術結扎患側門靜脈和肝靜脈及多條粗短肝靜脈。② 二期肝切除手術。LVD術后第2個月時即二期肝切除術前行增強CT檢查評估患者FLR增長情況(圖2c)。游離肝臟,明確棘球蚴病灶位置、大小及侵犯程度后,經評估采取常規肝切除方式,成功實現病灶根治性切除。 二期肝切除術后第9個月時的CT圖像示病灶完整切除未見復發,殘肝生長及血供良好(圖2d)。
 圖2
示LVD或ALPPS一期及二期手術的影像學結果
圖2
示LVD或ALPPS一期及二期手術的影像學結果
a:LVD術前CT三維重建圖像示病灶侵犯右半肝及左內葉;b:LVD術前CT平掃見門靜脈左、右支情況;c:LVD術后第2個月時CT圖像示門靜脈右支閉塞、左半肝增大;d:二期肝切除術后第9個月時的CT圖像示病灶完整切除,未見復發,殘肝生長及血供良好;e:ALPPS術前CT圖像示左、右半肝多發包蟲病灶;f:ALPPS術后第4個月時CT圖像示門靜脈右支結扎,中肝及左肝外葉部分病灶已切除,同時左半肝增大;g:二期肝切除手術后第1個月時CT圖像示病灶完整切除,殘肝血供良好;h:二期肝切除術后第12個月時CT圖像示未見復發,殘肝生長及血供良好
1.3.3 ALPPS后的二期肝切除手術
① 一期行ALPPS手術。術前行肝臟CT檢查顯示門靜脈左、右支情況(圖2e)。術中充分游離肝臟,解剖出門靜脈左、右支及Glisson系統并予以標記,自擬保留肝葉或肝段平面劈裂肝實質,必要時切除擬保留肝臟上的邊緣棘球蚴病灶,或非保留側且已被病灶侵蝕的肝葉或肝段直接切除,部分侵犯肝臟鄰近肝組織者可選擇一并切除,但需要注意,要使切緣距離病灶至少0.5 cm;結扎離斷擬二期切除患側肝臟對應的門靜脈分支;然后肝臟斷面徹底止血。需注意:肝臟劈裂過程中,需仔細結扎細小膽管分支及血管分支,避免術后膽汁漏或出血,必要時懸吊標記患側肝臟肝靜脈主干。② 二期“在體優先”的自體肝移植技術理念下的手術。ALPPS術后第4個月時即二期復雜肝切除手術前第4個月時CT檢查評估手術可行性(圖2f)。術中探查剩余肝臟增生情況,沿一期手術劈裂處使用超聲刀聯合電刀行肝臟常規切除;若有肝內外管道嚴重侵犯時,必要時完整顯露肝后下腔靜脈、第一、二肝門且分別預置阻斷帶,游離肝臟,明確棘球蚴病灶位置、大小及侵犯程度后,采取常規肝切除方式,優先在體劈裂肝臟,當劈裂至重要血管受侵犯處時根據血管受侵情況合理選擇手術方式:第一種情況,可直接在開腹或腹腔鏡下完成病灶切除術;第二種情況,病灶侵犯嚴重,評估無法實現前一種手術方式,通過半離體肝切除術完成病灶及受侵脈管的切除及重建。二期根治性切除術后行增強CT復查示病灶完整切除未見復發,殘肝增生及血供良好(圖2g和圖2h)。
1.4 觀察指標
① 一期手術觀察指標:PVE或LVD前后肝功能相關指標變化情況及術后FLR增長情況,術后并發癥(Clavien-Dindo分級,后文并發癥分級均指此分級)發生情況,手術間隔時間;ALPPS一期手術肝臟劈裂方式、門靜脈結扎選擇、病灶切除、手術時間、手術輸血情況、術后并發癥,ALPPS前后肝功能相關指標變化情況、術后FLR增長情況及手術間隔時間。② PVE、LVD或ALPPS二期肝切除手術后觀察指標包括:手術方式、手術時間、術中出血、術中術后輸血情況,術后并發癥及處理方式。
1.5 術后隨訪
所有患者通過電話或門診就診隨訪,隨訪截至2024年2月1日。隨訪內容包括患者術后一般情況,術后規律服用阿苯達唑情況,進行血管置換的患者長期規律口服抗凝藥物情況,定期進行實驗室及影像學檢查。
1.6 統計學方法
采用SPSS 27.0軟件對數據進行統計學分析。計量資料若滿足正態分布以均數±標準差(x±s)進行統計描述,偏態分布以中位數(median,M)和上下四分位數(P25,P75)進行統計描述;計數資料用頻數和百分率(%)描述。本研究中的計量資料比較均為同一對象治療前后的對比,故采用配對樣本比較的t檢驗或Wilcoxon符號秩檢驗。檢驗水準α=0.05。
2 結果
2.1 納入患者的基本資料
本研究共分析了11例晚期HAE患者,其術前基本資料見表1。男6例、女5例,年齡26~59歲,有4例患者有乙型肝炎(簡稱“乙肝”)病史,病灶最大直徑4.3~13.7 cm,一期有2例行PVE、2例行LVD、7例行ALPPS。11例患者均為藏族,均有長期疫區居住史,患者術前均無黃疸,術前Child-Pugh分級均為A級,除病例9外,其余10患者均為多發腫囊。
2.2 PVE后的二期肝切除術后結果
病例1及病例2行PVE栓塞門靜脈右支主干,PVE術后肝功能指標較術前水平變化不明顯,見表2。2例PVE術后患者均未發生嚴重并發癥。PVE后FLR增生滿足二期根治肝切除手術標準,病例1和病例2分別于一期PVE后第150和300天時行二期ELRA手術及半離體肝切除術,二期手術時間分別為560和450 min、術中出血量分別為700和600 mL,病例2術中輸注懸浮紅細胞3 U,二期手術后分別發生Ⅱ級和Ⅰ級并發癥,均不需要干預。
2.3 LVD后的二期肝切除術后結果
病例3及病例4行LVD手術結扎門靜脈右支主干、肝右靜脈及多條粗短肝靜脈,LVD后肝功能指標較術前水平變化不明顯,見表2。一期手術后2例患者均未發生嚴重并發癥。病例3及病例4在行LVD后FLR增生滿足二期根治切除手術標準,分別于術后第52天和第62天均直接行二期肝切除術,手術時間分別為330和300 min、術中出血量分別為400和300 mL,病例3術中輸注懸浮紅細胞3 U,二期手術后僅發生Ⅰ級并發癥,不需要干預。
2.4 ALPPS后的二期“在體優先”術后結果
2.4.1 ALPPS 一期術中及術后情況
7例患者均成功行ALPPS一期手術,術中處理情況見表3。病例5、7及10行中肝棘球蚴病灶完整切除(其中病例5還一并切除了部分受侵膈肌及心包)后,左右半肝已呈部分劈裂狀態,均結扎門靜脈左支(其中病例7僅S6段保留完整的入肝及出肝管道系統,結扎門靜脈左支及右前支,增加S6段的門靜脈供血);病例6、8及11行左肝切除(其中病例6和11是左半肝切除,病例11還聯合了右后葉棘球蚴病灶和部分膈肌切除,病例8是左外葉棘球蚴病灶聯合中肝部分邊緣病灶切除)后,病例8和11的左右半肝已呈部分劈裂狀態、病例6沿右肝后葉棘球蚴病灶邊緣劈裂右前葉及右后葉,病例8和11結扎門靜脈右支、病例6結扎門靜脈左支。ALPPS一期手術前后肝功能指標變化不明顯,見表4。7例患者經ALPPS一期手術后FLR增生效果滿意(表4),均滿足二期根治性切除的FLR/SLV標準。
2.4.2 二期術中及術后情況
7例行一期ALPPS患者增肝手術和二期肝切除手術的間隔時間[M(P25,P75)]為130(120,240)d。1例(病例7)通過半離體肝切除術完成病灶根治性切除,其余6例患者直接通過肝切除術完成病灶切除。二期肝切除手術時間 [M(P25,P75)]為360(250,420) min;術中出血量 [M(P25,P75)]為600(200,3 000)mL;術中及術后輸入紅細胞 [M(P25,P75)]為6.0(0.0,15.0)U,輸入新鮮冰凍血漿 [M(P25,P75)]為450(0,
2.5 隨訪結果
11例患者均獲得隨訪,隨訪時間 [M(P25,P75)]為36(15,75)個月。所有患者均堅持按療程服用阿苯達唑;有1例行ALPPS患者在術后第3年時復發再次行手術切除,其余10例患者實現了無病灶生存。
3 討論
由于肝棘球蚴病就診時已是晚期,若直接行根治性肝切除手術后往往會出現FLR不足,患者易發生肝切除術后肝衰竭,從而導致患者預后不佳。因此,術前進行增肝治療顯得尤為重要,其方法較多,本研究將重點討論PVE、LVD和ALPPS這3種增肝手術方式。
3.1 PVE
采用PVE增肝手術是通過介入實現對患側門靜脈栓塞,從而引起患側肝臟萎縮,讓更多的血液流向健側,促進增肝,此方法可用于那些預計肝切除術后FLR不足的患者。然而不足的是,由于PVE術后FLR增長一般需4~6周,此期間疾病可能進展,有文獻[9-11]報道,約25%的肝癌患者因此期間疾病進展而無法進行二期根治性手術。然而,與肝癌相比,HAE生長緩慢[12-13],因此在晚期HAE治療中采用PVE進行增肝治療是合理的。但對于肝硬化伴腹水、門靜脈高壓伴食管胃底靜脈曲張中度以上的高齡患者,應該謹慎選擇PVE[14]。近年有研究者[15]提出,對于肝功能Child-Pugh分級A級,肝功能正常者其FLR/SLV<40%或肝功能受損者(10%≤吲哚菁綠15 min滯留率≤20%)者其FLR/SLV<50%,并且保留側肝臟無腫瘤、無遠處轉移的患者,可先行PVE增肝,若保留側肝葉內膽管由于腫瘤壓迫引起梗阻性黃疸,可行經皮經肝膽管引流術或內支架減黃后再行PVE增肝。在本研究中,有2例(病例1和2)HAE患者采用了PVE增肝,分別在PVE后第150和300天時FLR/SLV分別為37.85%、49.66%和33.94%、58.37%,均達到肝切除標準,隨后分別采用ELRA及半離體肝切除術實現了病灶的根治性切除,術后不良反應少,預后較好。但二期手術方式較為復雜,需要進一步更多的臨床數據來確認療效。
3.2 LVD
2016年有研究者[16]報道1例由于肝右靜脈和門靜脈右支的早期血栓完全形成后,發現其右肝發生萎縮而左肝卻明顯肥大,但肝功能逐漸改善直至完全恢復。據此,有研究者[17]提出了一種用于誘發肝體積增長的LVD方式,即聯合應用PVE和肝靜脈栓塞,發現該方法能使肝臟快速增長,未發現嚴重不良反應發生且對肝功能影響不大;而且有研究者[18]發現,與行 ALPPS患者相比,采用LVD患者二期術后Ⅲ級以上并發癥發生率(13.2%比20.5%)及90 d內病死率(1.7%比6.8%)更低。可見,LVD的增生速度快于PVE,但稍慢于ALPPS,而LVD安全性可能優于ALPPS[17-19]。然而將LVD用于治療HAE的相關報道還較少。在本研究中病例3系首次報道用于治療HAE[20],因此將LVD用于治療HAE仍處于探索階段,需要更大樣本量的研究來進一步證實其安全性及有效性。
3.3 ALPPS
ALPPS作為分期肝切除的一種特殊術式,也可作為PVE無效的補救性術式[21-22]。該術式最早由de Santiba?es等[23]于2012年應用于肝臟巨大腫瘤的分期切除,他們將這一術式命名為“聯合肝臟離斷和門靜脈結扎二步肝切除術”。ALPPS一期手術通過劈裂肝實質,離斷左右肝之間的靜脈交通支,然后結扎離斷擬二期切除肝臟對應的門靜脈分支,使血液更多流向了保留側肝臟,從而實現肝體積短時間內的迅速增長,以達到二期手術完整切除腫瘤并避免肝切除術后肝衰竭發生。不同于PVE,ALPPS同時離斷了潛在的交通支,促使保留側肝臟在更短時間內實現增長,縮短兩次手術的時間間隔[24],并且可一并切除部分病灶。但仍有患者由于多已處于腫瘤較晚期,腫瘤增長較快,使部分腫瘤患者因為手術間隙發生保留側腫瘤轉移而無法行二期根治切除。相對于肝臟其他惡性腫瘤而言,HAE進展緩慢,兩次分期手術間隔不會明顯進展,故理論上相較于肝臟其他惡性腫瘤而言,ALPPS術更適合于終末期HAE的手術治療。Akbulut等[25]于2018年將ALPPS 應用于終末期HAE患者的右半肝切除,為HAE患者的根治性切除開辟了新路徑。在本研究中,ALPPS一期手術與二期肝切除手術間隔時間 [M(P25,P75)]為130(120,240) d, FLR增加明顯,FLR/SLV由術前的(29.39±2.17)%增大至(50.19±2.98)%,隨后二期肝切除手術中1例行半離體肝切除術,其余患者直接行復雜肝切除術完成對病灶的根治性切除。由于HAE具有不規則侵襲性生長的特點,傳統的ALPPS手術在一期手術中難以保留完整的肝葉。然而,此類患者通常尚保留有完整的功能肝段,且具備比硬化肝臟更活躍的增生能力。Schadde等[26]報道,將保留單個肝段的ALPPS手術應用于結直腸癌肝轉移患者,患者良好的預后證明該手術方式依然是有效安全的。基于此,筆者團隊也通過應用僅保留S6段的變異ALPPS聯合下腔靜脈重建,成功治療本次研究中的病例7患者,取得較好效果。因此,針對FLR不足的HAE患者,根據患者功能肝段的具體情況選擇ALPPS及其變異術式,是一種有效的治療方式[27]。但與傳統分期肝切除術相比,ALPPS術有更多的并發癥和更高的死亡率[13],通過ALPPS 促使肝臟增生的肝細胞相較于PVE,其密度更大,細胞更小,并且肝組織中的竇狀隙更易出現狹窄,胞內脂褐素顆粒及細胞器也比PVE少,這提示ALPPS誘導增生的肝細胞較為幼稚,進而誤判FLR,這是導致術后肝衰竭發生率高的原因之一[28],同時相較于PVE,ALPPS帶來的更大的手術創傷使得肝臟發生不同程度的水腫,影響對FLR的判斷,進而影響ALPPS術后的預后。有學者[29]用 ALPPS一期術后的動態生長速率來描述標準化FLR每日增長率,認為當動態生長速率≥6%/d時,肝切除術后肝衰竭的發生風險顯著降低。在對ALPPS領域的不斷探索中,衍生出眾多改良術式以應對其不良預后,如在腹腔鏡下進行兩期ALPPS 手術。總而來說,ALPPS手術操作復雜、創傷大、并發癥發生率高, 所以實施ALPPS術前仍需慎重考慮和評估[13]。
4 結論
將PVE、LVD和ALPPS 用于FLR不足的晚期HAE患者增肝效果明顯,有效預防了術后小肝綜合征的發生,降低了肝切除術后肝衰竭發生的風險,為原本無法根治性切除的晚期HAE患者帶來了新的生機。但3種術式各有利弊:① PVE需要更長的時間等待FLR的增長(本組資料中2例分別達5個月及10個月),這期間疾病可能發生進展,但是PVE創傷小,可通過介入方式完成,安全性更高,術后均未發生需要干預的Ⅲ級及以上并發癥。② ALPPS可使FLR增生更快,兩期手術時間間隔中位時間低于5個月,但是ALPPS所誘導的增生肝臟更加幼稚以及手術創傷所致的肝臟水腫容易導致在二期術前對FLR進行錯誤的估計;有文獻[17-19, 30]報道,相比于PVE,ALPPS二期術后并發癥發生率和病死率更高。本組7例ALPPS術中發生了1例Ⅲb級并發癥。③ LVD的FLR/SLV增生速度快于PVE,兩期手術間隔時間更短(在2個月之內),其安全性可能優于ALPPS手術,術后均未發生需要干預的Ⅲ級及以上并發癥,但LVD在治療HAE領域仍需繼續探究。在進行二步肝切除一期手術方式選擇時,有研究者[15]建議應根據患者的FLR/SLV進行個體化選擇:當FLR/SLV<30%,ALPPS可能更加適合;若FLR/SLV為30%~40%時,應當優先考慮行PVE。因此,晚期HAE患者術前應充分評估與個體化處理,最大限度地降低術后并發癥及肝功能衰竭發生幾率[31]。在本研究中,由于納入樣本量較少,且二期手術難度均較大,數據可能存在偏倚。因此,需要進一步的前瞻性研究來為臨床治療的選擇提供更加具有普適性的建議。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:邢洪銘和黃建花負責文獻總結、起草并撰寫文章;游欣雨和廖玉波負責文獻查詢與整理;張宇修訂論文格式、文章結構及文章重要論點,給予指導性意見并對最終文稿內容進行審閱。
倫理聲明:該研究已通過了四川省醫學科學院?四川省人民醫院醫學倫理委員會的審批,批文編號:倫審(研)2016年第24號。