引用本文: 劉曉晴, 蔡華健, 邱浩恒, 楊建欽, 余艾妮, 李麗媚, 趙子建, 穆云萍, 李芳紅. 新型磷酸二酯酶5抑制劑CPD1預防性治療對博來霉素誘導肺纖維化大鼠的保護作用. 中國呼吸與危重監護雜志, 2023, 22(11): 796-804. doi: 10.7507/1671-6205.202307008 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
間質性肺疾病(interstitial lung disease,ILD)是一類包含200多種異質性肺疾病的群體總稱,其病理特征表現為炎癥和纖維化[1]。肺纖維化(pulmonary fibrosis,PF)是ILD的一種終末期病理變化,主要表現為肺組織結構重構、氣體交換受阻和不可逆的功能減退,最終導致呼吸衰竭,甚至死亡[2]。肺泡上皮細胞的重復性局部微損傷會誘導上皮-間質轉化(epithelial-mesenchymal transition,EMT)的發生并分泌過多的促纖維化介質,從而導致成纖維細胞和肌成纖維細胞的遷移、增殖和活化,并分泌細胞外基質(extracellular matrix,ECM),最終導致肺纖維化。尼達尼布和吡非尼酮是目前僅有的兩種抗肺纖維化藥物[3-4],但它們只能在一定程度上改善纖維化癥狀,均不能徹底治愈疾病。此外,兩者均存在半衰期短、用藥劑量大、費用昂貴和不良反應明顯等不足,也嚴重限制了它們的臨床應用。因此,開發一種安全有效的抗肺纖維化療法是科研工作者亟需解決的一大難題。
磷酸二酯酶(Phosphodiesterase,PDEs)是一類能夠水解環磷酸腺苷(cAMP)或環磷酸鳥苷(cGMP)的水解酶。西地那非(Sildenafil)、他達拉非(Tadalafil)和阿伐那非(Avanafil)等PDE5抑制劑,都存在特異性低、水溶性差和半衰期短等不足,從而導致藥物的生物利用度低和不良反應大。基于此背景,在已公開的Sildenafil類似物WYQ結構基礎上(CN102020645A)[5],本課題組對其進行了優化改造,通過成鹽和共晶篩選,最終得到優良晶型CPD1,其水溶性及腸溶性得到了大幅提升[6]。團隊前期藥效學研究表明,CPD1對野百合堿誘導的肺動脈高壓大鼠[7]、異丙腎上腺素引起的心肌肥大大鼠[8]、四氯化碳引起的肝纖維化小鼠[9]以及單側輸尿管結扎和腎缺血再灌注引起的腎纖維化小鼠[10-11]均有顯著的治療作用,但CPD1對博來霉素(bleomycin,BLM)引起的單側肺纖維化的潛在治療作用還需進一步探究,因此本研究繼續探索了CPD1在肺纖維化中發揮的作用。本研究通過利用左側氣管滴注BLM構建單側肺纖維化大鼠模型,以及利用BLM處理腺癌性人肺泡基底上皮細胞A549,通過肺組織病理學分析及分子生物學技術,觀察新型PDE5抑制劑CPD1對單側肺纖維化大鼠患側肺組織結構損傷、肺間質纖維化及肺泡基底上皮細胞EMT的影響。初步探討CPD1對單側肺纖維化的預防性治療作用,為后續研究CPD1抗肺纖維化的分子機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 實驗動物及分組
雄性SD大鼠(SPF級,220~240 g)50只,購自浙江維通利華實驗動物技術有限公司,動物合格證號:1912180057,生產許可號[SCXK(浙)2019-0001]。將大鼠隨機分為4組:假手術組(Sham組,n=10)、模型組(BLM組,n=14)、CPD1治療組(BLM+CPD1 20 mg/kg,n=13)和尼達尼布陽性對照藥治療組(BLM+Nintedanib 50 mg/kg,n=13)。動物飼養于凱斯艾生物科技(蘇州)有限公司動物中心[SYXK(蘇)2017-0041],研究方案獲得凱斯艾生物科技(蘇州)有限公司IACUC委員會聯合審批確認。
1.1.2 試劑與儀器
CPD1(ET32637-37-P1)委托天津藥明康德新藥開發有限公司合成,經專業COA分析測定其純度達99%,陽性對照藥尼達尼布購自上海水正生物醫藥科技有限公司(CAS:656247-18-6)。胰蛋白酶(25200072)購自美國Gibco公司,胎牛血清(Z7185FBS-500)購自美國Zeta Life公司,RPMI 1640 With L-Glutamine培養基(C3010-0500)購自上海龍田生物科技有限公司,博來霉素硫酸鹽(S1214)購自美國Selleck Chemicals公司。辣根過氧化物酶標記山羊抗兔IgG(H+L)和蘇木精-伊紅(hematoxylin-eosin,HE)染色試劑盒(C0105S)購自上海碧云天生物技術有限公司,改良Masson三色染色試劑盒購自北京索萊寶科技有限公司(G1345)。異氟烷、戊巴比妥鈉麻醉劑、福爾馬林固定液均購自中國國藥集團股份有限公司。注射用鹽酸博來霉素(批號:970592)購自日本化藥株式會社。α平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)(CST:19245S)、纖維連接蛋白(fibronectin,Fn)(abcam:6328)、Ⅰ型膠原蛋白(Collagen Ⅰ)(CST:91144S)。RIPA裂解液(碧云天P0013B)、磷酸酶蛋白酶抑制劑(碧云天P1051)、脫脂奶粉,BSA(上海生工)、PMSF(碧云天ST506)、E-鈣粘蛋白(E-Cadherin,E-Cad)(Affinity:BF0219)、二抗β-actin(sigma,A2228)。CPD1的配制:用生理鹽水配成2.0 mg/mL的藥液,現配現用。尼達尼布的配制:用DMSO配成200 mg/mL的母液,使用時用生理鹽水稀釋成10 mg/mL,現配現用。TRIzol reagent RNA提取試劑盒(美國Invitrogen公司)、PrimeScript? RT reagent Kit(日本TaKaRa),引物由上海生工生物有限公司合成。ChemiDoc+XRS化學發光凝膠成像系統(Bio-Rad)、酶標儀(CMax Plus)、細胞培養箱、石蠟切片機及低溫離心機(美國Thermo Fisher Scientific)、石蠟包埋機(MPS/P1,德國SLEE公司)、冷凍臺(中威電子儀器有限公司)、正置光學顯微鏡(德國LEICA)、–80 ℃冰箱(中國美菱)、烘箱(DH6-9143B5-Ⅲ,上海新苗)、全自動切片數字掃描儀(匈牙利3DHISTECH公司),掃描瀏覽軟件為CaseViewer2.4。
1.2 方法
1.2.1 肺纖維化模型建立及給藥
BLM是一種水溶性糖肽類抗生素,同時也是一種抗腫瘤藥物。BLM通過抑制DNA的代謝,從而達到抑制腫瘤生長的療效。10%~30%接受BLM治療的患者會出現肺部毒性,其表現為非特異性肺炎到肺纖維化,甚至迅速死于肺纖維化[12],BLM誘導的肺纖維化模型是最廣泛用于研究IPF發病機制和評估抗肺纖維化治療的動物模型。本研究所用肺纖維化大鼠模型的構建和鑒定委托凱斯艾(蘇州)生物科技有限公司專業技術團隊完成。大鼠稱重后異氟烷麻醉,頸部消毒鈍性分離正中部肌肉,暴露主氣管,做一倒“T”形切口;PE-20管斜面向下,從切口處插入至左側主支氣管,手術線結扎固定以免脫落,注入BLM(劑量3 mg/kg,體積1.0 mL/kg)[13]。2 h后動物蘇醒,CPD1治療組、尼達尼布陽性對照治療組大鼠分別灌胃CPD1或尼達尼布,Sham組和模型組動物每天灌胃等體積生理鹽水,持續給藥2周。第15 d,利用20%烏拉坦(1 g/kg)腹腔注射麻醉安樂死大鼠,打開腹腔,剪斷腹主動脈,待心臟停止跳動,取出肺臟。每組肺臟將分為以下兩種處理方式:(1)將肺右葉結扎,取等量的福爾馬林液經氣管灌注左肺固定,進行后續的病理相關檢測;(2)收集左肺組織存放在–80℃冰箱備用,用于后續分子實驗的相關檢測。
1.2.2 肺組織病理學觀察
各組肺組織常溫固定24 h,依次經過不同濃度的乙醇脫水、二甲苯透明、浸蠟、包埋冷凍蠟塊后最大肺縱切面連續切片(5 μm),烤片后經二甲苯脫蠟,進行HE染色。在光學顯微鏡下觀察肺組織終末細支氣管損傷和炎癥浸潤、細小肺動脈損傷和炎癥浸潤程度,選取視野拍照并進行評分。評分標準見表1和表2。
1.2.3 Masson三色染色
Masson三色染色是膠原纖維染色經典方法之一,經過Masson三色染色后的膠原纖維呈藍色或綠色。各組肺組織切片經脫蠟脫水后,重鉻酸鉀過夜染色后流水沖洗,鐵蘇木素染色流水沖洗后分化再流水沖洗,麗春紅酸性品紅染色后用流水持續沖洗切片,磷鉬酸染色后不用水洗直接入苯胺藍染液染色,分化后常規脫水透明封片,最后封片劑干燥后光學顯微鏡下觀察評估肺組織中膠原纖維沉積情況,選取視野拍照,對各組肺切片進行纖維化評分,肺纖維化Ashcroft病理評分標準見表3。
1.2.4 免疫組織化學染色
各組肺組織蠟塊切片依次經二甲苯脫蠟、梯度乙醇水化、滅活內源性過氧化氫酶、抗原熱修復后用10%驢血清封閉。一抗(Fn、α-SMA、Collagen Ⅰ)孵育過夜(4℃),二抗室溫孵育1 h,用PBST緩沖液洗脫后加辣根過氧化酶標記的ABC工作液,避光孵育半小時后洗脫,繼續滴加DAB工作液染色,自來水沖洗后滴加蘇木素復染10 s,封片拍照。
1.2.5 細胞的培養與處理
腺癌性人肺泡基底上皮細胞A549采用RPMI 1640培養基(含10% FBS)培養,置于37 ℃,5% CO2及飽和濕度條件的培養箱中常規培養。細胞呈貼壁生長,及時更換培養液,每2~3 d傳代1次,取對數生長期的細胞,吹打制成細胞懸液,按所需濃度接種使用。藥物處理前,用無血清的培養基將細胞饑餓處理12 h。根據實驗目的分別設計為4組:空白對照組(Control組),BLM模型組(50 μmol/L),BLM(50 μmol/L)+CPD1(50 μmol/L)處理組,BLM(50 μmol/L)+CPD1(100 μmol/L)處理組。其中BLM+CPD1處理組先使用CPD1預孵育30 min后再加入BLM處理24 h。收集細胞,提取RNA,用于肺纖維化標志物及Smad信號通路相關基因的檢測。
1.2.6 RT-qPCR
利用TRIzol reagent RNA試劑盒提取各組大鼠左肺組織及A549細胞總RNA,測定濃度后,逆轉錄為cDNA并對目的基因進行實時熒光定量逆轉錄聚合酶鏈反應(real-time quantitativereverse transcription-polymerase chain reaction,RT-qPCR)。大鼠源相關基因上下游引物序列分別為,Fn1:5'-ACTCTGTGGGAATGCAGTGG-3',5'-AGTTGCCACCGTAAGTCTGG-3';Acta2:5'-TTGTCCACCGCAAATGCTTC-3',5'-TGAAGGCGCTGATCCACAAA-3';COL1A1:5'-CGTGACCTCAAGATGTGCCA-3',5'-TTGCAGCCTTGGTTAGGGTC-3';GAPDH:5'-AGGAGTAAGAAACCCTGGACC-3',5'-TGGGATGGAATTGTGAGGGAGAT-3';人源相關基因上下游引物序列分別為,Fn1:5'-GGGAACACTTACCGAGTGGG-3',5'-GCTTGCAGGTCCATTCTCCT-3'; PDE5A:5'-TCGTGCAGATAACAGTGCCC-3',5'-AATGGGTCTAAGAGGCCGGT-3';TGF-β1:5'-CTGGCGATACCTCAGCAACC-3',5'-AAGGCGAAAGCCCTCAATTTC-3';Smad3:5'-GGCTGTCTACCAGTTGACCC-3',5'-TCAGGTGCAGCTCAATCCAG-3';GAPDH:5'-TGGCGCTGAGTACGTCGTG-3',5'-TCTCCATGGTGGTGAAGACGC-3'。
1.2.7 肺組織Western blot檢測
取適量肺組織于加入磷酸酶和蛋白酶抑制劑的RIPA裂解液中,離心20 min(4℃,1 200×g),取上清得組織總蛋白,BCA法測定蛋白濃度。制備SDS-聚丙烯酰胺凝膠,上樣,電泳,轉膜,5%牛奶室溫封閉2 h,一抗4℃過夜孵育:E-Cad(1∶1 000),室溫孵育二抗β-actin(1∶5 000)1 h。點化學發光試劑曝光顯影,Image J軟件半定量分析。
1.3 統計學方法
應用統計軟件GraphPad Prism 8.0分析數據并繪圖。所有呈正態部分的計量數據均使用均數±標準差(x±s)表示,各組間差異比較用one-way ANOVA和配對t檢驗。P<0.05為差異有統計學意義。
2 結果
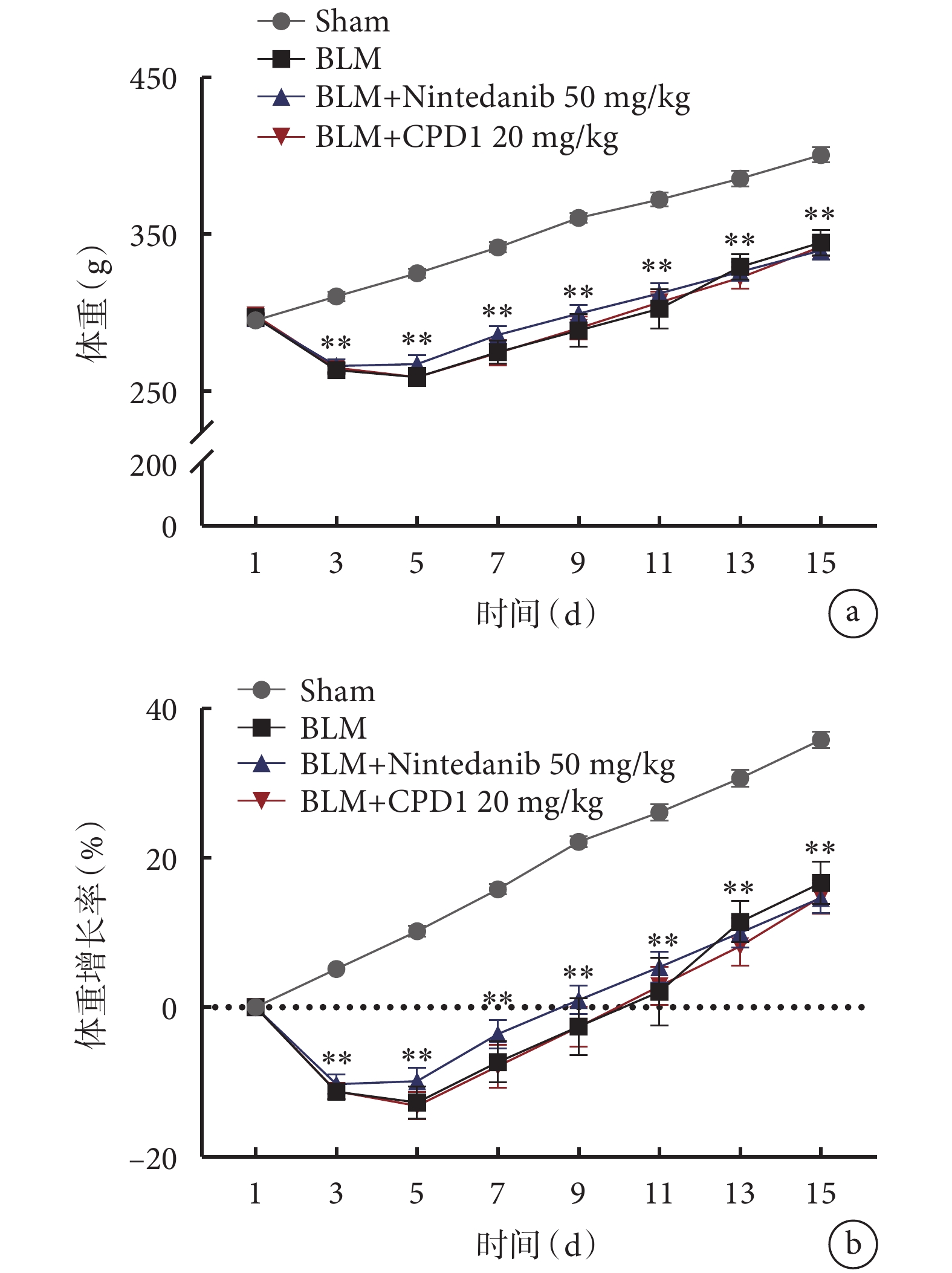
2.1 CPD1對肺纖維化大鼠體重的影響
Sham組大鼠在觀察期內體重呈穩定增長,各造模組大鼠體重在短時間內均有輕度下降,最低值出現在術后第4天,隨著實驗進展所有動物體重均逐漸增加;治療組動物體重變化趨勢與模型組基本一致,差異無統計學意義(圖1),表明新型PDE5抑制劑CPD1干預對大鼠體重變化無明顯不良影響。
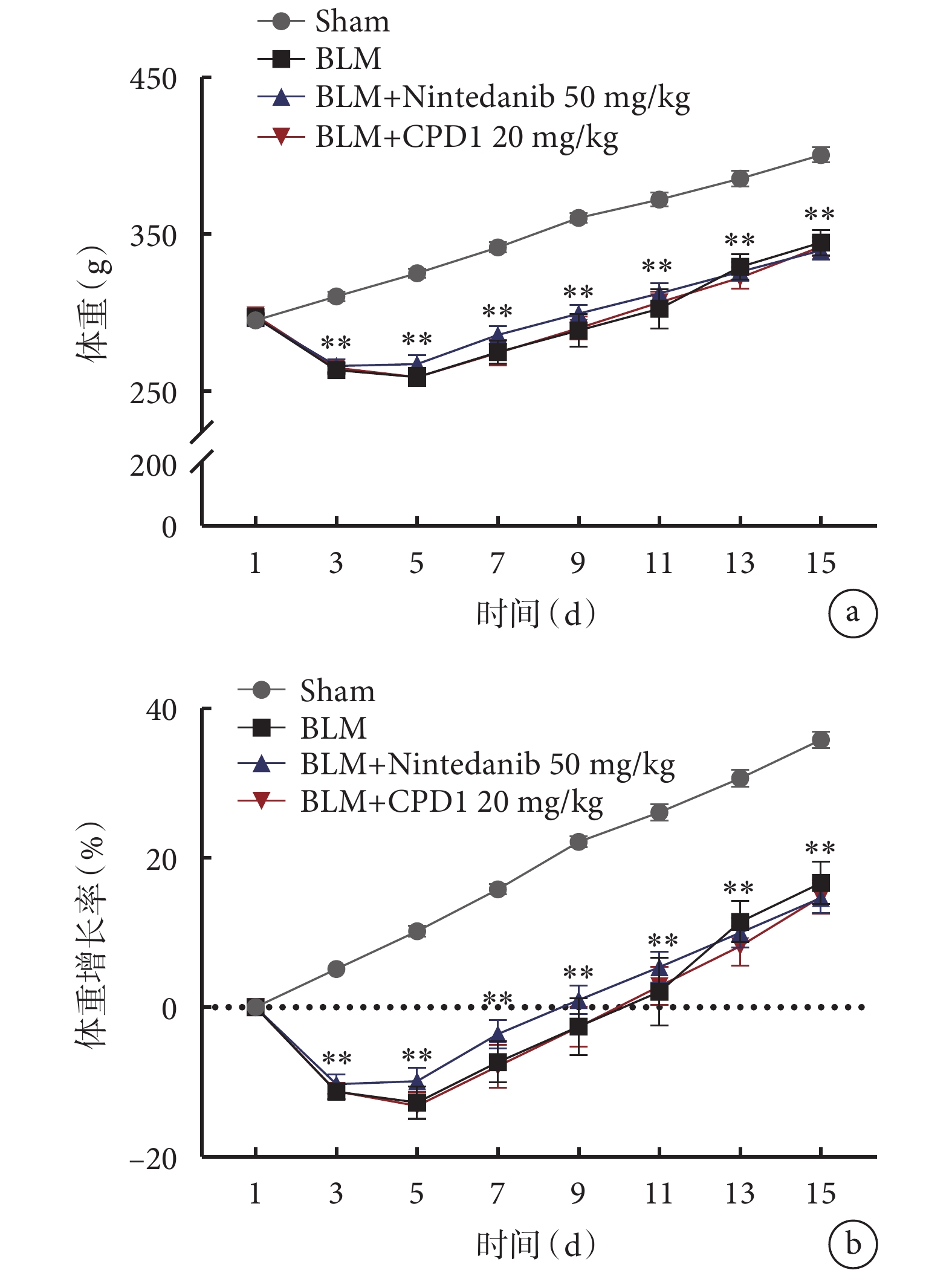 圖1
CPD1治療對BLM誘導的單側肺纖維化大鼠體重的影響
圖1
CPD1治療對BLM誘導的單側肺纖維化大鼠體重的影響
CPD1治療對大鼠體重變化無明顯影響。a. 體重的變化;b. 體重增長率的變化。與Sham組比較,**
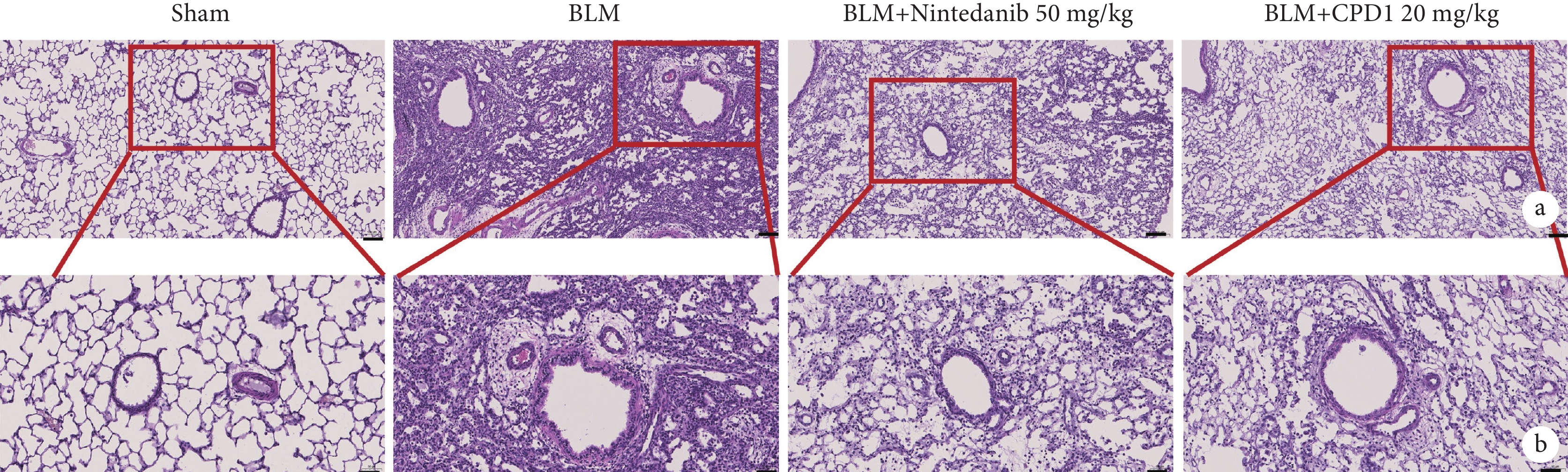
2.2 CPD1對肺纖維化大鼠患側肺組織病理結構損傷的影響
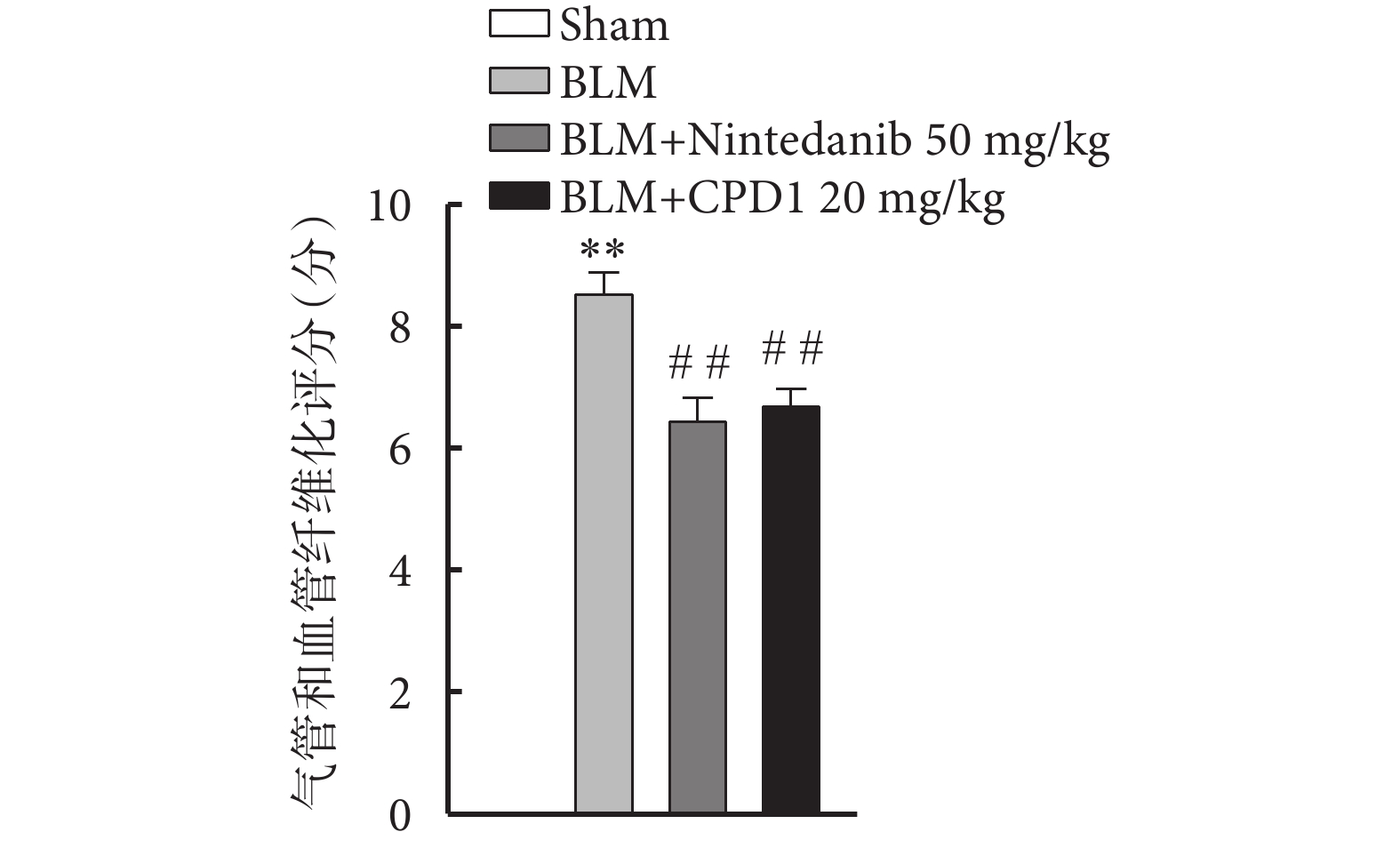
由圖2可見,Sham組大鼠左肺的肺泡形態完整,肺泡間隔清晰纖細,無明顯的炎細胞浸潤或纖維化增生;與Sham組比較,BLM組大鼠患側肺組織肺泡塌陷,肺泡結構明顯紊亂,肺泡間隔增厚,肺泡腔異常增大及肺小動脈管壁顯著增厚,同時伴有大量的炎性滲出物以及成纖維細胞增生;而經過CPD1灌胃給藥后,大鼠患側肺組織結構較BLM組明顯改善,表現為肺泡形態較為完整,肺泡間隔相對清晰纖細以及肺小動脈管壁增厚得到顯著改善,肉眼可見僅有少部分的炎性滲出物以及成纖維細胞增生。通過對各組肺組織的氣管損傷、氣管炎癥、血管損傷及血管炎癥進行評分(圖3),結果顯示CPD1治療組分值與陽性對照藥尼達尼布組無顯著差異,均顯著低于模型組,表明新型PDE5抑制劑CPD1預防性治療可顯著改善BLM引起的肺損傷。
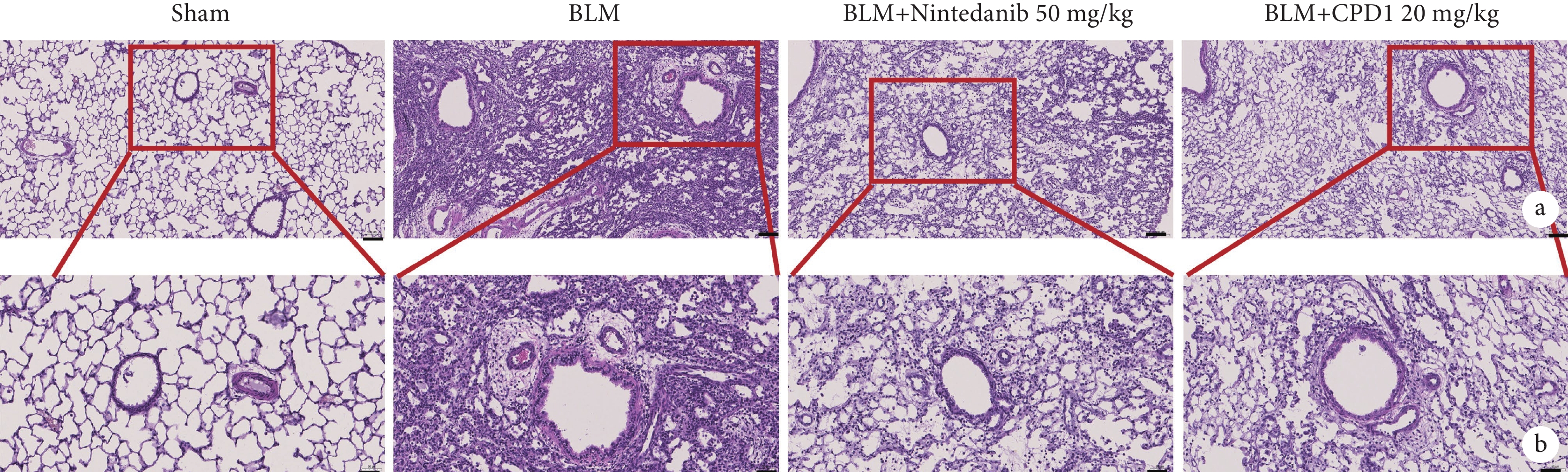 圖2
單側肺纖維化大鼠肺組織結構損傷病理像
圖2
單側肺纖維化大鼠肺組織結構損傷病理像
a. Sham組:肺泡形態完整,間隔清晰;BLM組:肺泡塌陷,結構紊亂;尼達尼布和CPD1治療組:肺泡結構得到改善(HE×100)。b:Sham組:無炎細胞浸潤或纖維化增生;BLM組:肺小動脈管壁增厚,伴有大量的炎性滲出物及成纖維細胞增生;尼達尼布和CPD1治療組:肺小動脈管壁增厚得到改善,僅有少部分炎性滲出物及成纖維細胞增生(HE×200)。
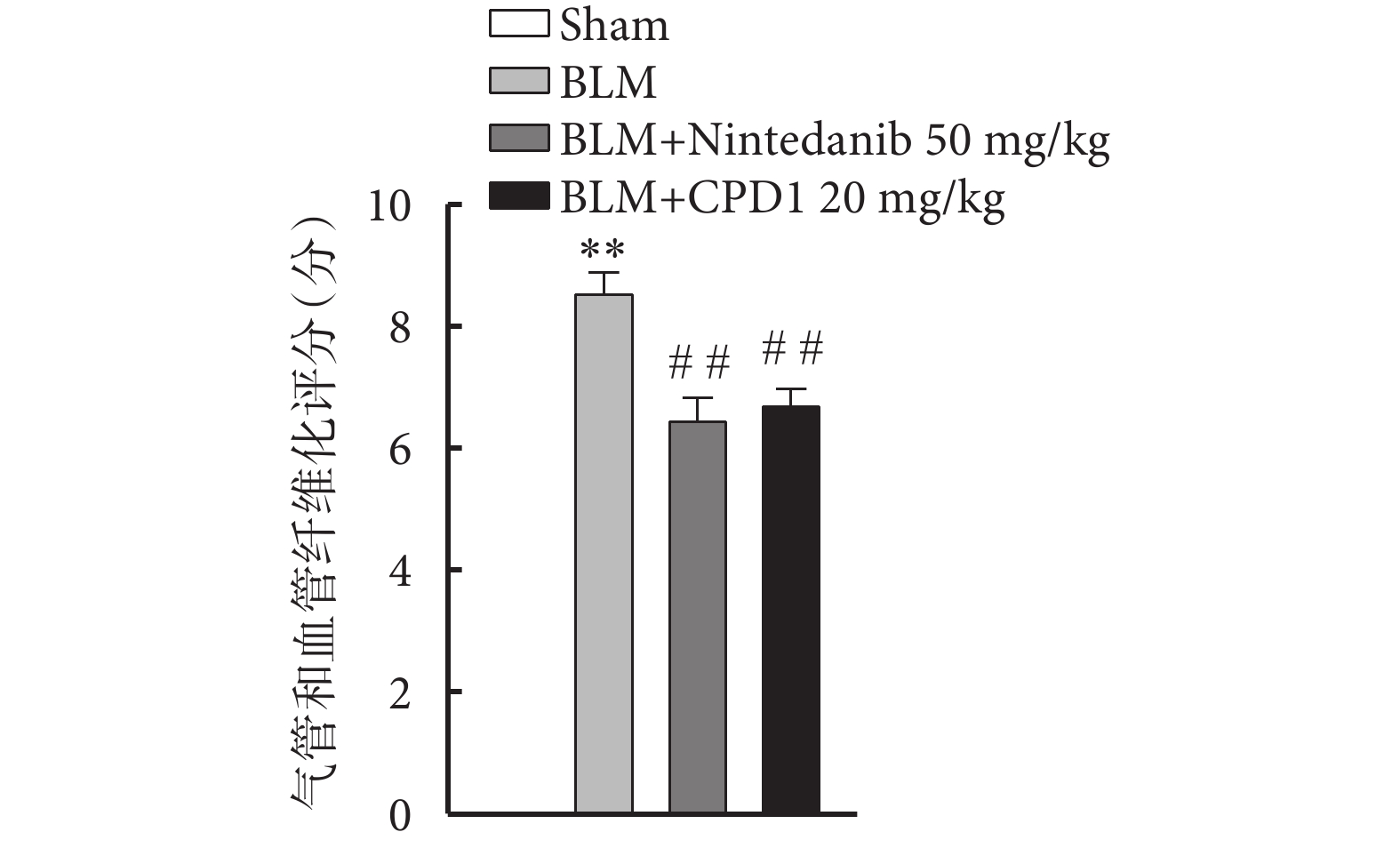 圖3
肺組織的氣管損傷、氣管炎癥、血管損傷及血管炎癥評分
圖3
肺組織的氣管損傷、氣管炎癥、血管損傷及血管炎癥評分
與Sham組比較,**
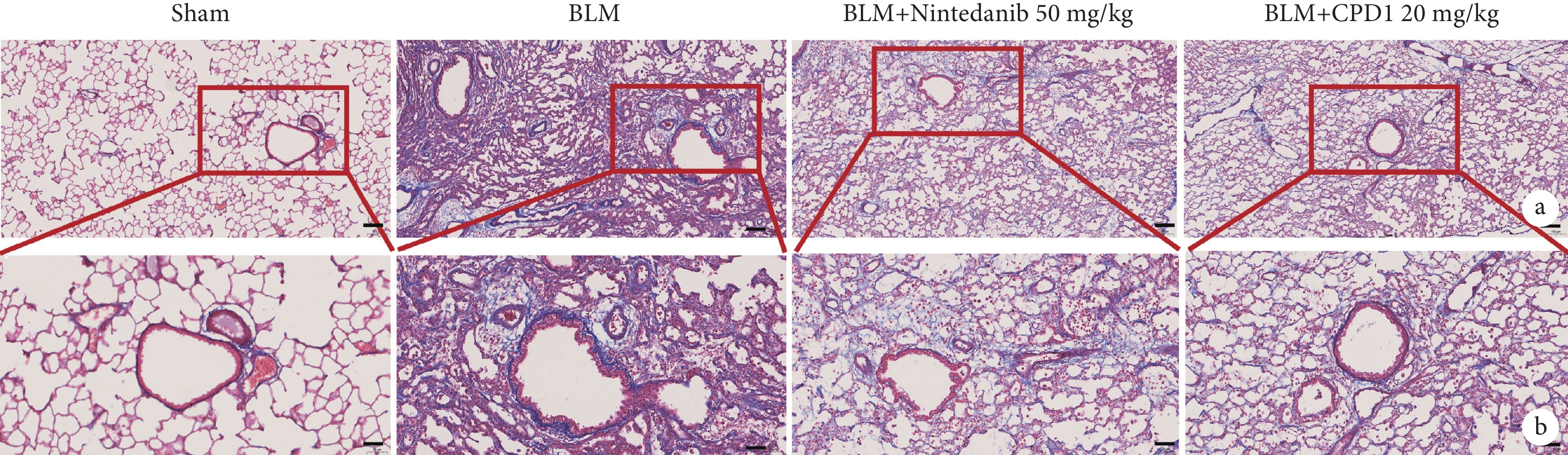
2.3 CPD1對肺纖維化大鼠患側肺組織間質膠原沉積的影響
由圖4可見,Sham組大鼠左肺組織未見明顯膠原纖維沉積,僅在肺泡間隔處發現少量被染上淡藍色的膠原纖維;與Sham組相比,BLM組大鼠左肺組織出現肺纖維化損傷,表現為肺泡腔內有炎性滲出物,出現不同程度的膠原纖維沉積,部分肺泡腔纖維化導致整體肺泡組織結構消失,肉眼可見明顯增厚的肺泡壁有大量藍色條狀膠原纖維增生;經CPD1預防性治療后,大鼠左肺組織中膠原沉積明顯減少。肺纖維化評分結果顯示其對膠原沉積的抑制作用可達到陽性對照藥尼達尼布的治療水平(圖5)。
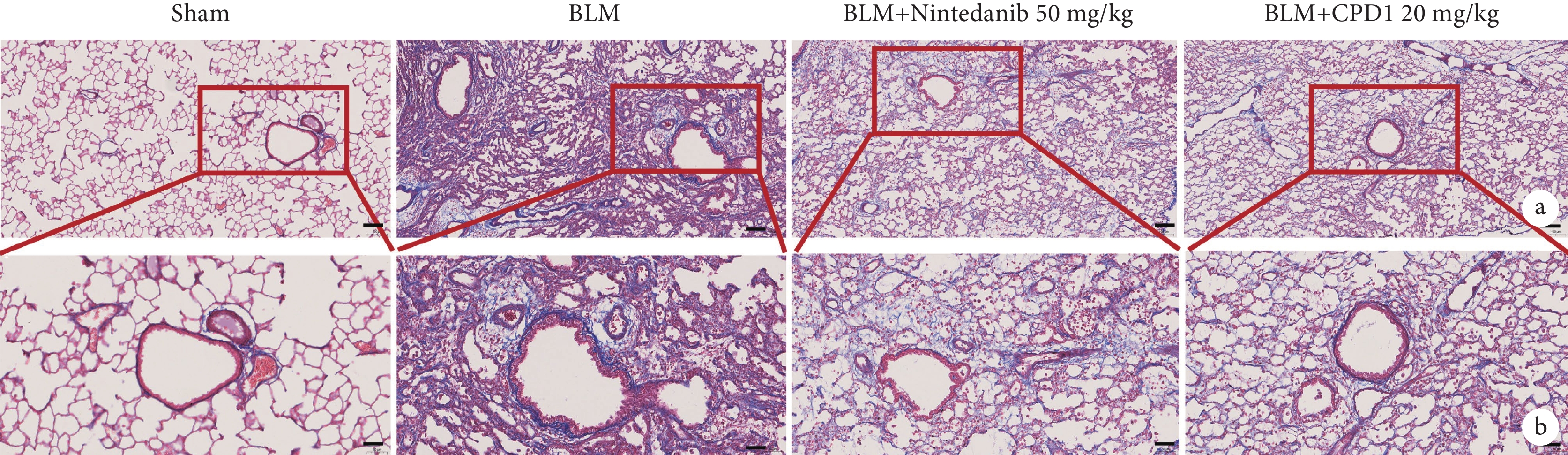 圖4
單側肺纖維化大鼠肺間質膠原沉積病理像
圖4
單側肺纖維化大鼠肺間質膠原沉積病理像
a. Sham組:未見明顯的膠原纖維沉積;BLM組:出現不同程度的膠原纖維沉積,部分肺泡腔纖維化導致整體肺泡組織結構消失;尼達尼布和CPD1治療組:肺組織結構得到改善(Masson×100);b:Sham組:僅在肺泡間隔處發現少量膠原纖維;BLM組:可見明顯增厚的肺泡壁有大量條狀膠原纖維增生;尼達尼布和CPD1治療組:膠原沉積明顯減少(Masson×200)。
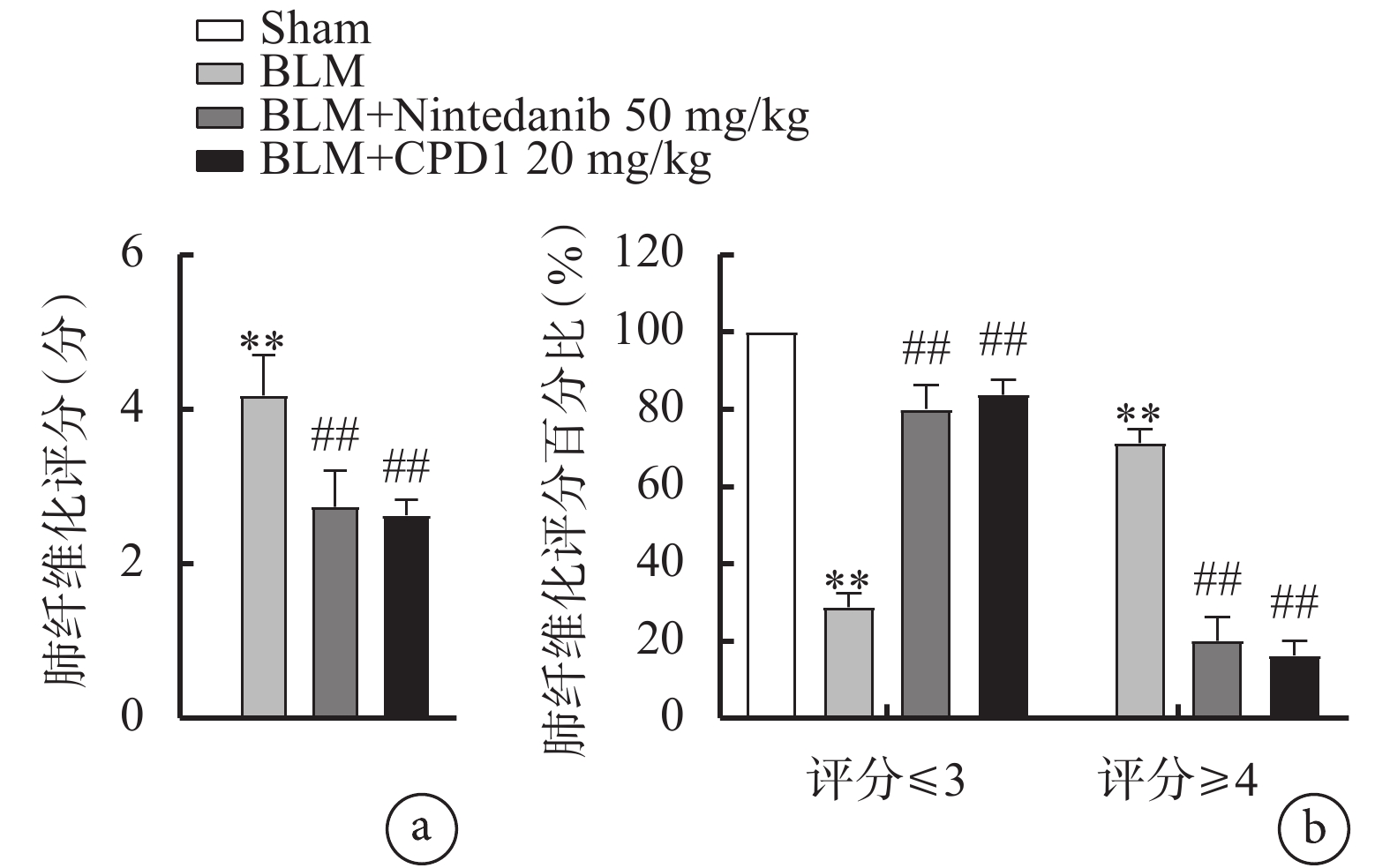
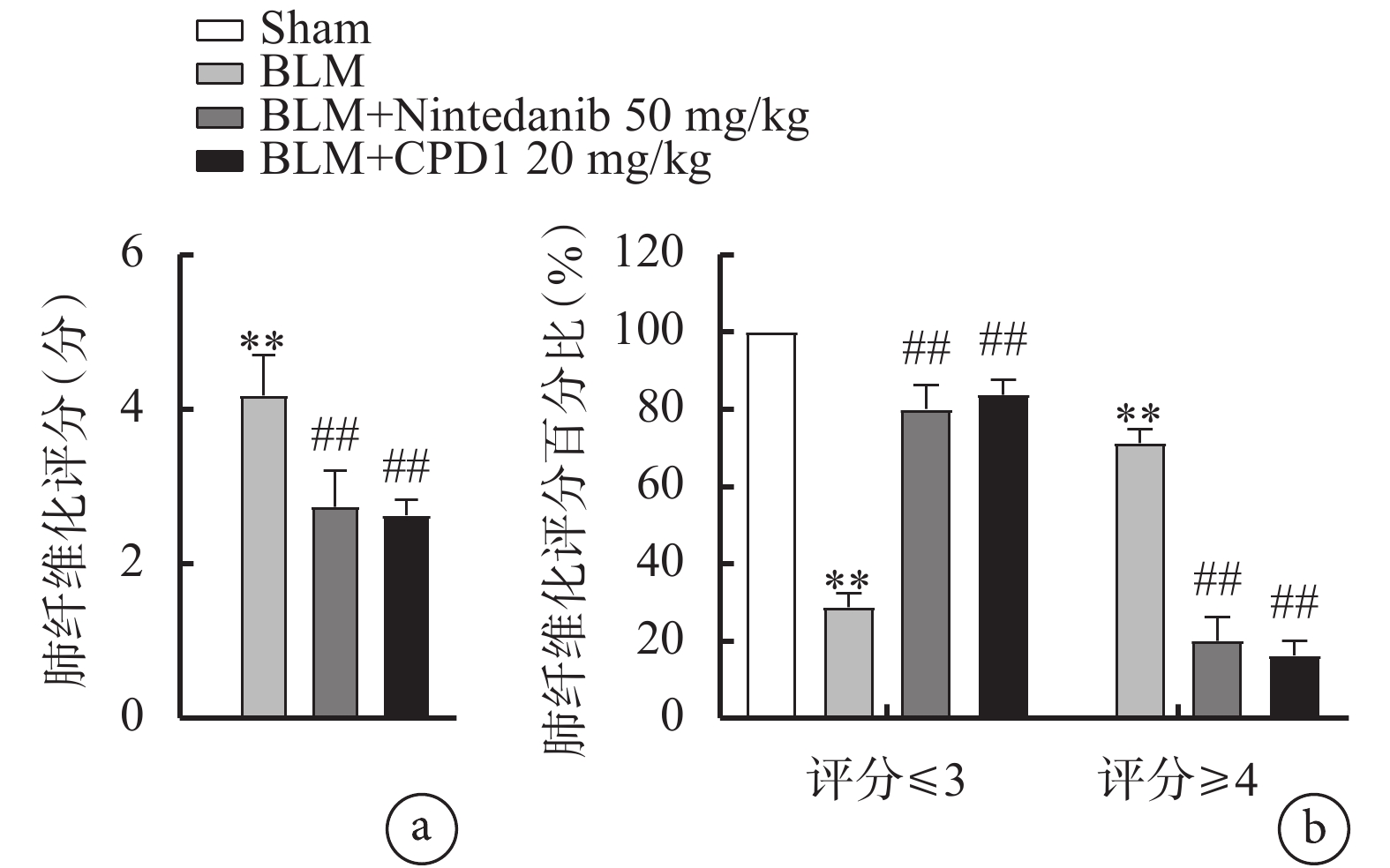 圖5
肺纖維化評分及肺纖維化評分百分比
圖5
肺纖維化評分及肺纖維化評分百分比
a. 肺纖維化評分:藥物治療后,肺纖維化整體評分顯著降低;b. 肺纖維化評分百分比:藥物治療后,肺纖維化程度≤3分的比例顯著增高,≥4分的比例顯著降低。與Sham組比較,**
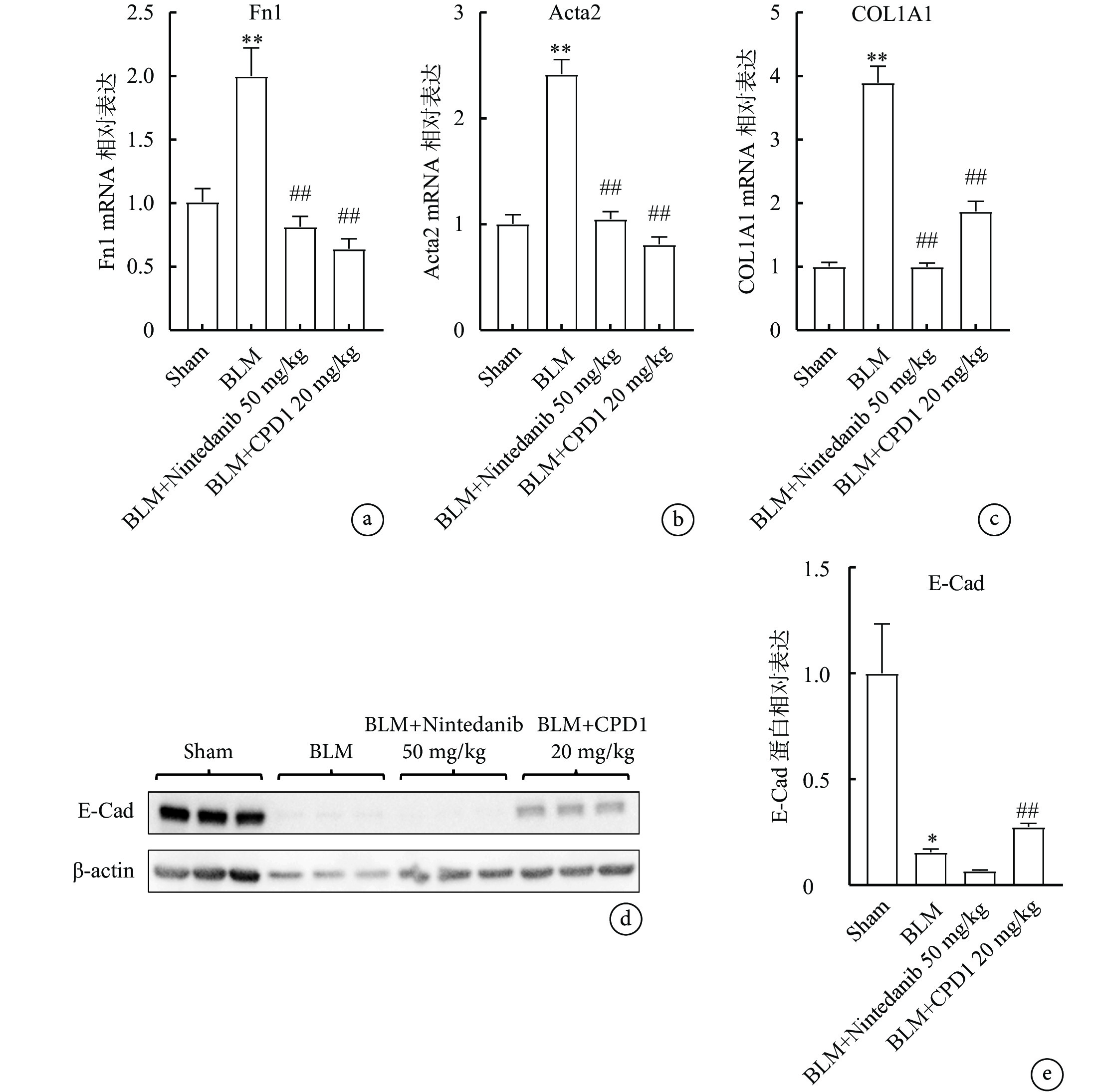
2.4 CPD1對肺纖維化大鼠患側肺組織中纖維化標志物表達及分布的影響
免疫組化染色結果(圖6)顯示,與Sham組相比,BLM模型組大鼠左肺組織中ECM主要成分Fn、α-SMA和Collagen Ⅰ以棕黃色條索狀聚集分布在肺泡隔及間質性病變區域;經CPD1預防性治療后,纖維化標志物表達均明顯減少,表現為肺泡及間質性病變區域的棕黃色條索狀明顯減少,并且其陽性表達顯色減弱。RT-qPCR結果顯示,BLM組大鼠肺組織中Fn、α-SMA和Collagen Ⅰ基因的表達水平均顯著高于Sham組(P<0.05),CPD1預防性治療后各種纖維化標志因子的mRNA表達均明顯減少(P<0.01)(圖7a~c)。Western blot結果顯示,BLM顯著降低肺組織中上皮標志物E-cad的表達,而CPD1預防性治療可上調E-cad的表達(P<0.01)(圖7d、e),表明CPD1可能通過抑制EMT延緩肺纖維化的進程。
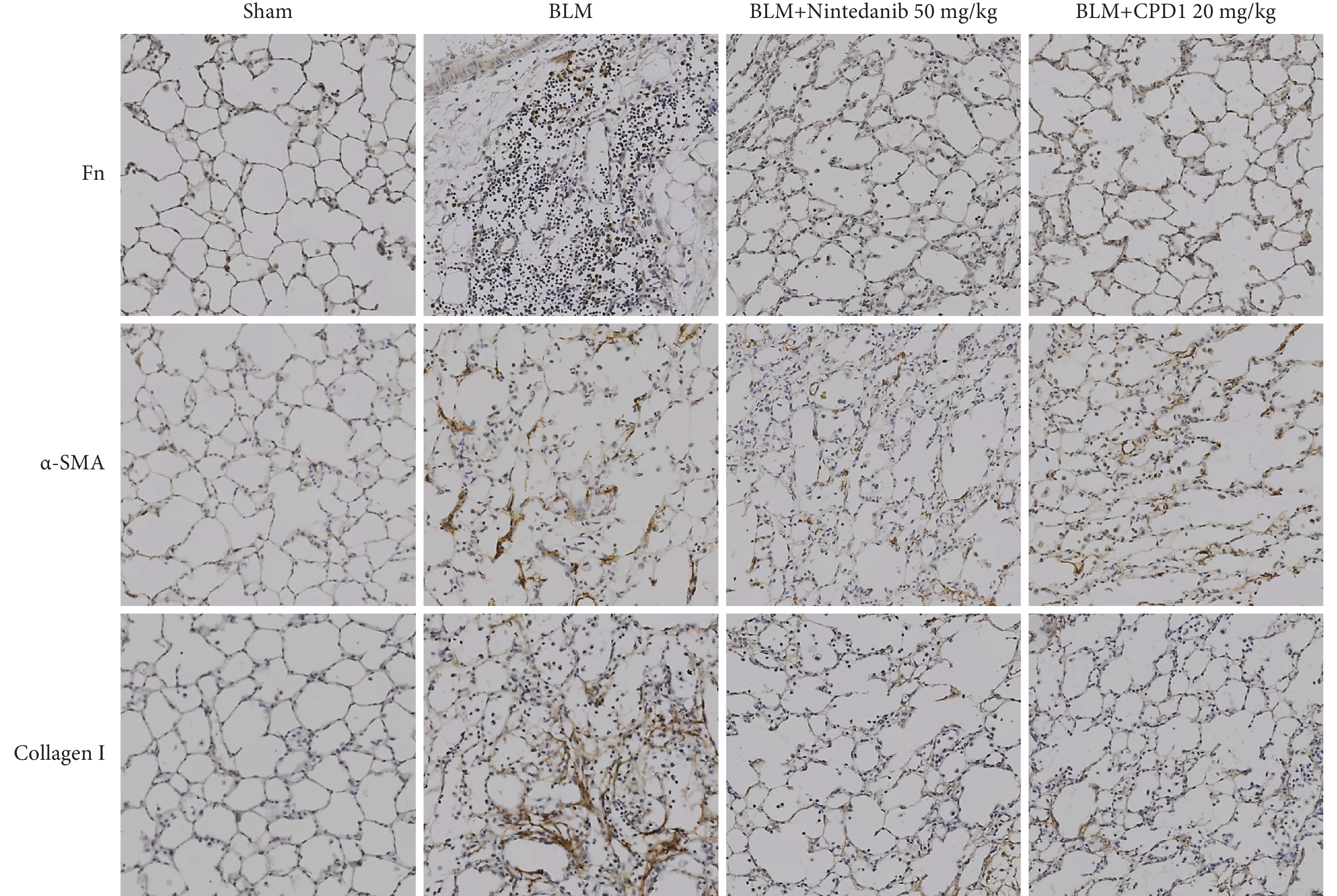
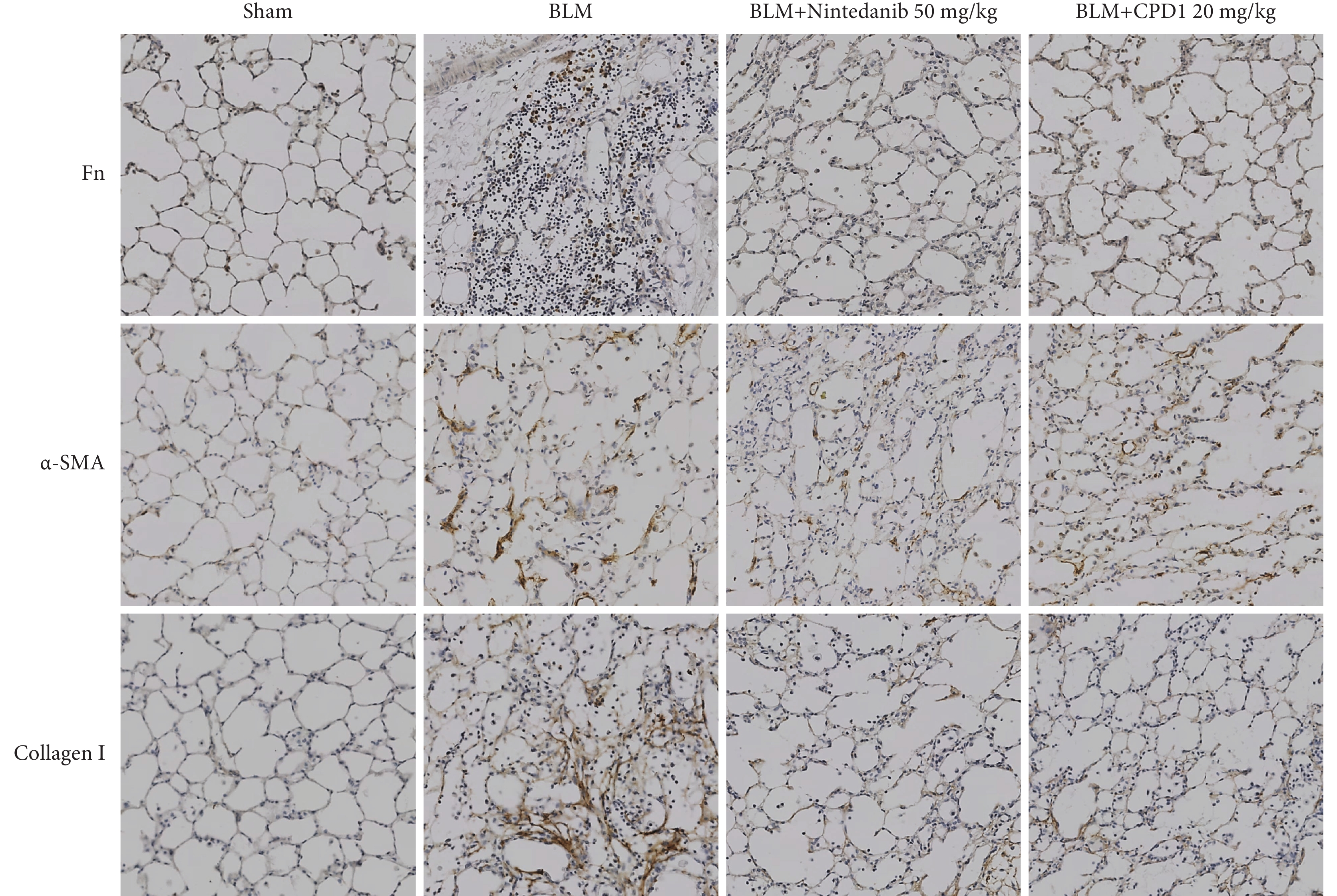 圖6
單側肺纖維化大鼠肺組織中纖維化標志蛋白表達和分布病理像
圖6
單側肺纖維化大鼠肺組織中纖維化標志蛋白表達和分布病理像
藥物治療顯著降低肺組織中纖維化標志蛋白Fn、α-SMA和Collagen Ⅰ的表達(免疫組化染色×200)
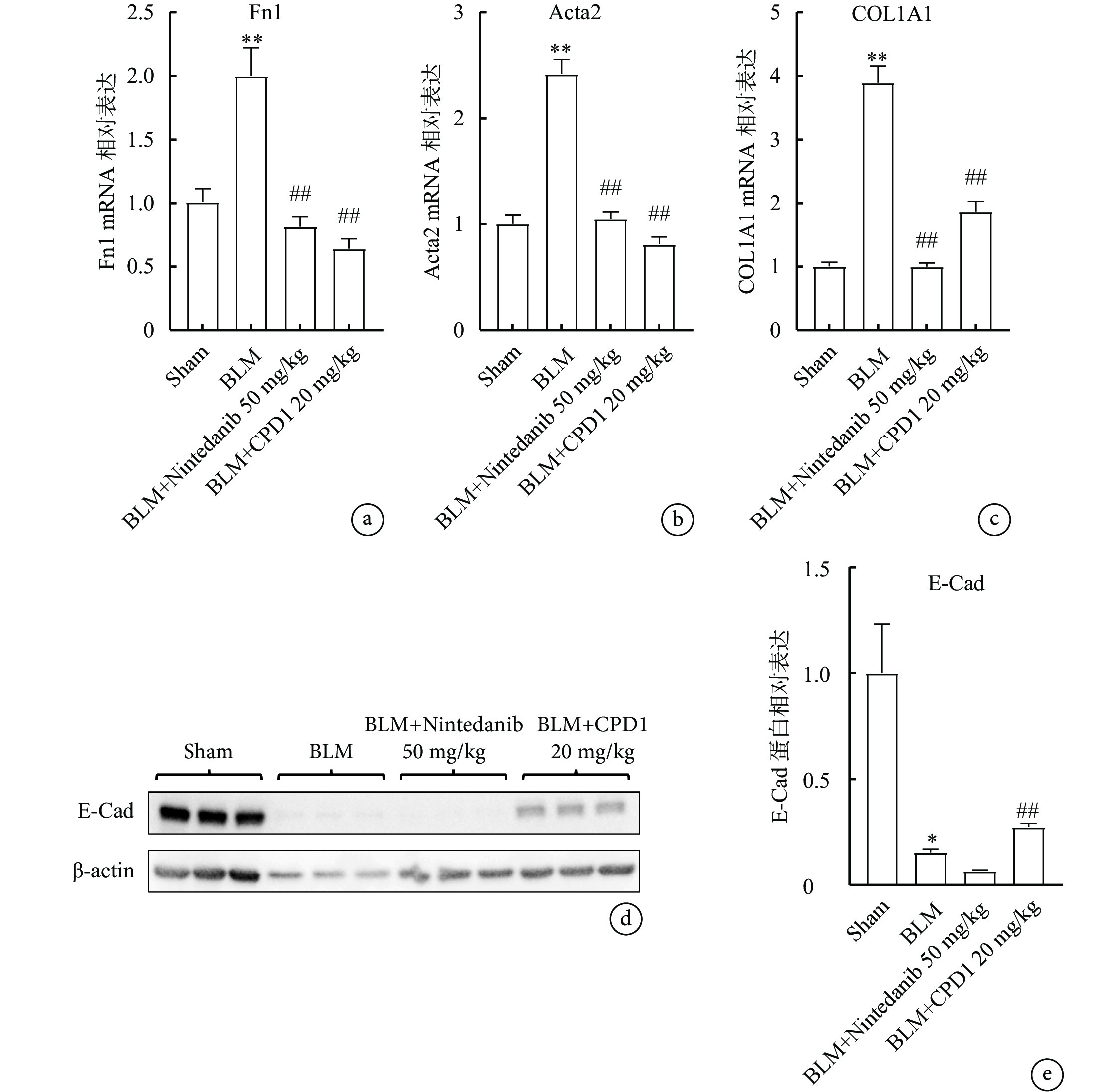 圖7
單側肺纖維化大鼠肺組織中纖維化標志物和上皮標志物的表達
圖7
單側肺纖維化大鼠肺組織中纖維化標志物和上皮標志物的表達
a~c. RT-qPCR結果顯示藥物治療顯著降低肺組織中纖維化標志物基因Fn1、Acta2和Collagen Ⅰ的mRNA表達;d. E-Cad免疫印跡檢測電泳條帶圖;e. 各組肺組織E-Cad蛋白表達水平:藥物治療顯著上調上皮標志物的表達。與Sham組比較,*
2.5 CPD1對TGF-β1/Smad信號通路的影響
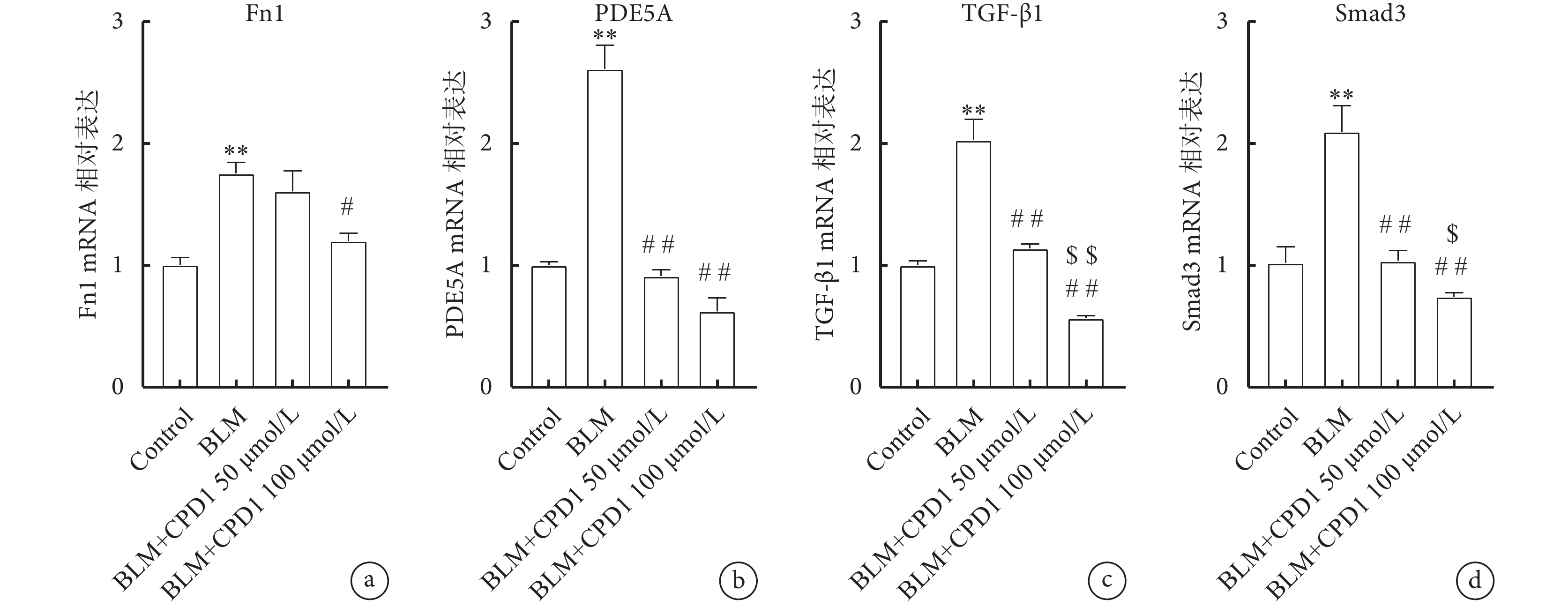
進一步探討CPD1預防性治療肺纖維化的作用機制,觀察CPD1對A549細胞中TGF-β/Smad信號通路相關基因表達的影響。細胞實驗結果顯示BLM預處理可顯著增加A549細胞中肺纖維化標志基因Fn1以及PDE5a基因的表達水平,而CPD1作用后顯著降低Fn1和PDE5a的表達。與空白對照組相比,BLM促進A549細胞中TGF-β1和Smad3 mRNA表達水平的顯著上調(P<0.01),而CPD1呈劑量依賴性顯著降低TGF-β1和Smad3基因的表達(圖8)。
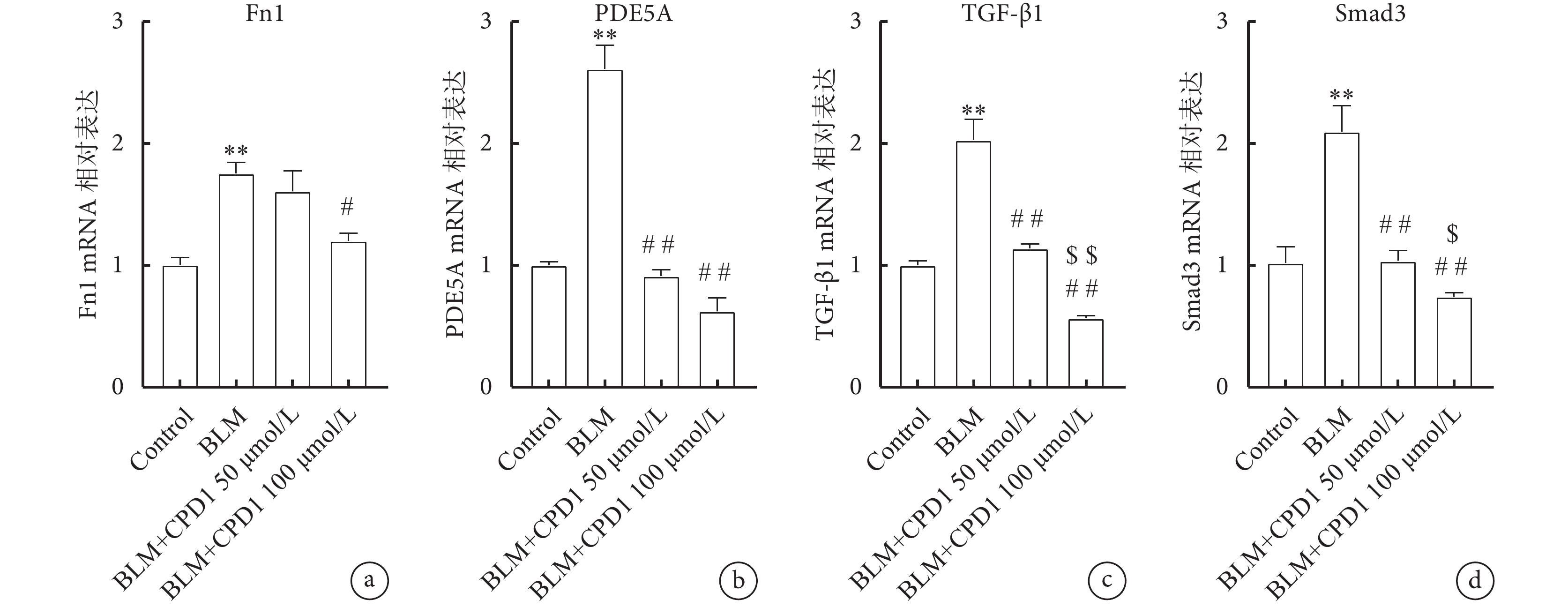 圖8
CPD1治療對A549細胞中TGF-β1/Smad3通路的影響
圖8
CPD1治療對A549細胞中TGF-β1/Smad3通路的影響
a. A549細胞中Fn1 mRNA的表達;b. PDE5a mRNA的表達;c. TGF-β1 mRNA的表達;d. Smad3 mRNA的表達(
3 討論
據全球最新的流行病學統計,每十萬人中約有5 000人患有纖維化相關疾病,并且由纖維化引起的健康問題已經成為全球四分之一人口的醫療負擔。新型冠狀病毒肺炎自2019年被發現以來,已經成為近百年來影響范圍最廣的大流行病。新冠病毒感染者患有肺纖維化幾率大幅增加,在重癥和危重癥患者肺部中觀察到大量的炎細胞浸潤和纖維組織增生,與僅感染1次新冠病毒感染者相比,重復感染者出現肺部后遺癥的風險增加了254%[14]。因此,全球肺纖維化的負擔大大增加。尼達尼布和吡非尼酮是目前僅有的兩種被批準用于治療特發性肺纖維化的孤兒藥物。其中,尼達尼布是一種小分子酪氨酸激酶抑制劑,可同時阻斷三種生長因子(VEGF、FGFR和PDGF)受體,從而有效抑制纖維化過程中的信號通路[15]。吡非尼酮具有抗纖維化、抗炎和抗氧化活性的功能,通過下調促纖維化細胞因子的產生,以及降低成纖維細胞增殖并影響成纖維細胞的分化,從而具有廣譜抗纖維化的作用[16],但目前尚未被批準用于進展性肺纖維化的治療,需要更多的臨床試驗探索[17]。此外,兩種藥物均具有有效劑量大、不良反應明顯和使用價格昂貴等特點,這給患者帶來沉重的經濟和身體負擔,因此亟需開發新型的抗肺纖維化藥物。團隊前期多項研究已證實新型PDE5抑制劑CPD1具有抗纖維化的作用[8-11],本研究繼續探討了CPD1預防性治療是否對BLM引起的單側肺組織結構損傷和膠原沉積有保護作用。
纖維化通常被認為是一種失調的傷口愈合反應,其特征是ECM在組織損傷部位過度沉積。構成纖維化瘢痕的ECM在組織中是高度保守的,主要由Fn、間質膠原蛋白(Ⅰ型和Ⅲ型)和層粘連蛋白等基底膜蛋白組成[18]。使用BLM、輻射、二氧化硅、石棉、異硫氰酸熒光素以及某些細胞因子的過表達會在強烈的炎癥反應后導致肺纖維化。根據美國胸科協會官方研討會報告[19],關于確定抗纖維化化合物臨床前評估的建議,推薦在實驗動物中使用小鼠或大鼠氣管內滴注BLM作為臨床前測試的肺纖維化最佳表征動物模型。由于大鼠雙側肺葉數量和結構不同,如果采用主氣管滴注法將不可避免導致左右肺葉藥物分布不均,出現雙側肺葉損傷不均一性的問題,因此本研究中每個動物BLM均通過支氣管滴注進入左肺,可以保證所有動物在左肺的損傷范圍相近,病灶分布均勻,減小組內差異[13]。本研究發現模型組大鼠患側肺組織結構嚴重損傷,圍繞中心氣道區域最嚴重,伴有明顯的炎癥細胞浸潤,同時肺間質出現大量膠原纖維沉積;CPD1預防性治療后顯著減輕患側肺組織結構損傷和間質纖維化程度,降低Fn、α-SMA和Collagen Ⅰ的表達,表明CPD1可有效抑制ECM的過度沉積,改善纖維化肺組織結構損傷。
TGF-β/Smad信號通路在纖維化進程中發揮重要作用,TGF-β1與其Ⅰ型、Ⅱ型受體結合形成復合物,使Smad2和/或Smad3被磷酸化,并與Smad4結合形成異源三聚體復合物,進入細胞核激活上皮間質轉化下游轉錄因子的表達,從而誘導上皮間質轉化的發生。本研究中,BLM促進A549細胞中TGF-β1和Smad3基因表達水平顯著上調,纖維化標志蛋白Fn1和PDE5a表達顯著增加,表明BLM激活TGF-β1/Smad3信號通路,引起肺泡上皮細胞發生上皮-間質轉化。而CPD1預防性治療顯著抑制TGF-β1和Smad3的表達,降低Fn1和PDE5a的表達,上調上皮標志物E-Cad的表達,表明CPD1可通過抑制TGF-β1/Smad3信號通路的激活,阻斷上皮間質轉化,減少肺間質細胞外基質的沉積,減輕肺組織病理結構的損傷,延緩纖維化進程。盡管如此,區分干擾炎癥和早期纖維化反應的藥物與預防纖維化進展的藥物至關重要,本研究屬于預防性給藥實驗,后續將進一步開展治療性給藥實驗,探究CPD1對肺纖維化的治療作用。此外,肺纖維化的預后異質性大,受年齡、性別、營養狀況、基礎肺功能等多種因素的影響,也是藥物治療效果基礎和臨床研究中不容忽視的關鍵因素[20]。
綜上所述,本研究從肺組織結構、肺間質膠原沉積和肺泡上皮細胞上皮-間質轉化探究了CPD1對BLM引起的單側肺纖維化的預防性治療作用。CPD1通過降低肺泡上皮細胞中PDE5的表達和活性,抑制TGF-β1/Smad3信號通路介導的上皮-間質轉化和炎癥,進而減輕肺組織結構損傷,發揮抗肺纖維化的作用。本研究對肺纖維化治療新藥的開發和臨床研究具有重要意義。
利益沖突:本研究不涉及任何利益沖突。
間質性肺疾病(interstitial lung disease,ILD)是一類包含200多種異質性肺疾病的群體總稱,其病理特征表現為炎癥和纖維化[1]。肺纖維化(pulmonary fibrosis,PF)是ILD的一種終末期病理變化,主要表現為肺組織結構重構、氣體交換受阻和不可逆的功能減退,最終導致呼吸衰竭,甚至死亡[2]。肺泡上皮細胞的重復性局部微損傷會誘導上皮-間質轉化(epithelial-mesenchymal transition,EMT)的發生并分泌過多的促纖維化介質,從而導致成纖維細胞和肌成纖維細胞的遷移、增殖和活化,并分泌細胞外基質(extracellular matrix,ECM),最終導致肺纖維化。尼達尼布和吡非尼酮是目前僅有的兩種抗肺纖維化藥物[3-4],但它們只能在一定程度上改善纖維化癥狀,均不能徹底治愈疾病。此外,兩者均存在半衰期短、用藥劑量大、費用昂貴和不良反應明顯等不足,也嚴重限制了它們的臨床應用。因此,開發一種安全有效的抗肺纖維化療法是科研工作者亟需解決的一大難題。
磷酸二酯酶(Phosphodiesterase,PDEs)是一類能夠水解環磷酸腺苷(cAMP)或環磷酸鳥苷(cGMP)的水解酶。西地那非(Sildenafil)、他達拉非(Tadalafil)和阿伐那非(Avanafil)等PDE5抑制劑,都存在特異性低、水溶性差和半衰期短等不足,從而導致藥物的生物利用度低和不良反應大。基于此背景,在已公開的Sildenafil類似物WYQ結構基礎上(CN102020645A)[5],本課題組對其進行了優化改造,通過成鹽和共晶篩選,最終得到優良晶型CPD1,其水溶性及腸溶性得到了大幅提升[6]。團隊前期藥效學研究表明,CPD1對野百合堿誘導的肺動脈高壓大鼠[7]、異丙腎上腺素引起的心肌肥大大鼠[8]、四氯化碳引起的肝纖維化小鼠[9]以及單側輸尿管結扎和腎缺血再灌注引起的腎纖維化小鼠[10-11]均有顯著的治療作用,但CPD1對博來霉素(bleomycin,BLM)引起的單側肺纖維化的潛在治療作用還需進一步探究,因此本研究繼續探索了CPD1在肺纖維化中發揮的作用。本研究通過利用左側氣管滴注BLM構建單側肺纖維化大鼠模型,以及利用BLM處理腺癌性人肺泡基底上皮細胞A549,通過肺組織病理學分析及分子生物學技術,觀察新型PDE5抑制劑CPD1對單側肺纖維化大鼠患側肺組織結構損傷、肺間質纖維化及肺泡基底上皮細胞EMT的影響。初步探討CPD1對單側肺纖維化的預防性治療作用,為后續研究CPD1抗肺纖維化的分子機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 實驗動物及分組
雄性SD大鼠(SPF級,220~240 g)50只,購自浙江維通利華實驗動物技術有限公司,動物合格證號:1912180057,生產許可號[SCXK(浙)2019-0001]。將大鼠隨機分為4組:假手術組(Sham組,n=10)、模型組(BLM組,n=14)、CPD1治療組(BLM+CPD1 20 mg/kg,n=13)和尼達尼布陽性對照藥治療組(BLM+Nintedanib 50 mg/kg,n=13)。動物飼養于凱斯艾生物科技(蘇州)有限公司動物中心[SYXK(蘇)2017-0041],研究方案獲得凱斯艾生物科技(蘇州)有限公司IACUC委員會聯合審批確認。
1.1.2 試劑與儀器
CPD1(ET32637-37-P1)委托天津藥明康德新藥開發有限公司合成,經專業COA分析測定其純度達99%,陽性對照藥尼達尼布購自上海水正生物醫藥科技有限公司(CAS:656247-18-6)。胰蛋白酶(25200072)購自美國Gibco公司,胎牛血清(Z7185FBS-500)購自美國Zeta Life公司,RPMI 1640 With L-Glutamine培養基(C3010-0500)購自上海龍田生物科技有限公司,博來霉素硫酸鹽(S1214)購自美國Selleck Chemicals公司。辣根過氧化物酶標記山羊抗兔IgG(H+L)和蘇木精-伊紅(hematoxylin-eosin,HE)染色試劑盒(C0105S)購自上海碧云天生物技術有限公司,改良Masson三色染色試劑盒購自北京索萊寶科技有限公司(G1345)。異氟烷、戊巴比妥鈉麻醉劑、福爾馬林固定液均購自中國國藥集團股份有限公司。注射用鹽酸博來霉素(批號:970592)購自日本化藥株式會社。α平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)(CST:19245S)、纖維連接蛋白(fibronectin,Fn)(abcam:6328)、Ⅰ型膠原蛋白(Collagen Ⅰ)(CST:91144S)。RIPA裂解液(碧云天P0013B)、磷酸酶蛋白酶抑制劑(碧云天P1051)、脫脂奶粉,BSA(上海生工)、PMSF(碧云天ST506)、E-鈣粘蛋白(E-Cadherin,E-Cad)(Affinity:BF0219)、二抗β-actin(sigma,A2228)。CPD1的配制:用生理鹽水配成2.0 mg/mL的藥液,現配現用。尼達尼布的配制:用DMSO配成200 mg/mL的母液,使用時用生理鹽水稀釋成10 mg/mL,現配現用。TRIzol reagent RNA提取試劑盒(美國Invitrogen公司)、PrimeScript? RT reagent Kit(日本TaKaRa),引物由上海生工生物有限公司合成。ChemiDoc+XRS化學發光凝膠成像系統(Bio-Rad)、酶標儀(CMax Plus)、細胞培養箱、石蠟切片機及低溫離心機(美國Thermo Fisher Scientific)、石蠟包埋機(MPS/P1,德國SLEE公司)、冷凍臺(中威電子儀器有限公司)、正置光學顯微鏡(德國LEICA)、–80 ℃冰箱(中國美菱)、烘箱(DH6-9143B5-Ⅲ,上海新苗)、全自動切片數字掃描儀(匈牙利3DHISTECH公司),掃描瀏覽軟件為CaseViewer2.4。
1.2 方法
1.2.1 肺纖維化模型建立及給藥
BLM是一種水溶性糖肽類抗生素,同時也是一種抗腫瘤藥物。BLM通過抑制DNA的代謝,從而達到抑制腫瘤生長的療效。10%~30%接受BLM治療的患者會出現肺部毒性,其表現為非特異性肺炎到肺纖維化,甚至迅速死于肺纖維化[12],BLM誘導的肺纖維化模型是最廣泛用于研究IPF發病機制和評估抗肺纖維化治療的動物模型。本研究所用肺纖維化大鼠模型的構建和鑒定委托凱斯艾(蘇州)生物科技有限公司專業技術團隊完成。大鼠稱重后異氟烷麻醉,頸部消毒鈍性分離正中部肌肉,暴露主氣管,做一倒“T”形切口;PE-20管斜面向下,從切口處插入至左側主支氣管,手術線結扎固定以免脫落,注入BLM(劑量3 mg/kg,體積1.0 mL/kg)[13]。2 h后動物蘇醒,CPD1治療組、尼達尼布陽性對照治療組大鼠分別灌胃CPD1或尼達尼布,Sham組和模型組動物每天灌胃等體積生理鹽水,持續給藥2周。第15 d,利用20%烏拉坦(1 g/kg)腹腔注射麻醉安樂死大鼠,打開腹腔,剪斷腹主動脈,待心臟停止跳動,取出肺臟。每組肺臟將分為以下兩種處理方式:(1)將肺右葉結扎,取等量的福爾馬林液經氣管灌注左肺固定,進行后續的病理相關檢測;(2)收集左肺組織存放在–80℃冰箱備用,用于后續分子實驗的相關檢測。
1.2.2 肺組織病理學觀察
各組肺組織常溫固定24 h,依次經過不同濃度的乙醇脫水、二甲苯透明、浸蠟、包埋冷凍蠟塊后最大肺縱切面連續切片(5 μm),烤片后經二甲苯脫蠟,進行HE染色。在光學顯微鏡下觀察肺組織終末細支氣管損傷和炎癥浸潤、細小肺動脈損傷和炎癥浸潤程度,選取視野拍照并進行評分。評分標準見表1和表2。
1.2.3 Masson三色染色
Masson三色染色是膠原纖維染色經典方法之一,經過Masson三色染色后的膠原纖維呈藍色或綠色。各組肺組織切片經脫蠟脫水后,重鉻酸鉀過夜染色后流水沖洗,鐵蘇木素染色流水沖洗后分化再流水沖洗,麗春紅酸性品紅染色后用流水持續沖洗切片,磷鉬酸染色后不用水洗直接入苯胺藍染液染色,分化后常規脫水透明封片,最后封片劑干燥后光學顯微鏡下觀察評估肺組織中膠原纖維沉積情況,選取視野拍照,對各組肺切片進行纖維化評分,肺纖維化Ashcroft病理評分標準見表3。
1.2.4 免疫組織化學染色
各組肺組織蠟塊切片依次經二甲苯脫蠟、梯度乙醇水化、滅活內源性過氧化氫酶、抗原熱修復后用10%驢血清封閉。一抗(Fn、α-SMA、Collagen Ⅰ)孵育過夜(4℃),二抗室溫孵育1 h,用PBST緩沖液洗脫后加辣根過氧化酶標記的ABC工作液,避光孵育半小時后洗脫,繼續滴加DAB工作液染色,自來水沖洗后滴加蘇木素復染10 s,封片拍照。
1.2.5 細胞的培養與處理
腺癌性人肺泡基底上皮細胞A549采用RPMI 1640培養基(含10% FBS)培養,置于37 ℃,5% CO2及飽和濕度條件的培養箱中常規培養。細胞呈貼壁生長,及時更換培養液,每2~3 d傳代1次,取對數生長期的細胞,吹打制成細胞懸液,按所需濃度接種使用。藥物處理前,用無血清的培養基將細胞饑餓處理12 h。根據實驗目的分別設計為4組:空白對照組(Control組),BLM模型組(50 μmol/L),BLM(50 μmol/L)+CPD1(50 μmol/L)處理組,BLM(50 μmol/L)+CPD1(100 μmol/L)處理組。其中BLM+CPD1處理組先使用CPD1預孵育30 min后再加入BLM處理24 h。收集細胞,提取RNA,用于肺纖維化標志物及Smad信號通路相關基因的檢測。
1.2.6 RT-qPCR
利用TRIzol reagent RNA試劑盒提取各組大鼠左肺組織及A549細胞總RNA,測定濃度后,逆轉錄為cDNA并對目的基因進行實時熒光定量逆轉錄聚合酶鏈反應(real-time quantitativereverse transcription-polymerase chain reaction,RT-qPCR)。大鼠源相關基因上下游引物序列分別為,Fn1:5'-ACTCTGTGGGAATGCAGTGG-3',5'-AGTTGCCACCGTAAGTCTGG-3';Acta2:5'-TTGTCCACCGCAAATGCTTC-3',5'-TGAAGGCGCTGATCCACAAA-3';COL1A1:5'-CGTGACCTCAAGATGTGCCA-3',5'-TTGCAGCCTTGGTTAGGGTC-3';GAPDH:5'-AGGAGTAAGAAACCCTGGACC-3',5'-TGGGATGGAATTGTGAGGGAGAT-3';人源相關基因上下游引物序列分別為,Fn1:5'-GGGAACACTTACCGAGTGGG-3',5'-GCTTGCAGGTCCATTCTCCT-3'; PDE5A:5'-TCGTGCAGATAACAGTGCCC-3',5'-AATGGGTCTAAGAGGCCGGT-3';TGF-β1:5'-CTGGCGATACCTCAGCAACC-3',5'-AAGGCGAAAGCCCTCAATTTC-3';Smad3:5'-GGCTGTCTACCAGTTGACCC-3',5'-TCAGGTGCAGCTCAATCCAG-3';GAPDH:5'-TGGCGCTGAGTACGTCGTG-3',5'-TCTCCATGGTGGTGAAGACGC-3'。
1.2.7 肺組織Western blot檢測
取適量肺組織于加入磷酸酶和蛋白酶抑制劑的RIPA裂解液中,離心20 min(4℃,1 200×g),取上清得組織總蛋白,BCA法測定蛋白濃度。制備SDS-聚丙烯酰胺凝膠,上樣,電泳,轉膜,5%牛奶室溫封閉2 h,一抗4℃過夜孵育:E-Cad(1∶1 000),室溫孵育二抗β-actin(1∶5 000)1 h。點化學發光試劑曝光顯影,Image J軟件半定量分析。
1.3 統計學方法
應用統計軟件GraphPad Prism 8.0分析數據并繪圖。所有呈正態部分的計量數據均使用均數±標準差(x±s)表示,各組間差異比較用one-way ANOVA和配對t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 CPD1對肺纖維化大鼠體重的影響
Sham組大鼠在觀察期內體重呈穩定增長,各造模組大鼠體重在短時間內均有輕度下降,最低值出現在術后第4天,隨著實驗進展所有動物體重均逐漸增加;治療組動物體重變化趨勢與模型組基本一致,差異無統計學意義(圖1),表明新型PDE5抑制劑CPD1干預對大鼠體重變化無明顯不良影響。
 圖1
CPD1治療對BLM誘導的單側肺纖維化大鼠體重的影響
圖1
CPD1治療對BLM誘導的單側肺纖維化大鼠體重的影響
CPD1治療對大鼠體重變化無明顯影響。a. 體重的變化;b. 體重增長率的變化。與Sham組比較,**
2.2 CPD1對肺纖維化大鼠患側肺組織病理結構損傷的影響
由圖2可見,Sham組大鼠左肺的肺泡形態完整,肺泡間隔清晰纖細,無明顯的炎細胞浸潤或纖維化增生;與Sham組比較,BLM組大鼠患側肺組織肺泡塌陷,肺泡結構明顯紊亂,肺泡間隔增厚,肺泡腔異常增大及肺小動脈管壁顯著增厚,同時伴有大量的炎性滲出物以及成纖維細胞增生;而經過CPD1灌胃給藥后,大鼠患側肺組織結構較BLM組明顯改善,表現為肺泡形態較為完整,肺泡間隔相對清晰纖細以及肺小動脈管壁增厚得到顯著改善,肉眼可見僅有少部分的炎性滲出物以及成纖維細胞增生。通過對各組肺組織的氣管損傷、氣管炎癥、血管損傷及血管炎癥進行評分(圖3),結果顯示CPD1治療組分值與陽性對照藥尼達尼布組無顯著差異,均顯著低于模型組,表明新型PDE5抑制劑CPD1預防性治療可顯著改善BLM引起的肺損傷。
 圖2
單側肺纖維化大鼠肺組織結構損傷病理像
圖2
單側肺纖維化大鼠肺組織結構損傷病理像
a. Sham組:肺泡形態完整,間隔清晰;BLM組:肺泡塌陷,結構紊亂;尼達尼布和CPD1治療組:肺泡結構得到改善(HE×100)。b:Sham組:無炎細胞浸潤或纖維化增生;BLM組:肺小動脈管壁增厚,伴有大量的炎性滲出物及成纖維細胞增生;尼達尼布和CPD1治療組:肺小動脈管壁增厚得到改善,僅有少部分炎性滲出物及成纖維細胞增生(HE×200)。
 圖3
肺組織的氣管損傷、氣管炎癥、血管損傷及血管炎癥評分
圖3
肺組織的氣管損傷、氣管炎癥、血管損傷及血管炎癥評分
與Sham組比較,**
2.3 CPD1對肺纖維化大鼠患側肺組織間質膠原沉積的影響
由圖4可見,Sham組大鼠左肺組織未見明顯膠原纖維沉積,僅在肺泡間隔處發現少量被染上淡藍色的膠原纖維;與Sham組相比,BLM組大鼠左肺組織出現肺纖維化損傷,表現為肺泡腔內有炎性滲出物,出現不同程度的膠原纖維沉積,部分肺泡腔纖維化導致整體肺泡組織結構消失,肉眼可見明顯增厚的肺泡壁有大量藍色條狀膠原纖維增生;經CPD1預防性治療后,大鼠左肺組織中膠原沉積明顯減少。肺纖維化評分結果顯示其對膠原沉積的抑制作用可達到陽性對照藥尼達尼布的治療水平(圖5)。
 圖4
單側肺纖維化大鼠肺間質膠原沉積病理像
圖4
單側肺纖維化大鼠肺間質膠原沉積病理像
a. Sham組:未見明顯的膠原纖維沉積;BLM組:出現不同程度的膠原纖維沉積,部分肺泡腔纖維化導致整體肺泡組織結構消失;尼達尼布和CPD1治療組:肺組織結構得到改善(Masson×100);b:Sham組:僅在肺泡間隔處發現少量膠原纖維;BLM組:可見明顯增厚的肺泡壁有大量條狀膠原纖維增生;尼達尼布和CPD1治療組:膠原沉積明顯減少(Masson×200)。
 圖5
肺纖維化評分及肺纖維化評分百分比
圖5
肺纖維化評分及肺纖維化評分百分比
a. 肺纖維化評分:藥物治療后,肺纖維化整體評分顯著降低;b. 肺纖維化評分百分比:藥物治療后,肺纖維化程度≤3分的比例顯著增高,≥4分的比例顯著降低。與Sham組比較,**
2.4 CPD1對肺纖維化大鼠患側肺組織中纖維化標志物表達及分布的影響
免疫組化染色結果(圖6)顯示,與Sham組相比,BLM模型組大鼠左肺組織中ECM主要成分Fn、α-SMA和Collagen Ⅰ以棕黃色條索狀聚集分布在肺泡隔及間質性病變區域;經CPD1預防性治療后,纖維化標志物表達均明顯減少,表現為肺泡及間質性病變區域的棕黃色條索狀明顯減少,并且其陽性表達顯色減弱。RT-qPCR結果顯示,BLM組大鼠肺組織中Fn、α-SMA和Collagen Ⅰ基因的表達水平均顯著高于Sham組(P<0.05),CPD1預防性治療后各種纖維化標志因子的mRNA表達均明顯減少(P<0.01)(圖7a~c)。Western blot結果顯示,BLM顯著降低肺組織中上皮標志物E-cad的表達,而CPD1預防性治療可上調E-cad的表達(P<0.01)(圖7d、e),表明CPD1可能通過抑制EMT延緩肺纖維化的進程。
 圖6
單側肺纖維化大鼠肺組織中纖維化標志蛋白表達和分布病理像
圖6
單側肺纖維化大鼠肺組織中纖維化標志蛋白表達和分布病理像
藥物治療顯著降低肺組織中纖維化標志蛋白Fn、α-SMA和Collagen Ⅰ的表達(免疫組化染色×200)
 圖7
單側肺纖維化大鼠肺組織中纖維化標志物和上皮標志物的表達
圖7
單側肺纖維化大鼠肺組織中纖維化標志物和上皮標志物的表達
a~c. RT-qPCR結果顯示藥物治療顯著降低肺組織中纖維化標志物基因Fn1、Acta2和Collagen Ⅰ的mRNA表達;d. E-Cad免疫印跡檢測電泳條帶圖;e. 各組肺組織E-Cad蛋白表達水平:藥物治療顯著上調上皮標志物的表達。與Sham組比較,*
2.5 CPD1對TGF-β1/Smad信號通路的影響
進一步探討CPD1預防性治療肺纖維化的作用機制,觀察CPD1對A549細胞中TGF-β/Smad信號通路相關基因表達的影響。細胞實驗結果顯示BLM預處理可顯著增加A549細胞中肺纖維化標志基因Fn1以及PDE5a基因的表達水平,而CPD1作用后顯著降低Fn1和PDE5a的表達。與空白對照組相比,BLM促進A549細胞中TGF-β1和Smad3 mRNA表達水平的顯著上調(P<0.01),而CPD1呈劑量依賴性顯著降低TGF-β1和Smad3基因的表達(圖8)。
 圖8
CPD1治療對A549細胞中TGF-β1/Smad3通路的影響
圖8
CPD1治療對A549細胞中TGF-β1/Smad3通路的影響
a. A549細胞中Fn1 mRNA的表達;b. PDE5a mRNA的表達;c. TGF-β1 mRNA的表達;d. Smad3 mRNA的表達(
3 討論
據全球最新的流行病學統計,每十萬人中約有5 000人患有纖維化相關疾病,并且由纖維化引起的健康問題已經成為全球四分之一人口的醫療負擔。新型冠狀病毒肺炎自2019年被發現以來,已經成為近百年來影響范圍最廣的大流行病。新冠病毒感染者患有肺纖維化幾率大幅增加,在重癥和危重癥患者肺部中觀察到大量的炎細胞浸潤和纖維組織增生,與僅感染1次新冠病毒感染者相比,重復感染者出現肺部后遺癥的風險增加了254%[14]。因此,全球肺纖維化的負擔大大增加。尼達尼布和吡非尼酮是目前僅有的兩種被批準用于治療特發性肺纖維化的孤兒藥物。其中,尼達尼布是一種小分子酪氨酸激酶抑制劑,可同時阻斷三種生長因子(VEGF、FGFR和PDGF)受體,從而有效抑制纖維化過程中的信號通路[15]。吡非尼酮具有抗纖維化、抗炎和抗氧化活性的功能,通過下調促纖維化細胞因子的產生,以及降低成纖維細胞增殖并影響成纖維細胞的分化,從而具有廣譜抗纖維化的作用[16],但目前尚未被批準用于進展性肺纖維化的治療,需要更多的臨床試驗探索[17]。此外,兩種藥物均具有有效劑量大、不良反應明顯和使用價格昂貴等特點,這給患者帶來沉重的經濟和身體負擔,因此亟需開發新型的抗肺纖維化藥物。團隊前期多項研究已證實新型PDE5抑制劑CPD1具有抗纖維化的作用[8-11],本研究繼續探討了CPD1預防性治療是否對BLM引起的單側肺組織結構損傷和膠原沉積有保護作用。
纖維化通常被認為是一種失調的傷口愈合反應,其特征是ECM在組織損傷部位過度沉積。構成纖維化瘢痕的ECM在組織中是高度保守的,主要由Fn、間質膠原蛋白(Ⅰ型和Ⅲ型)和層粘連蛋白等基底膜蛋白組成[18]。使用BLM、輻射、二氧化硅、石棉、異硫氰酸熒光素以及某些細胞因子的過表達會在強烈的炎癥反應后導致肺纖維化。根據美國胸科協會官方研討會報告[19],關于確定抗纖維化化合物臨床前評估的建議,推薦在實驗動物中使用小鼠或大鼠氣管內滴注BLM作為臨床前測試的肺纖維化最佳表征動物模型。由于大鼠雙側肺葉數量和結構不同,如果采用主氣管滴注法將不可避免導致左右肺葉藥物分布不均,出現雙側肺葉損傷不均一性的問題,因此本研究中每個動物BLM均通過支氣管滴注進入左肺,可以保證所有動物在左肺的損傷范圍相近,病灶分布均勻,減小組內差異[13]。本研究發現模型組大鼠患側肺組織結構嚴重損傷,圍繞中心氣道區域最嚴重,伴有明顯的炎癥細胞浸潤,同時肺間質出現大量膠原纖維沉積;CPD1預防性治療后顯著減輕患側肺組織結構損傷和間質纖維化程度,降低Fn、α-SMA和Collagen Ⅰ的表達,表明CPD1可有效抑制ECM的過度沉積,改善纖維化肺組織結構損傷。
TGF-β/Smad信號通路在纖維化進程中發揮重要作用,TGF-β1與其Ⅰ型、Ⅱ型受體結合形成復合物,使Smad2和/或Smad3被磷酸化,并與Smad4結合形成異源三聚體復合物,進入細胞核激活上皮間質轉化下游轉錄因子的表達,從而誘導上皮間質轉化的發生。本研究中,BLM促進A549細胞中TGF-β1和Smad3基因表達水平顯著上調,纖維化標志蛋白Fn1和PDE5a表達顯著增加,表明BLM激活TGF-β1/Smad3信號通路,引起肺泡上皮細胞發生上皮-間質轉化。而CPD1預防性治療顯著抑制TGF-β1和Smad3的表達,降低Fn1和PDE5a的表達,上調上皮標志物E-Cad的表達,表明CPD1可通過抑制TGF-β1/Smad3信號通路的激活,阻斷上皮間質轉化,減少肺間質細胞外基質的沉積,減輕肺組織病理結構的損傷,延緩纖維化進程。盡管如此,區分干擾炎癥和早期纖維化反應的藥物與預防纖維化進展的藥物至關重要,本研究屬于預防性給藥實驗,后續將進一步開展治療性給藥實驗,探究CPD1對肺纖維化的治療作用。此外,肺纖維化的預后異質性大,受年齡、性別、營養狀況、基礎肺功能等多種因素的影響,也是藥物治療效果基礎和臨床研究中不容忽視的關鍵因素[20]。
綜上所述,本研究從肺組織結構、肺間質膠原沉積和肺泡上皮細胞上皮-間質轉化探究了CPD1對BLM引起的單側肺纖維化的預防性治療作用。CPD1通過降低肺泡上皮細胞中PDE5的表達和活性,抑制TGF-β1/Smad3信號通路介導的上皮-間質轉化和炎癥,進而減輕肺組織結構損傷,發揮抗肺纖維化的作用。本研究對肺纖維化治療新藥的開發和臨床研究具有重要意義。
利益沖突:本研究不涉及任何利益沖突。