引用本文: 劉玲, 代靜泓, 邱玉英. 間質性肺疾病繼發肺孢子菌肺炎50例患者的臨床分析. 中國呼吸與危重監護雜志, 2023, 22(11): 789-795. doi: 10.7507/1671-6205.202305048 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
間質性肺疾病(interstitial lung disease,ILD)是一組肺間質和肺泡腔發生一系列炎癥和纖維化反應的進展性、異質性疾病,包括200多個可引起急性、慢性呼吸系統癥狀的病種[1]。在治療上,糖皮質激素及免疫抑制劑是ILD的常用藥物。長期使用激素及免疫抑制劑導致患者免疫功能下降,易于發生各種機會性感染。特別是當CD4+ T淋巴細胞計數<200個/μL時,易于繼發肺孢子菌(Pneumocystis jirovecii,PJ)感染,即肺孢子菌肺炎(pneumocystis pneumonia,PCP)[2]。一旦ILD患者繼發PCP,病情更為危重,呼吸功能迅速惡化,患者的病死率高達57.89%[3]。ILD繼發PCP時患者的臨床癥狀和影像學表現缺乏特異性,與ILD的急性加重難以區分,臨床上常誤診為ILD的急性加重而給予大劑量糖皮質激素沖擊治療,這會導致患者的病情進一步惡化,加速患者死亡[4],故對這類患者早期診斷可以降低患者的死亡風險。傳統的PCP確診方法主要是支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)涂片染色鏡檢。然而,由于其檢出率較低,臨床應用受到限制。近年來宏基因組二代測序(metagenomic next-generation sequencing,mNGS)技術得到廣泛應用。該技術可以無偏倚地從標本中提取微生物的基因序列進行遺傳信息分析,從而精確識別標本中所含的全部病原體,對于診斷困難的感染性疾病尤其是PCP的診斷具有重要價值[5]。當ILD患者診療過程中胸悶氣喘的癥狀加重,影像學上磨玻璃影、實變影進展時,需高度懷疑繼發PCP,在患者能耐受纖維支氣管鏡操作的早期階段進行BALF mNGS檢測以確定診斷,從而改善患者預后,降低患者病死率。為提高臨床醫生對ILD繼發PCP患者的預防和診療水平,現分析、總結2015年1月—2022年12月在南京鼓樓醫院呼吸與危重癥醫學科住院的50例ILD繼發PCP患者的臨床資料,以期在臨床工作中實現對ILD繼發PCP患者的早期診斷與早期治療。
1 資料與方法
1.1 臨床資料
回顧性分析2015年1月—2022年12月在南京鼓樓醫院呼吸與危重癥醫學科住院的ILD繼發PCP患者的臨床資料。納入標準:(1)存在ILD基礎病或因PCP入院后查出ILD;(2)在原有肺病癥狀的基礎上出現氣喘、咳嗽加重或發熱;(3)胸部高分辨率CT(high resolution computed tomography,HRCT)可見雙肺磨玻璃影,或在原有間質性肺炎病變基礎上新增磨玻璃影、實變影;(4)確診需病原學證據,即病原標本經mNGS或涂片染色鏡檢檢出PJ,標本來源包括肺泡灌洗液、外周血或痰液。排除標準:(1)艾滋病患者;(2)組織標本檢出PJ,但考慮為定植的患者;(3)資料不全者。最終納入患者50例。
1.2 方法
收集、分析50例患者的臨床資料,包括藥物使用史、基礎疾病、臨床癥狀與體征、實驗室檢驗和胸部HRCT檢查結果、治療方法及預后等。
1.3 統計學方法
采用SPSS 26.0統計軟件。計量資料采用中位數(數據范圍)表示,定性資料采用例(%)表示。
2 結果
2.1 一般資料
2015年1月—2022年12月,共收集ILD繼發PCP的患者50例,其中男23例,女27例,中位年齡64歲。48例(96%)ILD患者存在糖皮質激素使用史,其中40例患者長期(療程大于1個月)使用激素,中位激素使用時間為3個月,77.5%(31/40)的長期使用激素的患者在開始激素治療半年內發生PCP;另外8例患者采用短程治療(療程小于1個月)。34例(34/50,68.0%)患者存在免疫抑制劑使用史,包括環磷酰胺13例、他克莫司12例、羥氯喹9例、雷公藤8例、環孢素4例、麥考酚酸酯4例、沙利度胺3例、甲氨蝶呤3例、來氟米特2例,中位時間為3個月。50例ILD患者均未使用PCP預防藥物。除了ILD外,患者合并其他基礎疾病,包括結締組織病27例,高血壓16例,糖尿病9例,心臟病8例。患者的臨床癥狀主要有氣喘、發熱、咳嗽。結果見表1。
2.2 實驗室檢查
50例患者中外周血白細胞計數>10000個/μL 18例,總淋巴細胞計數<1100個/μL 38例,CD4+ T淋巴細胞缺乏(<200個/μL)27例,CD4+ T淋巴細胞<300個/μL 34例,CD3+ T淋巴細胞計數<750個/μL 37例,(1,3)-β-D葡聚糖試驗(β-D-glucan test,G試驗)>200 pg/mL 34例,血清乳酸脫氫酶(lactate dehydrogenase,LDH)>350 U/L 35例,Ⅰ型呼吸衰竭41例。結果見表1。
2.3 影像學檢查
ILD繼發PCP后胸部HRCT所示:(1)病變分布:所有患者均呈雙側分布,其中27例患者呈現雙側彌漫性病變。(2)病變形態:可見磨玻璃影46例(92.0%)例,實變影35例(70.0%),肺氣囊32例(64.0%),縱隔淋巴結腫大23例(46.0%),結節影21例(42.0%),縱隔和(或)皮下氣腫9例(18.0%),牽拉性支氣管擴張6例(12.0%)。ILD患者繼發PCP前后及抗PJ治療后的胸部HRCT表現見圖1。
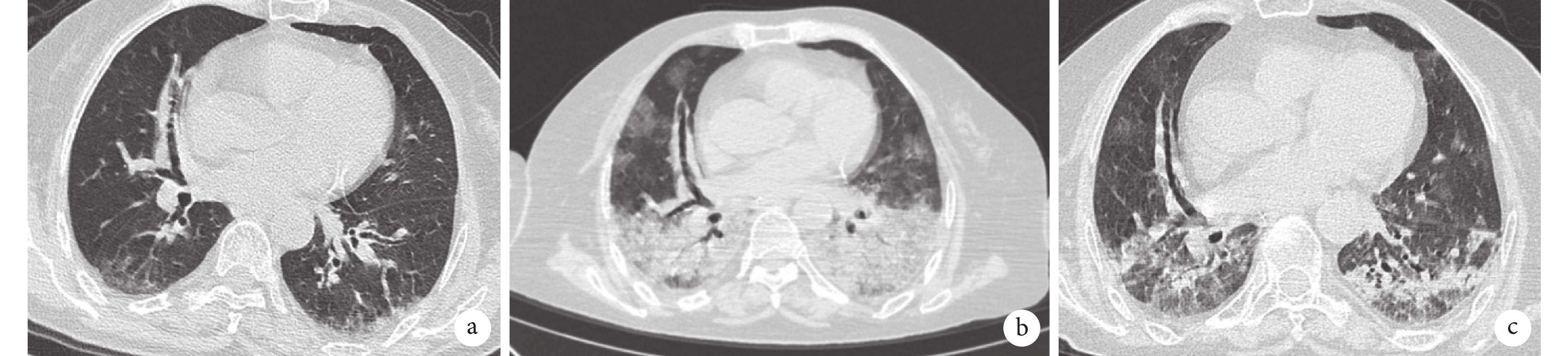 圖1
病例1診治期間胸部HRCT檢查像
圖1
病例1診治期間胸部HRCT檢查像
a. 2021-02-17,雙肺散在磨玻璃影、條索影,患者初診ILD;b. 2021-06-15,在原有散在磨玻璃影、條索影基礎上出現雙肺大片磨玻璃影、實變影,該患者口服激素及免疫抑制劑3個月后繼發PCP;c. 2021-07-06,經抗肺孢子菌治療近1個月后,實變影、磨玻璃影較前明顯吸收。
2.4 病原學診斷方法
本研究中36例患者通過mNGS技術檢出PJ,mNGS標本來源包括BALF 25例、血液9例、痰液2例。2例患者經BALF標本涂片染色鏡檢檢出PJ。
2.5 治療與預后
本研究50例患者均選用復方新諾明抗PJ治療,其中13例僅予復方新諾明單藥治療,37例聯合其他抗生素治療,包括復方新諾明+卡泊芬凈+克林霉素15例,復方新諾明+卡泊芬凈14例,復方新諾明+克林霉素8例。經過治療后,29例好轉出院,10例院內死亡,11例因治療無效、病情惡化等原因患者家屬要求自動出院。
3 討論
ILD患者常使用糖皮質激素及免疫抑制劑治療,這類藥物會使患者的CD4+ T淋巴細胞減少,從而容易繼發各種機會性感染。特別是當患者外周血中CD4+ T淋巴細胞缺乏(<200個/μL)時,容易繼發PCP[2]。因為CD4+ T淋巴細胞可釋放γ干擾素募集巨噬細胞,進而促進中性粒細胞清除PJ,當CD4+ T淋巴細胞缺乏時,γ干擾素缺乏,中性粒細胞清除PJ的防御功能下降,使機體易患PCP[6]。ILD患者繼發PCP后診斷難度大,病情較非ILD的PCP患者更為危重,呼吸功能迅速惡化,患者的預后差,病死率高達57.89%[3],故ILD繼發PCP的預防與早期診斷對于改善患者的預后至關重要。
與既往研究[3]相符,本研究中42.0%(21/50)的ILD繼發PCP患者預后不良。分析患者不良預后發生率高的原因:(1)部分患者在外院未得到有效診治,病情嚴重惡化后才入我科治療,此時患者已無法耐受纖維支氣管鏡檢查;(2)本研究納入的人群為ILD患者,有研究指出ILD是PCP預后不良的危險因素[7],可能因為患者本身存在一定程度的呼吸功能損害,PJ感染時炎癥反應重,使呼吸功能進一步下降,本研究中41例患者發生呼吸衰竭;(3)在病理學上,繼發PCP后所產生的炎癥反應會損傷肺泡上皮細胞,促進肺組織纖維化過程的發生,這也是ILD發生、發展的機制,這提示繼發PCP會加速ILD的病情進展。
ILD患者本身就有一定程度的呼吸道癥狀,由于應用激素及免疫抑制劑可能會掩蓋發熱等感染癥狀,部分ILD患者繼發PCP后癥狀加重不明顯,僅胸部CT顯示磨玻璃影較前進展,因此對比分析患者胸部CT的變化對于診斷至關重要[8]。ILD繼發PCP的影像學表現復雜多樣。與既往文獻[9]相符,本研究中患者胸部HRCT主要表現為在原有網格影、蜂窩肺、條索影、磨玻璃影等間質性肺炎病變的基礎上出現磨玻璃影、實變影明顯增多。此外,胸部CT也是評估患者病情嚴重程度及病情變化的重要手段,重癥PCP患者胸部CT可出現彌漫性鋪路石征及肺實變[10]。
既往研究多認為,當患者外周血CD4+ T淋巴細胞<200個/μL時,需要預防PJ感染,其納入的研究對象包括艾滋病、血液系統惡性腫瘤及器官移植的患者[2, 11-12]。然而目前缺乏針對ILD患者預防PCP用藥指征的研究。本研究中,若將CD4+ T淋巴細胞<200個/μL作為ILD患者預防PCP用藥的界值,僅54.0%(27/50)的ILD繼發PCP患者具有預防用藥指征;若將CD4+ T淋巴細胞計數<300個/μL作為界值,則68.0%(34/50)的ILD繼發PCP的患者具有藥物預防PCP的指征。故筆者認為,對于ILD患者來說,藥物預防PCP的CD4+ T淋巴細胞計數界值可能需要高于其他易感人群。究其原因,可能是ILD患者由于存在呼吸系統結構和功能的損害,呼吸道及肺部防御力降低,使PJ更容易定植和感染[13]。由于CD4+ T淋巴細胞介導的免疫反應可造成肺組織損傷,這也是PCP的發病機制[14],這也可以解釋發生PCP時部分ILD患者的CD4+ T淋巴細胞計數沒有明顯降低。與本研究相符,Messiaen等[15]對515例非艾滋病的PCP患者進行系統性回顧分析,發現72.4%的患者CD4+ T淋巴細胞計數<300個/μL。此外,也有研究認為CD4+ T淋巴細胞計數與預后相關,其值減少預示了PCP患者的不良預后[16]。相反,Chen等[17]對69例PCP患者進行回顧性分析,發現CD4+ T淋巴細胞水平與預后無關。未來需要更多數據來進一步研究CD4+ T淋巴細胞在PCP發生、發展中的作用。
除了CD4+ T淋巴細胞計數外,CD3+ T淋巴細胞計數也是ILD患者繼發PCP風險評估與預防用藥的重要依據。在非艾滋病患者中,由于免疫細胞的減損不像艾滋病患者那樣僅特異性地發生在CD4+ T淋巴細胞上,其他亞型的淋巴細胞也會減少,因此CD3+ T淋巴細胞(包括CD4+ T淋巴細胞、CD8+ T淋巴細胞及NK細胞)減少也是這類患者發生PCP的危險因素[18]。本研究中74.0%(37/50)的患者CD3+ T淋巴細胞<750個/μL。與本研究結論相符,Li等[18]研究發現超過90%的非艾滋病的PCP患者CD3+ T淋巴細胞<750個/μL,并提出當CD3+ T淋巴細胞<750個/μL時,需要藥物預防PCP。
本研究中48例ILD患者有糖皮質激素使用史,其中77.5%(31/40)的長期使用激素者在開始激素治療的半年內繼發PCP,中位時間為3個月,這與Cai等[19]的報道一致。本研究中34例患者同時有免疫抑制劑使用史,發生PCP時中位使用時間也是3個月。這提示臨床醫生要重視ILD患者的激素及免疫抑制劑使用情況,尤其是開始激素及免疫抑制劑治療半年內容易繼發PCP,在此期內需要密切監測CD4+及CD3+ T淋巴細胞計數水平,及時藥物預防PCP。與本研究結果相符,一項納入116例非艾滋病患者的研究發現,繼發PCP前的中位激素使用時間為25周[20]。另有研究發現,腎病患者使用激素及免疫抑制劑治療的第3個月最易繼發肺部感染[21]。Barbulescu等[22]對9654例類風濕關節炎患者進行了3年的隨訪,發現患者在開始激素治療的前6個月容易發生嚴重感染,并指出激素使用時間超過1年后幾乎沒有發生嚴重感染的風險。Cai等[19]認為激素治療初期時容易發生免疫功能紊亂,從而容易繼發PCP,所以激素及免疫抑制劑治療初期是預防PCP的良好時機。然而,本研究50例患者均未常規進行淋巴細胞亞群計數監測及相應的藥物預防,提示臨床醫生需提高ILD患者繼發PCP的預防意識。
外周血G試驗陽性是PCP的可靠輔助診斷指標。外周血G試驗測定的是PJ入侵肺組織后由吞噬細胞處理并釋放入血的真菌細胞壁成分的水平,因而外周血G試驗水平可反映肺部PJ的病原體載量及患者病情的嚴重程度[23]。本研究將200 pg/mL作為ILD患者繼發PCP的G試驗診斷界值,發現68.0%(34/50)的患者G試驗陽性,另有32.0%(16/50)患者G試驗為陰性。推測這16例患者G試驗陰性的原因可能是患者的PJ載量低而使其細胞壁成分釋放入血過少或是患者的血液標本未及時送檢[24]。由于G試驗有假陰性的可能,故需結合其他臨床資料綜合診斷PCP[23]。Morjaria等[25]對438例患者進行回顧性分析,發現G試驗對于PCP具有較高的診斷效能,當G試驗界值設定為200 pg/mL時,診斷PCP的敏感性為70%,特異性高達100%。需要明確的是,G試驗不是PCP的特異性標志物,其他真菌感染、白蛋白治療及使用磺胺類藥物時其值也可升高[26]。
其次,外周血LDH也是PCP的輔助診斷指標。參考既往文獻,本研究將LDH>350 U/L作為ILD患者診斷PCP的界值,發現70.0%(35/50)患者LDH陽性。既往研究認為外周血LDH水平高于350 U/L可作為艾滋病患者診斷PCP的可靠依據[27]。相反Esteves等[28]發現LDH對于PCP的診斷敏感性為71.0%,特異性僅42.1%,并指出LDH對于PCP的診斷價值有限。目前關于LDH在ILD患者中對于PCP的診斷效能方面尚缺乏相關研究,未來需要更多數據來評估其診斷效能。此外, Schmidt等[29]用多變量回歸模型分析了240例PCP患者,發現LDH水平是評估PCP患者預后的有效指標。
ILD繼發PCP的確診依據為病原標本中檢出PJ,傳統方法主要是病原標本涂片染色鏡檢,然而由于受到染色方法、標本質量、病原載量、檢測人員技術等多因素的影響而使其檢出率較低,臨床應用受到限制。近年來興起的mNGS技術可從標本中提取全部微生物的基因序列進行遺傳信息分析,對于診斷困難的感染性疾病尤其是PCP的診斷具有重要價值[5]。經纖維支氣管鏡采集的BALF標本包含下呼吸道深部的細胞及溶質,BALF mNGS的結果可以全面反映ILD患者下呼吸道微生物的分布情況[30]。Chen等[13]研究發現BALF mNGS對于PCP的診斷敏感性達100%,同時特異性也高達90%。mNGS除了病原體陽性檢出率高之外,還具有快速、無偏倚、病原體廣覆蓋等優勢,對于機會性感染和混合性感染的診斷價值高,特別適用于長期使用激素及免疫抑制劑的ILD患者。在臨床工作中,當長期使用激素及免疫抑制劑的ILD患者出現呼吸困難、咳嗽加重或發熱等癥狀,影像學上出現較前進展的磨玻璃影或實變影時,需要高度懷疑繼發PJ感染,并注意與ILD的急性加重相鑒別,兩者在癥狀及影像學改變上難以區分[3]。同時由于兩者的治療重點截然不同,若臨床出現誤診誤治,可使病情進一步惡化,加速患者死亡,故對這類患者需要盡快確診。由于BALF mNGS可以精準、快速篩選出PCP患者,所以本研究強調在患者能耐受支氣管鏡操作的早期階段行BALF mNGS檢測,有助于早期診斷與鑒別診斷,降低患者的病死率。張銘楊等[31]研究發現BALF mNGS檢測可降低ILD急性加重患者的28天病死率。但纖維支氣管鏡屬于侵入性操作,部分患者因病情嚴重而難以耐受。此時外周血mNGS對于ILD繼發PCP患者的確診可能發揮一定作用。2020年一項納入37例PCP患者的對照研究認為外周血mNGS具有無創、簡單、快速、避免定植干擾等優勢,同時對于PCP具有較高診斷效能[32]。本研究中9例患者由于無法獲取BALF標本,經外周血mNGS檢測也得到確診。
綜上所述,ILD患者使用激素及免疫抑制劑后容易繼發PCP,此時病情嚴重,診斷困難,預后較差,充分評估患者的易感因素與相關實驗室指標、對比繼發PCP前后的胸部CT并盡早行BALF mNGS檢測有助于及時、正確地開展診療工作。此外,ILD患者開始激素及免疫抑制劑治療的半年內容易繼發PCP,在此期間要定期監測患者的外周血CD4+ T淋巴細胞計數、CD3+ T淋巴細胞計數、G試驗及LDH水平,綜合、全面、個體化地評估患者的易感因素,及時藥物預防。然而,本研究納入的樣本量少。后續研究不僅需提高樣本量,還需進一步探索ILD患者預防PCP的指征及此類患者早期診斷PCP的方法。
利益沖突:本研究不涉及任何利益沖突。
間質性肺疾病(interstitial lung disease,ILD)是一組肺間質和肺泡腔發生一系列炎癥和纖維化反應的進展性、異質性疾病,包括200多個可引起急性、慢性呼吸系統癥狀的病種[1]。在治療上,糖皮質激素及免疫抑制劑是ILD的常用藥物。長期使用激素及免疫抑制劑導致患者免疫功能下降,易于發生各種機會性感染。特別是當CD4+ T淋巴細胞計數<200個/μL時,易于繼發肺孢子菌(Pneumocystis jirovecii,PJ)感染,即肺孢子菌肺炎(pneumocystis pneumonia,PCP)[2]。一旦ILD患者繼發PCP,病情更為危重,呼吸功能迅速惡化,患者的病死率高達57.89%[3]。ILD繼發PCP時患者的臨床癥狀和影像學表現缺乏特異性,與ILD的急性加重難以區分,臨床上常誤診為ILD的急性加重而給予大劑量糖皮質激素沖擊治療,這會導致患者的病情進一步惡化,加速患者死亡[4],故對這類患者早期診斷可以降低患者的死亡風險。傳統的PCP確診方法主要是支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)涂片染色鏡檢。然而,由于其檢出率較低,臨床應用受到限制。近年來宏基因組二代測序(metagenomic next-generation sequencing,mNGS)技術得到廣泛應用。該技術可以無偏倚地從標本中提取微生物的基因序列進行遺傳信息分析,從而精確識別標本中所含的全部病原體,對于診斷困難的感染性疾病尤其是PCP的診斷具有重要價值[5]。當ILD患者診療過程中胸悶氣喘的癥狀加重,影像學上磨玻璃影、實變影進展時,需高度懷疑繼發PCP,在患者能耐受纖維支氣管鏡操作的早期階段進行BALF mNGS檢測以確定診斷,從而改善患者預后,降低患者病死率。為提高臨床醫生對ILD繼發PCP患者的預防和診療水平,現分析、總結2015年1月—2022年12月在南京鼓樓醫院呼吸與危重癥醫學科住院的50例ILD繼發PCP患者的臨床資料,以期在臨床工作中實現對ILD繼發PCP患者的早期診斷與早期治療。
1 資料與方法
1.1 臨床資料
回顧性分析2015年1月—2022年12月在南京鼓樓醫院呼吸與危重癥醫學科住院的ILD繼發PCP患者的臨床資料。納入標準:(1)存在ILD基礎病或因PCP入院后查出ILD;(2)在原有肺病癥狀的基礎上出現氣喘、咳嗽加重或發熱;(3)胸部高分辨率CT(high resolution computed tomography,HRCT)可見雙肺磨玻璃影,或在原有間質性肺炎病變基礎上新增磨玻璃影、實變影;(4)確診需病原學證據,即病原標本經mNGS或涂片染色鏡檢檢出PJ,標本來源包括肺泡灌洗液、外周血或痰液。排除標準:(1)艾滋病患者;(2)組織標本檢出PJ,但考慮為定植的患者;(3)資料不全者。最終納入患者50例。
1.2 方法
收集、分析50例患者的臨床資料,包括藥物使用史、基礎疾病、臨床癥狀與體征、實驗室檢驗和胸部HRCT檢查結果、治療方法及預后等。
1.3 統計學方法
采用SPSS 26.0統計軟件。計量資料采用中位數(數據范圍)表示,定性資料采用例(%)表示。
2 結果
2.1 一般資料
2015年1月—2022年12月,共收集ILD繼發PCP的患者50例,其中男23例,女27例,中位年齡64歲。48例(96%)ILD患者存在糖皮質激素使用史,其中40例患者長期(療程大于1個月)使用激素,中位激素使用時間為3個月,77.5%(31/40)的長期使用激素的患者在開始激素治療半年內發生PCP;另外8例患者采用短程治療(療程小于1個月)。34例(34/50,68.0%)患者存在免疫抑制劑使用史,包括環磷酰胺13例、他克莫司12例、羥氯喹9例、雷公藤8例、環孢素4例、麥考酚酸酯4例、沙利度胺3例、甲氨蝶呤3例、來氟米特2例,中位時間為3個月。50例ILD患者均未使用PCP預防藥物。除了ILD外,患者合并其他基礎疾病,包括結締組織病27例,高血壓16例,糖尿病9例,心臟病8例。患者的臨床癥狀主要有氣喘、發熱、咳嗽。結果見表1。
2.2 實驗室檢查
50例患者中外周血白細胞計數>10000個/μL 18例,總淋巴細胞計數<1100個/μL 38例,CD4+ T淋巴細胞缺乏(<200個/μL)27例,CD4+ T淋巴細胞<300個/μL 34例,CD3+ T淋巴細胞計數<750個/μL 37例,(1,3)-β-D葡聚糖試驗(β-D-glucan test,G試驗)>200 pg/mL 34例,血清乳酸脫氫酶(lactate dehydrogenase,LDH)>350 U/L 35例,Ⅰ型呼吸衰竭41例。結果見表1。
2.3 影像學檢查
ILD繼發PCP后胸部HRCT所示:(1)病變分布:所有患者均呈雙側分布,其中27例患者呈現雙側彌漫性病變。(2)病變形態:可見磨玻璃影46例(92.0%)例,實變影35例(70.0%),肺氣囊32例(64.0%),縱隔淋巴結腫大23例(46.0%),結節影21例(42.0%),縱隔和(或)皮下氣腫9例(18.0%),牽拉性支氣管擴張6例(12.0%)。ILD患者繼發PCP前后及抗PJ治療后的胸部HRCT表現見圖1。
 圖1
病例1診治期間胸部HRCT檢查像
圖1
病例1診治期間胸部HRCT檢查像
a. 2021-02-17,雙肺散在磨玻璃影、條索影,患者初診ILD;b. 2021-06-15,在原有散在磨玻璃影、條索影基礎上出現雙肺大片磨玻璃影、實變影,該患者口服激素及免疫抑制劑3個月后繼發PCP;c. 2021-07-06,經抗肺孢子菌治療近1個月后,實變影、磨玻璃影較前明顯吸收。
2.4 病原學診斷方法
本研究中36例患者通過mNGS技術檢出PJ,mNGS標本來源包括BALF 25例、血液9例、痰液2例。2例患者經BALF標本涂片染色鏡檢檢出PJ。
2.5 治療與預后
本研究50例患者均選用復方新諾明抗PJ治療,其中13例僅予復方新諾明單藥治療,37例聯合其他抗生素治療,包括復方新諾明+卡泊芬凈+克林霉素15例,復方新諾明+卡泊芬凈14例,復方新諾明+克林霉素8例。經過治療后,29例好轉出院,10例院內死亡,11例因治療無效、病情惡化等原因患者家屬要求自動出院。
3 討論
ILD患者常使用糖皮質激素及免疫抑制劑治療,這類藥物會使患者的CD4+ T淋巴細胞減少,從而容易繼發各種機會性感染。特別是當患者外周血中CD4+ T淋巴細胞缺乏(<200個/μL)時,容易繼發PCP[2]。因為CD4+ T淋巴細胞可釋放γ干擾素募集巨噬細胞,進而促進中性粒細胞清除PJ,當CD4+ T淋巴細胞缺乏時,γ干擾素缺乏,中性粒細胞清除PJ的防御功能下降,使機體易患PCP[6]。ILD患者繼發PCP后診斷難度大,病情較非ILD的PCP患者更為危重,呼吸功能迅速惡化,患者的預后差,病死率高達57.89%[3],故ILD繼發PCP的預防與早期診斷對于改善患者的預后至關重要。
與既往研究[3]相符,本研究中42.0%(21/50)的ILD繼發PCP患者預后不良。分析患者不良預后發生率高的原因:(1)部分患者在外院未得到有效診治,病情嚴重惡化后才入我科治療,此時患者已無法耐受纖維支氣管鏡檢查;(2)本研究納入的人群為ILD患者,有研究指出ILD是PCP預后不良的危險因素[7],可能因為患者本身存在一定程度的呼吸功能損害,PJ感染時炎癥反應重,使呼吸功能進一步下降,本研究中41例患者發生呼吸衰竭;(3)在病理學上,繼發PCP后所產生的炎癥反應會損傷肺泡上皮細胞,促進肺組織纖維化過程的發生,這也是ILD發生、發展的機制,這提示繼發PCP會加速ILD的病情進展。
ILD患者本身就有一定程度的呼吸道癥狀,由于應用激素及免疫抑制劑可能會掩蓋發熱等感染癥狀,部分ILD患者繼發PCP后癥狀加重不明顯,僅胸部CT顯示磨玻璃影較前進展,因此對比分析患者胸部CT的變化對于診斷至關重要[8]。ILD繼發PCP的影像學表現復雜多樣。與既往文獻[9]相符,本研究中患者胸部HRCT主要表現為在原有網格影、蜂窩肺、條索影、磨玻璃影等間質性肺炎病變的基礎上出現磨玻璃影、實變影明顯增多。此外,胸部CT也是評估患者病情嚴重程度及病情變化的重要手段,重癥PCP患者胸部CT可出現彌漫性鋪路石征及肺實變[10]。
既往研究多認為,當患者外周血CD4+ T淋巴細胞<200個/μL時,需要預防PJ感染,其納入的研究對象包括艾滋病、血液系統惡性腫瘤及器官移植的患者[2, 11-12]。然而目前缺乏針對ILD患者預防PCP用藥指征的研究。本研究中,若將CD4+ T淋巴細胞<200個/μL作為ILD患者預防PCP用藥的界值,僅54.0%(27/50)的ILD繼發PCP患者具有預防用藥指征;若將CD4+ T淋巴細胞計數<300個/μL作為界值,則68.0%(34/50)的ILD繼發PCP的患者具有藥物預防PCP的指征。故筆者認為,對于ILD患者來說,藥物預防PCP的CD4+ T淋巴細胞計數界值可能需要高于其他易感人群。究其原因,可能是ILD患者由于存在呼吸系統結構和功能的損害,呼吸道及肺部防御力降低,使PJ更容易定植和感染[13]。由于CD4+ T淋巴細胞介導的免疫反應可造成肺組織損傷,這也是PCP的發病機制[14],這也可以解釋發生PCP時部分ILD患者的CD4+ T淋巴細胞計數沒有明顯降低。與本研究相符,Messiaen等[15]對515例非艾滋病的PCP患者進行系統性回顧分析,發現72.4%的患者CD4+ T淋巴細胞計數<300個/μL。此外,也有研究認為CD4+ T淋巴細胞計數與預后相關,其值減少預示了PCP患者的不良預后[16]。相反,Chen等[17]對69例PCP患者進行回顧性分析,發現CD4+ T淋巴細胞水平與預后無關。未來需要更多數據來進一步研究CD4+ T淋巴細胞在PCP發生、發展中的作用。
除了CD4+ T淋巴細胞計數外,CD3+ T淋巴細胞計數也是ILD患者繼發PCP風險評估與預防用藥的重要依據。在非艾滋病患者中,由于免疫細胞的減損不像艾滋病患者那樣僅特異性地發生在CD4+ T淋巴細胞上,其他亞型的淋巴細胞也會減少,因此CD3+ T淋巴細胞(包括CD4+ T淋巴細胞、CD8+ T淋巴細胞及NK細胞)減少也是這類患者發生PCP的危險因素[18]。本研究中74.0%(37/50)的患者CD3+ T淋巴細胞<750個/μL。與本研究結論相符,Li等[18]研究發現超過90%的非艾滋病的PCP患者CD3+ T淋巴細胞<750個/μL,并提出當CD3+ T淋巴細胞<750個/μL時,需要藥物預防PCP。
本研究中48例ILD患者有糖皮質激素使用史,其中77.5%(31/40)的長期使用激素者在開始激素治療的半年內繼發PCP,中位時間為3個月,這與Cai等[19]的報道一致。本研究中34例患者同時有免疫抑制劑使用史,發生PCP時中位使用時間也是3個月。這提示臨床醫生要重視ILD患者的激素及免疫抑制劑使用情況,尤其是開始激素及免疫抑制劑治療半年內容易繼發PCP,在此期內需要密切監測CD4+及CD3+ T淋巴細胞計數水平,及時藥物預防PCP。與本研究結果相符,一項納入116例非艾滋病患者的研究發現,繼發PCP前的中位激素使用時間為25周[20]。另有研究發現,腎病患者使用激素及免疫抑制劑治療的第3個月最易繼發肺部感染[21]。Barbulescu等[22]對9654例類風濕關節炎患者進行了3年的隨訪,發現患者在開始激素治療的前6個月容易發生嚴重感染,并指出激素使用時間超過1年后幾乎沒有發生嚴重感染的風險。Cai等[19]認為激素治療初期時容易發生免疫功能紊亂,從而容易繼發PCP,所以激素及免疫抑制劑治療初期是預防PCP的良好時機。然而,本研究50例患者均未常規進行淋巴細胞亞群計數監測及相應的藥物預防,提示臨床醫生需提高ILD患者繼發PCP的預防意識。
外周血G試驗陽性是PCP的可靠輔助診斷指標。外周血G試驗測定的是PJ入侵肺組織后由吞噬細胞處理并釋放入血的真菌細胞壁成分的水平,因而外周血G試驗水平可反映肺部PJ的病原體載量及患者病情的嚴重程度[23]。本研究將200 pg/mL作為ILD患者繼發PCP的G試驗診斷界值,發現68.0%(34/50)的患者G試驗陽性,另有32.0%(16/50)患者G試驗為陰性。推測這16例患者G試驗陰性的原因可能是患者的PJ載量低而使其細胞壁成分釋放入血過少或是患者的血液標本未及時送檢[24]。由于G試驗有假陰性的可能,故需結合其他臨床資料綜合診斷PCP[23]。Morjaria等[25]對438例患者進行回顧性分析,發現G試驗對于PCP具有較高的診斷效能,當G試驗界值設定為200 pg/mL時,診斷PCP的敏感性為70%,特異性高達100%。需要明確的是,G試驗不是PCP的特異性標志物,其他真菌感染、白蛋白治療及使用磺胺類藥物時其值也可升高[26]。
其次,外周血LDH也是PCP的輔助診斷指標。參考既往文獻,本研究將LDH>350 U/L作為ILD患者診斷PCP的界值,發現70.0%(35/50)患者LDH陽性。既往研究認為外周血LDH水平高于350 U/L可作為艾滋病患者診斷PCP的可靠依據[27]。相反Esteves等[28]發現LDH對于PCP的診斷敏感性為71.0%,特異性僅42.1%,并指出LDH對于PCP的診斷價值有限。目前關于LDH在ILD患者中對于PCP的診斷效能方面尚缺乏相關研究,未來需要更多數據來評估其診斷效能。此外, Schmidt等[29]用多變量回歸模型分析了240例PCP患者,發現LDH水平是評估PCP患者預后的有效指標。
ILD繼發PCP的確診依據為病原標本中檢出PJ,傳統方法主要是病原標本涂片染色鏡檢,然而由于受到染色方法、標本質量、病原載量、檢測人員技術等多因素的影響而使其檢出率較低,臨床應用受到限制。近年來興起的mNGS技術可從標本中提取全部微生物的基因序列進行遺傳信息分析,對于診斷困難的感染性疾病尤其是PCP的診斷具有重要價值[5]。經纖維支氣管鏡采集的BALF標本包含下呼吸道深部的細胞及溶質,BALF mNGS的結果可以全面反映ILD患者下呼吸道微生物的分布情況[30]。Chen等[13]研究發現BALF mNGS對于PCP的診斷敏感性達100%,同時特異性也高達90%。mNGS除了病原體陽性檢出率高之外,還具有快速、無偏倚、病原體廣覆蓋等優勢,對于機會性感染和混合性感染的診斷價值高,特別適用于長期使用激素及免疫抑制劑的ILD患者。在臨床工作中,當長期使用激素及免疫抑制劑的ILD患者出現呼吸困難、咳嗽加重或發熱等癥狀,影像學上出現較前進展的磨玻璃影或實變影時,需要高度懷疑繼發PJ感染,并注意與ILD的急性加重相鑒別,兩者在癥狀及影像學改變上難以區分[3]。同時由于兩者的治療重點截然不同,若臨床出現誤診誤治,可使病情進一步惡化,加速患者死亡,故對這類患者需要盡快確診。由于BALF mNGS可以精準、快速篩選出PCP患者,所以本研究強調在患者能耐受支氣管鏡操作的早期階段行BALF mNGS檢測,有助于早期診斷與鑒別診斷,降低患者的病死率。張銘楊等[31]研究發現BALF mNGS檢測可降低ILD急性加重患者的28天病死率。但纖維支氣管鏡屬于侵入性操作,部分患者因病情嚴重而難以耐受。此時外周血mNGS對于ILD繼發PCP患者的確診可能發揮一定作用。2020年一項納入37例PCP患者的對照研究認為外周血mNGS具有無創、簡單、快速、避免定植干擾等優勢,同時對于PCP具有較高診斷效能[32]。本研究中9例患者由于無法獲取BALF標本,經外周血mNGS檢測也得到確診。
綜上所述,ILD患者使用激素及免疫抑制劑后容易繼發PCP,此時病情嚴重,診斷困難,預后較差,充分評估患者的易感因素與相關實驗室指標、對比繼發PCP前后的胸部CT并盡早行BALF mNGS檢測有助于及時、正確地開展診療工作。此外,ILD患者開始激素及免疫抑制劑治療的半年內容易繼發PCP,在此期間要定期監測患者的外周血CD4+ T淋巴細胞計數、CD3+ T淋巴細胞計數、G試驗及LDH水平,綜合、全面、個體化地評估患者的易感因素,及時藥物預防。然而,本研究納入的樣本量少。后續研究不僅需提高樣本量,還需進一步探索ILD患者預防PCP的指征及此類患者早期診斷PCP的方法。
利益沖突:本研究不涉及任何利益沖突。