引用本文: 王平, 謝黎, 郗曉蕓, 歐蕓禎, 潘婭, 楊東生. CACNA1F基因變異相關眼病臨床表型特征. 中華眼底病雜志, 2024, 40(6): 443-448. doi: 10.3760/cma.j.cn511434-20231221-00497 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
CACNA1F基因位于人類染色體Xp11.23,編碼Cav1.4離子通道的α1F亞基。α1F亞基缺失,可使光感受器細胞帶狀突觸數量、形態以及功能發生異常,從而引發光感受器細胞與二級神經元之間視覺信號傳導障礙。目前已發現其有超過60個位點變異,引起先天性靜止夜盲2A型(CSNB2A)Aland Island眼病(AIED)、視錐視桿細胞營養不良3型(CORDX3)等3種不同表型的遺傳性視網膜變性性疾病[1-3]。三種疾病具有不同的預后和進展風險,臨床上明確亞型分類診斷非常重要。但三者具有較多共同臨床特征,如視力下降、色覺缺陷、近視、眼球震顫、視網膜和視神經發育異常、視網膜電圖(ERG)負波形等[4-6],而目前臨床尚無明確鑒別診斷標準。我們回顧分析了一組CACNA1F基因變異相關眼病的臨床特征,以期為臨床鑒別提供更多的診斷依據。現將結果報道如下。
1 對象和方法
回顧性臨床研究。經長沙愛爾眼科醫院倫理委員會審批(批文號:2021IRB036)。
2022年1月1日至2023年10月1日于長沙愛爾眼科醫院和濟南普瑞眼科醫院臨床、基因檢測確診的CACNA1F基因變異相關眼病患者36例納入本研究。參照文獻[4-6]確立CSNB2A、AIED、CORDX3的診斷標準。
患者均行最佳矯正視力(BCVA)、醫學驗光、眼底彩色照相、光相干斷層掃描(OCT)、全視野ERG、眼球震顫檢查以及基因全外顯子測序(WES)。
采用早期糖尿病視網膜病變治療研究兩用對數視力表行BCVA檢查,應用+4~6 D鏡片作單眼遮蓋,記錄時轉換為最小分辨角對數(logMAR)視力。采用德國Carl Zeiss公司CLARUS 500超廣角眼底照相機行眼底彩色照相檢查。采用日本Topcon公司3D OCT-2000儀行OCT檢查,并參照文獻[7]的標準進行中心凹發育不全(FH)分級(Thomas分級)。采用美國LKC公司RETeval眼電理儀行全視野ERG檢查。遵循ISCEV(2019)標準,20 min暗適應后記錄視桿細胞反應和最大混合反應;10 min明適應后記錄單次閃光視錐反應和30 Hz閃爍光反應。Schubert-Bornschein波型:暗適應最大混合反應呈負波形,b波小于a波。殘存型:殘存暗適應0.01反應波和明適應3.0反應波,30 Hz反應下降呈雙峰寬波; 明適下降為主型:明適應全熄滅,殘存暗適應反應波;全熄滅型:明適應暗適應全熄滅。采用美國New York MCBE公司頭盔式多功能視頻眼動記錄(EMR)系統行眼球震顫檢查。校準后分別記錄右眼、左眼及雙眼注視水平和垂直0°、±5°、±10°、±15°、±20°目標時眼動軌跡。采用Dell’Osso /RW Hertle眼動波形分類進行波形分析[8]。
WES由北京福君基因生物科技有限公司完成。參考美國醫學遺傳學和基因組學學會(ACMG)對CACNA1F基因變異進行致病等級評估,同時結合貝葉斯框架(Bayesian framework)指南,剔除小于0分者。
2 結果
36例患者均為男性;年齡(6.69±5.26)(1~22)歲。患眼 logMAR BCVA為0.67±0.27;近視14例(38.89%,14/36),等效球鏡度(?3.01±4.84)D。CSNB2A、AIED、CORDX3分別為10、8、18例。
WES結果顯示,共發現36個不同核苷酸序列變異。其中,致病性7例(例序1、6、8、12、27、31、34);可疑致病性14例(例序5、7、11、14、17、18、19、20、22、25、28、29、33、35);致病性不明15例(例序2、3、4、9、10、13、15、16、21、23、24、26、30、32、36)(表1)。
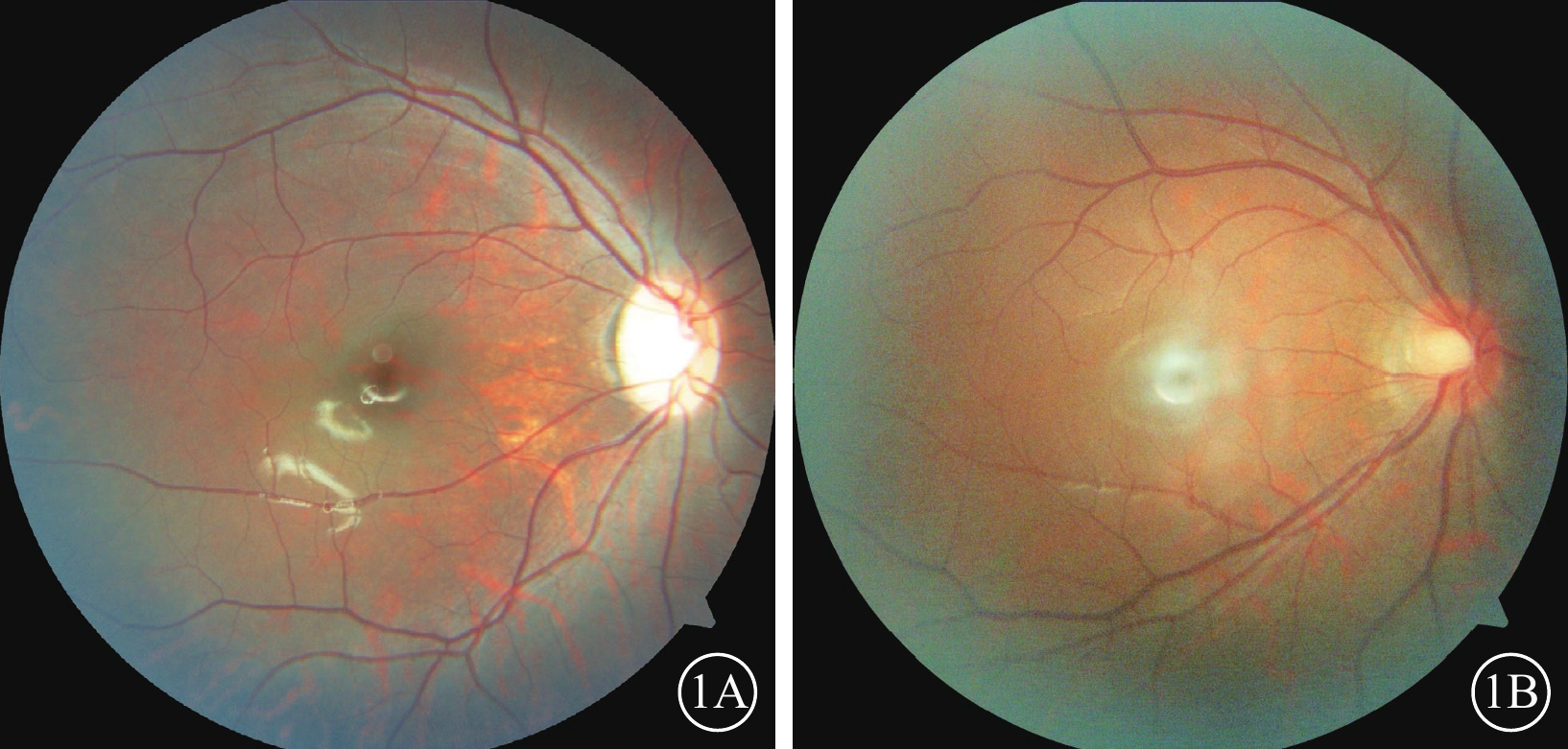
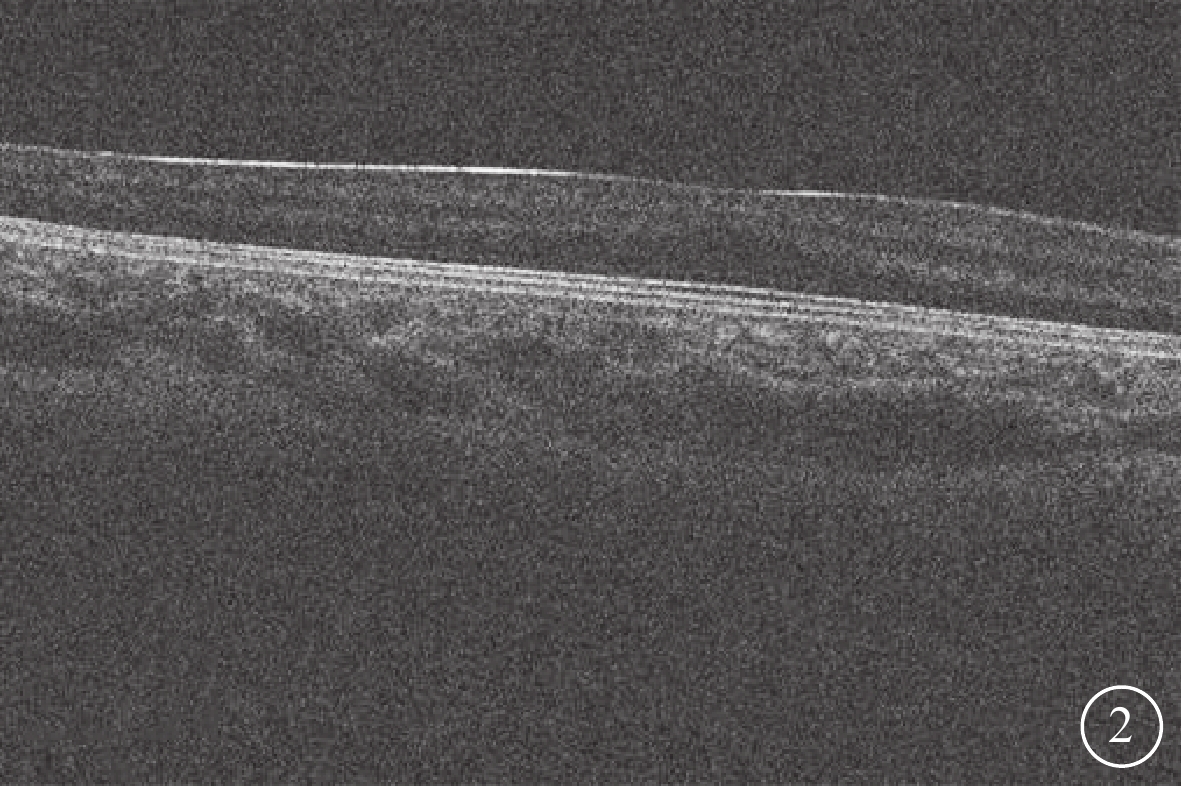
36例患者中,視神經萎縮(圖1A)26例(72.22%,26/36);視神經發育不良(圖1B)6例(16.67%,6/36);眼底色素發育不良伴輕度虹膜透照4例(11.11%,4/36)。OCT檢查,FH1級 (圖2)5例(13.89%,5/36)。
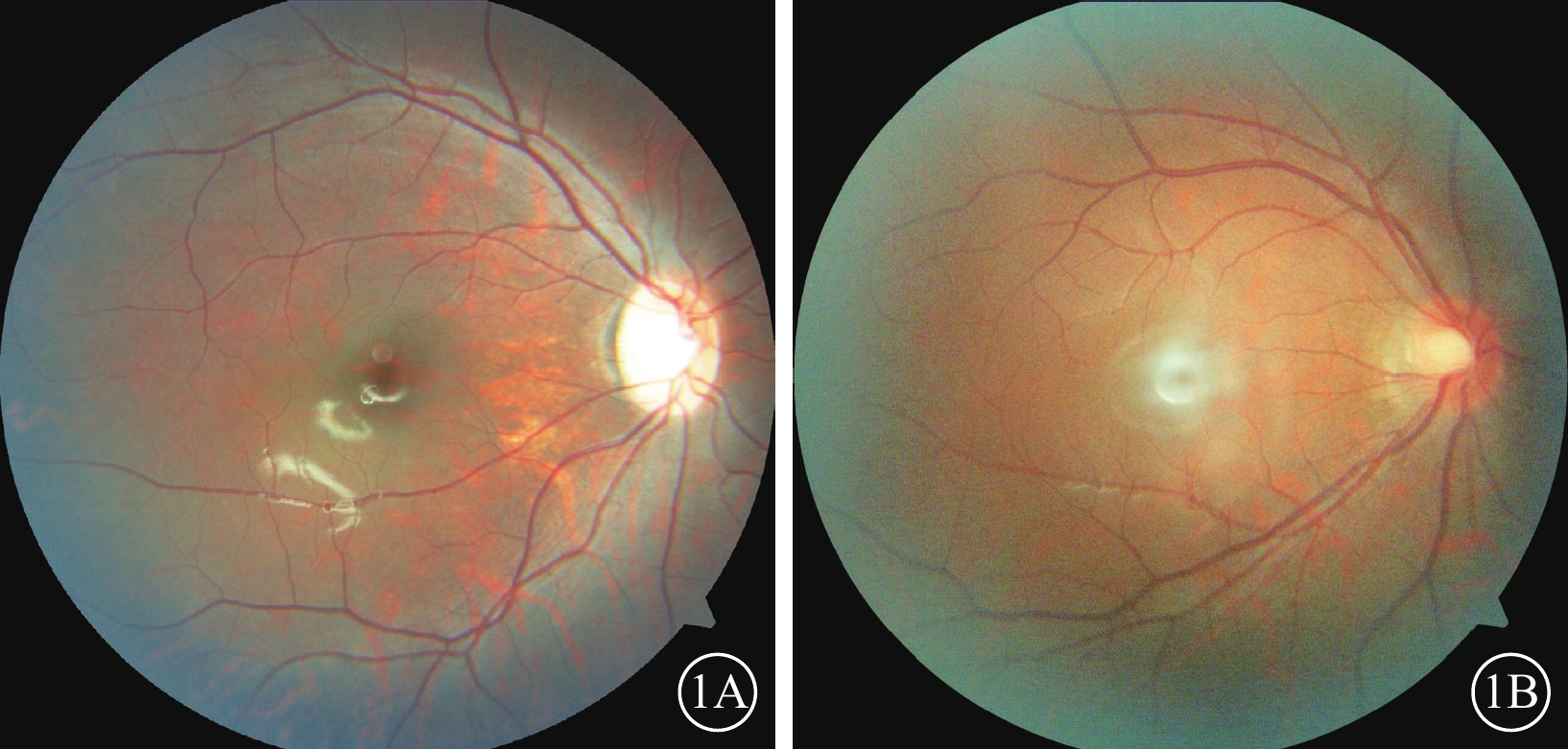 圖1
CACNA1F基因變異相關眼病患者彩色眼底像
圖1
CACNA1F基因變異相關眼病患者彩色眼底像
1A示視神經萎縮,視盤顏色淡,血管稍細;1B示視神經發育不全,視盤約正常視盤的1/2大小,顳側缺損
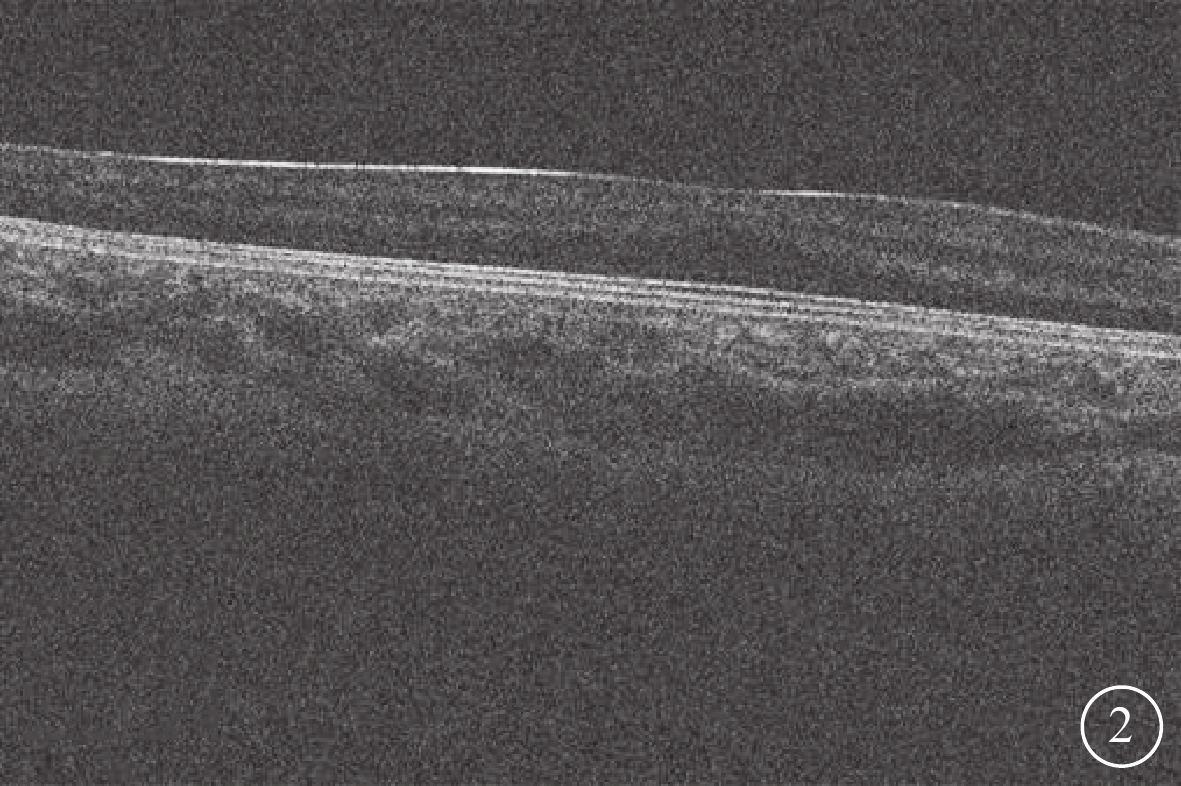 圖2
CACNA1F基因變異相關眼病患者黃斑光相干斷層掃描像
圖2
CACNA1F基因變異相關眼病患者黃斑光相干斷層掃描像
中心凹發育不全1級(Thomas分級),可見其中心凹變淺,叢狀層入侵
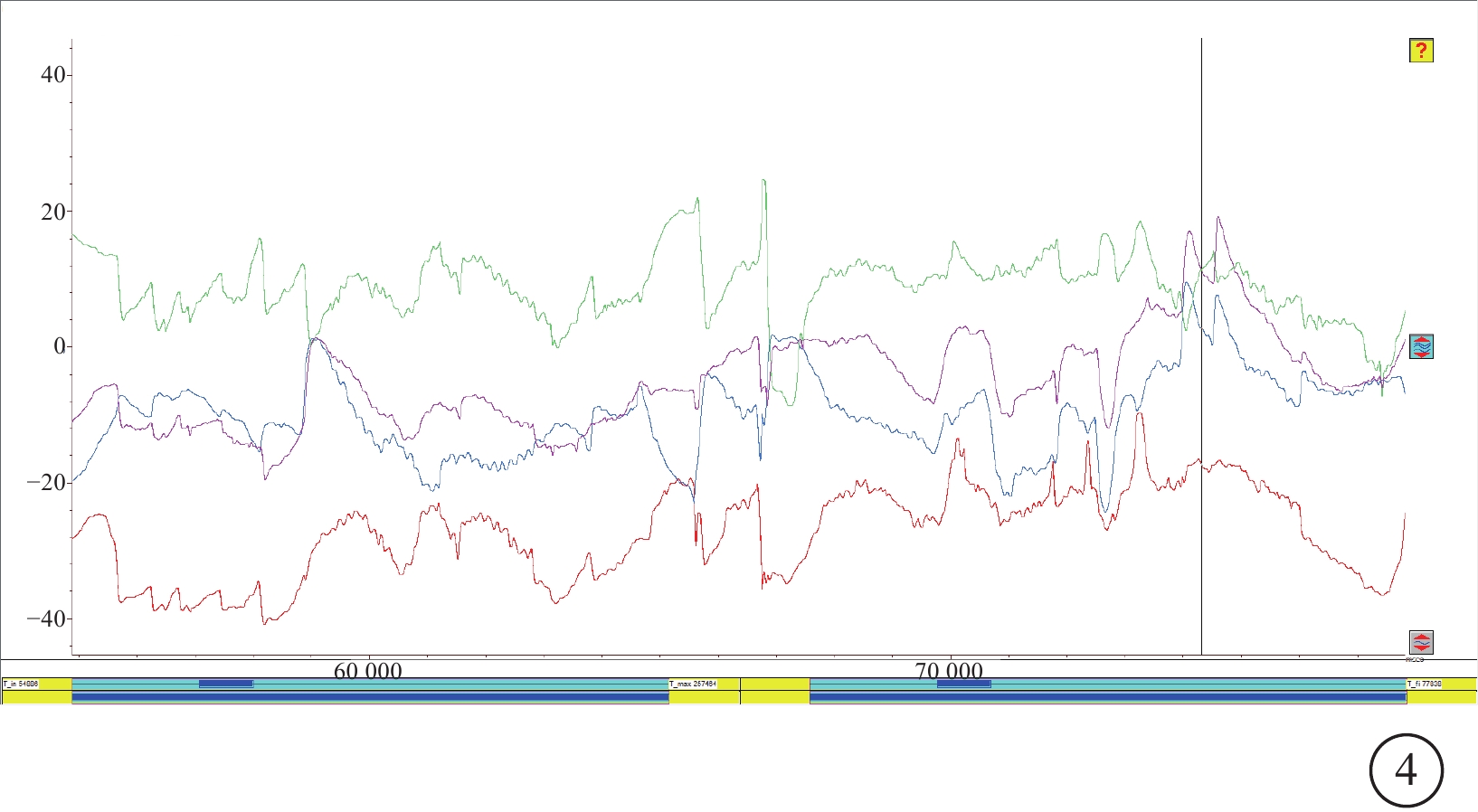
全視野ERG檢查,患眼均為Schubert-Bornschein波型,暗適應最大混合反應b波降低呈負波形,振蕩電位(Ops)振幅嚴重降低。其中,殘存型10例(27.78%,10/36)(圖3);明適下降為主型8例(22.22%,8/36);全熄滅型18例(50.00%,18/36)。
 圖3
CACNA1F基因變異相關眼病患者全視野視網膜電圖
圖3
CACNA1F基因變異相關眼病患者全視野視網膜電圖
左圖為右眼,右圖為左眼。3A、3B示暗適應閃光0.01;3C、3D示暗適應閃光3.0;3E、3F示振蕩電位;3G、3H示明適應閃光0.01;3I、3J示明適應閃光3.0。殘存型(3A、3C、3E、3G、3I)雙眼可記錄到暗適應0.01殘存波,振蕩電位有振蕩小波丟失,明適應3.0殘存,30 Hz反應下降呈寬大雙峰波型;明適應下降為主型(3B、3D、3F、3H、3J)ERG暗適應0.01中度降低,振蕩電位有振蕩小波丟失,明適反應熄滅型
EMR結果顯示,36例患者中,低振幅高頻率鐘擺(PLAHF)眼球震顫32例(88.89%,32/36)(圖4),其中伴晃頭、下頜上抬頭位分別為27(75.00%,27/36)、26(72.22%,26/36)例。
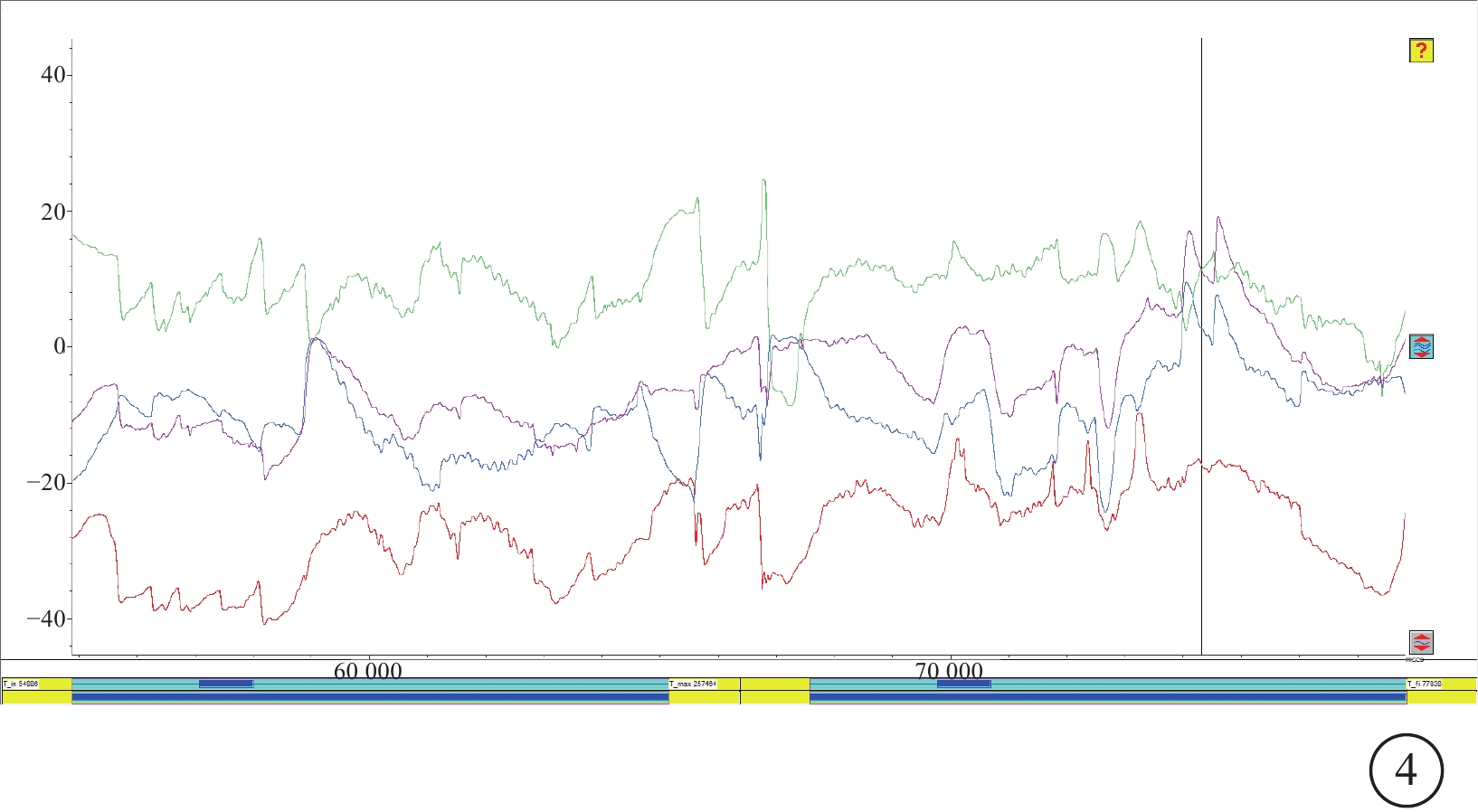 圖4
CACNA1F基因變異相關眼病患者低振幅高頻率鐘擺眼球震顫波形
圖4
CACNA1F基因變異相關眼病患者低振幅高頻率鐘擺眼球震顫波形
3 討論
CACNA1F基因由48個外顯子組成編碼一個多肽,形成l型電壓門控鈣通道1F亞基,通過開關途徑維持從光感受器到雙極細胞的鈣依賴性谷氨酸釋放;基因變異可導致CSNB2A、AIED、CORDX3,其臨床表型廣泛重疊,且不能用基因蛋白質功能進行解釋[5]。Boycott等[6]報道66例患者有3166-3167 insC突變,但72%的患者缺乏CSNB2A的主要特征,眼部表型在家庭成員之間存在較大差異。另有發現CSNB2A和AIED在一個家族中表型共存[9]。因此,明確表型多樣性機制,有助于提高臨床診斷率。
CACNA1F基因變異小鼠視網膜免疫組織化學染色顯示,光感受器突觸帶在沒有Ca2+釋放下無法成熟,使得光感受器到雙極細胞的信號傳遞受阻。免疫熒光染色發現Cav1.4主要定位于外叢狀層(OPL)的光感受器突觸,少量定位于內叢狀層和外核層(ONL)[10-12]。CACNA1F基因變異鼠視網膜發育、形態和功能將發生一系列變化:(1)異常的Cav1.4通道將影響光感受器細胞向雙極細胞的突觸傳導,而且影響視網膜一級突觸結構的成熟[13];(2)異常的突觸發芽延伸到OPL并進入ONL,導致視錐細胞變性[13],這可以解釋臨床上部分患者光感受器細胞功能出現進行性下降(AIED和CORDX3);(3)突觸缺陷發生在胚胎或者出生早期,會影響視錐細胞發育和移行,表現為ONL變短[14]和FH;(4)視網膜發育早期光感受器細胞成熟分化不良,可繼發雙極和(或)神經節細胞數量減少[15],從而出現視網膜變薄,視神經萎縮或發育不良。本組36例患者中FH1級者5例,黃斑周圍視網膜厚度變薄26例,視神經發育異常30例,也提示CACNA1F基因變異可影響視錐細胞早期分化移行及其后期發育成熟。但在各種小鼠模型主要表現為OPL突觸異常和ONL變薄,視網膜內層無明顯變化[16-17]。所以,視網膜內部變化可能是人類表型所獨有的,視網膜結構分化存在種族差異。
ERG也呈現出復雜多變的表型:(1)最典型特征是不完全Schubert-Bornschein波型,b波較a波降低為負波形,提示雙極細胞通路受損;(2)明適應3.0反應下降甚至熄滅,d波消失(off通道受累)[18],30 Hz閃爍反應降低呈雙波或全熄滅。這提示視錐細胞本身及其on-off通路都可能受累;(3)Ops部分振幅丟失,表示無長突細胞和水平細胞功能異常。本組患者ERG表現為殘存型者10例,表現為明暗適反應下降但不完全消失;明適下降為主型8例,表現為明適應嚴重下降,但可殘留暗適反應;全熄滅型18例,表現為明暗適應全部熄滅。以上提示基因突變相關位置及影響通道[19],可能是決定多樣表型的基礎。所以,OCT和ERG可以幫助臨床更好進行分類。
CACNA1F基因變異相關眼病通常伴有PHFLA眼球震顫。有學者認為鐘擺型眼球震顫是由于平滑追隨系統(PSN)或眼感覺系統缺陷使得視網膜到視束核的反饋回路出現增益延遲所致,延遲超過100 ms會引起眼球振蕩反饋運動以維持視覺穩定;延遲480 ms會產生疊加高頻振蕩;更嚴重的延遲會導致高頻低幅振蕩[20]。 Simonsz等[21]、Winkelman等[22]通過多電極陣列技術和單細胞電位記錄,證實了基因缺陷小鼠視網膜神經節細胞出現的源發于無長突細胞的自發Ops,是引起與之同步的鐘擺型眼球震顫的真正機制,導致了皮質下視動通路與皮質中央凹追蹤系統的相互聯系中斷[23]。本研究團隊將這種特殊類型的眼球震顫命名為PLAHF,在先天遺傳性視網膜疾病如 CSNB2A、全色盲、藍錐細胞單色視、家族性滲出性玻璃體視網膜病變中常常出現[24]。
CACNA1F基因變異相關眼病患者常常出現下頜上抬頭位,機制尚不明確。Simonsz等[21]認為可能是由于視網膜方向選擇性神經節細胞發育異常,導致向下刺激的視動性眼球震顫增益高于正常水平,而出現代償性下頜上抬頭位以穩定注視。另外,本組66.67%的患者(28/36)患者伴有晃頭,也可能是一種代償而非病理機制。
本研究結果表明,OCT和ERG檢查能幫助臨床診斷和評估CACNA1F相關眼病,其臨床表型可能與突變分布位置和視網膜各層受累程度有關;但這一推測需要更多動物模型研究來進一步證實。
CACNA1F基因位于人類染色體Xp11.23,編碼Cav1.4離子通道的α1F亞基。α1F亞基缺失,可使光感受器細胞帶狀突觸數量、形態以及功能發生異常,從而引發光感受器細胞與二級神經元之間視覺信號傳導障礙。目前已發現其有超過60個位點變異,引起先天性靜止夜盲2A型(CSNB2A)Aland Island眼病(AIED)、視錐視桿細胞營養不良3型(CORDX3)等3種不同表型的遺傳性視網膜變性性疾病[1-3]。三種疾病具有不同的預后和進展風險,臨床上明確亞型分類診斷非常重要。但三者具有較多共同臨床特征,如視力下降、色覺缺陷、近視、眼球震顫、視網膜和視神經發育異常、視網膜電圖(ERG)負波形等[4-6],而目前臨床尚無明確鑒別診斷標準。我們回顧分析了一組CACNA1F基因變異相關眼病的臨床特征,以期為臨床鑒別提供更多的診斷依據。現將結果報道如下。
1 對象和方法
回顧性臨床研究。經長沙愛爾眼科醫院倫理委員會審批(批文號:2021IRB036)。
2022年1月1日至2023年10月1日于長沙愛爾眼科醫院和濟南普瑞眼科醫院臨床、基因檢測確診的CACNA1F基因變異相關眼病患者36例納入本研究。參照文獻[4-6]確立CSNB2A、AIED、CORDX3的診斷標準。
患者均行最佳矯正視力(BCVA)、醫學驗光、眼底彩色照相、光相干斷層掃描(OCT)、全視野ERG、眼球震顫檢查以及基因全外顯子測序(WES)。
采用早期糖尿病視網膜病變治療研究兩用對數視力表行BCVA檢查,應用+4~6 D鏡片作單眼遮蓋,記錄時轉換為最小分辨角對數(logMAR)視力。采用德國Carl Zeiss公司CLARUS 500超廣角眼底照相機行眼底彩色照相檢查。采用日本Topcon公司3D OCT-2000儀行OCT檢查,并參照文獻[7]的標準進行中心凹發育不全(FH)分級(Thomas分級)。采用美國LKC公司RETeval眼電理儀行全視野ERG檢查。遵循ISCEV(2019)標準,20 min暗適應后記錄視桿細胞反應和最大混合反應;10 min明適應后記錄單次閃光視錐反應和30 Hz閃爍光反應。Schubert-Bornschein波型:暗適應最大混合反應呈負波形,b波小于a波。殘存型:殘存暗適應0.01反應波和明適應3.0反應波,30 Hz反應下降呈雙峰寬波; 明適下降為主型:明適應全熄滅,殘存暗適應反應波;全熄滅型:明適應暗適應全熄滅。采用美國New York MCBE公司頭盔式多功能視頻眼動記錄(EMR)系統行眼球震顫檢查。校準后分別記錄右眼、左眼及雙眼注視水平和垂直0°、±5°、±10°、±15°、±20°目標時眼動軌跡。采用Dell’Osso /RW Hertle眼動波形分類進行波形分析[8]。
WES由北京福君基因生物科技有限公司完成。參考美國醫學遺傳學和基因組學學會(ACMG)對CACNA1F基因變異進行致病等級評估,同時結合貝葉斯框架(Bayesian framework)指南,剔除小于0分者。
2 結果
36例患者均為男性;年齡(6.69±5.26)(1~22)歲。患眼 logMAR BCVA為0.67±0.27;近視14例(38.89%,14/36),等效球鏡度(?3.01±4.84)D。CSNB2A、AIED、CORDX3分別為10、8、18例。
WES結果顯示,共發現36個不同核苷酸序列變異。其中,致病性7例(例序1、6、8、12、27、31、34);可疑致病性14例(例序5、7、11、14、17、18、19、20、22、25、28、29、33、35);致病性不明15例(例序2、3、4、9、10、13、15、16、21、23、24、26、30、32、36)(表1)。
36例患者中,視神經萎縮(圖1A)26例(72.22%,26/36);視神經發育不良(圖1B)6例(16.67%,6/36);眼底色素發育不良伴輕度虹膜透照4例(11.11%,4/36)。OCT檢查,FH1級 (圖2)5例(13.89%,5/36)。
 圖1
CACNA1F基因變異相關眼病患者彩色眼底像
圖1
CACNA1F基因變異相關眼病患者彩色眼底像
1A示視神經萎縮,視盤顏色淡,血管稍細;1B示視神經發育不全,視盤約正常視盤的1/2大小,顳側缺損
 圖2
CACNA1F基因變異相關眼病患者黃斑光相干斷層掃描像
圖2
CACNA1F基因變異相關眼病患者黃斑光相干斷層掃描像
中心凹發育不全1級(Thomas分級),可見其中心凹變淺,叢狀層入侵
全視野ERG檢查,患眼均為Schubert-Bornschein波型,暗適應最大混合反應b波降低呈負波形,振蕩電位(Ops)振幅嚴重降低。其中,殘存型10例(27.78%,10/36)(圖3);明適下降為主型8例(22.22%,8/36);全熄滅型18例(50.00%,18/36)。
 圖3
CACNA1F基因變異相關眼病患者全視野視網膜電圖
圖3
CACNA1F基因變異相關眼病患者全視野視網膜電圖
左圖為右眼,右圖為左眼。3A、3B示暗適應閃光0.01;3C、3D示暗適應閃光3.0;3E、3F示振蕩電位;3G、3H示明適應閃光0.01;3I、3J示明適應閃光3.0。殘存型(3A、3C、3E、3G、3I)雙眼可記錄到暗適應0.01殘存波,振蕩電位有振蕩小波丟失,明適應3.0殘存,30 Hz反應下降呈寬大雙峰波型;明適應下降為主型(3B、3D、3F、3H、3J)ERG暗適應0.01中度降低,振蕩電位有振蕩小波丟失,明適反應熄滅型
EMR結果顯示,36例患者中,低振幅高頻率鐘擺(PLAHF)眼球震顫32例(88.89%,32/36)(圖4),其中伴晃頭、下頜上抬頭位分別為27(75.00%,27/36)、26(72.22%,26/36)例。
 圖4
CACNA1F基因變異相關眼病患者低振幅高頻率鐘擺眼球震顫波形
圖4
CACNA1F基因變異相關眼病患者低振幅高頻率鐘擺眼球震顫波形
3 討論
CACNA1F基因由48個外顯子組成編碼一個多肽,形成l型電壓門控鈣通道1F亞基,通過開關途徑維持從光感受器到雙極細胞的鈣依賴性谷氨酸釋放;基因變異可導致CSNB2A、AIED、CORDX3,其臨床表型廣泛重疊,且不能用基因蛋白質功能進行解釋[5]。Boycott等[6]報道66例患者有3166-3167 insC突變,但72%的患者缺乏CSNB2A的主要特征,眼部表型在家庭成員之間存在較大差異。另有發現CSNB2A和AIED在一個家族中表型共存[9]。因此,明確表型多樣性機制,有助于提高臨床診斷率。
CACNA1F基因變異小鼠視網膜免疫組織化學染色顯示,光感受器突觸帶在沒有Ca2+釋放下無法成熟,使得光感受器到雙極細胞的信號傳遞受阻。免疫熒光染色發現Cav1.4主要定位于外叢狀層(OPL)的光感受器突觸,少量定位于內叢狀層和外核層(ONL)[10-12]。CACNA1F基因變異鼠視網膜發育、形態和功能將發生一系列變化:(1)異常的Cav1.4通道將影響光感受器細胞向雙極細胞的突觸傳導,而且影響視網膜一級突觸結構的成熟[13];(2)異常的突觸發芽延伸到OPL并進入ONL,導致視錐細胞變性[13],這可以解釋臨床上部分患者光感受器細胞功能出現進行性下降(AIED和CORDX3);(3)突觸缺陷發生在胚胎或者出生早期,會影響視錐細胞發育和移行,表現為ONL變短[14]和FH;(4)視網膜發育早期光感受器細胞成熟分化不良,可繼發雙極和(或)神經節細胞數量減少[15],從而出現視網膜變薄,視神經萎縮或發育不良。本組36例患者中FH1級者5例,黃斑周圍視網膜厚度變薄26例,視神經發育異常30例,也提示CACNA1F基因變異可影響視錐細胞早期分化移行及其后期發育成熟。但在各種小鼠模型主要表現為OPL突觸異常和ONL變薄,視網膜內層無明顯變化[16-17]。所以,視網膜內部變化可能是人類表型所獨有的,視網膜結構分化存在種族差異。
ERG也呈現出復雜多變的表型:(1)最典型特征是不完全Schubert-Bornschein波型,b波較a波降低為負波形,提示雙極細胞通路受損;(2)明適應3.0反應下降甚至熄滅,d波消失(off通道受累)[18],30 Hz閃爍反應降低呈雙波或全熄滅。這提示視錐細胞本身及其on-off通路都可能受累;(3)Ops部分振幅丟失,表示無長突細胞和水平細胞功能異常。本組患者ERG表現為殘存型者10例,表現為明暗適反應下降但不完全消失;明適下降為主型8例,表現為明適應嚴重下降,但可殘留暗適反應;全熄滅型18例,表現為明暗適應全部熄滅。以上提示基因突變相關位置及影響通道[19],可能是決定多樣表型的基礎。所以,OCT和ERG可以幫助臨床更好進行分類。
CACNA1F基因變異相關眼病通常伴有PHFLA眼球震顫。有學者認為鐘擺型眼球震顫是由于平滑追隨系統(PSN)或眼感覺系統缺陷使得視網膜到視束核的反饋回路出現增益延遲所致,延遲超過100 ms會引起眼球振蕩反饋運動以維持視覺穩定;延遲480 ms會產生疊加高頻振蕩;更嚴重的延遲會導致高頻低幅振蕩[20]。 Simonsz等[21]、Winkelman等[22]通過多電極陣列技術和單細胞電位記錄,證實了基因缺陷小鼠視網膜神經節細胞出現的源發于無長突細胞的自發Ops,是引起與之同步的鐘擺型眼球震顫的真正機制,導致了皮質下視動通路與皮質中央凹追蹤系統的相互聯系中斷[23]。本研究團隊將這種特殊類型的眼球震顫命名為PLAHF,在先天遺傳性視網膜疾病如 CSNB2A、全色盲、藍錐細胞單色視、家族性滲出性玻璃體視網膜病變中常常出現[24]。
CACNA1F基因變異相關眼病患者常常出現下頜上抬頭位,機制尚不明確。Simonsz等[21]認為可能是由于視網膜方向選擇性神經節細胞發育異常,導致向下刺激的視動性眼球震顫增益高于正常水平,而出現代償性下頜上抬頭位以穩定注視。另外,本組66.67%的患者(28/36)患者伴有晃頭,也可能是一種代償而非病理機制。
本研究結果表明,OCT和ERG檢查能幫助臨床診斷和評估CACNA1F相關眼病,其臨床表型可能與突變分布位置和視網膜各層受累程度有關;但這一推測需要更多動物模型研究來進一步證實。