引用本文: 趙騫, 周雋, 王程隆, 孫可洋, 蘇旭玲, 劉志艷. RAS突變型甲狀腺腫瘤的臨床病理特征:單中心分析. 中國普外基礎與臨床雜志, 2024, 31(11): 1307-1312. doi: 10.7507/1007-9424.202410021 復制
甲狀腺上皮源性腫瘤包括C細胞源性甲狀腺髓樣癌(medullary thyroid carcinoma,MTC)和甲狀腺濾泡源性腫瘤,其中前者罕見,后者最多見。甲狀腺濾泡源性腫瘤又分類為良性、低風險及惡性腫瘤,其中惡性腫瘤分為甲狀腺濾泡癌(follicular thyroid carcinoma,FTC)、浸潤性包裹性濾泡亞型甲狀腺乳頭狀癌(invasive encapsulated follicular variant of papillary thyroid carcinoma,IEFVPTC)、甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)、甲狀腺嗜酸細胞癌(oncocytic thyroid carcinoma,OCA)、高級別分化型甲狀腺癌(differentiated high grade thyroid carcinoma,DHGTC)、低分化甲狀腺癌(poorly differentiated thyroid carcinoma,PDTC)和甲狀腺間變性癌(anaplastic thyroid carcinoma,ATC)[1-3]。根據甲狀腺濾泡源性腫瘤的分子特征,又可分為BRAF樣和RAS樣腫瘤,前者多具有明顯組織結構異型性,為中分化腫瘤;后者多以濾泡結構為主,為高分化腫瘤,通常預后較好[3-4]。本研究擬對單中心RAS突變型甲狀腺腫瘤的臨床病理特征進行分析并探討二者的關系,為臨床精準治療和預后評估提供依據。
1 資料與方法
1.1 研究對象
回顧性收集2021年1月至2023年6月期間在上海交通大學醫學院附屬第六人民醫院(簡稱“我院”)診治的經活檢或術后組織學病理確診的甲狀腺腫瘤患者的臨床病理資料。患者納入條件:① 原發病為甲狀腺腫瘤;② 行八基因檢測;③ 臨床病理數據完整。本研究經我院倫理委員會審批通過,患者均知情同意。
1.2 方法
① 組織病理形態學觀察:常規蘇木精-伊紅(hematoxylin-eosin,HE)染色切片由兩位高年資病理醫師采用雙盲法、參照世界衛生組織(第5版)和第8版美國癌癥聯合委員會指南對腫瘤進行診斷并分期[1, 3]。② 分子檢測:采用上海睿璟生物科技有限公司的甲狀腺癌八基因檢測試劑盒,以實時熒光定量PCR法檢測BRAFV600E、TERT、KRAS、NRAS、HRAS、CCDC6-RET、PAX8-PPARγ及ETV6-NTRK3基因融合。
1.3 統計學方法
使用SPSS 27.0軟件進行統計學分析。計數資料采用頻數和百分率(%)描述,組間比較采用χ2檢驗,檢驗水準α=0.05。組間兩兩比較采用卡方分割法(檢驗水準校正為α=0.001 1)。當數據不滿足χ2檢驗所需條件時,采用Fisher確切概率法。
2 結果
本研究共納入2021年1月至2023年6月期間符合納入標準的798例甲狀腺腫瘤患者,其中濾泡源性腫瘤747例,C細胞源性MTC 51例。798例甲狀腺腫瘤患者中有36例(4.5%)RAS基因突變。具體的病理類型及相應的RAS基因突變結果見表1。
2.1 36例RAS基因突變患者的臨床特征
36例RAS基因突變患者中女22例,男14例;年齡21~81歲,平均50歲(中位年齡48.5歲),≥55歲14例、<55歲22例;腫瘤最大徑0.15~7.50 cm、平均直徑2 cm,≤1 cm 14例、>1 cm 22例;TNM分期Ⅰ~Ⅱ期33例、Ⅲ~Ⅳ期3例;合并橋本甲狀腺炎3例,有血管侵犯9例,有淋巴管侵犯3例,有被膜侵犯9例,有甲狀腺腺外侵犯3例。有28例腫塊切面呈灰白色,4例呈灰黃色,4例質硬。
2.2 36例RAS基因突變患者的超聲表現
B超主要表現為甲狀腺實質內低回聲,甲狀腺癌多表現為不均質型回聲,聲像圖以實質性腫物為多見。低風險甲狀腺腫瘤均有完整包膜。20例惡性甲狀腺腫瘤界欠清,15例腫塊內血流豐富。
2.3 36例RAS基因突變患者的組織學亞型及其病理學特征
2.3.1 組織學亞型
甲狀腺濾泡源性腫瘤中惡性腫瘤26例,其中FTC 7例,PTC 15例 [包括4例濾泡亞型PTC(follicular variant of PTC, FVPTC),8例經典型PTC(classic PTC,CPTC)和3例高細胞亞型PTC(tall cell variant of papillary thyroid carcinoma,TCVPTC)],OCA 2例, DHGTC 1例,ATC 1例;低風險腫瘤8例,其中6例惡性潛能未定的甲狀腺高分化腫瘤(well-differentiated thyroid tumour of uncertain malignant potential,WT?UMP)和2例具有乳頭樣核特征的非浸潤性甲狀腺濾泡性腫瘤(noninvasive follicular thyroid neoplasm with papillary like nuclear features,NIFTP)。此外,MTC 2例。
2.3.2 不同組織學亞型的組織病理學特征
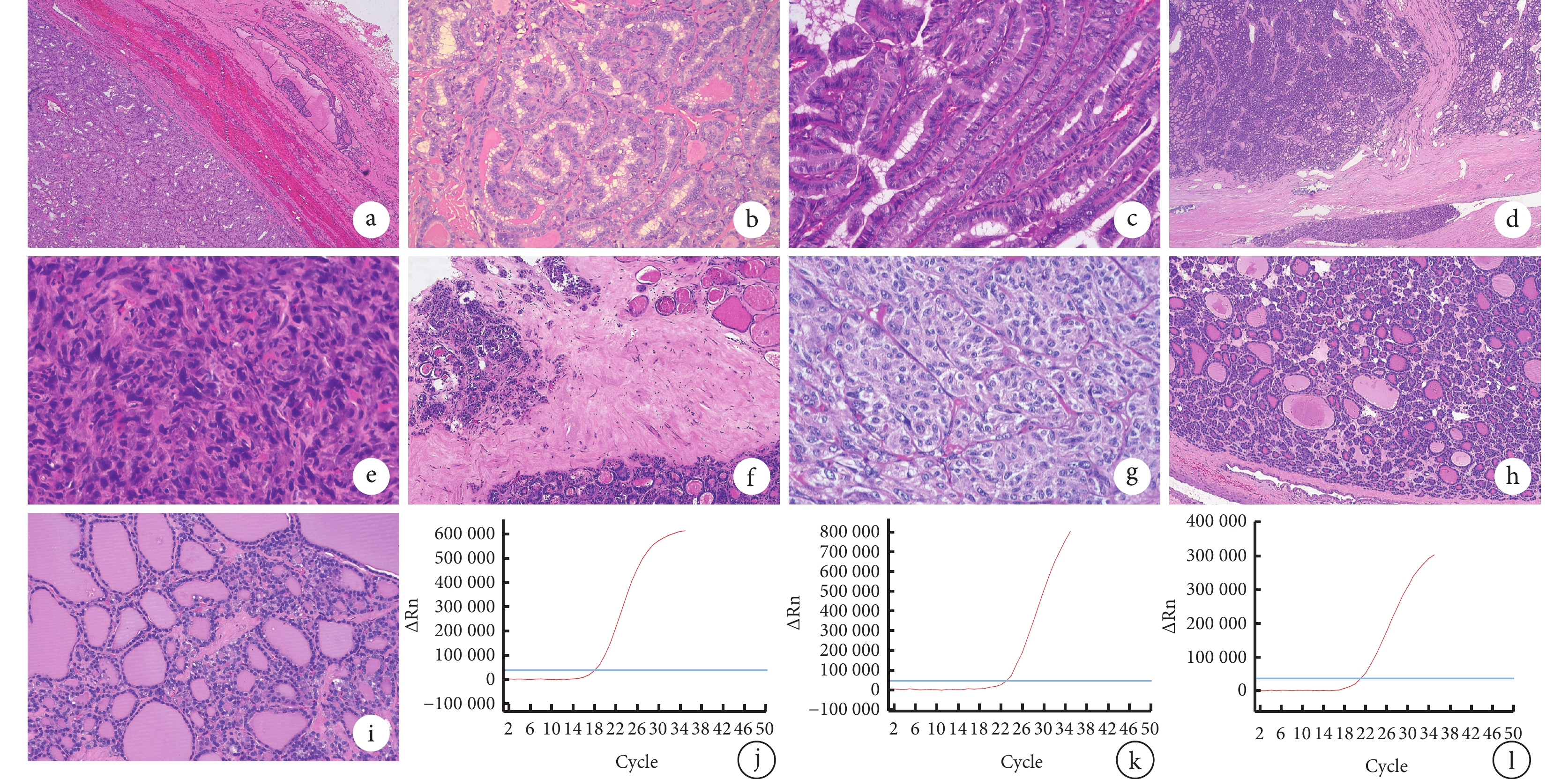
FVPTC的瘤體幾乎全部由濾泡構成,缺乏乳頭狀結構,但腫瘤細胞具有PTC細胞核特征(圖1a);CPTC可見真性乳頭及典型PTC細胞核特征(圖1b);TCVPTC的腫瘤細胞呈細長形,高是寬的2倍,具有典型PTC的細胞核特征(圖1c);FTC的瘤體呈濾泡結構,濾泡上皮異型明顯,包膜內見脈管浸潤(圖1d);ATC的腫瘤細胞呈多角型,胞質嗜酸或淡染,核仁明顯(圖1e);OCA的腫瘤細胞呈多邊形,具有豐富的嗜酸性顆粒性胞質,可見脈管浸潤(圖1f);MTC的腫瘤細胞核仁明顯,呈巢狀生長模式(圖1g);WT?UMP的濾泡細胞分化良好,有完整包膜(圖1h);NIFTP呈濾泡生長模式,無腫瘤性壞死及高核分裂象(圖1i)。
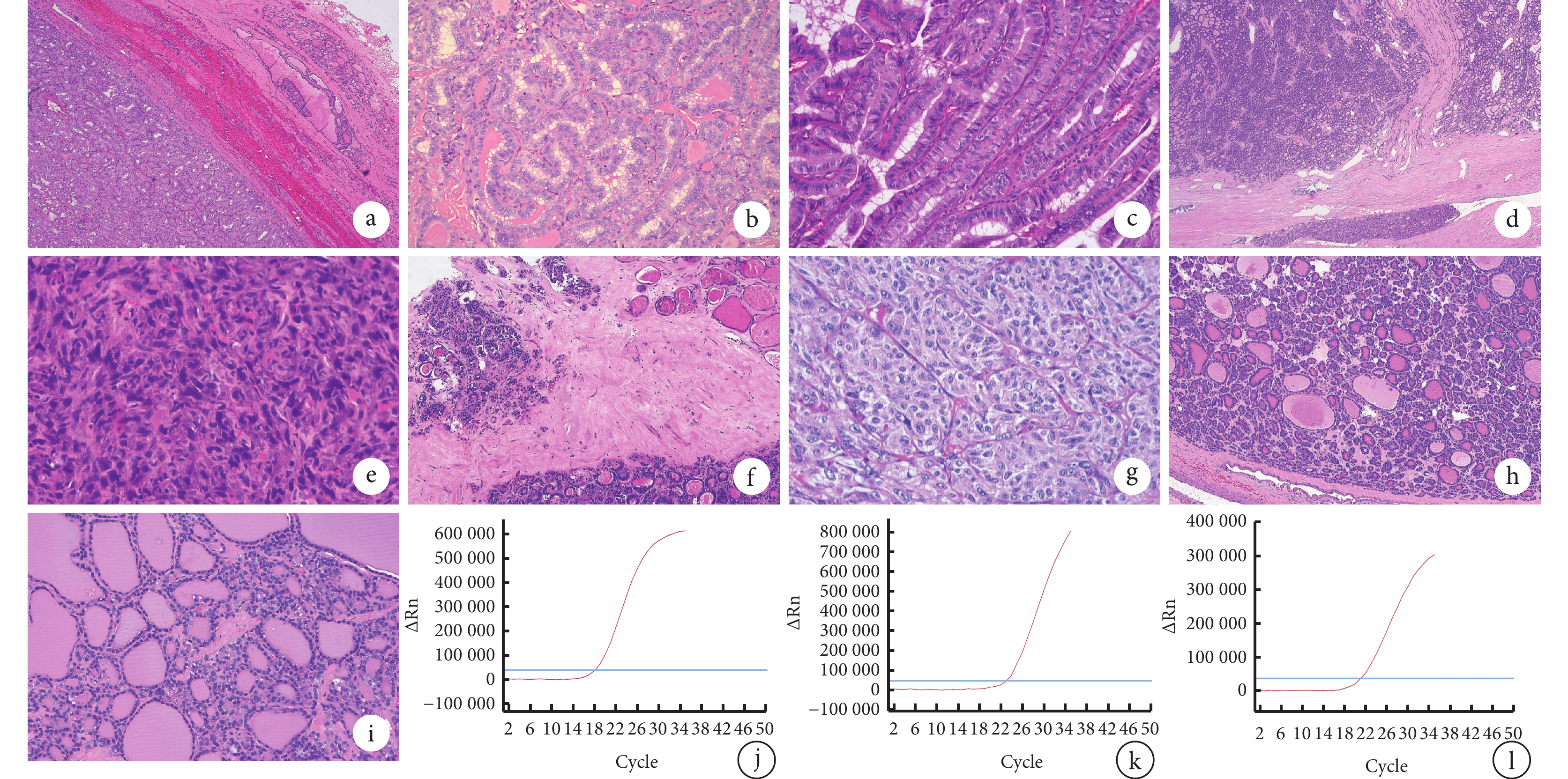 圖1
示甲狀腺上皮源性腫瘤各組織學亞型的組織學特征及其RAS突變
圖1
示甲狀腺上皮源性腫瘤各組織學亞型的組織學特征及其RAS突變
a:FVPTC(HE 染色 ×100);b:CPTC(HE 染色 ×200);c:TCVPTC(HE 染色 ×400);d:FTC(HE 染色 ×100);e:ATC(HE 染色 ×400);f:OCA(HE 染色 ×200);g:MTC(HE 染色 ×400);h:WT-UMP(HE 染色 ×200); i:NIFTP(HE 染色 ×200);j:NRAS EXON3 基因Q61R 位點突變;k:HRAS EXON3 基因 Q61R 位點突變;l:KRAS EXON3 基因 Q61R 位點突變
2.4 36例RAS基因突變患者的分子特征
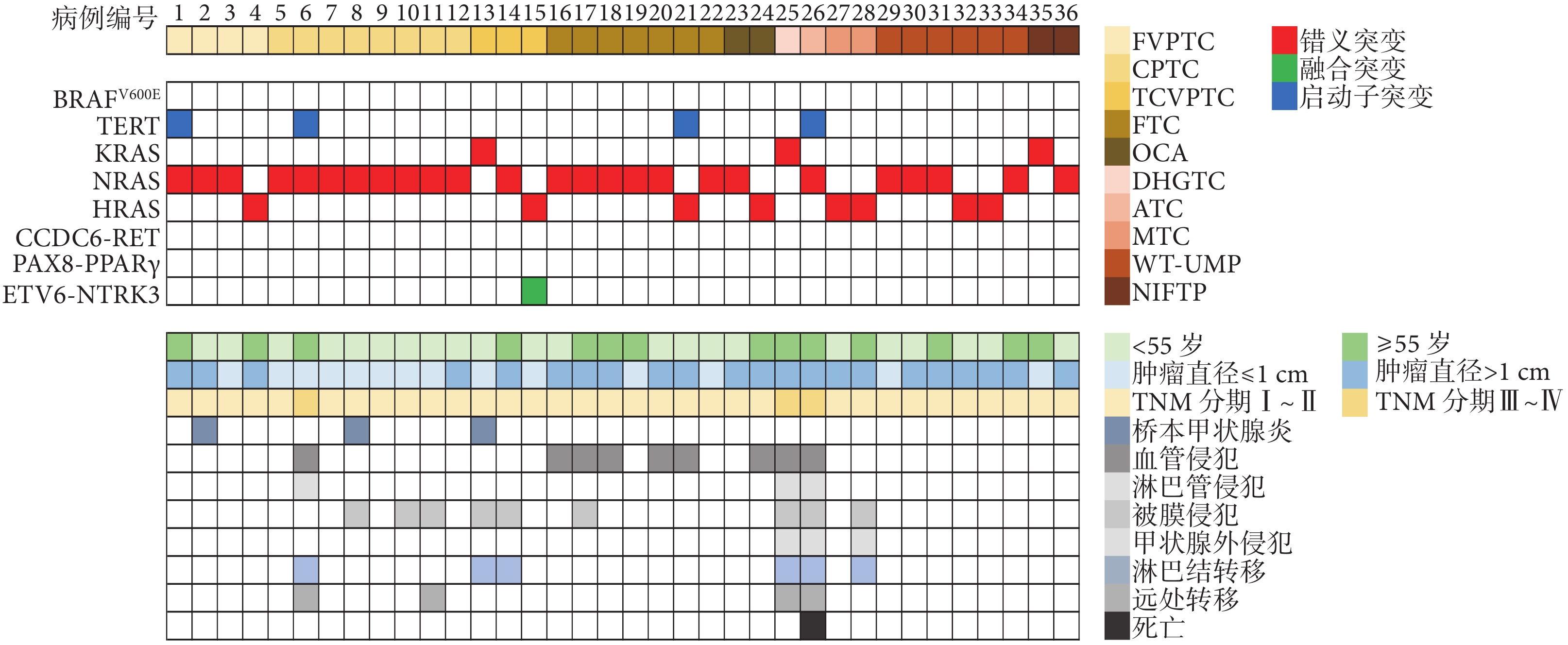
36例RAS基因突變型甲狀腺腫瘤中,NRAS突變25例(69.4%)、HRAS突變8例(22.2%)、KRAS突變3例(8.3%),均為61號密碼子突變(圖1j~1l)。4例合并TERT啟動子突變(分別為FVPTC、CPTC、FTC和ATC亞型),有2例合并BRAFV600E突變(分別為CPTC和TCVPTC),有1例合并ETV6-NTRK3突變(為TCVPTC),未見CCDC6-RET和PAX8-PPARγ突變,見圖2。10種組織病理亞型甲狀腺腫瘤組織中的RAS基因突變情況見表1。RAS基因突變率在10種組織亞型間總體比較差異有統計學意義(χ2=65.708,P<0.001),它在FTC中最高(25.9%)、在CPTC中最低(1.5%),其突變率從高到低依次是FTC、DHGTC、ATC、NIFTP、FVPTC及WT-UMP,其中在FTC、FVPTC及WT-UMP中均明顯高于CPTC(P<0.001 1)。
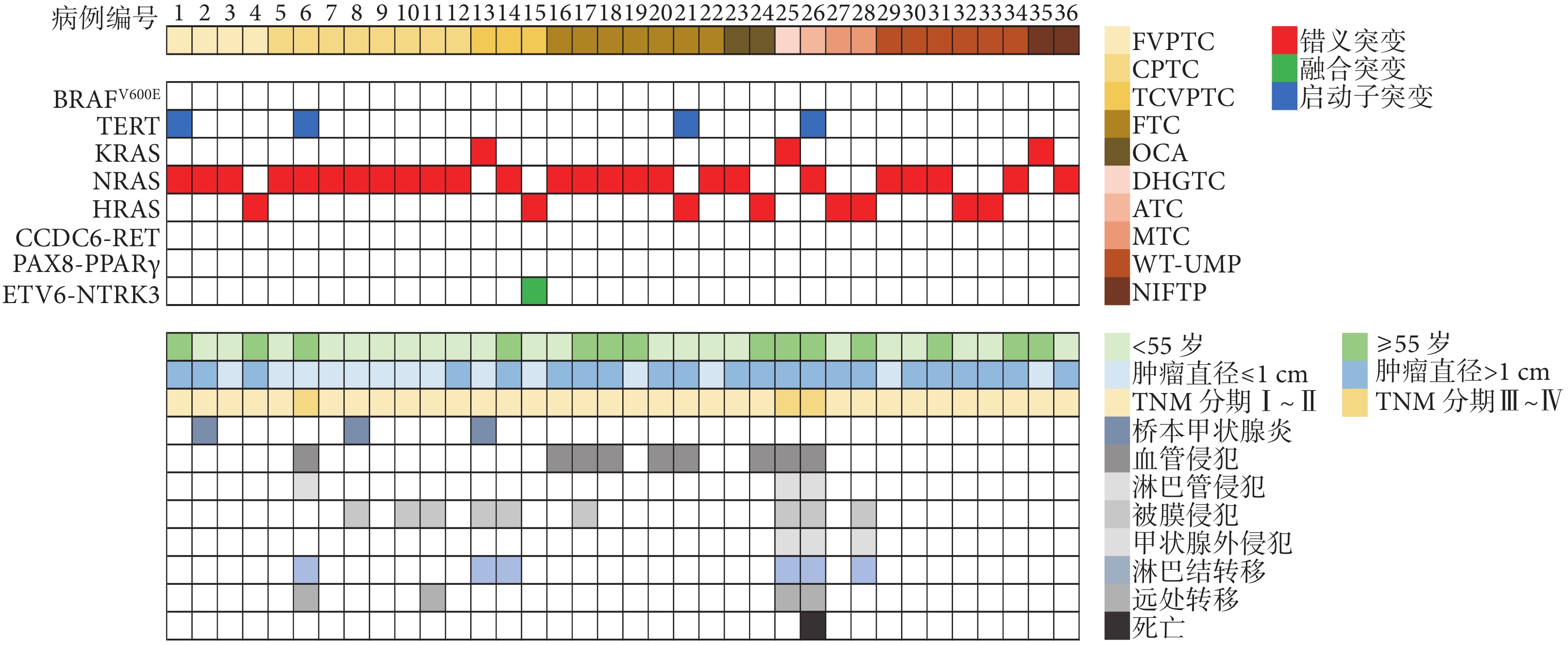 圖2
示36例RAS突變型甲狀腺腫瘤的分子特征及臨床病理特征
圖2
示36例RAS突變型甲狀腺腫瘤的分子特征及臨床病理特征
2.5 隨訪結果
35例患者行甲狀腺切除手術,1例患者僅行穿刺活檢;1例患者術后行碘-131治療;1例患者術后行靶向治療。術后采用電話隨訪,有效隨訪35例患者,1例失訪,平均隨訪時間21.4個月(中位時間18.5個月)。截至2024年3月,有6例患者發現頸部淋巴結轉移,4例患者發生遠處轉移(腓骨1例、椎體2例和肺部1例)。1例患者(為ATC)死亡。
3 討論
甲狀腺腫瘤為最常見的內分泌系統腫瘤,盡管大多數患者預后良好,但仍有部分腫瘤的侵襲性強,復發風險高,甚至導致患者死亡[5]。第5版世界衛生組織甲狀腺腫瘤分類結合腫瘤形態特征、突變和轉錄組學特征提出RAS樣和BRAF樣腫瘤,凸顯腫瘤分子特征與臨床生物學行為之間的相關性[1]。
RAS基因突變可見于所有類型甲狀腺濾泡源性腫瘤,包括甲狀腺濾泡腺瘤(20%~25%)、FTC(40%~50%)、FVPTC(30%~45%)、PDTC(20%~40%)、ATC(10%~20%)等[6-9]。本研究中,FTC中RAS基因突變率最高(25.9%),其次為DHGTC(20.0%)、ATC(20.0%)、NIFTP(18.2%)、FVPTC(16.0%)及WT-UMP(12.8%),較已有文獻報道略低,可能與不同檢測方法有關。本研究所采用的實時熒光定量PCR法,主要針對Q61R特定位點進行檢測;而已有文獻報道中多采用Sanger測序法和二代測序法,可發現更多少見位點。RAS基因突變率在10種甲狀腺腫瘤組織亞型間總體比較差異有統計學意義(χ2=65.708,P<0.001),它在FTC、DHGTC、ATC、NIFTP、FVPTC及WT-UMP這幾種亞型中均較高,其中在FTC、FVPTC和WT-UMP中均高于CPTC(P均<0.001 1),在FTC中最高(25.9%),在CPTC中最低(1.5%)。以上結果表明,RAS基因突變主要見于以濾泡結構為主的腫瘤,在乳頭狀結構突出的腫瘤中相對少見。
TCGA研究[10-11]表明,90%的PTC是由絲裂原活化蛋白激酶通路激活引起,而這種激活是通過BRAF或RAS癌基因的互斥突變發生。本研究中,病例8和病例14均發現BRAFV600E和NRAS共突變,提示少見情況下兩者可同時發生[12-15]。本研究36例RAS基因突變型腫瘤中具有典型乳頭狀結構的PTC共11例(30.6%),包括8例CPTC和3例TCVPTC,另有4例FVPTC。FVPTC的RAS基因突變率高于CPTC(16.0%比1.5%,P<0.001 1)。以上結果表明,RAS基因突變多見于不具有乳頭狀結構的腫瘤,尤其是FTC,與文獻[16-18]報道一致。
OCA分子特征為染色體廣泛丟失引發近全基因組單倍體化,伴或不伴BRAF和RAS的低頻突變[19-20]。RAS基因突變在OCA中僅占10%~15%[21-22]。本研究中25例OCA患者中有2例(8.0%)發生了RAS基因突變。
DHGTC為第5版世界衛生組織新提出的組織學亞型,罕見相關報道,通常表現為BRAF、RAS或少數基因融合等早期驅動基因變異之外,再攜帶繼發侵襲性突變,最常見的是TERT啟動子、少數PIK3CA和TP53等后期分子事件[23]。本研究5例(0.6%)DHGTC中1例表現為KRAS單基因突變。
ATC是一種罕見的高度侵襲性惡性腫瘤,約占甲狀腺癌的1%~2%[24]。進展迅速,預后極差,多數患者在1年內死亡;除局部浸潤外,還常伴局部淋巴結或遠處轉移。Landa等[23]發現BRAF基因突變ATC主要表現為局灶淋巴結轉移,而RAS基因突變ATC主要表現為遠處轉移。本研究中5例(0.6%)ATC患者中僅1例發生RAS基因突變,但它合并TERT基因啟動子突變(C250T),穿刺確診后于第3個月死于肺轉移。
甲狀腺濾泡源性腫瘤中的低風險腫瘤(NIFTP和WT-UMP)為RAS樣腫瘤,亞洲國家NIFTP診斷率(0.3%~5.0%)遠低于西方國家(15%~20%)[25]。本研究中11例(1.4%)NIFTP中有2例(18.2%)發生了RAS基因突變,47例WT-UMP中6例(12.8%)發生了RAS基因突變 [高于CPTC(P<0.001 1)],均低于文獻報道的RAS基因突變率(20%~40%)[1, 9],分析其原因可能與地域或檢測方法有關。
MTC中主要驅動基因異常為RET基因體細胞突變,其次是RAS基因突變(10%)[26]。本組病例51例MTC患者中僅2例(3.9%)發生了RAS基因突變,低于文獻[26]報道,尚需積累更多病例進一步驗證。
TERT啟動子突變在局部晚期和侵襲性甲狀腺癌中常見,最常見熱點突變為C228T和C250T,前者更為常見[20],該突變與甲狀腺癌侵襲性、腫瘤進展和去分化顯著相關[27]。在本研究中,有4例RAS突變型甲狀腺腫瘤(分別為FVPTC、CPTC、FTC和ATC)合并TERT啟動子突變,其中2例患者(1例CPTC和1例ATC)同時發生淋巴結轉移和遠處轉移,而且該例ATC患者死亡。有文獻[28]報道,RAS基因突變甲狀腺腫瘤更常表現出血行擴散并產生影響骨和肺的遠處轉移;本研究中有4例RAS基因突變腫瘤發生遠處轉移(分別轉移至腓骨、椎體和肺)。因此,盡管單RAS基因異常不足以診斷甲狀腺腫瘤良惡性,但若發現RAS和TERT啟動子共突變強烈提示腫瘤為惡性且侵襲性強[27],應充分取材尋找惡性證據。
4 總結
RAS基因突變在甲狀腺濾泡源性腫瘤和C細胞源性腫瘤(MTC)中均可發生,其中以NRAS基因突變更為常見。RAS基因突變發生率在FTC中最高,其次為DHGTC、ATC、NIFTP和FVPTC。鑒別診斷時,結合組織形態以及其他分子改變綜合考慮,可為指導治療和評估預后提供參考依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉志艷負責文稿審閱;趙騫負責臨床數據收集、隨訪和文章撰寫;周雋、王程隆、孫可洋和蘇旭玲參與臨床病理數據收集和基因檢測。
倫理聲明:本研究通過了上海市第六人民醫院倫理委員會審批(批文編號:2022-097)。
甲狀腺上皮源性腫瘤包括C細胞源性甲狀腺髓樣癌(medullary thyroid carcinoma,MTC)和甲狀腺濾泡源性腫瘤,其中前者罕見,后者最多見。甲狀腺濾泡源性腫瘤又分類為良性、低風險及惡性腫瘤,其中惡性腫瘤分為甲狀腺濾泡癌(follicular thyroid carcinoma,FTC)、浸潤性包裹性濾泡亞型甲狀腺乳頭狀癌(invasive encapsulated follicular variant of papillary thyroid carcinoma,IEFVPTC)、甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)、甲狀腺嗜酸細胞癌(oncocytic thyroid carcinoma,OCA)、高級別分化型甲狀腺癌(differentiated high grade thyroid carcinoma,DHGTC)、低分化甲狀腺癌(poorly differentiated thyroid carcinoma,PDTC)和甲狀腺間變性癌(anaplastic thyroid carcinoma,ATC)[1-3]。根據甲狀腺濾泡源性腫瘤的分子特征,又可分為BRAF樣和RAS樣腫瘤,前者多具有明顯組織結構異型性,為中分化腫瘤;后者多以濾泡結構為主,為高分化腫瘤,通常預后較好[3-4]。本研究擬對單中心RAS突變型甲狀腺腫瘤的臨床病理特征進行分析并探討二者的關系,為臨床精準治療和預后評估提供依據。
1 資料與方法
1.1 研究對象
回顧性收集2021年1月至2023年6月期間在上海交通大學醫學院附屬第六人民醫院(簡稱“我院”)診治的經活檢或術后組織學病理確診的甲狀腺腫瘤患者的臨床病理資料。患者納入條件:① 原發病為甲狀腺腫瘤;② 行八基因檢測;③ 臨床病理數據完整。本研究經我院倫理委員會審批通過,患者均知情同意。
1.2 方法
① 組織病理形態學觀察:常規蘇木精-伊紅(hematoxylin-eosin,HE)染色切片由兩位高年資病理醫師采用雙盲法、參照世界衛生組織(第5版)和第8版美國癌癥聯合委員會指南對腫瘤進行診斷并分期[1, 3]。② 分子檢測:采用上海睿璟生物科技有限公司的甲狀腺癌八基因檢測試劑盒,以實時熒光定量PCR法檢測BRAFV600E、TERT、KRAS、NRAS、HRAS、CCDC6-RET、PAX8-PPARγ及ETV6-NTRK3基因融合。
1.3 統計學方法
使用SPSS 27.0軟件進行統計學分析。計數資料采用頻數和百分率(%)描述,組間比較采用χ2檢驗,檢驗水準α=0.05。組間兩兩比較采用卡方分割法(檢驗水準校正為α=0.001 1)。當數據不滿足χ2檢驗所需條件時,采用Fisher確切概率法。
2 結果
本研究共納入2021年1月至2023年6月期間符合納入標準的798例甲狀腺腫瘤患者,其中濾泡源性腫瘤747例,C細胞源性MTC 51例。798例甲狀腺腫瘤患者中有36例(4.5%)RAS基因突變。具體的病理類型及相應的RAS基因突變結果見表1。
2.1 36例RAS基因突變患者的臨床特征
36例RAS基因突變患者中女22例,男14例;年齡21~81歲,平均50歲(中位年齡48.5歲),≥55歲14例、<55歲22例;腫瘤最大徑0.15~7.50 cm、平均直徑2 cm,≤1 cm 14例、>1 cm 22例;TNM分期Ⅰ~Ⅱ期33例、Ⅲ~Ⅳ期3例;合并橋本甲狀腺炎3例,有血管侵犯9例,有淋巴管侵犯3例,有被膜侵犯9例,有甲狀腺腺外侵犯3例。有28例腫塊切面呈灰白色,4例呈灰黃色,4例質硬。
2.2 36例RAS基因突變患者的超聲表現
B超主要表現為甲狀腺實質內低回聲,甲狀腺癌多表現為不均質型回聲,聲像圖以實質性腫物為多見。低風險甲狀腺腫瘤均有完整包膜。20例惡性甲狀腺腫瘤界欠清,15例腫塊內血流豐富。
2.3 36例RAS基因突變患者的組織學亞型及其病理學特征
2.3.1 組織學亞型
甲狀腺濾泡源性腫瘤中惡性腫瘤26例,其中FTC 7例,PTC 15例 [包括4例濾泡亞型PTC(follicular variant of PTC, FVPTC),8例經典型PTC(classic PTC,CPTC)和3例高細胞亞型PTC(tall cell variant of papillary thyroid carcinoma,TCVPTC)],OCA 2例, DHGTC 1例,ATC 1例;低風險腫瘤8例,其中6例惡性潛能未定的甲狀腺高分化腫瘤(well-differentiated thyroid tumour of uncertain malignant potential,WT?UMP)和2例具有乳頭樣核特征的非浸潤性甲狀腺濾泡性腫瘤(noninvasive follicular thyroid neoplasm with papillary like nuclear features,NIFTP)。此外,MTC 2例。
2.3.2 不同組織學亞型的組織病理學特征
FVPTC的瘤體幾乎全部由濾泡構成,缺乏乳頭狀結構,但腫瘤細胞具有PTC細胞核特征(圖1a);CPTC可見真性乳頭及典型PTC細胞核特征(圖1b);TCVPTC的腫瘤細胞呈細長形,高是寬的2倍,具有典型PTC的細胞核特征(圖1c);FTC的瘤體呈濾泡結構,濾泡上皮異型明顯,包膜內見脈管浸潤(圖1d);ATC的腫瘤細胞呈多角型,胞質嗜酸或淡染,核仁明顯(圖1e);OCA的腫瘤細胞呈多邊形,具有豐富的嗜酸性顆粒性胞質,可見脈管浸潤(圖1f);MTC的腫瘤細胞核仁明顯,呈巢狀生長模式(圖1g);WT?UMP的濾泡細胞分化良好,有完整包膜(圖1h);NIFTP呈濾泡生長模式,無腫瘤性壞死及高核分裂象(圖1i)。
 圖1
示甲狀腺上皮源性腫瘤各組織學亞型的組織學特征及其RAS突變
圖1
示甲狀腺上皮源性腫瘤各組織學亞型的組織學特征及其RAS突變
a:FVPTC(HE 染色 ×100);b:CPTC(HE 染色 ×200);c:TCVPTC(HE 染色 ×400);d:FTC(HE 染色 ×100);e:ATC(HE 染色 ×400);f:OCA(HE 染色 ×200);g:MTC(HE 染色 ×400);h:WT-UMP(HE 染色 ×200); i:NIFTP(HE 染色 ×200);j:NRAS EXON3 基因Q61R 位點突變;k:HRAS EXON3 基因 Q61R 位點突變;l:KRAS EXON3 基因 Q61R 位點突變
2.4 36例RAS基因突變患者的分子特征
36例RAS基因突變型甲狀腺腫瘤中,NRAS突變25例(69.4%)、HRAS突變8例(22.2%)、KRAS突變3例(8.3%),均為61號密碼子突變(圖1j~1l)。4例合并TERT啟動子突變(分別為FVPTC、CPTC、FTC和ATC亞型),有2例合并BRAFV600E突變(分別為CPTC和TCVPTC),有1例合并ETV6-NTRK3突變(為TCVPTC),未見CCDC6-RET和PAX8-PPARγ突變,見圖2。10種組織病理亞型甲狀腺腫瘤組織中的RAS基因突變情況見表1。RAS基因突變率在10種組織亞型間總體比較差異有統計學意義(χ2=65.708,P<0.001),它在FTC中最高(25.9%)、在CPTC中最低(1.5%),其突變率從高到低依次是FTC、DHGTC、ATC、NIFTP、FVPTC及WT-UMP,其中在FTC、FVPTC及WT-UMP中均明顯高于CPTC(P<0.001 1)。
 圖2
示36例RAS突變型甲狀腺腫瘤的分子特征及臨床病理特征
圖2
示36例RAS突變型甲狀腺腫瘤的分子特征及臨床病理特征
2.5 隨訪結果
35例患者行甲狀腺切除手術,1例患者僅行穿刺活檢;1例患者術后行碘-131治療;1例患者術后行靶向治療。術后采用電話隨訪,有效隨訪35例患者,1例失訪,平均隨訪時間21.4個月(中位時間18.5個月)。截至2024年3月,有6例患者發現頸部淋巴結轉移,4例患者發生遠處轉移(腓骨1例、椎體2例和肺部1例)。1例患者(為ATC)死亡。
3 討論
甲狀腺腫瘤為最常見的內分泌系統腫瘤,盡管大多數患者預后良好,但仍有部分腫瘤的侵襲性強,復發風險高,甚至導致患者死亡[5]。第5版世界衛生組織甲狀腺腫瘤分類結合腫瘤形態特征、突變和轉錄組學特征提出RAS樣和BRAF樣腫瘤,凸顯腫瘤分子特征與臨床生物學行為之間的相關性[1]。
RAS基因突變可見于所有類型甲狀腺濾泡源性腫瘤,包括甲狀腺濾泡腺瘤(20%~25%)、FTC(40%~50%)、FVPTC(30%~45%)、PDTC(20%~40%)、ATC(10%~20%)等[6-9]。本研究中,FTC中RAS基因突變率最高(25.9%),其次為DHGTC(20.0%)、ATC(20.0%)、NIFTP(18.2%)、FVPTC(16.0%)及WT-UMP(12.8%),較已有文獻報道略低,可能與不同檢測方法有關。本研究所采用的實時熒光定量PCR法,主要針對Q61R特定位點進行檢測;而已有文獻報道中多采用Sanger測序法和二代測序法,可發現更多少見位點。RAS基因突變率在10種甲狀腺腫瘤組織亞型間總體比較差異有統計學意義(χ2=65.708,P<0.001),它在FTC、DHGTC、ATC、NIFTP、FVPTC及WT-UMP這幾種亞型中均較高,其中在FTC、FVPTC和WT-UMP中均高于CPTC(P均<0.001 1),在FTC中最高(25.9%),在CPTC中最低(1.5%)。以上結果表明,RAS基因突變主要見于以濾泡結構為主的腫瘤,在乳頭狀結構突出的腫瘤中相對少見。
TCGA研究[10-11]表明,90%的PTC是由絲裂原活化蛋白激酶通路激活引起,而這種激活是通過BRAF或RAS癌基因的互斥突變發生。本研究中,病例8和病例14均發現BRAFV600E和NRAS共突變,提示少見情況下兩者可同時發生[12-15]。本研究36例RAS基因突變型腫瘤中具有典型乳頭狀結構的PTC共11例(30.6%),包括8例CPTC和3例TCVPTC,另有4例FVPTC。FVPTC的RAS基因突變率高于CPTC(16.0%比1.5%,P<0.001 1)。以上結果表明,RAS基因突變多見于不具有乳頭狀結構的腫瘤,尤其是FTC,與文獻[16-18]報道一致。
OCA分子特征為染色體廣泛丟失引發近全基因組單倍體化,伴或不伴BRAF和RAS的低頻突變[19-20]。RAS基因突變在OCA中僅占10%~15%[21-22]。本研究中25例OCA患者中有2例(8.0%)發生了RAS基因突變。
DHGTC為第5版世界衛生組織新提出的組織學亞型,罕見相關報道,通常表現為BRAF、RAS或少數基因融合等早期驅動基因變異之外,再攜帶繼發侵襲性突變,最常見的是TERT啟動子、少數PIK3CA和TP53等后期分子事件[23]。本研究5例(0.6%)DHGTC中1例表現為KRAS單基因突變。
ATC是一種罕見的高度侵襲性惡性腫瘤,約占甲狀腺癌的1%~2%[24]。進展迅速,預后極差,多數患者在1年內死亡;除局部浸潤外,還常伴局部淋巴結或遠處轉移。Landa等[23]發現BRAF基因突變ATC主要表現為局灶淋巴結轉移,而RAS基因突變ATC主要表現為遠處轉移。本研究中5例(0.6%)ATC患者中僅1例發生RAS基因突變,但它合并TERT基因啟動子突變(C250T),穿刺確診后于第3個月死于肺轉移。
甲狀腺濾泡源性腫瘤中的低風險腫瘤(NIFTP和WT-UMP)為RAS樣腫瘤,亞洲國家NIFTP診斷率(0.3%~5.0%)遠低于西方國家(15%~20%)[25]。本研究中11例(1.4%)NIFTP中有2例(18.2%)發生了RAS基因突變,47例WT-UMP中6例(12.8%)發生了RAS基因突變 [高于CPTC(P<0.001 1)],均低于文獻報道的RAS基因突變率(20%~40%)[1, 9],分析其原因可能與地域或檢測方法有關。
MTC中主要驅動基因異常為RET基因體細胞突變,其次是RAS基因突變(10%)[26]。本組病例51例MTC患者中僅2例(3.9%)發生了RAS基因突變,低于文獻[26]報道,尚需積累更多病例進一步驗證。
TERT啟動子突變在局部晚期和侵襲性甲狀腺癌中常見,最常見熱點突變為C228T和C250T,前者更為常見[20],該突變與甲狀腺癌侵襲性、腫瘤進展和去分化顯著相關[27]。在本研究中,有4例RAS突變型甲狀腺腫瘤(分別為FVPTC、CPTC、FTC和ATC)合并TERT啟動子突變,其中2例患者(1例CPTC和1例ATC)同時發生淋巴結轉移和遠處轉移,而且該例ATC患者死亡。有文獻[28]報道,RAS基因突變甲狀腺腫瘤更常表現出血行擴散并產生影響骨和肺的遠處轉移;本研究中有4例RAS基因突變腫瘤發生遠處轉移(分別轉移至腓骨、椎體和肺)。因此,盡管單RAS基因異常不足以診斷甲狀腺腫瘤良惡性,但若發現RAS和TERT啟動子共突變強烈提示腫瘤為惡性且侵襲性強[27],應充分取材尋找惡性證據。
4 總結
RAS基因突變在甲狀腺濾泡源性腫瘤和C細胞源性腫瘤(MTC)中均可發生,其中以NRAS基因突變更為常見。RAS基因突變發生率在FTC中最高,其次為DHGTC、ATC、NIFTP和FVPTC。鑒別診斷時,結合組織形態以及其他分子改變綜合考慮,可為指導治療和評估預后提供參考依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉志艷負責文稿審閱;趙騫負責臨床數據收集、隨訪和文章撰寫;周雋、王程隆、孫可洋和蘇旭玲參與臨床病理數據收集和基因檢測。
倫理聲明:本研究通過了上海市第六人民醫院倫理委員會審批(批文編號:2022-097)。